A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
אלקטרופורציה מבוססת מצע נקבובי עם ניטור עכבה חשמלית טרנסאפיתל
In This Article
Summary
אלקטרופורציה של מצע נקבובי (PSEP) משלבת אספקה עקבית בתפוקה גבוהה עם כדאיות תאים גבוהה. הכנסת מדידות עכבה חשמלית טרנסאפיתל (TEEI) מספקת תובנה לגבי תהליכי הביניים של PSEP ומאפשרת אספקה ללא תוויות. מאמר זה דן בשיטה לביצוע ניסויי העברת PSEP וניתוח מדידת TEEI בו-זמנית.
Abstract
אלקטרופורציה של מצע נקבובי (PSEP) היא שיטה מתפתחת של אלקטרופורציה המספקת תפוקה גבוהה ואספקה עקבית. כמו סוגים רבים אחרים של אספקה תוך-תאית, PSEP מסתמך במידה רבה על סמנים פלואורסצנטיים ומיקרוסקופ פלואורסצנטי כדי לקבוע מסירה מוצלחת. כדי לקבל תובנה לגבי שלבי הביניים של תהליך האלקטרופורציה, פותחה פלטפורמת PSEP עם ניטור עכבה חשמלית טרנסאפיתל משולב (TEEI). התאים מגודלים בתרבית בתוספות מסחריות עם ממברנות נקבוביות. לאחר תקופת דגירה של 12 שעות כדי לאפשר היווצרות של חד-שכבה תאית מתמזגת במלואה, התוספות ממוקמות באמצעי טרנספקציה הממוקמים בבארות של מכשיר PSEP. לאחר מכן חד-שכבות התא נחשפות לצורת גל המוגדרת על-ידי המשתמש, ויעילות המסירה מאושרת באמצעות מיקרוסקופ פלואורסצנטי. ניתן לשפר זרימת עבודה זו באופן משמעותי באמצעות מדידות TEEI בין מיקרוסקופ פועם למיקרוסקופ פלואורסצנטי כדי לאסוף נתונים נוספים על תהליך PSEP, ונתוני TEEI נוספים אלה מתואמים עם מדדי מסירה כגון יעילות מסירה וכדאיות. מאמר זה מתאר פרוטוקול לביצוע PSEP עם מדידות TEEI.
Introduction
אלקטרופורציה היא טכניקה שבה תאים נחשפים לשדה חשמלי, ויוצרים נקבוביות זמניות בקרום התא שדרכן מטענים, כולל חלבונים, רנ"א ודנ"א, יכולים לעבור 1,2. הגרסה הנפוצה ביותר היא אלקטרופורציה בתפזורת (BEP). BEP מבוצע על ידי מילוי קובטה באלקטרוליט המכיל מיליוני תאים, חושף את האלקטרוליט למתח גבוה, ומאפשר למטען להיכנס לתאים באמצעות דיפוזיה או אנדוציטוזה1. ישנם יתרונות רבים ל- BEP, כולל תפוקה גבוהה ומערכות רבות הזמינות מסחרית. עם זאת, ישנן מגבלות למשלוח ה- BEP. מיקום תאים לא עקבי ביחס לאלקטרודות ומיגון שדה חשמלי מתאים סמוכים גורם לשונות משמעותית בחשיפה לשדה חשמלי במהלך BEP 3,4. למתח הגבוה הנדרש ל-BEP יש גם השפעה שלילית משמעותית על כדאיות התא5. מאז הקמתה בשנת 20116, יש עניין גובר בשיטת אלקטרופורציה הנקראת אלקטרופורציה של מצע נקבובי (PSEP), אם כי לעתים מתייחסים אליה בשמות אחרים, כולל אלקטרופורציה מקומית וננו-אלקטרופורציה או מיקרו-אלקטרופורציה 1,7,8. בניגוד לתרחיף התא של BEP, PSEP מתבצע על תאים הנצמדים למצע נקבובי. לא רק שמצב דבק מועדף עבור רוב קווי התאים האנושיים9, אלא שהנקבוביות במצע מתמקדות גם בזרם החשמלי, וממקמות את הפוטנציאל החשמלי הטרנסממברנלי (TMP) לאזורים ספציפיים בקרום התא10,11. לוקליזציה זו מאפשרת הפחתה משמעותית במתח המופעל, הפחתת נזק והגדלת כדאיות התא. שילוב זה של השפעות מסייע לשלוט בהתפתחות נקבוביות קרום התא, וכתוצאה מכך אספקה עקבית ויעילה יותר 1,5,12.
מחקר שנערך לאחרונה הציג מכשיר PSEP עם מערך אלקטרודות מצופה זהב בעל שש בארות להחזקת תוספות קרום נקבוביות זמינות מסחרית13 (איור 1A,B), פרקטיקה שהוצגה לראשונה על-ידי Vindis et al.14. המכשיר יכול להפעיל פולסים ולמדוד את העכבה החשמלית על פני חד-שכבה של התא, המכונה עכבה חשמלית טרנסאפיתל (TEEI), בזמן אמת13. ממשק המשתמש של המכשיר מאפשר שליטה מלאה על צורת הגל והקוטביות של האלקטרופורציה. חשוב לציין, ניתן להשתמש במדידות עכבה בזמן אמת כדי לחזות תוצאות משלוח ללא צורך בריאגנטים יקרים או בסמנים פלואורסצנטיים, מושג המכונה משלוח ללא תוויות15.
פלטפורמת PSEP מורכבת משני רכיבים חשמליים עיקריים בהתאמה אישית: הגוף העיקרי של המכשיר, המאכלס את מחולל הדופק וציוד המדידה TEEI, ומערך האלקטרודות, שבו מוכנסים המצעים הנקבוביים, והאלקטרופורציה מתרחשת. דיאגרמות עבור כל הרכיבים האלקטרוניים והמודפסים בתלת-ממד בהתאמה אישית ניתן למצוא ב- GitHub: https://github.com/YangLabUNL/PSEP-TEEI. בנוסף לאלקטרוניקה המותאמת אישית, נדרש גם מחשב כדי שהפלטפורמה תתפקד כראוי. התוכנה המותאמת אישית דורשת הפעלת MATLAB (גרסה 2021a ואילך) ו- Microsoft Excel לאחסון נתונים וגישה אליהם לצורך ניתוח. התוכנית שולטת באלקטרוניקה המותאמת אישית ומספקת את ממשק המשתמש הגרפי (GUI) להתאמת הגדרות. תוכניות אלה היו זמינות גם ב- GitHub: https://github.com/YangLabUNL/PSEP-TEEI.
נתונים ראשוניים מצביעים על כך שתהליך זה אפשרי עבור סוגים שונים של תאים דבקים (איור 1C), אולם מאמר זה ידון רק בהכנה של תאי A431 באמצעות פרמטרים שנמצאו אופטימליים עבור קו תאים זה על-ידי ברוקס ועמיתיו. בנוסף, מכיוון שמטען הפרופידיום יודיד (PI) הוא ציטוטוקסי, מבוצעים שני ניסויים, הראשון עם מדיה טרנספקציה PI בריכוז גבוה כדי לכמת את יעילות המסירה, והשני עם מדיה של תרביות תאים בלבד למדידת TEEI על פני טווחי זמן ארוכים יותר. הניסויים האלה משתמשים בצורות גל אלקטרופורציה זהות, מה שמאפשר לתוצאות להיות מתואמות (איור 1D).
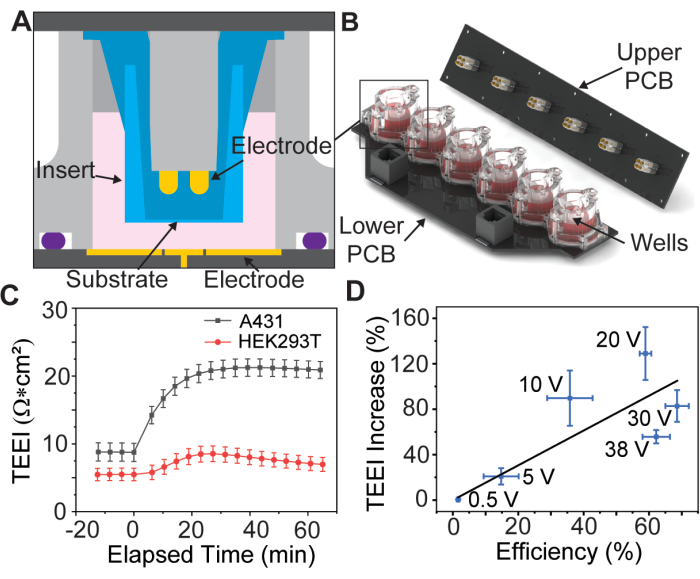
איור 1: דיאגרמת הרכבת מערך אלקטרודות ונתוני יסוד. (A) מודל CAD של תוספת בתוך באר של מערך האלקטרודות. (B) מודל CAD של מערך האלקטרודות. (C) עלייה בעכבה עקב PSEP עבור קווי תאים נבחרים, n = 3 לכל קו תא. שורת שגיאה: שגיאת תקן של הממוצע. (ד) יעילות אספקה לעומת TEEI מגדילים את נתוני המתאם. יעילות המסירה חושבה על ידי חלוקת מספר התאים המסומנים הן בתמונות PI והן בתמונות קלצאין מניסויי מסירה במספר הכולל של תאים שזוהו עם Hoechst. ספירת התאים נקבעה באמצעות צינור CellProfiler מותאם אישית, n = 6 לכל מתח. שורת שגיאה: (ציר x וציר y) שגיאת תקן של הממוצע. נתון זה משוכפל מברוקס ואחרים 13 באישור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Protocol
פרטי הריאגנטים והציוד ששימש במחקר מפורטים בטבלת החומרים.
1. הכנת ריאגנטים ותרבית תאים
- הכינו את מדיית תרבית התאים על ידי הוספת 50 מ"ל של סרום בקר עוברי (FBS) ו-5 מ"ל פניצילין-סטרפטומיצין למיכל של 500 מ"ל של מדיום הנשר המעובד של דולבקו (DMEM). לייצר אחד עשר 50 מ"ל aliquots כדי להפחית את הסיכון של זיהום ומקרר ב 4 °C.
- צור 1 מ"ל של 25 מיקרוגרם/מ"ל פלסמה אנושית פיברונקטין בתמיסת מלאי של מלח חוצץ פוספט (PBS) בהתאם להוראות היצרן.
- צור 15 מ"ל של 0.1 מ"ג/מ"ל פרופידיום יודיד בתמיסת מלאי DMEM כדי לאפשר ניסויים עם ריכוזי מטען משתנים.
- תרבית תאי A431 בבקבוק T75 המכיל 12 מ"ל של מצע תרבית התאים המוכן. התאים הועברו כל 1-2 ימים כדי לשמור על מפגש של 50%.
2. הכנת מדגם
- ציפוי פיברונקטין
- בחר שתים עשרה תוספות ושתי לוחיות 24 בארות. מניחים את התוספות בצלחת באר אחת, ויוצרים שתי שורות של שש. מניחים את צלחת הבאר השנייה בצד עד מאוחר יותר.
- צור 1,300 μL של 1 מיקרוגרם / מ"ל תמיסת פיברונקטין על ידי ערבוב 52 μL של תמיסת מלאי פיברונקטין ו 1,248 μL של PBS בצינור 1.5 מ"ל.
- מפזרים 100 מיקרוליטר של תמיסת הפיברונקטין לכל תוספת. לדגור את התוספות בצלחת הבאר ב 37 ° C במשך 3 שעות.
- התאמת ריכוז התאים לצפיפות תאים אופטימלית
- כשעה לפני השלמת הדגירה של פיברונקטין יש להסיר את בקבוק T75 של תאי A431 מהאינקובטור לצורך מיצוי תאים.
- הסר את התקשורת בבקבוק עם שואף ולשטוף עם 5 מ"ל של PBS. הסר את PBS באותו אופן ולהוסיף 3 מ"ל של טריפסין. יש לדגור במשך 3-4 דקות לפני שמקישים על דופן הבקבוק כדי לנתק לחלוטין את התאים.
- הוסיפו 6 מ"ל של תרבית תאים לצלוחית, ערבבו במרץ עם פיפטה כדי לנתק את התאים שנותרו, והעבירו את התוכן לצינור צנטריפוגה של 15 מ"ל. צנטריפוגה ב 100 x גרם ו 20 ° C במשך 5 דקות.
- הסר את מצע תרבית התא וטריפסין מצינור הצנטריפוגה באמצעות אספירטור, תוך זהירות שלא להפריע לכדורית התא. הוסף 1 מ"ל של מדיה לצינור הצנטריפוגה ולפיפטה הלוך ושוב (מבלי לייצר בועות) כדי לפרק את גלולת התא ולהשהות מחדש את התאים.
- פיפטה 10 μL של תרחיף התא, 40 μL של מדיה תרבית התא, ו 50 μL של צבע כחול טריפאן לתוך צינור 200 μL, באמצעות פיפטה כדי לערבב היטב.
- הסר 10 μL של תערובת הצבע והזריקו אותו לתוך המוציטומטר. ספור את התאים באמצעות דילול של 10% של תערובת הצבע כדי להעריך את ספירת התאים הכוללת בצינור הצנטריפוגה של 15 מ"ל.
הערה: עבור פרוטוקול זה, נניח ריכוז של 5,000,000 תאים/מ"ל. - מכפילים את צפיפות הזריעה הרצויה בשטח הפנים של קרום החדרה, מחלקים בתאים הנספרים/מ"ל בתרחיף, ומכפילים ב-1,000 כדי לחשב את המיקרוליטרים הנדרשים של תרחיף התא לכל תוספת.
- כדי למצוא את הכמות הכוללת הנדרשת של תרחיף תאים, הכפל נתון זה ב- 10 (כדי להבטיח מספיק תאים ל- 9 דגימות, מכיוון ש- 3 מתוך 12 התוספות יהיו פקדים ללא תאים), ועגל כלפי מעלה למספר השלם הקרוב ביותר. במקרה זה, סך של 135 μL של השעיית התא נדרש עבור ניסוי זה.
- צור 2,000 μL של תמיסת תאים מותאמת על ידי ערבוב 135 μL שחושב בעבר של תרחיף התא עם 1,865 μL של מדיה של תרבית תאים בצינור צנטריפוגה נפרד של 15 מ"ל.
- זריעת תאים
- הסר את עודפי הפיברונקטין מכל תוספת לאחר השלמת הדגירה של הפיברונקטין .
- שטפו את התוספות פעמיים על ידי הוספת 100 מיקרוליטר מים מזוקקים סטריליים לכל תוספת. מוציאים את המים לפי אותו סדר שבו הוספו כדי להבטיח זמן שטיפה עקבי בין התוספות.
- שטפו שוב את העלון על-ידי הוספת מדיה של תרבית תאים בגודל 100 μL לכל תוספת. הסר את המדיה לפי אותו סדר שבו היא נוספה כדי להבטיח זמן כביסה עקבי בין התוספות.
- תוספות לדוגמה של תאים
- זרע תאים על ידי pipeting 200 μL של תמיסת תאים מותאמים לתוך כל תוספת. כדי להבטיח מפגש עקבי בין התוספות, ערבבו את תמיסת התא בצינור הצנטריפוגה לפני החלוקה וערבבו שוב בתוך כל תוספת לאחר החלוקה.
- תוספות בקרה שלילית
- פיפטה 200 μL של מדיה תרבית תאים לתוך כל תוספת. כדי לשמור על עקביות עם התוספות לדוגמה של תאים, השתמש פיפטה כדי לערבב את המדיה של תרבית התא בתוך כל תוספת.
- תיוג ואינקובציה
- ציירו קו המחלק את לוח הבאר השני לשני עמודים ברוחב שלוש בארות (בתנאים המופעלים במשולש) באמצעות סמן קבוע. הפרד כל עמודה לשורות. תייג כל אזור ברשת עם פרמטרים רלוונטיים.
- הוסף 1 מ"ל של מדיה תרבית תאים לכל באר כדי לקבל תוספת עבור הניסוי. מעבירים את התוספות מצלחת באר ההכנה למיקומם המתאים בצלחת באר הניסוי המסומנת ודגרים בטמפרטורה של 37 מעלות צלזיוס למשך 12 שעות לפחות.
3. הליך ניסיוני
- ניסוי מסירה
- פיפטה 1.5 מ"ל של תמיסת PI 0.1 מ"ג/מ"ל לכל באר במערך האלקטרודות. הניחו אינסרט לכל באר במערך האלקטרודות, והתאימו את רגלי האינסרט לחריצי היישור כך שהאינסרט יהיה צמוד לפני השטח העליונים של הבאר (איור 1A,B).
- הברג את המעגלים המודפסים של האלקטרודות העליונות (PCB) לחלק העליון של בארות מערך האלקטרודות וחבר את מערך האלקטרודות להתקן PSEP.
- מקם את מערך האלקטרודות באינקובטור של 37 מעלות צלזיוס למשך שעה אחת לפחות כדי לאפשר לטמפרטורה להתאזן.
- לחץ על התפריט הנפתח לצד "ממברנה" בפינה השמאלית העליונה של ממשק המשתמש הגרפי ולחץ על 400 ננומטר GBO. חזור על שלב זה עבור "אלקטרוליט", "תאים", "צפיפות זריעת תאים" ו"משך התא", ובחר DMEM, A431, 200 ו- 12, בהתאמה.
הערה: ערכים אלה מיועדים למטרות שמירת רשומות בלבד, ואינם משפיעים על תפקוד ההתקן. הקפד להתאים ערכים אלה לפי הצורך למעקב נכון אחר נתונים. - הקלד 1 בשדה העריכה Post Pulse Time Duration (min) בצד ימין של ממשק המשתמש הגרפי כדי לשנות את זמן המדידה המוגדר כברירת מחדל לאחר פעימה לדקה אחת. השאר את כל ההגדרות האחרות במצב ברירת המחדל.
הערה: פרמטרי פולס המוגדרים כברירת מחדל יוצרים צורת גל ריבועית עם 30 וולט, 20 הרץ, משך אלפיות שנייה אחד ו- 200 פעימות. פרמטרי מדידת TEEI המוגדרים כברירת מחדל הם 0.5 וולט ו- 100 הרץ, 1,000 הרץ, 10,000 הרץ ו- 100,000 הרץ. - לחץ על כפתור הפעלה והזן שמות מתאימים עבור בארות 1-3 ו- 4-6 כאשר תתבקש לעשות זאת. לחץ על אישור כדי להתחיל את הניסוי.
- הסר את מערך האלקטרודות מהאינקובטור והעבר את התוספות בחזרה למיקומים המקוריים בלוח באר הניסוי כאשר התוכנית סיימה לבצע.
- ערבבו 2 μL של Hoechst 33342 ו-5 μL של calcein AM עם 123 μL של מדיה של תרבית תאים בצינור של 200 μL.
- מזליפים בעדינות פיפטה 10 μL של תמיסת הכתם לתוך כל תוספת פוסט-פולס ומחזירים את התוספות לאינקובטור למשך 5 דקות.
- מעבירים את צלחת הבאר למחזיק הצלחת במיקרוסקופ פלואורסצנטי עם יעד הגדלה פי 5. תמונה באמצעות שדה בהיר והפלואורסצנטיות של כל כתם. מרכז את העלון מעל המטרה לפני הפעלת המצלמה.
הערה: אורכי גל העירור עבור PI, calcein AM ו- Hoechst 33342 הם 558 ננומטר, 495 ננומטר ו- 353 ננומטר, בהתאמה. אורכי גל הפליטה הם 575 ננומטר, 519 ננומטר ו-465 ננומטר, בהתאמה.
- ניסוי מדידה TEEI
- פיפטה 1.5 מ"ל של מדיה תרבית התא לתוך כל באר במערך האלקטרודות. הכניסו את דגימת התא לבארות 1-3 ואת תוספות הבקרה לבארות 4-6, תוך התאמת רגלי האינסרט לחריצי היישור כך שהתוספת תהיה צמודה למשטח העליון של הבאר.
- הברג את לוח המעגלים המודפסים העליון של האלקטרודות לחלק העליון של בארות מערך האלקטרודות וחבר את מערך האלקטרודות להתקן PSEP.
- מקם את מערך האלקטרודות באינקובטור של 37 מעלות צלזיוס למשך שעה אחת לפחות כדי לאפשר לטמפרטורה להתאזן.
- לחץ על התפריט הנפתח ליד "ממברנה" בפינה השמאלית העליונה של ממשק המשתמש הגרפי ולחץ על 400 ננומטר GBO. חזור על שלב זה עבור "אלקטרוליט", "תאים", "צפיפות זריעת תאים" ו"משך התא", ובחר DMEM, A431, 200 ו- 12, בהתאמה.
הערה: ערכים אלה מיועדים למטרות שמירת רשומות בלבד, ואינם משפיעים על תפקוד ההתקן. הקפד להתאים ערכים אלה לפי הצורך למעקב נכון אחר נתונים. - השאר את כל ההגדרות הנותרות במצב ברירת המחדל.
הערה: פרמטרי פולס המוגדרים כברירת מחדל יוצרים צורת גל ריבועית עם 30 וולט, 20 הרץ, משך אלפיות שנייה אחד ו- 200 פעימות. פרמטרי מדידת TEEI המוגדרים כברירת מחדל הם 0.5 וולט ו- 100 הרץ, 1,000 הרץ, 10,000 הרץ ו- 100,000 הרץ. - לחץ על כפתור הפעלה והזן שמות מתאימים עבור בארות 1-3 ו- 4-6 כאשר תתבקש לעשות זאת. לחץ על אישור כדי להתחיל את הניסוי.
- הסר את מערך האלקטרודות מהאינקובטור והעבר את התוספות בחזרה למיקומים המקוריים בלוח באר הניסוי כאשר התוכנית סיימה לבצע.
- ערבבו 2 μL של Hoechst 33342, 5 μL של calcein AM, ו-10 μL של PI עם 113 μL של מדיה של תרבית תאים בצינור תגובה של 200 μL.
- פיפטה 10 μL של תמיסת הכתם לתוך כל תוספת פוסט-פולס ומניחים את התוספות בחזרה לתוך האינקובטור למשך 5 דקות.
- מעבירים את צלחת הבאר למחזיק הצלחת במיקרוסקופ הדמיה פלואורסצנטית עם עדשה אובייקטיבית פי 5. תמונה באמצעות שדה בהיר והפלואורסצנטיות של כל כתם. מרכז את הכנס מעל העדשה לפני הפעלת המצלמה.
הערה: אורכי גל העירור עבור PI, calcein AM ו- Hoechst 33342 הם 558 ננומטר, 495 ננומטר ו- 353 ננומטר, בהתאמה. אורכי גל הפליטה הם 575 ננומטר, 519 ננומטר ו-465 ננומטר, בהתאמה.
4. ניתוח נתונים
- ניתוח נתוני תמונה באמצעות צינור CellProfiler
- השתמש בזרימת העבודה המותאמת אישית של CellProfiler המסופקת ב- GitHub:https://github.com/YangLabUNL/PSEP-TEEI כדי לעבד את תמונות ניסוי המסירה והמדידה של TEEI.
- ניתוח TEEI
- לחץ על הכרטיסייה ניתוח בממשק המשתמש הגרפי.
- העבר את מחוון סוג העכבה ל- TEEI בתחתית ממשק המשתמש הגרפי.
- לחץ על החץ בתיבה השמאלית העליונה כדי להציג את כל שמות הניסויים בקובץ הנתונים. בחר את כל הנתונים לדוגמה של תאים מניסוי המדידה TEEI.
- לחץ על החץ בתיבה הבאה מימין כדי להציג את כל שמות הניסויים בקובץ הנתונים. בחר את כל נתוני הוספת הבקרה ממדידת TEEI.
- לחץ על הפעל. יופיע איור בסיסי המכיל נתוני דגימת תאים נבחרים בתדירות המדידה הנמוכה ביותר.
- בתיבת האפשרויות לדוגמה בצד ימין של ממשק המשתמש הגרפי, לחץ על החץ כדי להציג את כל נתוני ההוספה שנבחרו. ניתן להסיר חריגים על ידי בחירת הנתונים המתאימים ולחיצה על הסר למטה.
הערה: כל הנתונים שהוסרו מהניתוח בלחיצה האחרונה על לחצן הסר ניתנים לאחזור על-ידי לחצן בטל . - לחץ על בוצע כדי לעבור לאיור הבא כאשר הנתונים הרצויים מוצגים באיור.
- חזור על שלבים 4.2.6 ו- 4.2.7 עבור הנתונים הנותרים לדוגמה של תאים ונתוני בקרה. לאחר אישור מערך הנתונים הסופי על ידי לחיצה על "בוצע", יופיע נתון הניתוח המלא.
- שמור את נתון הניתוח.
תוצאות
הפרוטוקול הנתון קובע שיטה לשימוש במדידות TEEI כדי לבחון את תהליכי הביניים של אלקטרופורציה ולבצע תחזיות מסירה, במיוחד עבור קו תאי A431 ומטען PI. בעוד שינוי פרוטוקול זה נדון בהמשך המאמר, חשוב לציין כעת כי בעוד הערכים הספציפיים עשויים להשתנות, מגמות כלליות בתגובה נשארות עקביות. ...
Discussion
איור 2C מדגים כי TEEI עולה ממינימום ויורד מקו הבסיס מתוות עבור כל מתח בצורת גל PSEP. עליית TEEI יוצרת קשת פרבולית, שמגיעה לשיא סביב 20 וולט לפני הפחתה, בעוד שהירידה של TEEI מקו הבסיס עולה באופן אקספוננציאלי ככל שהמתח עולה. יעילות המסירה ואחוזי המוות באיור...
Disclosures
המחברים מצהירים כי אין ניגוד עניינים.
Acknowledgements
אנו מכירים בתמיכת המימון של NSF (פרסים 1826135, 1936065, 2143997), המכונים הלאומיים של NIH למדעי הרפואה הכלליים P20GM113126 (מרכז נברסקה לתקשורת ביומולקולרית משולבת) ו- P30GM127200 (מרכז נברסקה לננו-רפואה), יוזמת שיתוף הפעולה של נברסקה והתמיכה הביו-הנדסית של Voelte-Keegan. המכשיר יוצר במתקן ליבת המחקר של ננו-הנדסה (NERCF), הממומן חלקית על ידי יוזמת המחקר של נברסקה.
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Centrifuge Tube | Thermo Scientific | 339651 | |
| 2-Chip Disposable Hemocytometer | Bulldog Bio | DHC-N01 | |
| 75 cm2 Tissue Culture Flask | fisherbrand | FB012937 | |
| A431 Cells | ATCC | CRL-1555 | |
| Calcein AM | Invitrogen | C3099 | |
| Class II Type A2 Biosafety Cabinet | Labgard | NU-543-600 | |
| Custom Components | YangLab | https://github.com/YangLabUNL/PSEP-TEEI | |
| Disposable Centrifuge Tube (50 mL) | fisherbrand | 05-539-6 | |
| DMEM | Gibco | 11965092 | |
| Fetal Bovine Serum | Gibco | A5670401 | |
| Fluid Aspiration System | vacuubrand | 20727403 | |
| HERACELL 240i | Thermo Scientific | 51026331 | |
| Hoechst 33342 | Thermo Scientific | 62249 | |
| Human Plasma Fibronectin | Sigma-Aldrich | FIBRP-RO | |
| Inverted Fluorescent Microscope | Zeiss | 491916-0001-000 | |
| Inverted Microscope | Labomed | TCM 400 | |
| PBS | cytiva | SH30256.02 | |
| PCR Tube 200 µL | Sarstedt | 72.737 | |
| Penicillin / Streptomycin | Gibco | 15140148 | |
| Pipette (0.2-2 µL) | fisherbrand Elite | FBE00002 | |
| Pipette (100-1000 µL) | fisherbrand Elite | FBE01000 | |
| Pipette (20-200 µL) | fisherbrand Elite | FBE00200 | |
| Pipette (2-20 µL) | fisherbrand Elite | FBE00020 | |
| Propidium Iodide | Invitrogen | P1304MP | |
| Reaction Tube 1.5 mL | Sarstedt | 72.690.300 | |
| Sorvall ST 16R Centrifuge | Thermo Scientific | 75004240 | |
| Thincert (24-well) | Greiner Bio-One | 662 641 | 0.4 µm pore diameter, 2x106 cm-2 pore density, transparent PET |
| Tissue Culture Plate (24-well) | fisherbrand | FB012929 | |
| Trypan Blue Solution | Sigma-Aldrich | T8154-20mL | |
| Trypsin | Gibco | 15090046 |
References
- Brooks, J., et al. High throughput and highly controllable methods for in vitro intracellular delivery. Small. 16 (51), e2004917 (2020).
- Stewart, M. P., Langer, R., Jensen, K. F. Intracellular delivery by membrane disruption: Mechanisms, strategies, and concepts. Chem Rev. 118 (16), 7409-7531 (2018).
- Canatella, P. J., Karr, J. F., Petros, J. A., Prausnitz, M. R. Quantitative study of electroporation-mediated molecular uptake and cell viability. Biophys J. 80 (2), 755-764 (2001).
- Pliquett, U., Gift, E. A., Weaver, J. C. Determination of the electric field and anomalous heating caused by exponential pulses with aluminum electrodes in electroporation experiments. Bioelectrochem Bioenerg. 39 (1), 39-53 (1996).
- Pan, J., et al. Cell membrane damage and cargo delivery in nano-electroporation. Nanoscale. 15 (8), 4080-4089 (2023).
- Boukany, P. E., et al. Nanochannel electroporation delivers precise amounts of biomolecules into living cells. Nat Nanotechnol. 6 (11), 747-754 (2011).
- Chang, L., et al. Micro-/nanoscale electroporation. Lab Chip. 16 (21), 4047-4062 (2016).
- Patino, C. A., et al. Multiplexed high-throughput localized electroporation workflow with deep learning-based analysis for cell engineering. Sci Adv. 8 (29), 7637 (2022).
- Sagvolden, G., Giaever, I., Pettersen, E. O., Feder, J. Cell adhesion force microscopy. Proc Natl Acad Sci U S A. 96 (2), 471-476 (1999).
- Ishibashi, T., Takoh, K., Kaji, H., Abe, T., Nishizawa, M. A porous membrane-based culture substrate for localized in situ electroporation of adherent mammalian cells. Sensors Actuators B: Chem. 128 (1), 5-11 (2007).
- Mukherjee, P., Nathamgari, S. S. P., Kessler, J. A., Espinosa, H. D. Combined numerical and experimental investigation of localized electroporation-based cell transfection and sampling. ACS Nano. 12 (12), 12118-12128 (2018).
- Brooks, J. R., et al. An equivalent circuit model for localized electroporation on porous substrates. Biosens Bioelectron. 199, 113862 (2022).
- Brooks, J. R., et al. Transepithelial electrical impedance increase following porous substrate electroporation enables label-free delivery. Small. 20 (25), 2310221 (2023).
- Vindiš, T., et al. Gene electrotransfer into mammalian cells using commercial cell culture inserts with porous substrate. Pharmaceutics. 14 (9), 1959 (2022).
- Ye, Y., et al. Single-cell electroporation with real-time impedance assessment using a constriction microchannel. Micromachines. 11 (9), 856 (2020).
- Bednarek, R. In vitro methods for measuring the permeability of cell monolayers. Methods Protoc. 5 (1), 17 (2022).
- Harhaj, N. S., Antonetti, D. A. Regulation of tight junctions and loss of barrier function in pathophysiology. Int J Biochem Cell Biol. 36 (7), 1206-1237 (2004).
- Hunter, R. J. . Zeta potential in colloid science: Principles and applications. 2, (2013).
- Wong, P. K., Wang, T. -. H., Deval, J. H., Ho, C. -. M. Electrokinetics in microdevices for biotechnology applications. IEEE/ASME Trans Mechatron. 9 (2), 366-376 (2004).
- Qian, K., Wang, Y., Lei, Y., Yang, Q., Yao, C. An experimental and theoretical study on cell swelling for osmotic imbalance induced by electroporation. Bioelectrochemistry. 157, 108637 (2024).
- Fox, M. B., et al. Electroporation of cells in microfluidic devices: A review. Anal Bioanal Chem. 385 (3), 474-485 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved