Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Электропорация на основе пористой подложки с трансэпителиальным электроимпедансным мониторингом
В этой статье
Резюме
Электропористая субстрата (PSEP) сочетает в себе стабильную высокую производительность с высокой жизнеспособностью ячеек. Введение измерений трансэпителиального электрического импеданса (TEEI) дает представление о промежуточных процессах PSEP и позволяет доставлять продукцию без меток. В данной статье рассматривается метод одновременного проведения экспериментов по доставке PSEP и анализа измерений TEEI.
Аннотация
Электропористая субстрата (PSEP) — это новый метод электропорации, который обеспечивает высокую производительность и стабильную подачу. Как и многие другие типы внутриклеточной доставки, PSEP в значительной степени полагается на флуоресцентные маркеры и флуоресцентную микроскопию для определения успешной доставки. Чтобы получить представление о промежуточных этапах процесса электропорации, была разработана платформа PSEP со встроенным мониторингом трансэпителиального электрического импеданса (TEEI). Клетки культивируются в коммерчески доступных вставках с пористыми мембранами. После 12-часового инкубационного периода для образования полностью сливающегося клеточного монослоя вкладыши помещают в трансфекционные среды, расположенные в лунках устройства PSEP. Затем монослои клеток подвергаются воздействию заданной пользователем формы сигнала, а эффективность доставки подтверждается с помощью флуоресцентной микроскопии. Этот рабочий процесс может быть значительно улучшен с помощью измерений TEEI между импульсной и флуоресцентной микроскопией для сбора дополнительных данных о процессе PSEP, и эти дополнительные данные TEEI коррелируют с такими показателями доставки, как эффективность и жизнеспособность доставки. В данной статье описан протокол проведения PSEP с измерениями TEEI.
Введение
Электропорация — это метод, при котором клетки подвергаются воздействию электрического поля, создавая временные поры в клеточной мембране, через которые могут проходить грузы, включая белки, РНК и ДНК. Наиболее широко используемым вариантом является объемная электропорация (BEP). BEP выполняется путем заполнения кюветы электролитом, содержащим миллионы клеток, подвергая электролит воздействию высокого напряжения и позволяя грузу проникать в клетки посредством диффузии или эндоцитоза. У BEP есть много преимуществ, в том числе высокая пропускная способность и множество коммерчески доступных систем. Тем не менее, существуют ограничения на доставку BEP. Непоследовательное расположение ячеек относительно электродов и экранирование электрического поля от соседних ячеек вызывают значительную вариабельность воздействия электрического поля во время BEP 3,4. Высокое напряжение, необходимое для BEP, также оказывает значительное негативное влияние на жизнеспособность ячейки5. С момента своего создания в 2011 году растет интерес к методу электропорации, называемому электропорацией пористой подложки (PSEP), хотя иногда его называют и другими названиями, включая локализованную электропорацию и нано- или микроэлектропорацию 1,7,8. В отличие от клеточной суспензии BEP, PSEP проводится на клетках, которые прилегают к пористому субстрату. Малотого, что адгезивное состояние является предпочтительным для большинства клеточных линий человека9, но поры в субстрате также фокусируются на электрическом токе, локализуя трансмембранный электрический потенциал (TMP) в определенных областях клеточной мембраны10,11. Такая локализация позволяет значительно снизить приложенное напряжение, уменьшить повреждение и повысить жизнеспособность клеток. Эта комбинация эффектов помогает контролировать развитие пор клеточной мембраны, что приводит к более стабильной и эффективной доставке 1,5,12.
В недавнем исследовании было представлено устройство PSEP с шестилуночной позолоченной электродной матрицей для удержания коммерчески доступных пористых мембранных вставок13 (рис. 1A, B), практика, которая впервые была представлена Vindis et al.14. Устройство может подавать импульсы и измерять электрический импеданс на монослое клетки, известный как трансэпителиальный электрический импеданс (TEEI), в режиме реальноговремени13. Пользовательский интерфейс устройства позволяет полностью контролировать форму волны и полярность электропорации. Важно отметить, что измерения импеданса в режиме реального времени могут использоваться для прогнозирования результатов доставки без необходимости использования дорогостоящих реагентов или флуоресцентных маркеров, что известно как доставка без меток15.
Платформа PSEP состоит из двух основных специализированных электрических компонентов: основного корпуса устройства, в котором размещается генератор импульсов и измерительное оборудование TEEI, и электродной решетки, куда вставляются пористые подложки и происходит электропорация. Схемы для всей заказной электроники и компонентов, напечатанных на 3D-принтере, можно найти на GitHub: https://github.com/YangLabUNL/PSEP-TEEI. В дополнение к заказной электронике, для правильной работы платформы также требуется компьютер. Для работы пользовательского программного обеспечения требуется MATLAB (версия 2021a или более поздняя), а для хранения данных и доступа к ним для анализа — Microsoft Excel. Программа управляет пользовательской электроникой и предоставляет графический пользовательский интерфейс (GUI) для регулировки настроек. Эти программы также были доступны на GitHub: https://github.com/YangLabUNL/PSEP-TEEI.
Предварительные данные свидетельствуют о том, что этот процесс возможен для различных типов адгезивных клеток (рис. 1C), но в данной статье речь пойдет только о препарировании клеток A431 с использованием параметров, которые Brooks et al. сочли оптимальными для этой клеточной линии. Кроме того, поскольку груз йодида пропидия (PI) является цитотоксичным, проводятся два эксперимента: первый с высокой концентрацией трансфекционной среды PI для количественной оценки эффективности доставки, а второй с использованием только сред для клеточных культур для измерения TEEI в более длительных временных масштабах. В этих экспериментах используются идентичные формы волн электропорации, что позволяет коррелировать результаты (рис. 1D).
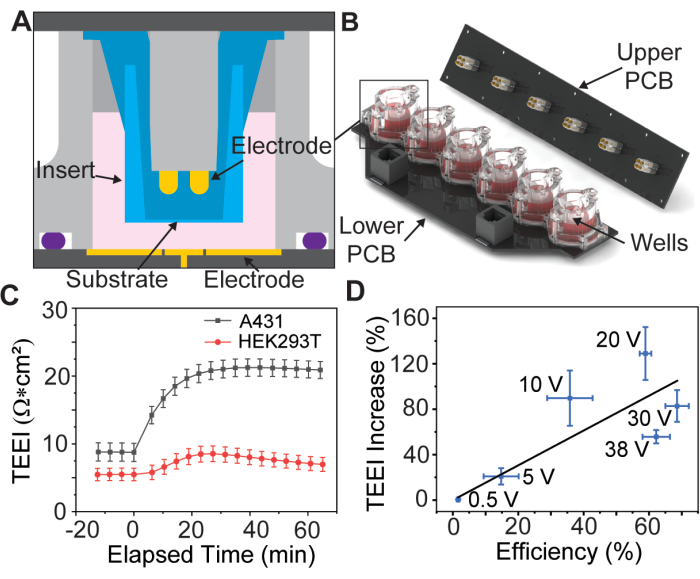
Иллюстрация 1: Схема сборки электродной матрицы и исходные данные. (A) CAD-модель вставки внутри лунки электродной матрицы. (B) CAD-модель электродной матрицы. (C) Увеличение импеданса из-за PSEP для отдельных клеточных линий, n = 3 на клеточную линию. Погрешность: стандартная погрешность среднего значения. (D) Эффективность доставки в соотношении. TEEI увеличивает корреляционные данные. Эффективность доставки рассчитывали путем деления числа клеток, помеченных на изображениях PI и кальцеина из экспериментов по доставке, на общее количество клеток, идентифицированных с помощью Хёхста. Количество ячеек определяли с помощью пользовательского конвейера CellProfiler, n = 6 на напряжение. Погрешность: (по осям x и y) стандартная погрешность среднего значения. Этот рисунок воспроизводится из Brooks et al.13 с разрешения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
протокол
Подробная информация о реагентах и оборудовании, использованном в исследовании, приведена в Таблице материалов.
1. Подготовка реагентов и клеточной культуры
- Приготовьте питательную среду для клеточных культур, добавив 50 мл фетальной бычьей сыворотки (FBS) и 5 мл пенициллин-стрептомицина в контейнер объемом 500 мл модифицированной орлиной среды (DMEM) от Dulbecco. Изготовьте одиннадцать аликвот по 50 мл для снижения риска загрязнения и храните в холодильнике при температуре 4 °C.
- Создайте 1 мл фибронектина плазмы крови человека 25 мкг/мл в исходном растворе фосфатно-солевого буфера (PBS) в соответствии с инструкцией производителя.
- Создайте 15 мл 0,1 мг/мл йодида пропидия в исходном растворе DMEM, чтобы можно было проводить эксперименты с различными концентрациями груза.
- Культивировать клетки А431 в колбе Т75, содержащей 12 мл приготовленной клеточной питательной среды. Клетки пропускали каждые 1-2 дня для поддержания 50% конфлюенции.
2. Подготовка образцов
- Фибронектиновое покрытие
- Выберите двенадцать вкладышей и два 24-луночных планшета. Поместите вкладыши в одну луночную пластину, создав два ряда по шесть. Отставьте вторую лунку в сторону на потом.
- Получите 1300 мкл 1 мкг/мл раствора фибронектина, смешав 52 мкл стокового раствора фибронектина и 1248 мкл PBS в пробирке объемом 1,5 мл.
- Распределите по 100 мкл раствора фибронектина в каждую вставку. Инкубируйте вкладыши в луночном планшете при температуре 37 °C в течение 3 часов.
- Регулировка концентрации клеток для оптимизации плотности клеток
- Примерно за 1 час до завершения инкубации фибронектина извлеките колбу T75 с клетками A431 из инкубатора для экстракции клеток.
- Удалите среду из колбы с помощью аспиратора и промойте 5 мл PBS. Удалите PBS таким же образом и добавьте 3 мл трипсина. Инкубируйте в течение 3-4 минут, прежде чем постукивать по стенке колбы, чтобы полностью отделить ячейки.
- Добавьте в колбу 6 мл среды для клеточных культур, энергично перемешивая пипеткой, чтобы отделить оставшиеся клетки, и перенесите содержимое в центрифужную пробирку объемом 15 мл. Центрифуга при 100 x g и 20 °C в течение 5 минут.
- Удалите питательную среду для клеточных культур и трипсин из центрифужной пробирки с помощью аспирата, стараясь не повредить клеточную гранулу. Добавьте 1 мл среды в пробирку центрифуги и пипетку вперед и назад (без образования пузырьков), чтобы разбить клеточную гранулу и повторно суспендировать клетки.
- Нанесите пипеткой 10 мкл клеточной суспензии, 40 мкл среды для клеточных культур и 50 мкл трипанового синего красителя в пробирку объемом 200 мкл, тщательно перемешав с помощью пипетки.
- Удалите 10 μл смеси красителей и введите ее в гемоцитометр. Подсчитайте клетки с использованием 10% разведения смеси красителей, чтобы оценить общее количество клеток в центрифужной пробирке объемом 15 мл.
ПРИМЕЧАНИЕ: Для этого протокола предполагается концентрация 5 000 000 клеток/мл. - Умножьте желаемую плотность посева на площадь поверхности мембраны вставки, разделите на подсчитанное количество клеток/мл в суспензии и умножьте на 1 000, чтобы рассчитать требуемые микролитры клеточной суспензии на вставку.
- Чтобы найти общее необходимое количество клеточной суспензии, умножьте эту цифру на 10 (чтобы обеспечить достаточное количество клеток для 9 образцов, так как 3 из 12 вставок будут контрольными без клеток) и округлите до ближайшего целого числа. В этом случае для этого эксперимента требуется в общей сложности 135 мкл клеточной суспензии.
- Создать 2000 мкл скорректированного клеточного раствора путем смешивания ранее рассчитанных 135 мкл клеточной суспензии с 1865 мкл среды для клеточных культур в отдельной центрифужной пробирке объемом 15 мл.
- Засевающие ячейки
- Удалите излишки фибронектина из каждой вставки после завершения инкубации фибронектина.
- Промойте вкладыши дважды, добавив 100 мкл стерильной дистиллированной воды в каждый вкладыш. Удаляйте воду в том же порядке, в котором она была добавлена, чтобы обеспечить равномерное время стирки между вставками.
- Снова промойте вкладыш, добавив 100 мкл среды для клеточных культур в каждую вставку. Извлекайте носитель в том же порядке, в котором он был добавлен, чтобы обеспечить равномерное время промывки между вставками.
- Вставки для образцов ячеек
- Затравочные клетки путем пипетирования 200 мкл отрегулированного клеточного раствора в каждую вставку. Чтобы обеспечить равномерное слияние между вставками, смешайте раствор ячейки в центрифужной пробирке перед распределением и снова перемешайте в каждой вставке после распределения.
- Пластины с отрицательным контролем
- Пипеткой впрыскивайте 200 мкл среды для клеточных культур в каждую вставку. Чтобы сохранить однородность вставок для образцов клеток, используйте пипетку для смешивания питательных сред для клеточных культур внутри каждой вставки.
- Маркировка и инкубация
- С помощью перманентного маркера проведите линию, разделяющую пластину второго луночного колодца на два столбца шириной три лунки (для условий, выполняемых в трех экземплярах). Разделите каждый столбец на строки. Обозначьте каждый регион в сетке соответствующими параметрами.
- Добавьте 1 мл среды для клеточных культур в каждую лунку, чтобы получить вкладыш для эксперимента. Перенесите вкладыши из планшета для подготовки лунки в соответствующее место в маркированной планшете для экспериментальной лунки и инкубируйте при температуре 37 °C в течение не менее 12 часов.
3. Методика проведения эксперимента
- Эксперимент по доставке
- Пипеткой введите 1,5 мл раствора 0,1 мг/мл PI в каждую лунку в электродной решетке. Поместите вставку в каждую лунку в электродной решетке, вставив ножки вставки в юстировочные канавки так, чтобы вставка находилась на одном уровне с верхней поверхностью лунки (рис. 1A, B).
- Прикрутите верхнюю электродную печатную плату (печатную плату) к верхней части колодцев электродной решетки и подключите электродную решетку к устройству PSEP.
- Поместите электродную решетку в инкубатор при температуре 37 °C не менее чем на 1 час, чтобы температура выровнялась.
- Нажмите на выпадающий список рядом с «Мембраной» в верхнем левом углу графического интерфейса и нажмите на 400 нм GBO. Повторите этот шаг для разделов «Электролит», «Ячейки», «Плотность затравки клеток» и «Длительность ячейки», выбрав DMEM, A431, 200 и 12 соответственно.
ПРИМЕЧАНИЕ: Эти значения предназначены только для целей ведения учета и не влияют на работу устройства. Убедитесь, что эти значения скорректированы по мере необходимости для правильного отслеживания данных. - Введите 1 в поле редактирования Post Pulse Time Duration (min) в правой части графического интерфейса, чтобы изменить время измерения после импульса по умолчанию на 1 минуту. Оставьте все остальные настройки в состоянии по умолчанию.
ПРИМЕЧАНИЕ: Параметры импульсов по умолчанию создают прямоугольную форму сигнала с напряжением 30 В, 20 Гц, длительностью 1 мс и 200 импульсами. Стандартные параметры измерения TEEI: 0,5 В и 100 Гц, 1 000 Гц, 10 000 Гц и 100 000 Гц. - Нажмите кнопку «Запустить» и введите соответствующие имена для скважин 1-3 и 4-6 при появлении запроса. Нажмите OK, чтобы начать эксперимент.
- После завершения выполнения программы извлеките электродную решетку из инкубатора и переместите вставки обратно на исходные места в пластине экспериментальной лунки.
- Смешайте 2 мкл Hoechst 33342 и 5 мкл кальцеина AM со 123 мкл среды для клеточных культур в пробирке объемом 200 мкл.
- Аккуратно нанесите пипеткой 10 μл раствора для окрашивания в каждый постимпульсный вкладыш и поместите вкладыши обратно в инкубатор на 5 минут.
- Перенесите луночный планшет в держатель планшета флуоресцентного микроскопа с объективом 5-кратного увеличения. Изображение с использованием светлого поля и флуоресценции каждого пятна. Центрируйте вставку над объективом перед срабатыванием камеры.
ПРИМЕЧАНИЕ: Длины волн возбуждения для PI, кальцеина AM и Hoechst 33342 составляют 558 нм, 495 нм и 353 нм соответственно. Длины волн излучения составляют 575 нм, 519 нм и 465 нм соответственно.
- Эксперимент по измерению TEEI
- Пипеткой внесите 1,5 мл среды для клеточных культур в каждую лунку в электродной решетке. Вставьте вкладыши для образцов ячеек в лунки 1-3, а контрольные вставки - в лунки 4-6, установив ножки вкладыша в выравнивающие канавки так, чтобы вставка находилась на одном уровне с верхней поверхностью лунки.
- Прикрутите печатную плату верхнего электрода к верхней части лунок электродной решетки и подключите электродную решетку к устройству PSEP.
- Поместите электродную решетку в инкубатор при температуре 37 °C не менее чем на 1 час, чтобы температура выровнялась.
- Нажмите на выпадающий список рядом с «Мембраной» в левом верхнем углу графического интерфейса и нажмите на 400 нм GBO. Повторите этот шаг для разделов «Электролит», «Ячейки», «Плотность затравки клеток» и «Длительность ячейки», выбрав DMEM, A431, 200 и 12 соответственно.
ПРИМЕЧАНИЕ: Эти значения предназначены только для целей ведения учета и не влияют на работу устройства. Убедитесь, что эти значения скорректированы по мере необходимости для правильного отслеживания данных. - Оставьте все оставшиеся настройки в состоянии по умолчанию.
ПРИМЕЧАНИЕ: Параметры импульсов по умолчанию создают прямоугольную форму сигнала с напряжением 30 В, 20 Гц, длительностью 1 мс и 200 импульсами. Стандартные параметры измерения TEEI: 0,5 В и 100 Гц, 1 000 Гц, 10 000 Гц и 100 000 Гц. - Нажмите кнопку «Запустить» и введите соответствующие имена для скважин 1-3 и 4-6 при появлении запроса. Нажмите OK, чтобы начать эксперимент.
- После завершения выполнения программы извлеките электродную решетку из инкубатора и переместите вставки обратно на исходные места в пластине экспериментальной лунки.
- Смешайте 2 мкл Hoechst 33342, 5 мкл кальцеина AM и 10 мкл PI со 113 мкл среды для клеточных культур в реакционной пробирке объемом 200 мкл.
- Внесите пипеткой 10 μл раствора красителя в каждый постимпульсный вкладыш и поместите вкладыши обратно в инкубатор на 5 минут.
- Перенесите луночный планшет в держатель пластины флуоресцентного микроскопа с 5-кратным объективом. Изображение с использованием светлого поля и флуоресценции каждого пятна. Отцентрируйте вставку над объективом перед срабатыванием камеры.
ПРИМЕЧАНИЕ: Длины волн возбуждения для PI, кальцеина AM и Hoechst 33342 составляют 558 нм, 495 нм и 353 нм соответственно. Длины волн излучения составляют 575 нм, 519 нм и 465 нм соответственно.
4. Анализ данных
- Анализ данных изображений с помощью конвейера CellProfiler
- Используйте пользовательский рабочий процесс CellProfiler, предоставленный по адресу GitHub:https://github.com/YangLabUNL/PSEP-TEEI, для обработки изображений эксперимента по доставке и измерению TEEI.
- Анализ TEEI
- Перейдите на вкладку «Анализ» в графическом интерфейсе.
- Переключите индикатор типа импеданса на TEEI в нижней части графического интерфейса.
- Нажмите на стрелку в левом верхнем поле, чтобы отобразить все названия экспериментов в файле данных. Выберите все данные образцов клеток из эксперимента по измерению TEEI.
- Нажмите на стрелку в следующем поле справа, чтобы отобразить все названия экспериментов в файле данных. Выберите все данные управляющей вставки из измерения TEEI.
- Нажмите « Выполнить». Появится базовый рисунок, содержащий данные выборки выбранной ячейки с наименьшей частотой измерения.
- В окне с образцами параметров в правой части графического интерфейса нажмите на стрелку, чтобы отобразить все выбранные данные вставки. Выбросы можно удалить, выбрав соответствующие данные и нажав на кнопку «Удалить » ниже.
ПРИМЕЧАНИЕ: Любые данные, которые были удалены из анализа последним нажатием кнопки "Удалить ", могут быть восстановлены с помощью кнопки "Отменить ". - Нажмите « Готово », чтобы перейти к следующему рисунку, когда на рисунке будут показаны нужные данные.
- Повторите шаги 4.2.6 и 4.2.7 для оставшихся данных образца клетки и контрольных данных. Когда окончательный набор данных будет подтвержден нажатием кнопки «Готово», появится полная цифра анализа.
- Сохраните рисунок анализа.
Результаты
Данный протокол устанавливает метод использования измерений TEEI для изучения промежуточных процессов электропорации и прогнозирования доставки, в частности, для клеточной линии A431 и груза PI. Хотя модификация этого протокола обсуждается далее в статье, важно отметит?...
Обсуждение
На рисунке 2C показано, что для каждого напряжения сигнала PSEP построены графики увеличения TEEI от минимума и уменьшения от базового уровня. Увеличение TEEI создает параболическую дугу, достигающую пика около 20 вольт перед снижением, в то время как уменьше?...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Мы выражаем признательность за финансовую поддержку со стороны NSF (Awards 1826135, 1936065, 2143997), Национальных институтов общих медицинских наук NIH P20GM113126 (Центр интегрированной биомолекулярной коммуникации Небраски) и P30GM127200 (Центр наномедицины Небраски), Совместной инициативы Небраски и Поддержки биоинженерии Воелте-Кигана. Устройство было изготовлено в NanoEngineering Research Core Facility (NERCF), который частично финансируется Исследовательской инициативой штата Небраска.
Материалы
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Centrifuge Tube | Thermo Scientific | 339651 | |
| 2-Chip Disposable Hemocytometer | Bulldog Bio | DHC-N01 | |
| 75 cm2 Tissue Culture Flask | fisherbrand | FB012937 | |
| A431 Cells | ATCC | CRL-1555 | |
| Calcein AM | Invitrogen | C3099 | |
| Class II Type A2 Biosafety Cabinet | Labgard | NU-543-600 | |
| Custom Components | YangLab | https://github.com/YangLabUNL/PSEP-TEEI | |
| Disposable Centrifuge Tube (50 mL) | fisherbrand | 05-539-6 | |
| DMEM | Gibco | 11965092 | |
| Fetal Bovine Serum | Gibco | A5670401 | |
| Fluid Aspiration System | vacuubrand | 20727403 | |
| HERACELL 240i | Thermo Scientific | 51026331 | |
| Hoechst 33342 | Thermo Scientific | 62249 | |
| Human Plasma Fibronectin | Sigma-Aldrich | FIBRP-RO | |
| Inverted Fluorescent Microscope | Zeiss | 491916-0001-000 | |
| Inverted Microscope | Labomed | TCM 400 | |
| PBS | cytiva | SH30256.02 | |
| PCR Tube 200 µL | Sarstedt | 72.737 | |
| Penicillin / Streptomycin | Gibco | 15140148 | |
| Pipette (0.2-2 µL) | fisherbrand Elite | FBE00002 | |
| Pipette (100-1000 µL) | fisherbrand Elite | FBE01000 | |
| Pipette (20-200 µL) | fisherbrand Elite | FBE00200 | |
| Pipette (2-20 µL) | fisherbrand Elite | FBE00020 | |
| Propidium Iodide | Invitrogen | P1304MP | |
| Reaction Tube 1.5 mL | Sarstedt | 72.690.300 | |
| Sorvall ST 16R Centrifuge | Thermo Scientific | 75004240 | |
| Thincert (24-well) | Greiner Bio-One | 662 641 | 0.4 µm pore diameter, 2x106 cm-2 pore density, transparent PET |
| Tissue Culture Plate (24-well) | fisherbrand | FB012929 | |
| Trypan Blue Solution | Sigma-Aldrich | T8154-20mL | |
| Trypsin | Gibco | 15090046 |
Ссылки
- Brooks, J., et al. High throughput and highly controllable methods for in vitro intracellular delivery. Small. 16 (51), e2004917 (2020).
- Stewart, M. P., Langer, R., Jensen, K. F. Intracellular delivery by membrane disruption: Mechanisms, strategies, and concepts. Chem Rev. 118 (16), 7409-7531 (2018).
- Canatella, P. J., Karr, J. F., Petros, J. A., Prausnitz, M. R. Quantitative study of electroporation-mediated molecular uptake and cell viability. Biophys J. 80 (2), 755-764 (2001).
- Pliquett, U., Gift, E. A., Weaver, J. C. Determination of the electric field and anomalous heating caused by exponential pulses with aluminum electrodes in electroporation experiments. Bioelectrochem Bioenerg. 39 (1), 39-53 (1996).
- Pan, J., et al. Cell membrane damage and cargo delivery in nano-electroporation. Nanoscale. 15 (8), 4080-4089 (2023).
- Boukany, P. E., et al. Nanochannel electroporation delivers precise amounts of biomolecules into living cells. Nat Nanotechnol. 6 (11), 747-754 (2011).
- Chang, L., et al. Micro-/nanoscale electroporation. Lab Chip. 16 (21), 4047-4062 (2016).
- Patino, C. A., et al. Multiplexed high-throughput localized electroporation workflow with deep learning-based analysis for cell engineering. Sci Adv. 8 (29), 7637 (2022).
- Sagvolden, G., Giaever, I., Pettersen, E. O., Feder, J. Cell adhesion force microscopy. Proc Natl Acad Sci U S A. 96 (2), 471-476 (1999).
- Ishibashi, T., Takoh, K., Kaji, H., Abe, T., Nishizawa, M. A porous membrane-based culture substrate for localized in situ electroporation of adherent mammalian cells. Sensors Actuators B: Chem. 128 (1), 5-11 (2007).
- Mukherjee, P., Nathamgari, S. S. P., Kessler, J. A., Espinosa, H. D. Combined numerical and experimental investigation of localized electroporation-based cell transfection and sampling. ACS Nano. 12 (12), 12118-12128 (2018).
- Brooks, J. R., et al. An equivalent circuit model for localized electroporation on porous substrates. Biosens Bioelectron. 199, 113862 (2022).
- Brooks, J. R., et al. Transepithelial electrical impedance increase following porous substrate electroporation enables label-free delivery. Small. 20 (25), 2310221 (2023).
- Vindiš, T., et al. Gene electrotransfer into mammalian cells using commercial cell culture inserts with porous substrate. Pharmaceutics. 14 (9), 1959 (2022).
- Ye, Y., et al. Single-cell electroporation with real-time impedance assessment using a constriction microchannel. Micromachines. 11 (9), 856 (2020).
- Bednarek, R. In vitro methods for measuring the permeability of cell monolayers. Methods Protoc. 5 (1), 17 (2022).
- Harhaj, N. S., Antonetti, D. A. Regulation of tight junctions and loss of barrier function in pathophysiology. Int J Biochem Cell Biol. 36 (7), 1206-1237 (2004).
- Hunter, R. J. . Zeta potential in colloid science: Principles and applications. 2, (2013).
- Wong, P. K., Wang, T. -. H., Deval, J. H., Ho, C. -. M. Electrokinetics in microdevices for biotechnology applications. IEEE/ASME Trans Mechatron. 9 (2), 366-376 (2004).
- Qian, K., Wang, Y., Lei, Y., Yang, Q., Yao, C. An experimental and theoretical study on cell swelling for osmotic imbalance induced by electroporation. Bioelectrochemistry. 157, 108637 (2024).
- Fox, M. B., et al. Electroporation of cells in microfluidic devices: A review. Anal Bioanal Chem. 385 (3), 474-485 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены