Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Transepitelyal Elektriksel Empedans İzleme ile Gözenekli Substrat Bazlı Elektroporasyon
Bu Makalede
Özet
Gözenekli substrat elektroporasyonu (PSEP), tutarlı, yüksek verimli iletimi yüksek hücre canlılığı ile eşleştirir. Transepitelyal elektrik empedans (TEEI) ölçümlerinin tanıtılması, PSEP'in ara süreçleri hakkında bilgi sağlar ve etiketsiz teslimata olanak tanır. Bu makalede, PSEP dağıtım deneylerini ve TEEI ölçüm analizini aynı anda gerçekleştirmek için bir yöntem tartışılmaktadır.
Özet
Gözenekli substrat elektroporasyonu (PSEP), yüksek verim ve tutarlı teslimat sağlayan yeni ortaya çıkan bir elektroporasyon yöntemidir. Diğer birçok hücre içi doğum türü gibi, PSEP de başarılı doğumu belirlemek için büyük ölçüde floresan belirteçlere ve floresan mikroskobuna dayanır. Elektroporasyon işleminin ara adımları hakkında bilgi edinmek için, entegre transepitelyal elektriksel empedans (TEEI) izlemeye sahip bir PSEP platformu geliştirilmiştir. Hücreler, gözenekli zarlara sahip ticari olarak temin edilebilen eklerde kültürlenir. 12 saatlik bir inkübasyon süresinden sonra, tamamen birleşik bir hücre tek tabakasının oluşumuna izin vermek için, ekler PSEP cihazının kuyucuklarında bulunan transfeksiyon ortamına yerleştirilir. Hücre tek katmanları daha sonra kullanıcı tanımlı bir dalga formuna tabi tutulur ve dağıtım verimliliği floresan mikroskobu ile doğrulanır. Bu iş akışı, PSEP süreci hakkında ek veri toplamak için darbeli ve floresan mikroskobu arasındaki TEEI ölçümleriyle önemli ölçüde geliştirilebilir ve bu ek TEEI verileri, teslimat verimliliği ve uygulanabilirliği gibi teslimat ölçümleriyle ilişkilendirilir. Bu makalede, TEEI ölçümleriyle PSEP gerçekleştirmek için bir protokol açıklanmaktadır.
Giriş
Elektroporasyon, hücrelerin bir elektrik alanına maruz bırakıldığı, hücre zarında proteinler, RNA ve DNA dahil olmak üzere kargolarıngeçebileceği geçici gözenekler oluşturduğu bir tekniktir 1,2. En yaygın kullanılan versiyon toplu elektroporasyondur (BEP). BEP, bir küvetin milyonlarca hücre içeren bir elektrolit ile doldurulması, elektrolitin yüksek voltaja maruz bırakılması ve yükün difüzyon veya endositoz1 yoluyla hücrelere girmesine izin verilmesiyle gerçekleştirilir. BEP'in yüksek verim ve ticari olarak temin edilebilen çok sayıda sistem dahil olmak üzere birçok avantajı vardır. Ancak, BEP dağıtımında sınırlamalar vardır. Elektrotlara göre tutarsız hücre konumlandırması ve bitişik hücrelerden gelen elektrik alan koruması, BEP 3,4 sırasında elektrik alanına maruz kalmada önemli değişkenliğe neden olur. BEP için gereken yüksek voltaj ayrıca hücre canlılığı üzerinde önemli bir olumsuz etkiye sahiptir5. 2011'dekibaşlangıcından bu yana6, gözenekli substrat elektroporasyonu (PSEP) adı verilen bir elektroporasyon yöntemine artan bir ilgi olmuştur, ancak bazen lokalize elektroporasyon ve nano veya mikro elektroporasyon 1,7,8 dahil olmak üzere başka isimlerle anılmaktadır. BEP'in hücre süspansiyonunun aksine, PSEP gözenekli bir substrata yapışan hücreler üzerinde gerçekleştirilir. İnsan hücre hatlarının9 çoğunluğu için sadece yapışık bir durum tercih edilmekle kalmaz, aynı zamanda substrattaki gözenekler de elektrik akımına odaklanır ve transmembran elektrik potansiyelini (TMP) hücre zarının10,11 belirli bölgelerine lokalize eder. Bu lokalizasyon, uygulanan voltajda önemli bir azalmaya, hasarı azaltmaya ve hücre canlılığını artırmaya izin verir. Bu etki kombinasyonu, hücre zarı gözenek gelişimini kontrol etmeye yardımcı olarak daha tutarlı ve verimli bir teslimat sağlar 1,5,12.
Yakın zamanda yapılan bir çalışmada, ilk olarak Vindis ve ark.14 tarafından tanıtılan, ticari olarak temin edilebilen gözenekli membran eklerini13 (Şekil 1A,B) tutmak için altı kuyulu, altın kaplama elektrot dizisine sahip bir PSEP cihazı tanıtıldı. Cihaz, gerçek zamanlı olarak13 olarak transepitelyal elektrik empedansı (TEEI) olarak bilinen hücre tek tabakası boyunca darbeler uygulayabilir ve elektrik empedansını ölçebilir. Cihazın kullanıcı arayüzü, elektroporasyon dalga formu ve polaritesi üzerinde tam kontrol sağlar. Daha da önemlisi, gerçek zamanlı empedans ölçümleri, etiketsiz teslimat15 olarak bilinen bir kavram olan pahalı reaktiflere veya floresan işaretleyicilere ihtiyaç duymadan teslimat sonuçlarını tahmin etmek için kullanılabilir.
PSEP platformu iki ana özel elektrik bileşeninden oluşur: darbe üreteci ve TEEI ölçüm ekipmanını barındıran cihazın ana gövdesi ve gözenekli alt tabakaların yerleştirildiği ve elektroporasyonun gerçekleştiği elektrot dizisi. Tüm özel elektronikler ve 3D baskılı bileşenler için diyagramlar GitHub'da bulunabilir: https://github.com/YangLabUNL/PSEP-TEEI. Özel elektroniklere ek olarak, platformun düzgün çalışması için bir bilgisayar da gereklidir. Özel yazılımın çalışması için MATLAB (sürüm 2021a veya üzeri) ve analiz için verileri depolamak ve verilere erişmek için Microsoft Excel gerekir. Program, özel elektronikleri kontrol eder ve ayarları yapmak için grafik kullanıcı arayüzü (GUI) sağlar. Bu programlar ayrıca GitHub: https://github.com/YangLabUNL/PSEP-TEEI'da da kullanıma sunuldu.
Ön veriler, bu işlemin farklı yapışık hücre türleri için mümkün olduğunu göstermektedir (Şekil 1C), ancak bu makale yalnızca Brooks ve ark.13 tarafından bu hücre hattı için optimal olduğu tespit edilen parametreleri kullanarak A431 hücrelerinin hazırlanmasını tartışacaktır. Ek olarak, propidyum iyodür (PI) kargosu sitotoksik olduğundan, ilki dağıtım verimliliğini ölçmek için yüksek konsantrasyonlu bir PI transfeksiyon ortamı ve ikincisi daha uzun zaman ölçeklerinde TEEI'yi ölçmek için yalnızca hücre kültürü ortamı olmak üzere iki deney gerçekleştirilir. Bu deneyler, sonuçların ilişkilendirilmesine izin veren aynı elektroporasyon dalga formlarını kullanır (Şekil 1D).
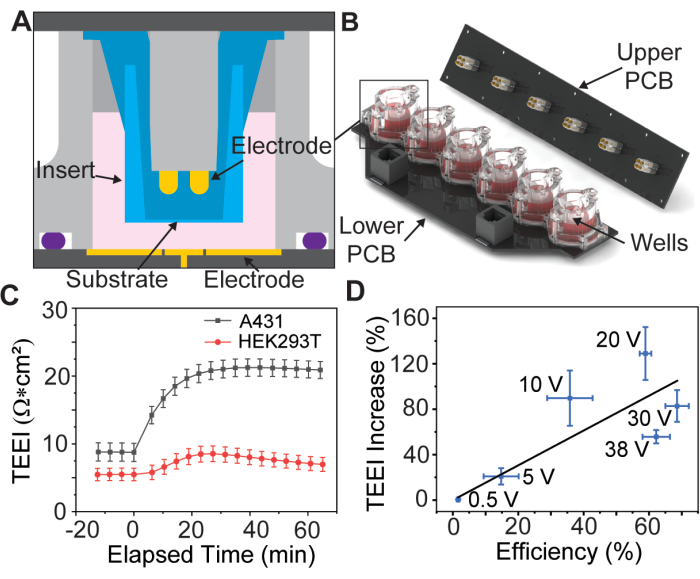
Şekil 1: Elektrot dizisi montaj şeması ve temel veriler. (A) Elektrot dizisinin bir kuyusu içindeki bir ekin CAD modeli. (B) Elektrot dizisinin CAD modeli. (C) Seçili hücre hatları için PSEP'e bağlı empedans artışı, hücre hattı başına n = 3. Hata çubuğu: ortalamanın standart hatası. (D) Teslimat verimliliği vs. TEEI korelasyon verilerini artırır. Dağıtım verimliliği, dağıtım deneylerinden hem PI hem de kalsein görüntülerinde etiketlenen hücre sayısının Hoechst ile tanımlanan toplam hücre sayısına bölünmesiyle hesaplandı. Hücre sayısı, voltaj başına n = 6 olan özel bir CellProfiler işlem hattı kullanılarak belirlendi. Hata çubuğu: (x ve y ekseni) ortalamanın standart hatası. Bu figür Brooks ve ark.13'ten izin alınarak çoğaltılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
Çalışmada kullanılan reaktiflerin ve ekipmanların detayları Malzeme Tablosunda listelenmiştir.
1. Reaktiflerin ve hücre kültürünün hazırlanması
- 500 mL'lik bir Dulbecco'nun Modifiye Kartal Ortamı (DMEM) kabına 50 mL fetal sığır serumu (FBS) ve 5 mL penisilin-streptomisin ekleyerek hücre kültürü ortamını hazırlayın. Kontaminasyon riskini azaltmak için on bir adet 50 mL'lik alikot üretin ve 4 °C'de soğutun.
- Üreticinin talimatlarına göre fosfat tamponlu salin (PBS) stok çözeltisinde 1 mL 25 μg / mL insan plazma fibronektini oluşturun.
- Değişen kargo konsantrasyonları ile deneylere izin vermek için DMEM stok çözeltisinde 15 mL 0.1 mg / mL propidyum iyodür oluşturun.
- Hazırlanan hücre kültürü ortamının 12 mL'sini içeren bir T75 şişesinde A431 hücrelerinin kültürü. % 50 birleşmeyi sağlamak için hücreler her 1-2 günde bir geçirildi.
2. Numune hazırlama
- Fibronektin kaplama
- On iki kesici uç ve iki adet 24 oyuklu plaka seçin. Ekleri bir kuyucuklu plakaya yerleştirin ve altılı iki sıra oluşturun. İkinci kuyu plakasını daha sonraya kadar bir kenara koyun.
- 1.5 mL'lik bir tüpte 52 μL fibronektin stok çözeltisi ve 1.248 μL PBS'yi karıştırarak 1.300 μL 1 μg / mL fibronektin çözeltisi oluşturun.
- Her bir eke 100 μL fibronektin çözeltisi dağıtın. Ekleri kuyu plakasında 37 ° C'de 3 saat inkübe edin.
- Optimize edilmiş hücre yoğunluğu için hücre konsantrasyonunun ayarlanması
- Fibronektin inkübasyonu tamamlanmadan yaklaşık 1 saat önce, hücre ekstraksiyonu için A431 hücrelerinin T75 şişesini inkübatörden çıkarın.
- Şişedeki ortamı bir aspiratör ile çıkarın ve 5 mL PBS ile yıkayın. PBS'yi aynı şekilde çıkarın ve 3 mL Tripsin ekleyin. Hücreleri tamamen ayırmak için şişenin kenarına dokunmadan önce 3-4 dakika inkübe edin.
- Şişeye 6 mL hücre kültürü ortamı ekleyin, kalan hücreleri ayırmak için bir pipetle kuvvetlice karıştırın ve içeriği 15 mL'lik bir santrifüj tüpüne aktarın. 100 x g ve 20 °C'de 5 dakika santrifüjleyin.
- Hücre peletini rahatsız etmemeye dikkat ederek hücre kültürü ortamını ve Tripsin'i bir aspiratör kullanarak santrifüj tüpünden çıkarın. Santrifüj tüpüne 1 mL ortam ekleyin ve hücre peletini parçalamak ve hücreleri yeniden süspanse etmek için ileri geri pipetleyin (kabarcık oluşturmadan).
- 10 μL hücre süspansiyonu, 40 μL hücre kültürü ortamı ve 50 μL tripan mavisi boyayı 200 μL'lik bir tüpe pipetleyin ve iyice karıştırın.
- Boya karışımından 10 μL çıkarın ve bir hemositometreye enjekte edin. 15 mL santrifüj tüpündeki toplam hücre sayısını tahmin etmek için boya karışımının %10 seyreltmesini kullanarak hücreleri sayın.
NOT: Bu protokol için 5.000.000 hücre/mL'lik bir konsantrasyon varsayalım. - İstenen tohumlama yoğunluğunu kesici uç zarının yüzey alanıyla çarpın, süspansiyondaki sayılan hücreler/mL'ye bölün ve ek başına gerekli mikrolitre hücre süspansiyonunu hesaplamak için 1.000 ile çarpın.
- Gerekli toplam hücre süspansiyonu miktarını bulmak için, bu rakamı 10 ile çarpın (9 örnek için yeterli hücre sağlamak için, çünkü 12 ekin 3'ü hücresiz kontroller olacaktır) ve en yakın tam sayıya yuvarlayın. Bu durumda, bu deney için toplam 135 μL hücre süspansiyonu gereklidir.
- Önceden hesaplanan 135 μL hücre süspansiyonunu ayrı bir 15 mL santrifüj tüpünde 1.865 μL hücre kültürü ortamı ile karıştırarak 2.000 μL ayarlanmış hücre çözeltisi oluşturun.
- Tohumlama hücreleri
- Fibronektin inkübasyonu tamamlandıktan sonra her bir parçadan fazla fibronektini çıkarın.
- Her bir parçaya 100 μL steril damıtılmış su ekleyerek ekleri iki kez yıkayın. Ekler arasında tutarlı bir yıkama süresi sağlamak için suyu, eklendiği sırayla çıkarın.
- Her bir kesici parçaya 100 μL hücre kültürü ortamı ekleyerek ek parçayı tekrar yıkayın. Uçlar arasında tutarlı bir yıkama süresi sağlamak için medyayı eklendiği sırayla çıkarın.
- Hücre örnek ekleri
- Her bir kesici uça 200 μL ayarlanmış hücre çözeltisi pipetleyerek hücreleri tohumlayın. Kesici uçlar arasında tutarlı bir birleşme sağlamak için, hücre çözeltisini dağıtımdan önce santrifüj tüpünde karıştırın ve dağıtımdan sonra her bir ek parçanın içinde tekrar karıştırın.
- Negatif kontrol ekleri
- Her bir inserte 200 μL hücre kültürü ortamı pipetleyin. Hücre numunesi ekleriyle tutarlı kalmak için, her bir ekin içindeki hücre kültürü ortamını karıştırmak için pipeti kullanın.
- Etiketleme ve inkübasyon
- Kalıcı bir işaretleyici kullanarak ikinci kuyu plakasını üç kuyu genişliğinde (üç nüsha halinde çalışan koşullar için) iki sütuna bölen bir çizgi çizin. Her sütunu satırlara ayırın. Kılavuzdaki her bölgeyi ilgili parametrelerle etiketleyin.
- Deney için bir ek almak üzere her kuyucuğa 1 mL hücre kültürü ortamı ekleyin. Ekleri hazırlama kuyusu plakasından etiketli deney kuyusu plakasındaki uygun yerlerine aktarın ve 37 °C'de en az 12 saat inkübe edin.
3. Deneysel prosedür
- Teslimat deneyi
- Elektrot dizisindeki her bir oyuğa 0.1 mg / mL PI çözeltisinin 1.5 mL'sini pipetleyin. Elektrot dizisindeki her bir oyuğa bir kesici uç yerleştirin ve ek parçanın ayaklarını, ek parçanın üst yüzeyi ile aynı hizada olacak şekilde hizalama oluklarına yerleştirin (Şekil 1A,B).
- Üst elektrot baskılı devre kartını (PCB) elektrot dizisi yuvalarının üstüne vidalayın ve elektrot dizisini PSEP cihazına bağlayın.
- Sıcaklığın dengelenmesi için elektrot dizisini en az 1 saat boyunca 37 °C inkübatöre yerleştirin.
- GUI'nin sol üst köşesindeki "Membran"ın yanındaki açılır menüye tıklayın ve 400 nm GBO'ya tıklayın. "Elektrolit", "Hücreler", "Hücre Tohumlama Yoğunluğu" ve "Hücre Süresi" için bu adımı tekrarlayın ve sırasıyla DMEM, A431, 200 ve 12'yi seçin.
NOT: Bu değerler yalnızca kayıt tutma amaçlıdır ve aygıtın işlevini etkilemez. Lütfen doğru veri takibi için bu değerleri gerektiği gibi ayarladığınızdan emin olun. - Varsayılan darbe sonrası ölçüm süresini 1 dakika olarak değiştirmek için GUI'nin sağ tarafındaki Darbe Sonrası Süre (dk) düzenleme alanına 1 yazın. Diğer tüm ayarları varsayılan durumda bırakın.
NOT: Varsayılan darbe parametreleri, 30 volt, 20 Hz, 1 ms süre ve 200 darbeli bir kare dalga biçimi oluşturur. Varsayılan TEEI ölçüm parametreleri 0,5 volt ve 100 Hz, 1,000 Hz, 10,000 Hz ve 100,000 Hz'dir. - Çalıştır düğmesine tıklayın ve istendiğinde 1-3 ve 4-6 numaralı kuyular için uygun adları girin. Denemeyi başlatmak için Tamam'a tıklayın.
- Elektrot dizisini inkübatörden çıkarın ve programın yürütülmesi bittiğinde ekleri deney kuyusu plakasındaki orijinal konumlarına geri aktarın.
- 200 μL'lik bir tüpte 2 μL Hoechst 33342 ve 5 μL kalsein'yi 123 μL hücre kültürü ortamı ile karıştırın.
- Her bir darbe sonrası eke 10 μL leke solüsyonunu nazikçe pipetleyin ve ekleri 5 dakika boyunca inkübatöre geri yerleştirin.
- Kuyu plakasını 5x büyütme objektifine sahip bir floresan mikroskobun plaka tutucusuna aktarın. Parlak alan ve her lekenin floresansını kullanan görüntü. Kamerayı tetiklemeden önce eki objektifin üzerinde ortalayın.
NOT: PI, kalsein ve Hoechst 33342 için uyarma dalga boyları sırasıyla 558 nm, 495 nm ve 353 nm'dir. Emisyon dalga boyları sırasıyla 575 nm, 519 nm ve 465 nm'dir.
- TEEI ölçüm deneyi
- Elektrot dizisindeki her bir oyuğa 1.5 mL hücre kültürü ortamını pipetleyin. Hücre numune eklerini 1-3 numaralı kuyucuklara yerleştirin ve kontrol eklerini 4-6 numaralı kuyucuklara yerleştirin, ek parçanın ayaklarını hizalama oluklarına yerleştirin, böylece ek parça kuyunun üst yüzeyi ile aynı hizada olur.
- Üst elektrot PCB'sini elektrot dizisi yuvalarının üstüne vidalayın ve elektrot dizisini PSEP cihazına bağlayın.
- Sıcaklığın dengelenmesi için elektrot dizisini en az 1 saat boyunca 37 °C inkübatöre yerleştirin.
- GUI'nin sol üst köşesindeki "Membran"ın yanındaki açılır menüye tıklayın ve 400 nm GBO'ya tıklayın. "Elektrolit", "Hücreler", "Hücre Tohumlama Yoğunluğu" ve "Hücre Süresi" için bu adımı tekrarlayın ve sırasıyla DMEM, A431, 200 ve 12'yi seçin.
NOT: Bu değerler yalnızca kayıt tutma amaçlıdır ve aygıtın işlevini etkilemez. Lütfen doğru veri takibi için bu değerleri gerektiği gibi ayarladığınızdan emin olun. - Kalan tüm ayarları varsayılan durumda bırakın.
NOT: Varsayılan darbe parametreleri, 30 volt, 20 Hz, 1 ms süre ve 200 darbeli bir kare dalga biçimi oluşturur. Varsayılan TEEI ölçüm parametreleri 0,5 volt ve 100 Hz, 1,000 Hz, 10,000 Hz ve 100,000 Hz'dir. - Çalıştır düğmesine tıklayın ve istendiğinde 1-3 ve 4-6 numaralı kuyular için uygun adları girin. Denemeyi başlatmak için Tamam'a tıklayın.
- Elektrot dizisini inkübatörden çıkarın ve programın yürütülmesi bittiğinde ekleri deney kuyusu plakasındaki orijinal konumlarına geri aktarın.
- 200 μL'lik bir reaksiyon tüpünde 2 μL Hoechst 33342, 5 μL kalsein ve 10 μL PI'yi 113 μL hücre kültürü ortamı ile karıştırın.
- Her bir darbe sonrası eke 10 μL leke solüsyonu pipetleyin ve ekleri 5 dakika boyunca inkübatöre geri yerleştirin.
- Kuyu plakasını 5x objektif lensli bir floresan görüntüleme mikroskobunun plaka tutucusuna aktarın. Parlak alan ve her lekenin floresansını kullanan görüntü. Kamerayı tetiklemeden önce ek parçayı lensin üzerinde ortalayın.
NOT: PI, kalsein ve Hoechst 33342 için uyarma dalga boyları sırasıyla 558 nm, 495 nm ve 353 nm'dir. Emisyon dalga boyları sırasıyla 575 nm, 519 nm ve 465 nm'dir.
4. Veri analizi
- CellProfiler işlem hattı ile görüntü verilerini analiz etme
- Teslim ve TEEI ölçüm deneyi görüntülerini işlemek için GitHub:https://github.com/YangLabUNL/PSEP-TEEI adresinde sağlanan özel CellProfiler iş akışını kullanın.
- TEEI analizi
- GUI'deki Analiz sekmesine tıklayın.
- GUI'nin altındaki empedans tipi göstergesini TEEI olarak değiştirin.
- Veri dosyasındaki tüm deney adlarını göstermek için sol üstteki kutudaki oka tıklayın. TEEI ölçüm deneyinden tüm hücre örneği verilerini seçin.
- Veri dosyasındaki tüm deney adlarını göstermek için sağdaki bir sonraki kutuda bulunan oka tıklayın. TEEI ölçümünden tüm kontrol ekleme verilerini seçin.
- Çalıştır'a tıklayın. En düşük ölçüm frekansında seçilen hücre örneği verilerini içeren temel bir şekil görünecektir.
- GUI'nin sağ tarafındaki örnek seçenekler kutusunda, seçilen tüm ekleme verilerini göstermek için oka tıklayın. Aykırı değerler, uygun verileri seçip aşağıdaki Kaldır'a tıklayarak kaldırılabilir.
NOT: Kaldır düğmesine son tıklanmasıyla analizden kaldırılan tüm veriler, Geri Al düğmesi tarafından geri alınabilir. - İstenen veriler şekilde gösterildiğinde bir sonraki şekle geçmek için Bitti'ye tıklayın.
- Kalan hücre örnek verileri ve kontrol verileri için 4.2.6 ve 4.2.7 adımlarını tekrarlayın. Nihai veri seti "Bitti" tıklanarak onaylandığında, tam analiz rakamı görünecektir.
- Analiz rakamını kaydedin.
Sonuçlar
Verilen protokol, özellikle A431 hücre hattı ve PI kargosu için elektroporasyonun ara süreçlerini incelemek ve teslimat tahminleri yapmak için TEEI ölçümlerini kullanmak için bir yöntem oluşturur. Bu protokolün modifikasyonu makalede daha ayrıntılı olarak tartışılmış olsa da, belirli değerler değişebilse de, yanıttaki genel eğilimlerin tutarlı kaldığını belirtmek önemlidir. Örneğin, ilk taban çizgisinin altına düşen TEEI verileri hücre ölümüne k...
Tartışmalar
Şekil 2C , her bir PSEP dalga biçimi voltajı için TEEI'nin minimumdan artışlarının ve taban çizgisinden düşüşlerin çizildiğini göstermektedir. TEEI artışı, azalmadan önce yaklaşık 20 volt zirve yapan parabolik bir ark oluştururken, taban çizgisinden TEEI düşüşü, voltaj arttıkça katlanarak artar. Şekil 2D'deki teslimat verimliliği ve ölüm yüzdeleri, teslimat verimliliği parabolik olarak ark ya...
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
NSF (Awards 1826135, 1936065, 2143997), NIH Ulusal Genel Tıp Bilimleri Enstitüleri P20GM113126 (Nebraska Entegre Biyomoleküler İletişim Merkezi) ve P30GM127200 (Nebraska Nanotıp Merkezi), Nebraska İşbirliği Girişimi ve Voelte-Keegan Biyomühendislik Desteği'nden sağlanan finansman desteğini kabul ediyoruz. Cihaz, kısmen Nebraska Araştırma Girişimi tarafından finanse edilen NanoEngineering Research Core Facility'de (NERCF) üretildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Centrifuge Tube | Thermo Scientific | 339651 | |
| 2-Chip Disposable Hemocytometer | Bulldog Bio | DHC-N01 | |
| 75 cm2 Tissue Culture Flask | fisherbrand | FB012937 | |
| A431 Cells | ATCC | CRL-1555 | |
| Calcein AM | Invitrogen | C3099 | |
| Class II Type A2 Biosafety Cabinet | Labgard | NU-543-600 | |
| Custom Components | YangLab | https://github.com/YangLabUNL/PSEP-TEEI | |
| Disposable Centrifuge Tube (50 mL) | fisherbrand | 05-539-6 | |
| DMEM | Gibco | 11965092 | |
| Fetal Bovine Serum | Gibco | A5670401 | |
| Fluid Aspiration System | vacuubrand | 20727403 | |
| HERACELL 240i | Thermo Scientific | 51026331 | |
| Hoechst 33342 | Thermo Scientific | 62249 | |
| Human Plasma Fibronectin | Sigma-Aldrich | FIBRP-RO | |
| Inverted Fluorescent Microscope | Zeiss | 491916-0001-000 | |
| Inverted Microscope | Labomed | TCM 400 | |
| PBS | cytiva | SH30256.02 | |
| PCR Tube 200 µL | Sarstedt | 72.737 | |
| Penicillin / Streptomycin | Gibco | 15140148 | |
| Pipette (0.2-2 µL) | fisherbrand Elite | FBE00002 | |
| Pipette (100-1000 µL) | fisherbrand Elite | FBE01000 | |
| Pipette (20-200 µL) | fisherbrand Elite | FBE00200 | |
| Pipette (2-20 µL) | fisherbrand Elite | FBE00020 | |
| Propidium Iodide | Invitrogen | P1304MP | |
| Reaction Tube 1.5 mL | Sarstedt | 72.690.300 | |
| Sorvall ST 16R Centrifuge | Thermo Scientific | 75004240 | |
| Thincert (24-well) | Greiner Bio-One | 662 641 | 0.4 µm pore diameter, 2x106 cm-2 pore density, transparent PET |
| Tissue Culture Plate (24-well) | fisherbrand | FB012929 | |
| Trypan Blue Solution | Sigma-Aldrich | T8154-20mL | |
| Trypsin | Gibco | 15090046 |
Referanslar
- Brooks, J., et al. High throughput and highly controllable methods for in vitro intracellular delivery. Small. 16 (51), e2004917 (2020).
- Stewart, M. P., Langer, R., Jensen, K. F. Intracellular delivery by membrane disruption: Mechanisms, strategies, and concepts. Chem Rev. 118 (16), 7409-7531 (2018).
- Canatella, P. J., Karr, J. F., Petros, J. A., Prausnitz, M. R. Quantitative study of electroporation-mediated molecular uptake and cell viability. Biophys J. 80 (2), 755-764 (2001).
- Pliquett, U., Gift, E. A., Weaver, J. C. Determination of the electric field and anomalous heating caused by exponential pulses with aluminum electrodes in electroporation experiments. Bioelectrochem Bioenerg. 39 (1), 39-53 (1996).
- Pan, J., et al. Cell membrane damage and cargo delivery in nano-electroporation. Nanoscale. 15 (8), 4080-4089 (2023).
- Boukany, P. E., et al. Nanochannel electroporation delivers precise amounts of biomolecules into living cells. Nat Nanotechnol. 6 (11), 747-754 (2011).
- Chang, L., et al. Micro-/nanoscale electroporation. Lab Chip. 16 (21), 4047-4062 (2016).
- Patino, C. A., et al. Multiplexed high-throughput localized electroporation workflow with deep learning-based analysis for cell engineering. Sci Adv. 8 (29), 7637 (2022).
- Sagvolden, G., Giaever, I., Pettersen, E. O., Feder, J. Cell adhesion force microscopy. Proc Natl Acad Sci U S A. 96 (2), 471-476 (1999).
- Ishibashi, T., Takoh, K., Kaji, H., Abe, T., Nishizawa, M. A porous membrane-based culture substrate for localized in situ electroporation of adherent mammalian cells. Sensors Actuators B: Chem. 128 (1), 5-11 (2007).
- Mukherjee, P., Nathamgari, S. S. P., Kessler, J. A., Espinosa, H. D. Combined numerical and experimental investigation of localized electroporation-based cell transfection and sampling. ACS Nano. 12 (12), 12118-12128 (2018).
- Brooks, J. R., et al. An equivalent circuit model for localized electroporation on porous substrates. Biosens Bioelectron. 199, 113862 (2022).
- Brooks, J. R., et al. Transepithelial electrical impedance increase following porous substrate electroporation enables label-free delivery. Small. 20 (25), 2310221 (2023).
- Vindiš, T., et al. Gene electrotransfer into mammalian cells using commercial cell culture inserts with porous substrate. Pharmaceutics. 14 (9), 1959 (2022).
- Ye, Y., et al. Single-cell electroporation with real-time impedance assessment using a constriction microchannel. Micromachines. 11 (9), 856 (2020).
- Bednarek, R. In vitro methods for measuring the permeability of cell monolayers. Methods Protoc. 5 (1), 17 (2022).
- Harhaj, N. S., Antonetti, D. A. Regulation of tight junctions and loss of barrier function in pathophysiology. Int J Biochem Cell Biol. 36 (7), 1206-1237 (2004).
- Hunter, R. J. . Zeta potential in colloid science: Principles and applications. 2, (2013).
- Wong, P. K., Wang, T. -. H., Deval, J. H., Ho, C. -. M. Electrokinetics in microdevices for biotechnology applications. IEEE/ASME Trans Mechatron. 9 (2), 366-376 (2004).
- Qian, K., Wang, Y., Lei, Y., Yang, Q., Yao, C. An experimental and theoretical study on cell swelling for osmotic imbalance induced by electroporation. Bioelectrochemistry. 157, 108637 (2024).
- Fox, M. B., et al. Electroporation of cells in microfluidic devices: A review. Anal Bioanal Chem. 385 (3), 474-485 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır