A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخراج الفرمون الجنسي المتطاير ومقايسة الجذب الكيميائي في Caenorhabditis elegans
In This Article
Summary
يحدد هذا البروتوكول طرقا لاستخراج وقياس الاستجابات للفرمون الجنسي المتطاير في C. ايليجانس، مما يوفر أدوات لدراسة الاتصال الكيميائي ومسار الملاحة.
Abstract
يعد الاتصال الكيميائي أمرا حيويا في صحة الكائنات الحية والتكاثر والرفاهية العامة. يظل فهم المسارات الجزيئية والعمليات العصبية والحسابات التي تحكم هذه الإشارات مجالا نشطا للبحث. توفر الديدان الخيطية Caenorhabditis elegans نموذجا قويا لدراسة هذه العمليات لأنها تنتج فرمون جنسي متطاير. يتم تصنيع هذا الفرمون بواسطة الإناث البكر أو الخنثى المستنفدة للحيوانات المنوية ويعمل كعامل جذب للذكور.
يصف هذا البروتوكول طريقة مفصلة لعزل الفرمون الجنسي المتطاير عن عدة C. ايليجانس سلالات (WT سلالة N2 و daf-22 و fog-2) و C. remanei. نقدم أيضا بروتوكولا لتحديد استجابة الانجذاب الكيميائي للذكور للفرمون الجنسي المتطاير. يستخدم تحليلنا قياسات مثل مؤشر الانجذاب الكيميائي (CI) ، ووقت الوصول (ATTA) ، ومخطط المسار لمقارنة استجابات الذكور في ظل ظروف مختلفة بدقة. تسمح هذه الطريقة بإجراء مقارنات قوية بين الذكور من خلفيات وراثية مختلفة أو مراحل النمو. علاوة على ذلك ، فإن الإعداد التجريبي الموضح هنا قابل للتكيف مع التحقيق في مواد كيميائية أخرى للجذب الكيميائي.
Introduction
يعد التفاعل بين الاتصال الكيميائي والنجاح الإنجابي مبدأ أساسيا في جميع أنحاء مملكة1،2،3،4،5،6،7،8،9،10. تؤدي الفيرومونات الجنسية إلى مجموعة واسعة من السلوكيات ثنائية الشكل جنسيا الضرورية لتحديد مكان الأصدقاء ، وتنسيق الخطوات المتبعة في العثور على شريك وجذبه ، وفي النهاية تعزيز تكاثر الأنواع11،12،13،14،15،16،17. تم إحراز تقدم كبير في فهم إشارات الفرمون ، لكن الآليات الجزيئية والدوائر العصبية والعمليات الحسابية التي تحكم هذه التفاعلات غالبا ما تظل غير محددة بشكل كامل18،19،20،21،22،23،24،25،26.
توفر الديدان الخيطية Caenorhabditis elegans نموذجا قويا لتشريح هذه الأسئلة. والجدير بالذكر أن C. ايليجانس يعرض استراتيجية إنجابية غير عادية - يمكن للخنثى أن تخصب ذاتيا ولكن أيضا تتفوق على الذكور27،28،29،30،31،32،33. تتطلب هذه المرونة نظام اتصال قوي للإشارة إلى الحالة الإنجابية. C. ايليجانس تشتهر بالفيرومونات القابلة للذوبان في الماء ، الأسكاروسيدات ، والتي تلعب أدوارا متنوعة في التطور والسلوك والتفاعلات الاجتماعية. كشفت الاكتشافات الحديثة النقاب عن فئة مميزة من الفيرومونات الجنسية المتطايرة التي تستخدمها الديدان الخيطية. يتم إنتاج هذه الفيرومونات على وجه التحديد بواسطة C. ايليجانس و C. remanei الإناث العذراء والخنثى المستنفدة للحيوانات المنوية ، وهي بمثابة عامل جذب للذكور البالغين29،34،35. يظهر هذا الجاذب إزدواج الشكل الجنسي الملحوظ في إنتاجه وتصوره. يتحكم الغدد التناسلية الجسدية الأنثوية في تخليق هذا الفرمون الجنسي المتطاير ، ويعكس الإنتاج ديناميكيا الحالة الإنجابية ، ويتوقف عند التزاوج ويستأنف بعد عدة ساعات29،34.
يوفر فهم التواصل الفرمي الجنسي للديدان الخيطية نظرة ثاقبة حول تطور أنظمة الاتصال الكيميائي ، والتفاعل بين الحالة الإنجابية والسلوك ، والآليات الكامنة وراء المعالجة العصبية ثنائية الشكل جنسيا24،26،36،37،38،39. تشير الدراسات إلى تورط الخلايا العصبية البرمائية AWA في الذكور على أنها حاسمة للكشف عن الفرمون ، حيث يلعب المستقبل المقترن ببروتين G SRD-1 دورا رئيسيا في اكتشاف الفرمون عند الذكور24. C. ايليجانس مناسب تماما لدراسة الاتصالات الكيميائية الحيوانية ، وخاصة إشارات الفرمون الجنسي ، نظرا لاعتماده على نظام حاسة الشم للبحث عن الشريك. في حين أن الكثير معروف عن إشارات الأسكاروسيد ، فإن نظام الفرمون الجنسي المتطاير يوفر فرصا فريدة للمقارنة25،26،36،40،41،42،43،44،45،46،47،48،49،50،
51،52،53،54،55،56،57. علاوة على ذلك ، C. ايليجانس هو كائن حي نموذجي وراثي قوي بسبب جينومه المتسلسل بالكامل ، ونسبه الخلوي المحدد بوضوح ، والطفرات الشمية المميزة جيدا.
ومع ذلك ، فإن الدوائر العصبية الكاملة التي تنطوي عليها معالجة هذا الفرمون ، والحسابات التي تترجم تصوره إلى سلوكيات مستهدفة للبحث عن الشريك ، وتنظيم التخليق الحيوي لا يزال يتعين توضيحها بالكامل. تعد التحقيقات الإضافية في هذه العمليات أمرا بالغ الأهمية لفهم الآليات المتنوعة التي تحكم التواصل الحيواني والسلوكيات الإنجابية. يعد تحديد الجينات الرئيسية المشاركة في تخليق الفرمون وإفرازه وإدراكه بالكشف عن لاعبين جزيئيين جدد في التواصل الحيواني. توفر المقايسات الموصوفة هنا أساسا لمعالجة هذه الأسئلة.
Protocol
1. استخراج الفرمون الجنسي الخام من الإناث والخنثى
- بروتوكول مزامنة C. ايليجانس
- تحضير الإناث البالغات أو الخنثى
- راقب لوحات الاستزراع يوميا حتى يوجد عدد كبير من الإناث / الخنثى البالغات ويستنفد مصدر غذاء OP50. باستخدام fog-2 C. ايليجانس و WT C. remanei الإناث لاستخراج الفرمون الجنسي الخام ، قم بإعداد بيض متزامن من الإناث المتزاوجة.
ملاحظة: في هذا البروتوكول ، C. ايليجانس الضباب -2 المتحولة XX ، التي لا تنتج المنوية الذاتية ، يشار إليها باسم C. ايليجانس الإناث.
- راقب لوحات الاستزراع يوميا حتى يوجد عدد كبير من الإناث / الخنثى البالغات ويستنفد مصدر غذاء OP50. باستخدام fog-2 C. ايليجانس و WT C. remanei الإناث لاستخراج الفرمون الجنسي الخام ، قم بإعداد بيض متزامن من الإناث المتزاوجة.
- غسل الديدان وتكويرها
- اغسل الديدان البالغة من لوحة مختلطة باستخدام عازلة M9. اجمع معلق الدودة في أنبوب طرد مركزي دقيق سعة 1.5 مل. جهاز طرد مركزي عند 1,500 × جم لمدة 0.5-1 دقيقة لحبيبات الديدان.
ملاحظة: التنظيف المسبق للتلوث الشديد (اختياري): دع الديدان تستقر في الأنبوب إذا كانت ملوثة بشدة. قم بإخراج المادة الطافية لإزالة البكتيريا وكرر ذلك حتى يصبح المادة الطافية صافية.
- اغسل الديدان البالغة من لوحة مختلطة باستخدام عازلة M9. اجمع معلق الدودة في أنبوب طرد مركزي دقيق سعة 1.5 مل. جهاز طرد مركزي عند 1,500 × جم لمدة 0.5-1 دقيقة لحبيبات الديدان.
- تبيض
- أضف 200 ميكرولتر من المخزن المؤقت M9 إلى حبيبات الدودة. قم بإعداد مخزن التحلل عن طريق خلط المبيض المنزلي و 1 M هيدروكسيد الصوديوم بنسبة 1: 1. أضف 500 ميكرولتر من هذا المخزن المؤقت للتحلل إلى الخليط ، والدوامة لمدة 10 ثوان ، ثم توقف مؤقتا لمراقبة حالة التحلل تحت مجهر تشريح. كرر هذه العملية المكونة من دوامات 10 ثوان متبوعة بالملاحظة حتى يتم تحلل الديدان البالغة بالكامل.
- وقف التبييض والتكوير للأجنة
- عندما يتم تحلل الديدان البالغة إلى شظايا صغيرة (ولكن لا تذوب تماما) ، أضف على الفور 500 ميكرولتر من المخزن المؤقت M9 لإبطاء التفاعل. جهاز طرد مركزي عند 15,000 × جم لمدة 30-60 ثانية لحبيبات الأجنة.
ملاحظة: يمكن أن يؤدي التحلل المفرط إلى إتلاف الأجنة. أوقف التفاعل عندما تتحلل أجسام الديدان البالغة إلى أجزاء صغيرة. يستمر التحلل أثناء خطوات الطرد المركزي والغسيل حتى تتم إزالة كل المخزن المؤقت للتحلل.
- عندما يتم تحلل الديدان البالغة إلى شظايا صغيرة (ولكن لا تذوب تماما) ، أضف على الفور 500 ميكرولتر من المخزن المؤقت M9 لإبطاء التفاعل. جهاز طرد مركزي عند 15,000 × جم لمدة 30-60 ثانية لحبيبات الأجنة.
- اغسل الأجنة 5 مرات باستخدام 1 مل من المخزن المؤقت M9 ، مع الطرد المركزي عند 15,000 × جم لمدة 30-60 ثانية بعد كل غسلة. قم بإزالة المادة الطافية بعد الطرد المركزي.
- تزامن
- أعد تعليق الأجنة في 800 ميكرولتر من المخزن المؤقت M9 في أنبوب طرد مركزي دقيق سعة 1.5 مل. قم بتدوير الأنبوب عند 20 درجة مئوية لمدة 12-15 ساعة لتفقيس L1 وتوقف الديدان في المرحلة L1 بسبب عدم وجود إمدادات غذائية. إطلاق الديدان واستزراعها عند 20 درجة مئوية لمدة 3 أيام حتى تصل إلى المرحلة L4.
- تحضير الإناث البالغات أو الخنثى
2. استخراج الفرمون الجنسي الخام من الإناث البكر البالغة من العمر يوم واحد (الشكل 1 أ)
ملاحظة: نعتمد بروتوكولا تم إنشاؤهمسبقا 24 لاستخراج الفيرومونات الجنسية من الإناث الطافرة البكر البالغة من العمر يوما واحدا (تأنيث السلالة الجرثومة) من C. ايليجانس و WT الإناث من C. remanei.
- تحضير الإناث البالغات
- حدد وعزل ما يقرب من 200 أنثى من مرحلة L4 -2 قبل يوم واحد من استخراج الفرمون. لضمان جمع الإناث البكر فقط ، افصل إناث L4 fog-2 بعناية حسب الجنس ووزعها على ثلاث ألواح منفصلة مقاس 6 سم OP50 NGM. ضع كمية صغيرة من بكتيريا OP50 في وسط كل لوحة.
ملاحظة: قم بتوزيع 200 دودة أنثوية L4 عبر ثلاث لوحات منفصلة لتجنب خطر إدخال دودة ذكر عن طريق الخطأ إلى اللوحة. إذا تم قطف ذكر ، فمن المحتمل أن يتزاوج مع العديد من الإناث ، مما يؤدي إلى تخصيب معظم الإناث في اليوم التالي عندما يصبحن بالغين. لا تنبعث من الإناث المخصبة فيرومونات جنسية متطايرة حتى يتم استنفاد المنوية ، مما يؤثر على نتائج الاستخراج. يقيد مصدر الغذاء المحدود الخنثى في منطقة أصغر في وسط الطبق ، مما يقلل من فرصة الهروب من الطبق خلال فترة العزل.
- حدد وعزل ما يقرب من 200 أنثى من مرحلة L4 -2 قبل يوم واحد من استخراج الفرمون. لضمان جمع الإناث البكر فقط ، افصل إناث L4 fog-2 بعناية حسب الجنس ووزعها على ثلاث ألواح منفصلة مقاس 6 سم OP50 NGM. ضع كمية صغيرة من بكتيريا OP50 في وسط كل لوحة.
- عملية الاستخراج
- في يوم الاستخراج (اليوم 1 من النضج الإنجابي ، بعد 3 أيام من إطلاق الديدان من اعتقال L1) ، قم باختيار وعزل 100 أنثى عذراء تبلغ من العمر يوم واحد من الضباب 2 في أنبوب طرد مركزي دقيق يحتوي على 1 مل من المخزن المؤقت M9. اغسل الإناث 5x باستخدام المخزن المؤقت M9 لتقليل التلوث البكتيري واحتضانها في 100 ميكرولتر من المخزن المؤقت M9 لمدة 6 ساعات عند 20 درجة مئوية للسماح بإنتاج الفرمون وتراكمه في الوسائط.
- قم بإجراء عملية استخراج مماثلة ل C. remanei الإناث ، باستخدام 15-20 إناث فقط من مرحلة L4 معزولة في اليوم السابق للاستخراج إلى ثلاث لوحات ، وفي اليوم التالي ، احتضان خمس إناث عذراء في 100 ميكرولتر من المخزن المؤقت M9 لمدة 6 ساعات عند 25 درجة مئوية (درجة حرارة النمو المثلى ل C. remanei)58.
ملاحظة: تنتج C. remanei الإناث كمية أكبر من الفيرومونات الجنسية المتطايرة مقارنة ب C. ايليجانس الإناث. لذلك ، يكفي خمس إناث فقط لاستخراج 100 ميكرولتر من الفرمون الجنسي المتطاير الخام.
- خزن
- عينات أجهزة الطرد المركزي عند 15,000 × جم لمدة 30-60 ثانية لحبيبات الديدان. انقل المادة الطافية (التي تحتوي على الفيرومونات) بعناية إلى أنبوب نظيف وتخلص من الأنبوب الذي يحتوي على حبيبات الدودة. قم بتخزين المادة الطافية المعزولة لمقايسات الجذب الكيميائي اللاحقة.
ملاحظة: يمكن تخزين مستخلص الفرمون الجنسي الخام المتطاير لمدة عام واحد على الأقل عند -80 درجة مئوية في أنبوب طرد مركزي دقيق ملفوف بالبارافيلم لتقليل التبخر.
- عينات أجهزة الطرد المركزي عند 15,000 × جم لمدة 30-60 ثانية لحبيبات الديدان. انقل المادة الطافية (التي تحتوي على الفيرومونات) بعناية إلى أنبوب نظيف وتخلص من الأنبوب الذي يحتوي على حبيبات الدودة. قم بتخزين المادة الطافية المعزولة لمقايسات الجذب الكيميائي اللاحقة.
- مراقبة الجودة
- قبل استخدام المستخلص, إجراء اختبار مراقبة الجودة باستخدام N2 الذكور أو له 5 الذكور للتحقق من جاذبيتها الكيميائية (انظر القسم 4).
3. كمية كبيرة من استخراج الفرمون الجنسي الخام من خنثى عذراء عمرها 6 أيام (الشكل 1 أ)
- استزراع الدودة
- للحصول على ما يقرب من 20 مل من الفرمون الجنسي الخام C. ايليجانس ، قم بمزامنة عشرين لوحا من NGM مقاس 10 سم تحتوي على ديدان C . ايليجانس (إما N2 أو daf-22 متحولة) باستخدام بروتوكول التبييض المذكور أعلاه ثم اغسلها 5x باستخدام المخزن المؤقت M9.
ملاحظة: هذه العملية تحضر ما يكفي من الأجنة لاستخراج الفرمون. N2: WT C. ايليجانس القياسية السلالة التي تنتج كلا من فيرومونات الأسكاروسيد القابلة للذوبان في الماء والفيرومونات الجنسية المتطايرة غير الأسكاروزيد. daf-22 متحول: متحولة تفتقر إلى القدرة على إنتاج العديد من فيرومونات الأسكاروسيد ، مما يجعلها مفيدة في دراسة الفيرومونات الجنسية المتطايرة غير الأسكاروسيدية بمعزل عن غيرها. - لمزامنة الديدان في المرحلة L1 ، قم بتدوير الأجنة في المخزن المؤقت M9 لمدة 12-15 ساعة لإيقاف النمو. انقل ديدان L1 الموقفة إلى صفائح استزراع NGM مقاس 10 سم بذرة بكتيريا OP50 للنمو والتطور.
- لتقليل وجود الذكور على صفائح خنثى ، تحقق من الألواح بعد يومين من إطلاق الدودة ، في المرحلة L4 ، وقم بإزالة أي ذكور ملحوظة (نادرة جدا).
- بعد ثلاثة أيام من التطور ، ابحث عن مظهر الأجنة التي تشير إلى أن الديدان أصبحت بالغة ناضجة تكاثريا.
ملاحظة: إناثالضباب -2 الطافرة من C. ايليجانس و WT الإناث من C. remanei غير مناسبة لاستخراج الفرمون الجنسي المتطاير بالجملة. ضباب 2 المتحولة C. ايليجانس و C. remanei لديها نسبة عالية من الذكور في سكانها ، والذكور يتزاوجون باستمرار مع الإناث. لا تنتج الإناث المخصبة فيرومونات جنسية متطايرة. وجود الذكور يعقد استخراج هذه المركبات.
- للحصول على ما يقرب من 20 مل من الفرمون الجنسي الخام C. ايليجانس ، قم بمزامنة عشرين لوحا من NGM مقاس 10 سم تحتوي على ديدان C . ايليجانس (إما N2 أو daf-22 متحولة) باستخدام بروتوكول التبييض المذكور أعلاه ثم اغسلها 5x باستخدام المخزن المؤقت M9.
- غسل الديدان وفصل الأجنة
- اغسل الأجنة بشكل متكرر باستخدام المخزن المؤقت M9 واتركها تستقر (1 جم ترسيب) حتى يصبح معظم البالغين في قاع الأنبوب. كرر 5-7x. اسمح لأنابيب الطرد المركزي الدقيقة بالاستقرار دون إزعاج في رف لعدة دقائق لتسهيل ترسيب الديدان البالغة وتمكين فصل الديدان البالغة عن الأجنة ، والتي تظل معلقة في المادة الطافية.
- قم بتقطيع البالغين المنفصلين ونقلهم إلى ألواح NGM الجديدة المصنفة OP50.
- كرر عملية الغسيل هذه لمدة 5-6 أيام لاستنفاد المنوية الذاتية.
ملاحظة: لاستخراج الفيرومونات الجنسية المتطايرة ، استخدم الخنثى التي يبلغ عمرها 5-6 أيام. يضمن هذا التوقيت أن المنوية الذاتية من المحتمل أن تكون مستنفدة ، لأن الخنثى ذات المنوية الذاتية المتاحة لا تنتج فيرومونات جنسية متطايرة. تشير العديد من الأجنة الميتة أو غير المفرغة على اللوحة بحلول اليوم 5 أو 6 إلى الوقت المناسب لبدء استخراج الفرمون.
- استخراج الفرمون الجنسي
- استخرج الفرمون الجنسي كما هو موضح في القسم 1 مع التعديلات.
- بدلا من إضافة 100 C. ايليجانس إناث لكل 100 ميكرولتر ، أضف المخزن المؤقت M9 بناء على حجم حبيبات الدودة النهائي. أضف 1 مل من المخزن المؤقت M9 لكل 50 ميكرولتر من الديدان المعبأة.
- مراقبة الجودة والتجانس
- دفعات اختبار مراقبة الجودة من الفرمون المستخرج باستخدام مقايسة الجذب الكيميائي مع ذكور N2 أو من الذكور من 5 (انظر القسم 4).
- امزج جميع الدفعات لإنشاء فرمون جنسي متطاير خام متجانس للتجارب التي تحتاج إلى كمية كبيرة من الفرمون ، مثل الفحص أو تجارب الموائع الدقيقة. قم بتخزين مستخلص الفرمون الجنسي الخام لمدة عام واحد على الأقل عند -80 درجة مئوية في أنابيب سعة 50 مل ملفوفة بالبارافيلم لتقليل التبخر.
- طريقة المعايرة بالتحليل الكيميائي القائمة على الفحص الكيميائي لتوحيد مستخلص الفرمون الجنسي الخام
- قم بإجراء فحص المعايرة بالتحليل الحجمي عن طريق اختبار التخفيفات التسلسلية لكل مستخلص فرمون على كل من WT N2 و him-5 ذكور C. ايليجانس. تحديد أعلى تخفيف (أقل تركيز) يثير باستمرار استجابة قوية وقابلة للتكرار للانجذاب الكيميائي في سلالات التحكم.
- قم بإعداد سلسلة من التخفيفات من كل مستخلص خام (على سبيل المثال ، 1: 2 ، 1: 4 ، 1: 8 ، إلخ) في المخزن المؤقت M9.
- فحوصات الانجذاب الكيميائي
- قم بإجراء فحوصات الانجذاب الكيميائي الموحدة (انظر القسم 4) باستخدام كل تخفيف على السلالة المرجعية للذكور. قم بإجراء ثلاث نسخ مكررة لضمان قابلية التكرار. قارن التخفيفات المثلى عبر دفعات الاستخراج المختلفة لتقييم الاتساق في تركيز الفرمون.
ملاحظة: هذا يحدد نقطة مرجعية لتقييم النشاط الحيوي لكل مستخلص. في مقايسة الجذب الكيميائي للفرمون الجنسي القياسي، سيتم استخدام المستخلصات الأصلية غير المخففة للتجارب اللاحقة، حيث تعمل المعايرة كخطوة لمراقبة الجودة لضمان نشاط الفرمون المتسق بين الدفعات. يمكن تعديل سلسلة التخفيف بناء على الاحتياجات التجريبية المحددة. بالنظر إلى أن بروتوكول الاستخراج القياسي ينتج باستمرار مستخلصات الفرمون الخام المشبعة ، فقد لا يكون اختبار المعايرة لتوحيد المستخلص ضروريا لمعظم التجارب. يوصى باستخدام نفس الدفعة من الفرمون الجنسي الخام خلال مجموعة من التجارب ذات الصلة للحفاظ على الاتساق وتقليل التباين في نشاط الفرمون.
- قم بإجراء فحوصات الانجذاب الكيميائي الموحدة (انظر القسم 4) باستخدام كل تخفيف على السلالة المرجعية للذكور. قم بإجراء ثلاث نسخ مكررة لضمان قابلية التكرار. قارن التخفيفات المثلى عبر دفعات الاستخراج المختلفة لتقييم الاتساق في تركيز الفرمون.
4. مقايسة الجذب الكيميائي الفرمون الجنسي المتطاير
ملاحظة: تم تكييف مقايسة الجذب الكيميائي للفرمون الجنسي المتطاير من الأساليب المعمول بها سابقا المستخدمة في دراسات الجذب الكيميائيالأخرى 24،29،59،60،61. تم تنفيذ هذه التعديلات لتحسين حساسية الفحص وخصوصيته للكشف عن الاستجابات للفيرومونات الجنسية المتطايرة. يعزز هذا النهج المخصص قابلية تطبيق الفحص على احتياجات بحثية محددة.
- راقب لوحات الاستزراع يوميا حتى تكثر الإناث / الخنثى البالغات. تؤثر صحة الديدان على استجابتها للفرمون الجنسي.
- تحضيره - 5 ذكور
- استخدم بروتوكول التبييض القياسي لمزامنة الديدان HIM-5 . بعد المزامنة ، اغسل الديدان 5x باستخدام المخزن المؤقت M9. عزل الذكور L4 في اليوم السابق للفحص ؛ بعد ذلك ، انقل الديدان الذكور البالغة من العمر يوما واحدا من صفائحها المصنفة واشطفها في مخزن M9 قبل الفحص. ضعها على ألواح NGM غير مصنفة قبل الفحص للقضاء على البكتيريا المتبقية ومنع التداخل من الطعام أثناء الفحص.
ملاحظة: لا تجويع الديدان لأكثر من ساعة قبل الفحص ، لأن هذا يمكن أن يغير حالتها الداخلية ويؤثر على نتائج مقايسة الجذب الكيميائي للفرمون الجنسي. لذلك ، إذا كنت تنوي إجراء أكثر من 10 فحوصات في يوم واحد ، فاستبدل عينات الدودة كل ساعة. علاوة على ذلك ، قم بالتبديل بين اختبار تجريبي واحد ومقايسة تحكم واحدة بشكل متكرر.
- استخدم بروتوكول التبييض القياسي لمزامنة الديدان HIM-5 . بعد المزامنة ، اغسل الديدان 5x باستخدام المخزن المؤقت M9. عزل الذكور L4 في اليوم السابق للفحص ؛ بعد ذلك ، انقل الديدان الذكور البالغة من العمر يوما واحدا من صفائحها المصنفة واشطفها في مخزن M9 قبل الفحص. ضعها على ألواح NGM غير مصنفة قبل الفحص للقضاء على البكتيريا المتبقية ومنع التداخل من الطعام أثناء الفحص.
- تحضير لوحات فحص أجار الجذب الكيميائي
- قم بإعداد لوحات فحص الجذب الكيميائي مع 1.5٪ أجار ، و 25 ملي كلوريد الصوديوم ، و 1.5 ملي مولار قاعدة تريس ، و 3.5 ملي مولار Tris-Cl كما هو موضح في الأدبيات ذات الصلة24.
- سخني الأجار في محلول الجذب الكيميائي باستخدام الميكروويف حتى يذوب تماما. اترك المحلول يبرد في درجة حرارة الغرفة لمدة 5 دقائق.
- استخدم مساعد الماصة لتوزيع محلول أجار الجذب الكيميائي بالتساوي في أطباق بتري: صب 30 مل في كل طبق 10 سم و 20 مل في كل طبق 6 سم.
- بعد صب محلول أجار الجذب الكيميائي في أطباق بتري ، اترك الأغطية مفتوحة في منطقة نظيفة لمدة 40 دقيقة على الأقل للسماح لسطح الأجار بالجفاف قليلا. بمجرد أن يجف السطح بشكل مناسب ، أغلق الأغطية.
ملاحظة: قد يختلف وقت التجفيف هذا حسب الرطوبة ودرجة حرارة بيئة المختبر.
- تخزين الألواح وإعداد الفحص المسبق
- قم بتعبئة وتخزين لوحات الفحص المحضرة في غرفة باردة لمدة تصل إلى 1 أسبوع. قبل الاستخدام ، قم بإزالة الأطباق من التخزين البارد واتركها تتأقلم مع درجة حرارة الغرفة لأكثر من ساعة. افتح الأغطية للسماح لأي رطوبة متبقية بالتبخر من الأجار قبل 20 دقيقة من الفحص في منطقة نظيفة ، مع التأكد من عدم وجود ماء واضح على السطح قبل إجراء الفحص.
- التصميم التجريبي ومقايسة الجذب الكيميائي
- لإجراء مقايسة الجذب الكيميائي ، ضع علامة على ثلاث نقاط مميزة على الغطاء والجانب السفلي من طبق بتري أو استخدم قالبا مطبوعا على ورق بلاستيكي شفاف يوضع تحت الطبق أو مرفقا بمجهر التشريح. تتضمن هذه العلامات نقطة وسطى (•) كنقطة انطلاق للديدان ، وعلامة زائد (+) للبقعة التجريبية (2 ميكرولتر من الفرمون الجنسي على الغطاء و 2 ميكرولتر من 1 M أزيد الصوديوم على اللوحة) ، وعلامة ناقص (-) لبقعة التحكم (2 ميكرولتر من M9 عازلة على الغطاء و 2 ميكرولتر من 1 M أزيد الصوديوم) (الشكل 2 أ). اضبط المسافة بين هذه العلامات وفقا لحجم الطبق والاحتياجات التجريبية المحددة. عادة ، بالنسبة لأطباق بتري 6 سم ، قم بتعيين مسافة ثابتة قدرها 1.5 سم من نقطة البداية إلى كل مادة اختبار لاختبارات التحكم الإيجابية.
- الخطوات التفصيلية لإجراء الفحص (الشكل 2)
- ضع 2 ميكرولتر من أزيد الصوديوم 1 M على كل بقعة تجريبية وتحكم على اللوحة.
- اختر 20 ديدة ذكور صحية وحركة بحرية باستخدام منتقي الديدان. أطلق في وقت واحد 20 ديدة ذكر عند نقطة البداية تحت مجهر تشريح.
- أضف بسرعة 2 ميكرولتر من الفرمون الجنسي و 2 ميكرولتر من المخزن المؤقت M9 إلى النقاط التجريبية والتحكم على الغطاء ، على التوالي.
- أغلق الغطاء برفق وضع لوحة الفحص في منطقة هادئة ومستقرة لدرجة الحرارة بجوار المجهر.
- بعد 30 دقيقة ، قم بتسجيل الاختبار عن طريق حساب عدد الديدان في كل بقعة.
ملاحظة: يجب ألا تتجاوز عملية قطف 20 دودة 1-2 دقيقة لمنع الديدان المقطوفة مبكرا من الجفاف وتصبح غير صحية ، مما قد يؤثر على النتائج. يجب أن تستغرق العملية برمتها من قطف الذكور إلى إغلاق الغطاء ما بين 2 و 5 دقائق.
- فحص التحكم الإيجابي
- اختبر ذكور الديدان على محلول مخفف بمقدار 1,000 ضعف من ثنائي الأسيتيل (مذاب في 10٪ إيثانول و 90٪ مخزن مؤقت M9) للتأكد من استجابتها للانجذاب الكيميائي. تقييم نتائج اختبار الجذب الكيميائي بعد 30 دقيقة من بدء الاختبار. تسجل الديدان المشلولة في الأماكن المحددة بناء على موقعها: "C" لأولئك الموجودين في نقطة التحكم ، و "E" لأولئك الموجودين في مكان التجربة. سجل الديدان في أي من المكانين ك "N" (الشكل 2 ج).
- لحساب مؤشر الجذب الكيميائي (CI) ، استخدم الصيغة التالية:
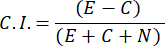
- حدد فقط عينات الذكور التي تحتوي على مؤشر الانجذاب الكيميائي ≥ 0.4 (CI ، انظر الشكل 2C). استخدم الذكر من نفس الدفعة لاختبار الفرمون الجنسي اللاحق.
ملاحظة: قم بإجراء ثلاثة فحوصات منفصلة ، يتضمن كل منها 20 دودة ، لضمان اتساق وموثوقية النتائج التجريبية. عادة ما تكون ثلاثة فحوصات كافية لاستنتاج الاتساق.
5. إرشادات التوقيت والتسجيل لمقايسة الجذب الكيميائي
- قم بتقييم استجابة الجذب الكيميائي للديدان بناء على مواقعها النهائية. سجل عدد الديدان في كل نقطة في ختام الفحص ، عادة بعد 30 دقيقة من بدايته.
ملاحظة: يؤدي استخدام أزيد الصوديوم في التجارب ونقاط التحكم إلى شل الديدان القادمة ، مما يسهل التسجيل بدقة. معظم ذكور WT N2 و him-5 قادرون على تحديد مصدر الفرمون في غضون 6-8 دقائق في صفيحة 6 سم مع إعداد مسافة 1.5 سم. - لالتقاط العيوب في كفاءة الانجذاب الكيميائي ، خاصة للكشف عن العيوب الدقيقة ، ضع في اعتبارك مراقبة الفحص على فترات منتظمة من 3-5 دقائق.
ملاحظة: تسمح هذه الملاحظة المتكررة بتوثيق الأوقات التي تصل فيها الديدان إلى مواقع الاختبار. يمكن أن يكشف هذا التتبع التفصيلي عن الحالات التي تظهر فيها الديدان كفاءة منخفضة في الانجذاب الكيميائي ولكنها لا تزال قادرة على الوصول إلى مكان الاختبار داخل نافذة الفحص.
6. التعديلات الاختيارية
- للحصول على تقييم محسن للانجذاب الكيميائي ، استخدم كاميرا موضوعة فوق اللوحة لتسجيل مسارات الديدان في جميع أنحاء الفحص.
ملاحظة: يتيح هذا التعديل تحليلا شاملا لأنماط حركتهم ، مما يوفر نظرة أعمق على سلوك الجذب الكيميائي ومساره (الشكل 3).
7. تحليل البيانات
- تسجيل وحساب مؤشر الجذب الكيميائي (CI)
- اتبع الخطوتين 4.7.1 و 4.7.2.
- مؤامرة وقت الوصول
- للحصول على تحليل أكثر شمولا لمقايسات الجذب الكيميائي ، ضع في اعتبارك مراقبة الفحص على فترات 3-5 دقائق أو استخدام كاميرا موضوعة فوق اللوحة لتسجيل مسارات الديدان في جميع أنحاء الفحص.
ملاحظة: لا تسمح هذه الأساليب بتسجيل أوقات وصول الديدان إلى مواقع التصميم فحسب ، بل تسمح أيضا بمقارنة متوسط أوقات الوصول وتحليل توزيع هذه الأوقات.
- للحصول على تحليل أكثر شمولا لمقايسات الجذب الكيميائي ، ضع في اعتبارك مراقبة الفحص على فترات 3-5 دقائق أو استخدام كاميرا موضوعة فوق اللوحة لتسجيل مسارات الديدان في جميع أنحاء الفحص.
- تحليل المسار المستند إلى الفيديو وتصور البيانات
ملاحظة: لتحليل أنماط حركة C. elegans أثناء فحوصات الجذب الكيميائي ، قم بتسجيل المسارات واستخراجها (انظر جدول المواد) ومزيد من التحليل (الشكل 3).- قم بإعداد نظام التسجيل.
- ابدأ تسجيلا جديدا وقم بالوصول إلى نافذة إعدادات التسجيل .
- حدد معلمات التسجيل المطلوبة:
- بادئة الملف: اختر اسما وصفيا لملفات الفيديو (على سبيل المثال، "experiment1_").
- معدل الإطارات (FPS): حدد الإطارات المناسبة في الثانية لالتقاط حركة الدودة (على سبيل المثال ، 7.5 إطارا في الثانية للديدان على لوحة أجار و 30 إطارا في الثانية للديدان السباحة ).
- المدة: اضبط طول التسجيل بالثواني (على سبيل المثال، 1,800 ثانية [30 دقيقة] لمقايسة الجذب الكيميائي بالجملة).
- تحسين جودة الصورة: اضبط شدة الإضاءة للتأكد من أن الديدان مرئية بوضوح على الخلفية وضبط التركيز بدقة للحصول على صورة حادة للديدان.
- لتحضير لوحة الفحص ، قم أولا بتوزيع محلول التحكم على مكان التحكم المخصص. بعد ذلك ، التقط الدودة (الدودان) بعناية وحررها برفق في وسط اللوحة. بمجرد أن تستقر الديدان (الدودان) ، ضع محلول الفرمون الجنسي على المكان التجريبي المحدد.
- وضع اللوحة: ضع اللوحة التي تحتوي على الديدان بحذر في وسط حقل التسجيل لزيادة مساحة الالتقاط.
- لتقليل الضغط على الديدان أثناء فحوصات الانجذاب الكيميائي ، ضع في اعتبارك الطريقتين التاليتين.
- بالنسبة لمقايسة الدودة المفردة ، ضع الدودة على لوحة الفحص واتركها تتأقلم لمدة 5 دقائق قبل إدخال محلول الفرمون الجنسي على المسافة المحددة (الموضع الذي يعتمد على الموقع الحالي للدودة).
ملاحظة: يؤدي ذلك إلى تقليل المناولة وتوفير الوقت للدودة للتكيف مع بيئتها الجديدة. - مقايسة الجذب الكيميائي بالجملة: اسمح للديدان بالاستقرار والتشتت بشكل طبيعي على الطبق لمدة 5 دقائق. بعد فترة التأقلم هذه ، أدخل محلول الفرمون في الموضع الثابت المحدد. أثناء تحليل الفيديو بعد ، قم بقياس مسافة بدء كل دودة من الفرمون وقم بتجميعها وفقا لذلك لمزيد من التحليل.
- بالنسبة لمقايسة الدودة المفردة ، ضع الدودة على لوحة الفحص واتركها تتأقلم لمدة 5 دقائق قبل إدخال محلول الفرمون الجنسي على المسافة المحددة (الموضع الذي يعتمد على الموقع الحالي للدودة).
- إجراء تحليل الفيديو
- الاستيراد والإعداد: قم باستيراد الفيديو المسجل إلى البرنامج. تكوين معلومات التسلسل (مثل معدل الإطارات) ؛ حدد مقياس التصوير (وحدات البكسل لكل وحدة قياس).
- ضبط الصورة: لتحسين اكتشاف الفيروسات المتنقلة، اضبط عتبة الكشف حتى تحدد التسمية الخضراء بإحكام الديدان دون التقاط ضوضاء الخلفية أو البيانات الاصطناعية. بالإضافة إلى ذلك ، قم بتطبيق خوارزميات تنعيم الخلفية لتقليل الضوضاء والتفاوت في الصورة ، مما يعزز التباين بين الديدان والخلفية. جرب مستويات تنعيم مختلفة للعثور على التوازن الأمثل بين تقليل الضوضاء والحفاظ على تفاصيل الدودة.
ملاحظة: يجب أن تغطي العتبة المثالية معظم جسم كل دودة مع استبعاد العناصر الدخيلة. - تحسين معلمة الكشف: حدد متنقلة تمثيلية لإنشاء معلمات الكشف تلقائيا. تحقق من دقة الكشف عن طريق الفحص البصري من 5 إلى 10 إطارات عشوائية. إذا كان الاكتشاف غير مرض، فقم بتنقيح معلمات الكشف يدويا، وأعد النظر في إعدادات ضبط الصورة إذا لزم الأمر، وتابع التتبع بمجرد أن يصبح الاكتشاف موثوقا.
- التدقيق اللغوي وإصلاح مسارات التتبع: بعد اكتمال عملية التتبع الآلي ، قم بإجراء تدقيق يدوي للمسارات التي تم إنشاؤها. إذا تم العثور على تناقضات أثناء التدقيق اللغوي، فاستخدم وظيفة الإصلاح لتصحيح المسار وتنفيذ العمليات التالية: الانضمام: قم بتوصيل مقاطع المسار التي تم تعيين معرفات مختلفة لها بشكل غير صحيح ولكنها تنتمي إلى نفس الفرد. تقسيم: مقاطع مسار منفصلة تم تعيين نفس المعرف لها بشكل غير صحيح ولكنها تنتمي إلى أفراد مختلفين.
ملاحظة: الهدف هو ضمان تعيين كل معرف فريد (رقم) باستمرار لنفس الفرد طوال فترة التتبع بأكملها.
مثال: إذا تم تصنيف متنقل على أنه "3" لفترة ما ، ثم تم تصنيفه بشكل غير صحيح على أنه "7" لفترة لاحقة ، فإن وظيفة الإصلاح ستنضم إلى هذين الجزأين تحت المعرف "3". على العكس من ذلك ، إذا تم تصنيف دودتين على أنهما "12" لفترة ، فإن وظيفة الإصلاح ستقسم هذا الجزء إلى مسارين منفصلين ، لكل منهما معرف فريد. من خلال التدقيق اللغوي بعناية وتطبيق الإصلاحات اللازمة ، يمكن تحسين دقة وموثوقية بيانات التتبع بشكل كبير. - تصور النتائج وتصديرها: استخدم البرامج للتصور والتحليل الأساسي. تصدير البيانات كملفات CSV لمزيد من التحليل باستخدام الأدوات أو التعليمات البرمجية المفضلة. توفر هذه الطريقة رمزا أساسيا (انظر https://github.com/edmondztt/pheromone-traj-analysis.git) لتصور مسار حركة الدودة بناء على خمس معلمات رئيسية (الشكل 3). الوقت: تقدم المسار ، مرمز بالألوان للإشارة إلى مرور الوقت منذ بدء التجربة. المسافة إلى الفرمون: المسافة بين الدودة ومصدر الفرمون في كل نقطة زمنية. السرعة: سرعة الدودة في كل نقطة ، والتي تشير أيضا إلى أحداث الدوران والتوقف. الاستقامة: ما مدى استقامة مسار الدودة. صحة الاتجاه: ما مدى محاذاة حركة الدودة مع اتجاه هدف الفرمون؟ يوفر هذا الرمز تصورا أساسيا لفهم سلوك الدودة ويمكن تخصيصه وتوسيعه لتحليل أعمق.
ملاحظة: يوفر هذا النهج المتقدم بديلا شاملا لمؤشر الجذب الكيميائي التقليدي من خلال تفصيل مسار الملاحة الدودية استجابة للفيرومونات الجنسية. يسمح بفهم أنماط الحركة دون الاعتماد على نقاط النهاية التعسفية للملاحة وتحديد النافذة الزمنية ، مما يوفر رؤى أعمق حول الديناميكيات السلوكية للمقايس. تم حساب متوسط البيانات على 20 إطارا ، والتي يمكن تعديلها بناء على الاحتياجات التجريبية المحددة ، لتصفية الحركة الناتجة عن التواء الجسم.
النتائج
تحليل المسار لإدراك الفرمون الجنسي المتطاير سلالة معيبة في مقايسة الجذب الكيميائي
يميز اختبار الجذب الكيميائي هذا بشكل موثوق بين السلالات البرية والمتحولة من C. ايليجانس في استجابتها للفيرومونات الجنسية المتطايرة. تظهر التجارب الناجحة معه - 5 ذكور ?...
Discussion
يوفر هذا البروتوكول منهجية قوية لاستخراج الفيرومونات الجنسية المتطايرة من C. ايليجانس، إلى جانب إنشاء مقايسة قوية للجذب الكيميائي لقياس استجابات الجذب الكيميائي للذكور. يمكن العثور على معلومات إضافية في دليل مستخدم WormLab (انظر جدول المواد) ؛ للحصول على رمز ...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
نحن ممتنون للدكتور Tingtao Zhou لتصميم وكتابة الكود لتصورات المسار المستخدمة في تحليلنا. تم دعم هذا العمل من خلال التمويل: R01 NS113119 (PWS) ، وزمالة Chen لمرحلة ما بعد الدكتوراه ، ومعهد Tianqiao و Chrissy Chen لعلم الأعصاب.
Materials
| Name | Company | Catalog Number | Comments |
| 10 cm Petri dishes | Falcon | 25373-100 | Falcon bacteriological Petri dish 100 x 15 mm |
| 6 cm Petri dishes | Falcon | 25373-085 | Falcon bacteriological Petri dish 60 x 15 mm |
| C. remanei (EM464) | CGC | ||
| Centrifuge | Eppendorf | centrifuge 5418 | Any brand should work. |
| Chemoattraction assay plates | Homemade solution | N/A | 1.5% agar, 25 mM NaCl, 1.5 mM Tris-base, and 3.5 mM Tris-Cl |
| Cholesterol | Alfa Aesar | 57-88-5 | |
| Dissecting Microscope | Leica | LeicaMZ75 | Any brand should work. |
| E. Coli OP50 | CGC | ||
| Ethanol | Koptec | 64-17-5 | |
| fog-2(q71) (JK574) | CGC | ||
| him-5(e1490)(CB4088) | CGC | ||
| Household bleach | Clorox Germicidal bleach concentrated | Bleach | |
| M9 buffer | Homemade solution | N/A | 3 g KH2PO4, 11.3 g Na2HPO4.7H2O, 5 g NaCl, H2O to 1 L. Sterilize by autoclaving. Add 1 mL 1 M MgSO4 after cool down to room temperature. |
| Magnesium Sulfate, Anhydrous, Powder | Macron | M1063-500GM-EA | |
| Microwave | TOSHIBA | N/A | Any brand should work. |
| N2 | CGC | ||
| NaOH | Sigma-aldrich | S318-3 | 1 M |
| NGM plates solution | Homemade solution | N/A | 2.5 g Peptone, 18 g agar, 3 g NaCl, H2O to 1 L.Sterilize by autoclaving. Once the autoclave is done (2 h), wait until the temperature of the medium drops to 65 °C. Put on a hotplate at 65 °C and stir. Then add the following, waiting 5 min between each to avoid crystallization: 1 mL CaCl2 (1 M), 1 mL MgSO4 (1 M), 25 mL K3PO4 (1 M, pH=6), 1 mL Cholesterol ( 5 mg/mL in ethanol). |
| Parafilm | Bemis | 13-374-10 | Bemis Parafilm M Laboratory Wrapping Film |
| Peptone | VWR | 97063-324 | |
| Pipet- aid | Drummond Scientific | 4-000-100 | Any brand should work. |
| Plastic paper | Octago | Waterproof Screen Printing Inkjet Transparency Film | https://www.amazon.com/Octago-Waterproof-Transparency-Printing-Printers/dp/B08HJQWFGD |
| Potassium chloride | Sigma-aldrich | SLBP2366V | |
| Potassium phosphate | Spectrum | 7778-77-0 | |
| Pipette | Eppendorf | SKU: EPPR4331; MFG#: 2231300006 | 20 - 200 µL, 100 - 1000 µL, any brand should work. |
| Rotator | Labnet | SKU: LI-H5500 | Labnet H5500 Mini LabRoller with Dual Direction Rotator. Any brand should work. |
| Sodium chloride | VWR | 7647-14-5 | |
| sodium phosphate dibasic | Sigma-aldrich | SLCG3888 | |
| Tris-base | Sigma-aldrich | 77-86-1 | |
| Tris-Cl | Roche | 1185-53-1 | |
| Tryptone | VWR | 97063-390 | |
| Vortex | Scientific industries | Vortex-Genie 2 | Any brand should work. |
| WormLab system | MBF Bioscience | N/A | https://www.mbfbioscience.com/help/WormLab/Content/home.htm; https://www.mbfbioscience.com/products/wormlab/ |
| Wormpicker | Homemade | N/A | made with platinum and glass pipet tips |
References
- Audesirk, T. E. Chemoreception in Alphysia californica. Iii. Evidence for pheromones influencing reproductive behavior. Behav Biol. 20 (2), 235-243 (1977).
- Traynor, K. S., Le Conte, Y., Page, R. E. Queen and young larval pheromones impact nursing and reproductive physiology of honey bee (Apis mellifera) workers. Behav Ecol Sociobiol. 68 (12), 2059-2073 (2014).
- Cowley, J. J., Wise, D. R. Pheromones, growth and behaviour. Ciba Found Study Group. 35, 144-170 (1970).
- Epple, G. Pheromones in primate reproduction and social behavior. Adv Behav Biol. 11, 131-155 (1974).
- Levinson, H. Z. Possibilities of using insectistatics and pheromones in pest control. Naturwissenschaften. 62 (6), 272-282 (1975).
- Roelofs, W. Manipulating sex pheromones for insect suppression. Environ Lett. 8 (1), 41-59 (1975).
- Marchlewska-Koj, A. Pheromones and mammalian reproduction. Oxf Rev Reprod Biol. 6, 266-302 (1984).
- Keverne, E. B. Neuroendocrinology briefings 11: Pheromones and reproduction. J Neuroendocrinol. 12 (11), 1045-1046 (2000).
- Rekwot, P. I., Ogwu, D., Oyedipe, E. O., Sekoni, V. O. The role of pheromones and biostimulation in animal reproduction. Anim Reprod Sci. 65 (3-4), 157-170 (2001).
- Gomez-Diaz, C., Benton, R. The joy of sex pheromones. EMBO reports. 14 (10), 874-883 (2013).
- Shorey, H. H., Gaston, L. K., Jefferson, R. N. Insect sex pheromones. Adv Pest Control Res. 8, 57-126 (1968).
- Bruce, H. M. Pheromones and behavior in mice. Acta Neurol Psychiatr Belg. 69 (7), 529-538 (1969).
- Shorey, H. H., Bartell, R. J. Role of a volatile female sex pheromone in stimulating male courtship behaviour in Drosophila melanogaster. Anim Behav. 18 (1), 159-164 (1970).
- Bobadoye, B., et al. Evidence of aggregation-sex pheromone use by longhorned beetles (coleoptera: Cerambycidae) species native to Africa. Environ Entomol. 48 (1), 189-192 (2019).
- Saunders, J. R. Sex pheromones in bacteria. Nature. 275 (5682), 692-694 (1978).
- Schulz, S., Toft, S. Identification of a sex pheromone from a spider. Science. 260 (5114), 1635-1637 (1993).
- Finnegan, D. E., Chambers, J. Identification of the sex pheromone of the guernsey carpet beetle, Anthrenussarnicus mroczkowski (coleoptera: Dermestidae). J Chem Ecol. 19 (5), 971-983 (1993).
- Vaillancourt, L. J., Raudaskoski, M., Specht, C. A., Raper, C. A. Multiple genes encoding pheromones and a pheromone receptor define the b beta 1 mating-type specificity in Schizophyllum commune. Genetics. 146 (2), 541-551 (1997).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook : the online review of C. elegans biology. , 1-22 (2013).
- Sakai, N., et al. A sexually conditioned switch of chemosensory behavior in C. elegans. PLoS One. 8 (7), e68676 (2013).
- Sengupta, S., Smith, D. P., Mucignat-Caretta, C. How Drosophila detect volatile pheromones: signaling, circuits, and behavior. Neurobiology of chemical communication. , (2014).
- Zhang, Y. K., Reilly, D. K., Yu, J., Srinivasan, J., Schroeder, F. C. Photoaffinity probes for nematode pheromone receptor identification. Org Biomol Chem. 18 (1), 36-40 (2019).
- Aprison, E. Z., Ruvinsky, I. Dynamic regulation of adult-specific functions of the nervous system by signaling from the reproductive system. Curr Biol. 29 (23), 4116-4123.e3 (2019).
- Wan, X., et al. SRD-1 in AWA neurons is the receptor for female volatile sex pheromones in C. elegans males. EMBO Rep. 20 (3), e46288 (2019).
- Peckol, E. L., Troemel, E. R., Bargmann, C. I. Sensory experience and sensory activity regulate chemosensory receptor gene expression in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 98 (20), 11032-11038 (2001).
- Jang, H., et al. Neuromodulatory state and sex specify alternative behaviors through antagonistic synaptic pathways in. C. elegans. Neuron. 75 (4), 585-592 (2012).
- Liu, K. S., Sternberg, P. W. Sensory regulation of male mating behavior in Caenorhabditis elegans. Neuron. 14 (1), 79-89 (1995).
- Chasnov, J. R., Chow, K. L. Why are there males in the hermaphroditic species Caenorhabditis elegans. Genetics. 160 (3), 983-994 (2002).
- Chasnov, J. R., So, W. K., Chan, C. M., Chow, K. L. The species, sex, and stage specificity of a Caenorhabditis sex pheromone. Proc Natl Acad Sci U S A. 104 (16), 6730-6735 (2007).
- Susoy, V., et al. Natural sensory context drives diverse brain-wide activity during C. elegans mating. Cell. 184 (20), 5122-5137.e17 (2021).
- Barriere, A., Felix, M. A. High local genetic diversity and low outcrossing rate in Caenorhabditis elegans natural populations. Curr Biol. 15 (13), 1176-1184 (2005).
- Click, A., Savaliya, C. H., Kienle, S., Herrmann, M., Pires-Dasilva, A. Natural variation of outcrossing in the hermaphroditic nematode Pristionchus pacificus. BMC Evol Biol. 9, 75 (2009).
- Anderson, J. L., Morran, L. T., Phillips, P. C. Outcrossing and the maintenance of males within C. elegans populations. J Hered. 101 (suppl_1), S62-S74 (2010).
- Leighton, D. H., Choe, A., Wu, S. Y., Sternberg, P. W. Communication between oocytes and somatic cells regulates volatile pheromone production in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 111 (50), 17905-17910 (2014).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Fagan, K. A., et al. A single-neuron chemosensory switch determines the valence of a sexually dimorphic sensory behavior. Curr Biol. 28 (6), 902-914.e5 (2018).
- Lipton, J., Kleemann, G., Ghosh, R., Lints, R., Emmons, S. W. Mate searching in Caenorhabditis elegans: A genetic model for sex drive in a simple invertebrate. J Neurosci. 24 (34), 7427-7434 (2004).
- Frady, E. P., Palmer, C. R., Kristan, W. B. Sexual attraction: Sex-specific wiring of neural circuitry. Curr Biol. 22 (22), R953-R956 (2012).
- Liu, Q., et al. Two preputial gland-secreted pheromones evoke sexually dimorphic neural pathways in the mouse vomeronasal system. Front Cell Neurosci. 13, 455 (2019).
- Ludewig, A. H., et al. Pheromone sensing regulates Caenorhabditis elegans lifespan and stress resistance via the deacetylase sir-2.1. Proc Natl Acad Sci U S A. 110 (14), 5522-5527 (2013).
- Golden, J. W., Riddle, D. L. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Butcher, R. A., Fujita, M., Schroeder, F. C., Clardy, J. Small-molecule pheromones that control dauer development in Caenorhabditis elegans. Nat Chem Biol. 3 (7), 420-422 (2007).
- Jeong, P. Y., et al. Chemical structure and biological activity of the Caenorhabditis elegans dauer-inducing pheromone. Nature. 433 (7025), 541-545 (2005).
- Butcher, R. A., Ragains, J. R., Kim, E., Clardy, J. A potent dauer pheromone component in Caenorhabditis elegans that acts synergistically with other components. Proc Natl Acad Sci U S A. 105 (38), 14288-14292 (2008).
- Aprison, E. Z., Ruvinsky, I. Counteracting ascarosides act through distinct neurons to determine the sexual identity of C. elegans pheromones. Curr Biol. 27 (17), 2589-2599.e3 (2017).
- Aprison, E. Z., Ruvinsky, I. Sex pheromones of C. elegans males prime the female reproductive system and ameliorate the effects of heat stress. PLoS Genet. 11 (12), e1005729 (2015).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Kaplan, F., et al. Ascaroside expression in Caenorhabditis elegans is strongly dependent on diet and developmental stage. PLoS One. 6 (3), e17804 (2011).
- Pungaliya, C., et al. A shortcut to identifying small molecule signals that regulate behavior and development in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 106 (19), 7708-7713 (2009).
- Srinivasan, J., et al. A modular library of small molecule signals regulates social behaviors in Caenorhabditis elegans. PLoS Biol. 10 (1), e1001237 (2012).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Choe, A., et al. Ascaroside signaling is widely conserved among nematodes. Curr Biol. 22 (9), 772-780 (2012).
- Von Reuss, S. H., et al. Comparative metabolomics reveals biogenesis of ascarosides, a modular library of small-molecule signals in C. elegans. J Am Chem Soc. 134 (3), 1817-1824 (2012).
- Choe, A., et al. Sex-specific mating pheromones in the nematode panagrellus redivivus. Proc Natl Acad Sci U S A. 109 (51), 20949-20954 (2012).
- Hsueh, Y. P., Mahanti, P., Schroeder, F. C., Sternberg, P. W. Nematode-trapping fungi eavesdrop on nematode pheromones. Curr Biol. 23 (1), 83-86 (2013).
- Hong, M., et al. Early pheromone experience modifies a synaptic activity to influence adult pheromone responses of C. elegans. Curr Biol. 27 (20), 3168-3177.e3 (2017).
- Ryu, L., et al. Feeding state regulates pheromone-mediated avoidance behavior via the insulin signaling pathway in Caenorhabditis elegans. EMBO J. 37 (15), e98402 (2018).
- Diaz, S. A., Lindström, J., Haydon, D. T. Basic demography of Caenorhabditis remanei cultured under standard laboratory conditions. J Nematol. 40 (3), 167 (2008).
- Bargmann, C. I. Chemosensation in C. elegans. WormBook : the online review of C.elegans biology. , 1-29 (2006).
- Margie, O., Palmer, C., Chin-Sang, I. C. elegans chemotaxis assay. JoVE: J Vis Exp. (74), e50069 (2013).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved