Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Caenorhabditis elegans'ta Uçucu Seks Feromon Ekstraksiyonu ve Kemocazibe Testi
Bu Makalede
Özet
Bu protokol, C. elegans'taki uçucu seks feromonuna verilen yanıtların çıkarılması ve ölçülmesi için yöntemler oluşturur ve kimyasal iletişim ve navigasyon yörüngesini incelemek için araçlar sağlar.
Özet
Kimyasal iletişim, organizma sağlığı, üreme ve genel refah için hayati önem taşır. Bu sinyalleri yöneten moleküler yolları, sinirsel süreçleri ve hesaplamaları anlamak aktif bir araştırma alanı olmaya devam etmektedir. Nematod Caenorhabditis elegans, uçucu bir seks feromonu ürettiği için bu süreçleri incelemek için güçlü bir model sağlar. Bu feromon, bakire dişiler veya spermi tükenmiş hermafroditler tarafından sentezlenir ve erkekler için cezbedici görevi görür.
Bu protokol, uçucu seks feromonunu birkaç C. elegans suşundan (WT suşu N2, daf-22 ve sis-2) ve C. remanei'den izole etmek için ayrıntılı bir yöntemi açıklar. Ayrıca, uçucu seks feromonuna karşı erkek kemotaksis yanıtını ölçmek için bir protokol de sağlıyoruz. Analizimiz, çeşitli koşullar altında erkek tepkilerini doğru bir şekilde karşılaştırmak için kemotaksis indeksi (CI), varış zamanı (AT) ve bir yörünge grafiği gibi ölçümleri kullanır. Bu yöntem, farklı genetik geçmişlere veya gelişim aşamalarına sahip erkekler arasında sağlam karşılaştırmalara izin verir. Ayrıca, burada özetlenen deney düzeneği, diğer kemocazibe kimyasallarının araştırılmasına uyarlanabilir.
Giriş
Kimyasal iletişim ve üreme başarısı arasındaki etkileşim, hayvanlar alemindetemel bir ilkedir 1,2,3,4,5,6,7,8,9,10. Seks feromonları, eş bulmak, bir eş bulma ve çekme ile ilgili adımları koordine etmek ve nihayetinde bir türün yayılmasını teşvik etmek için gerekli olan çok çeşitli cinsel olarak dimorfik davranışları tetikler 11,12,13,14,15,16,17. Feromon sinyallemesinin anlaşılmasında önemli ilerlemeler kaydedilmiştir, ancak bu etkileşimleri yöneten moleküler mekanizmalar, nöral devreler ve hesaplama süreçleri genellikle tam olarak tanımlanmamıştır 18,19,20,21,22,23,24,25,26.
Nematod Caenorhabditis elegans, bu soruları incelemek için güçlü bir model sağlar. Özellikle, C. elegans alışılmadık bir üreme stratejisi sergiler - hermafroditler kendi kendine döllenebilir, ancak aynı zamanda erkeklerle de çaprazlanabilir 27,28,29,30,31,32,33. Bu esneklik, üreme durumunu bildirmek için sağlam bir iletişim sistemi gerektirir. C. elegans, gelişim, davranış ve sosyal etkileşimlerde çeşitli roller oynayan iyi karakterize edilmiş suda çözünür feromonları, ascarosidleri ile bilinir. Son keşifler, nematodlar tarafından kullanılan farklı bir uçucu seks feromonları sınıfını ortaya çıkardı. Bu feromonlar özellikle cinsel olarak olgun C. elegans ve C. remanei bakire dişiler ve spermi tükenmiş hermafroditler tarafından üretilir ve yetişkin erkekler için cezbedici görevi görür 29,34,35. Bu cezbedici, üretiminde ve algılanmasında dikkate değer bir cinsel dimorfizm sergiler. Dişi somatik gonad, bu uçucu seks feromonunun sentezini yönetir ve üretim dinamik olarak üreme durumunu yansıtır, çiftleşmeden sonra durur ve birkaç saat sonra devam eder29,34.
Nematod cinsiyet feromon iletişimini anlamak, kimyasal iletişim sistemlerinin evrimi, üreme durumu ve davranış arasındaki etkileşim ve cinsel olarak dimorfik nöral işlemenin altında yatan mekanizmalar hakkında bilgi sağlar 24,26,36,37,38,39 . Çalışmalar, erkeklerde amfid nöron AWA'nın feromon tespiti için kritik olduğunu ve G-proteinine bağlı reseptör SRD-1'in erkeklerde feromon tespitinde önemli bir rol oynadığını göstermektedir24. C. elegans, eş arama için koku alma sistemine dayanması nedeniyle, hayvan kimyasal iletişimini, özellikle seks feromon sinyalini incelemek için çok uygundur. Ascaroside sinyalizasyonu hakkında çok şey bilinmesine rağmen, uçucu seks feromon sistemi karşılaştırma için benzersiz fırsatlar sunar 25,26,36,40,41,42,43,44,45,46,47,48,49,50,
51,52,53,54,55,56,57. Ayrıca, C. elegans, tam dizilenmiş genomu, açıkça tanımlanmış hücresel soyu ve iyi karakterize edilmiş koku alma mutantları nedeniyle güçlü bir genetik model organizmadır.
Bununla birlikte, bu feromonun işlenmesinde yer alan tüm nöral devre, algısını hedeflenen eş arama davranışlarına dönüştüren hesaplamalar ve biyosentez düzenlemesi tam olarak açıklığa kavuşturulmayı beklemektedir. Bu süreçlerle ilgili daha fazla araştırma, hayvan iletişimini ve üreme davranışlarını yöneten çeşitli mekanizmaları anlamak için çok önemlidir. Feromon sentezi, salgılanması ve algılanmasında yer alan anahtar genlerin tanımlanması, hayvan iletişiminde yeni moleküler oyuncuları ortaya çıkarmayı vaat ediyor. Burada açıklanan tahliller, bu soruları ele almak için bir temel sağlar.
Protokol
1. Dişilerden ve hermafroditlerden ham seks feromonu ekstraksiyonu
- C. elegans Senkronizasyonu için Protokol
- Yetişkin dişilerin veya hermafroditlerin hazırlanması
- Büyük bir yetişkin dişi/hermafrodit popülasyonu oluşana ve OP50 besin kaynağı tükenene kadar kültür plakalarını günlük olarak izleyin. Ham seks feromon ekstraksiyonu için fog-2 C. elegans ve WT C. remanei dişilerini kullanarak, çiftleşmiş dişilerden senkronize yumurtalar hazırlayın.
NOT: Bu protokolde kendi kendine sperm üretmeyen C. elegans fog-2 mutant XX hayvanları C. elegans dişileri olarak adlandırılmaktadır.
- Büyük bir yetişkin dişi/hermafrodit popülasyonu oluşana ve OP50 besin kaynağı tükenene kadar kültür plakalarını günlük olarak izleyin. Ham seks feromon ekstraksiyonu için fog-2 C. elegans ve WT C. remanei dişilerini kullanarak, çiftleşmiş dişilerden senkronize yumurtalar hazırlayın.
- Solucanların yıkanması ve peletlenmesi
- Yetişkin solucanları M9 tamponu ile karışık bir popülasyon plakasından yıkayın. Solucan süspansiyonunu 1.5 mL'lik bir mikrosantrifüj tüpüne toplayın. Solucanları peletlemek için 1.500 × g'da 0,5-1 dakika santrifüjleyin.
NOT: Ağır kirlilik için ön temizleme (isteğe bağlı): Çok kirlenmişse solucanların tüpe yerleşmesine izin verin. Bakterileri uzaklaştırmak için süpernatanı pipetleyin ve süpernatan berraklaşana kadar tekrarlayın.
- Yetişkin solucanları M9 tamponu ile karışık bir popülasyon plakasından yıkayın. Solucan süspansiyonunu 1.5 mL'lik bir mikrosantrifüj tüpüne toplayın. Solucanları peletlemek için 1.500 × g'da 0,5-1 dakika santrifüjleyin.
- Beyazlatma
- Solucan peletine 200 μL M9 tamponu ekleyin. Ev tipi çamaşır suyu ve 1 M NaOH'yi 1:1 oranında karıştırarak lizis tamponu hazırlayın. Karışıma bu lizis tamponundan 500 μL ekleyin, 10 saniye boyunca girdap yapın ve ardından diseksiyon mikroskobu altında lizis durumunu izlemek için duraklayın. Bu 10 saniyelik girdap işlemini tekrarlayın ve ardından yetişkin solucanlar tamamen parçalanana kadar gözlem yapın.
- Embriyoların ağartılmasını ve peletlenmesini durdurmak
- Yetişkin solucanlar küçük parçalara ayrıldığında (ancak tamamen çözünmediğinde), reaksiyonu yavaşlatmak için hemen 500 μL M9 tamponu ekleyin. Embriyoları peletlemek için 30-60 saniye boyunca 15.000 × g'da santrifüjleyin.
NOT: Aşırı lizis embriyolara zarar verebilir. Yetişkin solucan gövdeleri küçük parçalara ayrıldığında reaksiyonu durdurun. Lizis, santrifüj ve yıkama adımları sırasında tüm lizis tamponu çıkarılana kadar devam eder.
- Yetişkin solucanlar küçük parçalara ayrıldığında (ancak tamamen çözünmediğinde), reaksiyonu yavaşlatmak için hemen 500 μL M9 tamponu ekleyin. Embriyoları peletlemek için 30-60 saniye boyunca 15.000 × g'da santrifüjleyin.
- Embriyoları 5x 1 mL M9 tamponu ile yıkayın, her yıkamadan sonra 30-60 saniye boyunca 15.000 × g'da santrifüjleyin. Santrifüjlemeden sonra süpernatanı çıkarın.
- Senkronizasyon
- Embriyoları 1.5 mL'lik bir mikrosantrifüj tüpünde 800 μL M9 tamponunda yeniden süspanse edin. Tüp tüpünü 20 °C'de 12-15 saat döndürün, L1 kuluçka ve L1 aşamasında gıda kaynağı olmadığı için solucan tutuklaması. Solucanları L4 aşamasına ulaşana kadar 3 gün boyunca 20 ° C'de serbest bırakın ve kültürleyin.
- Yetişkin dişilerin veya hermafroditlerin hazırlanması
2. Bir günlük bakire dişilerden ham seks feromon ekstraksiyonu (Şekil 1A)
NOT: C. elegans'ın bir günlük bakire sis-2 (germ hattının dişileşmesi) mutant dişilerinden ve C. remanei'nin WT dişilerinden seks feromonlarını çıkarmak için daha önce kurulmuş bir protokol24'ü benimsiyoruz.
- Yetişkin dişilerin hazırlanması
- Feromon ekstraksiyonundan 1 gün önce yaklaşık 200 L4 evre sis-2 dişi seçin ve izole edin. Sadece bakire dişilerin toplandığından emin olmak için, bu L4 fog-2 dişilerini cinsiyetlerine göre dikkatlice ayırın ve üç ayrı 6 cm OP50 NGM plakasına dağıtın. Her plakanın ortasına az miktarda OP50 bakteri yerleştirin.
NOT: Tabağa yanlışlıkla bir erkek solucan sokma riskini önlemek için 200 L4 dişi solucanı üç ayrı plakaya dağıtın. Bir erkek seçilirse, birçok dişiyle çiftleşmesi muhtemeldir, bu da dişilerin çoğunun yetişkin olduklarında ertesi gün döllenmesine neden olur. Döllenmiş dişiler, sperm tükenene kadar uçucu seks feromonları yaymazlar, bu da ekstraksiyon sonuçlarını etkiler. Sınırlı besin kaynağı, hermafroditleri plakanın merkezinde daha küçük bir alanla sınırlayarak, izolasyon süresi boyunca plakadan kaçma şansını en aza indirir.
- Feromon ekstraksiyonundan 1 gün önce yaklaşık 200 L4 evre sis-2 dişi seçin ve izole edin. Sadece bakire dişilerin toplandığından emin olmak için, bu L4 fog-2 dişilerini cinsiyetlerine göre dikkatlice ayırın ve üç ayrı 6 cm OP50 NGM plakasına dağıtın. Her plakanın ortasına az miktarda OP50 bakteri yerleştirin.
- Ekstraksiyon işlemi
- Ekstraksiyon gününde (üreme olgunluğunun 1. günü, solucanların L1 tutuklamasından serbest bırakılmasından 3 gün sonra), 100 bakire, 1 günlük sis-2 dişisini 1 mL M9 tamponu içeren bir mikrosantrifüj tüpüne alın ve izole edin. Bakteriyel kontaminasyonu en aza indirmek için dişileri 5 kez M9 tamponu ile yıkayın ve feromon üretimine ve ortamda birikmesine izin vermek için 20 ° C'de 6 saat boyunca 100 μL M9 tamponunda inkübe edin.
- Benzer bir ekstraksiyon işlemi gerçekleştirin C. remanei dişiler, ekstraksiyondan bir gün önce üç plakaya izole edilen sadece 15-20 L4 aşaması dişisini kullanarak ve ertesi gün, beş bakire dişiyi 100 μL M9 tamponunda 25 ° C'de 6 saat boyunca inkübe edin ( C. remanei için en uygun büyüme sıcaklığı)58.
NOT: C. remanei dişileri, C. elegans dişilerine kıyasla daha yüksek miktarda uçucu seks feromonu üretir. Bu nedenle, 100 μL ham uçucu seks feromonunu çıkarmak için sadece beş dişi yeterlidir.
- Depolama
- Solucanları peletlemek için numuneleri 15.000 × g'da 30-60 saniye santrifüjleyin. Süpernatanı (feromon içeren) dikkatlice pipetle temiz bir tüpe aktarın ve solucan peletini içeren tüpü atın. İzole edilmiş süpernatanı sonraki kemoretraksiyon testleri için saklayın.
NOT: Ham uçucu seks feromon özütü, buharlaşmayı en aza indirmek için parafilm ile sarılmış bir mikrosantrifüj tüpünde -80 °C'de en az 1 yıl saklanabilir.
- Solucanları peletlemek için numuneleri 15.000 × g'da 30-60 saniye santrifüjleyin. Süpernatanı (feromon içeren) dikkatlice pipetle temiz bir tüpe aktarın ve solucan peletini içeren tüpü atın. İzole edilmiş süpernatanı sonraki kemoretraksiyon testleri için saklayın.
- Kalite kontrol
- Ekstraktı kullanmadan önce, kemoçekiciliğini doğrulamak için N2 erkekleri veya him-5 erkekleri kullanarak bir kalite kontrol testi yapın (bkz. bölüm 4).
3. 6 günlük bakire hermafroditlerden büyük miktarda ham seks feromonu ekstraksiyonu (Şekil 1A)
- Solucan kültürü
- Yaklaşık 20 mL ham C. elegans seks feromonu elde etmek için, yukarıda belirtilen ağartıcı protokolünü kullanarak sağlıklı yetişkin C. elegans (N2 veya daf-22 mutant) solucanları içeren yirmi 10 cm'lik NGM plakasını senkronize edin ve ardından 5x M9 tamponu ile yıkayın.
NOT: Bu işlem feromon ekstraksiyonu için yeterli embriyo hazırlar. N2: Hem suda çözünür askarosid feromonları hem de askarosid olmayan uçucu seks feromonları üreten standart WT C. elegans suşu. daf-22 mutantı: Çok sayıda ascaroside feromon üretme yeteneğinden yoksun bir mutant, bu da onları ascaroside olmayan uçucu seks feromonlarını izole olarak incelemede yardımcı kılar. - L1 aşamasında solucanları senkronize etmek için, gelişimi durdurmak için embriyoları M9 tamponunda 12-15 saat döndürün. Tutukladığınız L1 solucanlarını büyüme ve gelişme için OP50 bakterisi ile tohumlanmış 10 cm'lik NGM kültür plakalarına aktarın.
- Hermafrodit plakalarda erkeklerin varlığını en aza indirmek için, solucan salınımından 2 gün sonra, L4 aşamasında plakaları kontrol edin ve gözlenen erkekleri (çok nadir) çıkarın.
- Üç günlük gelişimden sonra, solucanların üreme açısından olgun yetişkinler haline geldiğini gösteren embriyoların görünümünü arayın.
NOT: C. elegans'ın fog-2 mutant dişileri ve C. remanei'nin WT dişileri toplu uçucu seks feromon ekstraksiyonu için uygun değildir. fog-2 mutantı C. elegans ve C. remanei, popülasyonlarında yüksek oranda erkeğe sahiptir ve erkekler sürekli olarak dişilerle çiftleşir. Döllenmiş dişiler uçucu seks feromonları üretmezler. Erkek varlığı bu bileşiklerin ekstraksiyonunu zorlaştırır.
- Yaklaşık 20 mL ham C. elegans seks feromonu elde etmek için, yukarıda belirtilen ağartıcı protokolünü kullanarak sağlıklı yetişkin C. elegans (N2 veya daf-22 mutant) solucanları içeren yirmi 10 cm'lik NGM plakasını senkronize edin ve ardından 5x M9 tamponu ile yıkayın.
- Solucan yıkama ve embriyo ayırma
- Embriyoları M9 tamponu ile tekrar tekrar yıkayın ve yetişkinlerin çoğu tüpün dibine gelene kadar çökmelerine izin verin (1 g sedimantasyon); 5-7x tekrarlayın. Yetişkin solucanların çökelmesini kolaylaştırmak ve yetişkin solucan popülasyonunun süpernatantta asılı kalan embriyolardan ayrılmasını sağlamak için mikrosantrifüj tüplerinin birkaç dakika boyunca bir rafta rahatsız edilmeden yerleşmesine izin verin.
- Ayrılan yetişkinleri pipetleyin ve yeni OP50 tohumlu NGM plakalarına aktarın.
- Kendi spermini tüketmek için bu yıkama işlemini 5-6 gün boyunca tekrarlayın.
NOT: Uçucu seks feromonlarının çıkarılması için 5-6 günlük hermafroditleri kullanın. Bu zamanlama, mevcut kendi spermine sahip hermafroditler uçucu seks feromonları üretmediğinden, kendi spermlerinin tükenme olasılığının yüksek olmasını sağlar. 5. veya 6. güne kadar plakadaki çok sayıda ölü veya yumurtadan çıkmamış embriyo, feromon ekstraksiyonuna başlamak için uygun bir zamanı gösterir.
- Seks feromon ekstraksiyonu
- Seks feromonunu modifikasyonlarla bölüm 1'de açıklandığı gibi çıkarın.
- 100 μL'ye 100 C. elegans dişi eklemek yerine, son solucan pelet hacmine bağlı olarak M9 tamponu ekleyin. Her 50 μL paketlenmiş solucan için 1 mL M9 tamponu ekleyin.
- Kalite kontrol ve homojenizasyon
- N2 erkekleri veya him-5 erkekleri ile kemorekattraction testi kullanılarak ekstrakte edilen feromonun kalite kontrol test partileri (bkz. bölüm 4).
- Tarama veya mikroakışkan deneyler gibi büyük miktarda feromon gerektiren deneyler için homojen bir ham uçucu seks feromonu oluşturmak üzere tüm partileri karıştırın. Ham seks feromonu ekstraktını buharlaşmayı en aza indirmek için parafilm ile sarılmış 50 mL'lik tüplerde -80 °C'de en az 1 yıl saklayın.
- Ham seks feromon ekstraktının standardizasyonu için kemocazibe tahlili bazlı titrasyon yöntemi
- Her bir feromon ekstraktının seri dilüsyonlarını hem WT N2 hem de him-5 erkek C. elegans üzerinde test ederek bir titrasyon testi gerçekleştirin. Kontrol suşlarında sürekli olarak sağlam ve tekrarlanabilir bir kemotaksis tepkisi ortaya çıkaran en yüksek seyreltmeyi (en düşük konsantrasyon) belirleyin.
- M9 tamponunda her ham ekstrakttan (örn. 1:2, 1:4, 1:8, vb.) bir dizi seyreltme hazırlayın.
- Kemotaksis testleri
- Erkeklerin referans suşu üzerindeki her seyreltmeyi kullanarak standartlaştırılmış kemotaksis testleri yapın (bkz. bölüm 4). Tekrarlanabilirliği sağlamak için üç çoğaltma gerçekleştirin. Feromon konsantrasyonundaki tutarlılığı değerlendirmek için farklı ekstraksiyon partileri arasındaki optimum seyreltmeleri karşılaştırın.
NOT: Bu, her bir ekstraktın biyoaktivitesini değerlendirmek için bir referans noktası oluşturur. Standart seks feromon kemoreaksiyon testinde, orijinal seyreltilmemiş ekstraktlar sonraki deneyler için kullanılacak ve titrasyon, partiler arasında tutarlı feromon aktivitesi sağlamak için bir kalite kontrol adımı olarak hizmet edecektir. Seyreltme serisi, belirli deneysel ihtiyaçlara göre ayarlanabilir. Standart ekstraksiyon protokolünün sürekli olarak doymuş ham feromon ekstraktları verdiği göz önüne alındığında, ekstraktı standartlaştırmak için bir titrasyon testi çoğu deney için gerekli olmayabilir. Tutarlılığı korumak ve feromon aktivitesindeki değişkenliği en aza indirmek için bir dizi ilgili deney boyunca aynı ham seks feromonu partisinin kullanılması önerilir.
- Erkeklerin referans suşu üzerindeki her seyreltmeyi kullanarak standartlaştırılmış kemotaksis testleri yapın (bkz. bölüm 4). Tekrarlanabilirliği sağlamak için üç çoğaltma gerçekleştirin. Feromon konsantrasyonundaki tutarlılığı değerlendirmek için farklı ekstraksiyon partileri arasındaki optimum seyreltmeleri karşılaştırın.
4. Uçucu seks feromon kemoreziva testi
NOT: Uçucu seks feromon kemorevaksiyon testi, diğer kemorekattraction çalışmalarında 24,29,59,60,61 kullanılan daha önce kurulmuş yöntemlerden uyarlanmıştır. Bu modifikasyonlar, uçucu seks feromonlarına verilen yanıtları tespit etmek için testin duyarlılığını ve özgüllüğünü optimize etmek için uygulandı. Bu özel yaklaşım, testin belirli araştırma ihtiyaçlarına uygulanabilirliğini artırır.
- Yetişkin dişi / hermafroditler bol olana kadar kültür plakalarını günlük olarak gözlemleyin. Solucanların sağlığı, seks feromonuna verdikleri tepkiyi etkiler.
- Onun-5 erkeğin hazırlanması
- Him-5 solucanlarını senkronize etmek için standart ağartma protokolünü kullanın. Senkronizasyondan sonra, solucanları 5x M9 tamponu ile yıkayın. Testten bir gün önce L4 erkeklerini izole edin; daha sonra, bir günlük yetişkin erkek solucanları tohumlu plakalarından aktarın ve tahlilden önce M9 tamponunda durulayın. Kalıntı bakterileri ortadan kaldırmak ve tahlil sırasında gıdalardan kaynaklanan etkileşimi önlemek için tahlilden önce bunları tohumlanmamış NGM plakalarına yerleştirin.
NOT: Solucanları testten önce bir saatten fazla aç bırakmayın, çünkü bu onların iç durumlarını değiştirebilir ve seks feromon kemorevivites testinin sonuçlarını etkileyebilir. Bu nedenle, tek bir günde 10'dan fazla tahlil yapmayı düşünüyorsanız, solucan örneklerini her saat değiştirin. Ayrıca, bir deneysel test ile bir kontrol testi arasında tekrar tekrar geçiş yapın.
- Him-5 solucanlarını senkronize etmek için standart ağartma protokolünü kullanın. Senkronizasyondan sonra, solucanları 5x M9 tamponu ile yıkayın. Testten bir gün önce L4 erkeklerini izole edin; daha sonra, bir günlük yetişkin erkek solucanları tohumlu plakalarından aktarın ve tahlilden önce M9 tamponunda durulayın. Kalıntı bakterileri ortadan kaldırmak ve tahlil sırasında gıdalardan kaynaklanan etkileşimi önlemek için tahlilden önce bunları tohumlanmamış NGM plakalarına yerleştirin.
- Kemoretraksiyonel agar test plaklarının hazırlanması
- İlgili literatürde açıklandığı gibi% 1.5 agar, 25 mM NaCl, 1.5 mM Tris-baz ve 3.5 mM Tris-Cl içeren kemorezientif test plakaları hazırlayın24.
- Agarı kemorezive çözeltisi içinde tamamen eriyene kadar bir mikrodalga kullanarak ısıtın. Solüsyonun oda sıcaklığında 5 dakika soğumasına izin verin.
- Kemoçekim agar solüsyonunu Petri kaplarına eşit olarak dağıtmak için bir pipet yardımcısı kullanın: her 10 cm'lik tabağa 30 mL ve her 6 cm'lik tabağa 20 mL dökün.
- Kemocazibe agar solüsyonunu Petri kaplarına döktükten sonra, agar yüzeyinin hafifçe kurumasını sağlamak için kapakları temiz bir alanda en az 40 dakika açık bırakın. Yüzey uygun şekilde kuruduktan sonra kapakları kapatın.
NOT: Bu kuruma süresi laboratuvar ortamının nem ve sıcaklığına bağlı olarak değişiklik gösterebilir.
- Plaka saklama ve tahlil öncesi hazırlık
- Hazırlanan tahlil plakalarını kutulayın ve 1 haftaya kadar soğuk bir odada saklayın. Kullanmadan önce plakaları soğuk hava deposundan çıkarın ve bir saatten fazla oda sıcaklığına alışmalarına izin verin. Tahlilden 20 dakika önce agardan kalan nemin temiz bir alanda buharlaşmasını sağlamak için kapakları açın ve tahlili yapmadan önce yüzeyde belirgin bir su olmadığından emin olun.
- Deneysel tasarım ve kemocazibe deneyi
- Kemorekreaksiyon testini yapmak için, kapakta ve Petri kabının alt tarafında üç ayrı noktayı işaretleyin veya tabağın altına yerleştirilmiş veya diseksiyon mikroskobuna bağlı şeffaf plastik kağıda basılmış bir şablon kullanın. Bu işaretler, solucanlar için başlangıç noktası olarak bir orta nokta (•), deney noktası için bir artı işareti (+) (kapakta 2 μL seks feromonu ve plaka üzerinde 2 μL 1 M sodyum azid) ve kontrol noktası için bir eksi işareti (-) (kapakta 2 μL M9 tamponu ve 2 μL 1 M sodyum azid) içerir (Şekil 2A). Bu işaretler arasındaki mesafeyi tabak boyutuna ve özel deneysel ihtiyaçlara göre ayarlayın. Tipik olarak, 6 cm'lik Petri kapları için, pozitif kontrol testleri için başlangıç noktasından her bir test maddesine 1,5 cm'lik sabit bir mesafe ayarlayın.
- Testi gerçekleştirmek için ayrıntılı adımlar (Şekil 2)
- Plaka üzerindeki her deney ve kontrol noktasına 2 μL 1 M sodyum azid uygulayın.
- Bir solucan toplayıcı ile 20 sağlıklı ve serbestçe hareket eden erkek solucan seçin. Bir diseksiyon mikroskobu altında başlangıç noktasında 20 erkek solucanı aynı anda serbest bırakın.
- Kapaktaki deney ve kontrol noktalarına sırasıyla 2 μL seks feromonu ve 2 μL M9 tamponu ekleyin.
- Kapağı yavaşça kapatın ve tahlil plakasını mikroskobun yanındaki sessiz, sıcaklığa dayanıklı bir alana yerleştirin.
- 30 dakika sonra, her noktadaki solucan sayısını sayarak testi puanlayın.
NOT: Erken toplanan solucanların kurumasını ve sağlıksız hale gelmesini önlemek için 20 solucan toplama işlemi 1-2 dakikayı geçmemelidir, bu da sonuçları etkileyebilir. Erkeklerin toplanmasından kapağın kapatılmasına kadar tüm süreç 2 ila 5 dakika sürmelidir.
- Pozitif kontrol taraması
- Kemotaksis duyarlılıklarını doğrulamak için erkek solucanları 1.000 kat seyreltilmiş diasetil çözeltisine (%10 etanol ve %90 M9 tamponunda çözülmüş) test edin. Testi başlattıktan 30 dakika sonra kemoreziva testinin sonuçlarını değerlendirin. Belirlenen noktalarda felç olan solucanları konumlarına göre puanlayın: Kontrol noktasındakiler için 'C' ve deney noktasındakiler için 'E'. Solucanları hiçbir noktada 'N' olarak puanlayın (Şekil 2C).
- Kemocazibe İndeksini (CI) hesaplamak için aşağıdaki formülü kullanın:
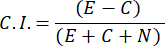
- Yalnızca kemotaksis indeksi 0.4 ≥ olan erkek numuneleri seçin (C.I., bkz. Şekil 2C). Sonraki seks feromon testi için aynı partiden erkeği kullanın.
NOT: Deney sonuçlarının tutarlılığını ve güvenilirliğini sağlamak için her biri 20 solucan içeren üç ayrı test yapın. Tutarlılık elde etmek için tipik olarak üç tahlil yeterlidir.
5. Kemorezive testi için zamanlama ve skorlama kılavuzları
- Solucanların kemoçekim tepkisini son konumlarına göre değerlendirin. Testin sonunda, genellikle başladıktan 30 dakika sonra, her noktadaki solucan sayısını puanlayın.
NOT: Deney ve kontrol noktalarında sodyum azid kullanımı, gelen solucanları felç ederek doğru puanlamayı kolaylaştırır. Çoğu WT N2 ve him-5 erkekleri, feromon kaynağını 1,5 cm mesafe kurulumuna sahip 6 cm'lik bir plakada 6-8 dakika içinde bulabilir. - Kemotaksis verimliliğindeki kusurları yakalamak, özellikle ince kusurları tespit etmek için, testi 3-5 dakikalık düzenli aralıklarla izlemeyi düşünün.
NOT: Bu sık gözlem, solucanların test noktalarına ne zaman ulaştığının belgelenmesini sağlar. Bu tür ayrıntılı izleme, solucanların düşük kemotaksis verimliliği sergilediği, ancak yine de inceleme penceresi içindeki test noktasına ulaşmayı başardığı durumları ortaya çıkarabilir.
6. İsteğe bağlı değişiklikler
- Kemotaksisin gelişmiş bir değerlendirmesi için, test boyunca solucanların yörüngelerini kaydetmek için plakanın üzerine yerleştirilmiş bir kamera kullanın.
NOT: Bu değişiklik, hareket modellerinin kapsamlı bir analizini mümkün kılarak, kemoçekim davranışı ve yörüngesi hakkında daha derin bir içgörü sağlar (Şekil 3).
7. Veri analizi
- Kemorevive İndeksi (C.I.) skorlaması ve hesaplanması
- 4.7.1 ve 4.7.2 adımlarını izleyin.
- Varış zamanı grafiği
- Kemoreziva tahlillerinin daha kapsamlı bir analizi için, tahlili 3-5 dakikalık aralıklarla izlemeyi veya tahlil boyunca solucanların yörüngelerini kaydetmek için plakanın üzerine yerleştirilmiş bir kamera kullanmayı düşünün.
NOT: Bu yaklaşımlar sadece solucanların tasarım noktalarına varış zamanlarının puanlanmasına izin vermekle kalmaz, aynı zamanda ortalama varış zamanlarının karşılaştırılmasına ve bu sürelerin dağılımının analiz edilmesine de izin verir.
- Kemoreziva tahlillerinin daha kapsamlı bir analizi için, tahlili 3-5 dakikalık aralıklarla izlemeyi veya tahlil boyunca solucanların yörüngelerini kaydetmek için plakanın üzerine yerleştirilmiş bir kamera kullanmayı düşünün.
- Video tabanlı yörünge analizi ve veri görselleştirme
NOT: Hareket kalıplarını analiz etmek için C. elegans kemocazibe tahlilleri sırasında, yörüngeleri kaydedin ve çıkarın (bkz. Malzeme Listesi) ve daha fazla analiz (Şekil 3).- Kayıt sistemini kurun.
- Yeni bir kayıt başlatın ve kayıt ayarları penceresine erişin.
- İstenen kayıt parametrelerini tanımlayın:
- Dosya Öneki: Video dosyaları için açıklayıcı bir ad seçin (ör. "experiment1_").
- Kare Hızı (FPS): Solucanın hareketini yakalamak için saniyede uygun kareyi seçin (örneğin, agar plakasındaki solucanlar için 7,5 FPS ve yüzen solucanlar için 30 FPS).
- Süre: Kaydın uzunluğunu saniye cinsinden ayarlayın (örneğin, toplu kemoreziva testi için 1.800 s [30 dk]).
- Görüntü kalitesini optimize edin: Solucanların arka planda net bir şekilde görülebilmesini sağlamak için aydınlatma yoğunluğunu ayarlayın ve solucanların keskin bir görüntüsünü elde etmek için odakta ince ayar yapın.
- Test plakasını hazırlamak için önce kontrol solüsyonunu belirlenen kontrol noktasına dağıtın. Ardından, solucanları dikkatlice toplayın ve yavaşça plakanın ortasına bırakın. Solucan(lar) yerleştikten sonra, seks feromon solüsyonunu belirlenen deney noktasına uygulayın.
- Plakayı yerleştirin: Yakalama alanını en üst düzeye çıkarmak için solucanları içeren plakayı kayıt alanının ortasına dikkatlice yerleştirin.
- Kemotaksis tahlilleri sırasında solucanlar üzerindeki stresi azaltmak için aşağıdaki iki yaklaşımı göz önünde bulundurun.
- Tek solucan tahlili için, solucanı tahlil plakasına yerleştirin ve seks feromon çözeltisini belirlenen mesafeye (solucanın mevcut konumuna bağlı konum) vermeden önce 5 dakika alışmasına izin verin.
NOT: Bu, kullanımı en aza indirir ve solucanın yeni ortamına uyum sağlaması için zaman sağlar. - Toplu kemorezivasyon deneyi: Solucanların 5 dakika boyunca plaka üzerinde doğal olarak yerleşmesine ve dağılmasına izin verin. Bu alışma süresinden sonra, feromon çözeltisini belirlenen sabit konuma getirin. Video analizi sırasında, her bir solucanın feromona olan başlangıç mesafesini ölçün ve daha fazla analiz için bunları buna göre gruplandırın.
- Tek solucan tahlili için, solucanı tahlil plakasına yerleştirin ve seks feromon çözeltisini belirlenen mesafeye (solucanın mevcut konumuna bağlı konum) vermeden önce 5 dakika alışmasına izin verin.
- Video analiz prosedürü
- İçe aktarma ve kurulum: Kaydedilen videoyu yazılıma aktarın. Sıra bilgilerini yapılandırın (örn. kare hızı); Görüntüleme ölçeğini belirtin (ölçü birimi başına piksel).
- Görüntü ayarı: Solucan algılamayı optimize etmek için, yeşil etiket arka plan gürültüsünü veya artefaktları yakalamadan solucanları sıkıca özetleyene kadar algılama eşiğini ayarlayın. Ek olarak, görüntüdeki gürültüyü ve düzensizliği azaltmak için arka plan yumuşatma algoritmaları uygulayın ve solucanlar ile arka plan arasındaki kontrastı artırın. Gürültü azaltma ve solucan ayrıntılarının korunması arasındaki en uygun dengeyi bulmak için farklı yumuşatma seviyeleriyle denemeler yapın.
NOT: İdeal eşik, yabancı elementleri hariç tutarken her solucanın vücudunun çoğunu kapsamalıdır. - Algılama parametresi optimizasyonu: Algılama parametrelerini otomatik olarak oluşturmak için temsili bir solucan seçin. 5-10 rastgele kareyi görsel olarak inceleyerek algılama doğruluğunu doğrulayın. Algılama tatmin edici değilse, algılama parametrelerini manuel olarak iyileştirin, gerekirse görüntü ayarlama ayarlarını yeniden gözden geçirin ve algılama güvenilir olduğunda izlemeye devam edin.
- İzleme yörüngelerinin düzeltilmesi ve onarılması: Otomatik izleme işlemi tamamlandıktan sonra, oluşturulan yörüngelerin manuel olarak düzeltilmesini gerçekleştirin. Düzeltme okuması sırasında tutarsızlıklar bulunursa, yörüngeyi düzeltmek için onarım işlevini kullanın ve aşağıdaki işlemleri gerçekleştirin: Katıl: Yanlış bir şekilde farklı tanımlayıcılar atanmış ancak aynı kişiye ait olan yörünge segmentlerini bağlayın. Bölme: Yanlış bir şekilde aynı tanımlayıcıya atanmış ancak farklı kişilere ait olan ayrı yörünge segmentleri.
NOT: Amaç, her bir benzersiz tanımlayıcının (sayı) tüm izleme süresi boyunca tutarlı bir şekilde aynı kişiye atanmasını sağlamaktır.
Örnek: Bir solucan bir dönem için "3" olarak etiketlenirse ve sonraki bir dönem için yanlış bir şekilde "7" olarak etiketlenirse, onarım işlevi bu iki segmenti "3" tanımlayıcısı altında birleştirir. Tersine, iki solucanın her ikisi de bir süre için "12" olarak etiketlenirse, onarım işlevi bu segmenti her biri benzersiz bir tanımlayıcıya sahip iki ayrı yörüngeye böler. Dikkatli bir şekilde yeniden okuyarak ve gerekli onarımları uygulayarak, izleme verilerinin doğruluğu ve güvenilirliği önemli ölçüde iyileştirilebilir. - Sonuç görselleştirme ve dışa aktarma: Görselleştirme ve temel analiz için yazılım kullanın. Tercih edilen araçlar veya kodla daha fazla analiz için verileri CSV dosyaları olarak dışa aktarın. Bu yöntem, beş temel parametreye dayalı olarak solucan hareketi yörüngesini görselleştirmek için temel bir kod (bkz. https://github.com/edmondztt/pheromone-traj-analysis.git) sağlar (Şekil 3). Zaman: Deneyin başlamasından bu yana geçen süreyi belirtmek için renk kodlu yörüngenin ilerlemesi. Feromona Olan Mesafe: Her zaman noktasında solucan ile feromon kaynağı arasındaki mesafe. Hız: Solucanın her noktadaki hızı, aynı zamanda dönme ve durma olaylarını da gösterir. Düzlük: Solucanın yolunun ne kadar düz olduğu. Yön Doğruluğu: Solucanın hareketi feromon hedefinin yönü ile ne kadar uyumlu? Bu kod, solucan davranışını anlamak için temel bir görselleştirme sağlar ve daha derin analiz için özelleştirilebilir ve genişletilebilir.
NOT: Bu gelişmiş yaklaşım, seks feromonlarına yanıt olarak solucan navigasyon yörüngesini detaylandırarak geleneksel kemocazibe indeksine kapsamlı bir alternatif sunar. Navigasyonun keyfi uç noktalarına ve zaman penceresi belirlemesine güvenmeden hareket kalıplarının anlaşılmasına olanak tanır ve tahlilin davranışsal dinamikleri hakkında daha derin bilgiler sunar. Verilerin, vücut bükülmesinin neden olduğu hareketi filtrelemek için belirli deneysel ihtiyaçlara göre ayarlanabilen 20 kare üzerinde ortalaması alındı.
Sonuçlar
Kemoattraction testinde uçucu seks feromon algısı kusurlu suşun yörünge analizi
Bu kemorekreaksiyon testi, uçucu seks feromonlarına tepkilerinde C. elegans'ın vahşi tip ve mutant suşları arasında güvenilir bir şekilde ayrım yapar. Him-5 erkekleriyle yapılan başarılı deneyler, feromon kaynağına karşı sürekli olarak sağlam kemotaksis göstermektedir. Bu, yüksek bir kemotaksis indeksi (C.I.) ile yansıtılır (
Tartışmalar
Bu protokol, erkek kemoçekitivite yanıtlarını ölçmek için sağlam bir kemorekattraction testi oluşturmanın yanı sıra C. elegans'tan uçucu seks feromonlarının ekstraksiyonu için sağlam bir metodoloji sağlar. Ek bilgiler WormLab kullanıcı kılavuzunda bulunabilir (Malzeme Tablosuna bakın); Solucan hareketinin yörüngesini görselleştirmek için temel bir kod için protokol bölüm 7.3.8.5'e bakın. Protokoldeki birkaç önemli adım sonuç i?...
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Analizimizde kullanılan yörünge görselleştirmeleri için kod tasarladığı ve yazdığı için Dr. Tingtao Zhou'ya minnettarız. Bu çalışma, R01 NS113119 (PWS), Chen kıdemli doktora sonrası bursu ve Tianqiao ve Chrissy Chen Sinirbilim Enstitüsü tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10 cm Petri dishes | Falcon | 25373-100 | Falcon bacteriological Petri dish 100 x 15 mm |
| 6 cm Petri dishes | Falcon | 25373-085 | Falcon bacteriological Petri dish 60 x 15 mm |
| C. remanei (EM464) | CGC | ||
| Centrifuge | Eppendorf | centrifuge 5418 | Any brand should work. |
| Chemoattraction assay plates | Homemade solution | N/A | 1.5% agar, 25 mM NaCl, 1.5 mM Tris-base, and 3.5 mM Tris-Cl |
| Cholesterol | Alfa Aesar | 57-88-5 | |
| Dissecting Microscope | Leica | LeicaMZ75 | Any brand should work. |
| E. Coli OP50 | CGC | ||
| Ethanol | Koptec | 64-17-5 | |
| fog-2(q71) (JK574) | CGC | ||
| him-5(e1490)(CB4088) | CGC | ||
| Household bleach | Clorox Germicidal bleach concentrated | Bleach | |
| M9 buffer | Homemade solution | N/A | 3 g KH2PO4, 11.3 g Na2HPO4.7H2O, 5 g NaCl, H2O to 1 L. Sterilize by autoclaving. Add 1 mL 1 M MgSO4 after cool down to room temperature. |
| Magnesium Sulfate, Anhydrous, Powder | Macron | M1063-500GM-EA | |
| Microwave | TOSHIBA | N/A | Any brand should work. |
| N2 | CGC | ||
| NaOH | Sigma-aldrich | S318-3 | 1 M |
| NGM plates solution | Homemade solution | N/A | 2.5 g Peptone, 18 g agar, 3 g NaCl, H2O to 1 L.Sterilize by autoclaving. Once the autoclave is done (2 h), wait until the temperature of the medium drops to 65 °C. Put on a hotplate at 65 °C and stir. Then add the following, waiting 5 min between each to avoid crystallization: 1 mL CaCl2 (1 M), 1 mL MgSO4 (1 M), 25 mL K3PO4 (1 M, pH=6), 1 mL Cholesterol ( 5 mg/mL in ethanol). |
| Parafilm | Bemis | 13-374-10 | Bemis Parafilm M Laboratory Wrapping Film |
| Peptone | VWR | 97063-324 | |
| Pipet- aid | Drummond Scientific | 4-000-100 | Any brand should work. |
| Plastic paper | Octago | Waterproof Screen Printing Inkjet Transparency Film | https://www.amazon.com/Octago-Waterproof-Transparency-Printing-Printers/dp/B08HJQWFGD |
| Potassium chloride | Sigma-aldrich | SLBP2366V | |
| Potassium phosphate | Spectrum | 7778-77-0 | |
| Pipette | Eppendorf | SKU: EPPR4331; MFG#: 2231300006 | 20 - 200 µL, 100 - 1000 µL, any brand should work. |
| Rotator | Labnet | SKU: LI-H5500 | Labnet H5500 Mini LabRoller with Dual Direction Rotator. Any brand should work. |
| Sodium chloride | VWR | 7647-14-5 | |
| sodium phosphate dibasic | Sigma-aldrich | SLCG3888 | |
| Tris-base | Sigma-aldrich | 77-86-1 | |
| Tris-Cl | Roche | 1185-53-1 | |
| Tryptone | VWR | 97063-390 | |
| Vortex | Scientific industries | Vortex-Genie 2 | Any brand should work. |
| WormLab system | MBF Bioscience | N/A | https://www.mbfbioscience.com/help/WormLab/Content/home.htm; https://www.mbfbioscience.com/products/wormlab/ |
| Wormpicker | Homemade | N/A | made with platinum and glass pipet tips |
Referanslar
- Audesirk, T. E. Chemoreception in Alphysia californica. Iii. Evidence for pheromones influencing reproductive behavior. Behav Biol. 20 (2), 235-243 (1977).
- Traynor, K. S., Le Conte, Y., Page, R. E. Queen and young larval pheromones impact nursing and reproductive physiology of honey bee (Apis mellifera) workers. Behav Ecol Sociobiol. 68 (12), 2059-2073 (2014).
- Cowley, J. J., Wise, D. R. Pheromones, growth and behaviour. Ciba Found Study Group. 35, 144-170 (1970).
- Epple, G. Pheromones in primate reproduction and social behavior. Adv Behav Biol. 11, 131-155 (1974).
- Levinson, H. Z. Possibilities of using insectistatics and pheromones in pest control. Naturwissenschaften. 62 (6), 272-282 (1975).
- Roelofs, W. Manipulating sex pheromones for insect suppression. Environ Lett. 8 (1), 41-59 (1975).
- Marchlewska-Koj, A. Pheromones and mammalian reproduction. Oxf Rev Reprod Biol. 6, 266-302 (1984).
- Keverne, E. B. Neuroendocrinology briefings 11: Pheromones and reproduction. J Neuroendocrinol. 12 (11), 1045-1046 (2000).
- Rekwot, P. I., Ogwu, D., Oyedipe, E. O., Sekoni, V. O. The role of pheromones and biostimulation in animal reproduction. Anim Reprod Sci. 65 (3-4), 157-170 (2001).
- Gomez-Diaz, C., Benton, R. The joy of sex pheromones. EMBO reports. 14 (10), 874-883 (2013).
- Shorey, H. H., Gaston, L. K., Jefferson, R. N. Insect sex pheromones. Adv Pest Control Res. 8, 57-126 (1968).
- Bruce, H. M. Pheromones and behavior in mice. Acta Neurol Psychiatr Belg. 69 (7), 529-538 (1969).
- Shorey, H. H., Bartell, R. J. Role of a volatile female sex pheromone in stimulating male courtship behaviour in Drosophila melanogaster. Anim Behav. 18 (1), 159-164 (1970).
- Bobadoye, B., et al. Evidence of aggregation-sex pheromone use by longhorned beetles (coleoptera: Cerambycidae) species native to Africa. Environ Entomol. 48 (1), 189-192 (2019).
- Saunders, J. R. Sex pheromones in bacteria. Nature. 275 (5682), 692-694 (1978).
- Schulz, S., Toft, S. Identification of a sex pheromone from a spider. Science. 260 (5114), 1635-1637 (1993).
- Finnegan, D. E., Chambers, J. Identification of the sex pheromone of the guernsey carpet beetle, Anthrenussarnicus mroczkowski (coleoptera: Dermestidae). J Chem Ecol. 19 (5), 971-983 (1993).
- Vaillancourt, L. J., Raudaskoski, M., Specht, C. A., Raper, C. A. Multiple genes encoding pheromones and a pheromone receptor define the b beta 1 mating-type specificity in Schizophyllum commune. Genetics. 146 (2), 541-551 (1997).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook : the online review of C. elegans biology. , 1-22 (2013).
- Sakai, N., et al. A sexually conditioned switch of chemosensory behavior in C. elegans. PLoS One. 8 (7), e68676 (2013).
- Sengupta, S., Smith, D. P., Mucignat-Caretta, C. How Drosophila detect volatile pheromones: signaling, circuits, and behavior. Neurobiology of chemical communication. , (2014).
- Zhang, Y. K., Reilly, D. K., Yu, J., Srinivasan, J., Schroeder, F. C. Photoaffinity probes for nematode pheromone receptor identification. Org Biomol Chem. 18 (1), 36-40 (2019).
- Aprison, E. Z., Ruvinsky, I. Dynamic regulation of adult-specific functions of the nervous system by signaling from the reproductive system. Curr Biol. 29 (23), 4116-4123.e3 (2019).
- Wan, X., et al. SRD-1 in AWA neurons is the receptor for female volatile sex pheromones in C. elegans males. EMBO Rep. 20 (3), e46288 (2019).
- Peckol, E. L., Troemel, E. R., Bargmann, C. I. Sensory experience and sensory activity regulate chemosensory receptor gene expression in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 98 (20), 11032-11038 (2001).
- Jang, H., et al. Neuromodulatory state and sex specify alternative behaviors through antagonistic synaptic pathways in. C. elegans. Neuron. 75 (4), 585-592 (2012).
- Liu, K. S., Sternberg, P. W. Sensory regulation of male mating behavior in Caenorhabditis elegans. Neuron. 14 (1), 79-89 (1995).
- Chasnov, J. R., Chow, K. L. Why are there males in the hermaphroditic species Caenorhabditis elegans. Genetics. 160 (3), 983-994 (2002).
- Chasnov, J. R., So, W. K., Chan, C. M., Chow, K. L. The species, sex, and stage specificity of a Caenorhabditis sex pheromone. Proc Natl Acad Sci U S A. 104 (16), 6730-6735 (2007).
- Susoy, V., et al. Natural sensory context drives diverse brain-wide activity during C. elegans mating. Cell. 184 (20), 5122-5137.e17 (2021).
- Barriere, A., Felix, M. A. High local genetic diversity and low outcrossing rate in Caenorhabditis elegans natural populations. Curr Biol. 15 (13), 1176-1184 (2005).
- Click, A., Savaliya, C. H., Kienle, S., Herrmann, M., Pires-Dasilva, A. Natural variation of outcrossing in the hermaphroditic nematode Pristionchus pacificus. BMC Evol Biol. 9, 75 (2009).
- Anderson, J. L., Morran, L. T., Phillips, P. C. Outcrossing and the maintenance of males within C. elegans populations. J Hered. 101 (suppl_1), S62-S74 (2010).
- Leighton, D. H., Choe, A., Wu, S. Y., Sternberg, P. W. Communication between oocytes and somatic cells regulates volatile pheromone production in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 111 (50), 17905-17910 (2014).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Fagan, K. A., et al. A single-neuron chemosensory switch determines the valence of a sexually dimorphic sensory behavior. Curr Biol. 28 (6), 902-914.e5 (2018).
- Lipton, J., Kleemann, G., Ghosh, R., Lints, R., Emmons, S. W. Mate searching in Caenorhabditis elegans: A genetic model for sex drive in a simple invertebrate. J Neurosci. 24 (34), 7427-7434 (2004).
- Frady, E. P., Palmer, C. R., Kristan, W. B. Sexual attraction: Sex-specific wiring of neural circuitry. Curr Biol. 22 (22), R953-R956 (2012).
- Liu, Q., et al. Two preputial gland-secreted pheromones evoke sexually dimorphic neural pathways in the mouse vomeronasal system. Front Cell Neurosci. 13, 455 (2019).
- Ludewig, A. H., et al. Pheromone sensing regulates Caenorhabditis elegans lifespan and stress resistance via the deacetylase sir-2.1. Proc Natl Acad Sci U S A. 110 (14), 5522-5527 (2013).
- Golden, J. W., Riddle, D. L. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Butcher, R. A., Fujita, M., Schroeder, F. C., Clardy, J. Small-molecule pheromones that control dauer development in Caenorhabditis elegans. Nat Chem Biol. 3 (7), 420-422 (2007).
- Jeong, P. Y., et al. Chemical structure and biological activity of the Caenorhabditis elegans dauer-inducing pheromone. Nature. 433 (7025), 541-545 (2005).
- Butcher, R. A., Ragains, J. R., Kim, E., Clardy, J. A potent dauer pheromone component in Caenorhabditis elegans that acts synergistically with other components. Proc Natl Acad Sci U S A. 105 (38), 14288-14292 (2008).
- Aprison, E. Z., Ruvinsky, I. Counteracting ascarosides act through distinct neurons to determine the sexual identity of C. elegans pheromones. Curr Biol. 27 (17), 2589-2599.e3 (2017).
- Aprison, E. Z., Ruvinsky, I. Sex pheromones of C. elegans males prime the female reproductive system and ameliorate the effects of heat stress. PLoS Genet. 11 (12), e1005729 (2015).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Kaplan, F., et al. Ascaroside expression in Caenorhabditis elegans is strongly dependent on diet and developmental stage. PLoS One. 6 (3), e17804 (2011).
- Pungaliya, C., et al. A shortcut to identifying small molecule signals that regulate behavior and development in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 106 (19), 7708-7713 (2009).
- Srinivasan, J., et al. A modular library of small molecule signals regulates social behaviors in Caenorhabditis elegans. PLoS Biol. 10 (1), e1001237 (2012).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Choe, A., et al. Ascaroside signaling is widely conserved among nematodes. Curr Biol. 22 (9), 772-780 (2012).
- Von Reuss, S. H., et al. Comparative metabolomics reveals biogenesis of ascarosides, a modular library of small-molecule signals in C. elegans. J Am Chem Soc. 134 (3), 1817-1824 (2012).
- Choe, A., et al. Sex-specific mating pheromones in the nematode panagrellus redivivus. Proc Natl Acad Sci U S A. 109 (51), 20949-20954 (2012).
- Hsueh, Y. P., Mahanti, P., Schroeder, F. C., Sternberg, P. W. Nematode-trapping fungi eavesdrop on nematode pheromones. Curr Biol. 23 (1), 83-86 (2013).
- Hong, M., et al. Early pheromone experience modifies a synaptic activity to influence adult pheromone responses of C. elegans. Curr Biol. 27 (20), 3168-3177.e3 (2017).
- Ryu, L., et al. Feeding state regulates pheromone-mediated avoidance behavior via the insulin signaling pathway in Caenorhabditis elegans. EMBO J. 37 (15), e98402 (2018).
- Diaz, S. A., Lindström, J., Haydon, D. T. Basic demography of Caenorhabditis remanei cultured under standard laboratory conditions. J Nematol. 40 (3), 167 (2008).
- Bargmann, C. I. Chemosensation in C. elegans. WormBook : the online review of C.elegans biology. , 1-29 (2006).
- Margie, O., Palmer, C., Chin-Sang, I. C. elegans chemotaxis assay. JoVE: J Vis Exp. (74), e50069 (2013).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır