Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Экстракция летучих половых феромонов и химиоаттракция у Caenorhabditis elegans
В этой статье
Резюме
Этот протокол устанавливает методы извлечения и количественной оценки ответов на летучий половой феромон у C. elegans, предоставляя инструменты для изучения химической коммуникации и траектории навигации.
Аннотация
Химическая коммуникация жизненно важна для здоровья организма, размножения и общего благополучия. Понимание молекулярных путей, нейронных процессов и вычислений, управляющих этими сигналами, остается активной областью исследований. Нематода Caenorhabditis elegans представляет собой мощную модель для изучения этих процессов, поскольку она продуцирует летучий половой феромон. Этот феромон синтезируется девственными самками или истощенными спермой гермафродитами и служит аттрактантом для самцов.
В этом протоколе подробно описан метод выделения летучего полового феромона из нескольких штаммов C. elegans (штамм WT N2, daf-22 и fog-2) и C. remanei. Мы также предоставляем протокол для количественной оценки мужской реакции хемотаксиса на летучий половой феромон. В нашем анализе используются такие измерения, как индекс хемотаксиса (C.I.), время прибытия (A.T.) и график траектории для точного сравнения реакций самцов в различных условиях. Этот метод позволяет проводить надежные сравнения между самцами с разным генетическим происхождением или стадиями развития. Кроме того, описанная здесь экспериментальная установка может быть адаптирована к исследованию других химических веществ хемопритяжения.
Введение
Взаимодействие между химической коммуникацией и репродуктивным успехом является фундаментальным принципом в животном царстве 1,2,3,4,5,6,7,8,9,10. Половые феромоны вызывают широкий спектр полового диморфизма, необходимого для поиска партнеров, координации шагов, связанных с поиском и привлечением партнера, и, в конечном итоге, способствуют размножению видов 11,12,13,14,15,16,17. Значительный прогресс был достигнут в понимании передачи сигналов феромонов, но молекулярные механизмы, нейронные цепи и вычислительные процессы, управляющие этими взаимодействиями, часто остаются неполностью определенными 18,19,20,21,22,23,24,25,26.
Нематода Caenorhabditis elegans представляет собой мощную модель для анализа этих вопросов. Примечательно, что C. elegans демонстрирует необычную репродуктивную стратегию — гермафродиты могут самооплодотворяться, а также скрещиваться с самцами 27,28,29,30,31,32,33. Такая гибкость требует надежной системы связи, сигнализирующей о репродуктивном статусе. C. elegans известен своими хорошо охарактеризованными водорастворимыми феромонами, аскарозидами, которые играют различные роли в развитии, поведении и социальных взаимодействиях. Недавние открытия выявили особый класс летучих половых феромонов, используемых нематодами. Эти феромоны специфически продуцируются половозрелыми самками C. elegans и C. remanei и истощенными спермой гермафродитами, служа аттрактантом для взрослых самцов 29,34,35. Этот аттрактант проявляет замечательный половой диморфизм в своем производстве и восприятии. Женская соматическая гонада управляет синтезом этого летучего полового феромона, и продукция динамически отражает репродуктивный статус, прекращаясь после спаривания и возобновляясь через несколько часов29,34.
Понимание коммуникации половых феромонов нематод дает представление об эволюции химических коммуникационных систем, взаимодействии между репродуктивным состоянием и поведением, а также о механизмах, лежащих в основе нейронной обработки полового диморфизма 24,26,36,37,38,39 . Исследования показывают, что амфидный нейрон AWA у самцов имеет решающее значение для обнаружения феромонов, при этом рецептор SRD-1, связанный с G-белком, играет ключевую роль в обнаружении феромонов у самцов24. C. elegans хорошо подходит для изучения химической коммуникации животных, особенно передачи сигналов половых феромонов, из-за его зависимости от обонятельной системы для поиска партнера. В то время как многое известно о передаче сигналов аскарозидами, летучая система половых феромонов предлагает уникальные возможности для сравнения 25,26,36,40,41,42,43,44,45,46,47,48,49,50,
51,52,53,54,55,56,57. Кроме того, C. elegans является мощным генетическим модельным организмом благодаря своему полностью секвенированному геному, четко определенной клеточной линии и хорошо охарактеризованным ольфакторным мутантам.
Тем не менее, полная нейронная схема, участвующая в обработке этого феромона, вычисления, которые переводят его восприятие в целевое поведение при поиске партнера, и регуляция его биосинтеза еще предстоит полностью выяснить. Дальнейшие исследования этих процессов имеют решающее значение для понимания различных механизмов, управляющих коммуникацией и репродуктивным поведением животных. Идентификация ключевых генов, участвующих в синтезе, секреции и восприятии феромонов, обещает открыть новых молекулярных игроков в коммуникации животных. Описанные здесь анализы дают основу для ответа на эти вопросы.
протокол
1. Экстракция сырых половых феромонов у самок и гермафродитов
- Протокол для синхронизации C. elegans
- Подготовка взрослых самок или гермафродитов
- Ежедневно контролируйте культуральные планшеты до тех пор, пока не появится большая популяция взрослых самок/гермафродитов и не истощится источники пищи OP50. Используя самок fog-2 C. elegans и WT C. remanei для экстракции сырых половых феромонов, готовят синхронизированные яйца от спаренных самок.
ПРИМЕЧАНИЕ: В этом протоколе мутантные животные C. elegans fog-2 XX, которые не производят собственный сперматозоид, называются самками C. elegans .
- Ежедневно контролируйте культуральные планшеты до тех пор, пока не появится большая популяция взрослых самок/гермафродитов и не истощится источники пищи OP50. Используя самок fog-2 C. elegans и WT C. remanei для экстракции сырых половых феромонов, готовят синхронизированные яйца от спаренных самок.
- Промывка и гранулирование червей
- Смойте взрослых червей со смешанной популяционной пластины буфером M9. Соберите суспензию червя в микроцентрифужную пробирку объемом 1,5 мл. Центрифугируйте при 1 500 × г в течение 0,5-1 минуты, чтобы гранулировать червей.
ПРИМЕЧАНИЕ: Предварительная очистка от сильного загрязнения (по желанию): Дайте червям осесть в трубке при сильном загрязнении. Выведите надосадочную жидкость пипеткой, чтобы удалить бактерии, и повторяйте, пока надосадочная жидкость не станет прозрачной.
- Смойте взрослых червей со смешанной популяционной пластины буфером M9. Соберите суспензию червя в микроцентрифужную пробирку объемом 1,5 мл. Центрифугируйте при 1 500 × г в течение 0,5-1 минуты, чтобы гранулировать червей.
- Отбеливание
- Добавьте 200 мкл буфера M9 в гранулу червя. Приготовьте буфер для лизиса, смешав бытовой отбеливатель и 1 М NaOH в соотношении 1:1. Добавьте в смесь 500 μл этого буфера для лизиса, сделайте вихрь в течение 10 с, а затем сделайте паузу для контроля состояния лизиса под рассекающим микроскопом. Повторите этот процесс в течение 10 с вихрей с последующим наблюдением до тех пор, пока взрослые черви полностью не лизируются.
- Прекращение обесцвечивания и гранулирования эмбрионов
- Когда взрослые черви лизируются на мелкие фрагменты (но не полностью растворяются), немедленно добавьте 500 мкл буфера M9, чтобы замедлить реакцию. Центрифуга при 15 000 × г в течение 30-60 с для гранулирования эмбрионов.
ПРИМЕЧАНИЕ: Чрезмерный лизис может повредить эмбрионы. Прекращают реакцию, когда тела взрослых червей распались на мелкие фрагменты. Лизис продолжается на этапах центрифуги и промывки до тех пор, пока не будет удален весь буфер для лизиса.
- Когда взрослые черви лизируются на мелкие фрагменты (но не полностью растворяются), немедленно добавьте 500 мкл буфера M9, чтобы замедлить реакцию. Центрифуга при 15 000 × г в течение 30-60 с для гранулирования эмбрионов.
- Промойте эмбрионы 5 раз 1 мл буфера M9, центрифугируя при 15 000 × г в течение 30-60 с после каждой промывки. Удалите надосадочную жидкость после центрифугирования.
- Синхронизация
- Ресуспендируйте эмбрионы в 800 мкл буфера M9 в микроцентрифужной пробирке объемом 1,5 мл. Вращайте трубку при температуре 20 °C в течение 12-15 часов для вылупления L1 и остановки червей на стадии L1 из-за отсутствия корма. Выпускайте и культивируйте червей при температуре 20°C в течение 3 дней, пока они не достигнут стадии L4.
- Подготовка взрослых самок или гермафродитов
2. Экстракция грубых половых феромонов у однодневных девственниц (Рисунок 1А)
ПРИМЕЧАНИЕ: Мы принимаем ранее установленный протокол24 для извлечения половых феромонов из однодневных мутантных самок C. elegans (феминизация зародышевой линии) и самок WT C. remanei.
- Подготовка взрослых самок
- Отберите и изолируйте около 200 самок стадии L4 fog-2 за 1 день до экстракции феромонов. Чтобы убедиться, что собраны только девственные самки, тщательно разделите этих самок L4 fog-2 по полу и распределите их по трем отдельным пластинам OP50 NGM диаметром 6 см. Поместите небольшое количество бактерий OP50 в центр каждой тарелки.
ПРИМЕЧАНИЕ: Распределите 200 женских червей L4 по трем отдельным пластинам, чтобы избежать риска случайного попадания самца червя в тарелку. Если выбрать самца, он, скорее всего, будет спариваться со многими самками, в результате чего большинство самок оплодотворяются на следующий день, когда они становятся взрослыми. Оплодотворенные самки не выделяют летучие половые феромоны до тех пор, пока сперматозоиды не будут исчерпаны, что влияет на результаты экстракции. Ограниченный источник пищи ограничивает гермафродитов меньшей площадью в центре пластины, сводя к минимуму вероятность побега из пластины в период изоляции.
- Отберите и изолируйте около 200 самок стадии L4 fog-2 за 1 день до экстракции феромонов. Чтобы убедиться, что собраны только девственные самки, тщательно разделите этих самок L4 fog-2 по полу и распределите их по трем отдельным пластинам OP50 NGM диаметром 6 см. Поместите небольшое количество бактерий OP50 в центр каждой тарелки.
- Процесс экстракции
- В день экстракции (день 1 репродуктивной зрелости, через 3 дня после того, как черви были освобождены от остановки L1) отоберите и изолируйте 100 девственных самок Fog-2 в микроцентрифужную пробирку, содержащую 1 мл буфера M9. Промойте самок 5 раз буфером M9, чтобы свести к минимуму бактериальное загрязнение, и инкубируйте их в 100 мкл буфера M9 в течение 6 часов при 20 °C, чтобы обеспечить выработку и накопление феромонов в среде.
- Аналогичный процесс экстракции проведите для самок C. remanei , используя только 15-20 самок стадии L4, выделенных за день до экстракции, на три планшета, а на следующий день инкубируйте пять девственных самок в 100 мкл буфера M9 в течение 6 ч при 25 °C (оптимальная температура роста для C. remanei)58.
Примечание: Самки C. remanei вырабатывают большее количество летучих половых феромонов по сравнению с самками C. elegans . Таким образом, всего пяти самок достаточно для извлечения 100 μл сырого летучего полового феромона.
- Хранение
- Центрифугируйте образцы при давлении 15 000 × г в течение 30-60 с для гранулирования червей. Осторожно переложите надосадочную жидкость (содержащую феромоны) в чистую пробирку и выбросьте пробирку, содержащую гранулу червя. Храните выделенную надосадочную жидкость для последующих анализов химиоаттракции.
ПРИМЕЧАНИЕ: Сырой экстракт летучих половых феромонов можно хранить не менее 1 года при температуре -80 °C в микроцентрифужной пробирке, обернутой парапленкой, чтобы свести к минимуму испарение.
- Центрифугируйте образцы при давлении 15 000 × г в течение 30-60 с для гранулирования червей. Осторожно переложите надосадочную жидкость (содержащую феромоны) в чистую пробирку и выбросьте пробирку, содержащую гранулу червя. Храните выделенную надосадочную жидкость для последующих анализов химиоаттракции.
- Контроль качества
- Перед использованием экстракта проведите тест контроля качества с использованием самцов N2 или самцов him-5 для проверки его хемопривлекательности (см. раздел 4).
3. Большое количество грубого извлечения половых феромонов из 6-дневных девственных гермафродитов (Рисунок 1А)
- Червеобразная культура
- Чтобы получить приблизительно 20 мл сырого полового феромона C. elegans , синхронизируйте двадцать 10-сантиметровых NGM-планшетов, содержащих здоровых взрослых червей C. elegans (мутант N2 или daf-22 ), используя вышеупомянутый протокол отбеливания, а затем промойте их 5 раз буфером M9.
ПРИМЕЧАНИЕ: Этот процесс подготавливает достаточное количество эмбрионов для экстракции феромонов. N2: Стандартный штамм WT C. elegans , который продуцирует как водорастворимые аскарозидные феромоны, так и неаскарозидные летучие половые феромоны. Мутант daf-22 : Мутант, лишенный способности продуцировать большое количество аскарозидных феромонов, что делает его полезным для изучения неаскарозидных летучих половых феромонов в изоляции. - Чтобы синхронизировать червей на стадии L1, поворачивайте эмбрионы в буфере M9 в течение 12-15 часов, чтобы остановить развитие. Перенесите остановленных червей L1 в 10-сантиметровые культуральные планшеты NGM, засеянные бактериями OP50 для роста и развития.
- Чтобы свести к минимуму присутствие самцов на гермафродитных пластинах, проверьте пластины через 2 дня после выпуска червей, на стадии L4, и удалите всех наблюдаемых самцов (очень редко).
- После трех дней развития обратите внимание на появление эмбрионов, указывающее на то, что черви стали репродуктивно зрелыми взрослыми особями.
Примечание: мутантные самкиfog-2 C. elegans и самки WT C. remanei непригодны для экстракции объемных летучих половых феромонов. Мутанты fog-2 C. elegans и C. remanei имеют высокую долю самцов в своих популяциях, и самцы постоянно спариваются с самками. Оплодотворенные самки не вырабатывают летучие половые феромоны. Мужское присутствие осложняет экстракцию этих соединений.
- Чтобы получить приблизительно 20 мл сырого полового феромона C. elegans , синхронизируйте двадцать 10-сантиметровых NGM-планшетов, содержащих здоровых взрослых червей C. elegans (мутант N2 или daf-22 ), используя вышеупомянутый протокол отбеливания, а затем промойте их 5 раз буфером M9.
- Промывание гельминтов и отделение эмбрионов
- Повторно промойте эмбрионы буфером M9 и дайте им осесть (1 г осаждения), пока большая часть взрослых особей не окажется на дне пробирки; Повторите 5-7 раз. Дайте микроцентрифужным пробиркам спокойно отстояться на решетке в течение нескольких минут, чтобы облегчить осаждение взрослых червей и обеспечить отделение популяции взрослых червей от эмбрионов, которые остаются во взвешенном состоянии в надосадочной жидкости.
- Пипетируйте отделенные взрослые особи и перенесите их на новые планшеты NGM, засеянные OP50.
- Повторяйте этот процесс промывания в течение 5-6 дней, чтобы истощить собственную сперму.
ПРИМЕЧАНИЕ: Для извлечения летучих половых феромонов используйте гермафродитов, возраст которых составляет 5-6 дней. Это время гарантирует, что их собственная сперма, скорее всего, будет исчерпана, поскольку гермафродиты с доступными собственными сперматозоидами не производят летучие половые феромоны. Многочисленные мертвые или невылупившиеся эмбрионы на планшете к 5 или 6 дню указывают на подходящее время для начала экстракции феромонов.
- Экстракция половых феромонов
- Извлеките половой феромон, как описано в разделе 1, с изменениями.
- Вместо добавления 100 самок C. elegans на 100 μл добавьте буфер M9 в зависимости от конечного объема гранул червя. Добавьте 1 мл буфера M9 на 50 мкл упакованных червей.
- Контроль качества и гомогенизация
- Контрольные испытательные партии экстрагированного феромона с использованием хемоаттракционного анализа с самцами N2 или самцами him-5 (см. раздел 4).
- Смешайте все партии, чтобы получить однородный сырой летучий половой феромон для экспериментов, требующих большого количества феромонов, таких как скрининг или микрофлюидные эксперименты. Храните сырой экстракт половых феромонов не менее 1 года при температуре -80 °C в пробирках объемом 50 мл, обернутых парапленкой, чтобы свести к минимуму испарение.
- Метод титрования на основе хемоаттракционного анализа для стандартизации экстракта сырых половых феромонов
- Проведите анализ титрования, протестировав серийные разведения каждого экстракта феромонов на самцах WT N2 и HIM-5 C. elegans. Определите самую высокую степень разведения (самую низкую концентрацию), которая неизменно вызывает устойчивый и воспроизводимый ответ хемотаксиса у контрольных штаммов.
- Приготовьте серию разведений из каждого сырого экстракта (например, 1:2, 1:4, 1:8 и т.д.) в буфере M9.
- Анализы хемотаксиса
- Проводите стандартизированные анализы хемотаксиса (см. раздел 4) с использованием каждого разведения на референсном штамме самцов. Выполните три повторения, чтобы обеспечить воспроизводимость. Сравните оптимальные разведения в разных партиях экстракции, чтобы оценить постоянство концентрации феромонов.
ПРИМЕЧАНИЕ: Это устанавливает точку отсчета для оценки биологической активности каждого экстракта. В стандартном анализе хемоаттракции на половые феромоны исходные неразбавленные экстракты будут использоваться для последующих экспериментов, при этом титрование будет служить этапом контроля качества для обеспечения постоянной активности феромонов между партиями. Ряд разведения может быть скорректирован в зависимости от конкретных экспериментальных потребностей. Учитывая, что стандартный протокол экстракции стабильно дает насыщенные сырые феромонные экстракты, тест на титрование для стандартизации экстракта может не потребоваться для большинства экспериментов. Рекомендуется использовать одну и ту же партию сырого полового феромона на протяжении всего ряда связанных экспериментов для поддержания согласованности и минимизации вариабельности активности феромонов.
- Проводите стандартизированные анализы хемотаксиса (см. раздел 4) с использованием каждого разведения на референсном штамме самцов. Выполните три повторения, чтобы обеспечить воспроизводимость. Сравните оптимальные разведения в разных партиях экстракции, чтобы оценить постоянство концентрации феромонов.
4. Анализ хемоаттракции летучих половых феромонов
ПРИМЕЧАНИЕ: Хемоаттракционный анализ летучих половых феромонов был адаптирован из ранее установленных методов, использованных в других исследованиях хемоаттракции 24,29,59,60,61. Эти модификации были реализованы для оптимизации чувствительности и специфичности анализа для обнаружения ответов на летучие половые феромоны. Такой индивидуальный подход повышает применимость анализа к конкретным исследовательским потребностям.
- Ежедневно наблюдайте за культуральными пластинами до тех пор, пока взрослые самки/гермафродиты не станут в изобилии. Здоровье червей влияет на их реакцию на половые феромоны.
- Подготовка из него-5 самцов
- Используйте стандартный протокол отбеливания для синхронизации червей him-5 . После синхронизации промойте червей 5 раз буфером M9. Изолировать самцов L4 за день до проведения анализа; Затем перенесите однодневных взрослых самцов червей из их посевных тарелок и промойте их в буфере M9 перед анализом. Поместите их на незасеянные планшеты NGM перед анализом, чтобы устранить остаточные бактерии и предотвратить помехи от пищи во время анализа.
ПРИМЕЧАНИЕ: Не морите червей голодом более чем за час до проведения анализа, так как это может изменить их внутреннее состояние и повлиять на результаты анализа хемоаттракции на половые феромоны. Поэтому, если вы намерены проводить более 10 анализов в течение одного дня, заменяйте образцы на червей каждый час. Более того, чередуйте один экспериментальный анализ и один контрольный анализ многократно.
- Используйте стандартный протокол отбеливания для синхронизации червей him-5 . После синхронизации промойте червей 5 раз буфером M9. Изолировать самцов L4 за день до проведения анализа; Затем перенесите однодневных взрослых самцов червей из их посевных тарелок и промойте их в буфере M9 перед анализом. Поместите их на незасеянные планшеты NGM перед анализом, чтобы устранить остаточные бактерии и предотвратить помехи от пищи во время анализа.
- Приготовление пластин для хемоаттракционного агарового анализа
- Приготовьте планшеты для хемоаттракционного анализа с 1,5% агаром, 25 мМ NaCl, 1,5 мМ трис-основанием и 3,5 мМ Tris-Cl, как описано в соответствующей литературе24.
- Нагрейте агар в растворе хемоаттракции с помощью микроволновой печи до полного растворения. Дайте раствору остыть при комнатной температуре в течение 5 минут.
- С помощью пипетки равномерно распределите раствор хемоаттракционного агара по чашкам Петри: налейте по 30 мл в каждую чашку диаметром 10 см и по 20 мл в каждую чашку диаметром 6 см.
- После того, как раствор хемоаттракционного агара вылился в чашки Петри, оставьте крышки открытыми в чистом месте не менее чем на 40 минут, чтобы поверхность агара немного подсохла. Как только поверхность высохнет, закройте крышки.
ПРИМЕЧАНИЕ: Время сушки может варьироваться в зависимости от влажности и температуры лабораторной среды.
- Хранение планшетов и подготовка к анализу
- Упакованные пробирные пластины упакуйте и храните в холодном помещении до 1 недели. Перед использованием достаньте пластины из холодильника и дайте им акклиматизироваться до комнатной температуры более часа. Откройте крышки, чтобы остаточная влага испарилась из агара за 20 минут до анализа в чистом месте, убедившись, что на поверхности нет очевидной воды перед проведением анализа.
- Дизайн эксперимента и хемоаттракционный анализ
- Чтобы провести хемоаттракционный анализ, отметьте три отдельных пятна на крышке и нижней стороне чашки Петри или используйте шаблон, распечатанный на прозрачной пластиковой бумаге, помещенной под чашку или прикрепленной к препарирующему микроскопу. Эти маркировки включают среднюю точку (•) в качестве отправной точки для червей, знак плюс (+) для экспериментального пятна (2 мкл полового феромона на крышке и 2 мкл 1 М азида натрия на пластине) и знак минус (-) для контрольного пятна (2 мкл буфера M9 на крышке и 2 мкл 1 М азида натрия) (рис. 2A). Отрегулируйте расстояние между этими отметками в соответствии с размером чашки и конкретными экспериментальными потребностями. Как правило, для 6-сантиметровых чашек Петри устанавливают фиксированное расстояние 1,5 см от начальной точки до каждого исследуемого вещества для положительных контрольных тестов.
- Подробные инструкции по проведению анализа (Рисунок 2)
- Нанесите 2 мкл 1 М азида натрия на каждую экспериментальную и контрольную точку на планшете.
- Соберите 20 здоровых и свободно передвигающихся самцов червей с помощью червечника. Одновременно выпустите 20 червей-самцов в начальной точке под препарирующим микроскопом.
- Быстро добавьте 2 мкл полового феромона и 2 мкл буфера М9 в экспериментальные и контрольные точки на крышке соответственно.
- Аккуратно закройте крышку и поместите пластину для анализа в тихое, стабильное по температуре место рядом с микроскопом.
- Через 30 минут оцените анализ, подсчитав количество червей в каждом месте.
ПРИМЕЧАНИЕ: Процесс сбора 20 червей не должен превышать 1-2 минуты, чтобы предотвратить высыхание и ухудшение здоровья ранее собранных червей, что может повлиять на результаты. Весь процесс от сбора самцов до закрытия крышки должен занять от 2 до 5 минут.
- Скрининг с положительным контролем
- Протестируйте самцов червей на 1000-кратном разбавлении раствора диацетила (растворенного в 10% этаноле и 90% буфере M9), чтобы подтвердить их реакцию на хемотаксис. Оцените результаты хемоаттракционного анализа через 30 минут после начала теста. Оцените червей, парализованных в назначенных местах, в зависимости от их местоположения: «C» для тех, кто находится в контрольной точке, и «E» для тех, кто находится в экспериментальной точке. Оцените червей ни в одном из этих мест как 'N' (Рисунок 2C).
- Чтобы вычислить индекс химиопритяжения (ИП), используйте следующую формулу:
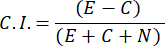
- Отбирайте только мужские образцы с индексом хемотаксиса ≥ 0,4 (C.I., см. рисунок 2C). Используйте самца из той же партии для последующего теста на половые феромоны.
ПРИМЕЧАНИЕ: Проведите три отдельных анализа, в каждом из которых задействовано 20 червей, чтобы обеспечить согласованность и надежность экспериментальных результатов. Трех анализов обычно достаточно для вывода о консистенции.
5. Рекомендации по срокам и подсчету баллов для анализа хемоаттракции
- Оцените реакцию хемоаттракции червей на основе их конечного местоположения. Подсчитайте количество червей в каждом месте в конце анализа, обычно через 30 минут после его начала.
ПРИМЕЧАНИЕ: Использование азида натрия в экспериментальных и контрольных точках парализует прибывающих червей, способствуя точному подсчету баллов. Большинство самцов WT N2 и him-5 способны локализовать источник феромонов в течение 6-8 мин в пластине толщиной 6 см с расстоянием 1,5 см. - Для выявления дефектов с эффективностью хемотаксиса, особенно для обнаружения малозаметных дефектов, рассмотрите возможность мониторинга анализа через равные промежутки времени в 3-5 минут.
ПРИМЕЧАНИЕ: Такое частое наблюдение позволяет документально зафиксировать время, в которое черви прибывают в места испытаний. Такое детальное отслеживание может выявить случаи, когда черви демонстрируют сниженную эффективность хемотаксиса, но все же умудряются достичь тестовой точки в пределах окна исследования.
6. Необязательные модификации
- Для более точной оценки хемотаксиса используйте камеру, расположенную над планшетом, чтобы записывать траектории червей на протяжении всего анализа.
Примечание: Эта модификация позволяет проводить всесторонний анализ их движений, обеспечивая более глубокое понимание хемопритягательного поведения и траектории (Рисунок 3).
7. Анализ данных
- Оценка и расчет Индекса ХемоАттракции (C.I.)
- Выполните шаги 4.7.1 и 4.7.2.
- График времени прибытия
- Для более полного анализа анализов хемоаттракции рассмотрите возможность мониторинга анализа с интервалом в 3-5 минут или использования камеры, расположенной над планшетом, для записи траекторий червей на протяжении всего анализа.
Примечание: Эти подходы позволяют не только оценить время прибытия червей в проектные точки, но и сравнить среднее время прибытия и проанализировать распределение этого времени.
- Для более полного анализа анализов хемоаттракции рассмотрите возможность мониторинга анализа с интервалом в 3-5 минут или использования камеры, расположенной над планшетом, для записи траекторий червей на протяжении всего анализа.
- Видеоанализ траекторий и визуализация данных
ПРИМЕЧАНИЕ: Для анализа моделей движения C. elegans Во время анализов хемоаттракции записывайте и извлекайте траектории (см. Таблица материалов) и дальнейший анализ (Рисунок 3).- Настройте систему записи.
- Запустите новую запись и откройте окно настроек записи .
- Определите желаемые параметры записи:
- Префикс файла: выберите описательное имя для видеофайлов (например, "experiment1_").
- Частота кадров (FPS): выберите подходящие кадры в секунду для съемки движения червя (например, 7,5 FPS для червей на агаровой пластине и 30 FPS для плавающих червей).
- Продолжительность: Установите продолжительность записи в секундах (например, 1 800 с [30 мин] для объемного хемоаттракционного анализа).
- Оптимизируйте качество изображения: отрегулируйте интенсивность освещения, чтобы черви были хорошо видны на фоне, и настройте фокус, чтобы получить четкое изображение червей.
- Чтобы подготовить пробирную пластину, сначала нанесите контрольный раствор на обозначенную контрольную точку. Затем осторожно возьмите червя (червей) и осторожно отпустите их на центр пластины. Как только черви осядут, нанесите раствор полового феромона в назначенное экспериментальное место.
- Расположите пластину: Осторожно поместите пластину с червями в центр поля записи, чтобы максимально увеличить область захвата.
- Чтобы уменьшить стресс для червей во время анализа хемотаксиса, рассмотрите следующие два подхода.
- Для анализа с одним червем поместите червя на пластину для анализа и дайте ему акклиматизироваться в течение 5 минут, прежде чем вводить раствор полового феромона на указанное расстояние (положение, основанное на текущем местоположении червя).
ПРИМЕЧАНИЕ: Это сводит к минимуму обработку и дает червю время для адаптации к новой среде. - Объемный хемоаттракционный анализ: Дайте червям осесть и рассейтесь естественным образом на тарелке в течение 5 минут. По истечении этого периода акклиматизации введите раствор феромонов в обозначенное фиксированное положение. Во время поствидеоанализа измерьте начальное расстояние каждого червя от феромона и сгруппируйте их соответствующим образом для дальнейшего анализа.
- Для анализа с одним червем поместите червя на пластину для анализа и дайте ему акклиматизироваться в течение 5 минут, прежде чем вводить раствор полового феромона на указанное расстояние (положение, основанное на текущем местоположении червя).
- Порядок проведения анализа видео
- Импорт и настройка: Импортируйте записанное видео в программу. Настройте информацию о последовательности (например, частоту кадров); Укажите масштаб изображения (пиксели на единицу измерения).
- Настройка изображения: Чтобы оптимизировать обнаружение червей, отрегулируйте порог обнаружения до тех пор, пока зеленая метка не будет четко очерчивать червей без захвата фонового шума или артефактов. Кроме того, примените алгоритмы сглаживания фона для уменьшения шума и неровностей на изображении, усиливая контраст между червями и фоном. Экспериментируйте с различными уровнями сглаживания, чтобы найти оптимальный баланс между снижением шума и сохранением деталей червяка.
ПРИМЕЧАНИЕ: Идеальный порог должен охватывать большую часть тела каждого червя, исключая при этом посторонние элементы. - Оптимизация параметров обнаружения: выберите репрезентативного червя для автоматического создания параметров обнаружения. Проверьте точность обнаружения, визуально изучив 5–10 случайных кадров. Если обнаружение неудовлетворительно, уточните параметры обнаружения вручную, при необходимости вернитесь к настройкам настройки изображения и перейдите к отслеживанию, как только обнаружение станет надежным.
- Корректура и исправление траекторий отслеживания: После завершения автоматизированного процесса отслеживания выполните ручную корректуру сгенерированных траекторий. Если во время корректуры обнаружены несоответствия, воспользуйтесь функцией исправления для коррекции траектории и выполните следующие операции: Соединить: соединить сегменты траектории, которым неправильно присвоены разные идентификаторы, но которые принадлежат одному и тому же лицу. Разделение: отдельные сегменты траектории, которым ошибочно присвоен один и тот же идентификатор, но которые принадлежат разным особям.
ПРИМЕЧАНИЕ: Цель состоит в том, чтобы гарантировать, что каждый уникальный идентификатор (номер) последовательно присваивается одному и тому же лицу на протяжении всего периода отслеживания.
Пример: Если червь помечен как "3" на определенный период, а затем неправильно помечен как "7" на последующий период, функция восстановления объединит эти два сегмента под идентификатором "3". И наоборот, если два червя помечены как «12» в течение определенного периода, функция восстановления разделит этот сегмент на две отдельные траектории, каждая из которых имеет уникальный идентификатор. Благодаря тщательной корректуре и проведению необходимых ремонтных работ точность и надежность данных отслеживания могут быть значительно улучшены. - Визуализация и экспорт результатов: Используйте программное обеспечение для визуализации и базового анализа. Экспортируйте данные в виде файлов CSV для дальнейшего анализа с помощью предпочитаемых инструментов или кода. Этот метод предоставляет базовый код (см. https://github.com/edmondztt/pheromone-traj-analysis.git) для визуализации траектории движения червя на основе пяти ключевых параметров (рис. 3). Время: Последовательность траектории, обозначенная цветом для обозначения течения времени с начала эксперимента. Расстояние до феромона: расстояние между червем и источником феромонов в каждой временной точке. Скорость: скорость червя в каждой точке, которая также указывает на события поворота и остановки. Прямолинейность: Насколько прям путь червя. Правильность направления: Насколько движение червя соответствует направлению феромонной цели? Этот код обеспечивает базовую визуализацию для понимания поведения червей и может быть настроен и расширен для более глубокого анализа.
Примечание: Этот усовершенствованный подход представляет собой комплексную альтернативу традиционному индексу хемоаттракции, детализируя траекторию навигации червя в ответ на половые феромоны. Это позволяет понять закономерности движения, не полагаясь на произвольные конечные точки навигации и определения временного окна, предлагая более глубокое понимание поведенческой динамики анализа. Данные были усреднены по 20 кадрам, которые могут быть скорректированы в зависимости от конкретных экспериментальных потребностей, чтобы отфильтровать движения, вызванные скручиванием тела.
Результаты
Траекторный анализ дефектного штамма восприятия летучих половых феромонов в анализе хемоаттракции
Этот анализ хемоаттракции надежно дифференцирует дикий тип и мутантные штаммы C. elegans в их реакции на летучие половые феромоны. Успешные эксперименты с ...
Обсуждение
Этот протокол обеспечивает надежную методологию экстракции летучих половых феромонов из C. elegans, а также создание надежного анализа хемоаттракции для измерения реакций самцов на хемоаттракцию. Дополнительную информацию можно найти в руководстве пользователя Wor...
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Мы благодарны доктору Тинтао Чжоу за разработку и написание кода для визуализации траекторий, использованных в нашем анализе. Эта работа была поддержана финансированием: R01 NS113119 (PWS), стипендией Чэня для старших постдоков и Институтом неврологии Тяньцяо и Крисси Чен.
Материалы
| Name | Company | Catalog Number | Comments |
| 10 cm Petri dishes | Falcon | 25373-100 | Falcon bacteriological Petri dish 100 x 15 mm |
| 6 cm Petri dishes | Falcon | 25373-085 | Falcon bacteriological Petri dish 60 x 15 mm |
| C. remanei (EM464) | CGC | ||
| Centrifuge | Eppendorf | centrifuge 5418 | Any brand should work. |
| Chemoattraction assay plates | Homemade solution | N/A | 1.5% agar, 25 mM NaCl, 1.5 mM Tris-base, and 3.5 mM Tris-Cl |
| Cholesterol | Alfa Aesar | 57-88-5 | |
| Dissecting Microscope | Leica | LeicaMZ75 | Any brand should work. |
| E. Coli OP50 | CGC | ||
| Ethanol | Koptec | 64-17-5 | |
| fog-2(q71) (JK574) | CGC | ||
| him-5(e1490)(CB4088) | CGC | ||
| Household bleach | Clorox Germicidal bleach concentrated | Bleach | |
| M9 buffer | Homemade solution | N/A | 3 g KH2PO4, 11.3 g Na2HPO4.7H2O, 5 g NaCl, H2O to 1 L. Sterilize by autoclaving. Add 1 mL 1 M MgSO4 after cool down to room temperature. |
| Magnesium Sulfate, Anhydrous, Powder | Macron | M1063-500GM-EA | |
| Microwave | TOSHIBA | N/A | Any brand should work. |
| N2 | CGC | ||
| NaOH | Sigma-aldrich | S318-3 | 1 M |
| NGM plates solution | Homemade solution | N/A | 2.5 g Peptone, 18 g agar, 3 g NaCl, H2O to 1 L.Sterilize by autoclaving. Once the autoclave is done (2 h), wait until the temperature of the medium drops to 65 °C. Put on a hotplate at 65 °C and stir. Then add the following, waiting 5 min between each to avoid crystallization: 1 mL CaCl2 (1 M), 1 mL MgSO4 (1 M), 25 mL K3PO4 (1 M, pH=6), 1 mL Cholesterol ( 5 mg/mL in ethanol). |
| Parafilm | Bemis | 13-374-10 | Bemis Parafilm M Laboratory Wrapping Film |
| Peptone | VWR | 97063-324 | |
| Pipet- aid | Drummond Scientific | 4-000-100 | Any brand should work. |
| Plastic paper | Octago | Waterproof Screen Printing Inkjet Transparency Film | https://www.amazon.com/Octago-Waterproof-Transparency-Printing-Printers/dp/B08HJQWFGD |
| Potassium chloride | Sigma-aldrich | SLBP2366V | |
| Potassium phosphate | Spectrum | 7778-77-0 | |
| Pipette | Eppendorf | SKU: EPPR4331; MFG#: 2231300006 | 20 - 200 µL, 100 - 1000 µL, any brand should work. |
| Rotator | Labnet | SKU: LI-H5500 | Labnet H5500 Mini LabRoller with Dual Direction Rotator. Any brand should work. |
| Sodium chloride | VWR | 7647-14-5 | |
| sodium phosphate dibasic | Sigma-aldrich | SLCG3888 | |
| Tris-base | Sigma-aldrich | 77-86-1 | |
| Tris-Cl | Roche | 1185-53-1 | |
| Tryptone | VWR | 97063-390 | |
| Vortex | Scientific industries | Vortex-Genie 2 | Any brand should work. |
| WormLab system | MBF Bioscience | N/A | https://www.mbfbioscience.com/help/WormLab/Content/home.htm; https://www.mbfbioscience.com/products/wormlab/ |
| Wormpicker | Homemade | N/A | made with platinum and glass pipet tips |
Ссылки
- Audesirk, T. E. Chemoreception in Alphysia californica. Iii. Evidence for pheromones influencing reproductive behavior. Behav Biol. 20 (2), 235-243 (1977).
- Traynor, K. S., Le Conte, Y., Page, R. E. Queen and young larval pheromones impact nursing and reproductive physiology of honey bee (Apis mellifera) workers. Behav Ecol Sociobiol. 68 (12), 2059-2073 (2014).
- Cowley, J. J., Wise, D. R. Pheromones, growth and behaviour. Ciba Found Study Group. 35, 144-170 (1970).
- Epple, G. Pheromones in primate reproduction and social behavior. Adv Behav Biol. 11, 131-155 (1974).
- Levinson, H. Z. Possibilities of using insectistatics and pheromones in pest control. Naturwissenschaften. 62 (6), 272-282 (1975).
- Roelofs, W. Manipulating sex pheromones for insect suppression. Environ Lett. 8 (1), 41-59 (1975).
- Marchlewska-Koj, A. Pheromones and mammalian reproduction. Oxf Rev Reprod Biol. 6, 266-302 (1984).
- Keverne, E. B. Neuroendocrinology briefings 11: Pheromones and reproduction. J Neuroendocrinol. 12 (11), 1045-1046 (2000).
- Rekwot, P. I., Ogwu, D., Oyedipe, E. O., Sekoni, V. O. The role of pheromones and biostimulation in animal reproduction. Anim Reprod Sci. 65 (3-4), 157-170 (2001).
- Gomez-Diaz, C., Benton, R. The joy of sex pheromones. EMBO reports. 14 (10), 874-883 (2013).
- Shorey, H. H., Gaston, L. K., Jefferson, R. N. Insect sex pheromones. Adv Pest Control Res. 8, 57-126 (1968).
- Bruce, H. M. Pheromones and behavior in mice. Acta Neurol Psychiatr Belg. 69 (7), 529-538 (1969).
- Shorey, H. H., Bartell, R. J. Role of a volatile female sex pheromone in stimulating male courtship behaviour in Drosophila melanogaster. Anim Behav. 18 (1), 159-164 (1970).
- Bobadoye, B., et al. Evidence of aggregation-sex pheromone use by longhorned beetles (coleoptera: Cerambycidae) species native to Africa. Environ Entomol. 48 (1), 189-192 (2019).
- Saunders, J. R. Sex pheromones in bacteria. Nature. 275 (5682), 692-694 (1978).
- Schulz, S., Toft, S. Identification of a sex pheromone from a spider. Science. 260 (5114), 1635-1637 (1993).
- Finnegan, D. E., Chambers, J. Identification of the sex pheromone of the guernsey carpet beetle, Anthrenussarnicus mroczkowski (coleoptera: Dermestidae). J Chem Ecol. 19 (5), 971-983 (1993).
- Vaillancourt, L. J., Raudaskoski, M., Specht, C. A., Raper, C. A. Multiple genes encoding pheromones and a pheromone receptor define the b beta 1 mating-type specificity in Schizophyllum commune. Genetics. 146 (2), 541-551 (1997).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook : the online review of C. elegans biology. , 1-22 (2013).
- Sakai, N., et al. A sexually conditioned switch of chemosensory behavior in C. elegans. PLoS One. 8 (7), e68676 (2013).
- Sengupta, S., Smith, D. P., Mucignat-Caretta, C. How Drosophila detect volatile pheromones: signaling, circuits, and behavior. Neurobiology of chemical communication. , (2014).
- Zhang, Y. K., Reilly, D. K., Yu, J., Srinivasan, J., Schroeder, F. C. Photoaffinity probes for nematode pheromone receptor identification. Org Biomol Chem. 18 (1), 36-40 (2019).
- Aprison, E. Z., Ruvinsky, I. Dynamic regulation of adult-specific functions of the nervous system by signaling from the reproductive system. Curr Biol. 29 (23), 4116-4123.e3 (2019).
- Wan, X., et al. SRD-1 in AWA neurons is the receptor for female volatile sex pheromones in C. elegans males. EMBO Rep. 20 (3), e46288 (2019).
- Peckol, E. L., Troemel, E. R., Bargmann, C. I. Sensory experience and sensory activity regulate chemosensory receptor gene expression in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 98 (20), 11032-11038 (2001).
- Jang, H., et al. Neuromodulatory state and sex specify alternative behaviors through antagonistic synaptic pathways in. C. elegans. Neuron. 75 (4), 585-592 (2012).
- Liu, K. S., Sternberg, P. W. Sensory regulation of male mating behavior in Caenorhabditis elegans. Neuron. 14 (1), 79-89 (1995).
- Chasnov, J. R., Chow, K. L. Why are there males in the hermaphroditic species Caenorhabditis elegans. Genetics. 160 (3), 983-994 (2002).
- Chasnov, J. R., So, W. K., Chan, C. M., Chow, K. L. The species, sex, and stage specificity of a Caenorhabditis sex pheromone. Proc Natl Acad Sci U S A. 104 (16), 6730-6735 (2007).
- Susoy, V., et al. Natural sensory context drives diverse brain-wide activity during C. elegans mating. Cell. 184 (20), 5122-5137.e17 (2021).
- Barriere, A., Felix, M. A. High local genetic diversity and low outcrossing rate in Caenorhabditis elegans natural populations. Curr Biol. 15 (13), 1176-1184 (2005).
- Click, A., Savaliya, C. H., Kienle, S., Herrmann, M., Pires-Dasilva, A. Natural variation of outcrossing in the hermaphroditic nematode Pristionchus pacificus. BMC Evol Biol. 9, 75 (2009).
- Anderson, J. L., Morran, L. T., Phillips, P. C. Outcrossing and the maintenance of males within C. elegans populations. J Hered. 101 (suppl_1), S62-S74 (2010).
- Leighton, D. H., Choe, A., Wu, S. Y., Sternberg, P. W. Communication between oocytes and somatic cells regulates volatile pheromone production in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 111 (50), 17905-17910 (2014).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Fagan, K. A., et al. A single-neuron chemosensory switch determines the valence of a sexually dimorphic sensory behavior. Curr Biol. 28 (6), 902-914.e5 (2018).
- Lipton, J., Kleemann, G., Ghosh, R., Lints, R., Emmons, S. W. Mate searching in Caenorhabditis elegans: A genetic model for sex drive in a simple invertebrate. J Neurosci. 24 (34), 7427-7434 (2004).
- Frady, E. P., Palmer, C. R., Kristan, W. B. Sexual attraction: Sex-specific wiring of neural circuitry. Curr Biol. 22 (22), R953-R956 (2012).
- Liu, Q., et al. Two preputial gland-secreted pheromones evoke sexually dimorphic neural pathways in the mouse vomeronasal system. Front Cell Neurosci. 13, 455 (2019).
- Ludewig, A. H., et al. Pheromone sensing regulates Caenorhabditis elegans lifespan and stress resistance via the deacetylase sir-2.1. Proc Natl Acad Sci U S A. 110 (14), 5522-5527 (2013).
- Golden, J. W., Riddle, D. L. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Butcher, R. A., Fujita, M., Schroeder, F. C., Clardy, J. Small-molecule pheromones that control dauer development in Caenorhabditis elegans. Nat Chem Biol. 3 (7), 420-422 (2007).
- Jeong, P. Y., et al. Chemical structure and biological activity of the Caenorhabditis elegans dauer-inducing pheromone. Nature. 433 (7025), 541-545 (2005).
- Butcher, R. A., Ragains, J. R., Kim, E., Clardy, J. A potent dauer pheromone component in Caenorhabditis elegans that acts synergistically with other components. Proc Natl Acad Sci U S A. 105 (38), 14288-14292 (2008).
- Aprison, E. Z., Ruvinsky, I. Counteracting ascarosides act through distinct neurons to determine the sexual identity of C. elegans pheromones. Curr Biol. 27 (17), 2589-2599.e3 (2017).
- Aprison, E. Z., Ruvinsky, I. Sex pheromones of C. elegans males prime the female reproductive system and ameliorate the effects of heat stress. PLoS Genet. 11 (12), e1005729 (2015).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Kaplan, F., et al. Ascaroside expression in Caenorhabditis elegans is strongly dependent on diet and developmental stage. PLoS One. 6 (3), e17804 (2011).
- Pungaliya, C., et al. A shortcut to identifying small molecule signals that regulate behavior and development in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 106 (19), 7708-7713 (2009).
- Srinivasan, J., et al. A modular library of small molecule signals regulates social behaviors in Caenorhabditis elegans. PLoS Biol. 10 (1), e1001237 (2012).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Choe, A., et al. Ascaroside signaling is widely conserved among nematodes. Curr Biol. 22 (9), 772-780 (2012).
- Von Reuss, S. H., et al. Comparative metabolomics reveals biogenesis of ascarosides, a modular library of small-molecule signals in C. elegans. J Am Chem Soc. 134 (3), 1817-1824 (2012).
- Choe, A., et al. Sex-specific mating pheromones in the nematode panagrellus redivivus. Proc Natl Acad Sci U S A. 109 (51), 20949-20954 (2012).
- Hsueh, Y. P., Mahanti, P., Schroeder, F. C., Sternberg, P. W. Nematode-trapping fungi eavesdrop on nematode pheromones. Curr Biol. 23 (1), 83-86 (2013).
- Hong, M., et al. Early pheromone experience modifies a synaptic activity to influence adult pheromone responses of C. elegans. Curr Biol. 27 (20), 3168-3177.e3 (2017).
- Ryu, L., et al. Feeding state regulates pheromone-mediated avoidance behavior via the insulin signaling pathway in Caenorhabditis elegans. EMBO J. 37 (15), e98402 (2018).
- Diaz, S. A., Lindström, J., Haydon, D. T. Basic demography of Caenorhabditis remanei cultured under standard laboratory conditions. J Nematol. 40 (3), 167 (2008).
- Bargmann, C. I. Chemosensation in C. elegans. WormBook : the online review of C.elegans biology. , 1-29 (2006).
- Margie, O., Palmer, C., Chin-Sang, I. C. elegans chemotaxis assay. JoVE: J Vis Exp. (74), e50069 (2013).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены