JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Volatile Sex Pheromone Extraction and Chemoattraction Assay in Caenorhabditis elegans(예쁜꼬마선충의 휘발성 성 페로몬 추출 및 화학매력 분석)
요약
이 프로토콜은 예쁜꼬마선충(C. elegans)의 휘발성 성 페로몬에 대한 반응을 추출하고 정량화하는 방법을 확립하여 화학적 통신 및 탐색 궤적을 연구하기 위한 도구를 제공합니다.
초록
화학적 의사소통은 유기체의 건강, 번식 및 전반적인 웰빙에 매우 중요합니다. 이러한 신호를 제어하는 분자 경로, 신경 과정 및 계산을 이해하는 것은 여전히 활발한 연구 분야입니다. 예쁜꼬마선충(Caenorhabditis elegans )은 휘발성 성 페로몬을 생성하기 때문에 이러한 과정을 연구하기 위한 강력한 모델을 제공합니다. 이 페로몬은 처녀 암컷이나 정자가 고갈된 자웅동체에 의해 합성되며 수컷의 유인제 역할을 합니다.
이 프로토콜은 여러 예쁜꼬마선 충 균주(WT 균주 N2, daf-22 및 fog-2) 및 C. remanei에서 휘발성 성 페로몬을 분리하는 자세한 방법을 설명합니다. 우리는 또한 휘발성 성 페로몬에 대한 남성 화학주성 반응을 정량화하기 위한 프로토콜을 제공합니다. 우리의 분석은 화학주성 지수(C.I.), 도착 시간(A.T.) 및 궤적 플롯과 같은 측정을 활용하여 다양한 조건에서 남성의 반응을 정확하게 비교합니다. 이 방법을 사용하면 서로 다른 유전적 배경 또는 발달 단계를 가진 남성 간의 강력한 비교가 가능합니다. 또한, 여기에 설명된 실험 설정은 다른 화학 인력 화학 물질을 조사하는 데 적용할 수 있습니다.
서문
화학적 의사소통과 번식 성공 사이의 상호작용은 동물계 1,2,3,4,5,6,7,8,9,10 전반에 걸친 기본 원칙이다. 섹스 페로몬은 짝을 찾고, 파트너를 찾고 끌어들이는 데 관련된 단계를 조정하고, 궁극적으로 종의 번식을 촉진하는 데 필수적인 다양한 성적 이형 행동을 유발합니다 11,12,13,14,15,16,17. 페로몬 신호 전달을 이해하는 데 상당한 진전이 있었지만 이러한 상호 작용을 지배하는 분자 메커니즘, 신경 회로 및 계산 과정은 종종 불완전하게 정의된 상태로 남아 있습니다 18,19,20,21,22,23,24,25,26.
예쁜꼬마선충(Caenorhabditis elegans)은 이러한 의문을 해부하기 위한 강력한 모델을 제공합니다. 특히, 예쁜꼬마선충(C. elegans)은 특이한 번식 전략을 보인다 - 자웅동체는 자가 수정을 할 수 있을 뿐만 아니라 수컷과 교배할 수도 있다 27,28,29,30,31,32,33. 이러한 유연성은 생식 상태를 알리는 강력한 통신 시스템을 필요로 합니다. 예쁜꼬마선충(C. elegans)은 발달, 행동 및 사회적 상호 작용에서 다양한 역할을 하는 잘 특성화된 수용성 페로몬인 아스카로사이드로 유명합니다. 최근의 발견은 선충류가 사용하는 휘발성 성 성 페로몬의 뚜렷한 부류를 밝혀냈다. 이 페로몬은 성적으로 성숙한 예쁜꼬마선충(C. elegans)과 예쁜꼬마선충(C. remanei) 처녀 암컷과 정자가 고갈된 자웅동체에 의해 특별히 생성되어 성인 수컷의 유인제 역할을 합니다 29,34,35. 이 유인제는 생산과 인식에서 현저한 성적 이형성을 나타냅니다. 암컷의 체세포 생식선은 이 휘발성 성 페로몬의 합성을 관장하며, 생산은 생식 상태를 동적으로 반영하며, 짝짓기를 중단하고 몇 시간 후에 재개한다29,34.
선충 성 페로몬 통신을 이해하면 화학 통신 시스템의 진화, 생식 상태와 행동 간의 상호 작용, 성적으로 이형성 된 신경 처리의 기저에 있는 메커니즘에 대한 통찰력을 얻을 수 있습니다 24,26,36,37,38,39. 연구에 따르면 남성의 양피이드 뉴런 AWA는 페로몬 검출에 중요하며, G-단백질 결합 수용체 SRD-1은 남성의 페로몬 검출에 중요한 역할을 합니다24. 예쁜꼬마선충(C. elegans)은 짝을 찾기 위해 후각 시스템에 의존하기 때문에 동물의 화학적 의사소통, 특히 성 페로몬 신호 전달을 연구하는 데 매우 적합합니다. 아스카로사이드 신호전달에 대해 많이 알려져 있지만, 휘발성 섹스 페로몬 시스템은 비교를 위한 독특한 기회를 제공합니다 25,26,36,40,41,42,43,44,45,46,47,48,49,50 ,
51,52,53,54,55,56,57입니다. 또한, 예쁜꼬마선충(C. elegans)은 완전히 염기서열이 밝혀진 게놈, 명확하게 정의된 세포 계통 및 잘 특성화된 후각 돌연변이로 인해 강력한 유전 모델 유기체입니다.
그러나 이 페로몬을 처리하는 데 관여하는 완전한 신경 회로, 페로몬의 지각을 표적 짝 찾기 행동으로 변환하는 계산, 그리고 페로몬의 생합성 조절은 완전히 밝혀지지 않았습니다. 이러한 과정에 대한 추가 연구는 동물의 의사소통과 번식 행동을 지배하는 다양한 메커니즘을 이해하는 데 중요합니다. 페로몬 합성, 분비 및 지각에 관여하는 핵심 유전자의 확인은 동물 의사소통에서 새로운 분자 역할을 밝혀낼 것을 약속합니다. 여기에 설명된 분석은 이러한 질문을 해결하기 위한 기초를 제공합니다.
프로토콜
1. 여성과 자웅동체에서 조잡한 성 페로몬 적출
- 예쁜꼬마선충 동기화를 위한 프로토콜
- 성인 여성 또는 자웅동체의 준비
- 성인 암컷/자웅동체의 많은 개체군이 존재하고 OP50 식품 공급원이 고갈될 때까지 매일 배양 플레이트를 모니터링합니다. 조잡한 성 페로몬 추출을 위해 fog-2 C. elegans 및 WT C. remanei 암컷을 사용하여 짝짓기 된 암컷에서 동기화 된 난자를 준비합니다.
참고: 이 프로토콜에서는 자가 정자를 생산하지 않는 예쁜꼬마선충 안개-2 돌연변이 XX 동물을 예쁜꼬마선충 암컷이라고 합니다.
- 성인 암컷/자웅동체의 많은 개체군이 존재하고 OP50 식품 공급원이 고갈될 때까지 매일 배양 플레이트를 모니터링합니다. 조잡한 성 페로몬 추출을 위해 fog-2 C. elegans 및 WT C. remanei 암컷을 사용하여 짝짓기 된 암컷에서 동기화 된 난자를 준비합니다.
- 웜 세척 및 펠릿
- M9 완충액이 있는 혼합 개체군 플레이트에서 성인 벌레를 씻어냅니다. 웜 현탁액을 1.5mL 미세 원심분리기 튜브에 수집합니다. 1,500× g 에서 0.5-1분 동안 원심분리하여 웜을 펠릿화합니다.
알림: 심한 오염에 대한 사전 세척(선택 사항): 심하게 오염된 경우 벌레가 튜브에 가라앉도록 하십시오. 상층액을 피펫팅하여 박테리아를 제거하고 상층액이 투명해질 때까지 반복합니다.
- M9 완충액이 있는 혼합 개체군 플레이트에서 성인 벌레를 씻어냅니다. 웜 현탁액을 1.5mL 미세 원심분리기 튜브에 수집합니다. 1,500× g 에서 0.5-1분 동안 원심분리하여 웜을 펠릿화합니다.
- 표백
- 웜 펠릿에 200μL의 M9 완충액을 추가합니다. 가정용 표백제와 1M NaOH를 1:1 비율로 혼합하여 용해 완충액을 준비합니다. 이 용해 완충액 500μL를 혼합물에 추가하고 10초 동안 소용돌이친 다음 일시 중지하여 절개 현미경으로 용해 상태를 모니터링합니다. 이 과정을 10초 소용돌이 반복한 다음 성인 벌레가 완전히 용해될 때까지 관찰합니다.
- 배아의 표백 및 펠릿화 중단
- 성충이 작은 조각으로 용해되면(완전히 용해되지 않음) 즉시 500μL의 M9 완충액을 추가하여 반응을 늦춥니다. 15,000× g 에서 30-60초 동안 원심분리하여 배아를 펠릿화합니다.
참고: 과용해는 배아를 손상시킬 수 있습니다. 성인 벌레 몸이 작은 조각으로 분해되었을 때 반응을 중지하십시오. 용해는 원심분리기 및 세척 단계에서 모든 용해 완충액이 제거될 때까지 계속됩니다.
- 성충이 작은 조각으로 용해되면(완전히 용해되지 않음) 즉시 500μL의 M9 완충액을 추가하여 반응을 늦춥니다. 15,000× g 에서 30-60초 동안 원심분리하여 배아를 펠릿화합니다.
- 배아를 1mL의 M9 완충액으로 5배 세척하고 각 세척 후 30-60초 동안 15,000× g 에서 원심분리합니다. 원심분리 후 상층액을 제거합니다.
- 동기화
- 1.5mL 미세 원심분리기 튜브에서 800μL의 M9 완충액에 배아를 재현탁시킵니다. L20 부화를 위해 15-12 ° C에서 튜브를 회전시키고 L1에서 웜 정지tage 먹이 공급이 없기 때문입니다. 웜을 20°C에서 L4 단계에 도달할 때까지 3일 동안 방출하고 배양합니다.
- 성인 여성 또는 자웅동체의 준비
2. 생후 1일 된 처녀 여성으로부터 추출된 조잡한 섹스 페로몬 (그림 1A)
참고: 우리는 예쁜꼬마선충(C. elegans)의 돌연변이 암컷과 C. 레마네이(C. remanei)의 WT 암컷에서 생후 1일 된 처녀 안개-2(생식세포의 여성화) 암컷에서 성 페로몬을 추출하기 위해 이전에 확립된 프로토콜24를 채택합니다.
- 성인 여성의 준비
- 페로몬 추출 1일 전에 약 200마리의 L4 stage fog-2 암컷을 선택하고 격리합니다. 처녀 암컷만 채취하려면 이 L4 fog-2 암컷을 성별에 따라 조심스럽게 분리하고 3개의 별도 6cm OP50 NGM 플레이트에 분배합니다. 각 접시의 중앙에 소량의 OP50 박테리아를 놓습니다.
알림: 200개의 L4 암컷 웜을 3개의 개별 플레이트에 분배하여 실수로 수컷 웜이 플레이트에 유입될 위험을 방지하십시오. 수컷을 선택하면 많은 암컷과 짝짓기를 할 가능성이 높기 때문에 대부분의 암컷은 성체가 되는 다음 날까지 수정됩니다. 수정된 암컷은 정자가 소진될 때까지 휘발성 성 페로몬을 방출하지 않으며, 이는 추출 결과에 영향을 미칩니다. 제한된 먹이 공급원은 자웅동체를 접시 중앙의 더 작은 영역으로 제한하여 격리 기간 동안 접시에서 탈출할 가능성을 최소화합니다.
- 페로몬 추출 1일 전에 약 200마리의 L4 stage fog-2 암컷을 선택하고 격리합니다. 처녀 암컷만 채취하려면 이 L4 fog-2 암컷을 성별에 따라 조심스럽게 분리하고 3개의 별도 6cm OP50 NGM 플레이트에 분배합니다. 각 접시의 중앙에 소량의 OP50 박테리아를 놓습니다.
- 추출 과정
- 추출일(생식 성숙 1일, L1 정지에서 기생충이 방출된 후 3일)에 100마리의 처녀, 1일 된 fog-2 암컷을 선택하여 1mL의 M9 완충액이 들어 있는 미세 원심분리 튜브에 격리합니다. 박테리아 오염을 최소화하기 위해 M9 완충액으로 암컷을 5배 세척하고 20°C에서 6시간 동안 100μL의 M9 완충액에 배양하여 페로몬 생성 및 배지에 축적할 수 있도록 합니다.
- 추출 전날 분리한 15-20개의 L4 단계 암컷만을 사용하여 C. remanei 암컷에 대해 유사한 추출 과정을 수행하고 다음 날 5마리의 처녀 암컷을 M9 완충액 100μL에 25°C(C. remanei의 최적 성장 온도)에서 6시간 동안 배양합니다( C. remanei의 최적 성장 온도)58.
참고 : C. remanei 암컷은 C. elegans 암컷에 비해 더 많은 양의 휘발성 성 성 페로몬을 생산합니다. 따라서 5 명의 암컷만으로도 100 μL의 조잡한 휘발성 성 성 페로몬을 추출하기에 충분합니다.
- 보관
- 15,000× g 에서 30-60초 동안 샘플을 원심분리하여 웜을 펠릿화합니다. 상층액(페로몬 함유)을 깨끗한 튜브로 조심스럽게 피펫 옮기고 웜 펠릿이 들어 있는 튜브를 버립니다. 후속 chemoattraction assay를 위해 분리된 상층액을 보관합니다.
참고: 미처리 휘발성 성 페로몬 추출물은 증발을 최소화하기 위해 파라필름으로 감싼 미세 원심분리기 튜브에 -80°C에서 최소 1년 동안 보관할 수 있습니다.
- 15,000× g 에서 30-60초 동안 샘플을 원심분리하여 웜을 펠릿화합니다. 상층액(페로몬 함유)을 깨끗한 튜브로 조심스럽게 피펫 옮기고 웜 펠릿이 들어 있는 튜브를 버립니다. 후속 chemoattraction assay를 위해 분리된 상층액을 보관합니다.
- 품질 관리
- 추출물을 사용하기 전에 N2 남성 또는 him-5 남성을 사용하여 품질 관리 테스트를 수행하여 화학적 매력을 확인하십시오(섹션 4 참조).
3. 6일 된 처녀 자웅동체에서 다량의 조잡한 성 페로몬 추출(그림 1A)
- 웜 배양
- 약 20mL의 예 쁜꼬마선 충 성 페로몬을 얻으려면 앞서 언급한 표백제 프로토콜을 사용하여 건강한 성인 예쁜꼬마선 충(N2 또는 daf-22 돌연변이) 웜이 포함된 20개의 10cm NGM 플레이트를 동기화한 다음 M9 완충액으로 5번 세척합니다.
참고: 이 과정은 페로몬 추출을 위한 충분한 배아를 준비합니다. N2 : 수용성 아스카로사이드 페로몬과 비 아스카로사이드 휘발성 성 페로몬을 모두 생성하는 표준 WT C. 예쁜꼬마선 충 균주. DAF-22 돌연변이: 많은 아스카로사이드 페로몬을 생성하는 능력이 부족한 돌연변이로, 비아스카로사이드 휘발성 성 페로몬을 단독으로 연구하는 데 도움이 됩니다. - L1 단계에서 웜을 동기화하려면 M9 완충액의 배아를 12-15시간 동안 회전시켜 발달을 막습니다. 포착된 L1 웜을 성장 및 발달을 위해 OP50 박테리아가 파종된 10cm NGM 배양 플레이트로 옮깁니다.
- 자웅동체 플레이트에 수컷의 존재를 최소화하려면 웜 방출 2일 후, L4 단계에서 플레이트를 확인하고 관찰된 수컷(매우 드물음)을 제거하십시오.
- 3 일간의 발달 후, 벌레가 생식적으로 성숙한 성인이되었음을 나타내는 배아의 모습을 찾으십시오.
참고: 예쁜꼬마선충(C. elegans)의안개-2 돌연변이 암컷과 C. remanei의 WT 암컷은 벌크 휘발성 성 페로몬 추출에 적합하지 않습니다. fog-2 돌연변이 예쁜꼬마선충(C. elegans)과 레마네이(C. remanei)는 개체군에서 수컷의 비율이 높으며 수컷은 지속적으로 암컷과 짝짓기를 합니다. 수정된 암컷은 휘발성 성 페로몬을 생성하지 않습니다. 남성의 존재는 이러한 화합물의 추출을 복잡하게 만듭니다.
- 약 20mL의 예 쁜꼬마선 충 성 페로몬을 얻으려면 앞서 언급한 표백제 프로토콜을 사용하여 건강한 성인 예쁜꼬마선 충(N2 또는 daf-22 돌연변이) 웜이 포함된 20개의 10cm NGM 플레이트를 동기화한 다음 M9 완충액으로 5번 세척합니다.
- 벌레 세척 및 배아 분리
- M9 완충액으로 배아를 반복적으로 세척하고 대부분의 성인이 튜브 바닥에 올 때까지 침전(침전) 둡니다. 5-7회 반복합니다. 미세 원심분리기 튜브가 몇 분 동안 랙에 방해받지 않고 가라앉도록 하여 성충 벌레의 침전을 용이하게 하고 상층액에 부유 상태로 남아 있는 배아에서 성충 개체군을 분리할 수 있도록 합니다.
- 분리된 성체를 피펫팅하여 새로운 OP50 파종 NGM 플레이트로 옮깁니다.
- 이 세탁 과정을 5-6일 동안 반복하여 자가 정자를 고갈시킵니다.
참고 : 휘발성 성 페로몬을 추출하려면 5-6 일 된 자웅동체를 사용하십시오. 이 타이밍은 사용 가능한 자기 정자가 있는 자웅동체가 휘발성 성 성 페로몬을 생성하지 않기 때문에 자기 정자가 고갈될 가능성이 있음을 보장합니다. 5일 또는 6일째까지 접시에 있는 수많은 죽거나 부화하지 않은 배아는 페로몬 추출을 시작하기에 적절한 시간을 나타냅니다.
- 섹스 페로몬 추출
- 섹션 1에 설명된 대로 섹스 페로몬을 수정하여 추출합니다.
- 100 μL 당 100 C. elegans 암컷을 추가하는 대신, 최종 웜 펠릿 부피에 따라 M9 완충액을 추가하십시오. 포장된 웜 50μL당 M9 완충액 1mL를 추가합니다.
- 품질 관리 및 균질화
- N2 남성 또는 him-5 남성으로 화학 매력 분석을 사용하여 추출된 페로몬의 품질 관리 테스트 배치(섹션 4 참조).
- 스크리닝 또는 미세유체 실험과 같이 많은 양의 페로몬이 필요한 실험을 위해 균일한 조잡한 휘발성 성 페로몬을 만들기 위해 모든 배치를 혼합합니다. 조잡한 성 페로몬 추출물을 증발을 최소화하기 위해 파라필름으로 감싼 50mL 튜브에 -80°C에서 최소 1년 동안 보관합니다.
- 조잡한 성 페로몬 추출물의 표준화를 위한 화학매력 분석 기반 적정 방법
- WT N2 및 him-5 남성 C. elegans 모두에서 각 페로몬 추출물의 연속 희석을 테스트하여 적정 분석을 수행합니다. 대조군 균주에서 강력하고 재현 가능한 화학주성 반응을 일관되게 이끌어내는 가장 높은 희석(가장 낮은 농도)을 결정합니다.
- M9 완충액에서 각 조추출물(예: 1:2, 1:4, 1:8 등)로 일련의 희석액을 준비합니다.
- 화학주성 분석
- 남성의 기준 균주에 대한 각 희석을 사용하여 표준화된 화학주성 분석(섹션 4 참조)을 수행합니다. 재현성을 보장하기 위해 세 번의 반복실험을 수행합니다. 페로몬 농도의 일관성을 평가하기 위해 여러 추출 배치에서 최적의 희석액을 비교합니다.
참고: 이는 각 추출물의 생체 활성을 평가하기 위한 기준점을 설정합니다. 표준 섹스 페로몬 화학매력 분석에서는 원래의 희석되지 않은 추출물이 후속 실험에 사용되며, 적정은 배치 간에 일관된 페로몬 활성을 보장하기 위한 품질 관리 단계 역할을 합니다. 희석 시리즈는 특정 실험 요구 사항에 따라 조정할 수 있습니다. 표준 추출 프로토콜이 포화 조잡 페로몬 추출물을 일관되게 산출한다는 점을 감안할 때, 추출물을 표준화하기 위한 적정 테스트는 대부분의 실험에서 필요하지 않을 수 있습니다. 일관성을 유지하고 페로몬 활성의 변동성을 최소화하기 위해 일련의 관련 실험에서 동일한 배치의 조잡한 성 페로몬을 사용하는 것이 좋습니다.
- 남성의 기준 균주에 대한 각 희석을 사용하여 표준화된 화학주성 분석(섹션 4 참조)을 수행합니다. 재현성을 보장하기 위해 세 번의 반복실험을 수행합니다. 페로몬 농도의 일관성을 평가하기 위해 여러 추출 배치에서 최적의 희석액을 비교합니다.
4. 휘발성 성 페로몬 chemoattraction 분석실험
참고 : 휘발성 성 성 페로몬 화학 인력 분석은 다른 화학 인력 연구 24,29,59,60,61에서 사용 된 이전에 확립 된 방법에서 채택되었습니다. 이러한 수정은 휘발성 성 페로몬에 대한 반응을 검출하기 위한 분석의 민감도와 특이성을 최적화하기 위해 구현되었습니다. 이 맞춤형 접근 방식은 특정 연구 요구 사항에 대한 분석의 적용 가능성을 향상시킵니다.
- 성인 암컷/자웅동체가 풍부해질 때까지 매일 배양 플레이트를 관찰하십시오. 지렁이의 건강은 성 페로몬에 대한 반응에 영향을 미칩니다.
- 그-5 남성의 준비
- 표준 표백제 프로토콜을 사용하여 him-5 웜을 동기화합니다. 동기화 후 M9 버퍼로 웜을 5번 세척합니다. 분석 전날 L4 수컷을 분리하십시오. 그런 다음 파종 플레이트에서 1일 된 성인 수컷 벌레를 옮기고 분석 전에 M9 완충액으로 헹굽니다. 분석 전에 씨를 뿌리지 않은 NGM 플레이트에 올려 놓아 잔류 박테리아를 제거하고 분석 중 음식물의 간섭을 방지합니다.
참고: 분석 전에 웜을 한 시간 이상 굶기지 마십시오., 이는 내부 상태를 변경하고 섹스 페로몬 화학 매력 분석의 결과에 영향을 미칠 수 있습니다. 따라서 하루에 10회 이상의 분석을 수행하려는 경우 매시간 웜 샘플을 교체하십시오. 또한 하나의 실험 분석과 하나의 대조군 분석을 반복적으로 번갈아 가며 수행합니다.
- 표준 표백제 프로토콜을 사용하여 him-5 웜을 동기화합니다. 동기화 후 M9 버퍼로 웜을 5번 세척합니다. 분석 전날 L4 수컷을 분리하십시오. 그런 다음 파종 플레이트에서 1일 된 성인 수컷 벌레를 옮기고 분석 전에 M9 완충액으로 헹굽니다. 분석 전에 씨를 뿌리지 않은 NGM 플레이트에 올려 놓아 잔류 박테리아를 제거하고 분석 중 음식물의 간섭을 방지합니다.
- chemoattraction agar assay plates의 준비
- 관련 문헌24에 설명된 대로 1.5% 한천, 25mM NaCl, 1.5mM Tris-염기 및 3.5mM Tris-Cl로 화학 견인 분석 플레이트를 준비합니다.
- 완전히 용해될 때까지 전자레인지를 사용하여 화학 인력 용액에서 한천을 가열합니다. 용액을 실온에서 5분 동안 식힙니다.
- 피펫 보조제를 사용하여 화학 인력 한천 용액을 페트리 접시에 고르게 분배하십시오: 각 10cm 접시에 30mL를 붓고 각 6cm 접시에 20mL를 붓습니다.
- 화학 인력 한천 용액을 페트리 접시에 부은 후 한천 표면이 약간 건조될 수 있도록 깨끗한 곳에서 뚜껑을 최소 40분 동안 열어 두십시오. 표면이 적절하게 건조되면 뚜껑을 닫습니다.
알림: 이 건조 시간은 실험실 환경의 습도와 온도에 따라 달라질 수 있습니다.
- 플레이트 보관 및 사전 분석 준비
- 준비된 분석 플레이트를 상자에 넣고 최대 1주일 동안 냉장실에 보관합니다. 사용하기 전에 냉장 보관에서 플레이트를 제거하고 한 시간 이상 실온에 적응하도록 하십시오. 뚜껑을 열어 깨끗한 지역에서 분석하기 20분 전에 한천에서 잔류 수분이 증발하도록 하고 분석을 수행하기 전에 표면에 명백한 물이 없는지 확인합니다.
- 실험 설계 및 화학인력 분석
- 화학 인력 분석을 수행하려면 Petri 접시의 뚜껑과 밑면에 세 개의 뚜렷한 점을 표시하거나 접시 아래에 놓거나 해부 현미경에 부착된 투명 플라스틱 종이에 인쇄된 템플릿을 사용하십시오. 이러한 표시에는 웜의 시작점인 가운데 점(•), 실험 지점(뚜껑에 있는 섹스 페로몬 2μL, 플레이트에 1M 아지드화나트륨 2μL)에 대한 더하기 기호(+), 대조군(뚜껑에 있는 M9 완충액 2μL, 1M 아지드화나트륨 2μL)에 대한 빼기 기호(-)가 포함됩니다(그림 2A). 접시 크기와 특정 실험 요구 사항에 따라 이러한 표시 사이의 거리를 조정하십시오. 일반적으로 6cm 페트리 접시의 경우 양성 대조 테스트를 위해 시작점에서 각 테스트 물질까지 1.5cm의 고정 거리를 설정합니다.
- 분석을 수행하기 위한 자세한 단계(그림 2)
- 2μL의 1M 아지드화나트륨을 플레이트의 각 실험 및 대조 지점에 적용합니다.
- 웜 피커로 건강하고 자유롭게 움직이는 수컷 웜 20마리를 고르세요. 해부 현미경으로 시작 지점에서 20마리의 수컷 벌레를 동시에 방출합니다.
- 2 μL의 섹스 페로몬과 2 μL의 M9 완충액을 각각 뚜껑의 실험 지점과 대조 지점에 빠르게 추가합니다.
- 뚜껑을 부드럽게 닫고 분석 플레이트를 현미경 옆의 조용하고 온도가 안정적인 장소에 놓습니다.
- 30분 후 각 지점의 웜 수를 계산하여 분석을 채점합니다.
알림: 20마리의 웜을 따는 과정은 처음에 선택한 웜이 건조되어 건강에 해로워져 결과에 영향을 줄 수 있는 것을 방지하기 위해 1-2분을 초과해서는 안 됩니다. 수컷을 따는 것부터 뚜껑을 닫는 것까지의 전체 과정은 2분에서 5분 정도 걸립니다.
- 양성 대조군 스크리닝
- 수컷 웜을 1,000배 희석된 다이아세틸 용액(10% 에탄올 및 90% M9 완충액에 용해)으로 테스트하여 화학주성 반응성을 확인합니다. 테스트를 시작한 후 30분 후에 화학 인력 분석 결과를 평가합니다. 지정된 지점에서 마비된 웜의 위치를 기준으로 점수를 매깁니다: 통제 지점에 있는 웜은 'C', 실험 지점에 있는 웜은 'E'입니다. 어느 지점에서도 웜의 점수를 'N'으로 매기지 않습니다(그림 2C).
- 화학매력지수(C.I.)를 계산하려면 다음 공식을 사용하십시오.
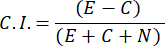
- 화학주성 지수가 0.4≥ 남성 샘플만 선택합니다(CI, 그림 2C 참조). 후속 섹스 페로몬 테스트를 위해 동일한 배치의 남성을 사용하십시오.
참고: 실험 결과의 일관성과 신뢰성을 보장하기 위해 각각 20개의 웜을 포함하는 3개의 개별 분석을 수행합니다. 일반적으로 세 가지 분석으로 일관성을 추론하기에 충분합니다.
5. chemoattraction assay를 위한 타이밍 및 스코어링 지침
- 웜의 최종 위치를 기준으로 웜의 화학인력 반응을 평가합니다. 분석이 끝날 때, 일반적으로 시작 후 30분 후에 각 지점에서 웜의 수를 점수화합니다.
참고: 실험 및 대조 지점에서 아지드화나트륨을 사용하면 도착하는 웜을 마비시켜 정확한 채점을 용이하게 합니다. 대부분의 WT N2 및 him-5 남성은 1.5cm 거리 설정으로 6cm 플레이트에서 6-8분 이내에 페로몬 소스를 찾을 수 있습니다. - 화학주성 효율성에 대한 결함을 포착하려면, 특히 미묘한 결함을 검출하기 위해 3-5분의 정기적인 간격으로 분석을 모니터링하는 것이 좋습니다.
참고: 이러한 빈번한 관찰을 통해 웜이 테스트 지점에 도착하는 시간을 문서화할 수 있습니다. 이러한 상세한 추적은 웜이 화학주성 효율성이 감소하면서도 검사 창 내의 테스트 지점에 도달하는 경우를 밝힐 수 있습니다.
6. 선택적 수정 사항
- 화학주성에 대한 평가를 강화하기 위해 플레이트 위에 위치한 카메라를 사용하여 분석 전반에 걸쳐 웜의 궤적을 기록하십시오.
참고: 이 수정을 통해 이동 패턴을 포괄적으로 분석할 수 있어 화학인력 거동 및 궤적에 대한 더 깊은 통찰력을 얻을 수 있습니다(그림 3).
7. 데이터 분석
- Chemoattraction Index (C.I.)의 점수 및 계산
- 4.7.1 및 4.7.2단계를 수행합니다.
- 도착 시간 플롯
- 화학인력 분석에 대한 보다 포괄적인 분석을 위해 3-5분 간격으로 분석을 모니터링하거나 플레이트 위에 위치한 카메라를 사용하여 분석 전반에 걸쳐 웜의 궤적을 기록하는 것이 좋습니다.
참고: 이러한 접근 방식을 사용하면 설계 지점에서 웜의 도착 시간을 점수화할 수 있을 뿐만 아니라 평균 도착 시간을 비교하고 이러한 시간의 분포를 분석할 수 있습니다.
- 화학인력 분석에 대한 보다 포괄적인 분석을 위해 3-5분 간격으로 분석을 모니터링하거나 플레이트 위에 위치한 카메라를 사용하여 분석 전반에 걸쳐 웜의 궤적을 기록하는 것이 좋습니다.
- 비디오 기반 궤적 분석 및 데이터 시각화
알림: 의 움직임 패턴을 분석하려면 C. elegans chemoattraction assay, 궤적을 기록하고 추출합니다( 재료 표) 및 추가 분석(그림 3).- 녹음 시스템을 설정합니다.
- 새 녹음을 시작하고 녹음 설정 창에 액세스합니다.
- 원하는 기록 매개변수를 정의합니다.
- 파일 접두어: 비디오 파일에 대한 설명이 포함된 이름(예: "experiment1_")을 선택합니다.
- 프레임 속도(FPS): 웜의 움직임을 캡처하기 위한 적절한 초당 프레임을 선택합니다(예: 한천 플레이트의 웜의 경우 7.5FPS, 헤엄치는 웜의 경우 30FPS).
- 지속 시간: 기록의 길이를 초 단위로 설정합니다(예: 벌크 화학 어트랙션 분석의 경우 1,800초[30분]).
- 이미지 품질 최적화: 웜이 배경에서 명확하게 보이도록 조명 강도를 조정하고 웜의 선명한 이미지를 얻기 위해 초점을 미세 조정합니다.
- 분석 플레이트를 준비하려면 먼저 대조 용액을 지정된 대조 지점에 분주합니다. 그런 다음 벌레를 조심스럽게 집어 접시 중앙에 부드럽게 놓습니다. 벌레가 가라앉으면 성 페로몬 용액을 지정된 실험 장소에 적용합니다.
- 플레이트 배치: 웜이 들어 있는 플레이트를 녹화 필드 중앙에 조심스럽게 배치하여 캡처 영역을 최대화합니다.
- 화학주성 분석 중 웜에 가해지는 스트레스를 줄이려면 다음 두 가지 접근법을 고려하십시오.
- 단일 웜 분석의 경우 웜을 분석 플레이트에 놓고 지정된 거리(웜의 현재 위치를 기준으로 한 위치)에서 섹스 페로몬 용액을 도입하기 전에 5분 동안 적응시키십시오.
참고: 이렇게 하면 취급이 최소화되고 웜이 새로운 환경에 적응할 수 있는 시간이 제공됩니다. - 벌크 화학 인력 분석: 웜이 5분 동안 플레이트에 자연적으로 가라앉고 분산되도록 합니다. 이 적응 기간이 지나면 지정된 고정 위치에 페로몬 용액을 도입하십시오. 포스트 비디오 분석 중에는 페로몬에서 각 웜의 시작 거리를 측정하고 추가 분석을 위해 그에 따라 그룹화합니다.
- 단일 웜 분석의 경우 웜을 분석 플레이트에 놓고 지정된 거리(웜의 현재 위치를 기준으로 한 위치)에서 섹스 페로몬 용액을 도입하기 전에 5분 동안 적응시키십시오.
- 비디오 분석 절차
- 가져오기 및 설정: 녹화된 비디오를 소프트웨어로 가져옵니다. 시퀀스 정보(예: 프레임 레이트)를 구성하고; 이미징 스케일(측정 단위당 픽셀 수)을 지정합니다.
- 이미지 조정: 웜 감지를 최적화하려면 녹색 라벨이 배경 소음이나 아티팩트를 캡처하지 않고 웜의 윤곽을 단단히 나타낼 때까지 감지 임계값 을 조정합니다. 또한 배경 다듬기 알고리즘을 적용하여 이미지의 노이즈와 불균일성을 줄이고 웜과 배경 사이의 대비를 향상시킵니다. 다양한 스무딩 수준으로 실험하여 노이즈 감소와 웜 세부 정보 보존 간의 최적 균형을 찾습니다.
알림: 이상적인 임계값은 외부 요소를 제외하고 각 웜 몸체의 대부분을 덮어야 합니다. - 탐지 파라미터 최적화: 대표적인 WORM을 선택하여 탐지 파라미터를 자동으로 생성합니다. 5-10개의 무작위 프레임을 육안으로 검사하여 감지 정확도를 확인합니다. 감지가 만족스럽지 않으면 감지 매개변수를 수동으로 미세 조정하고, 필요한 경우 이미지 조정 설정을 다시 검토하고, 감지가 신뢰할 수 있게 되면 추적을 진행합니다.
- 추적 궤적 교정 및 복구: 자동 추적 프로세스가 완료된 후 생성된 궤적에 대한 수동 교정을 수행합니다. 교정 중에 불일치가 발견되면 고치 기 기능을 사용하여 궤적을 수정하고 다음 작업을 수행합니다. 결합: 다른 식별자가 잘못 할당되었지만 동일한 개인에 속하는 궤적 세그먼트를 연결합니다. 분할: 동일한 식별자가 잘못 할당되었지만 다른 개인에 속하는 별도의 궤적 세그먼트입니다.
참고: 목표는 각 고유 식별자(번호)가 전체 추적 기간 동안 동일한 개인에게 일관되게 할당되도록 하는 것입니다.
예: 웜이 일정 기간 동안 "3"으로 레이블이 지정된 다음 후속 기간 동안 "7"로 잘못 레이블이 지정된 경우 복구 함수는 식별자 "3" 아래에 이 두 세그먼트를 결합합니다. 반대로, 두 개의 웜이 모두 일정 기간 동안 "12"로 레이블이 지정된 경우 복구 함수는 이 세그먼트를 각각 고유 식별자가 있는 두 개의 개별 궤적으로 분할합니다. 주의 깊게 교정하고 필요한 수리를 적용하면 추적 데이터의 정확성과 신뢰성을 크게 향상시킬 수 있습니다. - 결과 시각화 및 내보내기: 시각화 및 기본 분석을 위해 소프트웨어를 활용합니다. 선호하는 도구 또는 코드를 사용하여 추가 분석을 위해 데이터를 CSV 파일로 내보냅니다. 이 방법은 5개의 주요 매개변수를 기반으로 웜 이동 궤적을 시각화하는 기본 코드(https://github.com/edmondztt/pheromone-traj-analysis.git 참조)를 제공합니다(그림 3). 시간: 궤적의 진행 상황으로, 실험 시작 이후 시간의 경과를 나타내기 위해 색상으로 구분됩니다. 페로몬까지의 거리: 각 시점에서 웜과 페로몬 소스 사이의 거리. 속도: 각 지점에서 웜의 속도로, 회전 및 정지 이벤트도 나타냅니다. 직진도: 웜의 경로가 얼마나 직선인지. 방향 정확성: 웜의 움직임이 페로몬 대상의 방향과 얼마나 일치합니까? 이 코드는 웜 동작을 이해하기 위한 기본 시각화를 제공하며 심층적인 분석을 위해 사용자 지정 및 확장할 수 있습니다.
참고: 이 고급 접근 방식은 성 페로몬에 대한 반응으로 웜 탐색 궤적을 자세히 설명함으로써 전통적인 화학 인력 지수에 대한 포괄적인 대안을 제공합니다. 이를 통해 탐색 및 시간 창 결정의 임의의 끝점에 의존하지 않고 움직임 패턴을 이해할 수 있으며, 분석의 행동 역학에 대한 더 깊은 통찰력을 얻을 수 있습니다. 데이터는 20개 프레임에 걸쳐 평균화되었으며, 특정 실험 요구 사항에 따라 조정할 수 있어 신체 비틀림으로 인한 움직임을 필터링할 수 있습니다.
결과
chemoattraction assay에서 volatile sex pheromone perception defective strain 의 궤적 분석
이 화학 인력 분석은 휘발성 성 페로몬에 대한 반응에서 예쁜꼬마선충(C. elegans )의 야생형 및 돌연변이 균주를 신뢰성 있게 구별합니다. 그-5 수컷을 이용한 성공적인 실험은 페로몬 공급원에 대한 강력한 화학주성을 일관되게 보여줍니다. 이는 높은 화학주성 지수(C.I.)?...
토론
이 프로토콜은 예쁜꼬마선충(C. elegans)에서 휘발성 성 성 페로몬을 추출하기 위한 강력한 방법론을 제공하며, 남성의 화학인력 반응을 측정하기 위한 강력한 화학인력 분석을 수립합니다. 추가 정보는 WormLab 사용자 가이드에서 찾을 수 있습니다(재료 표 참조). WORM 이동 궤적을 시각화하는 기본 코드는 프로토콜 섹션 7.3.8.5를 참조하십시오. 프로토콜의 ?...
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
분석에 사용된 궤적 시각화를 위한 코드를 설계하고 작성해 주신 Tingtao Zhou 박사님께 감사드립니다. 이 연구는 R01 NS113119(PWS), Chen 선임 박사후 연구원, Tianqiao and Chrissy Chen Institute for Neuroscience의 자금 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 10 cm Petri dishes | Falcon | 25373-100 | Falcon bacteriological Petri dish 100 x 15 mm |
| 6 cm Petri dishes | Falcon | 25373-085 | Falcon bacteriological Petri dish 60 x 15 mm |
| C. remanei (EM464) | CGC | ||
| Centrifuge | Eppendorf | centrifuge 5418 | Any brand should work. |
| Chemoattraction assay plates | Homemade solution | N/A | 1.5% agar, 25 mM NaCl, 1.5 mM Tris-base, and 3.5 mM Tris-Cl |
| Cholesterol | Alfa Aesar | 57-88-5 | |
| Dissecting Microscope | Leica | LeicaMZ75 | Any brand should work. |
| E. Coli OP50 | CGC | ||
| Ethanol | Koptec | 64-17-5 | |
| fog-2(q71) (JK574) | CGC | ||
| him-5(e1490)(CB4088) | CGC | ||
| Household bleach | Clorox Germicidal bleach concentrated | Bleach | |
| M9 buffer | Homemade solution | N/A | 3 g KH2PO4, 11.3 g Na2HPO4.7H2O, 5 g NaCl, H2O to 1 L. Sterilize by autoclaving. Add 1 mL 1 M MgSO4 after cool down to room temperature. |
| Magnesium Sulfate, Anhydrous, Powder | Macron | M1063-500GM-EA | |
| Microwave | TOSHIBA | N/A | Any brand should work. |
| N2 | CGC | ||
| NaOH | Sigma-aldrich | S318-3 | 1 M |
| NGM plates solution | Homemade solution | N/A | 2.5 g Peptone, 18 g agar, 3 g NaCl, H2O to 1 L.Sterilize by autoclaving. Once the autoclave is done (2 h), wait until the temperature of the medium drops to 65 °C. Put on a hotplate at 65 °C and stir. Then add the following, waiting 5 min between each to avoid crystallization: 1 mL CaCl2 (1 M), 1 mL MgSO4 (1 M), 25 mL K3PO4 (1 M, pH=6), 1 mL Cholesterol ( 5 mg/mL in ethanol). |
| Parafilm | Bemis | 13-374-10 | Bemis Parafilm M Laboratory Wrapping Film |
| Peptone | VWR | 97063-324 | |
| Pipet- aid | Drummond Scientific | 4-000-100 | Any brand should work. |
| Plastic paper | Octago | Waterproof Screen Printing Inkjet Transparency Film | https://www.amazon.com/Octago-Waterproof-Transparency-Printing-Printers/dp/B08HJQWFGD |
| Potassium chloride | Sigma-aldrich | SLBP2366V | |
| Potassium phosphate | Spectrum | 7778-77-0 | |
| Pipette | Eppendorf | SKU: EPPR4331; MFG#: 2231300006 | 20 - 200 µL, 100 - 1000 µL, any brand should work. |
| Rotator | Labnet | SKU: LI-H5500 | Labnet H5500 Mini LabRoller with Dual Direction Rotator. Any brand should work. |
| Sodium chloride | VWR | 7647-14-5 | |
| sodium phosphate dibasic | Sigma-aldrich | SLCG3888 | |
| Tris-base | Sigma-aldrich | 77-86-1 | |
| Tris-Cl | Roche | 1185-53-1 | |
| Tryptone | VWR | 97063-390 | |
| Vortex | Scientific industries | Vortex-Genie 2 | Any brand should work. |
| WormLab system | MBF Bioscience | N/A | https://www.mbfbioscience.com/help/WormLab/Content/home.htm; https://www.mbfbioscience.com/products/wormlab/ |
| Wormpicker | Homemade | N/A | made with platinum and glass pipet tips |
참고문헌
- Audesirk, T. E. Chemoreception in Alphysia californica. Iii. Evidence for pheromones influencing reproductive behavior. Behav Biol. 20 (2), 235-243 (1977).
- Traynor, K. S., Le Conte, Y., Page, R. E. Queen and young larval pheromones impact nursing and reproductive physiology of honey bee (Apis mellifera) workers. Behav Ecol Sociobiol. 68 (12), 2059-2073 (2014).
- Cowley, J. J., Wise, D. R. Pheromones, growth and behaviour. Ciba Found Study Group. 35, 144-170 (1970).
- Epple, G. Pheromones in primate reproduction and social behavior. Adv Behav Biol. 11, 131-155 (1974).
- Levinson, H. Z. Possibilities of using insectistatics and pheromones in pest control. Naturwissenschaften. 62 (6), 272-282 (1975).
- Roelofs, W. Manipulating sex pheromones for insect suppression. Environ Lett. 8 (1), 41-59 (1975).
- Marchlewska-Koj, A. Pheromones and mammalian reproduction. Oxf Rev Reprod Biol. 6, 266-302 (1984).
- Keverne, E. B. Neuroendocrinology briefings 11: Pheromones and reproduction. J Neuroendocrinol. 12 (11), 1045-1046 (2000).
- Rekwot, P. I., Ogwu, D., Oyedipe, E. O., Sekoni, V. O. The role of pheromones and biostimulation in animal reproduction. Anim Reprod Sci. 65 (3-4), 157-170 (2001).
- Gomez-Diaz, C., Benton, R. The joy of sex pheromones. EMBO reports. 14 (10), 874-883 (2013).
- Shorey, H. H., Gaston, L. K., Jefferson, R. N. Insect sex pheromones. Adv Pest Control Res. 8, 57-126 (1968).
- Bruce, H. M. Pheromones and behavior in mice. Acta Neurol Psychiatr Belg. 69 (7), 529-538 (1969).
- Shorey, H. H., Bartell, R. J. Role of a volatile female sex pheromone in stimulating male courtship behaviour in Drosophila melanogaster. Anim Behav. 18 (1), 159-164 (1970).
- Bobadoye, B., et al. Evidence of aggregation-sex pheromone use by longhorned beetles (coleoptera: Cerambycidae) species native to Africa. Environ Entomol. 48 (1), 189-192 (2019).
- Saunders, J. R. Sex pheromones in bacteria. Nature. 275 (5682), 692-694 (1978).
- Schulz, S., Toft, S. Identification of a sex pheromone from a spider. Science. 260 (5114), 1635-1637 (1993).
- Finnegan, D. E., Chambers, J. Identification of the sex pheromone of the guernsey carpet beetle, Anthrenussarnicus mroczkowski (coleoptera: Dermestidae). J Chem Ecol. 19 (5), 971-983 (1993).
- Vaillancourt, L. J., Raudaskoski, M., Specht, C. A., Raper, C. A. Multiple genes encoding pheromones and a pheromone receptor define the b beta 1 mating-type specificity in Schizophyllum commune. Genetics. 146 (2), 541-551 (1997).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook : the online review of C. elegans biology. , 1-22 (2013).
- Sakai, N., et al. A sexually conditioned switch of chemosensory behavior in C. elegans. PLoS One. 8 (7), e68676 (2013).
- Sengupta, S., Smith, D. P., Mucignat-Caretta, C. How Drosophila detect volatile pheromones: signaling, circuits, and behavior. Neurobiology of chemical communication. , (2014).
- Zhang, Y. K., Reilly, D. K., Yu, J., Srinivasan, J., Schroeder, F. C. Photoaffinity probes for nematode pheromone receptor identification. Org Biomol Chem. 18 (1), 36-40 (2019).
- Aprison, E. Z., Ruvinsky, I. Dynamic regulation of adult-specific functions of the nervous system by signaling from the reproductive system. Curr Biol. 29 (23), 4116-4123.e3 (2019).
- Wan, X., et al. SRD-1 in AWA neurons is the receptor for female volatile sex pheromones in C. elegans males. EMBO Rep. 20 (3), e46288 (2019).
- Peckol, E. L., Troemel, E. R., Bargmann, C. I. Sensory experience and sensory activity regulate chemosensory receptor gene expression in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 98 (20), 11032-11038 (2001).
- Jang, H., et al. Neuromodulatory state and sex specify alternative behaviors through antagonistic synaptic pathways in. C. elegans. Neuron. 75 (4), 585-592 (2012).
- Liu, K. S., Sternberg, P. W. Sensory regulation of male mating behavior in Caenorhabditis elegans. Neuron. 14 (1), 79-89 (1995).
- Chasnov, J. R., Chow, K. L. Why are there males in the hermaphroditic species Caenorhabditis elegans. Genetics. 160 (3), 983-994 (2002).
- Chasnov, J. R., So, W. K., Chan, C. M., Chow, K. L. The species, sex, and stage specificity of a Caenorhabditis sex pheromone. Proc Natl Acad Sci U S A. 104 (16), 6730-6735 (2007).
- Susoy, V., et al. Natural sensory context drives diverse brain-wide activity during C. elegans mating. Cell. 184 (20), 5122-5137.e17 (2021).
- Barriere, A., Felix, M. A. High local genetic diversity and low outcrossing rate in Caenorhabditis elegans natural populations. Curr Biol. 15 (13), 1176-1184 (2005).
- Click, A., Savaliya, C. H., Kienle, S., Herrmann, M., Pires-Dasilva, A. Natural variation of outcrossing in the hermaphroditic nematode Pristionchus pacificus. BMC Evol Biol. 9, 75 (2009).
- Anderson, J. L., Morran, L. T., Phillips, P. C. Outcrossing and the maintenance of males within C. elegans populations. J Hered. 101 (suppl_1), S62-S74 (2010).
- Leighton, D. H., Choe, A., Wu, S. Y., Sternberg, P. W. Communication between oocytes and somatic cells regulates volatile pheromone production in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 111 (50), 17905-17910 (2014).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Fagan, K. A., et al. A single-neuron chemosensory switch determines the valence of a sexually dimorphic sensory behavior. Curr Biol. 28 (6), 902-914.e5 (2018).
- Lipton, J., Kleemann, G., Ghosh, R., Lints, R., Emmons, S. W. Mate searching in Caenorhabditis elegans: A genetic model for sex drive in a simple invertebrate. J Neurosci. 24 (34), 7427-7434 (2004).
- Frady, E. P., Palmer, C. R., Kristan, W. B. Sexual attraction: Sex-specific wiring of neural circuitry. Curr Biol. 22 (22), R953-R956 (2012).
- Liu, Q., et al. Two preputial gland-secreted pheromones evoke sexually dimorphic neural pathways in the mouse vomeronasal system. Front Cell Neurosci. 13, 455 (2019).
- Ludewig, A. H., et al. Pheromone sensing regulates Caenorhabditis elegans lifespan and stress resistance via the deacetylase sir-2.1. Proc Natl Acad Sci U S A. 110 (14), 5522-5527 (2013).
- Golden, J. W., Riddle, D. L. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Butcher, R. A., Fujita, M., Schroeder, F. C., Clardy, J. Small-molecule pheromones that control dauer development in Caenorhabditis elegans. Nat Chem Biol. 3 (7), 420-422 (2007).
- Jeong, P. Y., et al. Chemical structure and biological activity of the Caenorhabditis elegans dauer-inducing pheromone. Nature. 433 (7025), 541-545 (2005).
- Butcher, R. A., Ragains, J. R., Kim, E., Clardy, J. A potent dauer pheromone component in Caenorhabditis elegans that acts synergistically with other components. Proc Natl Acad Sci U S A. 105 (38), 14288-14292 (2008).
- Aprison, E. Z., Ruvinsky, I. Counteracting ascarosides act through distinct neurons to determine the sexual identity of C. elegans pheromones. Curr Biol. 27 (17), 2589-2599.e3 (2017).
- Aprison, E. Z., Ruvinsky, I. Sex pheromones of C. elegans males prime the female reproductive system and ameliorate the effects of heat stress. PLoS Genet. 11 (12), e1005729 (2015).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Kaplan, F., et al. Ascaroside expression in Caenorhabditis elegans is strongly dependent on diet and developmental stage. PLoS One. 6 (3), e17804 (2011).
- Pungaliya, C., et al. A shortcut to identifying small molecule signals that regulate behavior and development in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 106 (19), 7708-7713 (2009).
- Srinivasan, J., et al. A modular library of small molecule signals regulates social behaviors in Caenorhabditis elegans. PLoS Biol. 10 (1), e1001237 (2012).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Choe, A., et al. Ascaroside signaling is widely conserved among nematodes. Curr Biol. 22 (9), 772-780 (2012).
- Von Reuss, S. H., et al. Comparative metabolomics reveals biogenesis of ascarosides, a modular library of small-molecule signals in C. elegans. J Am Chem Soc. 134 (3), 1817-1824 (2012).
- Choe, A., et al. Sex-specific mating pheromones in the nematode panagrellus redivivus. Proc Natl Acad Sci U S A. 109 (51), 20949-20954 (2012).
- Hsueh, Y. P., Mahanti, P., Schroeder, F. C., Sternberg, P. W. Nematode-trapping fungi eavesdrop on nematode pheromones. Curr Biol. 23 (1), 83-86 (2013).
- Hong, M., et al. Early pheromone experience modifies a synaptic activity to influence adult pheromone responses of C. elegans. Curr Biol. 27 (20), 3168-3177.e3 (2017).
- Ryu, L., et al. Feeding state regulates pheromone-mediated avoidance behavior via the insulin signaling pathway in Caenorhabditis elegans. EMBO J. 37 (15), e98402 (2018).
- Diaz, S. A., Lindström, J., Haydon, D. T. Basic demography of Caenorhabditis remanei cultured under standard laboratory conditions. J Nematol. 40 (3), 167 (2008).
- Bargmann, C. I. Chemosensation in C. elegans. WormBook : the online review of C.elegans biology. , 1-29 (2006).
- Margie, O., Palmer, C., Chin-Sang, I. C. elegans chemotaxis assay. JoVE: J Vis Exp. (74), e50069 (2013).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유