このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
Caenorhabditis elegansにおける揮発性性フェロモン抽出と化学吸引アッセイ
要約
このプロトコルは、 C.エレガンスの揮発性性フェロモンに対する応答を抽出および定量化する方法を確立し、化学的コミュニケーションとナビゲーション軌道を研究するためのツールを提供します。
要約
化学的コミュニケーションは、生物の健康、生殖、および全体的な健康に不可欠です。これらのシグナルを支配する分子経路、神経プロセス、および計算を理解することは、依然として活発な研究分野です。線虫 Caenorhabditis elegansは 、揮発性の性フェロモンを生成するため、これらのプロセスを研究するための強力なモデルを提供します。このフェロモンは、処女の女性または精子が枯渇した雌雄同体によって合成され、男性の誘引物質として機能します。
このプロトコルは、いくつかの C.エレガンス 株(WT株N2、 daf-22、および fog-2)および C.remaneiから揮発性性フェロモンを単離するための詳細な方法を説明しています。また、揮発性性フェロモンに対する男性の走化性反応を定量化するためのプロトコルも提供しています。私たちの分析では、走化性指数(C.I.)、到着時間(A.T.)、軌道プロットなどの測定値を利用して、さまざまな条件下での男性の反応を正確に比較します。この方法により、異なる遺伝的背景または発達段階の男性間の堅牢な比較が可能になります。さらに、ここで概説した実験装置は、他の化学誘引性化学物質の調査にも適応可能です。
概要
化学的コミュニケーションと生殖の成功との間の相互作用は、動物界1,2,3,4,5,6,7,8,9,10全体にわたる基本原則です。性フェロモンは、配偶者を見つけ、パートナーを見つけて引きつけるためのステップを調整し、最終的に種の繁殖を促進するために不可欠な、さまざまな性的に二形性の行動を引き起こします11,12,13,14,15,16,17.フェロモンシグナル伝達の理解は大きく進歩しているが、これらの相互作用を支配する分子メカニズム、神経回路、および計算過程は、しばしば不完全なままである18,19,20,21,22,23,24,25,26。
線虫Caenorhabditis elegansは、これらの疑問を解剖するための強力なモデルを提供します。特に、C.エレガンスは珍しい繁殖戦略を示しています-雌雄同体は自家受精できるだけでなく、オスと交配することもできます27,28,29,30,31,32,33。この柔軟性には、生殖状態を知らせるための堅牢な通信システムが必要です。C.エレガンスは、その特徴がはっきりとした水溶性フェロモンであるアスカロシドで知られており、発生、行動、および社会的相互作用においてさまざまな役割を果たします。最近の発見により、線虫が使用する揮発性の性フェロモンの明確なクラスが明らかになりました。これらのフェロモンは、性的に成熟したC.エレガンスとC.レマネイ処女の女性、および精子が枯渇した雌雄同体によって特異的に産生され、成人男性の誘引剤として機能します29,34,35。この誘引剤は、その生成と知覚において顕著な性的二形性を示します。女性の体性生殖腺は、この揮発性の性フェロモンの合成を支配し、生産は動的に生殖状態を反映し、交尾を停止し、数時間後に再開します29,34。
線虫の性フェロモンコミュニケーションを理解することは、化学的コミュニケーションシステムの進化、生殖状態と行動の間の相互作用、および性的に二形性神経処理の根底にあるメカニズムについての洞察を提供します24,26,36,37,38,39.研究では、男性の両生ニューロンAWAがフェロモン検出に重要であることが示唆されており、Gタンパク質共役受容体SRD-1が男性のフェロモン検出に重要な役割を果たしています24。C.エレガンスは、配偶者探索を嗅覚系に依存しているため、動物の化学的コミュニケーション、特に性フェロモンシグナル伝達の研究に適しています。アスカロシドシグナル伝達については多くのことが知られていますが、揮発性性フェロモンシステムは、比較のためのユニークな機会を提供します 25,26,36,40,41,42,43,44,45,46,47,48,49,50 、
51、52、53、54、55、56、57。さらに、 C.エレガンスは 、その完全に配列決定されたゲノム、明確に定義された細胞系統、および十分に特徴付けられた嗅覚変異体により、強力な遺伝モデル生物です。
しかし、このフェロモンの処理に関与する完全な神経回路、その知覚を標的とした配偶者探索行動に変換する計算、およびその生合成制御については、まだ完全に解明されていません。これらの過程のさらなる研究は、動物のコミュニケーションと生殖行動を支配する多様なメカニズムを理解するために重要です。フェロモンの合成、分泌、知覚に関与する主要な遺伝子の同定は、動物コミュニケーションにおける新たな分子プレーヤーを明らかにすることを約束します。ここで説明するアッセイは、これらの疑問に対処するための基礎を提供します。
プロトコル
1. 雌と雌雄同体からの粗い性フェロモン抽出
- C.エレガンス同期のプロトコル
- 成人女性または雌雄同体の調製
- 成体の女性/雌雄同体の大規模な集団が存在し、OP50の食料源が枯渇するまで、培養プレートを毎日監視します。 fog-2 C. elegans とWT C. remanei の雌を粗性フェロモン抽出に用い、交配した雌から同期卵を作製する。
注:このプロトコルでは、自己精子を産生しない C.エレガンスfog-2 変異XX動物は、 C.エレガンス メスと呼ばれます。
- 成体の女性/雌雄同体の大規模な集団が存在し、OP50の食料源が枯渇するまで、培養プレートを毎日監視します。 fog-2 C. elegans とWT C. remanei の雌を粗性フェロモン抽出に用い、交配した雌から同期卵を作製する。
- ワームの洗浄とペレット化
- 成虫をM9バッファーを含む混合ポピュレーションプレートから洗い流します。ワーム懸濁液を1.5 mLの微量遠心チューブに集めます。1,500 × g で0.5〜1分間遠心分離し、線虫をペレット化します。
注意: 重度の汚染に対するプレクリーニング(オプション):ひどく汚染されている場合は、ワームをチューブに沈殿させます。上澄みをピペットで取り出してバクテリアを取り除き、上澄みが透明になるまで繰り返します。
- 成虫をM9バッファーを含む混合ポピュレーションプレートから洗い流します。ワーム懸濁液を1.5 mLの微量遠心チューブに集めます。1,500 × g で0.5〜1分間遠心分離し、線虫をペレット化します。
- 漂白
- 200 μLのM9バッファーをワームペレットに加えます。家庭用漂白剤と1 M NaOHを1:1の比率で混合して、溶解バッファーを調製します。この溶解バッファー500μLを混合物に加え、10秒間ボルテックスした後、解剖顕微鏡で溶解状態をモニターするために一時停止します。このプロセスを10秒の渦を繰り返し、成虫が完全に溶解するまで観察します。
- 胚の漂白とペレット化の停止
- 成虫を小さな断片に溶解した(完全には溶解していない)場合は、すぐに500 μLのM9バッファーを添加して反応を遅らせます。15,000 × g で30〜60秒間遠心分離し、胚をペレット化します。
注:過剰溶解は胚に損傷を与える可能性があります。成虫の体が小さな破片に分解されたら、反応を停止します。遠心分離機および洗浄ステップ中、溶解は、すべての溶解バッファーが除去されるまで続きます。
- 成虫を小さな断片に溶解した(完全には溶解していない)場合は、すぐに500 μLのM9バッファーを添加して反応を遅らせます。15,000 × g で30〜60秒間遠心分離し、胚をペレット化します。
- 胚を1mLのM9バッファーで5回洗浄し、各洗浄後に15,000 × g で30〜60秒間遠心分離します。遠心分離後、上清を除去します。
- 同期
- 1.5 mLの微量遠心チューブ内の800 μLのM9バッファーに胚を再懸濁します。L1の孵化および食糧供給のためのL1の段階でのワームの停止のための12-15時間のための管を20°Cで回して下さい。ワームを放出し、L4段階に達するまで3日間20°Cで培養します。
- 成人女性または雌雄同体の調製
2. 生後1日齢の処女雌からの粗い性フェロモン抽出(図1A)
注:私たちは、C.エレガンスの1日齢の処女fog-2(生殖細胞の女性化)突然変異体雌とC.remaneiのWT雌から性フェロモンを抽出するために、以前に確立されたプロトコル24を採用しています。
- 成人女性の準備
- フェロモン抽出の1日前に、約200匹のL4ステージ fog-2 メスを選択して分離します。処女の女性のみが収集されるように、これらのL4 fog-2 の女性を性別ごとに慎重に分離し、3つの別々の6 cm OP50 NGMプレートに分配します。各プレートの中央に少量のOP50バクテリアを置きます。
注:200匹のL4メスワームを3つの別々のプレートに分散させて、誤ってオスのワームをプレートに導入するリスクを回避します。オスが選ばれると、多くのメスと交尾する可能性が高く、その結果、ほとんどのメスが成体になる翌日までに受精します。受精した女性は、精子が枯渇するまで揮発性の性フェロモンを放出せず、それが抽出結果に影響を与えます。食料源が限られているため、雌雄同体はプレートの中央の小さな領域に制限され、隔離期間中にプレートから逃げる可能性が最小限に抑えられます。
- フェロモン抽出の1日前に、約200匹のL4ステージ fog-2 メスを選択して分離します。処女の女性のみが収集されるように、これらのL4 fog-2 の女性を性別ごとに慎重に分離し、3つの別々の6 cm OP50 NGMプレートに分配します。各プレートの中央に少量のOP50バクテリアを置きます。
- 抽出プロセス
- 抽出日(生殖成熟の1日目、線虫がL1停止から解放されてから3日後)に、100匹の処女、1日齢の fog-2 メスを選び、1mLのM9バッファーを含むマイクロ遠心チューブに分離します。雌をM9バッファーで5回洗浄して細菌汚染を最小限に抑え、100 μLのM9バッファーで20°Cで6時間インキュベートして、フェロモンの生成と培地への蓄積を可能にします。
- C. remaneiの雌についても同様の抽出プロセスを行い、抽出の前日に分離した15〜20のL4ステージの雌のみを3つのプレートに使用し、翌日、5匹の処女雌を100μLのM9緩衝液で25°C(C. remaneiの最適な増殖温度)で6時間インキュベートする58。
注: C. remanei の雌は、 C. elegans の雌と比較して、揮発性の性フェロモンを多く産生します。したがって、100μLの粗揮発性性フェロモンを抽出するには、わずか5人の女性で十分です。
- 貯蔵
- 15,000 × g でサンプルを30〜60秒間遠心分離し、ワームをペレット化します。上清(フェロモンを含む)を清潔なチューブに慎重にピペットで移し、ワームペレットの入ったチューブを廃棄します。単離された上清は、その後の化学吸引アッセイのために保存してください。
注:粗揮発性性フェロモン抽出物は、蒸発を最小限に抑えるためにパラフィルムで包まれた微量遠心チューブに-80°Cで少なくとも1年間保存できます。
- 15,000 × g でサンプルを30〜60秒間遠心分離し、ワームをペレット化します。上清(フェロモンを含む)を清潔なチューブに慎重にピペットで移し、ワームペレットの入ったチューブを廃棄します。単離された上清は、その後の化学吸引アッセイのために保存してください。
- 品質管理
- 抽出物を使用する前に、N2雄または him-5 雄を使用して品質管理試験を実施し、その化学引力を確認してください(セクション4を参照)。
3. 生後6日齢の処女雌雄同体からの大量の粗い性フェロモン抽出(図1A)
- ワーム培養
- 約20 mLの粗 線虫 性フェロモンを得るためには、健康な成虫 の線虫 (N2または daf-22 変異体)を含む20枚の10 cm NGMプレートを前述の漂白剤プロトコルを使用して同期させ、M9バッファーで5回洗浄します。
注:このプロセスは、フェロモン抽出のための十分な胚を準備します。N2:水溶性アスカロシドフェロモンと非アスカロシド揮発性性性フェロモンの両方を産生する標準的な WTエレガンス 株。 daf-22 変異体:多くのアスカロシドフェロモンを産生する能力を欠く変異体であり、非アスカロシド揮発性性フェロモンを単独で研究するのに役立ちます。 - L1段階で線虫を同期させるには、M9バッファー内の胚を12〜15時間回転させて発生を阻止します。停止したL1線虫をOP50細菌を播種した10 cm NGM培養プレートに移し、増殖と発生させます。
- 雌雄同体のプレート上のオスの存在を最小限に抑えるには、ワームの放出から2日後、L4段階でプレートをチェックし、観察されたオス(非常にまれ)をすべて取り除きます。
- 発生の3日後、線虫が生殖的に成熟した成虫になったことを示す胚の出現を探します。
注:C. elegansのfog-2変異体雌およびC. remaneiのWT雌は、大量の揮発性性フェロモン抽出には適していません。fog-2変異体C.エレガンスとC.レマネイは、その集団に占めるオスの割合が高く、オスはメスと継続的に交尾します。受精した女性は揮発性の性フェロモンを生成しません。男性の存在は、これらの化合物の抽出を複雑にします。
- 約20 mLの粗 線虫 性フェロモンを得るためには、健康な成虫 の線虫 (N2または daf-22 変異体)を含む20枚の10 cm NGMプレートを前述の漂白剤プロトコルを使用して同期させ、M9バッファーで5回洗浄します。
- ワーム洗浄と胚分離
- 胚をM9バッファーで繰り返し洗浄し、ほとんどの成体がチューブの底に来るまで沈殿させます(1 g の沈降)。5〜7回繰り返します。マイクロ遠心チューブをラックに数分間邪魔されずに沈殿させて、成虫の沈降を促進し、上清に懸濁したままの胚から成虫の集団を分離できるようにします。
- 分離した成体をピペットで移し、新しいOP50播種NGMプレートに移します。
- この洗浄プロセスを5〜6日間繰り返して、自己精子を枯渇させます。
注:揮発性の性フェロモンの抽出には、5〜6日齢の雌雄同体を利用します。このタイミングにより、利用可能な自己精子を持つ雌雄同体は揮発性の性フェロモンを生成しないため、自己精子が枯渇する可能性が高くなります。5日目または6日目までにプレート上に多数の死んだ胚または孵化していない胚は、フェロモン抽出を開始する適切な時期を示しています。
- 性フェロモン抽出
- セクション1に記載されているように性フェロモンを抽出し、変更を加えます。
- 100 μLあたり100匹の C.エレガンスの 雌を添加する代わりに、最終的な線虫ペレットの量に基づいてM9バッファーを添加します。パックされた線虫50μLあたり1mLのM9バッファーを添加します。
- 品質管理と均質化
- N2雄または him-5 雄を用いた化学療法吸引アッセイを用いた抽出されたフェロモンの品質管理試験バッチ(セクション4参照)。
- すべてのバッチを混合して、スクリーニングやマイクロ流体実験など、大量のフェロモンが必要な実験用の均質な粗揮発性性フェロモンを作成します。粗性フェロモン抽出物は、蒸発を最小限に抑えるために、パラフィルムで包んだ50mLチューブに-80°Cで少なくとも1年間保存してください。
- 粗性フェロモン抽出物の標準化のためのChemoattractionアッセイに基づく滴定法
- WT N2およびhim-5雄の C.エレガンスについて、各フェロモン抽出物の段階希釈液を試験することにより、滴定アッセイを実施します。コントロール株において堅牢で再現性のある走化性レスポンスを一貫して引き出す最高希釈度(最低濃度)を決定します。
- 各粗抽出物(1:2、1:4、1:8など)からM9バッファーに一連の希釈液を調製します。
- 走化性アッセイ
- 標準化された走化性アッセイ(セクション4を参照)を、雄の参照株の各希釈液を用いて実施します。再現性を確保するために、3回の繰り返しを実行します。異なる抽出バッチ間で最適な希釈を比較して、フェロモン濃度の一貫性を評価します。
注:これにより、各抽出物の生理活性を評価するための基準点が確立されます。標準的な性フェロモン化学療法アッセイでは、元の原液抽出物をその後の実験に使用し、滴定はバッチ間で一貫したフェロモン活性を確保するための品質管理ステップとして機能します。希釈シリーズは、特定の実験ニーズに基づいて調整することができます。標準抽出プロトコルでは、飽和粗フェロモン抽出物が一貫して得られるため、抽出物を標準化するための滴定試験は、ほとんどの実験で必要ない可能性があります。一貫性を維持し、フェロモン活性の変動を最小限に抑えるために、一連の関連実験全体で同じバッチの粗性フェロモンを使用することをお勧めします。.
- 標準化された走化性アッセイ(セクション4を参照)を、雄の参照株の各希釈液を用いて実施します。再現性を確保するために、3回の繰り返しを実行します。異なる抽出バッチ間で最適な希釈を比較して、フェロモン濃度の一貫性を評価します。
4. 揮発性性フェロモンケモアトラクションアッセイ
注:揮発性性フェロモン化学療法アッセイは、他の化学療法研究24,29,59,60,61で以前に確立された方法から適応されています。これらの変更は、揮発性性フェロモンに対する反応を検出するためのアッセイの感度と特異性を最適化するために実施されました。このカスタマイズされたアプローチにより、特定の研究ニーズに対するアッセイの適用性が向上します。
- 成体の女性/雌雄同体が豊富になるまで、毎日培養プレートを観察します。ワームの健康状態は、性フェロモンに対するワームの反応に影響を与えます。
- 彼の準備-5人の男性
- 標準の漂白剤プロトコルを利用して 、him-5 ワームを同期させます。同期後、ワームをM9バッファーで5回洗浄します。アッセイの前日にL4雄を分離します。次に、1日齢の成虫の雄虫を播種したプレートから移し、アッセイの前にM9バッファーですすいでください。アッセイの前に、シードされていないNGMプレートにそれらを置いて、残留細菌を除去し、アッセイ中の食品からの干渉を防ぎます。
注:アッセイの1時間以上前にワームを飢餓状態にしないでください、これはワームの内部状態を変化させ、性フェロモン化学療法アッセイの結果に影響を与える可能性があるためです。したがって、1 日に 10 回を超えるアッセイを実施する場合は、1 時間ごとに線虫サンプルを交換してください。さらに、1つの実験アッセイと1つのコントロールアッセイを繰り返し交互に行います。
- 標準の漂白剤プロトコルを利用して 、him-5 ワームを同期させます。同期後、ワームをM9バッファーで5回洗浄します。アッセイの前日にL4雄を分離します。次に、1日齢の成虫の雄虫を播種したプレートから移し、アッセイの前にM9バッファーですすいでください。アッセイの前に、シードされていないNGMプレートにそれらを置いて、残留細菌を除去し、アッセイ中の食品からの干渉を防ぎます。
- ケモ引力寒天アッセイプレートの調製
- 関連文献24に記載されているように、1.5%寒天、25 mM NaCl、1.5 mM Tris-base、および3.5 mM Tris-Clを含むケモアトラクションアッセイプレートを調製します。
- 寒天をマイクロ波を使用して化学吸引溶液中で完全に溶解するまで加熱します。溶液を室温で5分間冷まします。
- ピペットエイドを使用して、ケモアトラクション寒天溶液をペトリ皿に均等に分配します:各10 cm皿に30 mLを注ぎ、各6 cm皿に20 mLを注ぎます。.
- ケモアトラクション寒天溶液をペトリ皿に注いだ後、寒天の表面がわずかに乾くまで、清潔な場所で蓋を少なくとも40分間開いたままにします。表面が適度に乾いたら、フタを閉めます。
注:この乾燥時間は、実験室の湿度と温度によって異なる場合があります。
- プレートの保管とアッセイ前の調製
- 調製したアッセイプレートを箱詰めし、冷蔵室で最大1週間保管します。使用する前に、プレートを冷蔵保存から取り出し、室温に1時間以上順応させてください。分析の20分前に蓋を開けて、きれいな場所で寒天から残留水分を蒸発させ、分析を行う前に表面に明らかな水がないことを確認します。
- 実験デザインとケモアトラクションアッセイ
- ケモアトラクションアッセイを行うには、蓋とペトリ皿の下側に3つの異なるスポットをマークするか、透明なプラスチック紙に印刷されたテンプレートを皿の下に置くか、解剖顕微鏡に取り付けます。これらのマーキングには、線虫の開始点としての中央のドット(•)、実験スポット(蓋に2 μLの性フェロモン、プレートに2 μLの1 Mアジ化ナトリウム)、コントロールスポット(蓋に2 μLのM9バッファーと2 μLの1 Mアジ化ナトリウム)のマイナス記号(+)が含まれます(図2A)。これらのマーク間の距離は、皿のサイズと特定の実験ニーズに応じて調整してください。通常、6cmのシャーレの場合、ポジティブコントロールテストの開始点から各テスト物質まで1.5cmの固定距離を設定します。
- アッセイを実施するための詳細な手順(図2)
- 2 μLの1 Mアジ化ナトリウムをプレート上の各実験スポットおよびコントロールスポットに適用します。
- ワームピッカーで健康で自由に動くオスのワームを20匹選びます。解剖顕微鏡下で開始点で20匹の雄性ワームを同時に放出します。
- 2 μL の性フェロモンと 2 μL の M9 バッファーを、それぞれまぶたの実験スポットとコントロールスポットにすばやく加えます。
- 蓋を静かに閉め、アッセイプレートを顕微鏡の隣の静かで温度が安定した場所に置きます。
- 30分後、各スポットの線虫の数を数えてアッセイを採点します。
注:20匹のワームを摘み取るプロセスは、最初に摘み取ったワームが乾燥して健康でなくなるのを防ぐために、1〜2分を超えないようにする必要があります。オスを選ぶから蓋を閉めるまでの全プロセスには、2分から5分かかります。
- ポジティブコントロールスクリーニング
- 雄の線虫をジアセチルの1,000倍希釈溶液(10%エタノールおよび90%M9バッファーに溶解)で試験し、走化性応答性を確認します。テスト開始から30分後にケモアトラクションアッセイの結果を評価します。指定された場所で麻痺したワームを、その位置に基づいてスコアリングします:コントロールスポットのものには「C」、実験スポットのものには「E」。どちらのスポットにもワームを「N」としてスコアを付けます(図2C)。
- 化学吸引指数(C.I.)を計算するには、次の式を使用します。
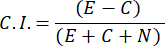
- 走化性指数が0.4≥男性サンプルのみを選択します(C.I.、 図2Cを参照)。同じバッチのオスをその後の性フェロモンテストに使用します。.
注:実験結果の一貫性と信頼性を確保するために、それぞれ20匹の線虫を含む3つの別々のアッセイを実施します。通常、一貫性を推測するには3つのアッセイで十分です。
5. ケモアトラクションアッセイのタイミングとスコアリングのガイドライン
- 線虫の化学引力反応を最終的な位置に基づいて評価します。アッセイの終了時(通常は開始から30分後)に、各スポットでの線虫の数をスコアリングします。
注:実験スポットとコントロールスポットでアジ化ナトリウムを使用すると、到着する線虫が麻痺し、正確なスコアリングが容易になります。ほとんどのWT N2および him-5 のオスは、1.5 cmの距離のセットアップで6 cmプレートで6〜8分以内にフェロモン源を見つけることができます。 - 走化性効率の欠陥を捕捉するため、特に微妙な欠陥を検出するために、アッセイを3〜5分間隔で定期的にモニタリングすることを検討してください。
注:この頻繁な観察により、ワームがテストスポットに到着した時間を文書化できます。このような詳細な追跡により、線虫が走化性効率が低下しているにもかかわらず、検査ウィンドウ内でテストスポットに到達できるケースを明らかにすることができます。
6. オプションの変更
- 走化性の評価を強化するには、プレートの上に配置されたカメラを使用して、アッセイ全体にわたる線虫の軌跡を記録します。
注:この変更により、それらの移動パターンの包括的な分析が可能になり、化学引力の挙動と軌道についてより深い洞察が得られます(図3)。
7. データ分析
- Chemoattraction Index(C.I.)のスコアリングと計算
- 手順 4.7.1 と 4.7.2 に従います。
- 到着時間プロット
- ケモアトラクションアッセイのより包括的な分析を行うには、アッセイを3〜5分間隔でモニタリングするか、プレートの上に配置されたカメラを使用してアッセイ全体の線虫の軌跡を記録することを検討してください。
注:これらのアプローチでは、設計スポットでのワームの到着時間をスコアリングできるだけでなく、平均到着時間を比較し、これらの時間の分布を分析することもできます。
- ケモアトラクションアッセイのより包括的な分析を行うには、アッセイを3〜5分間隔でモニタリングするか、プレートの上に配置されたカメラを使用してアッセイ全体の線虫の軌跡を記録することを検討してください。
- ビデオベースの軌道解析とデータの可視化
注:の動きのパターンを分析するには C. elegans ケモアトラクションアッセイ中に、軌跡を記録して抽出します( 資料表)およびさらなる分析(図 3).- 録音システムを設定します。
- 新しい録音を開始し、 録音設定 ウィンドウにアクセスします。
- 必要な録画パラメータを定義します。
- ファイルのプレフィックス: 動画ファイルのわかりやすい名前を選択します (例: 「experiment1_」)。
- フレームレート(FPS):ワームの動きをキャプチャするための適切なフレーム/秒を選択します(たとえば、寒天プレート上のワームの場合は7.5 FPS、遊泳ワームの場合は30 FPS)。
- Duration(持続時間):記録の長さを秒単位で設定します(例:バルク化学吸引アッセイの場合は1,800秒[30分])。
- 画質を最適化する:照明の強度を調整して、ワームが背景に対してはっきりと見えるようにし、フォーカスを微調整してワームの鮮明な画像を取得します。
- アッセイプレートを調製するには、まずコントロール溶液を指定されたコントロールスポットに分注します。次に、ワームを慎重に拾い上げ、プレートの中央にそっと放します。線虫が落ち着いたら、性フェロモン溶液を指定された実験スポットに適用します。
- プレートを配置する:キャプチャ領域を最大化するために、ワームを含むプレートを記録フィールドの中央に慎重に配置します。
- 走化性アッセイ中の線虫へのストレスを軽減するには、次の2つのアプローチを検討してください。
- シングルワームアッセイの場合は、ワームをアッセイプレートに置き、5分間順応させてから、指定された距離(ワームの現在位置に基づく位置)に性フェロモン溶液を導入します。
メモ: これにより、取り扱いが最小限に抑えられ、ワームが新しい環境に順応する時間を確保できます。 - バルクケモアトラクションアッセイ:ワームがプレート上に5分間自然に沈殿し、分散するのを待ちます。この順応期間の後、フェロモン溶液を所定の固定位置に導入します。ビデオ解析後に、各線虫のフェロモンからの開始距離を測定し、それに応じてグループ化してさらに解析します。
- シングルワームアッセイの場合は、ワームをアッセイプレートに置き、5分間順応させてから、指定された距離(ワームの現在位置に基づく位置)に性フェロモン溶液を導入します。
- ビデオ解析の手順
- インポートとセットアップ:録画したビデオをソフトウェアにインポートします。シーケンス情報(フレームレートなど)を設定します。画像スケール(測定単位あたりのピクセル数)を指定します。
- 画像調整: ワーム検出を最適化するには、バックグラウンド ノイズやアーティファクトをキャプチャせずに、緑色のラベルがワームの輪郭をしっかりと示すまで 検出しきい値 を調整します。さらに、背景のスムージング アルゴリズムを適用して、画像のノイズやムラを減らし、ワームと背景のコントラストを強化します。さまざまなスムージング レベルを試して、ノイズ リダクションとワームの詳細の保存の最適なバランスを見つけます。
注:理想的なしきい値は、無関係な要素を除外しながら、各ワームの体の大部分をカバーする必要があります。 - 検出パラメータの最適化:代表的なワームを選択して、検出パラメータを自動生成します。5〜10個のランダムフレームを目視検査して、検出精度を確認します。検出が不十分な場合は、検出パラメータを手動で調整し、必要に応じて画像調整設定を再検討し、検出が信頼できるとしたら追跡に進みます。
- トラッキング軌道の校正と修復: 自動追跡プロセスが完了したら、生成された軌道の手動校正を実行します。校正中に不整合が見つかった場合は、 修復 機能を使用して軌道を修正し、次の操作 を実行します。 結合:異なる識別子が誤って割り当てられているが、同じ個人に属している軌道セグメントを接続します。 分割: 同じ識別子が誤って割り当てられているが、異なる個人に属している別々の軌道セグメント。
注:目標は、追跡期間全体を通じて、各一意の識別子(番号)が同じ個人に一貫して割り当てられるようにすることです。
例: ワームがある期間で "3" とラベル付けされ、その後の期間で誤って "7" とラベル付けされた場合、修復関数はこれら 2 つのセグメントを識別子 "3" の下に結合します。逆に、2 つの線虫が両方とも一定期間「12」とラベル付けされている場合、修復関数はこのセグメントを 2 つの別々の軌跡に分割し、それぞれに一意の識別子を付けます。丁寧に校正し、必要な修理を行うことで、トラッキングデータの精度と信頼性を大幅に向上させることができます。 - 結果の視覚化とエクスポート:視覚化と基本的な分析にソフトウェアを利用します。データをCSVファイルとしてエクスポートし、お好みのツールやコードでさらに分析できます。この方法は、5つの主要なパラメータに基づいて線虫の移動軌跡を視覚化するための基本的なコード(https://github.com/edmondztt/pheromone-traj-analysis.git を参照)を提供します(図3)。 時間:軌道の進行で、実験開始からの時間の経過を示すために色分けされています。 フェロモンまでの距離: 各時点における線虫とフェロモン源との間の距離。 速度: 各ポイントでのワームの速度で、ターンとストップのイベントも示していました。 真直度:ワームの経路がどれだけまっすぐであるか。 方向の正確さ:線虫の動きがフェロモンターゲットの方向にどの程度一致しているか?このコードは、ワームの動作を理解するための基本的な視覚化を提供し、より深い分析のためにカスタマイズおよび拡張できます。
注:この高度なアプローチは、性フェロモンに応答した線虫のナビゲーション軌道を詳述することにより、従来の化学療法指数に代わる包括的な方法を提供します。これにより、ナビゲーションや時間枠の決定という任意のエンドポイントに頼ることなく、移動パターンを理解することができ、アッセイの行動ダイナミクスについてより深い洞察を得ることができます。データは20フレームにわたって平均化され、特定の実験ニーズに基づいて調整でき、体のねじれによって引き起こされる動きをフィルタリングできます。
結果
化学吸引アッセイにおける揮発性性フェロモン知覚欠陥株の軌道解析
このケモアトラクションアッセイは、揮発性の性フェロモンに対する応答において、 C.エレガンスの 野生型と変異株を確実に区別します。 彼-5 の雄を用いた成功した実験は、フェロモン源に対して一貫して強い走化性を示しています。これは、高い走化性指数(C.I.)に?...
ディスカッション
このプロトコルは、C.エレガンスからの揮発性性フェロモンの抽出のための堅牢な方法論を提供するとともに、男性の化学吸引反応を測定するための堅牢な化学吸引アッセイを確立します。追加情報は、WormLabユーザーガイド(資料の表を参照)に記載されています。ワームの移動軌跡を視覚化する基本的なコードについては、プロトコルのセクショ?...
開示事項
著者には、開示すべき利益相反はありません。
謝辞
私たちの分析で使用した軌道視覚化のコードを設計および作成してくれたTingtao Zhou博士に感謝します。この研究は、R01 NS113119(PWS)、Chenシニアポスドクフェローシップ、Tianqiao and Chrissy Chen Institute for Neuroscienceの資金提供を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| 10 cm Petri dishes | Falcon | 25373-100 | Falcon bacteriological Petri dish 100 x 15 mm |
| 6 cm Petri dishes | Falcon | 25373-085 | Falcon bacteriological Petri dish 60 x 15 mm |
| C. remanei (EM464) | CGC | ||
| Centrifuge | Eppendorf | centrifuge 5418 | Any brand should work. |
| Chemoattraction assay plates | Homemade solution | N/A | 1.5% agar, 25 mM NaCl, 1.5 mM Tris-base, and 3.5 mM Tris-Cl |
| Cholesterol | Alfa Aesar | 57-88-5 | |
| Dissecting Microscope | Leica | LeicaMZ75 | Any brand should work. |
| E. Coli OP50 | CGC | ||
| Ethanol | Koptec | 64-17-5 | |
| fog-2(q71) (JK574) | CGC | ||
| him-5(e1490)(CB4088) | CGC | ||
| Household bleach | Clorox Germicidal bleach concentrated | Bleach | |
| M9 buffer | Homemade solution | N/A | 3 g KH2PO4, 11.3 g Na2HPO4.7H2O, 5 g NaCl, H2O to 1 L. Sterilize by autoclaving. Add 1 mL 1 M MgSO4 after cool down to room temperature. |
| Magnesium Sulfate, Anhydrous, Powder | Macron | M1063-500GM-EA | |
| Microwave | TOSHIBA | N/A | Any brand should work. |
| N2 | CGC | ||
| NaOH | Sigma-aldrich | S318-3 | 1 M |
| NGM plates solution | Homemade solution | N/A | 2.5 g Peptone, 18 g agar, 3 g NaCl, H2O to 1 L.Sterilize by autoclaving. Once the autoclave is done (2 h), wait until the temperature of the medium drops to 65 °C. Put on a hotplate at 65 °C and stir. Then add the following, waiting 5 min between each to avoid crystallization: 1 mL CaCl2 (1 M), 1 mL MgSO4 (1 M), 25 mL K3PO4 (1 M, pH=6), 1 mL Cholesterol ( 5 mg/mL in ethanol). |
| Parafilm | Bemis | 13-374-10 | Bemis Parafilm M Laboratory Wrapping Film |
| Peptone | VWR | 97063-324 | |
| Pipet- aid | Drummond Scientific | 4-000-100 | Any brand should work. |
| Plastic paper | Octago | Waterproof Screen Printing Inkjet Transparency Film | https://www.amazon.com/Octago-Waterproof-Transparency-Printing-Printers/dp/B08HJQWFGD |
| Potassium chloride | Sigma-aldrich | SLBP2366V | |
| Potassium phosphate | Spectrum | 7778-77-0 | |
| Pipette | Eppendorf | SKU: EPPR4331; MFG#: 2231300006 | 20 - 200 µL, 100 - 1000 µL, any brand should work. |
| Rotator | Labnet | SKU: LI-H5500 | Labnet H5500 Mini LabRoller with Dual Direction Rotator. Any brand should work. |
| Sodium chloride | VWR | 7647-14-5 | |
| sodium phosphate dibasic | Sigma-aldrich | SLCG3888 | |
| Tris-base | Sigma-aldrich | 77-86-1 | |
| Tris-Cl | Roche | 1185-53-1 | |
| Tryptone | VWR | 97063-390 | |
| Vortex | Scientific industries | Vortex-Genie 2 | Any brand should work. |
| WormLab system | MBF Bioscience | N/A | https://www.mbfbioscience.com/help/WormLab/Content/home.htm; https://www.mbfbioscience.com/products/wormlab/ |
| Wormpicker | Homemade | N/A | made with platinum and glass pipet tips |
参考文献
- Audesirk, T. E. Chemoreception in Alphysia californica. Iii. Evidence for pheromones influencing reproductive behavior. Behav Biol. 20 (2), 235-243 (1977).
- Traynor, K. S., Le Conte, Y., Page, R. E. Queen and young larval pheromones impact nursing and reproductive physiology of honey bee (Apis mellifera) workers. Behav Ecol Sociobiol. 68 (12), 2059-2073 (2014).
- Cowley, J. J., Wise, D. R. Pheromones, growth and behaviour. Ciba Found Study Group. 35, 144-170 (1970).
- Epple, G. Pheromones in primate reproduction and social behavior. Adv Behav Biol. 11, 131-155 (1974).
- Levinson, H. Z. Possibilities of using insectistatics and pheromones in pest control. Naturwissenschaften. 62 (6), 272-282 (1975).
- Roelofs, W. Manipulating sex pheromones for insect suppression. Environ Lett. 8 (1), 41-59 (1975).
- Marchlewska-Koj, A. Pheromones and mammalian reproduction. Oxf Rev Reprod Biol. 6, 266-302 (1984).
- Keverne, E. B. Neuroendocrinology briefings 11: Pheromones and reproduction. J Neuroendocrinol. 12 (11), 1045-1046 (2000).
- Rekwot, P. I., Ogwu, D., Oyedipe, E. O., Sekoni, V. O. The role of pheromones and biostimulation in animal reproduction. Anim Reprod Sci. 65 (3-4), 157-170 (2001).
- Gomez-Diaz, C., Benton, R. The joy of sex pheromones. EMBO reports. 14 (10), 874-883 (2013).
- Shorey, H. H., Gaston, L. K., Jefferson, R. N. Insect sex pheromones. Adv Pest Control Res. 8, 57-126 (1968).
- Bruce, H. M. Pheromones and behavior in mice. Acta Neurol Psychiatr Belg. 69 (7), 529-538 (1969).
- Shorey, H. H., Bartell, R. J. Role of a volatile female sex pheromone in stimulating male courtship behaviour in Drosophila melanogaster. Anim Behav. 18 (1), 159-164 (1970).
- Bobadoye, B., et al. Evidence of aggregation-sex pheromone use by longhorned beetles (coleoptera: Cerambycidae) species native to Africa. Environ Entomol. 48 (1), 189-192 (2019).
- Saunders, J. R. Sex pheromones in bacteria. Nature. 275 (5682), 692-694 (1978).
- Schulz, S., Toft, S. Identification of a sex pheromone from a spider. Science. 260 (5114), 1635-1637 (1993).
- Finnegan, D. E., Chambers, J. Identification of the sex pheromone of the guernsey carpet beetle, Anthrenussarnicus mroczkowski (coleoptera: Dermestidae). J Chem Ecol. 19 (5), 971-983 (1993).
- Vaillancourt, L. J., Raudaskoski, M., Specht, C. A., Raper, C. A. Multiple genes encoding pheromones and a pheromone receptor define the b beta 1 mating-type specificity in Schizophyllum commune. Genetics. 146 (2), 541-551 (1997).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook : the online review of C. elegans biology. , 1-22 (2013).
- Sakai, N., et al. A sexually conditioned switch of chemosensory behavior in C. elegans. PLoS One. 8 (7), e68676 (2013).
- Sengupta, S., Smith, D. P., Mucignat-Caretta, C. How Drosophila detect volatile pheromones: signaling, circuits, and behavior. Neurobiology of chemical communication. , (2014).
- Zhang, Y. K., Reilly, D. K., Yu, J., Srinivasan, J., Schroeder, F. C. Photoaffinity probes for nematode pheromone receptor identification. Org Biomol Chem. 18 (1), 36-40 (2019).
- Aprison, E. Z., Ruvinsky, I. Dynamic regulation of adult-specific functions of the nervous system by signaling from the reproductive system. Curr Biol. 29 (23), 4116-4123.e3 (2019).
- Wan, X., et al. SRD-1 in AWA neurons is the receptor for female volatile sex pheromones in C. elegans males. EMBO Rep. 20 (3), e46288 (2019).
- Peckol, E. L., Troemel, E. R., Bargmann, C. I. Sensory experience and sensory activity regulate chemosensory receptor gene expression in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 98 (20), 11032-11038 (2001).
- Jang, H., et al. Neuromodulatory state and sex specify alternative behaviors through antagonistic synaptic pathways in. C. elegans. Neuron. 75 (4), 585-592 (2012).
- Liu, K. S., Sternberg, P. W. Sensory regulation of male mating behavior in Caenorhabditis elegans. Neuron. 14 (1), 79-89 (1995).
- Chasnov, J. R., Chow, K. L. Why are there males in the hermaphroditic species Caenorhabditis elegans. Genetics. 160 (3), 983-994 (2002).
- Chasnov, J. R., So, W. K., Chan, C. M., Chow, K. L. The species, sex, and stage specificity of a Caenorhabditis sex pheromone. Proc Natl Acad Sci U S A. 104 (16), 6730-6735 (2007).
- Susoy, V., et al. Natural sensory context drives diverse brain-wide activity during C. elegans mating. Cell. 184 (20), 5122-5137.e17 (2021).
- Barriere, A., Felix, M. A. High local genetic diversity and low outcrossing rate in Caenorhabditis elegans natural populations. Curr Biol. 15 (13), 1176-1184 (2005).
- Click, A., Savaliya, C. H., Kienle, S., Herrmann, M., Pires-Dasilva, A. Natural variation of outcrossing in the hermaphroditic nematode Pristionchus pacificus. BMC Evol Biol. 9, 75 (2009).
- Anderson, J. L., Morran, L. T., Phillips, P. C. Outcrossing and the maintenance of males within C. elegans populations. J Hered. 101 (suppl_1), S62-S74 (2010).
- Leighton, D. H., Choe, A., Wu, S. Y., Sternberg, P. W. Communication between oocytes and somatic cells regulates volatile pheromone production in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 111 (50), 17905-17910 (2014).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Fagan, K. A., et al. A single-neuron chemosensory switch determines the valence of a sexually dimorphic sensory behavior. Curr Biol. 28 (6), 902-914.e5 (2018).
- Lipton, J., Kleemann, G., Ghosh, R., Lints, R., Emmons, S. W. Mate searching in Caenorhabditis elegans: A genetic model for sex drive in a simple invertebrate. J Neurosci. 24 (34), 7427-7434 (2004).
- Frady, E. P., Palmer, C. R., Kristan, W. B. Sexual attraction: Sex-specific wiring of neural circuitry. Curr Biol. 22 (22), R953-R956 (2012).
- Liu, Q., et al. Two preputial gland-secreted pheromones evoke sexually dimorphic neural pathways in the mouse vomeronasal system. Front Cell Neurosci. 13, 455 (2019).
- Ludewig, A. H., et al. Pheromone sensing regulates Caenorhabditis elegans lifespan and stress resistance via the deacetylase sir-2.1. Proc Natl Acad Sci U S A. 110 (14), 5522-5527 (2013).
- Golden, J. W., Riddle, D. L. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Butcher, R. A., Fujita, M., Schroeder, F. C., Clardy, J. Small-molecule pheromones that control dauer development in Caenorhabditis elegans. Nat Chem Biol. 3 (7), 420-422 (2007).
- Jeong, P. Y., et al. Chemical structure and biological activity of the Caenorhabditis elegans dauer-inducing pheromone. Nature. 433 (7025), 541-545 (2005).
- Butcher, R. A., Ragains, J. R., Kim, E., Clardy, J. A potent dauer pheromone component in Caenorhabditis elegans that acts synergistically with other components. Proc Natl Acad Sci U S A. 105 (38), 14288-14292 (2008).
- Aprison, E. Z., Ruvinsky, I. Counteracting ascarosides act through distinct neurons to determine the sexual identity of C. elegans pheromones. Curr Biol. 27 (17), 2589-2599.e3 (2017).
- Aprison, E. Z., Ruvinsky, I. Sex pheromones of C. elegans males prime the female reproductive system and ameliorate the effects of heat stress. PLoS Genet. 11 (12), e1005729 (2015).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Kaplan, F., et al. Ascaroside expression in Caenorhabditis elegans is strongly dependent on diet and developmental stage. PLoS One. 6 (3), e17804 (2011).
- Pungaliya, C., et al. A shortcut to identifying small molecule signals that regulate behavior and development in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 106 (19), 7708-7713 (2009).
- Srinivasan, J., et al. A modular library of small molecule signals regulates social behaviors in Caenorhabditis elegans. PLoS Biol. 10 (1), e1001237 (2012).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Choe, A., et al. Ascaroside signaling is widely conserved among nematodes. Curr Biol. 22 (9), 772-780 (2012).
- Von Reuss, S. H., et al. Comparative metabolomics reveals biogenesis of ascarosides, a modular library of small-molecule signals in C. elegans. J Am Chem Soc. 134 (3), 1817-1824 (2012).
- Choe, A., et al. Sex-specific mating pheromones in the nematode panagrellus redivivus. Proc Natl Acad Sci U S A. 109 (51), 20949-20954 (2012).
- Hsueh, Y. P., Mahanti, P., Schroeder, F. C., Sternberg, P. W. Nematode-trapping fungi eavesdrop on nematode pheromones. Curr Biol. 23 (1), 83-86 (2013).
- Hong, M., et al. Early pheromone experience modifies a synaptic activity to influence adult pheromone responses of C. elegans. Curr Biol. 27 (20), 3168-3177.e3 (2017).
- Ryu, L., et al. Feeding state regulates pheromone-mediated avoidance behavior via the insulin signaling pathway in Caenorhabditis elegans. EMBO J. 37 (15), e98402 (2018).
- Diaz, S. A., Lindström, J., Haydon, D. T. Basic demography of Caenorhabditis remanei cultured under standard laboratory conditions. J Nematol. 40 (3), 167 (2008).
- Bargmann, C. I. Chemosensation in C. elegans. WormBook : the online review of C.elegans biology. , 1-29 (2006).
- Margie, O., Palmer, C., Chin-Sang, I. C. elegans chemotaxis assay. JoVE: J Vis Exp. (74), e50069 (2013).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved