A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מיצוי פרומון מין נדיף ובדיקת כימותרפיה ב- Caenorhabditis elegans
In This Article
Summary
פרוטוקול זה קובע שיטות לחילוץ וכימות תגובות לפרומון המין הנדיף ב- C. elegans, ומספק כלים לחקר תקשורת כימית ומסלול ניווט.
Abstract
תקשורת כימית חיונית לבריאות האורגניזם, לרבייה ולרווחה הכללית. הבנת המסלולים המולקולריים, התהליכים העצביים והחישובים השולטים באותות אלה נותרה תחום מחקר פעיל. הנמטודה Caenorhabditis elegans מספקת מודל רב עוצמה לחקר תהליכים אלה מכיוון שהיא מייצרת פרומון מין נדיף. פרומון זה מסונתז על ידי נקבות בתולות או הרמפרודיטים מדולדלי זרע ומשמש כמושך לזכרים.
פרוטוקול זה מתאר שיטה מפורטת לבידוד פרומון המין הנדיף ממספר זנים של C. elegans (זן WT N2, daf-22 ו-fog-2) ו-C. remanei. אנו מספקים גם פרוטוקול לכימות תגובת הכימוטקסיס הגברית לפרומון המין הנדיף. הניתוח שלנו משתמש במדידות כגון מדד כימוטקסיס (C.I.), זמן הגעה (A.T.) ותרשים מסלול כדי להשוות במדויק תגובות גברים בתנאים שונים. שיטה זו מאפשרת השוואה חזקה בין זכרים בעלי רקע גנטי שונה או שלבי התפתחות שונים. יתר על כן, מערך הניסוי המתואר כאן ניתן להתאמה לחקר כימיקלים כימותרפיים אחרים.
Introduction
יחסי הגומלין בין תקשורת כימית להצלחת הרבייה הם עיקרון בסיסי ברחבי ממלכת החי 1,2,3,4,5,6,7,8,9,10. פרומוני מין מעוררים מגוון רחב של התנהגויות דימורפיות מיניות החיוניות לאיתור בני זוג, תיאום הצעדים הכרוכים במציאת בן זוג ובמשיכתו, ובסופו של דבר לקידום התפשטות המין 11,12,13,14,15,16,17. התקדמות משמעותית הושגה בהבנת איתות פרומון, אך המנגנונים המולקולריים, המעגלים העצביים והתהליכים החישוביים השולטים באינטראקציות אלה נותרים לעתים קרובות מוגדרים חלקית18,19,20,21,22,23,24,25,26.
הנמטודה Caenorhabditis elegans מספקת מודל רב עוצמה לניתוח שאלות אלה. יש לציין כי C. elegans מציג אסטרטגיית רבייה יוצאת דופן - הרמפרודיטים יכולים להפרות את עצמם אך גם לחצות עם זכרים 27,28,29,30,31,32,33. גמישות זו דורשת מערכת תקשורת חזקה כדי לאותת על מצב הרבייה. C. elegans ידוע בפרומונים מסיסים במים המאופיינים היטב שלו, האסקרוסידים, הממלאים תפקידים מגוונים בהתפתחות, התנהגות ואינטראקציות חברתיות. תגליות אחרונות חשפו סוג מובחן של פרומוני מין נדיפים המשמשים נמטודות. פרומונים אלה מיוצרים במיוחד על ידי נקבות בתולות C. elegans ו-C. remanei בוגרות מינית והרמפרודיטים מדולדלי זרע, ומשמשים כגורם משיכה לזכרים בוגרים 29,34,35. מושך זה מפגין דימורפיזם מיני יוצא דופן בייצורו ובתפיסתו. נקבת הגונד הסומטית שולטת בסינתזה של פרומון מין נדיף זה, והייצור משקף באופן דינמי את מצב הרבייה, מפסיק עם ההזדווגות ומתחדש כעבורמספר שעות 29,34.
הבנת תקשורת פרומון המין של נמטודה מספקת תובנות על האבולוציה של מערכות תקשורת כימיות, יחסי הגומלין בין מצב הרבייה להתנהגות, והמנגנונים העומדים בבסיס עיבוד עצבי דימורפי מיני 24,26,36,37,38,39. מחקרים מצביעים על כך שנוירון האמפיד AWA בזכרים הוא קריטי לזיהוי פרומונים, כאשר הקולטן המצומד לחלבון G SRD-1 ממלא תפקיד מפתח בזיהוי פרומונים אצל גבריםבני 24. C. elegans מתאים היטב לחקר תקשורת כימית של בעלי חיים, במיוחד איתות פרומון מין, בשל הסתמכותו על מערכת חוש הריח לחיפוש בני זוג. בעוד שהרבה ידוע על איתות אסקרוסיד, מערכת פרומון המין הנדיף מציעה הזדמנויות ייחודיות להשוואה 25,26,36,40,41,42,43,44,45,46,47,48,49,50,
51,52,53,54,55,56,57. יתר על כן, C. elegans הוא אורגניזם מודל גנטי רב עוצמה בשל הגנום המרוצף במלואו שלו, שושלת תאים מוגדרת בבירור, ומוטציות ריח מאופיינות היטב.
עם זאת, המעגלים העצביים השלמים המעורבים בעיבוד פרומון זה, החישובים המתרגמים את תפיסתו להתנהגויות ממוקדות של חיפוש בני זוג, וויסות הביוסינתזה שלו עדיין לא ברורים במלואם. חקירות נוספות של תהליכים אלה חיוניות להבנת המנגנונים המגוונים השולטים בתקשורת בעלי חיים ובהתנהגויות רבייה. זיהוי גני מפתח המעורבים בסינתזה, הפרשה ותפיסה של פרומונים מבטיח לחשוף שחקנים מולקולריים חדשים בתקשורת בעלי חיים. המבחנים המתוארים כאן מספקים בסיס להתמודדות עם שאלות אלה.
Protocol
1. מיצוי פרומון מין גס מנקבות והרמפרודיטים
- פרוטוקול לסנכרון C. elegans
- הכנת נקבות בוגרות או הרמפרודיטים
- יש לעקוב אחר צלחות התרבית מדי יום עד שקיימת אוכלוסייה גדולה של נקבות/הרמפרודיטים בוגרים ומקור המזון OP50 מתרוקן. בעזרת נקבות ערפל-2 C. elegans ו-WT C. remanei להפקת פרומון מין גולמי, מכינים ביצים מסונכרנות מהנקבות המזווגות.
הערה: בפרוטוקול זה, חיות XX מוטנטיות מסוג C. elegans fog-2 , שאינן מייצרות זרע עצמי, נקראות נקבות C. elegans .
- יש לעקוב אחר צלחות התרבית מדי יום עד שקיימת אוכלוסייה גדולה של נקבות/הרמפרודיטים בוגרים ומקור המזון OP50 מתרוקן. בעזרת נקבות ערפל-2 C. elegans ו-WT C. remanei להפקת פרומון מין גולמי, מכינים ביצים מסונכרנות מהנקבות המזווגות.
- כביסה וגלולות תולעים
- שטפו תולעים בוגרות מצלחת אוכלוסייה מעורבת עם חיץ M9. לאסוף תרחיף תולעת לתוך צינור microcentrifuge 1.5 מ"ל. צנטריפוגה ב 1,500 × גרם במשך 0.5-1 דקות כדי לפטר את התולעים.
הערה: ניקוי מקדים לזיהום כבד (אופציונלי): הניחו לתולעים לשקוע בצינור אם הן מזוהמות מאוד. פיפטה החוצה את supernatant כדי להסיר חיידקים וחוזר על הפעולה עד supernatant הופך ברור.
- שטפו תולעים בוגרות מצלחת אוכלוסייה מעורבת עם חיץ M9. לאסוף תרחיף תולעת לתוך צינור microcentrifuge 1.5 מ"ל. צנטריפוגה ב 1,500 × גרם במשך 0.5-1 דקות כדי לפטר את התולעים.
- הלבנת
- הוסף 200 μL של חיץ M9 לגלולת התולעת. הכינו את חיץ הליזיס על ידי ערבוב אקונומיקה ביתית ו-1 M NaOH ביחס של 1:1. הוסף 500 μL של חיץ ליזה זה לתערובת, מערבולת במשך 10 שניות, ולאחר מכן לעצור כדי לפקח על מצב ליזה תחת מיקרוסקופ ניתוח. חזור על תהליך זה של מערבולות 10 שניות ואחריו תצפית עד שהתולעים הבוגרות יעברו ליזה מלאה.
- הפסקת הלבנה והטלת העוברים
- כאשר תולעים בוגרות מפוזרות לשברים קטנים (אך לא מומסים לחלוטין), הוסיפו מיד 500 μL של חיץ M9 כדי להאט את התגובה. צנטריפוגה ב 15,000 × גרם במשך 30-60 שניות כדי להטיל את העוברים.
הערה: ליזה יתר עלולה להזיק לעוברים. הפסיקו את התגובה כאשר גופי התולעים הבוגרים התפרקו לרסיסים קטנים. הליזיס ממשיך בשלבי הצנטריפוגה והשטיפה עד להסרת כל חיץ הליזיס.
- כאשר תולעים בוגרות מפוזרות לשברים קטנים (אך לא מומסים לחלוטין), הוסיפו מיד 500 μL של חיץ M9 כדי להאט את התגובה. צנטריפוגה ב 15,000 × גרם במשך 30-60 שניות כדי להטיל את העוברים.
- יש לשטוף את העוברים 5x עם 1 מ"ל של חיץ M9, צנטריפוגה ב 15,000 × גרם במשך 30-60 שניות לאחר כל כביסה. מוציאים את הסופרנאטנט אחרי הצנטריפוגה.
- סנכרון
- להשעות מחדש את העוברים ב 800 μL של חיץ M9 בצינור מיקרוצנטריפוגה 1.5 מ"ל. סובב את הצינור ב 20 ° C במשך 12-15 שעות עבור בקיעת L1 ומעצר תולעים בשלב L1 עקב חוסר אספקת מזון. שחררו ותרבו את התולעים בטמפרטורה של 20 מעלות צלזיוס במשך 3 ימים עד שהן מגיעות לשלב L4.
- הכנת נקבות בוגרות או הרמפרודיטים
2. מיצוי פרומון מין גולמי מנקבות בתולות בנות יום אחד (איור 1A)
הערה: אנו מאמצים פרוטוקול24 שנקבע בעבר כדי לחלץ פרומוני מין מנקבות מוטנטיות בנות יום אחד של C. elegans ונקבות WT של C. remanei.
- הכנת נקבות בוגרות
- יש לבחור ולבודד כ-200 נקבות ערפל-2 בשלב L4 יום אחד לפני הפקת הפרומון. כדי להבטיח שרק נקבות בתולות נאספות, הפרידו את נקבות L4 ערפל-2 אלה בזהירות לפי מין ופזרו אותן על שלוש לוחיות נפרדות בגודל 6 ס"מ OP50 NGM. הניחו כמות קטנה של חיידקי OP50 במרכז כל צלחת.
הערה: פזרו 200 תולעים נקבות L4 על פני שלוש צלחות נפרדות כדי למנוע את הסיכון של החדרת תולעת זכרית בטעות לצלחת. אם זכר נקטף, סביר להניח שהוא יזדווג עם נקבות רבות, וכתוצאה מכך רוב הנקבות יופרו עד למחרת, כאשר הן הופכות לבוגרות. נקבות מופרות אינן פולטות פרומוני מין נדיפים עד למיצוי הזרע, דבר המשפיע על תוצאות השאיבה. מקור המזון המוגבל מגביל את ההרמפרודיטים לאזור קטן יותר במרכז הצלחת, וממזער את הסיכוי לברוח מהצלחת בתקופת הבידוד.
- יש לבחור ולבודד כ-200 נקבות ערפל-2 בשלב L4 יום אחד לפני הפקת הפרומון. כדי להבטיח שרק נקבות בתולות נאספות, הפרידו את נקבות L4 ערפל-2 אלה בזהירות לפי מין ופזרו אותן על שלוש לוחיות נפרדות בגודל 6 ס"מ OP50 NGM. הניחו כמות קטנה של חיידקי OP50 במרכז כל צלחת.
- תהליך החילוץ
- ביום החילוץ (יום 1 לבשלות הרבייה, 3 ימים לאחר שהתולעים שוחררו ממעצר L1), יש לאסוף ולבודד 100 נקבות ערפל-2 בתולות בנות יום אחד לתוך צינור מיקרוצנטריפוגה המכיל 1 מ"ל של חיץ M9. שטפו את הנקבות 5x עם חיץ M9 כדי למזער זיהום חיידקי ולדגור עליהן במאגר M9 של 100 μL למשך 6 שעות ב-20°C כדי לאפשר ייצור והצטברות פרומונים במדיה.
- בצעו תהליך מיצוי דומה עבור נקבות C. remanei , תוך שימוש רק ב-15-20 נקבות בשלב L4 שבודדו יום לפני החילוץ לשלוש פלטות, ולמחרת, דגרו על חמש נקבות בתולות ב-100 μL של חיץ M9 למשך 6 שעות ב-25°C (טמפרטורת גדילה אופטימלית עבור C. remanei)58.
הערה: נקבות C. remanei מייצרות כמות גבוהה יותר של פרומוני מין נדיפים בהשוואה לנקבות C. elegans . לכן, רק חמש נקבות מספיקות כדי לחלץ 100 μL של פרומון מין נדיף גולמי.
- אחסון
- דגימות צנטריפוגות ב 15,000 × גרם במשך 30-60 שניות כדי לגרש את התולעים. מעבירים בזהירות את הסופרנאטנט (המכיל פרומונים) לצינור נקי ומשליכים את הצינור המכיל את גלולת התולעת. אחסנו את הסופרנאטנט המבודד לבדיקות כימותרפיות עוקבות.
הערה: ניתן לאחסן את תמצית פרומון המין הגולמי הנדיף למשך שנה לפחות בטמפרטורה של -80°C בצינור מיקרוצנטריפוגה עטוף בפרפילם כדי למזער אידוי.
- דגימות צנטריפוגות ב 15,000 × גרם במשך 30-60 שניות כדי לגרש את התולעים. מעבירים בזהירות את הסופרנאטנט (המכיל פרומונים) לצינור נקי ומשליכים את הצינור המכיל את גלולת התולעת. אחסנו את הסופרנאטנט המבודד לבדיקות כימותרפיות עוקבות.
- בקרת איכות
- לפני השימוש בתמצית, בצע בדיקת בקרת איכות באמצעות זכרי N2 או זכרי him-5 כדי לאמת את האטרקטיביות הכימותרפית שלה (ראה סעיף 4).
3. כמות גדולה של מיצוי פרומון מין גולמי מהרמפרודיטים בתוליים בני 6 ימים (איור 1A)
- תרבית תולעים
- כדי להשיג כ-20 מ"ל של פרומון מין גולמי מסוג C. elegans , יש לסנכרן עשרים לוחות NGM בקוטר 10 ס"מ המכילים תולעים בוגרות בריאות מסוג C. elegans (מוטציות N2 או daf-22 ) באמצעות פרוטוקול האקונומיקה הנ"ל ולאחר מכן לשטוף אותן 5x עם חיץ M9.
הערה: תהליך זה מכין מספיק עוברים להפקת פרומון. N2: הזן הסטנדרטי WT C. elegans המייצר גם פרומוני אסקרוסידים מסיסים במים וגם פרומוני מין נדיפים שאינם אסקארוזידים. מוטנט DAF-22 : מוטנט חסר יכולת לייצר פרומוני אסקרוסידים רבים, מה שהופך אותם למועילים בחקר פרומוני מין נדיפים שאינם אסקרוסיד בבידוד. - כדי לסנכרן תולעים בשלב L1, סובבו את העוברים במאגר M9 למשך 12-15 שעות כדי לעצור את ההתפתחות. העבירו את תולעי L1 הכלואות לצלחות תרבית NGM בקוטר 10 ס"מ שנזרעו עם חיידקי OP50 לצורך גדילה והתפתחות.
- כדי למזער את נוכחותם של זכרים על לוחות הרמפרודיטים, בדוק את הצלחות יומיים לאחר שחרור התולעת, בשלב L4, והסר את כל הזכרים שנצפו (נדיר מאוד).
- לאחר שלושה ימים של התפתחות, לחפש את המראה של עוברים המציין כי התולעים הפכו בוגרים רבייה.
הערה: נקבות מוטנטיותערפל-2 של C. elegans ונקבות WT של C. remanei אינן מתאימות להפקת פרומון מין נדיף בתפזורת. למוטאנטים C. elegans ו-C. remanei יש שיעור גבוה של זכרים באוכלוסיותיהם, והזכרים מזדווגים ברציפות עם נקבות. נקבות מופרות אינן מייצרות פרומוני מין נדיפים. נוכחות גברית מסבכת את מיצוי תרכובות אלה.
- כדי להשיג כ-20 מ"ל של פרומון מין גולמי מסוג C. elegans , יש לסנכרן עשרים לוחות NGM בקוטר 10 ס"מ המכילים תולעים בוגרות בריאות מסוג C. elegans (מוטציות N2 או daf-22 ) באמצעות פרוטוקול האקונומיקה הנ"ל ולאחר מכן לשטוף אותן 5x עם חיץ M9.
- שטיפת תולעים והפרדת עוברים
- לשטוף את העוברים שוב ושוב עם חיץ M9 ולתת להם לשקוע (1 גרם שיקוע) עד שרוב הבוגרים נמצאים בתחתית הצינור; חזור על הפעולה 5-7x. לאפשר לצינורות המיקרוצנטריפוגות להתיישב באין מפריע במדף למשך מספר דקות כדי להקל על שקיעת התולעים הבוגרות ולאפשר הפרדה של אוכלוסיית התולעים הבוגרות מהעוברים, שנותרו תלויים בסופרנטנט.
- פיפטה את הבוגרים המופרדים ולהעביר אותם ללוחות NGM חדשים מזרעי OP50.
- חזור על תהליך כביסה זה במשך 5-6 ימים כדי לרוקן זרע עצמי.
הערה: להפקת פרומוני מין נדיפים, השתמש בהרמפרודיטים בני 5-6 ימים. תזמון זה מבטיח כי הזרע העצמי שלהם צפוי להיות מותש, כמו hermaphrodites עם זרע עצמי זמין אינם מייצרים פרומוני מין נדיפים. עוברים מתים או לא בקעו רבים על הצלחת ביום 5 או 6 מצביעים על זמן מתאים להתחיל בהפקת פרומון.
- מיצוי פרומון מין
- חלץ פרומון מין כמתואר בסעיף 1 עם שינויים.
- במקום להוסיף 100 נקבות C. elegans לכל 100 μL, הוסף חיץ M9 בהתבסס על נפח גלולת התולעת הסופית. הוסף 1 מ"ל של חיץ M9 לכל 50 מיקרוליטר של תולעים ארוזות.
- בקרת איכות והומוגניזציה
- אצוות בדיקת בקרת איכות של פרומון מופק באמצעות בדיקת כימותרפיה עם זכרי N2 או זכרי him-5 (ראה סעיף 4).
- ערבבו את כל האצוות ליצירת פרומון מין נדיף גולמי הומוגני לניסויים הדורשים כמות גדולה של פרומון, כגון בדיקות סקר או ניסויים מיקרופלואידים. אחסנו את תמצית פרומון המין הגולמי למשך שנה אחת לפחות בטמפרטורה של -80°C בצינורות של 50 מ"ל עטופים בפרפילם כדי למזער את האידוי.
- שיטת טיטרציה מבוססת בדיקת כימותרפיה לסטנדרטיזציה של תמצית פרומון מין גולמי
- בצע בדיקת טיטרציה על ידי בדיקת דילול סדרתי של כל תמצית פרומון הן על WT N2 והן על him-5 זכר C. elegans. קבע את הדילול הגבוה ביותר (הריכוז הנמוך ביותר) המעורר באופן עקבי תגובת כימוטקסיס חזקה וניתנת לשחזור בזני ביקורת.
- הכינו סדרה של דילולים מכל תמצית גולמית (למשל, 1:2, 1:4, 1:8 וכו') במאגר M9.
- בדיקות כימוטקסיס
- לבצע בדיקות כימוטקסיס סטנדרטיות (ראה סעיף 4) באמצעות כל דילול על זן הייחוס של זכרים. בצע שלושה עותקים משוכפלים כדי להבטיח יכולת שחזור. השווה את הדילולים האופטימליים בין אצוות מיצוי שונות כדי להעריך את העקביות בריכוז הפרומון.
הערה: פעולה זו יוצרת נקודת התייחסות להערכת הפעילות הביולוגית של כל תמצית. בבדיקת הכימותרפיה הסטנדרטית של פרומון המין, התמציות המקוריות הלא מדוללות ישמשו לניסויים הבאים, כאשר הטיטרציה תשמש כשלב בקרת איכות כדי להבטיח פעילות פרומון עקבית בין אצוות. ניתן להתאים את סדרת הדילול בהתאם לצרכים ניסיוניים ספציפיים. בהתחשב בכך שפרוטוקול המיצוי הסטנדרטי מניב באופן עקבי תמציות פרומון גולמי רווי, ייתכן שלא יהיה צורך בבדיקת טיטרציה כדי לתקנן את התמצית ברוב הניסויים. מומלץ להשתמש באותה אצווה של פרומון מין גולמי במהלך סדרה של ניסויים קשורים כדי לשמור על עקביות ולמזער את השונות בפעילות הפרומון.
- לבצע בדיקות כימוטקסיס סטנדרטיות (ראה סעיף 4) באמצעות כל דילול על זן הייחוס של זכרים. בצע שלושה עותקים משוכפלים כדי להבטיח יכולת שחזור. השווה את הדילולים האופטימליים בין אצוות מיצוי שונות כדי להעריך את העקביות בריכוז הפרומון.
4. בדיקת כימותרפיה של פרומון מין נדיף
הערה: בדיקת הכימותרפיה של פרומון המין הנדיף הותאמה משיטות מבוססות בעבר המשמשות במחקרי כימותרפיה אחרים 24,29,59,60,61. שינויים אלה יושמו כדי לייעל את הרגישות והספציפיות של הבדיקה לאיתור תגובות לפרומוני מין נדיפים. גישה מותאמת זו משפרת את תחולת הבדיקה לצרכי מחקר ספציפיים.
- שימו לב לצלחות התרבות מדי יום עד שנקבות בוגרות / הרמפרודיטים נמצאים בשפע. בריאות התולעים משפיעה על תגובתן לפרומון המין.
- הכנת אותו-5 זכרים
- השתמש בפרוטוקול אקונומיקה סטנדרטי כדי לסנכרן אותו-5 תולעים. לאחר הסנכרון, שטפו את התולעים 5x עם חיץ M9. בודדו זכרי L4 יום לפני הבדיקה; לאחר מכן, העבירו תולעים זכרים בוגרים בני יום אחד מצלחות הזרעים שלהם ושטפו אותם בחיץ M9 לפני הבדיקה. הניחו אותם על צלחות NGM ללא זרעים לפני הבדיקה כדי לחסל שאריות חיידקים ולמנוע הפרעה מהמזון במהלך הבדיקה.
הערה: אין להרעיב את התולעים במשך יותר משעה לפני הבדיקה, מכיוון שהדבר יכול לשנות את מצבן הפנימי ולהשפיע על תוצאות בדיקת הכימותרפיה של פרומון המין. לכן, אם אתה מתכוון לבצע יותר מ -10 בדיקות ביום אחד, להחליף את דגימות התולעת כל שעה. יתר על כן, לסירוגין בין בדיקה ניסיונית אחת לבדיקת בקרה אחת שוב ושוב.
- השתמש בפרוטוקול אקונומיקה סטנדרטי כדי לסנכרן אותו-5 תולעים. לאחר הסנכרון, שטפו את התולעים 5x עם חיץ M9. בודדו זכרי L4 יום לפני הבדיקה; לאחר מכן, העבירו תולעים זכרים בוגרים בני יום אחד מצלחות הזרעים שלהם ושטפו אותם בחיץ M9 לפני הבדיקה. הניחו אותם על צלחות NGM ללא זרעים לפני הבדיקה כדי לחסל שאריות חיידקים ולמנוע הפרעה מהמזון במהלך הבדיקה.
- הכנת צלחות בדיקת אגר כימותרפיה
- הכינו צלחות בדיקת כימותרפיה עם 1.5% אגר, 25 מ"מ NaCl, 1.5 מ"מ בסיס טריס ו-3.5 מ"מ Tris-Cl כמתואר בספרות הרלוונטית24.
- מחממים את האגר בתמיסת הכימותרפיה באמצעות מיקרוגל עד להמסה מוחלטת. תנו לתמיסה להתקרר בטמפרטורת החדר למשך 5 דקות.
- השתמשו בעזר פיפטה כדי לפזר באופן שווה את תמיסת האגר הכימותרפית לצלחות פטרי: שפכו 30 מ"ל לכל צלחת של 10 ס"מ ו-20 מ"ל לכל צלחת של 6 ס"מ.
- לאחר מזיגת תמיסת האגר הכימותרפית לצלחות הפטרי, השאירו את המכסים פתוחים באזור נקי למשך 40 דקות לפחות כדי לאפשר לפני השטח של האגר להתייבש מעט. לאחר שהמשטח התייבש כראוי, סגרו את העפעפיים.
הערה: זמן ייבוש זה עשוי להשתנות בהתאם ללחות ולטמפרטורה של סביבת המעבדה.
- אחסון צלחות והכנה מראש
- ארזו ואחסנו את צלחות הבדיקה המוכנות בחדר קר עד שבוע. לפני השימוש, הוציאו את הצלחות מהאחסון הקר ואפשרו להן להתאקלם לטמפרטורת החדר למשך יותר משעה. פתחו את העפעפיים כדי לאפשר ללחות שיורית להתאדות מהאגר 20 דקות לפני הבדיקה באזור נקי, וודאו שאין מים ברורים על פני השטח לפני ביצוע הבדיקה.
- תכנון ניסויי ובדיקת כימותרפיה
- כדי לבצע את בדיקת הכימו, סמנו שלושה כתמים ברורים על המכסה ועל החלק התחתון של צלחת הפטרי או השתמשו בתבנית המודפסת על נייר פלסטיק שקוף המונח מתחת לצלחת או מחובר למיקרוסקופ המנתחת. סימונים אלה כוללים נקודה אמצעית (•) כנקודת ההתחלה של התולעים, סימן פלוס (+) עבור נקודת הניסוי (2 מיקרוליטר של פרומון מין על המכסה ו-2 מיקרוליטר של 1 מ' נתרן אזיד על הצלחת), וסימן מינוס (-) עבור נקודת הבקרה (2 מיקרוליטר של חיץ M9 על המכסה ו-2 מיקרוליטר של 1 מ' נתרן אזיד) (איור 2A). התאימו את המרחק בין סימנים אלה בהתאם לגודל המנה ולצרכי הניסוי הספציפיים. בדרך כלל, עבור צלחות פטרי בקוטר 6 ס"מ, יש לקבוע מרחק קבוע של 1.5 ס"מ מנקודת המוצא לכל חומר בדיקה לצורך בדיקות הבקרה החיוביות.
- שלבים מפורטים לביצוע הבדיקה (איור 2)
- יש למרוח 2 μL של 1 M נתרן אזיד על כל נקודת ניסוי ובקרה בצלחת.
- בחרו 20 תולעים זכריות בריאות ונעות בחופשיות בעזרת קוטף תולעים. בו זמנית לשחרר 20 תולעים זכרים בנקודת ההתחלה תחת מיקרוסקופ ניתוח.
- הוסף במהירות 2 μL של פרומון מין ו -2 μL של חיץ M9 לנקודות הניסוי והבקרה על המכסה, בהתאמה.
- סגרו בעדינות את המכסה והניחו את צלחת הבדיקה באזור שקט ויציב בטמפרטורה ליד המיקרוסקופ.
- לאחר 30 דקות, הניקוד את הבדיקה על ידי ספירת מספר התולעים בכל נקודה.
הערה: תהליך בחירת 20 התולעים לא יעלה על 1-2 דקות כדי למנוע מהתולעים שנקטפו מוקדם להתייבש ולהפוך ללא בריאות, מה שעלול להשפיע על התוצאות. כל התהליך מבחירת הזכרים ועד סגירת המכסה אמור להימשך בין 2 ל-5 דקות.
- סינון בקרה חיובי
- בדקו את התולעים הזכרים לתמיסה מדוללת פי 1,000 של דיאצטיל (מומס ב-10% אתנול ו-90% חיץ M9) כדי לאשר את תגובת הכימוטקסיס שלהם. הערך את תוצאות בדיקת הכימותרפיה 30 דקות לאחר תחילת הבדיקה. ציון תולעים המשותקות בנקודות המיועדות על סמך מיקומן: 'C' עבור אלה בנקודת הביקורת, ו- 'E' עבור אלה בנקודת הניסוי. ציון תולעים באף אחת מהנקודות לא כ-N (איור 2C).
- כדי לחשב את מדד הכימותרפיה (C.I.), השתמש בנוסחה הבאה:
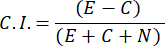
- בחר רק דגימות גברים עם אינדקס כימוטקסיס ≥ 0.4 (C.I., ראה איור 2C). השתמש בזכר מאותה אצווה לבדיקת פרומון המין שלאחר מכן.
הערה: ערוך שלוש בדיקות נפרדות, שכל אחת מהן כללה 20 תולעים, כדי להבטיח עקביות ואמינות של תוצאות הניסוי. שלוש בדיקות מספיקות בדרך כלל כדי להסיק עקביות.
5. הנחיות תזמון וניקוד לבדיקת כימותרפיה
- להעריך את התגובה הכימותרפית של התולעים בהתבסס על מיקומן הסופי. ציון מספר התולעים בכל נקודה בסיום הבדיקה, בדרך כלל 30 דקות לאחר תחילתה.
הערה: השימוש בנתרן אזיד בנקודות ניסוי ובקרה משתק תולעים מגיעות, ומקל על ניקוד מדויק. רוב זכרי WT N2 ו-him-5 מסוגלים לאתר את מקור הפרומון תוך 6-8 דקות בלוח של 6 ס"מ עם מערך של 1.5 ס"מ מרחק. - כדי ללכוד פגמים ביעילות כימוטקסיס, במיוחד כדי לזהות פגמים עדינים, שקול ניטור הבדיקה במרווחי זמן קבועים של 3-5 דקות.
הערה: תצפית תכופה זו מאפשרת תיעוד של הזמנים שבהם תולעים מגיעות לנקודות הבדיקה. מעקב מפורט כזה יכול לגלות מקרים בהם התולעים מפגינות יעילות כימוטקסיס ירודה אך עדיין מצליחות להגיע למקום הבדיקה בתוך חלון הבדיקה.
6. שינויים אופציונליים
- להערכה משופרת של כימוטקסיס, השתמש במצלמה הממוקמת מעל הצלחת כדי לתעד את מסלולי התולעים לאורך הבדיקה.
הערה: שינוי זה מאפשר ניתוח מקיף של דפוסי התנועה שלהם, ומספק תובנה עמוקה יותר לגבי התנהגות ומסלול כימותרפיה (איור 3).
7. ניתוח נתונים
- ניקוד וחישוב מדד כימותרפיה (C.I.)
- בצע את שלבים 4.7.1 ו- 4.7.2.
- עלילת זמן הגעה
- לניתוח מקיף יותר של בדיקות כימואטרקציה, שקול לעקוב אחר הבדיקה במרווחים של 3-5 דקות או להשתמש במצלמה הממוקמת מעל הצלחת כדי לתעד את מסלולי התולעים לאורך הבדיקה.
הערה: גישות אלה מאפשרות לא רק ניקוד זמני ההגעה של התולעים בנקודות העיצוב, אלא גם השוואת זמני ההגעה הממוצעים וניתוח ההתפלגות של זמנים אלה.
- לניתוח מקיף יותר של בדיקות כימואטרקציה, שקול לעקוב אחר הבדיקה במרווחים של 3-5 דקות או להשתמש במצלמה הממוקמת מעל הצלחת כדי לתעד את מסלולי התולעים לאורך הבדיקה.
- ניתוח מסלול מבוסס וידאו ותצוגה חזותית של נתונים
הערה: כדי לנתח את דפוסי התנועה של C. elegans במהלך מבחני כימותרפיה, רשום וחלץ מסלולים (ראה את טבלת חומרים) וניתוח נוסף (תרשים 3).- הגדר את מערכת ההקלטה.
- התחל הקלטה חדשה וגש לחלון הגדרות ההקלטה .
- הגדר את פרמטרי ההקלטה הרצויים:
- קידומת קובץ: בחר/י שם תיאורי לקובצי הווידאו (לדוגמה, "experiment1_").
- קצב פריימים (FPS): בחר את המסגרות המתאימות לשנייה ללכידת תנועת התולעת (לדוגמה, 7.5 FPS לתולעים על צלחת האגר ו- 30 FPS לתולעי שחייה ).
- משך: הגדר את אורך ההקלטה בשניות (למשל, 1,800 שניות [30 דקות] לבדיקת כימותרפיה בתפזורת).
- מטב את איכות התמונה: התאם את עוצמת ההארה כדי להבטיח שהתולעים נראות בבירור על הרקע וכוונן את המיקוד כדי לקבל תמונה חדה של התולעים.
- כדי להכין את צלחת הבדיקה, תחילה יש להוציא את תמיסת הבקרה לנקודת הבקרה המיועדת. לאחר מכן, הרימו בזהירות את התולעת (ים) ושחררו אותם בעדינות למרכז הצלחת. לאחר שהתולעת התיישבה, יש למרוח את תמיסת פרומון המין על נקודת הניסוי המיועדת.
- מקם את הצלחת: מקם בזהירות את הצלחת המכילה את התולעים במרכז שדה ההקלטה כדי למקסם את שטח הלכידה.
- כדי להפחית את הלחץ על התולעים במהלך בדיקות chemotaxis, לשקול את שתי הגישות הבאות .
- לבדיקת תולעת בודדת, הניחו את התולעת על צלחת הבדיקה ואפשרו לה להתאקלם במשך 5 דקות לפני החדרת תמיסת פרומון המין במרחק המיועד (המיקום מבוסס על מיקומה הנוכחי של התולעת).
הערה: פעולה זו ממזערת את הטיפול ומספקת לתולעת זמן להסתגל לסביבה החדשה שלה. - בדיקת כימותרפיה בתפזורת: הניחו לתולעים לשקוע ולהתפזר באופן טבעי על הצלחת למשך 5 דקות. לאחר תקופת התאקלמות זו, הציגו את תמיסת הפרומון במיקום הקבוע המיועד. במהלך ניתוח לאחר וידאו, מדדו את מרחק ההתחלה של כל תולעת מהפרומון וקבצו אותם בהתאם לניתוח נוסף.
- לבדיקת תולעת בודדת, הניחו את התולעת על צלחת הבדיקה ואפשרו לה להתאקלם במשך 5 דקות לפני החדרת תמיסת פרומון המין במרחק המיועד (המיקום מבוסס על מיקומה הנוכחי של התולעת).
- הליך ניתוח וידאו
- ייבוא והגדרה: ייבא את הווידאו המוקלט לתוכנה. הגדר את פרטי הרצף (לדוגמה, קצב פריימים); ציינו את קנה המידה של ההדמיה (פיקסלים ליחידת מידה).
- התאמת תמונה: כדי למטב את זיהוי התולעים, כוונן את סף הזיהוי עד שהתווית הירוקה תשרטט היטב את התולעים מבלי ללכוד רעשי רקע או תוצרים. בנוסף, החילו אלגוריתמים להחלקת רקע כדי להפחית רעש וחוסר אחידות בתמונה, ולשפר את הניגודיות בין התולעים לרקע. התנסו ברמות החלקה שונות כדי למצוא את האיזון האופטימלי בין הפחתת רעשים ושמירה על פרטי התולעת.
הערה: הסף האידיאלי צריך לכסות את רוב הגוף של כל תולעת תוך הרחקת אלמנטים חיצוניים. - מיטוב פרמטרי זיהוי: בחר תולעת מייצגת כדי ליצור באופן אוטומטי פרמטרי זיהוי. ודא את דיוק הזיהוי על-ידי בדיקה חזותית של 5-10 מסגרות אקראיות. אם הזיהוי אינו משביע רצון, מקד את פרמטרי הזיהוי באופן ידני, בקר שוב בהגדרות התאמת התמונה במידת הצורך, והמשך למעקב לאחר שהזיהוי אמין.
- הגהה ותיקון מסלולי מעקב: לאחר השלמת תהליך המעקב האוטומטי, בצע הגהה ידנית של המסלולים שנוצרו. אם נמצאו חוסר עקביות במהלך ההגהה, השתמש בפונקציית התיקון כדי לתקן את המסלול ולבצע את הפעולות הבאות: הצטרפות: חבר מקטעי מסלול שהוקצו להם באופן שגוי מזהים שונים אך שייכים לאותו אדם. פיצול: מקטעי מסלול נפרדים שהוקצו להם באופן שגוי אותו מזהה אך שייכים לאנשים שונים.
הערה: המטרה היא להבטיח שכל מזהה ייחודי (מספר) יוקצה באופן עקבי לאותו אדם לאורך כל תקופת המעקב.
דוגמה: אם תולעת מסומנת כ- "3" למשך תקופה, ולאחר מכן מסומנת באופן שגוי כ- "7" עבור תקופה עוקבת, פונקציית התיקון תצטרף לשני מקטעים אלה תחת המזהה "3". לעומת זאת, אם שתי תולעים מסומנות שתיהן כ-"12" למשך תקופה, פונקציית התיקון תפצל את המקטע הזה לשני מסלולים נפרדים, שלכל אחד מהם מזהה ייחודי. על ידי הגהה קפדנית ויישום התיקונים הדרושים, ניתן לשפר באופן משמעותי את הדיוק והאמינות של נתוני המעקב. - תצוגה חזותית וייצוא של תוצאות: השתמש בתוכנה לתצוגה חזותית ולניתוח בסיסי. יצא נתונים כקובצי CSV לניתוח נוסף באמצעות הכלים או הקוד המועדפים. שיטה זו מספקת קוד בסיסי (ראו https://github.com/edmondztt/pheromone-traj-analysis.git) כדי להמחיש את מסלול תנועת התולעת בהתבסס על חמישה פרמטרים עיקריים (איור 3). זמן: התקדמות המסלול, מסומן בצבע כדי לציין את חלוף הזמן מאז תחילת הניסוי. המרחק לפרומון: המרחק בין התולעת למקור הפרומון בכל נקודת זמן. מהירות: מהירות התולעת בכל נקודה, מה שציין גם את אירועי הפנייה והעצירה. ישרות: כמה ישר הנתיב של התולעת. נכונות כיוון: עד כמה תנועת התולעת מיושרת עם כיוון מטרת הפרומון? קוד זה מספק הדמיה בסיסית להבנת התנהגות התולעים וניתן להתאים אותו אישית ולהרחיב אותו לניתוח מעמיק יותר.
הערה: גישה מתקדמת זו מספקת חלופה מקיפה לאינדקס הכימותרפיה המסורתי על ידי פירוט מסלול ניווט התולעים בתגובה לפרומוני מין. הוא מאפשר להבין דפוסי תנועה מבלי להסתמך על נקודות קצה שרירותיות של הניווט וקביעת חלון הזמן, ומציע תובנות עמוקות יותר על הדינמיקה ההתנהגותית של הבדיקה. הנתונים נערכו בממוצע על פני 20 פריימים, הניתנים להתאמה על פי צרכי ניסוי ספציפיים, כדי לסנן תנועה הנגרמת על ידי פיתול הגוף.
תוצאות
ניתוח מסלול של תפיסת פרומון מין נדיף זן פגום בבדיקת כימותרפיה
בדיקת כימותרפיה זו מבחינה באופן אמין בין זנים פראיים וזנים מוטנטיים של C. elegans בתגובתם לפרומוני מין נדיפים. ניסויים מוצלחים עם זכרי HIM-5 הדגימו באופן עקבי כימוטקסיס חזק כלפי מקור הפרומון. זה...
Discussion
פרוטוקול זה מספק מתודולוגיה חזקה להפקת פרומוני מין נדיפים מ- C. elegans, יחד עם הקמת בדיקת כימותרפיה חזקה למדידת תגובות כימותרפיות גבריות. מידע נוסף ניתן למצוא במדריך למשתמש של WormLab (עיין בטבלת החומרים); לקבלת קוד בסיסי להמחשת מסלול תנועת התולעת, ראה סעיף פרוטוק?...
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
אנו אסירי תודה לד"ר טינגטאו ג'ואו על העיצוב וכתיבת הקוד להדמיות המסלול המשמשות בניתוח שלנו. עבודה זו נתמכה על ידי מימון: R01 NS113119 (PWS), מלגת צ'ן לפוסט-דוקטורט בכיר, ומכון טיאנצ'יאו וכריסי צ'ן למדעי המוח.
Materials
| Name | Company | Catalog Number | Comments |
| 10 cm Petri dishes | Falcon | 25373-100 | Falcon bacteriological Petri dish 100 x 15 mm |
| 6 cm Petri dishes | Falcon | 25373-085 | Falcon bacteriological Petri dish 60 x 15 mm |
| C. remanei (EM464) | CGC | ||
| Centrifuge | Eppendorf | centrifuge 5418 | Any brand should work. |
| Chemoattraction assay plates | Homemade solution | N/A | 1.5% agar, 25 mM NaCl, 1.5 mM Tris-base, and 3.5 mM Tris-Cl |
| Cholesterol | Alfa Aesar | 57-88-5 | |
| Dissecting Microscope | Leica | LeicaMZ75 | Any brand should work. |
| E. Coli OP50 | CGC | ||
| Ethanol | Koptec | 64-17-5 | |
| fog-2(q71) (JK574) | CGC | ||
| him-5(e1490)(CB4088) | CGC | ||
| Household bleach | Clorox Germicidal bleach concentrated | Bleach | |
| M9 buffer | Homemade solution | N/A | 3 g KH2PO4, 11.3 g Na2HPO4.7H2O, 5 g NaCl, H2O to 1 L. Sterilize by autoclaving. Add 1 mL 1 M MgSO4 after cool down to room temperature. |
| Magnesium Sulfate, Anhydrous, Powder | Macron | M1063-500GM-EA | |
| Microwave | TOSHIBA | N/A | Any brand should work. |
| N2 | CGC | ||
| NaOH | Sigma-aldrich | S318-3 | 1 M |
| NGM plates solution | Homemade solution | N/A | 2.5 g Peptone, 18 g agar, 3 g NaCl, H2O to 1 L.Sterilize by autoclaving. Once the autoclave is done (2 h), wait until the temperature of the medium drops to 65 °C. Put on a hotplate at 65 °C and stir. Then add the following, waiting 5 min between each to avoid crystallization: 1 mL CaCl2 (1 M), 1 mL MgSO4 (1 M), 25 mL K3PO4 (1 M, pH=6), 1 mL Cholesterol ( 5 mg/mL in ethanol). |
| Parafilm | Bemis | 13-374-10 | Bemis Parafilm M Laboratory Wrapping Film |
| Peptone | VWR | 97063-324 | |
| Pipet- aid | Drummond Scientific | 4-000-100 | Any brand should work. |
| Plastic paper | Octago | Waterproof Screen Printing Inkjet Transparency Film | https://www.amazon.com/Octago-Waterproof-Transparency-Printing-Printers/dp/B08HJQWFGD |
| Potassium chloride | Sigma-aldrich | SLBP2366V | |
| Potassium phosphate | Spectrum | 7778-77-0 | |
| Pipette | Eppendorf | SKU: EPPR4331; MFG#: 2231300006 | 20 - 200 µL, 100 - 1000 µL, any brand should work. |
| Rotator | Labnet | SKU: LI-H5500 | Labnet H5500 Mini LabRoller with Dual Direction Rotator. Any brand should work. |
| Sodium chloride | VWR | 7647-14-5 | |
| sodium phosphate dibasic | Sigma-aldrich | SLCG3888 | |
| Tris-base | Sigma-aldrich | 77-86-1 | |
| Tris-Cl | Roche | 1185-53-1 | |
| Tryptone | VWR | 97063-390 | |
| Vortex | Scientific industries | Vortex-Genie 2 | Any brand should work. |
| WormLab system | MBF Bioscience | N/A | https://www.mbfbioscience.com/help/WormLab/Content/home.htm; https://www.mbfbioscience.com/products/wormlab/ |
| Wormpicker | Homemade | N/A | made with platinum and glass pipet tips |
References
- Audesirk, T. E. Chemoreception in Alphysia californica. Iii. Evidence for pheromones influencing reproductive behavior. Behav Biol. 20 (2), 235-243 (1977).
- Traynor, K. S., Le Conte, Y., Page, R. E. Queen and young larval pheromones impact nursing and reproductive physiology of honey bee (Apis mellifera) workers. Behav Ecol Sociobiol. 68 (12), 2059-2073 (2014).
- Cowley, J. J., Wise, D. R. Pheromones, growth and behaviour. Ciba Found Study Group. 35, 144-170 (1970).
- Epple, G. Pheromones in primate reproduction and social behavior. Adv Behav Biol. 11, 131-155 (1974).
- Levinson, H. Z. Possibilities of using insectistatics and pheromones in pest control. Naturwissenschaften. 62 (6), 272-282 (1975).
- Roelofs, W. Manipulating sex pheromones for insect suppression. Environ Lett. 8 (1), 41-59 (1975).
- Marchlewska-Koj, A. Pheromones and mammalian reproduction. Oxf Rev Reprod Biol. 6, 266-302 (1984).
- Keverne, E. B. Neuroendocrinology briefings 11: Pheromones and reproduction. J Neuroendocrinol. 12 (11), 1045-1046 (2000).
- Rekwot, P. I., Ogwu, D., Oyedipe, E. O., Sekoni, V. O. The role of pheromones and biostimulation in animal reproduction. Anim Reprod Sci. 65 (3-4), 157-170 (2001).
- Gomez-Diaz, C., Benton, R. The joy of sex pheromones. EMBO reports. 14 (10), 874-883 (2013).
- Shorey, H. H., Gaston, L. K., Jefferson, R. N. Insect sex pheromones. Adv Pest Control Res. 8, 57-126 (1968).
- Bruce, H. M. Pheromones and behavior in mice. Acta Neurol Psychiatr Belg. 69 (7), 529-538 (1969).
- Shorey, H. H., Bartell, R. J. Role of a volatile female sex pheromone in stimulating male courtship behaviour in Drosophila melanogaster. Anim Behav. 18 (1), 159-164 (1970).
- Bobadoye, B., et al. Evidence of aggregation-sex pheromone use by longhorned beetles (coleoptera: Cerambycidae) species native to Africa. Environ Entomol. 48 (1), 189-192 (2019).
- Saunders, J. R. Sex pheromones in bacteria. Nature. 275 (5682), 692-694 (1978).
- Schulz, S., Toft, S. Identification of a sex pheromone from a spider. Science. 260 (5114), 1635-1637 (1993).
- Finnegan, D. E., Chambers, J. Identification of the sex pheromone of the guernsey carpet beetle, Anthrenussarnicus mroczkowski (coleoptera: Dermestidae). J Chem Ecol. 19 (5), 971-983 (1993).
- Vaillancourt, L. J., Raudaskoski, M., Specht, C. A., Raper, C. A. Multiple genes encoding pheromones and a pheromone receptor define the b beta 1 mating-type specificity in Schizophyllum commune. Genetics. 146 (2), 541-551 (1997).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook : the online review of C. elegans biology. , 1-22 (2013).
- Sakai, N., et al. A sexually conditioned switch of chemosensory behavior in C. elegans. PLoS One. 8 (7), e68676 (2013).
- Sengupta, S., Smith, D. P., Mucignat-Caretta, C. How Drosophila detect volatile pheromones: signaling, circuits, and behavior. Neurobiology of chemical communication. , (2014).
- Zhang, Y. K., Reilly, D. K., Yu, J., Srinivasan, J., Schroeder, F. C. Photoaffinity probes for nematode pheromone receptor identification. Org Biomol Chem. 18 (1), 36-40 (2019).
- Aprison, E. Z., Ruvinsky, I. Dynamic regulation of adult-specific functions of the nervous system by signaling from the reproductive system. Curr Biol. 29 (23), 4116-4123.e3 (2019).
- Wan, X., et al. SRD-1 in AWA neurons is the receptor for female volatile sex pheromones in C. elegans males. EMBO Rep. 20 (3), e46288 (2019).
- Peckol, E. L., Troemel, E. R., Bargmann, C. I. Sensory experience and sensory activity regulate chemosensory receptor gene expression in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 98 (20), 11032-11038 (2001).
- Jang, H., et al. Neuromodulatory state and sex specify alternative behaviors through antagonistic synaptic pathways in. C. elegans. Neuron. 75 (4), 585-592 (2012).
- Liu, K. S., Sternberg, P. W. Sensory regulation of male mating behavior in Caenorhabditis elegans. Neuron. 14 (1), 79-89 (1995).
- Chasnov, J. R., Chow, K. L. Why are there males in the hermaphroditic species Caenorhabditis elegans. Genetics. 160 (3), 983-994 (2002).
- Chasnov, J. R., So, W. K., Chan, C. M., Chow, K. L. The species, sex, and stage specificity of a Caenorhabditis sex pheromone. Proc Natl Acad Sci U S A. 104 (16), 6730-6735 (2007).
- Susoy, V., et al. Natural sensory context drives diverse brain-wide activity during C. elegans mating. Cell. 184 (20), 5122-5137.e17 (2021).
- Barriere, A., Felix, M. A. High local genetic diversity and low outcrossing rate in Caenorhabditis elegans natural populations. Curr Biol. 15 (13), 1176-1184 (2005).
- Click, A., Savaliya, C. H., Kienle, S., Herrmann, M., Pires-Dasilva, A. Natural variation of outcrossing in the hermaphroditic nematode Pristionchus pacificus. BMC Evol Biol. 9, 75 (2009).
- Anderson, J. L., Morran, L. T., Phillips, P. C. Outcrossing and the maintenance of males within C. elegans populations. J Hered. 101 (suppl_1), S62-S74 (2010).
- Leighton, D. H., Choe, A., Wu, S. Y., Sternberg, P. W. Communication between oocytes and somatic cells regulates volatile pheromone production in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 111 (50), 17905-17910 (2014).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Fagan, K. A., et al. A single-neuron chemosensory switch determines the valence of a sexually dimorphic sensory behavior. Curr Biol. 28 (6), 902-914.e5 (2018).
- Lipton, J., Kleemann, G., Ghosh, R., Lints, R., Emmons, S. W. Mate searching in Caenorhabditis elegans: A genetic model for sex drive in a simple invertebrate. J Neurosci. 24 (34), 7427-7434 (2004).
- Frady, E. P., Palmer, C. R., Kristan, W. B. Sexual attraction: Sex-specific wiring of neural circuitry. Curr Biol. 22 (22), R953-R956 (2012).
- Liu, Q., et al. Two preputial gland-secreted pheromones evoke sexually dimorphic neural pathways in the mouse vomeronasal system. Front Cell Neurosci. 13, 455 (2019).
- Ludewig, A. H., et al. Pheromone sensing regulates Caenorhabditis elegans lifespan and stress resistance via the deacetylase sir-2.1. Proc Natl Acad Sci U S A. 110 (14), 5522-5527 (2013).
- Golden, J. W., Riddle, D. L. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Butcher, R. A., Fujita, M., Schroeder, F. C., Clardy, J. Small-molecule pheromones that control dauer development in Caenorhabditis elegans. Nat Chem Biol. 3 (7), 420-422 (2007).
- Jeong, P. Y., et al. Chemical structure and biological activity of the Caenorhabditis elegans dauer-inducing pheromone. Nature. 433 (7025), 541-545 (2005).
- Butcher, R. A., Ragains, J. R., Kim, E., Clardy, J. A potent dauer pheromone component in Caenorhabditis elegans that acts synergistically with other components. Proc Natl Acad Sci U S A. 105 (38), 14288-14292 (2008).
- Aprison, E. Z., Ruvinsky, I. Counteracting ascarosides act through distinct neurons to determine the sexual identity of C. elegans pheromones. Curr Biol. 27 (17), 2589-2599.e3 (2017).
- Aprison, E. Z., Ruvinsky, I. Sex pheromones of C. elegans males prime the female reproductive system and ameliorate the effects of heat stress. PLoS Genet. 11 (12), e1005729 (2015).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Kaplan, F., et al. Ascaroside expression in Caenorhabditis elegans is strongly dependent on diet and developmental stage. PLoS One. 6 (3), e17804 (2011).
- Pungaliya, C., et al. A shortcut to identifying small molecule signals that regulate behavior and development in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 106 (19), 7708-7713 (2009).
- Srinivasan, J., et al. A modular library of small molecule signals regulates social behaviors in Caenorhabditis elegans. PLoS Biol. 10 (1), e1001237 (2012).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Choe, A., et al. Ascaroside signaling is widely conserved among nematodes. Curr Biol. 22 (9), 772-780 (2012).
- Von Reuss, S. H., et al. Comparative metabolomics reveals biogenesis of ascarosides, a modular library of small-molecule signals in C. elegans. J Am Chem Soc. 134 (3), 1817-1824 (2012).
- Choe, A., et al. Sex-specific mating pheromones in the nematode panagrellus redivivus. Proc Natl Acad Sci U S A. 109 (51), 20949-20954 (2012).
- Hsueh, Y. P., Mahanti, P., Schroeder, F. C., Sternberg, P. W. Nematode-trapping fungi eavesdrop on nematode pheromones. Curr Biol. 23 (1), 83-86 (2013).
- Hong, M., et al. Early pheromone experience modifies a synaptic activity to influence adult pheromone responses of C. elegans. Curr Biol. 27 (20), 3168-3177.e3 (2017).
- Ryu, L., et al. Feeding state regulates pheromone-mediated avoidance behavior via the insulin signaling pathway in Caenorhabditis elegans. EMBO J. 37 (15), e98402 (2018).
- Diaz, S. A., Lindström, J., Haydon, D. T. Basic demography of Caenorhabditis remanei cultured under standard laboratory conditions. J Nematol. 40 (3), 167 (2008).
- Bargmann, C. I. Chemosensation in C. elegans. WormBook : the online review of C.elegans biology. , 1-29 (2006).
- Margie, O., Palmer, C., Chin-Sang, I. C. elegans chemotaxis assay. JoVE: J Vis Exp. (74), e50069 (2013).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved