Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Extracción de feromonas sexuales volátiles y ensayo de quimioatracción en Caenorhabditis elegans
En este artículo
Resumen
Este protocolo establece métodos para extraer y cuantificar las respuestas a la feromona sexual volátil en C. elegans, proporcionando herramientas para estudiar la comunicación química y la trayectoria de navegación.
Resumen
La comunicación química es vital para la salud del organismo, la reproducción y el bienestar general. La comprensión de las vías moleculares, los procesos neuronales y los cálculos que gobiernan estas señales sigue siendo un área activa de investigación. El nematodo Caenorhabditis elegans proporciona un poderoso modelo para estudiar estos procesos, ya que produce una feromona sexual volátil. Esta feromona es sintetizada por hembras vírgenes o hermafroditas sin esperma y sirve como atrayente para los machos.
Este protocolo describe un método detallado para aislar la feromona sexual volátil de varias cepas de C. elegans (cepa WT N2, daf-22 y fog-2) y C. remanei. También proporcionamos un protocolo para cuantificar la respuesta de la quimiotaxis masculina a la feromona sexual volátil. Nuestro análisis utiliza mediciones como el índice de quimiotaxis (CI), el tiempo de llegada (A.T.) y un gráfico de trayectoria para comparar con precisión las respuestas masculinas en diversas condiciones. Este método permite realizar comparaciones sólidas entre machos de diferentes orígenes genéticos o etapas de desarrollo. Además, la configuración experimental descrita aquí es adaptable a la investigación de otros productos químicos de quimioatracción.
Introducción
La interacción entre la comunicación química y el éxito reproductivo es un principio fundamental en todo el reino animal 1,2,3,4,5,6,7,8,9,10. Las feromonas sexuales desencadenan una amplia gama de comportamientos sexualmente dimórficos esenciales para localizar parejas, coordinar los pasos necesarios para encontrar y atraer a una pareja y, en última instancia, promover la propagación de una especie 11,12,13,14,15,16,17. Se han logrado avances significativos en la comprensión de la señalización de feromonas, pero los mecanismos moleculares, los circuitos neuronales y los procesos computacionales que gobiernan estas interacciones a menudo permanecen incompletamente definidos 18,19,20,21,22,23,24,25,26.
El nematodo Caenorhabditis elegans proporciona un poderoso modelo para diseccionar estas preguntas. En particular, C. elegans exhibe una estrategia reproductiva inusual: los hermafroditas pueden autofertilizarse, pero también cruzarse con los machos 27,28,29,30,31,32,33. Esta flexibilidad requiere un sistema de comunicación robusto para señalar el estado reproductivo. C. elegans es conocido por sus feromonas solubles en agua bien caracterizadas, los ascarósidos, que desempeñan diversas funciones en el desarrollo, el comportamiento y las interacciones sociales. Descubrimientos recientes han revelado una clase distinta de feromonas sexuales volátiles empleadas por los nematodos. Estas feromonas son producidas específicamente por hembras vírgenes de C. elegans y C. remanei sexualmente maduras y hermafroditas sin esperma, sirviendo como atrayente para los machos adultos 29,34,35. Este atrayente exhibe un notable dimorfismo sexual en su producción y percepción. La gónada somática femenina gobierna la síntesis de esta feromona sexual volátil, y la producción refleja dinámicamente el estado reproductivo, cesando al aparearse y reanudándose varias horas después29,34.
La comprensión de la comunicación de las feromonas sexuales de los nematodos proporciona información sobre la evolución de los sistemas de comunicación química, la interacción entre el estado reproductivo y el comportamiento, y los mecanismos subyacentes al procesamiento neuronal sexualmente dimórfico 24,26,36,37,38,39 . Los estudios implican a la neurona anfiforme AWA en los hombres como crítica para la detección de feromonas, con el receptor SRD-1 acoplado a la proteína G desempeñando un papel clave en la detección de feromonas en los hombres24. C. elegans es muy adecuado para estudiar la comunicación química de los animales, especialmente la señalización de feromonas sexuales, debido a su dependencia del sistema olfativo para la búsqueda de pareja. Si bien se sabe mucho sobre la señalización de ascarósido, el sistema de feromonas sexuales volátiles ofrece oportunidades únicas para la comparación 25,26,36,40,41,42,43,44,45,46,47,48,49,50,
51,52,53,54,55,56,57. Además, C. elegans es un poderoso organismo modelo genético debido a su genoma completamente secuenciado, su linaje celular claramente definido y sus mutantes olfativos bien caracterizados.
Sin embargo, los circuitos neuronales completos involucrados en el procesamiento de esta feromona, los cálculos que traducen su percepción en comportamientos específicos de búsqueda de pareja y su regulación de biosíntesis aún no se han dilucidado por completo. Las investigaciones adicionales sobre estos procesos son cruciales para comprender los diversos mecanismos que gobiernan la comunicación y los comportamientos reproductivos de los animales. La identificación de genes clave implicados en la síntesis, secreción y percepción de feromonas promete desvelar nuevos actores moleculares en la comunicación animal. Los ensayos descritos aquí proporcionan una base para abordar estas preguntas.
Protocolo
1. Extracción cruda de feromonas sexuales de hembras y hermafroditas
- Protocolo para la sincronización de C. elegans
- Preparación de hembras adultas o hermafroditas
- Monitoree las placas de cultivo diariamente hasta que exista una gran población de hembras adultas/hermafroditas y la fuente de alimento OP50 se agote. Usando hembras de C. elegans y C . remanei de fog-2 para la extracción de feromonas sexuales crudas, prepare huevos sincronizados de las hembras apareadas.
NOTA: En este protocolo, los animales mutantes XX de C. elegans fog-2 , que no producen esperma propio, se denominan hembras de C. elegans .
- Monitoree las placas de cultivo diariamente hasta que exista una gran población de hembras adultas/hermafroditas y la fuente de alimento OP50 se agote. Usando hembras de C. elegans y C . remanei de fog-2 para la extracción de feromonas sexuales crudas, prepare huevos sincronizados de las hembras apareadas.
- Lavado y granulación de lombrices
- Lave los gusanos adultos de una placa de población mixta con tampón M9. Recoja la suspensión de tornillo sin fin en un tubo de microcentrífuga de 1,5 mL. Centrifugar a 1.500 × g durante 0,5-1 min para pellets los gusanos.
NOTA: Limpieza previa para contaminación pesada (opcional): Deje que los gusanos se asienten en el tubo si están muy contaminados. Pipetear el sobrenadante para eliminar las bacterias y repetir hasta que el sobrenadante se aclare.
- Lave los gusanos adultos de una placa de población mixta con tampón M9. Recoja la suspensión de tornillo sin fin en un tubo de microcentrífuga de 1,5 mL. Centrifugar a 1.500 × g durante 0,5-1 min para pellets los gusanos.
- Blanqueo
- Agregue 200 μL de tampón M9 al gránulo de gusano. Prepare el tampón de lisis mezclando lejía de uso doméstico y 1 M de NaOH en una proporción de 1:1. Agregue 500 μL de este tampón de lisis a la mezcla, vórtice durante 10 s y luego haga una pausa para monitorear la condición de lisis bajo un microscopio de disección. Repita este proceso de vórtices de 10 s seguido de observación hasta que los gusanos adultos estén completamente lisados.
- Detener el blanqueo y la granulación de los embriones
- Cuando los gusanos adultos se lisan en fragmentos pequeños (pero no se disuelven completamente), agregue inmediatamente 500 μL de tampón M9 para ralentizar la reacción. Centrifugar a 15.000 × g durante 30-60 s para pellet los embriones.
NOTA: La lisis excesiva puede dañar los embriones. Detenga la reacción cuando los cuerpos de los gusanos adultos se hayan descompuesto en pequeños fragmentos. La lisis continúa durante las etapas de centrifugación y lavado hasta que se elimina todo el tampón de lisis.
- Cuando los gusanos adultos se lisan en fragmentos pequeños (pero no se disuelven completamente), agregue inmediatamente 500 μL de tampón M9 para ralentizar la reacción. Centrifugar a 15.000 × g durante 30-60 s para pellet los embriones.
- Lavar los embriones 5 veces con 1 mL de tampón M9, centrifugando a 15.000 × g durante 30-60 s después de cada lavado. Retire el sobrenadante después de la centrifugación.
- Sincronización
- Vuelva a suspender los embriones en 800 μL de tampón M9 en un tubo de microcentrífuga de 1,5 mL. Gire el tubo a 20 °C durante 12-15 h para la eclosión L1 y la detención de lombrices en la etapa L1 debido a la falta de suministro de alimentos. Libere y cultive los gusanos a 20 ° C durante 3 días hasta que alcancen la etapa L4.
- Preparación de hembras adultas o hermafroditas
2. Extracción cruda de feromonas sexuales de hembras vírgenes de un día de edad (Figura 1A)
NOTA: Adoptamos un protocolo previamente establecido24 para extraer feromonas sexuales de hembras mutantes vírgenes de niebla-2 (feminización de la línea germinal) de C. elegans y hembras WT de C. remanei.
- Preparación de hembras adultas
- Seleccione y aísle aproximadamente 200 hembras de niebla-2 de la etapa L4 1 día antes de la extracción de feromonas. Para asegurarse de que solo se recolectan hembras vírgenes, separe cuidadosamente estas hembras L4 fog-2 por sexo y distribúyalas en tres placas NGM OP50 de 6 cm separadas. Coloque una pequeña cantidad de bacterias OP50 en el centro de cada plato.
NOTA: Distribuya 200 gusanos hembra L4 en tres placas separadas para evitar el riesgo de introducir accidentalmente un gusano macho en la placa. Si se elige un macho, es probable que se aparee con muchas hembras, lo que resulta en que la mayoría de las hembras sean fertilizadas al día siguiente cuando se conviertan en adultas. Las hembras fertilizadas no emiten feromonas sexuales volátiles hasta que se agota el esperma, lo que afecta los resultados de la extracción. La fuente de alimento limitada restringe a los hermafroditas a un área más pequeña en el centro del plato, minimizando la posibilidad de escapar del plato durante el período de aislamiento.
- Seleccione y aísle aproximadamente 200 hembras de niebla-2 de la etapa L4 1 día antes de la extracción de feromonas. Para asegurarse de que solo se recolectan hembras vírgenes, separe cuidadosamente estas hembras L4 fog-2 por sexo y distribúyalas en tres placas NGM OP50 de 6 cm separadas. Coloque una pequeña cantidad de bacterias OP50 en el centro de cada plato.
- Proceso de extracción
- El día de la extracción (día 1 de madurez reproductiva, 3 días después de que los gusanos fueron liberados de la detención L1), elija y aísle 100 hembras vírgenes de niebla-2 de 1 día de edad en un tubo de microcentrífuga que contenga 1 mL de tampón M9. Lave las hembras 5 veces con tampón M9 para minimizar la contaminación bacteriana e incube en 100 μL de tampón M9 durante 6 h a 20 °C para permitir la producción y acumulación de feromonas en el medio.
- Realizar un proceso de extracción similar para las hembras de C. remanei , utilizando solo 15-20 hembras en etapa L4 aisladas el día antes de la extracción en tres placas, y al día siguiente, incubar cinco hembras vírgenes en 100 μL de tampón M9 durante 6 h a 25 °C (temperatura óptima de crecimiento para C. remanei)58.
NOTA: Las hembras de C. remanei producen una mayor cantidad de feromonas sexuales volátiles en comparación con las hembras de C. elegans . Por lo tanto, solo cinco hembras son suficientes para extraer 100 μL de feromona sexual volátil bruta.
- Almacenamiento
- Centrifugar muestras a 15.000 × g durante 30-60 s para pellets los gusanos. Transfiera con cuidado el sobrenadante (que contiene feromonas) a un tubo limpio y deseche el tubo que contiene la pelletza de gusano. Almacene el sobrenadante aislado para ensayos de quimioatracción posteriores.
NOTA: El extracto crudo de feromonas sexuales volátiles se puede almacenar durante al menos 1 año a -80 °C en un tubo de microcentrífuga envuelto con parafilm para minimizar la evaporación.
- Centrifugar muestras a 15.000 × g durante 30-60 s para pellets los gusanos. Transfiera con cuidado el sobrenadante (que contiene feromonas) a un tubo limpio y deseche el tubo que contiene la pelletza de gusano. Almacene el sobrenadante aislado para ensayos de quimioatracción posteriores.
- Control de calidad
- Antes de utilizar el extracto, realizar una prueba de control de calidad utilizando machos N2 o machos him-5 para verificar su quimioatractivo (ver sección 4).
3. Una gran cantidad de extracción cruda de feromonas sexuales de hermafroditas vírgenes de 6 días de edad (Figura 1A)
- Cultivo de lombrices
- Para obtener aproximadamente 20 mL de feromona sexual cruda de C. elegans , sincronice veinte placas NGM de 10 cm que contengan gusanos adultos sanos de C. elegans (ya sea N2 o daf-22 mutante) utilizando el protocolo de blanqueo antes mencionado y luego lávelos 5 veces con tampón M9.
NOTA: Este proceso prepara suficientes embriones para la extracción de feromonas. N2: La cepa estándar de WT C. elegans que produce feromonas de ascarósido solubles en agua y feromonas sexuales volátiles no ascarósidas. Mutante daf-22 : Un mutante que carece de la capacidad de producir muchas feromonas de ascarósido, lo que los hace útiles para estudiar feromonas sexuales volátiles no ascarósido de forma aislada. - Para sincronizar los gusanos en la etapa L1, rote los embriones en el tampón M9 durante 12-15 h para detener el desarrollo. Transfiera los gusanos L1 detenidos a placas de cultivo NGM de 10 cm sembradas con bacterias OP50 para su crecimiento y desarrollo.
- Para minimizar la presencia de machos en las placas hermafroditas, revise las placas 2 días después de la liberación del gusano, en la etapa L4, y elimine los machos observados (muy raros).
- Después de tres días de desarrollo, busque la aparición de embriones que indiquen que los gusanos se han convertido en adultos reproductivamente maduros.
NOTA: Las hembras mutantesde niebla-2 de C. elegans y las hembras WT de C. remanei no son adecuadas para la extracción masiva de feromonas sexuales volátiles. Los mutantes de niebla-2 C. elegans y C. remanei tienen una alta proporción de machos en sus poblaciones, y los machos se aparean continuamente con las hembras. Las hembras fertilizadas no producen feromonas sexuales volátiles. La presencia masculina complica la extracción de estos compuestos.
- Para obtener aproximadamente 20 mL de feromona sexual cruda de C. elegans , sincronice veinte placas NGM de 10 cm que contengan gusanos adultos sanos de C. elegans (ya sea N2 o daf-22 mutante) utilizando el protocolo de blanqueo antes mencionado y luego lávelos 5 veces con tampón M9.
- Lavado de lombrices y separación de embriones
- Lavar los embriones repetidamente con tampón M9 y dejar que se asienten (1 g de sedimentación) hasta que la mayoría de los adultos estén en el fondo del tubo; Repita de 5 a 7 veces. Deje que los tubos de microcentrífuga se depositen sin perturbaciones en una rejilla durante varios minutos para facilitar la sedimentación de los gusanos adultos y permitir la separación de la población de gusanos adultos de los embriones, que permanecen suspendidos en el sobrenadante.
- Pipetear los adultos separados y transferirlos a nuevas placas NGM sembradas con OP50.
- Repita este proceso de lavado durante 5-6 días para agotar el esperma propio.
NOTA: Para la extracción de feromonas sexuales volátiles, utilice hermafroditas que tengan 5-6 días de antigüedad. Este momento asegura que es probable que su propio esperma se agote, ya que los hermafroditas con autoesperma disponible no producen feromonas sexuales volátiles. Numerosos embriones muertos o sin eclosionar en la placa para el día 5 o 6 indican un momento apropiado para comenzar la extracción de feromonas.
- Extracción de feromonas sexuales
- Extraiga la feromona sexual como se describe en la sección 1 con modificaciones.
- En lugar de agregar 100 hembras de C. elegans por cada 100 μL, agregue tampón M9 en función del volumen final de gránulos de gusano. Agregue 1 mL de tampón M9 por cada 50 μL de gusanos empaquetados.
- Control de calidad y homogeneización
- Control de calidad de los lotes de prueba de feromonas extraídas mediante el ensayo de quimioatracción con machos N2 o machos him-5 (ver sección 4).
- Mezcle todos los lotes para crear una feromona sexual volátil cruda homogénea para experimentos que necesitan una gran cantidad de feromona, como experimentos de detección o microfluídicos. Almacene el extracto crudo de feromonas sexuales durante al menos 1 año a -80 °C en tubos de 50 ml envueltos con parafilm para minimizar la evaporación.
- Método de valoración basado en el ensayo de quimioatracción para la estandarización del extracto crudo de feromonas sexuales
- Realice un ensayo de titulación probando diluciones en serie de cada extracto de feromona tanto en WT N2 como en macho de C. elegans him-5. Determine la dilución más alta (concentración más baja) que provoque consistentemente una respuesta de quimiotaxis robusta y reproducible en las cepas de control.
- Prepare una serie de diluciones de cada extracto crudo (por ejemplo, 1:2, 1:4, 1:8, etc.) en tampón M9.
- Ensayos de quimiotaxis
- Realizar ensayos de quimiotaxis estandarizados (ver sección 4) utilizando cada dilución en la cepa de referencia de los machos. Realice tres réplicas para garantizar la reproducibilidad. Compare las diluciones óptimas en diferentes lotes de extracción para evaluar la consistencia en la concentración de feromonas.
NOTA: Esto establece un punto de referencia para evaluar la bioactividad de cada extracto. En el ensayo estándar de quimioatracción de feromonas sexuales, los extractos originales sin diluir se utilizarán para experimentos posteriores, y la titulación servirá como un paso de control de calidad para garantizar una actividad constante de feromonas entre lotes. La serie de dilución se puede ajustar en función de las necesidades experimentales específicas. Dado que el protocolo de extracción estándar produce sistemáticamente extractos de feromonas crudas saturadas, es posible que no sea necesario realizar una prueba de titulación para estandarizar el extracto en la mayoría de los experimentos. Se recomienda utilizar el mismo lote de feromona sexual cruda a lo largo de un conjunto de experimentos relacionados para mantener la consistencia y minimizar la variabilidad en la actividad de las feromonas.
- Realizar ensayos de quimiotaxis estandarizados (ver sección 4) utilizando cada dilución en la cepa de referencia de los machos. Realice tres réplicas para garantizar la reproducibilidad. Compare las diluciones óptimas en diferentes lotes de extracción para evaluar la consistencia en la concentración de feromonas.
4. Ensayo de quimioatracción de feromonas sexuales volátiles
NOTA: El ensayo de quimioatracción de feromonas sexuales volátiles se ha adaptado de métodos previamente establecidos utilizados en otros estudios de quimioatracción 24,29,59,60,61. Estas modificaciones se implementaron para optimizar la sensibilidad y especificidad del ensayo para detectar respuestas a feromonas sexuales volátiles. Este enfoque personalizado mejora la aplicabilidad del ensayo a necesidades específicas de investigación.
- Observe las placas de cultivo diariamente hasta que las hembras adultas/hermafroditas sean abundantes. La salud de los gusanos influye en su respuesta a la feromona sexual.
- Preparación de él-5 machos
- Utilice el protocolo estándar de blanqueo para sincronizar los gusanos él-5 . Después de la sincronización, lave los gusanos 5 veces con el tampón M9. Aislar los machos L4 el día antes del ensayo; luego, transfiera gusanos machos adultos de un día de edad de sus placas sembradas y enjuáguelos en tampón M9 antes del ensayo. Colóquelos en placas NGM sin semillas antes del ensayo para eliminar las bacterias residuales y evitar la interferencia de los alimentos durante el ensayo.
NOTA: No deje morir de hambre a los gusanos durante más de una hora antes del ensayo, ya que esto puede alterar su estado interno e influir en los resultados del ensayo de quimioatracción de feromonas sexuales. Por lo tanto, si tiene la intención de realizar más de 10 ensayos en un solo día, reemplace las muestras de lombrices cada hora. Además, alterne entre un ensayo experimental y un ensayo de control repetidamente.
- Utilice el protocolo estándar de blanqueo para sincronizar los gusanos él-5 . Después de la sincronización, lave los gusanos 5 veces con el tampón M9. Aislar los machos L4 el día antes del ensayo; luego, transfiera gusanos machos adultos de un día de edad de sus placas sembradas y enjuáguelos en tampón M9 antes del ensayo. Colóquelos en placas NGM sin semillas antes del ensayo para eliminar las bacterias residuales y evitar la interferencia de los alimentos durante el ensayo.
- Preparación de placas de ensayo de agar quimioatracción
- Prepare placas de ensayo de quimioatracción con agar al 1,5%, 25 mM de NaCl, 1,5 mM de Tris-base y 3,5 mM de Tris-Cl como se describe en la literatura pertinente24.
- Caliente el agar en la solución de quimioatracción usando un microondas hasta que se disuelva por completo. Deje que la solución se enfríe a temperatura ambiente durante 5 minutos.
- Utilice una pipeta para distribuir uniformemente la solución de agar quimioatracción en placas de Petri: vierta 30 mL en cada placa de 10 cm y 20 mL en cada placa de 6 cm.
- Después de verter la solución de agar quimioatracción en las placas de Petri, deje las tapas abiertas en un área limpia durante al menos 40 minutos para permitir que la superficie del agar se seque ligeramente. Una vez que la superficie se haya secado adecuadamente, cierre las tapas.
NOTA: Este tiempo de secado puede variar en función de la humedad y la temperatura del entorno del laboratorio.
- Almacenamiento de placas y preparación previa al ensayo
- Empaquetar y almacenar las placas de ensayo preparadas en una cámara frigorífica durante un máximo de 1 semana. Antes de usar, retire las placas del almacenamiento en frío y deje que se aclimaten a temperatura ambiente durante más de una hora. Abra las tapas para dejar que la humedad residual se evapore del agar 20 minutos antes del ensayo en un área limpia, asegurándose de que no haya agua evidente en la superficie antes de realizar el ensayo.
- Diseño experimental y ensayo de quimioatracción
- Para llevar a cabo el ensayo de quimioatracción, marque tres puntos distintos en la tapa y la parte inferior de la placa de Petri o use una plantilla impresa en papel plástico transparente colocado debajo de la placa o conectado al microscopio de disección. Estas marcas incluyen un punto central (•) como punto de partida para los gusanos, un signo más (+) para el punto experimental (2 μL de feromona sexual en la tapa y 2 μL de azida sódica 1 M en la placa) y un signo menos (-) para el punto de control (2 μL de tampón M9 en la tapa y 2 μL de azida sódica 1 M) (Figura 2A). Ajuste la distancia entre estas marcas de acuerdo con el tamaño del plato y las necesidades experimentales específicas. Normalmente, en el caso de las placas de Petri de 6 cm, se establece una distancia fija de 1,5 cm desde el punto de partida hasta cada sustancia problema para las pruebas de control positivas.
- Pasos detallados para realizar el ensayo (Figura 2)
- Aplique 2 μL de azida sódica 1 M en cada punto experimental y de control de la placa.
- Recoge 20 gusanos machos sanos y que se muevan libremente con un recogedor de gusanos. Libera simultáneamente 20 gusanos machos en el punto de partida bajo un microscopio de disección.
- Agregue rápidamente 2 μL de feromona sexual y 2 μL de tampón M9 a los puntos experimental y de control en el párpado, respectivamente.
- Cierre suavemente la tapa y coloque la placa de ensayo en un área tranquila y estable a la temperatura junto al microscopio.
- Después de 30 minutos, puntúe el ensayo contando el número de lombrices en cada punto.
NOTA: El proceso de recolección de 20 lombrices no debe exceder 1-2 minutos para evitar que las lombrices seleccionadas temprano se sequen y se vuelvan poco saludables, lo que podría afectar los resultados. Todo el proceso, desde la recogida de los machos hasta el cierre de la tapa, debería durar entre 2 y 5 minutos.
- Cribado de control positivo
- Pruebe los gusanos macho con una solución diluida de diacetilo 1.000 veces (disuelta en etanol al 10% y tampón M9 al 90%) para confirmar su capacidad de respuesta a la quimiotaxia. Evalúe los resultados del ensayo de quimioatracción 30 minutos después de iniciar la prueba. Puntúe los gusanos que están paralizados en los puntos designados en función de su ubicación: 'C' para los que están en el punto de control y 'E' para los que están en el lugar experimental. Marque los gusanos en ninguno de los puntos como 'N' (Figura 2C).
- Para calcular el Índice de Quimioatracción (CI), use la siguiente fórmula:
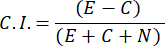
- Seleccione solo muestras masculinas con un índice de quimiotaxis ≥ 0,4 (I.C., ver Figura 2C). Utilice el macho del mismo lote para la prueba de feromonas sexuales posterior.
NOTA: Realice tres ensayos separados, cada uno con 20 gusanos, para garantizar la consistencia y confiabilidad de los resultados experimentales. Por lo general, tres ensayos son suficientes para inferir la consistencia.
5. Pautas de tiempo y puntuación para el ensayo de quimioatracción
- Evalúe la respuesta de quimioatracción de los gusanos en función de sus ubicaciones finales. Marque el número de lombrices en cada punto al final del ensayo, generalmente 30 minutos después de su inicio.
NOTA: El uso de azida sódica en puntos experimentales y de control paraliza la llegada de gusanos, lo que facilita una puntuación precisa. La mayoría de los machos WT N2 y him-5 son capaces de localizar la fuente de feromonas en 6-8 minutos en una placa de 6 cm con una configuración de distancia de 1,5 cm. - Para detectar defectos en la eficiencia de la quimiotaxis, especialmente para detectar defectos sutiles, considere monitorear el ensayo a intervalos regulares de 3 a 5 minutos.
NOTA: Esta observación frecuente permite documentar los momentos en que los gusanos llegan a los puntos de prueba. Este seguimiento detallado puede revelar casos en los que los gusanos exhiben una disminución de la eficiencia de la quimiotaxis y, sin embargo, logran alcanzar el punto de prueba dentro de la ventana de examen.
6. Modificaciones opcionales
- Para una mejor evaluación de la quimiotaxis, emplee una cámara colocada sobre la placa para registrar las trayectorias de los gusanos a lo largo del ensayo.
NOTA: Esta modificación permite un análisis exhaustivo de sus patrones de movimiento, proporcionando una visión más profunda del comportamiento y la trayectoria de la quimioatracción (Figura 3).
7. Análisis de datos
- Puntuación y cálculo del Índice de Quimioatracción (C.I.)
- Siga los pasos 4.7.1 y 4.7.2.
- Gráfico de la hora de llegada
- Para un análisis más completo de los ensayos de quimioatracción, considere monitorear el ensayo a intervalos de 3 a 5 minutos o emplear una cámara colocada sobre la placa para registrar las trayectorias de los gusanos a lo largo del ensayo.
NOTA: Estos enfoques no solo permiten puntuar los tiempos de llegada de los gusanos a los puntos de diseño, sino también comparar los tiempos medios de llegada y analizar la distribución de estos tiempos.
- Para un análisis más completo de los ensayos de quimioatracción, considere monitorear el ensayo a intervalos de 3 a 5 minutos o emplear una cámara colocada sobre la placa para registrar las trayectorias de los gusanos a lo largo del ensayo.
- Análisis de trayectorias y visualización de datos basados en vídeo
NOTA: Para analizar los patrones de movimiento de C. elegans Durante los ensayos de quimioatracción, registre y extraiga las trayectorias (consulte la Tabla de materiales) y análisis más detallados (Figura 3).- Configura el sistema de grabación.
- Inicie una nueva grabación y acceda a la ventana de configuración de grabación .
- Defina los parámetros de grabación deseados:
- Prefijo de archivo: elija un nombre descriptivo para los archivos de vídeo (por ejemplo, "experiment1_").
- Velocidad de fotogramas (FPS): seleccione los fotogramas por segundo apropiados para capturar el movimiento del gusano (por ejemplo, 7,5 FPS para gusanos en la placa de agar y 30 FPS para gusanos nadadores ).
- Duración: establezca la duración de la grabación en segundos (por ejemplo, 1.800 s [30 min] para el ensayo de quimioatracción masiva).
- Optimice la calidad de la imagen: Ajuste la intensidad de la iluminación para asegurarse de que los gusanos sean claramente visibles contra el fondo y ajuste el enfoque para obtener una imagen nítida de los gusanos.
- Para preparar la placa de ensayo, primero dispense la solución de control en el punto de control designado. Luego, levante con cuidado los gusanos y suéltelos suavemente en el centro del plato. Una vez que los gusanos se hayan asentado, aplique la solución de feromonas sexuales en el lugar experimental designado.
- Coloque la placa: Coloque con cuidado la placa que contiene los gusanos en el centro del campo de grabación para maximizar el área de captura.
- Para reducir el estrés en los gusanos durante los ensayos de quimiotaxis, considere los siguientes dos enfoques.
- Para el ensayo de un solo gusano, coloque el gusano en la placa de ensayo y deje que se aclimate durante 5 minutos antes de introducir la solución de feromonas sexuales a la distancia designada (la posición se basa en la ubicación actual del gusano).
NOTA: Esto minimiza la manipulación y proporciona tiempo al gusano para adaptarse a su nuevo entorno. - Ensayo de quimioatracción a granel: Deje que los gusanos se asienten y se dispersen naturalmente en el plato durante 5 minutos. Después de este período de aclimatación, introduzca la solución de feromonas en la posición fija designada. Durante el análisis posterior al video, mida la distancia inicial de cada gusano a la feromona y agrúpelos en consecuencia para un análisis posterior.
- Para el ensayo de un solo gusano, coloque el gusano en la placa de ensayo y deje que se aclimate durante 5 minutos antes de introducir la solución de feromonas sexuales a la distancia designada (la posición se basa en la ubicación actual del gusano).
- Procedimiento de análisis de vídeo
- Importación y configuración: Importe el video grabado en el software. Configure la información de secuencia (por ejemplo, velocidad de fotogramas); Especifique la escala de imagen (píxeles por unidad de medida).
- Ajuste de imagen: Para optimizar la detección de gusanos, ajuste el umbral de detección hasta que la etiqueta verde los delimite claramente sin capturar el ruido de fondo ni los artefactos. Además, aplique algoritmos de suavizado de fondo para reducir el ruido y las irregularidades de la imagen, mejorando el contraste entre los gusanos y el fondo. Experimente con diferentes niveles de suavizado para encontrar el equilibrio óptimo entre la reducción de ruido y la conservación de los detalles de los gusanos.
NOTA: El umbral ideal debe cubrir la mayor parte del cuerpo de cada gusano y excluir los elementos extraños. - Optimización de parámetros de detección: seleccione un gusano representativo para generar automáticamente los parámetros de detección. Verifique la precisión de la detección inspeccionando visualmente de 5 a 10 fotogramas aleatorios. Si la detección no es satisfactoria, refine los parámetros de detección manualmente, vuelva a revisar la configuración de ajuste de la imagen si es necesario y proceda a realizar el seguimiento una vez que la detección sea confiable.
- Revisión y reparación de trayectorias de seguimiento: Una vez finalizado el proceso de seguimiento automatizado, realice una revisión manual de las trayectorias generadas. Si se encuentran inconsistencias durante la revisión, utilice la función de reparación para corregir la trayectoria y realice las siguientes operaciones: Unir: Conecte segmentos de trayectoria a los que se les han asignado incorrectamente diferentes identificadores pero que pertenecen a la misma persona. Dividir: segmentos de trayectoria separados a los que se les ha asignado incorrectamente el mismo identificador pero que pertenecen a diferentes individuos.
NOTA: El objetivo es garantizar que cada identificador único (número) se asigne de forma coherente a la misma persona durante todo el período de seguimiento.
Ejemplo: Si un gusano se etiqueta como "3" durante un período, y luego se etiqueta incorrectamente como "7" durante un período posterior, la función de reparación uniría estos dos segmentos bajo el identificador "3". Por el contrario, si dos gusanos están etiquetados como "12" durante un período, la función de reparación dividiría este segmento en dos trayectorias separadas, cada una con un identificador único. Mediante una revisión cuidadosa y la aplicación de las reparaciones necesarias, la precisión y la fiabilidad de los datos de seguimiento pueden mejorarse significativamente. - Visualización y exportación de resultados: Utilice software para la visualización y el análisis básico. Exporte datos como archivos CSV para su posterior análisis con las herramientas o el código preferidos. Este método proporciona un código básico (ver https://github.com/edmondztt/pheromone-traj-analysis.git) para visualizar la trayectoria del movimiento del gusano en función de cinco parámetros clave (Figura 3). Tiempo: La progresión de la trayectoria, codificada por colores para indicar el paso del tiempo desde el inicio del experimento. Distancia a la feromona: La distancia entre el gusano y la fuente de feromonas en cada punto de tiempo. Velocidad: La velocidad del gusano en cada punto, que también indica los eventos de giro y parada. Rectitud: Qué tan recto es el camino del gusano. Corrección de dirección: ¿Qué tan alineado está el movimiento del gusano con la dirección del objetivo de la feromona? Este código proporciona una visualización fundamental para comprender el comportamiento de los gusanos y se puede personalizar y ampliar para un análisis más profundo.
NOTA: Este enfoque avanzado proporciona una alternativa integral al índice de quimioatracción tradicional al detallar la trayectoria de navegación del gusano en respuesta a las feromonas sexuales. Permite comprender los patrones de movimiento sin depender de puntos finales arbitrarios de la navegación y la determinación de la ventana de tiempo, lo que ofrece una visión más profunda de la dinámica de comportamiento del ensayo. Los datos se promediaron en 20 fotogramas, que se pueden ajustar en función de las necesidades experimentales específicas, para filtrar el movimiento causado por la torsión del cuerpo.
Resultados
Análisis de trayectoria de la percepción de feromonas sexuales volátiles en el ensayo de quimioatracción
Este ensayo de quimioatracción diferencia de forma fiable entre cepas de C . elegans de tipo salvaje y mutantes en su respuesta a las feromonas sexuales volátiles. Los experimentos exitosos con machos him-5 demuestran consistentemente una quimiotaxis robusta hacia la fuente de feromonas. Esto se refleja en un alto índice de quimiotaxis (C.I...
Discusión
Este protocolo proporciona una metodología robusta para la extracción de feromonas sexuales volátiles de C. elegans, junto con el establecimiento de un ensayo de quimioatracción robusto para medir las respuestas de quimioatracción masculina. Se puede encontrar información adicional en la guía del usuario de WormLab (consulte la Tabla de materiales); Para obtener un código básico para visualizar la trayectoria del movimiento del gusano, consulte la secci...
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Agradecemos al Dr. Tingtao Zhou por diseñar y escribir el código para las visualizaciones de trayectorias utilizadas en nuestro análisis. Este trabajo contó con el apoyo financiero de R01 NS113119 (PWS), la beca postdoctoral senior Chen y el Instituto de Neurociencia de Tianqiao y Chrissy Chen.
Materiales
| Name | Company | Catalog Number | Comments |
| 10 cm Petri dishes | Falcon | 25373-100 | Falcon bacteriological Petri dish 100 x 15 mm |
| 6 cm Petri dishes | Falcon | 25373-085 | Falcon bacteriological Petri dish 60 x 15 mm |
| C. remanei (EM464) | CGC | ||
| Centrifuge | Eppendorf | centrifuge 5418 | Any brand should work. |
| Chemoattraction assay plates | Homemade solution | N/A | 1.5% agar, 25 mM NaCl, 1.5 mM Tris-base, and 3.5 mM Tris-Cl |
| Cholesterol | Alfa Aesar | 57-88-5 | |
| Dissecting Microscope | Leica | LeicaMZ75 | Any brand should work. |
| E. Coli OP50 | CGC | ||
| Ethanol | Koptec | 64-17-5 | |
| fog-2(q71) (JK574) | CGC | ||
| him-5(e1490)(CB4088) | CGC | ||
| Household bleach | Clorox Germicidal bleach concentrated | Bleach | |
| M9 buffer | Homemade solution | N/A | 3 g KH2PO4, 11.3 g Na2HPO4.7H2O, 5 g NaCl, H2O to 1 L. Sterilize by autoclaving. Add 1 mL 1 M MgSO4 after cool down to room temperature. |
| Magnesium Sulfate, Anhydrous, Powder | Macron | M1063-500GM-EA | |
| Microwave | TOSHIBA | N/A | Any brand should work. |
| N2 | CGC | ||
| NaOH | Sigma-aldrich | S318-3 | 1 M |
| NGM plates solution | Homemade solution | N/A | 2.5 g Peptone, 18 g agar, 3 g NaCl, H2O to 1 L.Sterilize by autoclaving. Once the autoclave is done (2 h), wait until the temperature of the medium drops to 65 °C. Put on a hotplate at 65 °C and stir. Then add the following, waiting 5 min between each to avoid crystallization: 1 mL CaCl2 (1 M), 1 mL MgSO4 (1 M), 25 mL K3PO4 (1 M, pH=6), 1 mL Cholesterol ( 5 mg/mL in ethanol). |
| Parafilm | Bemis | 13-374-10 | Bemis Parafilm M Laboratory Wrapping Film |
| Peptone | VWR | 97063-324 | |
| Pipet- aid | Drummond Scientific | 4-000-100 | Any brand should work. |
| Plastic paper | Octago | Waterproof Screen Printing Inkjet Transparency Film | https://www.amazon.com/Octago-Waterproof-Transparency-Printing-Printers/dp/B08HJQWFGD |
| Potassium chloride | Sigma-aldrich | SLBP2366V | |
| Potassium phosphate | Spectrum | 7778-77-0 | |
| Pipette | Eppendorf | SKU: EPPR4331; MFG#: 2231300006 | 20 - 200 µL, 100 - 1000 µL, any brand should work. |
| Rotator | Labnet | SKU: LI-H5500 | Labnet H5500 Mini LabRoller with Dual Direction Rotator. Any brand should work. |
| Sodium chloride | VWR | 7647-14-5 | |
| sodium phosphate dibasic | Sigma-aldrich | SLCG3888 | |
| Tris-base | Sigma-aldrich | 77-86-1 | |
| Tris-Cl | Roche | 1185-53-1 | |
| Tryptone | VWR | 97063-390 | |
| Vortex | Scientific industries | Vortex-Genie 2 | Any brand should work. |
| WormLab system | MBF Bioscience | N/A | https://www.mbfbioscience.com/help/WormLab/Content/home.htm; https://www.mbfbioscience.com/products/wormlab/ |
| Wormpicker | Homemade | N/A | made with platinum and glass pipet tips |
Referencias
- Audesirk, T. E. Chemoreception in Alphysia californica. Iii. Evidence for pheromones influencing reproductive behavior. Behav Biol. 20 (2), 235-243 (1977).
- Traynor, K. S., Le Conte, Y., Page, R. E. Queen and young larval pheromones impact nursing and reproductive physiology of honey bee (Apis mellifera) workers. Behav Ecol Sociobiol. 68 (12), 2059-2073 (2014).
- Cowley, J. J., Wise, D. R. Pheromones, growth and behaviour. Ciba Found Study Group. 35, 144-170 (1970).
- Epple, G. Pheromones in primate reproduction and social behavior. Adv Behav Biol. 11, 131-155 (1974).
- Levinson, H. Z. Possibilities of using insectistatics and pheromones in pest control. Naturwissenschaften. 62 (6), 272-282 (1975).
- Roelofs, W. Manipulating sex pheromones for insect suppression. Environ Lett. 8 (1), 41-59 (1975).
- Marchlewska-Koj, A. Pheromones and mammalian reproduction. Oxf Rev Reprod Biol. 6, 266-302 (1984).
- Keverne, E. B. Neuroendocrinology briefings 11: Pheromones and reproduction. J Neuroendocrinol. 12 (11), 1045-1046 (2000).
- Rekwot, P. I., Ogwu, D., Oyedipe, E. O., Sekoni, V. O. The role of pheromones and biostimulation in animal reproduction. Anim Reprod Sci. 65 (3-4), 157-170 (2001).
- Gomez-Diaz, C., Benton, R. The joy of sex pheromones. EMBO reports. 14 (10), 874-883 (2013).
- Shorey, H. H., Gaston, L. K., Jefferson, R. N. Insect sex pheromones. Adv Pest Control Res. 8, 57-126 (1968).
- Bruce, H. M. Pheromones and behavior in mice. Acta Neurol Psychiatr Belg. 69 (7), 529-538 (1969).
- Shorey, H. H., Bartell, R. J. Role of a volatile female sex pheromone in stimulating male courtship behaviour in Drosophila melanogaster. Anim Behav. 18 (1), 159-164 (1970).
- Bobadoye, B., et al. Evidence of aggregation-sex pheromone use by longhorned beetles (coleoptera: Cerambycidae) species native to Africa. Environ Entomol. 48 (1), 189-192 (2019).
- Saunders, J. R. Sex pheromones in bacteria. Nature. 275 (5682), 692-694 (1978).
- Schulz, S., Toft, S. Identification of a sex pheromone from a spider. Science. 260 (5114), 1635-1637 (1993).
- Finnegan, D. E., Chambers, J. Identification of the sex pheromone of the guernsey carpet beetle, Anthrenussarnicus mroczkowski (coleoptera: Dermestidae). J Chem Ecol. 19 (5), 971-983 (1993).
- Vaillancourt, L. J., Raudaskoski, M., Specht, C. A., Raper, C. A. Multiple genes encoding pheromones and a pheromone receptor define the b beta 1 mating-type specificity in Schizophyllum commune. Genetics. 146 (2), 541-551 (1997).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook : the online review of C. elegans biology. , 1-22 (2013).
- Sakai, N., et al. A sexually conditioned switch of chemosensory behavior in C. elegans. PLoS One. 8 (7), e68676 (2013).
- Sengupta, S., Smith, D. P., Mucignat-Caretta, C. How Drosophila detect volatile pheromones: signaling, circuits, and behavior. Neurobiology of chemical communication. , (2014).
- Zhang, Y. K., Reilly, D. K., Yu, J., Srinivasan, J., Schroeder, F. C. Photoaffinity probes for nematode pheromone receptor identification. Org Biomol Chem. 18 (1), 36-40 (2019).
- Aprison, E. Z., Ruvinsky, I. Dynamic regulation of adult-specific functions of the nervous system by signaling from the reproductive system. Curr Biol. 29 (23), 4116-4123.e3 (2019).
- Wan, X., et al. SRD-1 in AWA neurons is the receptor for female volatile sex pheromones in C. elegans males. EMBO Rep. 20 (3), e46288 (2019).
- Peckol, E. L., Troemel, E. R., Bargmann, C. I. Sensory experience and sensory activity regulate chemosensory receptor gene expression in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 98 (20), 11032-11038 (2001).
- Jang, H., et al. Neuromodulatory state and sex specify alternative behaviors through antagonistic synaptic pathways in. C. elegans. Neuron. 75 (4), 585-592 (2012).
- Liu, K. S., Sternberg, P. W. Sensory regulation of male mating behavior in Caenorhabditis elegans. Neuron. 14 (1), 79-89 (1995).
- Chasnov, J. R., Chow, K. L. Why are there males in the hermaphroditic species Caenorhabditis elegans. Genetics. 160 (3), 983-994 (2002).
- Chasnov, J. R., So, W. K., Chan, C. M., Chow, K. L. The species, sex, and stage specificity of a Caenorhabditis sex pheromone. Proc Natl Acad Sci U S A. 104 (16), 6730-6735 (2007).
- Susoy, V., et al. Natural sensory context drives diverse brain-wide activity during C. elegans mating. Cell. 184 (20), 5122-5137.e17 (2021).
- Barriere, A., Felix, M. A. High local genetic diversity and low outcrossing rate in Caenorhabditis elegans natural populations. Curr Biol. 15 (13), 1176-1184 (2005).
- Click, A., Savaliya, C. H., Kienle, S., Herrmann, M., Pires-Dasilva, A. Natural variation of outcrossing in the hermaphroditic nematode Pristionchus pacificus. BMC Evol Biol. 9, 75 (2009).
- Anderson, J. L., Morran, L. T., Phillips, P. C. Outcrossing and the maintenance of males within C. elegans populations. J Hered. 101 (suppl_1), S62-S74 (2010).
- Leighton, D. H., Choe, A., Wu, S. Y., Sternberg, P. W. Communication between oocytes and somatic cells regulates volatile pheromone production in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 111 (50), 17905-17910 (2014).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Fagan, K. A., et al. A single-neuron chemosensory switch determines the valence of a sexually dimorphic sensory behavior. Curr Biol. 28 (6), 902-914.e5 (2018).
- Lipton, J., Kleemann, G., Ghosh, R., Lints, R., Emmons, S. W. Mate searching in Caenorhabditis elegans: A genetic model for sex drive in a simple invertebrate. J Neurosci. 24 (34), 7427-7434 (2004).
- Frady, E. P., Palmer, C. R., Kristan, W. B. Sexual attraction: Sex-specific wiring of neural circuitry. Curr Biol. 22 (22), R953-R956 (2012).
- Liu, Q., et al. Two preputial gland-secreted pheromones evoke sexually dimorphic neural pathways in the mouse vomeronasal system. Front Cell Neurosci. 13, 455 (2019).
- Ludewig, A. H., et al. Pheromone sensing regulates Caenorhabditis elegans lifespan and stress resistance via the deacetylase sir-2.1. Proc Natl Acad Sci U S A. 110 (14), 5522-5527 (2013).
- Golden, J. W., Riddle, D. L. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Butcher, R. A., Fujita, M., Schroeder, F. C., Clardy, J. Small-molecule pheromones that control dauer development in Caenorhabditis elegans. Nat Chem Biol. 3 (7), 420-422 (2007).
- Jeong, P. Y., et al. Chemical structure and biological activity of the Caenorhabditis elegans dauer-inducing pheromone. Nature. 433 (7025), 541-545 (2005).
- Butcher, R. A., Ragains, J. R., Kim, E., Clardy, J. A potent dauer pheromone component in Caenorhabditis elegans that acts synergistically with other components. Proc Natl Acad Sci U S A. 105 (38), 14288-14292 (2008).
- Aprison, E. Z., Ruvinsky, I. Counteracting ascarosides act through distinct neurons to determine the sexual identity of C. elegans pheromones. Curr Biol. 27 (17), 2589-2599.e3 (2017).
- Aprison, E. Z., Ruvinsky, I. Sex pheromones of C. elegans males prime the female reproductive system and ameliorate the effects of heat stress. PLoS Genet. 11 (12), e1005729 (2015).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Kaplan, F., et al. Ascaroside expression in Caenorhabditis elegans is strongly dependent on diet and developmental stage. PLoS One. 6 (3), e17804 (2011).
- Pungaliya, C., et al. A shortcut to identifying small molecule signals that regulate behavior and development in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 106 (19), 7708-7713 (2009).
- Srinivasan, J., et al. A modular library of small molecule signals regulates social behaviors in Caenorhabditis elegans. PLoS Biol. 10 (1), e1001237 (2012).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Choe, A., et al. Ascaroside signaling is widely conserved among nematodes. Curr Biol. 22 (9), 772-780 (2012).
- Von Reuss, S. H., et al. Comparative metabolomics reveals biogenesis of ascarosides, a modular library of small-molecule signals in C. elegans. J Am Chem Soc. 134 (3), 1817-1824 (2012).
- Choe, A., et al. Sex-specific mating pheromones in the nematode panagrellus redivivus. Proc Natl Acad Sci U S A. 109 (51), 20949-20954 (2012).
- Hsueh, Y. P., Mahanti, P., Schroeder, F. C., Sternberg, P. W. Nematode-trapping fungi eavesdrop on nematode pheromones. Curr Biol. 23 (1), 83-86 (2013).
- Hong, M., et al. Early pheromone experience modifies a synaptic activity to influence adult pheromone responses of C. elegans. Curr Biol. 27 (20), 3168-3177.e3 (2017).
- Ryu, L., et al. Feeding state regulates pheromone-mediated avoidance behavior via the insulin signaling pathway in Caenorhabditis elegans. EMBO J. 37 (15), e98402 (2018).
- Diaz, S. A., Lindström, J., Haydon, D. T. Basic demography of Caenorhabditis remanei cultured under standard laboratory conditions. J Nematol. 40 (3), 167 (2008).
- Bargmann, C. I. Chemosensation in C. elegans. WormBook : the online review of C.elegans biology. , 1-29 (2006).
- Margie, O., Palmer, C., Chin-Sang, I. C. elegans chemotaxis assay. JoVE: J Vis Exp. (74), e50069 (2013).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados