É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Extração de feromônios sexuais voláteis e ensaio de quimioatração em Caenorhabditis elegans
Neste Artigo
Resumo
Este protocolo estabelece métodos para extrair e quantificar as respostas ao feromônio sexual volátil em C. elegans, fornecendo ferramentas para estudar a comunicação química e a trajetória de navegação.
Resumo
A comunicação química é vital para a saúde do organismo, a reprodução e o bem-estar geral. Compreender as vias moleculares, os processos neurais e os cálculos que regem esses sinais continua sendo uma área ativa de pesquisa. O nematóide Caenorhabditis elegans fornece um modelo poderoso para estudar esses processos, pois produz um feromônio sexual volátil. Este feromônio é sintetizado por fêmeas virgens ou hermafroditas empobrecidos em esperma e serve como atrativo para os machos.
Este protocolo descreve um método detalhado para isolar o feromônio sexual volátil de várias cepas de C. elegans (WT cepa N2, daf-22 e fog-2) e C. remanei. Também fornecemos um protocolo para quantificar a resposta da quimiotaxia masculina ao feromônio sexual volátil. Nossa análise utiliza medições como índice de quimiotaxia (CI), tempo de chegada (AT) e um gráfico de trajetória para comparar as respostas masculinas sob várias condições com precisão. Este método permite comparações robustas entre machos de diferentes origens genéticas ou estágios de desenvolvimento. Além disso, a configuração experimental descrita aqui é adaptável à investigação de outros produtos químicos de quimioatração.
Introdução
A interação entre a comunicação química e o sucesso reprodutivo é um princípio fundamental em todo o reino animal 1,2,3,4,5,6,7,8,9,10. Os feromônios sexuais desencadeiam uma ampla gama de comportamentos sexualmente dimórficos essenciais para localizar parceiros, coordenar as etapas envolvidas na busca e atração de um parceiro e, finalmente, promover a propagação de uma espécie 11,12,13,14,15,16,17. Um progresso significativo foi feito na compreensão da sinalização de feromônios, mas os mecanismos moleculares, circuitos neurais e processos computacionais que regem essas interações muitas vezes permanecem incompletamente definidos 18,19,20,21,22,23,24,25,26.
O nematóide Caenorhabditis elegans fornece um modelo poderoso para dissecar essas questões. Notavelmente, C. elegans exibe uma estratégia reprodutiva incomum - hermafroditas podem se autofertilizar, mas também cruzar com os machos 27,28,29,30,31,32,33. Essa flexibilidade requer um sistema de comunicação robusto para sinalizar o status reprodutivo. C. elegans é conhecido por seus feromônios solúveis em água bem caracterizados, os ascarosídeos, que desempenham papéis variados no desenvolvimento, comportamento e interações sociais. Descobertas recentes revelaram uma classe distinta de feromônios sexuais voláteis empregados pelos nematóides. Esses feromônios são produzidos especificamente por fêmeas virgens sexualmente maduras de C. elegans e C. remanei e hermafroditas depletados de esperma, servindo como atrativo para machos adultos 29,34,35. Este atrativo exibe notável dimorfismo sexual em sua produção e percepção. A gônada somática feminina governa a síntese desse feromônio sexual volátil, e a produção reflete dinamicamente o estado reprodutivo, cessando após o acasalamento e retomando várias horas depois29,34.
Compreender a comunicação do feromônio sexual dos nematóides fornece informações sobre a evolução dos sistemas de comunicação química, a interação entre o estado reprodutivo e o comportamento e os mecanismos subjacentes ao processamento neural sexualmente dimórfico 24,26,36,37,38,39 . Estudos implicam o neurônio anfido AWA em homens como crítico para a detecção de feromônios, com o receptor acoplado à proteína G SRD-1 desempenhando um papel fundamental na detecção de feromônios em homens24. C. elegans é adequado para estudar a comunicação química animal, especialmente a sinalização de feromônios sexuais, devido à sua dependência do sistema olfativo para a busca de parceiros. Embora muito se saiba sobre a sinalização de ascarosídeo, o sistema de feromônios sexuais voláteis oferece oportunidades únicas de comparação 25,26,36,40,41,42,43,44,45,46,47,48,49,50,
51,52,53,54,55,56,57. Além disso, C. elegans é um poderoso organismo modelo genético devido ao seu genoma totalmente sequenciado, linhagem celular claramente definida e mutantes olfativos bem caracterizados.
No entanto, o circuito neural completo envolvido no processamento desse feromônio, os cálculos que traduzem sua percepção em comportamentos de busca de parceiros direcionados e sua regulação da biossíntese ainda precisam ser totalmente elucidados. Investigações adicionais sobre esses processos são cruciais para a compreensão dos diversos mecanismos que regem a comunicação animal e os comportamentos reprodutivos. A identificação de genes-chave envolvidos na síntese, secreção e percepção de feromônios promete revelar novos atores moleculares na comunicação animal. Os ensaios descritos aqui fornecem uma base para abordar essas questões.
Protocolo
1. Extração bruta de feromônios sexuais de fêmeas e hermafroditas
- Protocolo para sincronização de C. elegans
- Preparação de fêmeas adultas ou hermafroditas
- Monitore as placas de cultura diariamente até que exista uma grande população de fêmeas adultas/hermafroditas e a fonte de alimento OP50 se esgote. Usando fêmeas de C. elegans e WT C. remanei para extração de feromônio sexual bruto, prepare ovos sincronizados das fêmeas acasaladas.
NOTA: Neste protocolo, os animais XX mutantes de C. elegans fog-2 , que não produzem espermatozóides, são chamados de fêmeas de C. elegans .
- Monitore as placas de cultura diariamente até que exista uma grande população de fêmeas adultas/hermafroditas e a fonte de alimento OP50 se esgote. Usando fêmeas de C. elegans e WT C. remanei para extração de feromônio sexual bruto, prepare ovos sincronizados das fêmeas acasaladas.
- Lavagem e peletização de minhocas
- Lave os vermes adultos de uma placa de população mista com tampão M9. Colete a suspensão sem-fim em um tubo de microcentrífuga de 1,5 mL. Centrifugue a 1.500 × g por 0,5-1 min para peletar as minhocas.
NOTA: Pré-limpeza para contaminação pesada (opcional): Deixe os vermes se depositarem no tubo se estiverem muito contaminados. Pipetar o sobrenadante para remover as bactérias e repetir até que o sobrenadante fique claro.
- Lave os vermes adultos de uma placa de população mista com tampão M9. Colete a suspensão sem-fim em um tubo de microcentrífuga de 1,5 mL. Centrifugue a 1.500 × g por 0,5-1 min para peletar as minhocas.
- Branqueamento
- Adicione 200 μL de tampão M9 ao pellet de minhoca. Prepare o tampão de lise misturando alvejante doméstico e NaOH 1 M na proporção de 1:1. Adicione 500 μL desse tampão de lise à mistura, vórtice por 10 s e, em seguida, faça uma pausa para monitorar a condição de lise sob um microscópio de dissecação. Repita este processo de vórtices de 10 s seguido de observação até que os vermes adultos estejam totalmente lisados.
- Parar de branquear e peletizar os embriões
- Quando os vermes adultos são lisados em pequenos fragmentos (mas não completamente dissolvidos), adicione imediatamente 500 μL de tampão M9 para retardar a reação. Centrifugue a 15.000 × g por 30-60 s para pellet os embriões.
NOTA: A lise excessiva pode danificar os embriões. Pare a reação quando os corpos dos vermes adultos se decomporem em pequenos fragmentos. A lise continua durante as etapas de centrifugação e lavagem até que todo o tampão de lise seja removido.
- Quando os vermes adultos são lisados em pequenos fragmentos (mas não completamente dissolvidos), adicione imediatamente 500 μL de tampão M9 para retardar a reação. Centrifugue a 15.000 × g por 30-60 s para pellet os embriões.
- Lave os embriões 5x com 1 mL de tampão M9, centrifugando a 15.000 × g por 30-60 s após cada lavagem. Remover o sobrenadante após centrifugação.
- Sincronização
- Ressuspenda os embriões em 800 μL de tampão M9 em um tubo de microcentrífuga de 1,5 mL. Gire o tubo a 20 °C por 12-15 h para incubação L1 e travamento de vermes no estágio L1 devido à falta de suprimento de alimento. Solte e cultive os vermes a 20° C por 3 dias até atingirem o estágio L4.
- Preparação de fêmeas adultas ou hermafroditas
2. Extração bruta de feromônios sexuais de fêmeas virgens de um dia de idade (Figura 1A)
NOTA: Adotamos um protocolo24 previamente estabelecido para extrair feromônios sexuais de fêmeas mutantes de fog-2 virgem (feminização da linha germinativa) de um dia de C . elegans e fêmeas WT de C. remanei.
- Preparação de fêmeas adultas
- Selecione e isole aproximadamente 200 fêmeas de neblina de estágio L4-2 1 dia antes da extração do feromônio. Para garantir que apenas fêmeas virgens sejam coletadas, separe essas fêmeas L4 fog-2 cuidadosamente por sexo e distribua-as em três placas separadas de 6 cm OP50 NGM. Coloque uma pequena quantidade de bactérias OP50 no centro de cada placa.
NOTA: Distribua 200 vermes fêmeas L4 em três placas separadas para evitar o risco de introduzir acidentalmente um verme macho na placa. Se um macho for escolhido, é provável que acasale com muitas fêmeas, resultando na fertilização da maioria das fêmeas no dia seguinte, quando se tornarem adultas. As fêmeas fertilizadas não emitem feromônios sexuais voláteis até que o esperma se esgote, o que afeta os resultados da extração. A fonte de alimento limitada restringe os hermafroditas a uma área menor no centro da placa, minimizando a chance de escapar da placa durante o período de isolamento.
- Selecione e isole aproximadamente 200 fêmeas de neblina de estágio L4-2 1 dia antes da extração do feromônio. Para garantir que apenas fêmeas virgens sejam coletadas, separe essas fêmeas L4 fog-2 cuidadosamente por sexo e distribua-as em três placas separadas de 6 cm OP50 NGM. Coloque uma pequena quantidade de bactérias OP50 no centro de cada placa.
- Processo de extração
- No dia da extração (dia 1 da maturidade reprodutiva, 3 dias após os vermes terem sido liberados da parada L1), pegue e isole 100 fêmeas virgens de 1 dia de idade em um tubo de microcentrífuga contendo 1 mL de tampão M9. Lave as fêmeas 5x com tampão M9 para minimizar a contaminação bacteriana e incube-as em 100 μL de tampão M9 por 6 h a 20 °C para permitir a produção e acúmulo de feromônios no meio.
- Realize um processo de extração semelhante para fêmeas de C. remanei , usando apenas 15-20 fêmeas do estágio L4 isoladas no dia anterior à extração em três placas e, no dia seguinte, incube cinco fêmeas virgens em 100 μL de tampão M9 por 6 h a 25 ° C (temperatura ideal de crescimento para C. remanei) 58 .
NOTA: As fêmeas de C. remanei produzem uma quantidade maior de feromônios sexuais voláteis em comparação com as fêmeas de C. elegans . Portanto, apenas cinco fêmeas são suficientes para extrair 100 μL de feromônio sexual volátil bruto.
- Armazenamento
- Centrifugue amostras a 15.000 × g por 30-60 s para peletar os vermes. Pipete cuidadosamente a transferência do sobrenadante (contendo feromônios) para um tubo limpo e descarte o tubo que contém o pellet de minhoca. Armazene o sobrenadante isolado para ensaios de quimioatração subsequentes.
NOTA: O extrato bruto de feromônio sexual volátil pode ser armazenado por pelo menos 1 ano a -80 °C em um tubo de microcentrífuga envolto em parafilme para minimizar a evaporação.
- Centrifugue amostras a 15.000 × g por 30-60 s para peletar os vermes. Pipete cuidadosamente a transferência do sobrenadante (contendo feromônios) para um tubo limpo e descarte o tubo que contém o pellet de minhoca. Armazene o sobrenadante isolado para ensaios de quimioatração subsequentes.
- Controle de qualidade
- Antes de utilizar o extracto, efectuar um ensaio de controlo de qualidade utilizando machos N2 ou machos him-5 para verificar a sua quimioatractividade (ver secção 4).
3. Uma grande quantidade de extração bruta de feromônios sexuais de hermafroditas virgens de 6 dias (Figura 1A)
- Cultura de minhocas
- Para obter aproximadamente 20 mL de feromônio sexual bruto de C. elegans , sincronize vinte placas NGM de 10 cm contendo vermes adultos saudáveis de C. elegans (mutante N2 ou daf-22 ) usando o protocolo de alvejante mencionado acima e, em seguida, lave-os 5x com tampão M9.
NOTA: Este processo prepara embriões suficientes para a extração de feromônios. N2: A cepa padrão WT C. elegans que produz feromônios de ascarosídeo solúveis em água e feromônios sexuais voláteis não ascarosídeos. mutante daf-22 : Um mutante sem a capacidade de produzir muitos feromônios de ascarosídeo, tornando-os úteis no estudo de feromônios sexuais voláteis não ascarosídeos isoladamente. - Para sincronizar vermes no estágio L1, gire os embriões no tampão M9 por 12-15 h para interromper o desenvolvimento. Transferir os vermes L1 presos para placas de cultura NGM de 10 cm semeadas com bactérias OP50 para crescimento e desenvolvimento.
- Para minimizar a presença de machos nas placas hermafroditas, verifique as placas 2 dias após a liberação do verme, no estágio L4, e remova todos os machos observados (muito raro).
- Após três dias de desenvolvimento, procure o aparecimento de embriões indicando que os vermes se tornaram adultos reprodutivamente maduros.
NOTA: as fêmeas mutantesfog-2 de C. elegans e as fêmeas WT de C. remanei são inadequadas para extração de feromônios sexuais voláteis em massa. Os mutantes de névoa-2 C. elegans e C. remanei têm uma alta proporção de machos em suas populações, e os machos acasalam continuamente com as fêmeas. As fêmeas fertilizadas não produzem feromônios sexuais voláteis. A presença masculina complica a extração desses compostos.
- Para obter aproximadamente 20 mL de feromônio sexual bruto de C. elegans , sincronize vinte placas NGM de 10 cm contendo vermes adultos saudáveis de C. elegans (mutante N2 ou daf-22 ) usando o protocolo de alvejante mencionado acima e, em seguida, lave-os 5x com tampão M9.
- Lavagem de vermes e separação de embriões
- Lavar os embriões repetidamente com tampão M9 e deixá-los repousar (1 g de sedimentação) até que a maioria dos adultos esteja no fundo do tubo; repita 5-7x. Permitir que os tubos de microcentrífuga assentem sem perturbações num rack durante vários minutos para facilitar a sedimentação dos vermes adultos e permitir a separação da população de vermes adultos dos embriões, que permanecem suspensos no sobrenadante.
- Pipete os adultos separados e transfira-os para novas placas NGM com sementes OP50.
- Repita este processo de lavagem por 5-6 dias para esgotar o auto-esperma.
NOTA: Para a extração de feromônios sexuais voláteis, utilize hermafroditas com 5-6 dias de idade. Esse tempo garante que seu autoespermatozóide provavelmente se esgote, pois os hermafroditas com espermatozóides disponíveis não produzem feromônios sexuais voláteis. Numerosos embriões mortos ou não eclodidos na placa no dia 5 ou 6 indicam um momento apropriado para iniciar a extração de feromônios.
- Extração de feromônios sexuais
- Extrair a feromona sexual conforme descrito na secção 1 com modificações.
- Em vez de adicionar 100 fêmeas de C. elegans por 100 μL, adicione tampão M9 com base no volume final do pellet de verme. Adicione 1 mL de tampão M9 por 50 μL de vermes compactados.
- Controle de qualidade e homogeneização
- Lotes de teste de controle de qualidade de feromônio extraído usando o ensaio de quimioatração com machos N2 ou machos him-5 (ver seção 4).
- Misture todos os lotes para criar um feromônio sexual volátil bruto homogêneo para experimentos que precisam de uma grande quantidade de feromônio, como triagem ou experimentos microfluídicos. Armazene o extrato bruto de feromônio sexual por pelo menos 1 ano a -80 ° C em tubos de 50 mL envoltos em parafilme para minimizar a evaporação.
- Método de titulação baseado em ensaio de quimioatração para padronização do extrato bruto de feromônio sexual
- Realize um ensaio de titulação testando diluições seriadas de cada extrato de feromônio em Wt N2 e elegans machos him-5. Determinar a diluição mais elevada (concentração mais baixa) que provoca consistentemente uma resposta quimiotaxia robusta e reprodutível em estirpes de controlo.
- Preparar uma série de diluições de cada extracto bruto (por exemplo, 1:2, 1:4, 1:8, etc.) em tampão M9.
- Ensaios de quimiotaxia
- Realizar ensaios de quimiotaxia normalizados (ver secção 4) utilizando cada diluição na estirpe de referência dos machos. Execute três réplicas para garantir a reprodutibilidade. Compare as diluições ideais em diferentes lotes de extração para avaliar a consistência na concentração de feromônios.
NOTA: Isso estabelece um ponto de referência para avaliar a bioatividade de cada extrato. No ensaio de quimioatração de feromônio sexual padrão, os extratos originais não diluídos serão usados para experimentos subsequentes, com a titulação servindo como uma etapa de controle de qualidade para garantir uma atividade consistente de feromônios entre os lotes. A série de diluições pode ser ajustada com base em necessidades experimentais específicas. Dado que o protocolo de extração padrão produz consistentemente extratos de feromônios brutos saturados, um teste de titulação para padronizar o extrato pode não ser necessário para a maioria dos experimentos. Recomenda-se usar o mesmo lote de feromônio sexual bruto em um conjunto de experimentos relacionados para manter a consistência e minimizar a variabilidade na atividade do feromônio.
- Realizar ensaios de quimiotaxia normalizados (ver secção 4) utilizando cada diluição na estirpe de referência dos machos. Execute três réplicas para garantir a reprodutibilidade. Compare as diluições ideais em diferentes lotes de extração para avaliar a consistência na concentração de feromônios.
4. Ensaio de quimioatração de feromônio sexual volátil
NOTA: O ensaio de quimioatração de feromônios sexuais voláteis foi adaptado de métodos previamente estabelecidos usados em outros estudos de quimioatração 24,29,59,60,61. Essas modificações foram implementadas para otimizar a sensibilidade e especificidade do ensaio para detectar respostas a feromônios sexuais voláteis. Essa abordagem personalizada aumenta a aplicabilidade do ensaio a necessidades específicas de pesquisa.
- Observe as placas de cultura diariamente até que as fêmeas adultas/hermafroditas sejam abundantes. A saúde dos vermes influencia sua resposta ao feromônio sexual.
- Preparação dele-5 machos
- Utilize o protocolo de alvejante padrão para sincronizá-lo-5 vermes. Após a sincronização, lave os worms 5x com buffer M9. Isolar os machos L4 no dia anterior ao ensaio; em seguida, transferir os vermes machos adultos de um dia das suas placas semeadas e enxaguá-los em tampão M9 antes do ensaio. Coloque-os em placas NGM não semeadas antes do ensaio para eliminar bactérias residuais e evitar a interferência de alimentos durante o ensaio.
NOTA: Não deixe os vermes morrerem de fome por mais de uma hora antes do ensaio, pois isso pode alterar seu estado interno e influenciar os resultados do ensaio de quimioatração de feromônios sexuais. Portanto, se você pretende realizar mais de 10 ensaios em um único dia, substitua as amostras de vermes a cada hora. Além disso, alterne entre um ensaio experimental e um ensaio de controle repetidamente.
- Utilize o protocolo de alvejante padrão para sincronizá-lo-5 vermes. Após a sincronização, lave os worms 5x com buffer M9. Isolar os machos L4 no dia anterior ao ensaio; em seguida, transferir os vermes machos adultos de um dia das suas placas semeadas e enxaguá-los em tampão M9 antes do ensaio. Coloque-os em placas NGM não semeadas antes do ensaio para eliminar bactérias residuais e evitar a interferência de alimentos durante o ensaio.
- Preparação de placas de ensaio de ágar quimioatração
- Prepare placas de ensaio de quimioatração com ágar 1,5%, NaCl 25 mM, Tris-base 1,5 mM e Tris-Cl 3,5 mM, conforme descrito na literatura relevante24.
- Aquecer o ágar-ágar na solução de quimioatração no micro-ondas até dissolver completamente. Deixe a solução esfriar em temperatura ambiente por 5 min.
- Use um auxiliar de pipeta para distribuir uniformemente a solução de ágar quimioatração em placas de Petri: despeje 30 mL em cada placa de 10 cm e 20 mL em cada placa de 6 cm.
- Depois de despejar a solução de ágar quimioatração nas placas de Petri, deixe as tampas abertas em uma área limpa por pelo menos 40 minutos para permitir que a superfície do ágar seque ligeiramente. Assim que a superfície secar adequadamente, feche as tampas.
NOTA: Este tempo de secagem pode variar dependendo da umidade e temperatura do ambiente do laboratório.
- Armazenamento em placas e preparação pré-ensaio
- Embale e armazene as placas de ensaio preparadas em uma câmara fria por até 1 semana. Antes de usar, remova as placas do armazenamento refrigerado e deixe-as se aclimatar à temperatura ambiente por mais de uma hora. Abra as tampas para permitir que qualquer umidade residual evapore do ágar 20 minutos antes do ensaio em uma área limpa, garantindo que não haja água óbvia na superfície antes de fazer o ensaio.
- Desenho experimental e ensaio de quimioatração
- Para realizar o ensaio de quimioatração, marque três pontos distintos na tampa e na parte inferior da placa de Petri ou use um gabarito impresso em papel plástico transparente colocado sob a placa ou anexado ao microscópio de dissecação. Essas marcações incluem um ponto do meio (•) como ponto de partida para os vermes, um sinal de mais (+) para o local experimental (2 μL de feromônio sexual na tampa e 2 μL de azida sódica 1 M na placa) e um sinal de menos (-) para o ponto de controle (2 μL de tampão M9 na tampa e 2 μL de azida sódica 1 M) (Figura 2A). Ajuste a distância entre essas marcas de acordo com o tamanho do prato e as necessidades experimentais específicas. Normalmente, para placas de Petri de 6 cm, definir uma distância fixa de 1,5 cm do ponto de partida para cada substância de ensaio para os testes de controlo positivo.
- Etapas detalhadas para realizar o ensaio (Figura 2)
- Aplique 2 μL de azida sódica 1 M em cada ponto experimental e de controle na placa.
- Escolha 20 minhocas machos saudáveis e que se movem livremente com um selecionador de minhocas. Solte simultaneamente 20 vermes machos no ponto de partida sob um microscópio de dissecação.
- Adicione rapidamente 2 μL de feromônio sexual e 2 μL de tampão M9 aos pontos experimentais e de controle na tampa, respectivamente.
- Feche suavemente a tampa e coloque a placa de ensaio em uma área silenciosa e estável à temperatura ao lado do microscópio.
- Após 30 min, marque o ensaio contando o número de vermes em cada ponto.
NOTA: O processo de colheita de 20 minhocas não deve exceder 1-2 min para evitar que as minhocas colhidas precocemente sequem e se tornem insalubres, o que pode afetar os resultados. Todo o processo, desde a escolha dos machos até o fechamento da tampa, deve levar entre 2 e 5 minutos.
- Triagem de controle positivo
- Teste os vermes machos em uma solução diluída de 1.000 vezes de diacetil (dissolvido em etanol a 10% e tampão M9 a 90%) para confirmar sua capacidade de resposta à quimiotaxia. Avalie os resultados do ensaio de quimioatração 30 min após o início do teste. Marque os vermes que estão paralisados nos pontos designados com base em sua localização: 'C' para aqueles no local de controle e 'E' para aqueles no local experimental. Pontue os vermes em nenhum dos pontos como 'N' (Figura 2C).
- Para calcular o Índice de Quimioatração (IC), use a seguinte fórmula:
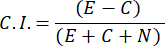
- Selecione apenas amostras masculinas com um índice de quimiotaxia ≥ 0,4 (CI, consulte a Figura 2C). Use o macho do mesmo lote para o teste de feromônio sexual subsequente.
NOTA: Realize três ensaios separados, cada um envolvendo 20 vermes, para garantir a consistência e confiabilidade dos resultados experimentais. Três ensaios são normalmente suficientes para inferir consistência.
5. Diretrizes de tempo e pontuação para ensaio de quimioatração
- Avalie a resposta de quimioatração dos vermes com base em suas localizações finais. Marque o número de vermes em cada ponto na conclusão do ensaio, geralmente 30 minutos após o início.
NOTA: O uso de azida sódica em pontos experimentais e de controle paralisa os vermes que chegam, facilitando a pontuação precisa. A maioria dos machos WT N2 e him-5 são capazes de localizar a fonte de feromônio dentro de 6-8 min em uma placa de 6 cm com uma configuração de distância de 1,5 cm. - Para capturar defeitos na eficiência da quimiotaxia, especialmente para detectar defeitos sutis, considere monitorar o ensaio em intervalos regulares de 3-5 min.
NOTA: Esta observação frequente permite documentar os horários em que os vermes chegam aos pontos de teste. Esse rastreamento detalhado pode revelar casos em que os vermes exibem diminuição da eficiência da quimiotaxia, mas ainda conseguem chegar ao local de teste dentro da janela de exame.
6. Modificações opcionais
- Para uma avaliação aprimorada da quimiotaxia, empregue uma câmera posicionada acima da placa para registrar as trajetórias dos vermes ao longo do ensaio.
NOTA: Esta modificação permite uma análise abrangente de seus padrões de movimento, fornecendo uma visão mais profunda do comportamento e da trajetória da quimioatração (Figura 3).
7. Análise dos dados
- Pontuação e cálculo do Índice de Quimioatração (I.C.)
- Siga as etapas 4.7.1 e 4.7.2.
- Gráfico de tempo de chegada
- Para uma análise mais abrangente dos ensaios de quimioatração, considere monitorar o ensaio em intervalos de 3-5 minutos ou empregar uma câmera posicionada acima da placa para registrar as trajetórias dos vermes ao longo do ensaio.
NOTA: Essas abordagens não só permitem pontuar os tempos de chegada das minhocas nos pontos de projeto, mas também comparar os tempos médios de chegada e analisar a distribuição desses tempos.
- Para uma análise mais abrangente dos ensaios de quimioatração, considere monitorar o ensaio em intervalos de 3-5 minutos ou empregar uma câmera posicionada acima da placa para registrar as trajetórias dos vermes ao longo do ensaio.
- Análise de trajetória baseada em vídeo e visualização de dados
NOTA: Para analisar os padrões de movimento de C. elegans durante os ensaios de quimioatração, registre e extraia trajetórias (consulte o Tabela de Materiais) e uma análise mais aprofundada (Figura 3).- Configure o sistema de gravação.
- Inicie uma nova gravação e acesse a janela de configurações de gravação .
- Defina os parâmetros de gravação desejados:
- Prefixo do arquivo: Escolha um nome descritivo para os arquivos de vídeo (por exemplo, "experiment1_").
- Taxa de quadros (FPS): Selecione os quadros apropriados por segundo para capturar o movimento do verme (por exemplo, 7,5 FPS para vermes na placa de ágar e 30 FPS para minhocas nadadoras ).
- Duração: Defina a duração da gravação em segundos (por exemplo, 1.800 s [30 min] para ensaio de quimioatração em massa).
- Otimize a qualidade da imagem: Ajuste a intensidade da iluminação para garantir que os vermes sejam claramente visíveis contra o fundo e ajuste o foco para obter uma imagem nítida dos vermes.
- Para preparar a placa de ensaio, primeiro dispense a solução de controle no ponto de controle designado. Em seguida, pegue cuidadosamente o (s) verme (s) e solte-os suavemente no centro da placa. Uma vez que o(s) verme(s) tenha(m) se acomodado(s), aplique a solução de feromônio sexual no local experimental designado.
- Posicione a placa: Coloque cuidadosamente a placa contendo os vermes no centro do campo de gravação para maximizar a área de captura.
- Para reduzir o estresse nos vermes durante os ensaios de quimiotaxia, considere as duas abordagens a seguir.
- Para ensaio de verme único, coloque o verme na placa de ensaio e deixe-o aclimatar por 5 minutos antes de introduzir a solução de feromônio sexual na distância designada (a posição baseada na localização atual do verme).
NOTA: Isso minimiza o manuseio e fornece ao worm tempo para se ajustar ao seu novo ambiente. - Ensaio de quimioatração em massa: Deixe os vermes assentarem e se dispersarem naturalmente na placa por 5 min. Após este período de aclimatação, introduza a solução de feromônio na posição fixa designada. Durante a análise pós-vídeo, meça a distância inicial de cada verme do feromônio e agrupe-os de acordo para uma análise posterior.
- Para ensaio de verme único, coloque o verme na placa de ensaio e deixe-o aclimatar por 5 minutos antes de introduzir a solução de feromônio sexual na distância designada (a posição baseada na localização atual do verme).
- Procedimento de análise de vídeo
- Importação e configuração: Importe o vídeo gravado para o software. Configure as informações da sequência (por exemplo, taxa de quadros); Especifique a escala de imagem (pixels por unidade de medida).
- Ajuste de imagem: Para otimizar a detecção de worms, ajuste o limite de detecção até que o rótulo verde contorne firmemente os worms sem capturar ruídos ou artefatos de fundo. Além disso, aplique algoritmos de suavização de fundo para reduzir o ruído e a irregularidade na imagem, aumentando o contraste entre os vermes e o fundo. Experimente diferentes níveis de suavização para encontrar o equilíbrio ideal entre redução de ruído e preservação dos detalhes do worm.
NOTA: O limite ideal deve cobrir a maior parte do corpo de cada verme, excluindo elementos estranhos. - Otimização do parâmetro de detecção: Selecione um worm representativo para gerar automaticamente os parâmetros de detecção. Verifique a precisão da detecção inspecionando visualmente de 5 a 10 quadros aleatórios. Se a detecção for insatisfatória, refine os parâmetros de detecção manualmente, revise as configurações de ajuste de imagem, se necessário, e prossiga para rastrear quando a detecção for confiável.
- Revisão e reparo de trajetórias de rastreamento: Após a conclusão do processo de rastreamento automatizado, execute uma revisão manual das trajetórias geradas. Se forem encontradas inconsistências durante a revisão, use a função de reparo para corrigir a trajetória e execute as seguintes operações: Unir: Conecte segmentos de trajetória que foram atribuídos incorretamente a identificadores diferentes, mas pertencem ao mesmo indivíduo. Dividir: Segmentos de trajetória separados que receberam incorretamente o mesmo identificador, mas pertencem a indivíduos diferentes.
NOTA: O objetivo é garantir que cada identificador exclusivo (número) seja atribuído consistentemente ao mesmo indivíduo durante todo o período de rastreamento.
Exemplo: Se um worm for rotulado como "3" por um período e, em seguida, rotulado incorretamente como "7" por um período subsequente, a função de reparo unirá esses dois segmentos sob o identificador "3". Por outro lado, se dois worms forem rotulados como "12" por um período, a função de reparo dividirá esse segmento em duas trajetórias separadas, cada uma com um identificador exclusivo. Ao revisar cuidadosamente e aplicar os reparos necessários, a precisão e a confiabilidade dos dados de rastreamento podem ser significativamente melhoradas. - Visualização e exportação de resultados: Utilize software para visualização e análise básica. Exporte dados como arquivos CSV para análise posterior com as ferramentas ou código preferidos. Esse método fornece um código básico (consulte https://github.com/edmondztt/pheromone-traj-analysis.git) para visualizar a trajetória do movimento do verme com base em cinco parâmetros principais (Figura 3). Tempo: A progressão da trajetória, codificada por cores para indicar a passagem do tempo desde o início do experimento. Distância até o feromônio: A distância entre o verme e a fonte de feromônio em cada ponto de tempo. Velocidade: A velocidade do worm em cada ponto, que também indicava os eventos de giro e parada. Retidão: Quão reto é o caminho do verme. Correção de direção: Quão alinhado o movimento do verme está com a direção do alvo do feromônio? Esse código fornece uma visualização básica para entender o comportamento do worm e pode ser personalizado e expandido para uma análise mais profunda.
NOTA: Esta abordagem avançada fornece uma alternativa abrangente ao índice de quimioatração tradicional, detalhando a trajetória de navegação do verme em resposta aos feromônios sexuais. Ele permite entender os padrões de movimento sem depender de pontos finais arbitrários da navegação e da determinação da janela de tempo, oferecendo insights mais profundos sobre a dinâmica comportamental do ensaio. Os dados foram calculados em média em 20 quadros, que podem ser ajustados com base em necessidades experimentais específicas, para filtrar o movimento causado pela torção do corpo.
Resultados
Análise da trajetória da cepa defeituosa de percepção de feromônio sexual volátil no ensaio de quimioatração
Este ensaio de quimioatração diferencia de forma confiável entre cepas selvagens e mutantes de C. elegans em sua resposta a feromônios sexuais voláteis. Experimentos bem-sucedidos com machos him-5 demonstram consistentemente quimiotaxia robusta em direção à fonte de feromônios. Isso se reflete em um alto índice de quimiotaxia...
Discussão
Este protocolo fornece uma metodologia robusta para a extração de feromônios sexuais voláteis de C. elegans, juntamente com o estabelecimento de um ensaio robusto de quimioatração para medir as respostas de quimioatração masculina. Informações adicionais podem ser encontradas no guia do usuário do WormLab (consulte a Tabela de Materiais); Para obter um código básico para visualizar a trajetória do movimento do worm, consulte a seção 7.3.8.5 do pr...
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Somos gratos ao Dr. Tingtao Zhou por projetar e escrever o código para as visualizações de trajetória usadas em nossa análise. Este trabalho foi apoiado por financiamento: R01 NS113119 (PWS), bolsa de pós-doutorado sênior Chen e o Instituto de Neurociência Tianqiao e Chrissy Chen.
Materiais
| Name | Company | Catalog Number | Comments |
| 10 cm Petri dishes | Falcon | 25373-100 | Falcon bacteriological Petri dish 100 x 15 mm |
| 6 cm Petri dishes | Falcon | 25373-085 | Falcon bacteriological Petri dish 60 x 15 mm |
| C. remanei (EM464) | CGC | ||
| Centrifuge | Eppendorf | centrifuge 5418 | Any brand should work. |
| Chemoattraction assay plates | Homemade solution | N/A | 1.5% agar, 25 mM NaCl, 1.5 mM Tris-base, and 3.5 mM Tris-Cl |
| Cholesterol | Alfa Aesar | 57-88-5 | |
| Dissecting Microscope | Leica | LeicaMZ75 | Any brand should work. |
| E. Coli OP50 | CGC | ||
| Ethanol | Koptec | 64-17-5 | |
| fog-2(q71) (JK574) | CGC | ||
| him-5(e1490)(CB4088) | CGC | ||
| Household bleach | Clorox Germicidal bleach concentrated | Bleach | |
| M9 buffer | Homemade solution | N/A | 3 g KH2PO4, 11.3 g Na2HPO4.7H2O, 5 g NaCl, H2O to 1 L. Sterilize by autoclaving. Add 1 mL 1 M MgSO4 after cool down to room temperature. |
| Magnesium Sulfate, Anhydrous, Powder | Macron | M1063-500GM-EA | |
| Microwave | TOSHIBA | N/A | Any brand should work. |
| N2 | CGC | ||
| NaOH | Sigma-aldrich | S318-3 | 1 M |
| NGM plates solution | Homemade solution | N/A | 2.5 g Peptone, 18 g agar, 3 g NaCl, H2O to 1 L.Sterilize by autoclaving. Once the autoclave is done (2 h), wait until the temperature of the medium drops to 65 °C. Put on a hotplate at 65 °C and stir. Then add the following, waiting 5 min between each to avoid crystallization: 1 mL CaCl2 (1 M), 1 mL MgSO4 (1 M), 25 mL K3PO4 (1 M, pH=6), 1 mL Cholesterol ( 5 mg/mL in ethanol). |
| Parafilm | Bemis | 13-374-10 | Bemis Parafilm M Laboratory Wrapping Film |
| Peptone | VWR | 97063-324 | |
| Pipet- aid | Drummond Scientific | 4-000-100 | Any brand should work. |
| Plastic paper | Octago | Waterproof Screen Printing Inkjet Transparency Film | https://www.amazon.com/Octago-Waterproof-Transparency-Printing-Printers/dp/B08HJQWFGD |
| Potassium chloride | Sigma-aldrich | SLBP2366V | |
| Potassium phosphate | Spectrum | 7778-77-0 | |
| Pipette | Eppendorf | SKU: EPPR4331; MFG#: 2231300006 | 20 - 200 µL, 100 - 1000 µL, any brand should work. |
| Rotator | Labnet | SKU: LI-H5500 | Labnet H5500 Mini LabRoller with Dual Direction Rotator. Any brand should work. |
| Sodium chloride | VWR | 7647-14-5 | |
| sodium phosphate dibasic | Sigma-aldrich | SLCG3888 | |
| Tris-base | Sigma-aldrich | 77-86-1 | |
| Tris-Cl | Roche | 1185-53-1 | |
| Tryptone | VWR | 97063-390 | |
| Vortex | Scientific industries | Vortex-Genie 2 | Any brand should work. |
| WormLab system | MBF Bioscience | N/A | https://www.mbfbioscience.com/help/WormLab/Content/home.htm; https://www.mbfbioscience.com/products/wormlab/ |
| Wormpicker | Homemade | N/A | made with platinum and glass pipet tips |
Referências
- Audesirk, T. E. Chemoreception in Alphysia californica. Iii. Evidence for pheromones influencing reproductive behavior. Behav Biol. 20 (2), 235-243 (1977).
- Traynor, K. S., Le Conte, Y., Page, R. E. Queen and young larval pheromones impact nursing and reproductive physiology of honey bee (Apis mellifera) workers. Behav Ecol Sociobiol. 68 (12), 2059-2073 (2014).
- Cowley, J. J., Wise, D. R. Pheromones, growth and behaviour. Ciba Found Study Group. 35, 144-170 (1970).
- Epple, G. Pheromones in primate reproduction and social behavior. Adv Behav Biol. 11, 131-155 (1974).
- Levinson, H. Z. Possibilities of using insectistatics and pheromones in pest control. Naturwissenschaften. 62 (6), 272-282 (1975).
- Roelofs, W. Manipulating sex pheromones for insect suppression. Environ Lett. 8 (1), 41-59 (1975).
- Marchlewska-Koj, A. Pheromones and mammalian reproduction. Oxf Rev Reprod Biol. 6, 266-302 (1984).
- Keverne, E. B. Neuroendocrinology briefings 11: Pheromones and reproduction. J Neuroendocrinol. 12 (11), 1045-1046 (2000).
- Rekwot, P. I., Ogwu, D., Oyedipe, E. O., Sekoni, V. O. The role of pheromones and biostimulation in animal reproduction. Anim Reprod Sci. 65 (3-4), 157-170 (2001).
- Gomez-Diaz, C., Benton, R. The joy of sex pheromones. EMBO reports. 14 (10), 874-883 (2013).
- Shorey, H. H., Gaston, L. K., Jefferson, R. N. Insect sex pheromones. Adv Pest Control Res. 8, 57-126 (1968).
- Bruce, H. M. Pheromones and behavior in mice. Acta Neurol Psychiatr Belg. 69 (7), 529-538 (1969).
- Shorey, H. H., Bartell, R. J. Role of a volatile female sex pheromone in stimulating male courtship behaviour in Drosophila melanogaster. Anim Behav. 18 (1), 159-164 (1970).
- Bobadoye, B., et al. Evidence of aggregation-sex pheromone use by longhorned beetles (coleoptera: Cerambycidae) species native to Africa. Environ Entomol. 48 (1), 189-192 (2019).
- Saunders, J. R. Sex pheromones in bacteria. Nature. 275 (5682), 692-694 (1978).
- Schulz, S., Toft, S. Identification of a sex pheromone from a spider. Science. 260 (5114), 1635-1637 (1993).
- Finnegan, D. E., Chambers, J. Identification of the sex pheromone of the guernsey carpet beetle, Anthrenussarnicus mroczkowski (coleoptera: Dermestidae). J Chem Ecol. 19 (5), 971-983 (1993).
- Vaillancourt, L. J., Raudaskoski, M., Specht, C. A., Raper, C. A. Multiple genes encoding pheromones and a pheromone receptor define the b beta 1 mating-type specificity in Schizophyllum commune. Genetics. 146 (2), 541-551 (1997).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook : the online review of C. elegans biology. , 1-22 (2013).
- Sakai, N., et al. A sexually conditioned switch of chemosensory behavior in C. elegans. PLoS One. 8 (7), e68676 (2013).
- Sengupta, S., Smith, D. P., Mucignat-Caretta, C. How Drosophila detect volatile pheromones: signaling, circuits, and behavior. Neurobiology of chemical communication. , (2014).
- Zhang, Y. K., Reilly, D. K., Yu, J., Srinivasan, J., Schroeder, F. C. Photoaffinity probes for nematode pheromone receptor identification. Org Biomol Chem. 18 (1), 36-40 (2019).
- Aprison, E. Z., Ruvinsky, I. Dynamic regulation of adult-specific functions of the nervous system by signaling from the reproductive system. Curr Biol. 29 (23), 4116-4123.e3 (2019).
- Wan, X., et al. SRD-1 in AWA neurons is the receptor for female volatile sex pheromones in C. elegans males. EMBO Rep. 20 (3), e46288 (2019).
- Peckol, E. L., Troemel, E. R., Bargmann, C. I. Sensory experience and sensory activity regulate chemosensory receptor gene expression in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 98 (20), 11032-11038 (2001).
- Jang, H., et al. Neuromodulatory state and sex specify alternative behaviors through antagonistic synaptic pathways in. C. elegans. Neuron. 75 (4), 585-592 (2012).
- Liu, K. S., Sternberg, P. W. Sensory regulation of male mating behavior in Caenorhabditis elegans. Neuron. 14 (1), 79-89 (1995).
- Chasnov, J. R., Chow, K. L. Why are there males in the hermaphroditic species Caenorhabditis elegans. Genetics. 160 (3), 983-994 (2002).
- Chasnov, J. R., So, W. K., Chan, C. M., Chow, K. L. The species, sex, and stage specificity of a Caenorhabditis sex pheromone. Proc Natl Acad Sci U S A. 104 (16), 6730-6735 (2007).
- Susoy, V., et al. Natural sensory context drives diverse brain-wide activity during C. elegans mating. Cell. 184 (20), 5122-5137.e17 (2021).
- Barriere, A., Felix, M. A. High local genetic diversity and low outcrossing rate in Caenorhabditis elegans natural populations. Curr Biol. 15 (13), 1176-1184 (2005).
- Click, A., Savaliya, C. H., Kienle, S., Herrmann, M., Pires-Dasilva, A. Natural variation of outcrossing in the hermaphroditic nematode Pristionchus pacificus. BMC Evol Biol. 9, 75 (2009).
- Anderson, J. L., Morran, L. T., Phillips, P. C. Outcrossing and the maintenance of males within C. elegans populations. J Hered. 101 (suppl_1), S62-S74 (2010).
- Leighton, D. H., Choe, A., Wu, S. Y., Sternberg, P. W. Communication between oocytes and somatic cells regulates volatile pheromone production in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 111 (50), 17905-17910 (2014).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Fagan, K. A., et al. A single-neuron chemosensory switch determines the valence of a sexually dimorphic sensory behavior. Curr Biol. 28 (6), 902-914.e5 (2018).
- Lipton, J., Kleemann, G., Ghosh, R., Lints, R., Emmons, S. W. Mate searching in Caenorhabditis elegans: A genetic model for sex drive in a simple invertebrate. J Neurosci. 24 (34), 7427-7434 (2004).
- Frady, E. P., Palmer, C. R., Kristan, W. B. Sexual attraction: Sex-specific wiring of neural circuitry. Curr Biol. 22 (22), R953-R956 (2012).
- Liu, Q., et al. Two preputial gland-secreted pheromones evoke sexually dimorphic neural pathways in the mouse vomeronasal system. Front Cell Neurosci. 13, 455 (2019).
- Ludewig, A. H., et al. Pheromone sensing regulates Caenorhabditis elegans lifespan and stress resistance via the deacetylase sir-2.1. Proc Natl Acad Sci U S A. 110 (14), 5522-5527 (2013).
- Golden, J. W., Riddle, D. L. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Butcher, R. A., Fujita, M., Schroeder, F. C., Clardy, J. Small-molecule pheromones that control dauer development in Caenorhabditis elegans. Nat Chem Biol. 3 (7), 420-422 (2007).
- Jeong, P. Y., et al. Chemical structure and biological activity of the Caenorhabditis elegans dauer-inducing pheromone. Nature. 433 (7025), 541-545 (2005).
- Butcher, R. A., Ragains, J. R., Kim, E., Clardy, J. A potent dauer pheromone component in Caenorhabditis elegans that acts synergistically with other components. Proc Natl Acad Sci U S A. 105 (38), 14288-14292 (2008).
- Aprison, E. Z., Ruvinsky, I. Counteracting ascarosides act through distinct neurons to determine the sexual identity of C. elegans pheromones. Curr Biol. 27 (17), 2589-2599.e3 (2017).
- Aprison, E. Z., Ruvinsky, I. Sex pheromones of C. elegans males prime the female reproductive system and ameliorate the effects of heat stress. PLoS Genet. 11 (12), e1005729 (2015).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Kaplan, F., et al. Ascaroside expression in Caenorhabditis elegans is strongly dependent on diet and developmental stage. PLoS One. 6 (3), e17804 (2011).
- Pungaliya, C., et al. A shortcut to identifying small molecule signals that regulate behavior and development in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 106 (19), 7708-7713 (2009).
- Srinivasan, J., et al. A modular library of small molecule signals regulates social behaviors in Caenorhabditis elegans. PLoS Biol. 10 (1), e1001237 (2012).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Choe, A., et al. Ascaroside signaling is widely conserved among nematodes. Curr Biol. 22 (9), 772-780 (2012).
- Von Reuss, S. H., et al. Comparative metabolomics reveals biogenesis of ascarosides, a modular library of small-molecule signals in C. elegans. J Am Chem Soc. 134 (3), 1817-1824 (2012).
- Choe, A., et al. Sex-specific mating pheromones in the nematode panagrellus redivivus. Proc Natl Acad Sci U S A. 109 (51), 20949-20954 (2012).
- Hsueh, Y. P., Mahanti, P., Schroeder, F. C., Sternberg, P. W. Nematode-trapping fungi eavesdrop on nematode pheromones. Curr Biol. 23 (1), 83-86 (2013).
- Hong, M., et al. Early pheromone experience modifies a synaptic activity to influence adult pheromone responses of C. elegans. Curr Biol. 27 (20), 3168-3177.e3 (2017).
- Ryu, L., et al. Feeding state regulates pheromone-mediated avoidance behavior via the insulin signaling pathway in Caenorhabditis elegans. EMBO J. 37 (15), e98402 (2018).
- Diaz, S. A., Lindström, J., Haydon, D. T. Basic demography of Caenorhabditis remanei cultured under standard laboratory conditions. J Nematol. 40 (3), 167 (2008).
- Bargmann, C. I. Chemosensation in C. elegans. WormBook : the online review of C.elegans biology. , 1-29 (2006).
- Margie, O., Palmer, C., Chin-Sang, I. C. elegans chemotaxis assay. JoVE: J Vis Exp. (74), e50069 (2013).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados