需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
秀丽隐杆线虫中的挥发性信息素提取和趋化试验
摘要
该协议建立了提取和量化对 秀丽隐杆线虫中挥发性信息素的反应的方法,为研究化学通讯和导航轨迹提供了工具。
摘要
化学通讯对于有机体健康、繁殖和整体福祉至关重要。了解控制这些信号的分子途径、神经过程和计算仍然是一个活跃的研究领域。线虫秀 丽隐杆 线虫为研究这些过程提供了一个强大的模型,因为它会产生挥发性的性信息素。这种信息素由处女雌性或精子耗尽的雌雄同体合成,可作为雄性的引诱剂。
该方案描述了从几种 秀丽隐杆线 虫菌株(WT 菌株 N2、 daf-22 和 fog-2)和 C. remanei 中分离挥发性信息素的详细方法。我们还提供了一种方案,用于量化雄性趋化性对挥发性信息素的反应。我们的分析利用趋化性指数 (CI)、到达时间 (AT) 和轨迹图等测量值来准确比较各种条件下的男性反应。这种方法允许在具有不同遗传背景或发育阶段的雄性之间进行稳健的比较。此外,此处概述的实验设置适用于研究其他化学引诱化学物质。
引言
化学通讯与繁殖成功之间的相互作用是整个动物王国的基本原则 1,2,3,4,5,6,7,8,9,10。性信息素触发了广泛的性二态性行为,这些行为对于寻找配偶、协调寻找和吸引伴侣所涉及的步骤以及最终促进物种的繁殖至关重要 11,12,13,14,15,16,17.在理解信息素信号传导方面已经取得了重大进展,但控制这些相互作用的分子机制、神经回路和计算过程往往仍未完全定义 18,19,20,21,22,23,24,25,26。
线虫秀丽隐杆线虫为剖析这些问题提供了一个强大的模型。值得注意的是,秀丽隐杆线虫表现出一种不寻常的繁殖策略——雌雄同体可以自我受精,但也可以与雄性杂交27、28、29、30、31、32、33。这种灵活性需要一个强大的通信系统来传达生殖状态。秀丽隐杆线虫以其特征明确的水溶性信息素蛔苷而闻名,它在发育、行为和社会互动中发挥着不同的作用。最近的发现揭示了线虫使用的一类独特的挥发性信息素。这些信息素由性成熟的秀丽隐杆线虫和 C. remanei 处女雌性以及精子耗尽的雌雄同体专门产生,可作为成年雄性的引诱剂 29,34,35。这种引诱物在其产生和感知中表现出显着的性二态性。雌性体细胞性腺控制这种挥发性信息素的合成,其产生动态地反映生殖状态,在交配时停止,并在几个小时后恢复29,34。
了解线虫性信息素通讯可以深入了解化学通讯系统的进化、生殖状态和行为之间的相互作用以及性二态神经加工的潜在机制 24,26,36,37,38,39.研究表明,雄性两栖神经元 AWA 对信息素检测至关重要,其中 G 蛋白偶联受体 SRD-1 在雄性信息素检测中起关键作用24。秀丽隐杆线虫非常适合研究动物化学通讯,尤其是性信息素信号,因为它依赖嗅觉系统进行配偶搜索。虽然对蛔蛔苷信号传导了解很多,但挥发性的性信息素系统提供了独特的比较机会 25,26,36,40,41,42,43,44,45,46,47,48,49,50、
51,52,53,54,55,56,57。此外,秀丽隐杆线虫是一种强大的遗传模式生物,因为它具有完全测序的基因组、明确定义的细胞谱系和特征明确的嗅觉突变体。
然而,处理这种信息素所涉及的完整神经回路、将其感知转化为靶向寻找配偶行为的计算以及它的生物合成调节仍有待完全阐明。对这些过程的进一步研究对于理解控制动物交流和繁殖行为的不同机制至关重要。鉴定参与信息素合成、分泌和感知的关键基因有望揭示动物交流中的新型分子参与者。此处描述的分析为解决这些问题提供了基础。
研究方案
1. 从女性和雌雄同体中提取粗性信息素
- 秀丽隐杆线虫同步协议
- 成年雌性或雌雄同体的准备
- 每天监测培养板,直到存在大量成年雌性/雌雄同体并且 OP50 食物来源耗尽。使用 fog-2 C. elegans 和 WT C. remanei 雌性进行粗制性信息素提取,从交配的雌性中制备同步卵。
注意:在本方案中,不产生自身精子的 秀丽隐杆线虫雾-2 突变体 XX 动物被称为 秀丽隐 杆线虫雌性。
- 每天监测培养板,直到存在大量成年雌性/雌雄同体并且 OP50 食物来源耗尽。使用 fog-2 C. elegans 和 WT C. remanei 雌性进行粗制性信息素提取,从交配的雌性中制备同步卵。
- 蠕虫清洗和造粒
- 用 M9 缓冲液从混合种群板上洗掉成虫。将蠕虫悬浮液收集到 1.5 mL 微量离心管中。以 1,500 × g 离心 0.5-1 分钟以沉淀蠕虫。
注意:重度污染的预清洁(可选):如果受到严重污染,让蠕虫沉淀在管中。吸出上清液以去除细菌并重复,直到上清液变得澄清。
- 用 M9 缓冲液从混合种群板上洗掉成虫。将蠕虫悬浮液收集到 1.5 mL 微量离心管中。以 1,500 × g 离心 0.5-1 分钟以沉淀蠕虫。
- 漂白
- 向蠕虫沉淀中加入 200 μL M9 缓冲液。通过将家用漂白剂和 1 M NaOH 以 1:1 的比例混合来制备裂解缓冲液。向混合物中加入 500 μL 这种裂解缓冲液,涡旋 10 秒,然后暂停以在解剖显微镜下监测裂解情况。重复此过程 10 秒漩涡,然后观察,直到成虫完全裂解。
- 停止漂白和沉淀胚胎
- 当成虫裂解成小片段(但未完全溶解)时,立即加入 500 μL M9 缓冲液以减慢反应速度。以 15,000 × g 离心 30-60 秒以沉淀胚胎。
注意:过度裂解会损坏胚胎。当成虫体分解成小碎片时停止反应。在离心和洗涤步骤中继续裂解,直到去除所有裂解缓冲液。
- 当成虫裂解成小片段(但未完全溶解)时,立即加入 500 μL M9 缓冲液以减慢反应速度。以 15,000 × g 离心 30-60 秒以沉淀胚胎。
- 用 1 mL M9 缓冲液洗涤胚胎 5 次,每次洗涤后以 15,000 × g 离心 30-60 秒。离心后去除上清液。
- 同步
- 在 1.5 mL 微量离心管中的 800 μL M9 缓冲液中重悬胚胎。由于没有食物供应,在 20 °C 下旋转试管 12-15 小时,以便在 L1 阶段进行 L1 孵化和蠕虫停止。释放蠕虫并在 20°C 下培养 3 天,直到它们达到 L4 阶段。
- 成年雌性或雌雄同体的准备
2. 从一日龄处女雌性中提取粗性信息素(图 1A)
注意:我们采用先前建立的方案24 从 C. elegans 的 1 日龄处女 fog-2(种系女性化)突变雌性和 C. remanei 的 WT 雌性中提取性信息素。
- 成年雌性的准备
- 在信息素提取前 1 天选择并分离大约 200 个 L4 阶段 雾-2 雌性。为确保仅收集处女雌性,请按性别仔细分离这些 L4 雾-2 雌性,并将它们分配到三个独立的 6 cm OP50 NGM 平板上。在每个板的中心放置少量 OP50 细菌。
注意:将 200 个 L4 雌性蠕虫分布在三个单独的板中,以避免意外将雄性蠕虫引入板的风险。如果采摘雄性,它很可能会与许多雌配,导致大多数雌性在第二天成年时受精。受精的雌性在精子耗尽之前不会释放挥发性的性信息素,这会影响提取结果。有限的食物来源将雌雄同体限制在板中心的较小区域,最大限度地减少了隔离期间从板中逃脱的机会。
- 在信息素提取前 1 天选择并分离大约 200 个 L4 阶段 雾-2 雌性。为确保仅收集处女雌性,请按性别仔细分离这些 L4 雾-2 雌性,并将它们分配到三个独立的 6 cm OP50 NGM 平板上。在每个板的中心放置少量 OP50 细菌。
- 提取过程
- 在提取日(生殖成熟的第 1 天,蠕虫从 L1 期停滞中释放后 3 天),挑选并分离 100 只处女、1 日龄的 fog-2 雌性放入含有 1 mL M9 缓冲液的微量离心管中。用 M9 缓冲液洗涤雌性 5 次,以尽量减少细菌污染,并在 20 °C 下在 100 μL M9 缓冲液中孵育 6 小时,以允许信息素在培养基中产生和积累。
- 对 C. remanei 雌性进行类似的提取过程,仅使用提取前一天分离的 15-20 L4 期雌性到三个板中,第二天,将 5 只处女雌性在 100 μL M9 缓冲液中在 25 °C( C. remanei 的最佳生长温度)下孵育 6 小时58。
注意:与秀丽隐杆线虫雌性相比,C. remanei 雌性产生更多的挥发性信息素。因此,只有 5 只雌性就足以提取 100 μL 的粗挥发性信息素。
- 存储
- 将样品以 15,000 × g 离心 30-60 秒以沉淀蠕虫。小心地将上清液(含有信息素)移液到干净的试管中,并丢弃含有蠕虫沉淀的试管。储存分离的上清液以用于后续的化学吸引测定。
注意:粗挥发性信息素提取物可在-80°C下在用封口膜包裹的微量离心管中储存至少1年,以尽量减少蒸发。
- 将样品以 15,000 × g 离心 30-60 秒以沉淀蠕虫。小心地将上清液(含有信息素)移液到干净的试管中,并丢弃含有蠕虫沉淀的试管。储存分离的上清液以用于后续的化学吸引测定。
- 质量管理
- 在使用提取物之前,使用 N2 雄性或 him-5 雄性进行质量控制测试,以验证其化学吸引力(参见第 4 节)。
3. 从 6 日龄处女雌雄同体中提取大量粗性信息素(图 1A)
- 蠕虫培养
- 为了获得大约 20 mL 的粗 秀丽隐杆线 虫性信息素,使用上述漂白方案同步 20 个含有健康成年 秀丽隐杆线 虫(N2 或 daf-22 突变体)蠕虫的 10 cm NGM 板,然后用 M9 缓冲液洗涤 5 次。
注意:此过程为信息素提取准备了足够的胚胎。N2:标准 WT C. elegans 菌株,可产生水溶性蛔虫苷信息素和非蛔虫苷挥发性信息素。 daf-22 突变体:一种缺乏产生许多蛔形苷信息素能力的突变体,这使得它们有助于单独研究非蛔形苷挥发性信息素。 - 为了在 L1 阶段同步蠕虫,将胚胎在 M9 缓冲液中旋转 12-15 小时以阻止发育。将被捕获的 L1 蠕虫转移到接种有 OP50 细菌的 10 cm NGM 培养板中,用于生长和发育。
- 为了尽量减少雌雄同体平板上雄性的存在,请在蠕虫释放后 2 天,在 L4 阶段检查板,并去除任何观察到的雄性(非常罕见)。
- 发育三天后,寻找胚胎的外观,表明蠕虫已经成为生殖成熟的成虫。
注意:秀丽隐杆线虫的fog-2 突变雌性和 C. remanei 的 WT 雌性不适合大量挥发性信息素提取。fog-2 突变体秀丽隐杆线虫和 C. remanei 在其种群中雄性比例很高,雄性不断与雌配。受精的雌性不会产生挥发性的性信息素。雄性的存在使这些化合物的提取变得复杂。
- 为了获得大约 20 mL 的粗 秀丽隐杆线 虫性信息素,使用上述漂白方案同步 20 个含有健康成年 秀丽隐杆线 虫(N2 或 daf-22 突变体)蠕虫的 10 cm NGM 板,然后用 M9 缓冲液洗涤 5 次。
- 蠕虫清洗和胚胎分离
- 用 M9 缓冲液反复洗涤胚胎,让它们沉淀(1 g 沉淀),直到大多数成虫位于管的底部;重复 5-7 次。让微量离心管在架子上不受干扰地沉淀几分钟,以促进成虫的沉淀,并使成虫种群与胚胎分离,胚胎仍然悬浮在上清液中。
- 移液分离的成虫并将它们转移到新的 OP50 种子 NGM 板中。
- 重复此洗涤过程 5-6 天以耗尽自身精子。
注意:为了提取挥发性信息素,请使用 5-6 天大的雌雄同体。这个时间确保他们的自身精子可能会耗尽,因为拥有可用自身精子的雌雄同体不会产生挥发性的性信息素。到第 5 天或第 6 天,平板上出现大量死亡或未孵化的胚胎表明开始信息素提取的合适时间。
- 性信息素提取
- 如第 1 节所述提取性信息素,并进行修改。
- 不要每 100 μL 添加 100 个 秀丽隐杆线 虫雌性秀丽隐杆线虫,而是根据最终蠕虫颗粒体积添加 M9 缓冲液。每 50 μL 填充蠕虫添加 1 mL M9 缓冲液。
- 质量控制和均质化
- 使用 N2 雄性或 Him-5 雄性的化学吸引测定法对提取的信息素进行质量控制测试批次(参见第 4 节)。
- 混合所有批次以产生均匀的粗挥发性信息素,用于需要大量信息素的实验,例如筛选或微流体实验。将粗的性信息素提取物在 -80 °C 下储存在 50 mL 管中,并用封口膜包裹,以尽量减少蒸发。
- 基于趋化试验的粗性信息素提取物标准化滴定方法
- 通过在 WT N2 和 him-5 雄性 秀丽隐杆线虫上测试每种信息素提取物的连续稀释来进行滴定测定。确定在对照菌株中始终引起稳健且可重现的趋化性反应的最高稀释度(最低浓度)。
- 在 M9 缓冲液中从每种粗提取物(例如,1:2、1:4、1:8 等)中制备一系列稀释液。
- 趋化性检测
- 在雄性参考菌株上使用每种稀释液进行标准化趋化性测定(参见第 4 节)。执行 3 次重复以确保重现性。比较不同提取批次的最佳稀释度,以评估信息素浓度的一致性。
注:这为评估每种提取物的生物活性建立了一个参考点。在标准性信息素趋化测定中,原始未稀释的提取物将用于后续实验,滴定作为质量控制步骤,以确保批次之间信息素活性一致。稀释系列可根据特定的实验需求进行调整。鉴于标准提取方案始终产生饱和粗信息素提取物,因此对于大多数实验来说,可能不需要进行滴定测试以标准化提取物。建议在一组相关实验中使用同一批次的粗制性信息素,以保持一致性并最大限度地减少信息素活性的可变性。
- 在雄性参考菌株上使用每种稀释液进行标准化趋化性测定(参见第 4 节)。执行 3 次重复以确保重现性。比较不同提取批次的最佳稀释度,以评估信息素浓度的一致性。
4. 挥发性信息素趋化试验
注意:挥发性信息素趋化测定已改编自其他趋化研究中使用的先前建立的方法 24,29,59,60,61。实施这些修改是为了优化检测对挥发性信息素反应的测定的灵敏度和特异性。这种量身定制的方法增强了检测对特定研究需求的适用性。
- 每天观察培养板,直到成年雌性/雌雄同体丰富。蠕虫的健康状况会影响它们对性信息素的反应。
- 他 5 只雄性的准备
- 利用标准漂白方案同步 him-5 蠕虫。同步后,用 M9 缓冲液洗涤蠕虫 5 次。在测定前一天分离 L4 雄性;然后,从其种子板中转移一日龄的成年雄性蠕虫,并在测定前用 M9 缓冲液冲洗它们。在测定前将它们放在未接种的 NGM 平板上,以消除残留细菌并防止测定过程中食物的干扰。
注意:检测前不要让蠕虫饿得超过一个小时,因为这会改变它们的内部状态并影响性信息素趋化检测的结果。因此,如果您打算在一天内进行 10 次以上的检测,请每小时更换一次蠕虫样品。此外,在一种实验测定和一种对照测定之间重复交替。
- 利用标准漂白方案同步 him-5 蠕虫。同步后,用 M9 缓冲液洗涤蠕虫 5 次。在测定前一天分离 L4 雄性;然后,从其种子板中转移一日龄的成年雄性蠕虫,并在测定前用 M9 缓冲液冲洗它们。在测定前将它们放在未接种的 NGM 平板上,以消除残留细菌并防止测定过程中食物的干扰。
- 趋化琼脂测定板的制备
- 如相关文献24 所述,用 1.5% 琼脂、25 mM NaCl、1.5 mM Tris-碱基和 3.5 mM Tris-Cl 制备趋化测定板。
- 使用微波炉加热化学吸引溶液中的琼脂,直至完全溶解。让溶液在室温下冷却 5 分钟。
- 使用移液器辅助工具将化学吸引琼脂溶液均匀分配到培养皿中:将 30 mL 倒入每个 10 cm 培养皿中,将 20 mL 倒入每个 6 cm 培养皿中。
- 将吸引化疗琼脂溶液倒入培养皿中后,将盖子在干净的区域打开至少 40 分钟,让琼脂表面略微干燥。表面适当干燥后,盖上盖子。
注意:此干燥时间可能因实验室环境的湿度和温度而异。
- 板储存和分析前准备
- 将制备好的检测板装箱并存放在冷藏室中长达 1 周。使用前,将板从冷藏中取出,让它们适应室温一个多小时。在检测前 20 分钟,打开盖子,让任何残留的水分从琼脂中蒸发,放在干净的区域,确保在进行检测之前表面没有明显的水。
- 实验设计和趋化试验
- 为了进行化学吸引测定,请在培养皿的盖子和下侧标记三个不同的点,或使用印在透明塑料纸上的模板,放置在培养皿下方或连接到解剖显微镜上。这些标记包括一个中间点 (•) 作为蠕虫的起点,一个加号 (+) 用于实验点(盖子上有 2 μL 性信息素,板上有 2 μL 1 M 叠氮化钠),以及一个减号 (-) 用于控制点(盖子上有 2 μL 的 M9 缓冲液和 2 μL 的 1 M 叠氮化钠)(图 2A)。根据培养皿的大小和特定的实验需要调整这些标记之间的距离。通常,对于 6 cm 培养皿,从阳性对照测试的起点到每个测试物质的固定距离为 1.5 cm。
- 执行检测的详细步骤(图 2)
- 将 2 μL 1 M 叠氮化钠添加到板上的每个实验点和对照点。
- 用蠕虫采摘器挑选 20 条健康且自由移动的雄性蠕虫。在解剖显微镜下在起点同时释放 20 条雄性蠕虫。
- 分别将 2 μL 性信息素和 2 μL M9 缓冲液快速加入盖子上的实验点和对照点。
- 轻轻盖上盖子,将检测板放在显微镜旁边安静、温度稳定的区域。
- 30 分钟后,通过计算每个点的蠕虫数量对测定进行评分。
注意:采摘 20 条蠕虫的过程不应超过 1-2 分钟,以防止早期采摘的蠕虫变干并变得不健康,从而影响结果。从挑选雄性到合上盖子的整个过程需要 2 到 5 分钟。
- 阳性对照筛选
- 用 1,000 倍稀释的双乙酰溶液(溶于 10% 乙醇和 90% M9 缓冲液)测试雄性蠕虫,以确认它们的趋化性反应性。开始测试后 30 分钟评估趋化试验的结果。根据它们的位置对在指定位置瘫痪的蠕虫进行评分:“C”代表控制点的蠕虫,“E”代表实验点的蠕虫。将蠕虫在两个位置上评分为 “N”(图 2C)。
- 要计算趋化指数 (C.I.),请使用以下公式:
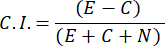
- 仅选择趋化指数≥ 0.4 的男性样品(CI,参见 图 2C)。使用同一批次的雄性进行后续的性信息素测试。
注:进行三次单独的测定,每次涉及 20 条蠕虫,以确保实验结果的一致性和可靠性。通常 3 次测定足以推断一致性。
5. 趋化试验的时间和评分指南
- 根据蠕虫的最终位置评估蠕虫的趋化反应。在测定结束时(通常在测定开始后 30 分钟)对每个点的蠕虫数量进行评分。
注:在实验和控制点使用叠氮化钠会麻痹到达的蠕虫,从而促进准确评分。大多数 WT N2 和 him-5 雄性能够在 6-8 分钟内在 6 cm 板中以 1.5 cm 的距离设置定位信息素源。 - 为了捕获趋化性效率的缺陷,特别是检测细微的缺陷,请考虑定期监测 3-5 分钟的测定。
注意:这种频繁的观察可以记录蠕虫到达测试点的时间。这种详细的跟踪可以揭示蠕虫表现出趋化性效率降低但仍设法到达检查窗口内测试点的情况。
6. 可选修改
- 为了加强趋化性的评估,请使用位于板上方的摄像头来记录蠕虫在整个检测过程中的轨迹。
注意:这种修改可以对它们的运动模式进行全面分析,从而更深入地了解化疗吸引行为和轨迹(图 3)。
7. 数据分析
- 趋化指数 (C.I.) 的评分和计算
- 按照步骤 4.7.1 和 4.7.2 进行操作。
- 到达时间图
- 为了更全面地分析趋化分析,请考虑每隔 3-5 分钟监测一次分析或使用位于板上方的摄像头来记录蠕虫在整个分析过程中的轨迹。
注意:这些方法不仅允许对蠕虫在设计点的到达时间进行评分,还可以比较平均到达时间并分析这些时间的分布。
- 为了更全面地分析趋化分析,请考虑每隔 3-5 分钟监测一次分析或使用位于板上方的摄像头来记录蠕虫在整个分析过程中的轨迹。
- 基于视频的轨迹分析和数据可视化
注:要分析 C. elegans 在化学吸引测定过程中,记录并提取轨迹(参见 材料表) 和进一步分析 (图 3).- 设置录制系统。
- 启动新的录制并访问 录制设置 窗口。
- 定义所需的录制参数:
- 文件前缀:为视频文件选择一个描述性名称(例如,“experiment1_”)。
- 帧速率 (FPS):选择适当的每秒帧数来捕捉蠕虫的运动(例如,琼脂板上的蠕虫为 7.5 FPS,游泳蠕虫为 30 FPS)。
- 持续时间:以秒为单位设置记录的长度(例如,批量化学吸引测定为 1,800 秒 [30 分钟])。
- 优化图像质量:调整照明强度以确保蠕虫在背景下清晰可见,并微调焦距以获得蠕虫的清晰图像。
- 要制备检测板,首先将对照溶液分配到指定的对照点上。然后,小心地拿起蠕虫并轻轻将它们释放到板的中心。蠕虫安定下来后,将性信息素溶液涂抹在指定的实验部位。
- 定位板:小心地将含有蠕虫的板放在记录区域的中心,以最大限度地扩大捕获区域。
- 为了减少趋化性测定过程中对蠕虫的压力,请考虑以下两种方法。
- 对于单蠕虫测定,将蠕虫放在测定板上并让它适应 5 分钟,然后在指定距离(基于蠕虫当前位置的位置)引入性信息素溶液。
注意:这最大限度地减少了处理,并为蠕虫提供了适应新环境的时间。 - 批量化学吸引测定:让蠕虫在板上自然沉淀并分散 5 分钟。在此驯化期之后,在指定的固定位置引入信息素溶液。在视频后分析期间,测量每条蠕虫与信息素的起始距离,并相应地对它们进行分组以进行进一步分析。
- 对于单蠕虫测定,将蠕虫放在测定板上并让它适应 5 分钟,然后在指定距离(基于蠕虫当前位置的位置)引入性信息素溶液。
- 视频分析程序
- 导入和设置:将录制的视频导入软件。配置序列信息(例如帧速率);指定成像比例 (每个测量单位的像素数)。
- 图像调整:要优化蠕虫检测,请调整 检测阈值 ,直到绿色标签紧密勾勒出蠕虫的轮廓,而不会捕获背景噪声或伪影。此外,应用背景平滑算法以减少图像中的杂色和不均匀性,从而增强蠕虫与背景之间的对比度。尝试不同的平滑级别,以找到降噪和保留蠕虫细节之间的最佳平衡。
注意:理想的阈值应覆盖每个蠕虫的大部分身体,同时排除无关的元素。 - 检测参数优化:选择具有代表性的蠕虫,自动生成检测参数。通过目视检查 5-10 个随机帧来验证检测准确性。如果检测结果不令人满意,请手动优化检测参数,根据需要重新访问图像调整设置,并在检测可靠后继续跟踪。
- 校对和修复跟踪轨迹:自动跟踪过程完成后,对生成的轨迹执行手动校对。如果在校对过程中发现不一致,请使用 repair 功能校正轨迹并执行以下操作: Join:连接被错误分配了不同标识符但属于同一个体的轨迹段。 Split:被错误地分配了相同标识符但属于不同个体的单独轨迹段。
注意: 目标是确保在整个跟踪周期内将每个唯一标识符(编号)一致地分配给同一个人。
示例:如果蠕虫在一段时间内被标记为“3”,然后在随后的一段时间内被错误地标记为“7”,则修复函数会将这两个段联接到标识符“3”下。相反,如果两个蠕虫在一段时间内都标记为 “12”,则修复函数会将此段拆分为两个单独的轨迹,每个轨迹都有一个唯一的标识符。通过仔细校对和进行必要的修复,可以显著提高跟踪数据的准确性和可靠性。 - 结果可视化和导出:利用软件进行可视化和基本分析。将数据导出为 CSV 文件,以便使用首选工具或代码进行进一步分析。该方法提供了一个基本代码(见 https://github.com/edmondztt/pheromone-traj-analysis.git),以根据五个关键参数可视化蠕虫运动轨迹(图 3)。 时间:轨迹的进程,用颜色编码表示自实验开始以来的时间流逝。 Distance to Pheromone:每个时间点蠕虫与信息素源的距离。 Speed:蠕虫在每个点的速度,这也指示转动和停止事件。 Straightness(直线度):蠕虫路径的直线程度。 方向正确性:蠕虫的运动与信息素目标方向的对齐程度如何?此代码为了解蠕虫行为提供了基础可视化效果,并且可以进行自定义和扩展以进行更深入的分析。
注意:这种先进的方法通过详细说明响应性信息素的蠕虫导航轨迹,为传统的化学吸引指数提供了一种全面的替代方案。它允许在不依赖导航和时间窗确定的任意终点的情况下理解运动模式,从而更深入地了解分析的行为动态。数据在 20 帧中取平均值,可以根据特定的实验需求进行调整,以过滤掉由身体扭曲引起的运动。
结果
化学吸引试验中挥发性信息素感知缺陷菌株的轨迹分析
这种化学吸引测定可靠地区分 了秀丽隐杆线虫 的野生型和突变型菌株对挥发性信息素的反应。对 him-5 雄性的成功实验始终表明对信息素来源的强强趋化性。这反映在高趋化指数 (C.I.)(图 2),通常超过 0.5,表明对信息素来源有强烈的偏好。相反,使用信息素受?...
讨论
该方案为从秀丽隐杆线虫中提取挥发性信息素提供了一种强大的方法,同时建立了一种强大的化学吸引测定法来测量雄性化学吸引反应。其他信息可在 WormLab 用户指南中找到(参见材料表);有关可视化蠕虫移动轨迹的基本代码,请参阅协议第 7.3.8.5 节。协议中的几个关键步骤对结果很重要。首先,蠕虫种群的仔细同步对于控制年龄和生殖状态至关重要...
披露声明
作者没有需要披露的利益冲突。
致谢
我们感谢 Tingtao 周 博士为我们分析中使用的轨迹可视化设计和编写代码。这项工作得到了资金支持:R01 NS113119 (PWS)、Chen 高级博士后奖学金以及 Tianqiao 和 Chrissy Chen 神经科学研究所。
材料
| Name | Company | Catalog Number | Comments |
| 10 cm Petri dishes | Falcon | 25373-100 | Falcon bacteriological Petri dish 100 x 15 mm |
| 6 cm Petri dishes | Falcon | 25373-085 | Falcon bacteriological Petri dish 60 x 15 mm |
| C. remanei (EM464) | CGC | ||
| Centrifuge | Eppendorf | centrifuge 5418 | Any brand should work. |
| Chemoattraction assay plates | Homemade solution | N/A | 1.5% agar, 25 mM NaCl, 1.5 mM Tris-base, and 3.5 mM Tris-Cl |
| Cholesterol | Alfa Aesar | 57-88-5 | |
| Dissecting Microscope | Leica | LeicaMZ75 | Any brand should work. |
| E. Coli OP50 | CGC | ||
| Ethanol | Koptec | 64-17-5 | |
| fog-2(q71) (JK574) | CGC | ||
| him-5(e1490)(CB4088) | CGC | ||
| Household bleach | Clorox Germicidal bleach concentrated | Bleach | |
| M9 buffer | Homemade solution | N/A | 3 g KH2PO4, 11.3 g Na2HPO4.7H2O, 5 g NaCl, H2O to 1 L. Sterilize by autoclaving. Add 1 mL 1 M MgSO4 after cool down to room temperature. |
| Magnesium Sulfate, Anhydrous, Powder | Macron | M1063-500GM-EA | |
| Microwave | TOSHIBA | N/A | Any brand should work. |
| N2 | CGC | ||
| NaOH | Sigma-aldrich | S318-3 | 1 M |
| NGM plates solution | Homemade solution | N/A | 2.5 g Peptone, 18 g agar, 3 g NaCl, H2O to 1 L.Sterilize by autoclaving. Once the autoclave is done (2 h), wait until the temperature of the medium drops to 65 °C. Put on a hotplate at 65 °C and stir. Then add the following, waiting 5 min between each to avoid crystallization: 1 mL CaCl2 (1 M), 1 mL MgSO4 (1 M), 25 mL K3PO4 (1 M, pH=6), 1 mL Cholesterol ( 5 mg/mL in ethanol). |
| Parafilm | Bemis | 13-374-10 | Bemis Parafilm M Laboratory Wrapping Film |
| Peptone | VWR | 97063-324 | |
| Pipet- aid | Drummond Scientific | 4-000-100 | Any brand should work. |
| Plastic paper | Octago | Waterproof Screen Printing Inkjet Transparency Film | https://www.amazon.com/Octago-Waterproof-Transparency-Printing-Printers/dp/B08HJQWFGD |
| Potassium chloride | Sigma-aldrich | SLBP2366V | |
| Potassium phosphate | Spectrum | 7778-77-0 | |
| Pipette | Eppendorf | SKU: EPPR4331; MFG#: 2231300006 | 20 - 200 µL, 100 - 1000 µL, any brand should work. |
| Rotator | Labnet | SKU: LI-H5500 | Labnet H5500 Mini LabRoller with Dual Direction Rotator. Any brand should work. |
| Sodium chloride | VWR | 7647-14-5 | |
| sodium phosphate dibasic | Sigma-aldrich | SLCG3888 | |
| Tris-base | Sigma-aldrich | 77-86-1 | |
| Tris-Cl | Roche | 1185-53-1 | |
| Tryptone | VWR | 97063-390 | |
| Vortex | Scientific industries | Vortex-Genie 2 | Any brand should work. |
| WormLab system | MBF Bioscience | N/A | https://www.mbfbioscience.com/help/WormLab/Content/home.htm; https://www.mbfbioscience.com/products/wormlab/ |
| Wormpicker | Homemade | N/A | made with platinum and glass pipet tips |
参考文献
- Audesirk, T. E. Chemoreception in Alphysia californica. Iii. Evidence for pheromones influencing reproductive behavior. Behav Biol. 20 (2), 235-243 (1977).
- Traynor, K. S., Le Conte, Y., Page, R. E. Queen and young larval pheromones impact nursing and reproductive physiology of honey bee (Apis mellifera) workers. Behav Ecol Sociobiol. 68 (12), 2059-2073 (2014).
- Cowley, J. J., Wise, D. R. Pheromones, growth and behaviour. Ciba Found Study Group. 35, 144-170 (1970).
- Epple, G. Pheromones in primate reproduction and social behavior. Adv Behav Biol. 11, 131-155 (1974).
- Levinson, H. Z. Possibilities of using insectistatics and pheromones in pest control. Naturwissenschaften. 62 (6), 272-282 (1975).
- Roelofs, W. Manipulating sex pheromones for insect suppression. Environ Lett. 8 (1), 41-59 (1975).
- Marchlewska-Koj, A. Pheromones and mammalian reproduction. Oxf Rev Reprod Biol. 6, 266-302 (1984).
- Keverne, E. B. Neuroendocrinology briefings 11: Pheromones and reproduction. J Neuroendocrinol. 12 (11), 1045-1046 (2000).
- Rekwot, P. I., Ogwu, D., Oyedipe, E. O., Sekoni, V. O. The role of pheromones and biostimulation in animal reproduction. Anim Reprod Sci. 65 (3-4), 157-170 (2001).
- Gomez-Diaz, C., Benton, R. The joy of sex pheromones. EMBO reports. 14 (10), 874-883 (2013).
- Shorey, H. H., Gaston, L. K., Jefferson, R. N. Insect sex pheromones. Adv Pest Control Res. 8, 57-126 (1968).
- Bruce, H. M. Pheromones and behavior in mice. Acta Neurol Psychiatr Belg. 69 (7), 529-538 (1969).
- Shorey, H. H., Bartell, R. J. Role of a volatile female sex pheromone in stimulating male courtship behaviour in Drosophila melanogaster. Anim Behav. 18 (1), 159-164 (1970).
- Bobadoye, B., et al. Evidence of aggregation-sex pheromone use by longhorned beetles (coleoptera: Cerambycidae) species native to Africa. Environ Entomol. 48 (1), 189-192 (2019).
- Saunders, J. R. Sex pheromones in bacteria. Nature. 275 (5682), 692-694 (1978).
- Schulz, S., Toft, S. Identification of a sex pheromone from a spider. Science. 260 (5114), 1635-1637 (1993).
- Finnegan, D. E., Chambers, J. Identification of the sex pheromone of the guernsey carpet beetle, Anthrenussarnicus mroczkowski (coleoptera: Dermestidae). J Chem Ecol. 19 (5), 971-983 (1993).
- Vaillancourt, L. J., Raudaskoski, M., Specht, C. A., Raper, C. A. Multiple genes encoding pheromones and a pheromone receptor define the b beta 1 mating-type specificity in Schizophyllum commune. Genetics. 146 (2), 541-551 (1997).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook : the online review of C. elegans biology. , 1-22 (2013).
- Sakai, N., et al. A sexually conditioned switch of chemosensory behavior in C. elegans. PLoS One. 8 (7), e68676 (2013).
- Sengupta, S., Smith, D. P., Mucignat-Caretta, C. How Drosophila detect volatile pheromones: signaling, circuits, and behavior. Neurobiology of chemical communication. , (2014).
- Zhang, Y. K., Reilly, D. K., Yu, J., Srinivasan, J., Schroeder, F. C. Photoaffinity probes for nematode pheromone receptor identification. Org Biomol Chem. 18 (1), 36-40 (2019).
- Aprison, E. Z., Ruvinsky, I. Dynamic regulation of adult-specific functions of the nervous system by signaling from the reproductive system. Curr Biol. 29 (23), 4116-4123.e3 (2019).
- Wan, X., et al. SRD-1 in AWA neurons is the receptor for female volatile sex pheromones in C. elegans males. EMBO Rep. 20 (3), e46288 (2019).
- Peckol, E. L., Troemel, E. R., Bargmann, C. I. Sensory experience and sensory activity regulate chemosensory receptor gene expression in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 98 (20), 11032-11038 (2001).
- Jang, H., et al. Neuromodulatory state and sex specify alternative behaviors through antagonistic synaptic pathways in. C. elegans. Neuron. 75 (4), 585-592 (2012).
- Liu, K. S., Sternberg, P. W. Sensory regulation of male mating behavior in Caenorhabditis elegans. Neuron. 14 (1), 79-89 (1995).
- Chasnov, J. R., Chow, K. L. Why are there males in the hermaphroditic species Caenorhabditis elegans. Genetics. 160 (3), 983-994 (2002).
- Chasnov, J. R., So, W. K., Chan, C. M., Chow, K. L. The species, sex, and stage specificity of a Caenorhabditis sex pheromone. Proc Natl Acad Sci U S A. 104 (16), 6730-6735 (2007).
- Susoy, V., et al. Natural sensory context drives diverse brain-wide activity during C. elegans mating. Cell. 184 (20), 5122-5137.e17 (2021).
- Barriere, A., Felix, M. A. High local genetic diversity and low outcrossing rate in Caenorhabditis elegans natural populations. Curr Biol. 15 (13), 1176-1184 (2005).
- Click, A., Savaliya, C. H., Kienle, S., Herrmann, M., Pires-Dasilva, A. Natural variation of outcrossing in the hermaphroditic nematode Pristionchus pacificus. BMC Evol Biol. 9, 75 (2009).
- Anderson, J. L., Morran, L. T., Phillips, P. C. Outcrossing and the maintenance of males within C. elegans populations. J Hered. 101 (suppl_1), S62-S74 (2010).
- Leighton, D. H., Choe, A., Wu, S. Y., Sternberg, P. W. Communication between oocytes and somatic cells regulates volatile pheromone production in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 111 (50), 17905-17910 (2014).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Fagan, K. A., et al. A single-neuron chemosensory switch determines the valence of a sexually dimorphic sensory behavior. Curr Biol. 28 (6), 902-914.e5 (2018).
- Lipton, J., Kleemann, G., Ghosh, R., Lints, R., Emmons, S. W. Mate searching in Caenorhabditis elegans: A genetic model for sex drive in a simple invertebrate. J Neurosci. 24 (34), 7427-7434 (2004).
- Frady, E. P., Palmer, C. R., Kristan, W. B. Sexual attraction: Sex-specific wiring of neural circuitry. Curr Biol. 22 (22), R953-R956 (2012).
- Liu, Q., et al. Two preputial gland-secreted pheromones evoke sexually dimorphic neural pathways in the mouse vomeronasal system. Front Cell Neurosci. 13, 455 (2019).
- Ludewig, A. H., et al. Pheromone sensing regulates Caenorhabditis elegans lifespan and stress resistance via the deacetylase sir-2.1. Proc Natl Acad Sci U S A. 110 (14), 5522-5527 (2013).
- Golden, J. W., Riddle, D. L. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Butcher, R. A., Fujita, M., Schroeder, F. C., Clardy, J. Small-molecule pheromones that control dauer development in Caenorhabditis elegans. Nat Chem Biol. 3 (7), 420-422 (2007).
- Jeong, P. Y., et al. Chemical structure and biological activity of the Caenorhabditis elegans dauer-inducing pheromone. Nature. 433 (7025), 541-545 (2005).
- Butcher, R. A., Ragains, J. R., Kim, E., Clardy, J. A potent dauer pheromone component in Caenorhabditis elegans that acts synergistically with other components. Proc Natl Acad Sci U S A. 105 (38), 14288-14292 (2008).
- Aprison, E. Z., Ruvinsky, I. Counteracting ascarosides act through distinct neurons to determine the sexual identity of C. elegans pheromones. Curr Biol. 27 (17), 2589-2599.e3 (2017).
- Aprison, E. Z., Ruvinsky, I. Sex pheromones of C. elegans males prime the female reproductive system and ameliorate the effects of heat stress. PLoS Genet. 11 (12), e1005729 (2015).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Kaplan, F., et al. Ascaroside expression in Caenorhabditis elegans is strongly dependent on diet and developmental stage. PLoS One. 6 (3), e17804 (2011).
- Pungaliya, C., et al. A shortcut to identifying small molecule signals that regulate behavior and development in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 106 (19), 7708-7713 (2009).
- Srinivasan, J., et al. A modular library of small molecule signals regulates social behaviors in Caenorhabditis elegans. PLoS Biol. 10 (1), e1001237 (2012).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Choe, A., et al. Ascaroside signaling is widely conserved among nematodes. Curr Biol. 22 (9), 772-780 (2012).
- Von Reuss, S. H., et al. Comparative metabolomics reveals biogenesis of ascarosides, a modular library of small-molecule signals in C. elegans. J Am Chem Soc. 134 (3), 1817-1824 (2012).
- Choe, A., et al. Sex-specific mating pheromones in the nematode panagrellus redivivus. Proc Natl Acad Sci U S A. 109 (51), 20949-20954 (2012).
- Hsueh, Y. P., Mahanti, P., Schroeder, F. C., Sternberg, P. W. Nematode-trapping fungi eavesdrop on nematode pheromones. Curr Biol. 23 (1), 83-86 (2013).
- Hong, M., et al. Early pheromone experience modifies a synaptic activity to influence adult pheromone responses of C. elegans. Curr Biol. 27 (20), 3168-3177.e3 (2017).
- Ryu, L., et al. Feeding state regulates pheromone-mediated avoidance behavior via the insulin signaling pathway in Caenorhabditis elegans. EMBO J. 37 (15), e98402 (2018).
- Diaz, S. A., Lindström, J., Haydon, D. T. Basic demography of Caenorhabditis remanei cultured under standard laboratory conditions. J Nematol. 40 (3), 167 (2008).
- Bargmann, C. I. Chemosensation in C. elegans. WormBook : the online review of C.elegans biology. , 1-29 (2006).
- Margie, O., Palmer, C., Chin-Sang, I. C. elegans chemotaxis assay. JoVE: J Vis Exp. (74), e50069 (2013).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。