Method Article
غشاء القاعدة الليفي النانوي المصنوع من حرير العنكبوت الوظيفي المؤتلف في إدراج ثقافة الأنسجة حسب الطلب
In This Article
Summary
تعتبر إدخالات زراعة الأنسجة ذات الأغشية البلاستيكية هي المعيار الذهبي في مختبرات زراعة الخلايا كدعامات قابلة للاختراق لإنشاء طبقات الخلايا ونماذج الأنسجة الحاجزة. هنا ، نقدم طريقة بسيطة لاستبدال الغشاء البلاستيكي بغشاء أكثر صلة بيولوجيا مصنوع من بروتين حرير العنكبوت الوظيفي المؤتلف.
Abstract
يعد تكرار حواجز الأنسجة أمرا بالغ الأهمية لإنشاء نماذج مختبرية ذات صلة لتقييم العلاجات الجديدة. اليوم ، يتم ذلك بشكل شائع باستخدام إدخالات زراعة الأنسجة بغشاء بلاستيكي ، والذي يولد جانبا قميا وقاعديا. إلى جانب توفير الدعم للخلايا ، تأتي هذه الأغشية بعيدا عن محاكاة نظيرتها الأصلية ، الغشاء القاعدي ، وهو عبارة عن مصفوفة أليفية نانوية قائمة على البروتين. في هذا العمل ، نعرض طريقة بسيطة لتحسين الأهمية البيولوجية لإدخالات زراعة الأنسجة بشكل كبير عن طريق استبدال الغشاء البلاستيكي بغشاء مصنوع من بروتين حرير العنكبوت الوظيفي المؤتلف النقي. يتشكل غشاء الحرير من خلال التجميع الذاتي ويلتصق تلقائيا بإدخال ثقافة الأنسجة الخالية من الأغشية ، حيث يمكن أن يوفر الدعم للخلايا. يمكن طباعة إدخالات زراعة الأنسجة المصممة خصيصا باستخدام طابعة ثلاثية الأبعاد قياسية ، باتباع التعليمات الواردة في البروتوكول ، أو يمكن شراء الطابعات التجارية واستخدامها بدلا من ذلك. يوضح هذا البروتوكول كيفية إعداد نظام الاستزراع مع أغشية الحرير في الإدخالات ، وبالتالي ، كيف يمكن تنفيذ نفس تقنيات زراعة الخلايا المستخدمة مع الإدخالات التقليدية المتاحة تجاريا.
Introduction
حظيت النماذج المختبرية التي يمكنها تكرار حواجز الأنسجة باهتمام متزايد نظرا لقابليتها للتطبيق في اختبار العلاجات الجديدة وتسهيل فهم آليات المرض الأساسية1،2. لإعادة إنشاء البيئة المكروية الأصلية بدقة ، من الأهمية بمكان تلخيص وظيفة الغشاء القاعدي (BM) ، وهو مجمع مصفوفة خارج الخلية عالي التخصص (ECM). يوجد BM في كل نسيج تقريبا في جسم الإنسان ، حيث يوفر الدعم للخلايا البطانية والظهارية ويفصلها عن الأنسجة الأساسية2،3. بالإضافة إلى توفير الدعم المادي ، ينظم BM أيضا ويحافظ على الإشارات الكيميائية الحيوية بين الخلايا والأنسجة المحيطة. هذه الوظائف الحيوية تجعل من الضروري تصميم سقالات تشبه الهيكل ، بالإضافة إلى الخصائص الميكانيكية والوظيفية ل BM3 الأصلي.
واحدة من أكثر الطرق شيوعا لتقليد BM في المختبر اليوم هي من خلال استخدام إدخالات زراعة الأنسجة المتاحة تجاريا (TC-inserts). هذه هي في الأساس أسطوانات بلاستيكية ذات غشاء قابل للاختراق يقسم الغرفة إلى جانبين قمي وسطحي4،5. على الرغم من سهولة الاستخدام ، إلا أن الأغشية الموجودة في الإدخالات التجارية تكون صلبة بشكل عام ، محفورة بالمسار ، ومصنوعة من بوليمرات مثل البولي (كربونات) (PC) وبولي (إيثيلين تيريفثاليت) (PET) 3،4،6. إنها مرنة من حيث القطر وكثافة المسام والحجم ويمكن طلاءها لتعزيز التصاق الخلية ولكنها تفتقر إلى جميع الميزات الأخرى ذات الصلة ب BM ، مثل السماكةالمماثلة 6 ، والمسامية المترابطة ، والهندسة الليفية ، ومعامل المرونة3 ذي الصلة.
ألهم توحيد إدخالات TC وسهولة استخدامها العديد من المجموعات ، بما في ذلك مجموعتنا ، لاستبدال الغشاء البلاستيكي بنظير يشبه الجسم الحي (تم الاطلاع عليه في الجدول 1). تتراوح المواد المستخدمة من البوليمرات مثل Polydimethylsiloxane (PDMS) 7 و Poly (lactide-co-caprolactone) (PLCL) 8 و polycaprolactone (PCL) 4،9،10 إلى المواد القائمة على البروتين مثل الجيلاتين 2،11،12 ، والكولاجين5،13 ، والحرير العنكبوتي المؤتلف14،15،16،17. تم ربط الأغشية من هذه المواد بطرق مختلفة ، سواء إلى الإدخالات المتاحة تجاريا والتي تمت إزالة الغشاء منها4،7،8،10،12،13،14،16،18،19،20،21، وكذلك إلى الإدخالات المصممة خصيصا المصنعة من خلال الطباعة ثلاثية الأبعاد1،11،15،17،20 أو قولبة الحقن9،22. ومع ذلك ، لا يزال معظمها بعيدا عن التشابه مع BM الأصلي من حيث السماكة ، حيث تتراوح النسخ المتماثلة من مئات11،18 إلى بضعة ميكرومترات5،10،14،21،22. يتطلب العديد منها أيضا التكوين المعقد و / أو طرق التثبيتاليدوي 1،7،13،14،18،19،21 ، مما يجعل التحجيم والنسخ المتماثل في المختبرات الأخرى أمرا صعبا.
هنا ، نقدم طريقة بسيطة لتشكيل غشاء حريري وإرفاقه بالإدخالات ونوضح كيفية زراعة الخلايا على جانبي الغشاء. تتشكل أغشية الحرير من خلال التجميع الذاتي لبروتين FN-4RepCT (FN-silk) في واجهة الهواء السائل لمحلول دائم16،17. حرير FN هو نسخة قصيرة منتجة بشكل مؤتلف من Major Ampullulate Spidroin 1 من Euprosthenops australis ، تعمل بزخارف RGD مشتقة من الفيبرونيكتين23. لقد ثبت أنه يتجمع في مصفوفات ليفية تعزز التصاق الخلايا ونموها وهجرتها15،16،17،23،24،25. تعتمد طريقة ربط الغشاء على الإدخال على الالتصاق التلقائي وقد وجد أنها مناسبة للإدخالات المتاحة تجاريا والتي تمت إزالة الغشاءمنها 16 ، بالإضافة إلى إدخالات مطبوعة ثلاثية الأبعاد من حمض اللاكتيك (PLA) 17 و Dental LT15. توضح هذه الورقة بالتفصيل كيفية استخدام هذه الطريقة للإدخالات المطبوعة من Dental LT. بعد ربط أغشية الحرير FN بالإدخالات ، يمكن ، في جوهرها ، التعامل معها مثل إدخالات زراعة الأنسجة التجارية القياسية. باختصار ، نقدم طريقة بسيطة لتوليد نماذج أكثر صلة في المختبر لحواجز الأنسجة عن طريق استبدال الأغشية البلاستيكية بغشاء حرير FN قائم على البروتين.
Protocol
1. 3D الطباعة من الإدخالات
- قم بتنزيل ملف . ملف تصميم STL (JoVe_Silk_Insert.stl) من الملف التكميلي 1.
- قم بإعداد الملفات للطباعة عن طريق فتحها في حزمة البرامج المخصصة لتحويل ملف . STL إلى ملف طباعة للطابعة ثلاثية الأبعاد المستخدمة.
- استخدم البرنامج المخصص لإضافة الدعامات. تم تصميم الهيكل الداعم بواسطة البرنامج ، وسيعتمد المبلغ المطلوب على الطابعة والبرنامج المستخدم. قم بتوجيه الملحق بحيث لا تلمس منصة المبنى ولا الدعامات الجزء السفلي.
- اطبع العدد المطلوب من الإدخالات باستخدام راتينج متوافق حيويا (مثل Dental LT أو BioMed) أو خيوط (مثل PLA) مناسبة للطابعة ثلاثية الأبعاد المستخدمة.
ملاحظة: تأكد من أن المادة يمكنها تحمل عملية التعقيم المناسبة مثل التعقيم أو التشعيع أو غمر الإيثانول. - افصل الإدخالات المطبوعة عن منصة الطباعة وقم بإزالة الهيكل الداعم المطبوع من الجزء النهائي.
- إذا كنت تستخدم طابعة من الراتنج، فقم بمعالجة الإدخالات باستخدام البروتوكول القياسي الذي توفره الشركة المصنعة.
ملاحظة: قد تختلف المعالجة اعتمادا على الراتنج المستخدم. يتم توفير البروتوكول المستخدم للراتنج المستخدم هنا في الملف التكميلي 2. - تعقيم الإدخالات باستخدام تقنية مناسبة للمواد التي تختارها.
ملاحظة: التوصيات هي التعقيم أو التشعيع أو الغمر في 70٪ من الإيثانول ، أو مزيج منهما. في حالة استخدام طابعة الراتنج ، قد تكون هناك حاجة إلى بروتوكول ترشيح شامل لتحقيق التوافق الحيوي الأمثل. راجع البروتوكول الوارد في الملف التكميلي 2 للحصول على توصية. - تأكد من أن الحشوات جافة تماما وقم بتخزينها معقمة حتى الاستخدام.
2. تشكيل أغشية الحرير FN
- املأ صندوقا بالثلج الجاف وأحضره إلى الفريزر -80 درجة مئوية.
- اجمع قوارير الحرير FN من الفريزر -80 درجة مئوية وضعها في الثلج الجاف للنقل. أحضر قوارير الحرير FN إلى خزانة السلامة البيولوجية وقم بتنفيذ المزيد من الخطوات هناك. ضع قوارير FN-silk في رف أنبوب الطرد المركزي الدقيق لإذابة الجليد دون لمسها بشكل مفرط.
- أثناء ذوبان حرير FN ، قم بفك اللوحة المكونة من 48 بئرا. بمجرد ذوبان حرير الجبهة الوطنية تماما ، انتقل إلى الخطوة التالية في غضون 10 دقائق ، ويفضل أن يكون ذلك في أقرب وقت.
- قم بتخفيف محلول FN-silk في PBS المبرد أو بدرجة حرارة الغرفة إلى التركيز المطلوب ، ويفضل 1.8 مجم / مل. ماصة 550 ميكرولتر من محلول الحرير FN مباشرة في قاع بئر فارغ في الصفيحة المكونة من 48 بئرا. ماصة محلول FN-silk حتى يتم تحضير العدد المطلوب من الأغشية.
ملاحظة: تجنب إدخال فقاعات الهواء وإزالة أي فقاعات هواء على الفور باستخدام ماصة. لا تستخدم الآبار في الصف A أو F أو العمود 1 أو 8 ، ولا الآبار المجاورة (انظر التخطيطي في الشكل التكميلي S1). - ضع الغطاء على اللوحة المكونة من 48 بئرا وضعها داخل صندوق أكبر ومعقم لتوفير بيئة معقمة أثناء الحضانة.
- حرك الصندوق بعناية من خزانة السلامة البيولوجية واتركه في الظروف المحيطة في مكان غير مضطرب دون تدفق هواء كبير طوال الليل.
3. التمسك بأغشية الحرير FN للإدراج
- في اليوم التالي ، أحضر الإدخالات المعقمة إلى خزانة السلامة البيولوجية.
- أعد الصندوق المعقم الكبير الذي يحتوي على الصفيحة المكونة من 48 بئرا مع أغشية الحرير FN إلى خزانة السلامة البيولوجية وقم بتنفيذ المزيد من الخطوات هناك. ارفع اللوحة المكونة من 48 بئرا بحذر من الصندوق المعقم الكبير.
- تحقق بصريا من تكوين الغشاء من خلال ملاحظة الغيوم في الآبار وفتح غطاء الصفيحة المكونة من 48 بئرا التي تحتوي على الأغشية. التقط حشوة واحدة باستخدام ملاقط معقمة وقم بتوجيه الملحق لأسفل على الغشاء حتى تلمس مقابض الإدخال الجزء العلوي من البئر كما هو موضح في الشكل 1. احتفظ بالجزء السفلي من الملحق موازيا لأسفل اللوحة.
- كرر الخطوة 3.3 حتى يتم إنزال الإدخالات على جميع الأغشية المتشكلة. ضع الغطاء فوق اللوحة المكونة من 48 بئرا ثم أعد الطبق إلى الصندوق المعقم. اترك اللوحة دون إزعاج لمدة 2 ساعة في الظروف المحيطة للسماح للأغشية بالالتصاق بالإدخالات.
- قم بتسخين وسط النمو أو PBS عند 37 درجة مئوية.
- قم بتفريغ طبق 24 بئر.
- بمجرد مرور ساعتين ، قم بإزالة اللوحة المكونة من 48 بئرا من الصندوق وافتح الغطاء. باستخدام ملاقط معقمة ، أمسك حشوة من مقابضها وارفعها من اللوحة المكونة من 48 بئرا.
- مباشرة بعد الرفع ، املأ الملحق بوسط ثقافة مسخن مسبقا أو PBS. استخدم 100 ميكرولتر من وسط الاستزراع إذا كنت تمضي قدما في البذر الجانبي القاعدي أو 200 ميكرولتر إذا كنت تمضي قدما في البذر الجانبي القمي. إذا كان سيتم تخزين الأغشية لاستخدامها لاحقا ، فاستخدم 200 ميكرولتر من PBS بدلا من ذلك.
نقطة تفتيش: إذا تم الاحتفاظ بالسائل فوق الغشاء ، فقد نجح الرفع. إذا كان السائل يقطر على المقعد ، يتسرب الغشاء ويجب تجاهله. - ضع الملحق في بئر فارغ من اللوحة المكونة من 24 بئرا.
- ارفع جميع الإدخالات من اللوحة المكونة من 48 بئرا وانقلها إلى اللوحة المكونة من 24 بئرا. املأ الآبار ب 1,000 ميكرولتر من وسط النمو إذا كنت تمضي قدما في بذر الخلايا أو PBS للتخزين مع الحفاظ على اللوحة مائلة قليلا.
ملاحظة: من المهم أن تكون حافة الغشاء أقل من مستوى السائل (الشكل 2). - إذا كان سيتم زرع الخلايا على الفور ، فانتقل إلى القسم 4 أو 5 اعتمادا على جانب الغشاء الذي سيتم زرع الخلايا فيه. إذا لم يكن الأمر كذلك ، ضع الغطاء على الطبق المكون من 24 بئرا وضعه إما في الثلاجة (4 درجات مئوية) أو في حاضنة 37 درجة مئوية. إذا تم وضعها في الحاضنة ، فقم بتجديد PBS كل يومين لضمان الحفاظ على الحجم المطلوب.
4. بذر الخلايا على الجانب القمي من الغشاء
ملاحظة: إذا تم تخزين الأغشية في PBS ، فاستبدل PBS بوسط استزراع مسخن مسبقا كما هو موضح في القسم 6.
- حصاد الخلايا. قم بإعداد تعليق الخلية بحيث يكون العدد المطلوب من الخلايا لكل غشاء موجودا في 20-50 ميكرولتر من المعلق. أعد التعليق لتحقيق تركيز الخلية المطلوب.
- باستخدام ماصة P100 أو P200 ، قم بشفط 20-50 ميكرولتر من تعليق الخلية. مع توجيه طرف الماصة نحو مركز الغشاء، احتفظ بالطرف بعيدا بمقدار 1-2 مم عن سطح وسط المزرعة داخل الملحق واضغط ببطء على مكبس الماصة لإنشاء قطرة على حافة الحافة. اجعل القطرة ملامسة لوسط الثقافة داخل الملحق.
ملاحظة: حافظ على الماصة عموديا على سطح العمل. - كرر الخطوة 4.2 للأغشية المتبقية. أعد تعليق مخزون الخلية بعد بذر خمسة أغشية لضمان توزيع الخلايا المتجانس. حرك اللوحة بنمط الشكل ثمانية لضمان توزيع أفضل للخلايا على الغشاء.
- استزراع في ظروف قياسية (37 درجة مئوية و 5٪ ثاني أكسيد الكربون) وتغيير الوسط كل يومين.
5. بذر الخلايا على الجانب القاعدي من الغشاء
ملاحظة: إذا تم تخزين الأغشية في PBS ، فاستبدل PBS ب 100 ميكرولتر من وسط النمو الدافئ مسبقا واملأ الآبار ب 1 مل من وسط النمو الدافئ مسبقا كما هو موضح في القسم 6.
- حصاد الخلايا وإعداد معلق الخلية بحيث يكون العدد المطلوب من الخلايا لكل غشاء موجودا في 20 ميكرولتر من المعلق. أعد التعليق لتحقيق تركيز الخلية المطلوب.
- قم بفك وفتح غطاء طبق بتري. تأكد من أن ارتفاع طبق بتري كاف لاستيعاب الإدخالات دون أن تلمس قيعانها الغطاء.
- باستخدام الملقط ، ارفع الملحق من اللوحة المكونة من 24 بئرا ، واترك وسط الاستزراع في الآبار. باستخدام مجموعة من الملقط في كل يد ، اقلب الملحق بحيث يكون الجانب القاعدي متجها لأعلى ، ويواجه الجانب القمي منطقة العمل. ضع الملحق المقلوب في طبق بتري كما في الشكل 3 ج. كرر مع الإدخالات المتبقية.
ملاحظة: لا تقم بإزالة وسط الثقافة على الجانب القمي. سيبقي الغشاء رطبا أثناء الحضانة. - أعد تعليق مخزون الخلية لضمان التوزيع المتساوي للخلايا في المحلول، واستنشق 20 ميكرولتر من تعليق الخلية باستخدام ماصة P100 أو P200. قم بتوجيه طرف الماصة باتجاه مركز الغشاء ، واحتفظ بالطرف بعيدا عن الغشاء واضغط ببطء على مكبس الماصة لإنشاء قطرة عند حافة الحافة. حافظ على الماصة عموديا على سطح الغشاء واترك القطرة تسقط على الغشاء. كرر مع الأغشية المتبقية.
ملاحظة: أعد تعليق مخزون الخلية بعد بذر خمسة أغشية لضمان توزيع الخلايا بشكل متساو. - ضع الغطاء على طبق بتري ، وأحضر طبق بتري واللوحة المكونة من 24 بئرا إلى الحاضنة ، واحتضن الإدخالات مع الخلايا في ظل الظروف القياسية (37 درجة مئوية و 5٪ ثاني أكسيدالكربون 2) لمدة 30 دقيقة.
- أحضر اللوحة المكونة من 24 بئرا التي تحتوي على وسط الاستزراع وطبق بتري في خزانة السلامة البيولوجية. افتح كلا الجفنين واستخدم مجموعة من الملقط في كل يد ، والتقط حشوة واحدة واقلبها بحيث يكون الجانب القمي للغشاء متجها الآن لأعلى والجانب القاعدي لأسفل.
- باستخدام ماصة P200، أضف 200 ميكرولتر من وسط الاستزراع داخل الملحق. ضع الملحق في أحد الآبار المملوءة مسبقا باللوحة المكونة من 24 بئرا وكرر ذلك مع الأغشية المتبقية.
- استزراع في ظروف قياسية (37 درجة مئوية و 5٪ ثاني أكسيد الكربون) وتغيير الوسط كل يومين.
6. التغيير المتوسط للثقافات في الظروف المغمورة
- قم بإعداد طبق جديد مكون من 24 بئرا مع وسط الاستزراع الطازج بإضافة 1,000 ميكرولتر / بئر. باستخدام ملاقط ، ارفع حشوة واحدة من اللوحة المكونة من 24 بئرا ، وقم بإمالتها قليلا ، وقم بإزالة الوسط من الجانب القمي.
- أضف 200 ميكرولتر من وسط الاستزراع الطازج داخل الملحق. ضع الملحق في بئر مملوء مسبقا بوسط ثقافة طازج. كرر لجميع الأغشية.
7. التغيير المتوسط للثقافات في ظروف الجسر الجوي
- باستخدام ملاقط ، ارفع الملحق وضعه في بئر فارغ من طبق 24 بئرا. كرر لأربعة أغشية أخرى.
- قم بإمالة اللوحة المكونة من 24 بئرا قليلا وأضف ببطء 1,000 ميكرولتر من وسط الاستزراع الطازج داخل كل طبق جيدا. كرر مع الأغشية المتبقية.
8. قياس المقاومة الكهربائية عبر الظهارة (TEER)
- قم بإعداد صفيحة من 24 بئرا مع 1,000 ميكرولتر من وسط الاستزراع أو PBS داخل الآبار ونقل الأغشية إليها. تأكد من وجود 200 ميكرولتر من المحلول المقابل فوق الغشاء.
- باستخدام مجموعة من الملقط ، قم بتثبيت الملحق داخل اللوحة جيدا عن طريق الضغط برفق على أذرع الإدراج. بدون إزالة الملقط ، أدخل قطب TEER في البئر وسجل القياس.
- قم بإزالة القطب الكهربائي ثم ارفع الملقط.
- كرر الخطوات 8.2-8.3 للأغشية المتبقية.
النتائج
صور تمثيلية للإدخالات
تظهر صور الإدخالات قبل وبعد إطلاقها من منصة الطباعة في الشكل 3 أ ، ب. تظهر صورة لإدراج نهائي تمت إزالة الدعم منه في الشكل 3C. والنتيجة هي مجموعة من الإدخالات المطبوعة ثلاثية الأبعاد ، جاهزة للتعقيم والاستخدام اللاحق.
رفع ومناولة أغشية الحرير FN
يظهر الرسم التخطيطي العام لتشكيل غشاء الحرير FN والرفع اليدوي في الشكل 1. والنتيجة هي عدد من الإدخالات مع غشاء حريري FN. لضمان أعلى معدل نجاح مع رفع الأغشية السليمة ، يجب اتباع الخطوات الموضحة في البروتوكول بدقة. يوضح الشكل 4 صورا فوتوغرافية لغشاء وهو سليم (A ، D) وبعد التمزق (B ، E ، F). يمكن تصور التمزق باستخدام الفحص المجهري للحقل الساطع (الشكل 4E ، F) و / أو عن طريق تقطير السائل عبر الغشاء (الشكل 4 ب). من المهم رفع وخفض الإدخالات بشكل عمودي على الغشاء ، للتأكد من أن الغشاء يلتصق بالتساوي ويمتد أسفل الإدخالات. يمكن ملاحظة التصاق الغشاء بصريا ، كما هو موضح في الشكل 4 أ. إذا تم خفض الملحق حسب التعليمات وتم الاحتفاظ بمستويات السائل كما هو موضح في الشكل 2 ، يظل الغشاء متصلا بالملحق طوال فترات الثقافة الطويلة.
هنا ، يتم التحقق من صحة ارتباط الغشاء بالملحق من خلال إجراء تجربة نفاذية15،16،17 على الأغشية التي تم الاحتفاظ بها في ظل ظروف زراعة الخلايا القياسية لمدة 9 أيام. باختصار ، عند إضافة جزيء فلورسنت أعلى الغشاء وقياس الإشارة في المحلول أدناه ، فإن ملف نفاذية أغشية الحرير يتبع ملف تعريف إدراج ثقافة الأنسجة المتاح تجاريا (الشكل 4C) ، مما يظهر عدم وجود تسرب على مدى 36 ساعة من الاختراق ويشير إلى أن الغشاء يظل سليما ومتصلة بالملحق. تم إجراء تجارب مماثلة سابقا على الخلايا المزروعة على جانبواحد من الغشاء الحريري 15 أو كلا جانبيه. تم عرض قوة الالتصاق سابقا باستخدام المسافة البادئةالكلية 16 واختبارات التضخم16،17. ضمن تجارب المسافة البادئة الكلية ، تم استخدام قلم لتمديد الغشاء ، الذي تمزق تحت قوة 1.4 mN ، بينما ظل متصلا بالملحق16.
وتجدر الإشارة إلى أن معدل نجاح رفع الأغشية السليمة يرتبط بالمواد والمعالجة اللاحقة للإدخالات. باستخدام هذا البروتوكول ، كانت 95٪ من الأغشية المرفوعة باستخدام الإدخالات المطبوعة بالراتنج المستخدم مناسبة لتلقيح الخلايا ، مقارنة ب 74٪ عند استخدام راتنج مماثل بدلا من ذلك. نتوقع أن الالتصاق مدعوم بالتفاعلات الكارهة للماء وقوى فان دير فالس ، وبالتالي تغيير خصائص المواد يغير قوة الالتصاق. ويدعم ذلك أيضا حقيقة أن الأغشية لا تلتصق جيدا بالمواد المحبة للماء (البيانات غير معروضة).
النتائج التمثيلية لزراعة الخلايا على أغشية الحرير FN
تظهر صور التألق المناعي للخلايا الكيراتينية (HaCaT) المزروعة على الجانب القمي أو القاعدي من الغشاء في الشكل 5. لوحظ أن الخلايا الملتصقة (الشكل 5D.i) تغطي منطقة الثقافة بالتساوي في اليوم 1 مع اكتساب مورفولوجيا الحصى النموذجية للخلايا الكيراتينية (الشكل 5A.i-B.i). في اليوم 3 ، أنشأت الخلايا الكيراتينية طبقة ملتقرة (الشكل 5A.ii-B.ii) وشكلت شبكة من التقاطعات الضيقة (الشكل 5D.ii) ، مما يشير إلى أنها كانت تتولى وظائف ظهارية فسيولوجية. كما ظهرت المستويات العالية من جدوى الخلية التي تم تحقيقها في مصفوفات الحريرFN 15،17،23،24 في إعداد ثقافة إدخال غشاء الحرير الموصوف هنا. بعد 3 أيام في الثقافة ، ظلت الخلايا الكيراتينية قابلة للحياة بدرجة كبيرة (الشكل 5C.i-iv). بالإضافة إلى ذلك ، لم يلاحظ أي اختلاف في توزيع الخلايا الميتة بين المركز (الشكل 5C.i-ii) ومحيط الغشاء (الشكل 5C.iii-iv) ، مما يكشف عن عدم وجود تأثير كبير للمادة المدخلة على جدوى HaCaT. بشكل عام ، قدم نظام استزراع الحرير إدراج نفس (الشكل 5i-ii ، v-vi) إذا لم يتم تحسينه (الشكل 5iii-iv ، vii-viii) قابلية للخلايا الكيراتينية مع نظام إدخال غشاء PET التجاري.
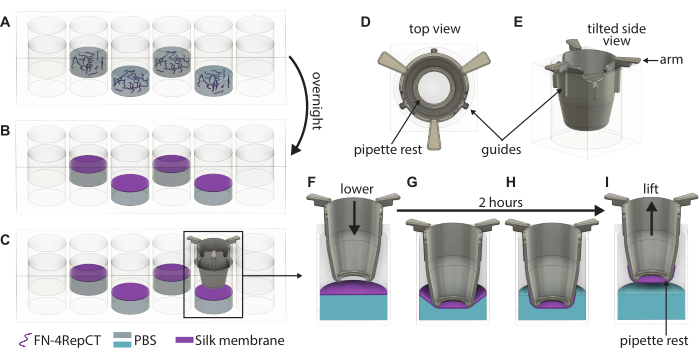
الشكل 1: رسم توضيحي مفصل لتشكيل ورفع أغشية الحرير FN الفريدة. (أ) املأ كل بئر ثانية (تجنب الصف / العمود الخارجي) في صفيحة مكونة من 48 بئرا بمحلول بروتين FN-silk حيث (ب) يتم تجميعها ذاتيا في غشاء عند واجهة الهواء السائل بين عشية وضحاها. (ج) أمسك الملحق بزوج من الملقط وخفضه ببطء على الغشاء باستخدام أدلة (D ، E) على الملحق المطبوع ثلاثي الأبعاد لضمان خفض الملحق بشكل عمودي على الغشاء. تكبير التصاق غشاء الحرير يظهر مقطعا عرضيا للإدخال (F) فوق الغشاء مباشرة و (G) أثناء ملامسته لغشاء الحرير. خلال فترة الحضانة التي استمرت ساعتين ، (H) يرتبط غشاء الحرير تلقائيا بالملحق ، والذي يستخدم بعد ذلك (I) لرفع الغشاء من الواجهة. الاختصارات: FN = فيبرونيكتين. PBS = محلول ملحي مخزن بالفوسفات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
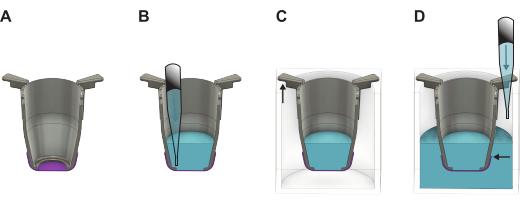
الشكل 2: رسم توضيحي مفصل يوضح كيفية التعامل مع غشاء الحرير FN بعد رفعه من لوحة التكوين. (أ) الإدخال (الرمادي) مع الغشاء (الأرجواني) مباشرة بعد الرفع. (ب) يضاف السائل (الأزرق) على الجانب القمي من الغشاء ، والذي يتم وضعه بعد ذلك في صفيحة (C) مكونة من 24 بئرا حيث يتدلى الجزء الأطول من أذرع الإدخال على الجدران ، ويحافظ الجزء الأقصر على الملحق في منتصف اللوحة. (د) يضاف السائل إلى البئر ، مما يضمن أن مستوى السائل متوازن وفوق حافة الغشاء. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: صور فوتوغرافية للإدخالات المطبوعة ثلاثية الأبعاد. (أ) الإدخالات مباشرة بعد إزالتها من الطابعة ثلاثية الأبعاد ، ولا تزال متصلة بلوحة البناء. (ب) إدخال واحد بعد إزالته من لوحة البناء ، قبل كسر الدعامات. (ج) إدخال واحد بعد إزالة الدعامات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
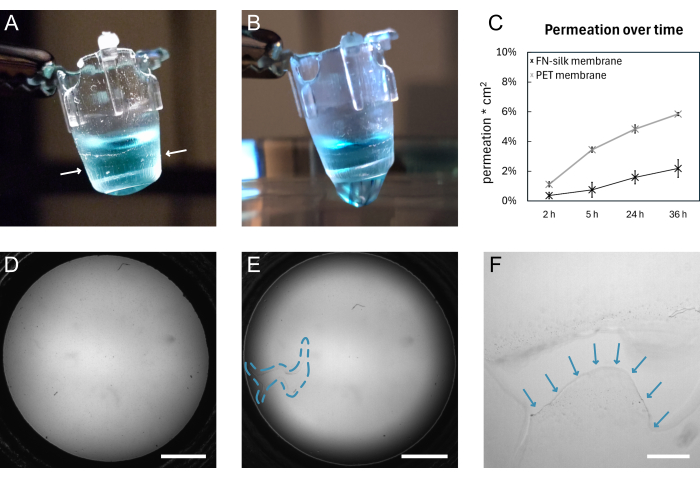
الشكل 4: غشاء حريري FN قبل وبعد الكسر. (أ) صورة لغشاء سليم يحمل 200 ميكرولتر من PBS المصبوغ (الأزرق) على الجانب القمي. يشار إلى حافة الغشاء الملفوفة حول الملحق بواسطة سهام بيضاء. (ب) صورة لنفس الغشاء بعد التمزق. PBS يتسرب عبر الغشاء. (ج) مخطط يوضح تغلغل جزيء فلورسنت 3 كيلو دالتون على مدى 36 ساعة من خلال غشاء حريري أو غشاء PET متاح تجاريا يتم الاحتفاظ به في ظروف زراعة الخلايا القياسية لمدة 9 أيام. (د) صورة المجال الساطع للغشاء قبل التمزق. (ه) صورة المجال الساطع لنفس الغشاء بعد التمزق. يشار إلى المنطقة المعيبة من خلال المخطط الأزرق المتقطع. (و) منظر مكبر للتمزق الموضح في D مع حافة الغشاء الممزق المشار إليها بأسهم زرقاء. أشرطة المقياس = 1 مم (D ، E) ، 200 ميكرومتر (F). الاختصارات: FN = فيبرونيكتين. PBS = محلول ملحي مخزن بالفوسفات ؛ PET = بولي (إيثيلين تيريفثاليت). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
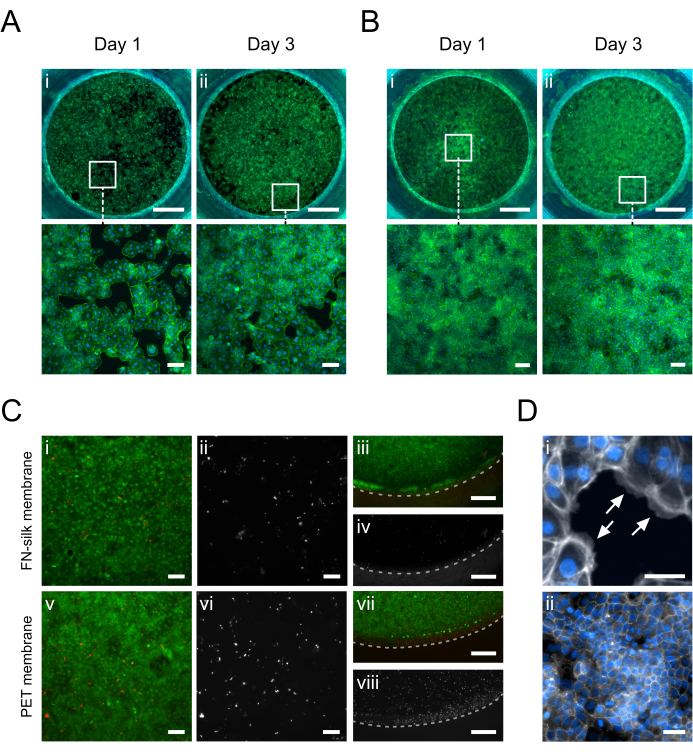
الشكل 5: الخلايا الكيراتينية (HaCaT) المستزرعة على غشاء الحرير FN. في اليوم الأول ، التزمت الخلايا الكيراتينية وغطت بالتساوي مساحة سطح الغشاء على الجانب القمي (AI) أو الجانب القاعدي (BI) (الفالودين ، الأخضر). في اليوم 3 ، يتم إنشاء طبقة أحادية التقاء على الجانب القمي (A.ii) أو القاعدي (B.ii) (الفالودين ، الأخضر). (ج) تقييم صلاحية الخلية على الغشاء الحريري (i-iv) مقارنة بغشاء PET التجاري (v-viii) في الوسط (i ، ii ، v ، vi) والمحيط (iii ، iv ، vii ، viii) من طبقة الخلية. تظهر الخلايا الحية باللون الأخضر (الأول ، الثالث ، الخامس ، السابع) والخلايا الميتة باللون الأحمر (الأول ، الثالث ، الخامس ، السابع) أو الأبيض (الثاني ، الرابع ، السادس ، الثامن). يشير الخط المتقطع إلى الطور البيني لإدخال الغشاء. (د) تم تكبيره بالتفصيل ، (أنا) يشير إلى (الأسهم البيضاء) التصاق الخلية بالغشاء (الفالودين ، الأبيض) و (ثانيا) شبكة تقاطع ضيقة تشكلت بعد 3 أيام في الثقافة (ZO-1 ، أبيض). أشرطة المقياس = 1 مم (الصف العلوي: A ، B) ، 100 ميكرومتر (الصف السفلي: A ، B ، Ci ، ii ، v ، vi) ، 500 ميكرومتر (C iii ، iv ، vii ، viii) ، 50 ميكرومتر (D). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: نظرة عامة على العمل السابق حيث تم دمج الأغشية في إدخالات زراعة الخلايا. الاختصارات: PCL = بولي كابرولاكتون. PEGDA = بولي (إيثيلين جلايكول) دياكريلات. PLGA = بولي (حمض اللاكتيك كو جليكوليك) ؛ PDMS = بولي ديميثيل سيلوكسان. الكمبيوتر = البولي كربونات. RSS = بروتين حرير العنكبوت المؤتلف ؛ PLCL = بولي (اللاكتيد كو كابرولاكتون) ؛ RHSIF = بروتينات الخيوط الوسيطة لسمك الهاج المؤتلف الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 2: نظرة عامة على العمل السابق الذي يلخص أنواع الخلايا المختلفة المزروعة على أغشية الحرير FN. FN-4repCT (FN-silk) هي نسخة قصيرة من حرير خط السحب من Euprosthenops australis ، والذي يتم إنتاجه وتشغيله بشكل مؤتلف باستخدام شكل RGD من الفيبرونيكتين على المستوى الجيني. يستخدم هذا البروتين في جميع الحالات الملخصة هنا. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 3: استكشاف الأخطاء وإصلاحها. الرجاء النقر هنا لتنزيل هذا الجدول.
الملف التكميلي 1: ملف التصميم (.stl) للطباعة ثلاثية الأبعاد للإدخالات. الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 2: بروتوكول الطباعة والمعالجة اللاحقة والتعقيم عند استخدام الطابعة والراتنج المحدد في جدول المواد. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي S1: تخطيطي للنمط المقترح استخدامه عند وضع محلول FN-silk في اللوحة المكونة من 48 بئرا. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
يحدد البروتوكول الموصوف هنا طريقة بسيطة لعمل إدخالات لزراعة الخلايا ذات الصلة بيولوجيا. يبدأ بطباعة الإدخالات ، متبوعا بتكوين وربط أغشية الحرير FN ، وينتهي بإظهار كيف يمكن زرع الخلايا على كل من الجانبين القمي والقاعدي للغشاء. هناك خطوة واحدة حاسمة حقا في هذا البروتوكول لضمان النجاح على المدى الطويل مع مزارع الخلايا وهي خفض ورفع الإدخالات على الغشاء. سيؤدي التنفيذ الناجح لهذه الخطوات إلى نظام ثقافة غشاء حريري قادر على تحمل زراعة الخلايا على غرار الأنظمة المتاحة تجاريا مع الأغشية الاصطناعية. لضمان ذلك ، تم تنفيذ حواجز توجيه على جانبي الإدخالات المصممة خصيصا لمنع خفضها بزاوية أو تحريكها جانبا في البئر ، مما قد يؤدي إلى التصاق غشاء غير متساو ، مما يؤدي إلى نقاط ضعف ثم تسرب لاحق. من الشائع أن تنشأ مشكلات بسيطة عند اتباع بروتوكول لأول مرة. لمساعدة المستخدم الجديد في التحايل عليها ، إذا واجهها أثناء اتباع البروتوكول المعروض أعلاه ، حددنا المشكلات المحتملة وحلولها في الجدول 3.
لقد ثبت أن الغشاء نفسه مفيد لنمذجة الأنسجة الحاجزة المختلفة (تم الاطلاع عليها في الجدول 2) ؛ ومع ذلك ، تجدر الإشارة إلى أن الراتنج المستخدم لطباعة الإدخالات هنا لم يتم اختباره على نطاق واسع لتأثيره على بقاء أنواع الخلايا الأخرى. على الرغم من أننا لم نواجه أي مشاكل من هذا القبيل حتى الآن ، فمن الممكن أن يؤثر الراتنج سلبا على صلاحية ونمو بعض الخلايا الحساسة. لذلك يوصى بإجراء اختبار جدوى مشابه للاختبار المعروض هنا للتحقق من توافق الراتنج مع كل نوع من أنواع الخلايا المستخدمة. إذا تم اختبار السمية الخلوية ، فيجب إنشاء بروتوكول علاج و / أو ترشيح أكثر شمولا لمنع المونومرات غير المعالجة من التسرب بمرور الوقت وإلحاق الضرر بالخلايا. يمكن العثور على مثال على هذا البروتوكول ، الذي تم استخدامه للراتنج المستخدم لطباعة الإدخالات داخل هذا البروتوكول ، في الملف التكميلي 2. تم استخدام هذا البروتوكول سابقا لإعداد إدخالات لزراعة بطانة الدماغ bEnd.3 على أغشية الحرير لمدة تصل إلى 8 أيام15.
تتمثل الفائدة الرئيسية للطريقة المقدمة في هذا العمل في أنها توفر طريقة بسيطة لاستبدال الأغشية البلاستيكية الحالية على إدخالات زراعة الأنسجة ، وعلى هذا النحو ، تحسين نماذج زراعة الأنسجة الثابتة. القيد الرئيسي هو أن المستخدم يحتاج إلى الوصول إلى معدات الطباعة ثلاثية الأبعاد أو لشراء وقت في منشأة لطباعة إدخالاته. ومع ذلك ، إذا لزم الأمر ، يمكن التحايل على ذلك باستخدام إدخالات زراعة الأنسجة التجارية بعد إزالة أغشيةها. بالإضافة إلى ذلك ، في حين أن أغشية الحرير ، في جوهرها ، يمكن استخدامها كإدخالات لزراعة الأنسجة العادية ، إلا أنها أرق وذات تركيبة بروتين ، وبالتالي فهي أكثر حساسية من نظيراتها التجارية الاصطناعية الحالية. وبالتالي ، فإنها تتطلب معالجة أكثر دقة من قبل المستخدمين وتحتاج إلى أن تظل رطبة للحفاظ على مرونتها. وتجدر الإشارة إلى أن الأغشية يمكن أن تتحمل التمدد والتضخم16،17 ، مما يجعلها مناسبة ، على سبيل المثال ، لمحاكاة حركة التنفس. ومع ذلك ، فمن المحتمل أن يكسر المستخدمون الجدد بعض الأغشية في المراحل الأولية ، ولكن مع زيادة تجربة التعامل مع الأغشية ، من المتوقع أن يزداد معدل النجاح. إذا بقيت المشاكل، يجب على المستخدم الرجوع إلى الجدول 3 لاستكشاف الأخطاء وإصلاحها.
خلال العقد الماضي ، تم تقديم العديد من البدائل للإدخالات البلاستيكية التجارية (الجدول 1) ، وفي كل مرة تمت فيها مقارنة أداء مزارع الخلايا ، أسفرت الأغشية الجديدة الأكثر صلة بيولوجيا بنتائج أفضل من نظيراتها البلاستيكية التجارية2،5،6،7،14،22. وقد لوحظ هذا في المقام الأول من حيث وظيفة الحاجز المحسنة2،5،6،7،14،22 ، ولكن أيضا في تكوين المزيد من نمو الخلايا الشبيهة بالسكانالأصليين 14 وزيادة التفاعلات من خلال الغشاء في أنظمة الزراعة المشتركة7. لوحظ هذا الاتجاه سابقا لأغشية الحرير FN عند إنشاء نموذج جدار الأوعية الدموية. في هذه الدراسة ، نمت خلايا HDMEC والعضلات الملساء (SMCs) على جوانب متقابلة من الغشاء. وقد تبين أن SMCs تفرز ECM أكثر سمكا عند زراعتها مع HDMEC على أغشية الحرير FN مقارنة بأغشية PET التجارية. وبالمثل ، أنشأت HDMEC حاجزا أكثر إحكاما على أغشية الحرير FN17. من المحتمل أن تكون نتائج زراعة الخلايا المحسنة بسبب تحسين الاتصال الخلوي والمزيد في ظروف الاستزراع الشبيهة بالجسم الحي . يقترب غشاء الحرير FN من BM الأصلي من حيث السماكة والهيكل والخصائص الميكانيكية. يتراوح حجم BM الأصلي بين 20 نانومتر و 3 ميكرومتر22 ، وأغشية PET 10 ميكرومتر ، وأغشية الحرير FN حوالي 1 ميكرومتر ، وبالتالي تقع ضمن النطاق الأصلي. هيكل غشاء الحرير FN هو أيضا الليفي النانوي16 ، تماما مثل BM22 الأصلي ، بينما يتكون غشاء PET من البلاستيك مع مسام محفورة بالمسار ، عادة ما يتراوح قطرها بين 0.4 ميكرومتر و 8 ميكرومترفي القطر 7. أغشية PET هي أيضا أكثر صلابة من BM ، حيث تحتوي على معامل يونغ حوالي 2 GPa ، مقارنة ب BM الذي يتراوح من kPa إلى MPa ، ولكن يتم الاستشهاد به بشكل عام حوالي 250-500 كيلو باسكال22. تحتوي أغشية الحرير FN على معامل يونغ يبلغ 115 كيلو باسكال16 ، والذي يقع ضمن الظروف الأصلية. وتجدر الإشارة أيضا إلى أنه بمجرد نمو الخلايا على الغشاء ، تصبح قوتها هي العامل المهيمن ، وليس الغشاء نفسه17. في النهاية ، تجدر الإشارة أيضا إلى أن الوظيفة المتكاملة لبروتين الحرير FN يضمن أن الخلايا تلتصق مباشرة بالغشاء ، وبالتالي ، لن يكون الطلاء ضروريا. بالنسبة لأغشية PET ، غالبا ما يكون من المعتاد الطلاء ببروتين ECM لضمان التصاق الخلايا المناسب7.
عند مقارنة غشاء الحرير FN مع الأساليب الأخرى المستخدمة لاستبدال غشاء PET (تم الاستدعاء العام في الجدول 1) ، فإن الميزة الرئيسية لطريقتنا هي استخدام بروتين الحرير الوظيفي المنتج مؤتلف. هذا يضمن قابلية التكاثر وظروف الاستزراع المحددة على عكس المواد الأخرى القائمة على البروتين والمشتقة من مثل الكولاجين. لاحظ مرة أخرى أن وظيفة البروتين تضمن عدم الحاجة إلى الطلاء لأن الخلايا تلتصق جيدا بالأغشية لأنهاتبلغ 17 عاما. علاوة على ذلك ، فإن إنتاج الأغشية الحريرية الموصوفة هنا يعتمد على التجميع الذاتي ولا يتطلب أي إعداد معقد أو استخدام مواد كيميائية قاسية ، على عكس العديد من التقنيات الأخرى التي تعتمد ، على سبيل المثال ، على الغزل الكهربائي. يلغي الالتصاق التلقائي للغشاء بالملحق أيضا الحاجة إلى المعالجة اليدوية المرتبطة بالإدخالات المكونة من جزأين ، واللصق ، وحلقات تركيب السيليكون ، وبالتالي تبسيط التحجيم وتمكين التكرار السهل في أي مختبر. بالإضافة إلى الإنتاج السهل ، من السهل أن تتكيف طريقتنا مع الاحتياجات التجريبية للمستخدم حيث يمكن استخدام مواد إدخال مختلفة ويمكن ضبط سمك الغشاء عن طريق ضبط تركيز الحرير للمحلول الأولي16. أخيرا ، يمكن أن ينتج عن هذا البروتوكول ، على حد علمنا ، أنحف غشاء قائم بذاته متصل بملحق ثقافة الأنسجة ، مما يسمح بأقرب تشابه مع الغشاء القاعدي الأصلي.
بروتوكول تكوين غشاء الحرير والتعامل معه المقدم هنا سهل الاستخدام لأي شخص معتاد على العمل مع إدخالات زراعة الأنسجة في مختبر زراعة الخلايا. إنها طريقة بسيطة للانتقال بعيدا عن الأغشية البلاستيكية إلى نظير يشبه الجسم الحي ، مما يسمح بإنشاء نماذج أنسجة أكثر صلة باستخدام أنواع مختلفة من الخلايا (الجدول 2). يمكن أن تدعم أغشية الحرير زراعة الخلايا على جوانبها القمية أو القاعدية بالإضافة إلى الثقافات المشتركة لأنواع الخلايا المختلفة بشكل ثنائي17. يمكن استخدام نماذج الأنسجة الحاجزة التي تم تطويرها على أغشية الحرير لنفس مجموعة التطبيقات مثل إدخالات زراعة الأنسجة ، بما في ذلك فحوصات الأدوية ودراسات النفاذية والعدوى. بالنسبة للحالات التي يكون فيها الحديث المتبادل بين أنواع الخلايا المختلفة موضع اهتمام ، فقد ثبت أنها تتفوق على إدخالات TC نظرا لخصائصها الشبيهة بالجسم الحي 17.
Disclosures
تعمل LG لدى شركة Spiber Technologies AB ، وهي الشركة التي تنتج بروتين الحرير FN.
Acknowledgements
يود المؤلفون أن يشكروا شركة Spiber Technologies AB على توفير بروتين حرير العنكبوت المؤتلف الوظيفي و Eline Freeze لطباعة جزء كبير من الإدخالات المطبوعة ثلاثية الأبعاد.
Materials
| Name | Company | Catalog Number | Comments |
| CHEMICALS | |||
| Alexa Fluor 488 | Invitrogen; Thermo Fisher Scientific | A-21121 | Goat anti-mouse, Dilution 1:500 |
| Alexa Fluor 488 Phalloidin | Invitrogen; Thermo Fisher Scientific | A12379 | Dilution 1:400 |
| anti-ZO-1 (1A12) antibody | Invitrogen; Thermo Fisher Scientific | 33-9100 | Mouse anti-human, Monoclonal, Dilution 1:200 |
| Dextran, Alexa Fluor 680; 3,000 MW, Anionic | Invitrogen; Thermo Fisher Scientific | D34681 | Diluted 2,5% (w/v) in 200 ul of culture medium |
| DMEM/F-12 | Gibco; Thermo Fisher Scientific | 31330095 | Supplemented with 5% v/v FBS and 1% v/v Penicillin-Streptomycin |
| Ethanol | Solveco | 1326 | 70% (CAS-no 64-17-5) |
| Fetal Bovine Serum, qualified, heat inactivated, United States | Gibco; Thermo Fisher Scientific | 16140071 | |
| FN-silk | Spiber technologies AB | Store at -80 °C | |
| Isopropanol, EMPARTA ACS analytical reagent | Supelco | 1096342511 | ≥99.5% (CAS-no 67-63-0) |
| Live/Dead Viability/Cytotoxicity Kit | Invitrogen; Thermo Fisher Scientific | L3224 | |
| PBS | Swedish Veterinary Agency / Statens veterinärmedicinska anstalt | 992420 | without Ca and Mg, filtered |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco; Thermo Fisher Scientific | 11548876 | |
| MATERIAL | |||
| Dental LT Clear Resin | Denthouse | #DLCL-01 | |
| HaCaT cells | CLS | 300493 | |
| Nunc Cell-Culture Treated Multidishes 24-well | Fisher Scientific | 10604903 | |
| Nunc Cell-Culture Treated Multidishes 48-wel | Fisher Scientific | 10644901 | |
| TC insert, for 24-well plates, PET, transparent | Sarstedt | 83.3932.041 | pore size: 0.4 µm |
| ThinCert Cell Culture Inserts, translusent membrane (PET) | Greiner | 662640 | pore size: 0.4 µm |
| EQUIPMENT | |||
| EVOM meter with chopsticks | World Precision Instruments (WPI) Germany, GMBH | ||
| Form 3B | FormLabs | ||
| Form Wash | FormLabs | ||
| Form Cure | FormLabs | ||
| Isotemp General Purpose Deluxe Water Baths | Fisherbrand | ||
| Inverted fluorescence microscope Eclipse Ti | Nikon | ||
| Inverted fluorescence microscope DMI6000 B | Leica | ||
| Laminar flow hood Ninosafe, class II | Labolutions | ||
| Midi CO2 Incubator, 40 L | Thermo Scientific |
References
- Kumar, P., Kedaria, D., Mahapatra, C., Mohandas, M., Chatterjee, K. A designer cell culture insert with a nanofibrous membrane toward engineering an epithelial tissue model validated by cellular nanomechanics. Nanoscale Adv. 3 (16), 4714-4725 (2021).
- Wang, Y., et al. Ultrathin and handleable nanofibrous net as a novel biomimetic basement membrane material for endothelial barrier formation. Colloids Surf B Biointerfaces. 219, 112775(2022).
- Jain, P., Rauer, S. B., Möller, M., Singh, S. Mimicking the natural basement membrane for advanced tissue engineering. Biomacromolecules. 23 (8), 3081-3103 (2022).
- Eom, S., Park, S. M., Han, S. J., Kim, J. W., Kim, D. S. One-step fabrication of a tunable nanofibrous well insert via electrolyte-assisted electrospinning. RSC Advances. 7 (61), 38300-38306 (2017).
- Kim, D., Eom, S., Park, S. M., Hong, H., Kim, D. S. A collagen gel-coated, aligned nanofiber membrane for enhanced endothelial barrier function. Sci Rep. 9 (1), 1-11 (2019).
- Ebrahim, N. A., et al. Porous honeycomb film membranes enhance endothelial barrier integrity in human vascular wall bilayer model compared to standard track-etched membranes. J Biomed Mater Res A. 111 (5), 701-713 (2023).
- Zakharova, M., et al. Transwell-integrated 2 µm thick transparent polydimethylsiloxane membranes with controlled pore sizes and distribution to model the blood-brain barrier. Advanced Materials Technologies. 6 (12), 2100138(2021).
- Park, S., et al. Use of elastic, porous, and ultrathin co-culture membranes to control the endothelial barrier function via cell alignment. Advanced Functional Materials. 31 (9), 2008172(2021).
- Youn, J., et al. Facile and adhesive-free method for bonding nanofiber membrane onto thermoplastic polystyrene substrate to fabricate 3D cell culture platforms. Materials Today Bio. 20, 100648(2023).
- Liu, H., et al. Electrohydrodynamic jet-printed ultrathin polycaprolactone scaffolds mimicking Bruch’s membrane for retinal pigment epithelial tissue engineering. Int J Bioprint. 8 (3), 550(2022).
- Dogan, A. A., Dufva, M. Customized 3D-printed stackable cell culture inserts tailored with bioactive membranes. Sci Rep. 12 (1), 1-12 (2022).
- Rohde, F., Danz, K., Jung, N., Wagner, S., Windbergs, M. Electrospun scaffolds as cell culture substrates for the cultivation of an in vitro blood–brain barrier model using human induced pluripotent stem cells. Pharmaceutics. 14 (6), 1308(2022).
- Slater, S. C., et al. An in vitro model of the glomerular capillary wall using electrospun collagen nanofibres in a bioartificial composite basement membrane. PLoS ONE. 6 (6), e20802(2011).
- Harris, T. I., et al. Utilizing recombinant spider silk proteins to develop a synthetic Bruch’s membrane for modeling the retinal pigment epithelium. ACS Biomater Sci Eng. 5 (8), 4023-4036 (2019).
- Hjelm, L. C., Hedhammar, M., Löfblom, J. In blood–brain barrier model based on recombinant spider silk protein nanomembranes for evaluation of transcytosis capability of biomolecules. Biochem Biophys Res Commun. 669, 77-84 (2023).
- Gustafsson, L., et al. Recombinant spider silk forms tough and elastic nanomembranes that are protein-permeable and support cell attachment and growth. Advanced Functional Materials. 30 (40), 2002982(2020).
- Tasiopoulos, C. P., Gustafsson, L., Van Der Wijngaart, W., Hedhammar, M. Fibrillar nanomembranes of recombinant spider silk protein support cell co-culture in an in vitro blood vessel wall model. ACS Biomater Sci Eng. 7 (7), 3332-3339 (2021).
- Marino, A., Baronio, M., Buratti, U., Mele, E., Ciofani, G. Porous optically transparent cellulose acetate scaffolds for biomimetic blood-brain barrier in vitro models. Front Bioeng Biotechnol. 9, 630063(2021).
- Schramm, R. A., Koslow, M. H., Nelson, D. A., Larsen, M., Castracane, J. A novel impedance biosensor for measurement of trans-epithelial resistance in cells cultured on nanofiber scaffolds. Biosensors. 7 (3), 35(2017).
- Qi, D., et al. Establishment of a human iPSC- and nanofiber-based microphysiological blood-brain barrier system. ACS Appl Mater Interfaces. 10 (26), 21825-21835 (2018).
- Rickabaugh, E., Weatherston, D., Harris, T. I., Jones, J. A., Vargis, E. Engineering a biomimetic in vitro model of Bruch’s membrane using hagfish slime intermediate filament proteins. ACS Biomater Sci Eng. 9 (8), 5051-5061 (2023).
- Choi, J. W., Youn, J., Kim, D. S., Park, T. E. Human iPS-derived blood-brain barrier model exhibiting enhanced barrier properties empowered by engineered basement membrane. Biomaterials. 293, 121983(2023).
- Widhe, M., Shalaly, N. D., Hedhammar, M. A fibronectin mimetic motif improves integrin mediated cell biding to recombinant spider silk matrices. Biomaterials. 74, 256-266 (2016).
- Johansson, U., et al. Assembly of functionalized silk together with cells to obtain proliferative 3D cultures integrated in a network of ECM-like microfibers. Sci Rep. 9 (1), 1-13 (2019).
- Widhe, M., Johansson, U., Hillerdahl, C. O., Hedhammar, M. Recombinant spider silk with cell binding motifs for specific adherence of cells. Biomaterials. 34 (33), 8223-8224 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved