Method Article
纳米原纤维基底膜模拟物,由重组功能化蜘蛛丝制成,用于定制组织培养小室
摘要
带有塑料膜的组织培养小室是细胞培养实验室的黄金标准,可作为建立细胞层和屏障组织模型的渗透性支持物。在此,我们提出了一种简单的方法,用由重组功能化蜘蛛丝蛋白制成的更具生物学相关性的膜代替塑料膜。
摘要
复制组织屏障对于生成用于评估新疗法的相关 体外 模型至关重要。今天,这通常使用带有塑料膜的组织培养插入物来完成,该插入物产生顶端和基底侧。除了为细胞提供支持外,这些膜还远非模拟它们的天然对应物基底膜,后者是一种基于蛋白质的纳米纤维基质。在这项工作中,我们展示了一种简单的方法,通过用纯重组功能化蜘蛛丝蛋白制成的塑料膜代替塑料膜来显着提高组织培养插入物的生物学相关性。丝膜通过自组装形成,并会自发粘附在无膜的组织培养插入物上,在那里它可以为细胞提供支持。可以按照实验方案中提供的说明使用标准 3D 打印机打印定制设计的组织培养插入物,也可以购买并使用商业插入物。该方案展示了如何设置插入片段中带有丝膜的培养系统,以及随后如何实施与传统的市售插入片段相同的细胞培养技术。
引言
可以复制组织屏障的体外模型因其在测试新疗法和促进对基本疾病机制的理解方面的适用性而受到越来越多的关注 1,2。为了准确重建天然微环境,概括基底膜 (BM) 的功能至关重要,BM 是一种高度专业化的细胞外基质 (ECM) 复合物。BM 几乎存在于人体的每个组织中,它为内皮细胞和上皮细胞提供支持,并将它们与底层组织分离 2,3。除了提供物理支持外,BM 还调节和维持细胞与周围组织之间的生化信号。这些重要功能使得设计类似于天然 BM3 的结构以及机械和功能特性的支架变得必要。
当今在体外模拟 BM 的最常见方法之一是使用市售的组织培养插入片段 (TC-inserts)。这些本质上是塑料圆柱体,带有可渗透膜,将腔室分为顶端和基底外侧 4,5。虽然易于使用,但商业插件中的膜通常是刚性的、径迹蚀刻的,并且由聚碳酸酯 (PC) 和聚对苯二甲酸乙二醇酯 (PET) 等聚合物制成3,4,6。它们在直径、孔密度和尺寸方面具有柔韧性,可以涂覆以增强细胞粘附,但缺乏 BM 的所有其他相关特性,例如可比的厚度6、互连孔隙率、纤维结构和相关的弹性模量3。
TC 插入物的标准化及其易用性激发了包括我们在内的几个小组用更像体内的对应物取代塑料膜(如表 1 所示)。使用的材料范围从聚二甲基硅氧烷 (PDMS)7、聚(丙交酯-共己内酯)8 和聚己内酯 (PCL)4,9,10 等聚合物到蛋白质材料,如明胶 2,11,12、胶原蛋白 5,13 和重组蜘蛛丝 14,15,16,17.这些材料的膜以各种方式附着在市售的插入物上,从中去除了膜 4,7,8,10,12,13,14,16,18,19,20,21 ,以及通过 3D 打印 1,11,15,17,20 或注塑成型 9,22 制造的定制设计嵌件。然而,这些中的大多数在厚度上仍然与原生 BM 相去甚远,那里的复制品从数百微米11,18 到几微米 5,10,14,21,22 不等。其中许多还需要复杂的形成和/或手动连接方法 1,7,13,14,18,19,21,这使得其他实验室的放大和复制具有挑战性。
在此,我们提出了一种简单的方法来形成丝膜并将其连接到插入物上,并展示了如何在膜的任一侧培养细胞。丝膜是通过 FN-4RepCT (FN-silk) 蛋白在静置溶液的液-气界面处自组装形成的 16,17。FN 丝是来自 Euprosthenops australis 的 Major Ampullulate Spidroin 1 的重组短版本,用源自纤连蛋白23 的 RGD 基序功能化。它已被证明可以组装成纤维状基质,促进细胞粘附、生长和迁移 15,16,17,23,24,25。膜附着在嵌件上的方法依赖于自发粘附,并且已被发现适用于已去除膜的市售嵌件16,以及聚乳酸 (PLA) 17 和 Dental LT15 的 3D 打印嵌件。本文详细介绍了如何将这种方法用于从 Dental LT 打印的嵌件。FN 丝膜附着到插入片段上后,它们基本上可以像标准商业组织培养插入片段一样处理。简而言之,我们提出了一种简单的方法,通过用基于蛋白质的 FN 丝膜代替塑料膜来生成更相关的组织屏障体外模型。
研究方案
1. 3D 刀片印刷
- 下载 . 补充文件 1 中的 STL 设计文件 (JoVe_Silk_Insert.stl)。
- 通过在专用于转换 .STL 文件转换为正在使用的 3D 打印机的打印文件。
- 使用专用软件添加支持。支撑结构由软件设计,所需数量取决于打印机和所使用的软件。调整嵌件的方向,使建筑平台和支撑都不会接触底部。
- 使用适合所用 3D 打印机的生物相容性树脂(如 Dental LT 或 BioMed)或细丝(如 PLA)打印所需数量的插入物。
注意:确保材料能够承受适当的灭菌过程,例如高压灭菌、辐照或乙醇浸没。 - 从打印平台上拆下打印的插页,并从成品部件上拆下打印的支撑结构。
- 如果使用树脂打印机,请使用制造商提供的标准方案处理插入片段。
注:加工可能会因使用的树脂而异。用于此处使用的树脂的方案在 补充文件 2 中提供。 - 使用适合所选材料的技术对插入物进行消毒。
注:建议进行高压灭菌、辐照或浸没在 70% 乙醇中,或两者的组合。如果使用树脂打印机,则可能需要广泛的浸出方案以实现最佳生物相容性。有关建议,请参阅 补充文件 2 中提供的协议。 - 确保插件完全干燥,并以无菌方式存放直至使用。
2. FN 丝膜的形成
- 用干冰装满一个盒子,然后将其放入 -80 °C 冰箱中。
- 从 -80 °C 冰箱中收集 FN-silk 样品瓶,并将其放入干冰中运输。将 FN-silk 样品瓶带到生物安全柜中,并在那里执行进一步的步骤。将 FN-silk 样品瓶放在微量离心管架中解冻,不要过度接触。
- 在 FN-silk 解冻时,打开 48 孔板的包装。FN 丝完全解冻后,请在 10 分钟内进行下一步,最好尽早进行。
- 在冷藏或室温 PBS 中将 FN-silk 溶液稀释至所需浓度,最好为 1.8 mg/mL。将 550 μL FN-silk 溶液直接移液到 48 孔板中空孔的底部。移液 FN-silk 溶液,直到制备出所需数量的膜。
注意:避免引入气泡,并立即用移液器去除任何气泡。不要使用 A 行或 F 行或第 1 列或第 8 列中的孔,也不要使用相邻的孔(参见 补充图 S1 中的示意图)。 - 将盖子放在 48 孔板上,并将其放入更大的无菌盒中,以便在孵育过程中提供无菌环境。
- 小心地将盒子从生物安全柜中移出,并将其置于环境条件下不受干扰且没有明显气流的地方过夜。
3. 将 FN 丝膜粘附到插入物上
- 第二天,将无菌插入物带到生物安全柜。
- 将装有 48 孔板和 FN-silk 膜的大无菌盒带回生物安全柜中,并在那里执行进一步的步骤。小心地从大无菌盒中取出 48 孔板。
- 通过观察孔中的浑浊情况目视验证膜的形成,然后打开包含膜的 48 孔板的盖子。使用无菌镊子拿起一个插入物,然后将插入物向下引导到膜上,直到插入物的手柄接触孔的顶部,如图 1 所示。保持插件底部与板底部平行。
- 重复步骤 3.3,直到插入物下降到所有形成的膜上。将盖子放在 48 孔板的顶部,然后将板放回无菌盒中。在环境条件下让板不受干扰 2 小时,以使膜粘附在插入物上。
- 在 37 °C 下预热生长培养基或 PBS。
- 打开 24 孔板的包装。
- 2 小时后,从盒子中取出 48 孔板并打开盖子。使用无菌镊子握住插入物的手柄,然后将其从 48 孔板中取出。
- 提升后,立即用预热的培养基或 PBS 填充插入物。如果进行基底侧接种,则使用 100 μL 培养基,如果进行根尖侧接种,则使用 200 μL 培养基。如果要储存膜以备后用,请改用 200 μL PBS。
检查点:如果液体保留在膜上方,则提升成功。如果液体滴到工作台上,则膜会泄漏,应忽略。 - 将插件放入 24 孔板的空孔中。
- 将所有插件从 48 孔板中取出并转移到 24 孔板中。如果进行细胞接种,则用 1,000 μL 生长培养基填充孔,如果进行细胞接种,则用 PBS 填充孔,同时保持板略微倾斜。
注意:膜的边缘低于液位很重要(图 2)。 - 如果要立即接种细胞,请根据细胞要接种的膜的哪一侧进行第 4 部分或第 5 部分。如果没有,请将盖子放在 24 孔板上,然后将其放入冰箱 (4 °C) 或 37 °C 培养箱中。如果放入培养箱中,每隔一天补充一次 PBS,以确保维持所需的体积。
4. 细胞接种在膜的顶端侧
注:如果膜已储存在 PBS 中,请按照第 6 节所述用预热的培养基更换 PBS。
- 收获细胞。准备细胞悬液,使 20-50 μL 的悬浮液中存在每个膜所需的细胞数。重悬以达到所需的细胞浓度。
- 使用 P100 或 P200 移液器,吸出 20-50 μL 细胞悬液。将移液器吸头对准膜中心,使吸头与插入物内的培养基表面保持 1-2 mm 的距离,然后缓慢按下移液器柱塞,在吸头边缘形成液滴。使液滴与插入管内的培养基接触。
注意:保持移液器垂直于工作表面。 - 对剩余的膜重复步骤 4.2。接种 5 个膜后重悬细胞原液,以确保细胞分布均匀。以 8 字形移动板,以确保细胞在膜上分布更好。
- 在标准条件(37 °C 和 5% CO2 )下培养,并每隔一天更换一次培养基。
5. 细胞接种在膜的基底侧
注:如果膜已储存在 PBS 中,请用 100 μL 预热的生长培养基替换 PBS,并按照第 6 节所述用 1 mL 预热的生长培养基填充孔。
- 收获细胞并制备细胞悬液,使 20 μL 悬浮液中每层膜的细胞数达到所需数量。重悬以达到所需的细胞浓度。
- 打开培养皿的包装并打开盖子。确保培养皿的高度足以容纳插入物,而不会使它们的底部接触盖子。
- 使用镊子将插入物从 24 孔板中取出,将培养基留在孔中。每只手使用一组镊子,将插入物倒置,使基部朝上,顶端朝向工作区域。如图 3C 所示,将倒置的插件放入培养皿中。对其余插入重复上述步骤。
注意:请勿去除顶端侧的培养基。它将在孵育过程中保持膜湿润。 - 重悬细胞原液以确保细胞在溶液中分布均匀,并用 P100 或 P200 移液器吸出 20 μL 细胞悬液。将移液器吸头对准膜中心,使吸头与膜保持 1-2 mm 的距离,然后缓慢按下移液器柱塞,在吸头边缘形成液滴。保持移液器垂直于膜表面,让液滴落到膜上。对剩余的膜重复此操作。
注:接种 5 个膜后重悬细胞原液,以确保细胞分布均匀。 - 盖上培养皿的盖子,将培养皿和 24 孔板带到培养箱中,并在标准条件(37 °C 和 5 % CO2 )下将插入物与细胞孵育 30 分钟。
- 将含有培养基和培养皿的 24 孔板带入生物安全柜中。打开两个盖子,每只手使用一组镊子,拿起一个插入物并将其倒置,使膜的顶端侧现在朝上,基底侧朝下。
- 使用 P200 移液器,在插件内添加 200 μL 培养基。将插入物放入 24 孔板的其中一个预装孔中,然后对剩余的膜重复此操作。
- 在标准条件(37 °C 和 5% CO2 )下培养,并每隔一天更换一次培养基。
6. 浸没条件下培养物的培养基变化
- 添加 1,000 μL/孔,用新鲜培养基制备新的 24 孔板。使用镊子从 24 孔板中取出一个插入物,稍微倾斜,然后从顶端取出培养基。
- 在插入物中加入 200 μL 新鲜培养基。将插入物放入预装有新鲜培养基的孔中。对所有膜重复此操作。
7. 空运条件下培养基培养基
- 使用镊子提起插件并将其放入 24 孔板的空孔中。对另外四个膜重复此操作。
- 稍微倾斜 24 孔板,并在每个板孔内缓慢添加 1,000 μL 新鲜培养基。对剩余的膜重复此操作。
8. 测量跨上皮电阻 (TEER)
- 准备一个 24 孔板,孔内装有 1,000 μL 培养基或 PBS,然后将膜转移到其中。确保在膜上方有 200 μL 的相应溶液。
- 使用一组镊子,轻轻按压插入臂,将插入管板内部稳定下来。在不取下镊子的情况下,将 TEER 电极插入孔中并记录测量结果。
- 取下电极,然后提起镊子。
- 对剩余的膜重复步骤 8.2-8.3。
结果
插页的代表性照片
从打印平台释放之前和之后的插入物的照片如图 3A、B 所示。 图 3C 显示了已去除支撑的成品嵌件的图像。结果是一批 3D 打印的嵌件,可以进行消毒和后续使用。
FN 丝膜的提升和搬运
FN 丝膜形成和手动提升的一般示意图如图 1 所示。结果是许多附有 FN 丝膜的插入片段。为确保提升完整膜的最高成功率,应严格遵循方案中概述的步骤。 图 4 显示了膜完整时 (A、D) 和撕裂后 (B、E、F) 的照片。可以使用明场显微镜(图 4E、F)和/或通过膜滴落液体(图 4B)来观察撕裂。垂直于膜升降插入物非常重要,以确保保护膜均匀粘附并在插入物下方伸展。可以目视观察到膜粘附,如图 4A 所示。如果按照说明降低插入片段并保持液面如图 2 所示,则在整个长时间培养期间,膜会保持附着在插入片段上。
在此,通过在标准细胞培养条件下保存 9 天的膜上进行渗透实验 15,16,17 来验证膜附着到插入物上。简而言之,当在膜顶部添加荧光分子并测量下面溶液中的信号时,丝膜的渗透曲线遵循市售组织培养插入物的渗透曲线(图 4C),显示渗透 36 小时后没有泄漏,并表明膜保持完整并附着在插入物上。以前已经对接种在丝膜17 的一侧15 或两侧的细胞进行了类似的实验。粘附强度之前已使用宏观压痕16 和膨胀测试16,17 显示。在宏观压痕实验中,使用探针拉伸膜,该膜在 1.4 mN 的力下破裂,同时保持附着在插入物16 上。
应该注意的是,提升完整膜的成功率与嵌件的材料和后处理有关。在该方案中,使用所用填料打印的小室提升的膜中有 95% 适合细胞接种,而使用类似填料时为 74%。我们推测,疏水相互作用和范德华力有助于粘附力,因此改变材料特性会改变粘附力的强度。膜不能很好地粘附在亲水性材料上这一事实进一步支持了这一点(数据未显示)。
FN 丝膜细胞培养的代表性结果
在膜的顶端或基底侧培养的角质形成细胞 (HaCaT) 的免疫荧光图像如图 5 所示。观察到粘附的细胞(图 5D.i)在第 1 天均匀覆盖培养区域,同时获得典型的角质形成细胞鹅卵石形态(图 5A.i-B.i)。 在第 3 天,角质形成细胞建立了一个汇合层(图 5A.ii-B.ii)并形成了一个紧密连接网络(图 5D.ii),表明它们承担了生理上皮功能。在 FN 丝基质15、17、23、24 中实现的高水平细胞活力也存在于本文描述的丝膜插入物培养设置中。培养 3 天后,角质形成细胞仍然具有高度活力(图 5C.i-iv)。此外,在中心(图 5C.i-ii)和膜外围(图 5C.iii-iv)之间未观察到死细胞分布的差异,表明插入材料对 HaCaT 的活力没有显着影响。总体而言,丝插入培养系统提供了与商业 PET 膜插入系统相似(图 5i-ii、v-vi)的角质形成细胞活力(图 5i-ii、v-vi),如果不是改进(图 5iii-iv、vii-viii)。
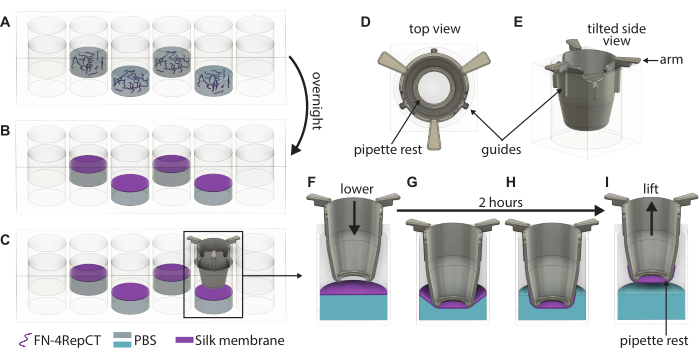
图 1:单个 FN 丝膜的形成和提升的详细图示。 (A) 在 48 孔板中每隔一个孔(避免外行/列)填充 FN 丝蛋白溶液,其中 (B) 它在液-气界面处自组装成膜过夜。(C) 用一把镊子抓住插入物,然后使用 3D 打印插入物上的 (D,E) 导轨将其缓慢降低到膜上,以确保插入物垂直于膜降低。丝膜粘附的放大倍率显示插入物 (F) 在膜正上方的横截面,以及 (G) 接触丝膜时的横截面。在 2 小时的孵育期内,(H) 丝膜自发附着在插入物上,然后 (I) 用于从界面上提起膜。缩写:FN = 纤连蛋白;PBS = 磷酸盐缓冲盐水。 请单击此处查看此图的较大版本。
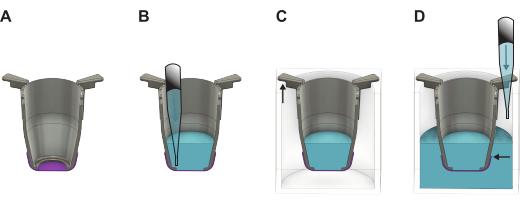
图 2:详细插图显示了从形成板中取出 FN 丝膜后如何处理 FN-silk 膜。 (A) 提升后直接带有膜(紫色)的插入物(灰色)。(B) 在膜的顶端添加液体(蓝色),然后将其放置在 (C) 24 孔板中,其中插入臂的较长部分悬挂在壁上,较短的部分保持插入管位于板的中心。(D) 将液体加入孔中,确保液位平衡并高于膜边缘。 请单击此处查看此图的较大版本。

图 3:3D 打印嵌件的照片。 (A) 从 3D 打印机中取出后,嵌件仍附着在构建板上。(B) 从构建板上取下后,在破坏支撑之前,一个插件。(C) 移除支撑后的 1 个插件。 请单击此处查看此图的较大版本。
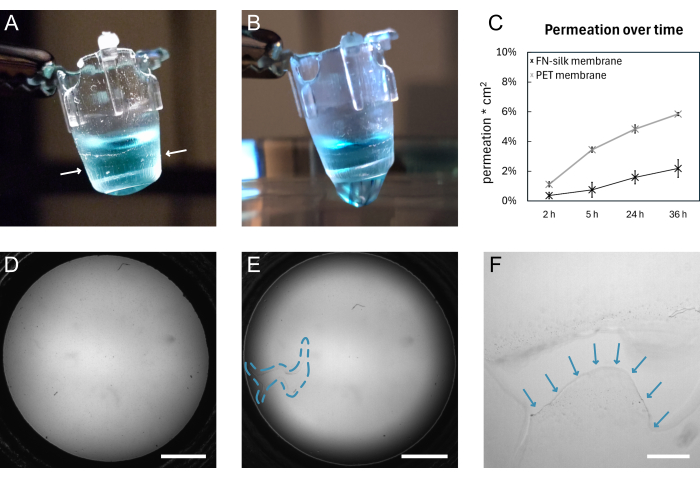
图 4:断裂前后的 FN 丝膜。 (A) 顶端携带 200 μL 染色(蓝色)PBS 的完整膜的照片。包裹在插入物周围的膜边缘用白色箭头表示。(B) 撕裂后同一膜的照片。PBS 通过膜渗漏。(C) 图显示了 3 kDa 荧光分子在 36 小时内通过丝膜或市售 PET 膜在标准细胞培养条件下保存 9 天的渗透性。(D) 撕裂前膜的明场图像。(E) 撕裂后同一膜的明场图像。缺陷区域由蓝色虚线轮廓表示。 (F) D 所示撕裂的放大视图,撕裂膜的边缘由蓝色箭头表示。比例尺 = 1 毫米 (D,E),200 微米 (F)。缩写:FN = 纤连蛋白;PBS = 磷酸盐缓冲盐水;PET = 聚对苯二甲酸乙二醇酯。 请单击此处查看此图的较大版本。
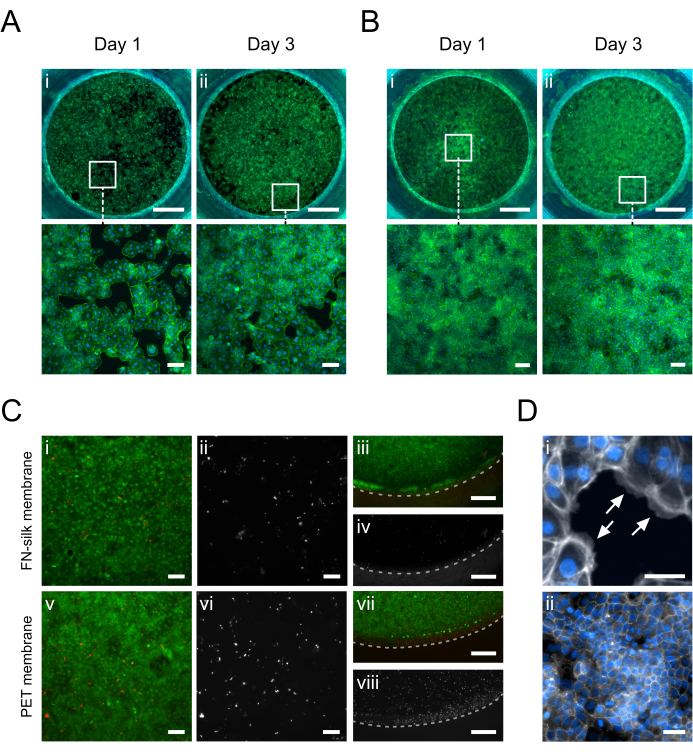
图 5:在 FN 丝膜上培养的角质形成细胞 (HaCaT)。在第 1 天,角质形成细胞粘附并均匀覆盖顶端 (A.i) 或基底侧 (B.i) 的膜表面积(鬼笔环肽,绿色)。在第 3 天,在顶端 (A.ii) 或基底 (B.ii) 侧(鬼笔环肽,绿色)建立汇合的单层。(C) 与细胞层中心 (i, ii, v, vi) 和外围 (iii, iv, vii, viii) 的市售 PET 膜 (v-viii) 相比,丝膜 (i-iv) 上的细胞活力评估。活细胞以绿色 (i, iii, v, vii) 显示,死细胞以红色 (i, iii, v, vii) 或白色 (ii, iv, vi, viii) 显示。虚线标记膜插入室间期。(D) 放大细节,(i) 表示(白色箭头)细胞粘附在膜上(鬼笔环肽,白色)和 (ii) 培养 3 天后形成的紧密连接网络(ZO-1,白色)。比例尺 = 1 mm(顶行:A、B)、100 μm(底行:A、B、CI、II、V、VI)、500 μm(C iii、iv、vii、viii)、50 μm (D)。请单击此处查看此图的较大版本。
表 1:将膜整合到细胞培养小室中的先前工作概述。 缩写:PCL = 聚己内酯;PEGDA = 聚(乙二醇)二丙烯酸酯;PLGA = 聚(乳酸-羟基乙酸共聚物);PDMS = 聚二甲基硅氧烷;PC = 聚碳酸酯;RSS = 重组蜘蛛丝蛋白;PLCL = 聚(丙交酯-己内酯共聚物);RHSIF = 重组盲鳗粘液中间丝蛋白 请点击此处下载此表格。
表 2:总结了在 FN 丝膜上培养的不同细胞类型的先前工作概述。 FN-4repCT (FN-silk) 是 Euprosthenops australis 的拉索丝的简称,它在基因水平上用纤连蛋白的 RGD 基序重组生产和功能化。这种蛋白质用于此处总结的所有情况。 请点击此处下载此表格。
表 3:故障排除。请点击此处下载此表格。
补充文件 1:用于 3D 打印嵌件的设计文件 (.stl)。请点击此处下载此文件。
补充文件 2:使用材料表中指定的打印机和树脂时的打印、后处理和灭菌方案。请点击此处下载此文件。
补充图 S1:将 FN-silk 溶液放入 48 孔板时建议使用的模式示意图。请点击此处下载此文件。
讨论
本文描述的方案概述了一种制备生物学相关细胞培养插入物的简单方法。它从打印插入片段开始,然后是 FN 丝膜的形成和附着,最后展示了细胞如何在膜的顶端和基底侧接种。该方案中有一个真正关键的步骤是确保细胞培养的长期成功,那就是将插入物降低和提升到膜上。成功执行这些步骤将产生能够承受细胞培养的丝膜插入培养系统,类似于具有合成膜的市售系统。为了确保这一点,在定制设计的嵌件的侧面安装了导轨,以防止它们在井中倾斜下降或侧向移动,这会导致膜粘附不均匀,产生薄弱点并随后泄漏。第一次遵循协议时出现小问题是很常见的。为了帮助新用户规避这些问题,如果他们在遵循上述协议时遇到这些问题,我们在 表 3 中概述了潜在问题及其解决方案。
膜本身已被证明有利于模拟不同的屏障组织(如 表 2 中概述);然而,应该指出的是,用于打印此处插入片段的树脂尚未对其对其他细胞类型活力的影响进行广泛测试。虽然到目前为止我们还没有遇到任何此类问题,但树脂可能会对一些敏感细胞的活力和生长产生负面影响。因此,建议进行类似于此处介绍的活力测试,以验证填料与所用每种细胞类型的相容性。如果出现细胞毒性,应建立更彻底的固化和/或浸出方案,以防止未固化的单体随着时间的推移而浸出并伤害细胞。可以在 补充文件 2 中找到这种方案的示例,该方案用于打印该方案中用于打印插入片段的树脂。该方案以前已用于制备用于在丝膜上培养 bEnd.3 脑内皮细胞长达 8 天的插入片段15。
本研究中介绍的方法的主要优点是,它提供了一种简单的方法来替换组织培养插入物上的当前塑料膜,从而改善静态组织培养模型。主要限制是用户需要使用 3D 打印设备或在设施中购买时间来打印他们的插页。然而,如有必要,可以通过在去除膜后使用市售组织培养插入物来规避这种情况。此外,虽然丝膜本质上可以用作常规的组织培养插入物,但它们更薄且具有蛋白质成分,因此比目前的合成商业同类产品更敏感。因此,它们需要用户更小心地处理,并且需要保持湿润以保持其弹性。应该注意的是,膜可以承受拉伸和充气16,17,使其适用于模拟呼吸运动等。即便如此,新用户很可能会在初始阶段破坏一些膜,但随着他们的膜处理经验的增加,预计成功率会提高。如果问题仍然存在,用户应参考表 3 进行故障排除。
在过去的十年中,已经提出了几种商业塑料插入物的替代品(表 1),每次比较细胞培养物的性能时,新的、更具生物学相关性的膜都比商业塑料膜产生更好的结果 2,5,6,7,14,22。这主要体现在增强的屏障功能方面 2,5,6,7,14,22,但也体现在形成更像天然的细胞生长14 和在共培养系统中通过膜的相互作用增加 7 .以前在建立血管壁模型时,FN 丝膜已经观察到了这种趋势。在这项研究中,HDMEC 和平滑肌细胞 (SMC) 生长在膜的相对两侧。结果表明,与市售 PET 膜相比,SMC 在 FN 丝膜上与 HDMEC 共培养时分泌更厚的 ECM。同样,HDMEC 在 FN 丝膜上建立了更紧密的屏障17。细胞培养结果的改善可能是由于细胞通讯的改善和更多的体内类似培养条件。FN 丝膜在厚度、结构和机械性能方面更接近天然 BM。天然 BM 在 20 nm 到 3 μm 之间,薄 22 英寸,PET 膜为 10 μm,FN 丝膜约为 1 μm,因此完全属于天然范围。FN 丝膜的结构也是纳米纤维16,就像天然 BM22 一样,而 PET 膜由带有轨迹蚀刻孔的塑料组成,直径通常在 0.4 μm 到 8 μm之间 7。PET 膜的刚性也比 BM 高得多,杨氏模量约为 2 GPa,而 BM 的模量范围为 kPa 至 MPa,但通常约为 250-500 kPa22。FN 丝膜的杨氏模量为 115 kPa16,属于天然条件。还应该注意的是,一旦细胞在膜上生长,它们的强度就成为主导因素,而不是膜本身17。最后,还应该注意的是,FN 丝蛋白的集成功能化确保细胞直接粘附在膜上,因此不需要涂层。对于 PET 膜,通常标配的是涂覆 ECM 蛋白以确保适当的细胞粘附7。
当将 FN 丝膜与用于替代 PET 膜的其他方法进行比较时(如 表 1 所示),我们方法的主要优点是使用重组生产的功能化丝蛋白。这确保了可重复性和确定的培养条件,与其他基于蛋白质的动物源性材料(如胶原蛋白)相比。再次注意,蛋白质的功能化确保不需要涂层,因为细胞可以很好地粘附在膜上,因为它是17。此外,本文描述的丝基膜的生产基于自组装,不需要任何复杂的设置或使用刺激性化学品,这与许多其他依赖于静电纺丝的技术不同。膜自发粘附到小室上,也无需与两部分小室、胶合和硅安装环相关的手动操作,从而简化了放大,并在任何实验室中实现轻松的可重复性。除了简单的生产外,我们的方法还很容易适应用户的实验需求,因为可以使用不同的插入材料,并且可以通过调整初始溶液的丝浓度来调整膜厚度16。最后,据我们所知,该方案可以产生迄今为止附着在组织培养插入物上的最薄的独立膜,从而与天然基底膜最相似。
这里介绍的丝膜形成和处理方案对于习惯于在细胞培养实验室中使用组织培养小室的任何人来说都很容易使用。这是一种从塑料膜过渡到更像 体内的简单方法,它允许使用各种类型的细胞生成更相关的组织模型(表 2)。丝膜可以支持其顶端或基底侧的细胞培养以及双侧不同细胞类型的共培养17。在丝膜上开发的屏障组织模型可用于与组织培养插入物相同的应用范围,包括药物筛选以及渗透和感染研究。对于不同细胞类型之间的串扰值得关注的情况,由于它们在 体内更相似的特性,它们已被证明优于 TC 插入片段17。
披露声明
L.G. 为 Spiber Technologies AB 工作,M.H. 拥有该公司的股份,该公司生产 FN 丝蛋白。
致谢
作者要感谢 Spiber Technologies AB 提供重组功能化蜘蛛丝蛋白,感谢 Eline Freeze 打印大部分 3D 打印插入物。
材料
| Name | Company | Catalog Number | Comments |
| CHEMICALS | |||
| Alexa Fluor 488 | Invitrogen; Thermo Fisher Scientific | A-21121 | Goat anti-mouse, Dilution 1:500 |
| Alexa Fluor 488 Phalloidin | Invitrogen; Thermo Fisher Scientific | A12379 | Dilution 1:400 |
| anti-ZO-1 (1A12) antibody | Invitrogen; Thermo Fisher Scientific | 33-9100 | Mouse anti-human, Monoclonal, Dilution 1:200 |
| Dextran, Alexa Fluor 680; 3,000 MW, Anionic | Invitrogen; Thermo Fisher Scientific | D34681 | Diluted 2,5% (w/v) in 200 ul of culture medium |
| DMEM/F-12 | Gibco; Thermo Fisher Scientific | 31330095 | Supplemented with 5% v/v FBS and 1% v/v Penicillin-Streptomycin |
| Ethanol | Solveco | 1326 | 70% (CAS-no 64-17-5) |
| Fetal Bovine Serum, qualified, heat inactivated, United States | Gibco; Thermo Fisher Scientific | 16140071 | |
| FN-silk | Spiber technologies AB | Store at -80 °C | |
| Isopropanol, EMPARTA ACS analytical reagent | Supelco | 1096342511 | ≥99.5% (CAS-no 67-63-0) |
| Live/Dead Viability/Cytotoxicity Kit | Invitrogen; Thermo Fisher Scientific | L3224 | |
| PBS | Swedish Veterinary Agency / Statens veterinärmedicinska anstalt | 992420 | without Ca and Mg, filtered |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco; Thermo Fisher Scientific | 11548876 | |
| MATERIAL | |||
| Dental LT Clear Resin | Denthouse | #DLCL-01 | |
| HaCaT cells | CLS | 300493 | |
| Nunc Cell-Culture Treated Multidishes 24-well | Fisher Scientific | 10604903 | |
| Nunc Cell-Culture Treated Multidishes 48-wel | Fisher Scientific | 10644901 | |
| TC insert, for 24-well plates, PET, transparent | Sarstedt | 83.3932.041 | pore size: 0.4 µm |
| ThinCert Cell Culture Inserts, translusent membrane (PET) | Greiner | 662640 | pore size: 0.4 µm |
| EQUIPMENT | |||
| EVOM meter with chopsticks | World Precision Instruments (WPI) Germany, GMBH | ||
| Form 3B | FormLabs | ||
| Form Wash | FormLabs | ||
| Form Cure | FormLabs | ||
| Isotemp General Purpose Deluxe Water Baths | Fisherbrand | ||
| Inverted fluorescence microscope Eclipse Ti | Nikon | ||
| Inverted fluorescence microscope DMI6000 B | Leica | ||
| Laminar flow hood Ninosafe, class II | Labolutions | ||
| Midi CO2 Incubator, 40 L | Thermo Scientific |
参考文献
- Kumar, P., Kedaria, D., Mahapatra, C., Mohandas, M., Chatterjee, K. A designer cell culture insert with a nanofibrous membrane toward engineering an epithelial tissue model validated by cellular nanomechanics. Nanoscale Adv. 3 (16), 4714-4725 (2021).
- Wang, Y., et al. Ultrathin and handleable nanofibrous net as a novel biomimetic basement membrane material for endothelial barrier formation. Colloids Surf B Biointerfaces. 219, 112775(2022).
- Jain, P., Rauer, S. B., Möller, M., Singh, S. Mimicking the natural basement membrane for advanced tissue engineering. Biomacromolecules. 23 (8), 3081-3103 (2022).
- Eom, S., Park, S. M., Han, S. J., Kim, J. W., Kim, D. S. One-step fabrication of a tunable nanofibrous well insert via electrolyte-assisted electrospinning. RSC Advances. 7 (61), 38300-38306 (2017).
- Kim, D., Eom, S., Park, S. M., Hong, H., Kim, D. S. A collagen gel-coated, aligned nanofiber membrane for enhanced endothelial barrier function. Sci Rep. 9 (1), 1-11 (2019).
- Ebrahim, N. A., et al. Porous honeycomb film membranes enhance endothelial barrier integrity in human vascular wall bilayer model compared to standard track-etched membranes. J Biomed Mater Res A. 111 (5), 701-713 (2023).
- Zakharova, M., et al. Transwell-integrated 2 µm thick transparent polydimethylsiloxane membranes with controlled pore sizes and distribution to model the blood-brain barrier. Advanced Materials Technologies. 6 (12), 2100138(2021).
- Park, S., et al. Use of elastic, porous, and ultrathin co-culture membranes to control the endothelial barrier function via cell alignment. Advanced Functional Materials. 31 (9), 2008172(2021).
- Youn, J., et al. Facile and adhesive-free method for bonding nanofiber membrane onto thermoplastic polystyrene substrate to fabricate 3D cell culture platforms. Materials Today Bio. 20, 100648(2023).
- Liu, H., et al. Electrohydrodynamic jet-printed ultrathin polycaprolactone scaffolds mimicking Bruch’s membrane for retinal pigment epithelial tissue engineering. Int J Bioprint. 8 (3), 550(2022).
- Dogan, A. A., Dufva, M. Customized 3D-printed stackable cell culture inserts tailored with bioactive membranes. Sci Rep. 12 (1), 1-12 (2022).
- Rohde, F., Danz, K., Jung, N., Wagner, S., Windbergs, M. Electrospun scaffolds as cell culture substrates for the cultivation of an in vitro blood–brain barrier model using human induced pluripotent stem cells. Pharmaceutics. 14 (6), 1308(2022).
- Slater, S. C., et al. An in vitro model of the glomerular capillary wall using electrospun collagen nanofibres in a bioartificial composite basement membrane. PLoS ONE. 6 (6), e20802(2011).
- Harris, T. I., et al. Utilizing recombinant spider silk proteins to develop a synthetic Bruch’s membrane for modeling the retinal pigment epithelium. ACS Biomater Sci Eng. 5 (8), 4023-4036 (2019).
- Hjelm, L. C., Hedhammar, M., Löfblom, J. In blood–brain barrier model based on recombinant spider silk protein nanomembranes for evaluation of transcytosis capability of biomolecules. Biochem Biophys Res Commun. 669, 77-84 (2023).
- Gustafsson, L., et al. Recombinant spider silk forms tough and elastic nanomembranes that are protein-permeable and support cell attachment and growth. Advanced Functional Materials. 30 (40), 2002982(2020).
- Tasiopoulos, C. P., Gustafsson, L., Van Der Wijngaart, W., Hedhammar, M. Fibrillar nanomembranes of recombinant spider silk protein support cell co-culture in an in vitro blood vessel wall model. ACS Biomater Sci Eng. 7 (7), 3332-3339 (2021).
- Marino, A., Baronio, M., Buratti, U., Mele, E., Ciofani, G. Porous optically transparent cellulose acetate scaffolds for biomimetic blood-brain barrier in vitro models. Front Bioeng Biotechnol. 9, 630063(2021).
- Schramm, R. A., Koslow, M. H., Nelson, D. A., Larsen, M., Castracane, J. A novel impedance biosensor for measurement of trans-epithelial resistance in cells cultured on nanofiber scaffolds. Biosensors. 7 (3), 35(2017).
- Qi, D., et al. Establishment of a human iPSC- and nanofiber-based microphysiological blood-brain barrier system. ACS Appl Mater Interfaces. 10 (26), 21825-21835 (2018).
- Rickabaugh, E., Weatherston, D., Harris, T. I., Jones, J. A., Vargis, E. Engineering a biomimetic in vitro model of Bruch’s membrane using hagfish slime intermediate filament proteins. ACS Biomater Sci Eng. 9 (8), 5051-5061 (2023).
- Choi, J. W., Youn, J., Kim, D. S., Park, T. E. Human iPS-derived blood-brain barrier model exhibiting enhanced barrier properties empowered by engineered basement membrane. Biomaterials. 293, 121983(2023).
- Widhe, M., Shalaly, N. D., Hedhammar, M. A fibronectin mimetic motif improves integrin mediated cell biding to recombinant spider silk matrices. Biomaterials. 74, 256-266 (2016).
- Johansson, U., et al. Assembly of functionalized silk together with cells to obtain proliferative 3D cultures integrated in a network of ECM-like microfibers. Sci Rep. 9 (1), 1-13 (2019).
- Widhe, M., Johansson, U., Hillerdahl, C. O., Hedhammar, M. Recombinant spider silk with cell binding motifs for specific adherence of cells. Biomaterials. 34 (33), 8223-8224 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。