Method Article
Mímica de membrana basal nanofibrilar feita de seda de aranha funcionalizada recombinante em inserções de cultura de tecidos feitas sob medida
Neste Artigo
Resumo
As inserções de cultura de tecidos com membranas plásticas são o padrão ouro em laboratórios de cultura de células como suportes permeáveis para estabelecer camadas celulares e modelos de tecidos de barreira. Aqui, apresentamos um método simples para substituir a membrana plástica por uma membrana mais biologicamente relevante feita de uma proteína de seda de aranha funcionalizada recombinante.
Resumo
A replicação de barreiras teciduais é fundamental para gerar modelos in vitro relevantes para avaliar novas terapêuticas. Hoje, isso é comumente feito usando inserções de cultura de tecidos com uma membrana plástica, que gera um lado apical e um basal. Além de fornecer suporte para as células, essas membranas estão longe de emular sua contraparte nativa, a membrana basal, que é uma matriz nanofibrilar à base de proteínas. Neste trabalho, mostramos uma maneira simples de melhorar consideravelmente a relevância biológica das inserções de cultura de tecidos, substituindo a membrana plástica por uma feita de uma proteína de seda de aranha funcionalizada recombinante pura. A membrana de seda se forma por meio de automontagem e adere espontaneamente a uma inserção de cultura de tecidos sem membrana, onde pode fornecer suporte para as células. As inserções de cultura de tecidos personalizadas podem ser impressas usando uma impressora 3D padrão, seguindo as instruções fornecidas no protocolo, ou as comerciais podem ser adquiridas e usadas. Este protocolo mostra como o sistema de cultura com membranas de seda em insertos é configurado e, posteriormente, como as mesmas técnicas de cultura celular que são usadas com insertos tradicionais disponíveis comercialmente podem ser implementadas.
Introdução
Modelos in vitro que podem replicar barreiras teciduais têm recebido atenção crescente devido à sua aplicabilidade no teste de novas terapêuticas e facilitando a compreensão dos mecanismos fundamentais da doença 1,2. Para recriar com precisão o microambiente nativo, é fundamental recapitular a função da membrana basal (BM), um complexo de matriz extracelular (MEC) altamente especializado. A MO existe em quase todos os tecidos do corpo humano, onde fornece suporte às células endoteliais e epiteliais e as separa do tecido subjacente 2,3. Além de fornecer suporte físico, o MO também regula e mantém os sinais bioquímicos entre as células e o tecido circundante. Essas funções vitais tornam necessário projetar andaimes que se assemelhem à estrutura, bem como às características mecânicas e funcionais do BM 3 nativo.
Uma das formas mais comuns de mimetizar a MO in vitro hoje é através do uso de inserções de cultura de tecidos disponíveis comercialmente (inserções TC). Trata-se essencialmente de cilindros plásticos com membrana permeável que divide a câmara em lados apicais e basolaterais 4,5. Embora fáceis de usar, as membranas em insertos comerciais são geralmente rígidas, gravadas em esteira e feitas de polímeros como poli(carbonato) (PC) e poli(tereftalato de etileno) (PET)3,4,6. Eles são flexíveis em termos de diâmetro, densidade de poros e tamanho e podem ser revestidos para melhorar a adesão celular, mas carecem de todas as outras características relevantes do BM, como espessura comparável6, porosidade interconectada, arquitetura fibrosa e módulo de elasticidade relevante3.
A padronização das inserções de TC e sua facilidade de uso inspiraram vários grupos, incluindo o nosso, a substituir a membrana plástica por uma contraparte mais in vivo (vista na Tabela 1). Os materiais utilizados variam de polímeros como Polidimetilsiloxano (PDMS)7, Poli(lactídeo-co-caprolactona) (PLCL)8 e policaprolactona (PCL)4,9,10 a materiais à base de proteínas, como gelatina 2,11,12, colágeno 5,13 e seda de aranha recombinante 14,15,16,17. As membranas desses materiais foram fixadas de várias maneiras, tanto em inserções disponíveis comercialmente das quais a membrana foi removida 4,7,8,10,12,13,14,16,18,19,20,21 , bem como a inserções personalizadas fabricadas por meio de impressão 3D 1,11,15,17,20 ou moldagem por injeção 9,22. No entanto, a maioria delas ainda está longe de se assemelhar à MO nativa em termos de espessura, onde as réplicas variam de centenas 11,18 a alguns micrômetros 5,10,14,21,22. Muitos deles também requerem métodos complexos de formação e/ou fixação manual 1,7,13,14,18,19,21, tornando desafiador o dimensionamento e a replicação em outros laboratórios.
Aqui, apresentamos um método simples para formar e anexar uma membrana de seda às inserções e mostramos como cultivar células em ambos os lados da membrana. As membranas de seda são formadas por meio da automontagem da proteína FN-4RepCT (FN-seda) na interface líquido-ar de uma solução permanente 16,17. FN-silk é uma versão curta produzida recombinantemente de Major Ampullulate Spidroin 1 de Euprosthenops australis, funcionalizado com um motivo RGD derivado de fibronectina23. Foi demonstrado que se monta em matrizes fibrilares que promovem a adesão, crescimento e migração celular 15,16,17,23,24,25. O método de fixação da membrana no inserto baseia-se na adesão espontânea e foi considerado adequado para insertos disponíveis comercialmente dos quais a membrana foi removida16, bem como insertos impressos em 3D de ácido polilático (PLA) 17 e Dental LT15. Este artigo detalha como esse método é usado para inserções impressas a partir de Dental LT. Depois que as membranas de seda FN foram fixadas às inserções, elas podem, em essência, ser tratadas como inserções comerciais padrão de cultura de tecidos. Em suma, apresentamos um método simples para gerar modelos in vitro mais relevantes de barreiras teciduais, substituindo as membranas plásticas por uma membrana FN-seda à base de proteínas.
Protocolo
1. 3D-impressão de inserções
- Baixe o arquivo . Arquivo de design STL (JoVe_Silk_Insert.stl) do Arquivo Suplementar 1.
- Prepare os arquivos para impressão abrindo-os no pacote de software dedicado à conversão de um arquivo . STL para um arquivo de impressão para a impressora 3D que está sendo usada.
- Use o software dedicado para adicionar suportes. A estrutura de suporte é projetada pelo software, e a quantidade necessária dependerá da impressora e do software que está sendo usado. Oriente a inserção de forma que nem a plataforma do edifício nem os suportes toquem na parte inferior.
- Imprima o número desejado de inserções usando uma resina biocompatível (como Dental LT ou BioMed) ou filamento (como PLA) adequado para a impressora 3D que está sendo usada.
NOTA: Certifique-se de que o material possa suportar um processo de esterilização adequado, como autoclavagem, irradiação ou submersão com etanol. - Retire as inserções impressas da plataforma de impressão e remova a estrutura de suporte impressa da peça acabada.
- Se estiver usando uma impressora de resina, processe as pastilhas usando o protocolo padrão fornecido pelo fabricante.
NOTA: O processamento pode variar dependendo de qual resina é usada. O protocolo usado para a resina usada aqui é fornecido no Arquivo Suplementar 2. - Esterilize as inserções usando uma técnica adequada ao material de sua escolha.
NOTA: As recomendações são autoclavagem, irradiação ou submersão em etanol a 70%, ou uma combinação dos mesmos. Se estiver usando uma impressora de resina, um extenso protocolo de lixiviação pode ser necessário para obter a biocompatibilidade ideal. Consulte o protocolo fornecido no Arquivo Suplementar 2 para obter uma recomendação. - Certifique-se de que as inserções estejam completamente secas e guarde-as estéreis até o uso.
2. Formação de membranas de seda FN
- Encha uma caixa com gelo seco e leve-a ao freezer a -80 °C.
- Recolha os frascos de seda FN do congelador a -80 °C e coloque-os em gelo seco para transporte. Leve os frascos de seda FN para um gabinete de segurança biológica e execute outras etapas lá. Coloque os frascos de seda FN em um suporte de tubo de microcentrífuga para descongelar sem tocá-los excessivamente.
- Enquanto a seda FN está descongelando, desembale a placa de 48 poços. Assim que a seda FN tiver descongelado completamente, prossiga para a próxima etapa em 10 minutos, de preferência o mais rápido possível.
- Diluir a solução de seda FN em PBS refrigerado ou à temperatura ambiente até à concentração desejada, de preferência 1,8 mg/ml. Pipete 550 μL de solução de seda FN diretamente no fundo de um poço vazio na placa de 48 poços. Pipetar a solução de seda FN até que o número desejado de membranas tenha sido preparado.
NOTA: Evite introduzir bolhas de ar e remova quaisquer bolhas de ar imediatamente com uma pipeta. Não use poços na Linha A ou F ou na coluna 1 ou 8, nem poços adjacentes (consulte o esquema na Figura Suplementar S1). - Coloque a tampa na placa de 48 poços e coloque-a dentro de uma caixa maior e estéril para fornecer um ambiente estéril durante a incubação.
- Mova cuidadosamente a caixa do gabinete de segurança biológica e deixe-a em condições ambientais em um local não perturbado sem fluxo de ar significativo durante a noite.
3. Aderindo membranas de seda FN às inserções
- No dia seguinte, leve as inserções estéreis para o gabinete de segurança biológica.
- Traga a grande caixa estéril contendo a placa de 48 poços com as membranas de seda FN de volta para o gabinete de segurança biológica e execute outras etapas lá. Levante cuidadosamente a placa de 48 poços da caixa grande e estéril.
- Verifique visualmente a formação da membrana observando a nebulosidade nos poços e abra a tampa da placa de 48 poços que contém as membranas. Pegue um inserto usando uma pinça estéril e guie o inserto para baixo na membrana até que as alças do inserto toquem a parte superior do poço, conforme mostrado na Figura 1. Mantenha a parte inferior da pastilha paralela à parte inferior da placa.
- Repita a etapa 3.3 até que as inserções tenham sido abaixadas em todas as membranas formadas. Coloque a tampa em cima da placa de 48 poços e, em seguida, coloque a placa de volta na caixa estéril. Deixe a placa intacta por 2 h em condições ambientais para permitir que as membranas adiram às inserções.
- Pré-aqueça o meio de crescimento ou PBS a 37 °C.
- Desembale uma placa de 24 poços.
- Depois de 2 h, remova a placa de 48 poços da caixa e abra a tampa. Usando uma pinça estéril, segure uma inserção pelas alças e retire-a da placa de 48 poços.
- Imediatamente após o levantamento, encha o inserto com meio de cultura pré-aquecido ou PBS. Use 100 μL de meio de cultura se prosseguir com a semeadura lateral basal ou 200 μL se prosseguir com a semeadura lateral apical. Se as membranas forem armazenadas para uso posterior, use 200 μL de PBS.
PONTO DE VERIFICAÇÃO: Se o líquido for retido acima da membrana, o levantamento foi bem-sucedido. Se o líquido pingar na bancada, a membrana vaza e deve ser desconsiderada. - Coloque o inserto em um poço vazio da placa de 24 poços.
- Levante todas as inserções da placa de 48 poços e transfira-as para a placa de 24 poços. Encha os poços com 1.000 μL de meio de crescimento se prosseguir com a semeadura de células ou PBS para armazenamento, mantendo a placa ligeiramente inclinada.
NOTA: É importante que a borda da membrana esteja abaixo do nível do líquido (Figura 2). - Se as células forem semeadas imediatamente, prossiga para a seção 4 ou 5, dependendo de qual lado da membrana as células serão semeadas. Caso contrário, coloque a tampa na placa de 24 poços e coloque-a na geladeira (4 °C) ou em uma incubadora a 37 °C. Se colocado na incubadora, reabasteça o PBS a cada dois dias para garantir que o volume necessário seja mantido.
4. Semeadura celular no lado apical da membrana
NOTA: Se as membranas tiverem sido armazenadas em PBS, substitua o PBS por meio de cultura pré-aquecido conforme descrito na seção 6.
- Colha as células. Prepare a suspensão celular de modo que o número desejado de células por membrana esteja presente em 20-50 μL da suspensão. Ressuspenda para atingir a concentração celular desejada.
- Usando uma pipeta P100 ou P200, aspire 20-50 μL da suspensão celular. Apontando a ponta da pipeta para o centro da membrana, mantenha a ponta a 1-2 mm de distância da superfície do meio de cultura dentro do inserto e pressione lentamente o êmbolo da pipeta para criar uma gota na borda da ponteira. Coloque a gota em contato com o meio de cultura dentro da inserção.
NOTA: Mantenha a pipeta perpendicular à superfície de trabalho. - Repita a etapa 4.2 para as membranas restantes. Ressuspenda o estoque de células após semear cinco membranas para garantir uma distribuição celular homogênea. Mova a placa em um padrão em forma de oito para garantir uma melhor distribuição celular na membrana.
- Cultivar em condições normais (37 °C e 5% de CO2) e mudar de meio de dois em dois dias.
5. Semeadura celular no lado basal da membrana
NOTA: Se as membranas foram armazenadas em PBS, substitua o PBS por 100 μL de meio de crescimento pré-aquecido e encha os poços com 1 mL de meio de crescimento pré-aquecido conforme descrito na seção 6.
- Colha as células e prepare a suspensão celular de modo que o número desejado de células por membrana esteja presente em 20 μL da suspensão. Ressuspenda para atingir a concentração celular desejada.
- Desembale e abra a tampa de uma placa de Petri. Certifique-se de que a altura da placa de Petri seja suficiente para acomodar as inserções sem que o fundo toque na tampa.
- Usando uma pinça, levante o inserto da placa de 24 poços, deixando o meio de cultura nos poços. Usando um conjunto de pinças em cada mão, inverta a inserção de modo que o lado basal fique voltado para cima e o lado apical fique voltado para a área de trabalho. Coloque o inserto invertido na placa de Petri como na Figura 3C. Repita para as inserções restantes.
NOTA: Não remova o meio de cultura do lado apical. Ele manterá a membrana úmida durante a incubação. - Ressuspenda o estoque de células para garantir uma distribuição uniforme das células na solução e aspire 20 μL da suspensão celular com uma pipeta P100 ou P200. Apontando a ponta da pipeta para o centro da membrana, mantenha a ponta a 1-2 mm de distância da membrana e pressione lentamente o êmbolo da pipeta para criar uma gota na borda da ponteira. Mantenha a pipeta perpendicular à superfície da membrana e deixe a gota cair sobre a membrana. Repita para as membranas restantes.
NOTA: Ressuspenda o estoque de células após semear cinco membranas para garantir uma distribuição uniforme das células. - Coloque a tampa na placa de Petri, traga a placa de Petri e a placa de 24 poços para a incubadora e incube as inserções com as células em condições padrão (37 °C e 5% CO2) por 30 min.
- Traga a placa de 24 poços contendo o meio de cultura e a placa de Petri para o gabinete de segurança biológica. Abra as duas tampas e, usando um conjunto de pinças em cada mão, pegue uma inserção e inverta-a de modo que o lado apical da membrana fique voltado para cima e o lado basal para baixo.
- Usando uma pipeta P200, adicione 200 μL de meio de cultura dentro do inserto. Coloque o inserto em um dos poços pré-preenchidos da placa de 24 poços e repita para as membranas restantes.
- Cultivar em condições normais (37 °C e 5% de CO2) e mudar de meio de dois em dois dias.
6. Mudança média de culturas em condições submersas
- Prepare uma nova placa de 24 poços com o meio de cultura fresco adicionando 1.000 μL/poço. Usando uma pinça, levante uma inserção da placa de 24 poços, incline-a levemente e remova o meio do lado apical.
- Adicione 200 μL de meio de cultura fresco dentro do inserto. Coloque a inserção em um poço pré-preenchido com meio de cultura fresco. Repita para todas as membranas.
7. Mudança média de culturas em condições de transporte aéreo
- Usando uma pinça, levante o inserto e coloque-o em um poço vazio de uma placa de 24 poços. Repita para mais quatro membranas.
- Incline levemente a placa de 24 poços e adicione lentamente 1.000 μL de meio de cultura fresco dentro de cada poço de placa. Repita para as membranas restantes.
8. Medição da resistência elétrica transepitelial (TEER)
- Prepare uma placa de 24 poços com 1.000 μL de meio de cultura ou PBS dentro dos poços e transfira as membranas para dentro dela. Certifique-se de ter 200 μL da solução correspondente acima da membrana.
- Usando um conjunto de pinças, estabilize bem o inserto dentro da placa pressionando suavemente os braços do inserto. Sem remover a pinça, insira o eletrodo TEER no poço e registre a medição.
- Remova o eletrodo e levante a pinça.
- Repita as etapas 8.2 a 8.3 para as membranas restantes.
Resultados
Fotografias representativas das inserções
Fotografias das inserções antes e depois da liberação da plataforma de impressão são mostradas na Figura 3A, B. Uma imagem de uma pastilha acabada da qual o suporte foi removido é mostrada na Figura 3C. O resultado é um lote de inserções impressas em 3D, prontas para esterilização e uso subsequente.
Elevação e manuseio de membranas de seda FN
Um esquema geral da formação da membrana de seda FN e do levantamento manual é mostrado na Figura 1. O resultado é uma série de inserções com uma membrana de seda FN anexada. Para garantir a maior taxa de sucesso com o levantamento de membranas intactas, as etapas descritas no protocolo devem ser seguidas com precisão. A Figura 4 mostra fotografias de uma membrana intacta (A, D) e após o rompimento (B, E, F). A ruptura pode ser visualizada com o uso de microscopia de campo claro (Figura 4E,F) e/ou pelo gotejamento de líquido através da membrana (Figura 4B). É importante levantar e abaixar as inserções perpendicularmente à membrana, para garantir que a membrana adira uniformemente e se estique abaixo das inserções. A adesão da membrana pode ser observada visualmente, conforme mostrado na Figura 4A. Se o inserto for abaixado conforme as instruções e os níveis de líquido forem mantidos conforme mostrado na Figura 2, a membrana permanecerá presa ao inserto por longos períodos de cultura.
Aqui, a fixação da membrana ao inserto é validada pela realização de um experimento de permeação 15,16,17 em membranas que foram mantidas sob condições padrão de cultura de células por 9 dias. Resumidamente, ao adicionar uma molécula fluorescente no topo da membrana e medir o sinal na solução abaixo, o perfil de permeação das membranas de seda segue o de um inserto de cultura de tecidos disponível comercialmente (Figura 4C), não mostrando vazamento ao longo de 36 h de permeação e indicando que a membrana permanece intacta e presa ao inserto. Experimentos semelhantes foram conduzidos anteriormente com células semeadas em um15 ou ambos os lados da membrana de seda17. A força da adesão já foi demonstrada anteriormente usando macro indentação16 e testes de inflação16,17. Nos experimentos de macro indentação, um estilete foi usado para esticar a membrana, que se rompeu sob uma força de 1,4 mN, permanecendo presa ao inserto16.
Deve-se notar que a taxa de sucesso do levantamento de membranas intactas está relacionada ao material e ao pós-tratamento das inserções. Com este protocolo, 95% das membranas levantadas usando inserções impressas com a resina usada foram apropriadas para a semeadura celular, em comparação com 74% quando uma resina comparável foi usada. Especulamos que a adesão é auxiliada por interações hidrofóbicas e forças de van der Waals e, portanto, alterar as propriedades do material altera a força da adesão. Isso é ainda mais apoiado pelo fato de que as membranas não aderem bem a materiais hidrofílicos (dados não mostrados).
Resultados representativos da cultura de células nas membranas FN-seda
Imagens de imunofluorescência de queratinócitos (HaCaT) cultivados no lado apical ou basal da membrana são mostradas na Figura 5. Observou-se que as células aderidas (Figura 5D.i) cobriam uniformemente a área de cultura no Dia 1 enquanto adquiriam a morfologia típica de paralelepípedos de queratinócitos (Figura 5A.i-B.i). No dia 3, os queratinócitos estabeleceram uma camada confluente (Figura 5A.ii-B.ii) e formaram uma rede de junções apertadas (Figura 5D.ii), indicando que estavam assumindo funções epiteliais fisiológicas. Os altos níveis de viabilidade celular alcançados nas matrizes FN-seda 15,17,23,24 também foram apresentados na configuração de cultura de inserção de membrana de seda aqui descrita. Após 3 dias em cultura, os queratinócitos permaneceram altamente viáveis (Figura 5C.i-iv). Além disso, não foi observada diferença na distribuição de células mortas entre o centro (Figura 5C.i-ii) e a periferia da membrana (Figura 5C.iii-iv), não revelando nenhum efeito significativo do material de inserção na viabilidade do HaCaT. No geral, o sistema de cultura de inserção de seda ofereceu uma viabilidade semelhante (Figura 5i-ii, v-vi), se não melhorada (Figura 5iii-iv, vii-viii) de queratinócitos com a de um sistema comercial de inserção de membrana PET.
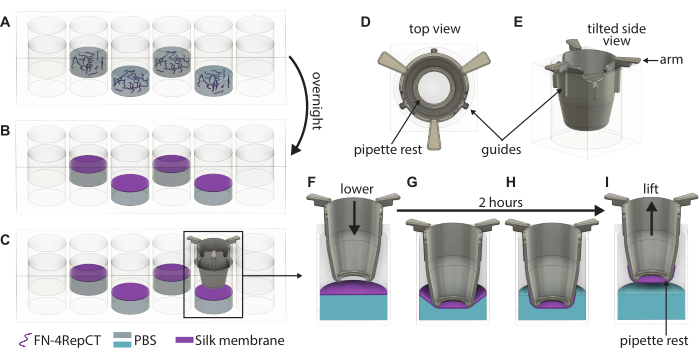
Figura 1: Ilustração detalhada da formação e elevação de membranas de seda FN singulares. (A) Encha a cada segundo poço (evite a linha / coluna externa) em uma placa de 48 poços com solução de proteína de seda FN onde (B) ela se auto-monta em uma membrana na interface líquido-ar durante a noite. (C) Pegue a inserção com uma pinça e abaixe-a lentamente sobre a membrana usando as guias (D,E) na inserção impressa em 3D para garantir que a inserção seja abaixada perpendicularmente à membrana. Ampliação da adesão da membrana de seda mostrando uma seção transversal da inserção (F) logo acima da membrana e (G) ao tocar a membrana de seda. Durante o período de incubação de 2 h, (H) a membrana de seda se liga espontaneamente à inserção, que é então (I) usada para levantar a membrana da interface. Abreviaturas: FN = fibronectina; PBS = solução salina tamponada com fosfato. Clique aqui para ver uma versão maior desta figura.
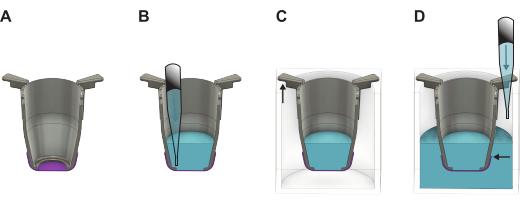
Figura 2: Ilustração detalhada mostrando como manusear a membrana de seda FN depois de levantá-la da placa de formação. (A) A inserção (cinza) com a membrana (roxo) logo após o levantamento. (B) Líquido (azul) é adicionado no lado apical da membrana, que então é colocado em uma placa (C) de 24 poços onde a parte mais longa dos braços da inserção fica pendurada nas paredes e a parte mais curta mantém a inserção posicionada no centro da placa. (D) O líquido é adicionado ao poço, garantindo que o nível do líquido esteja equilibrado e acima da borda da membrana. Clique aqui para ver uma versão maior desta figura.

Figura 3: Fotografias das inserções impressas em 3D. (A) As inserções diretamente após serem removidas da impressora 3D, ainda presas à placa de impressão. (B) Uma pastilha após ser removida da placa de impressão, antes de quebrar os suportes. (C) Uma inserção após a remoção dos suportes. Clique aqui para ver uma versão maior desta figura.
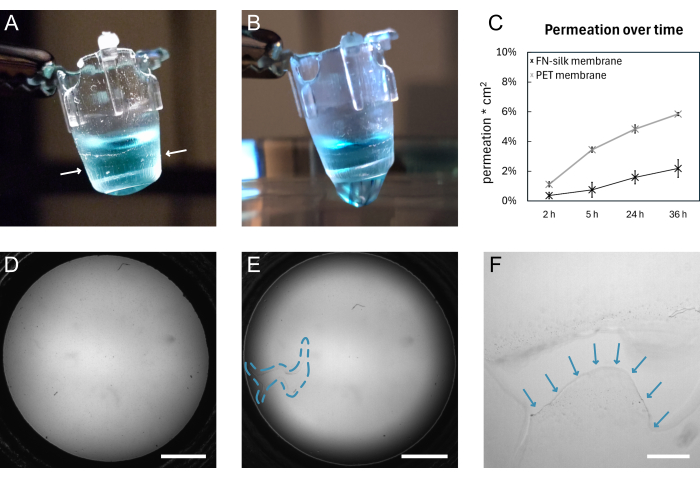
Figura 4: Uma membrana de seda FN antes e depois da quebra . (A) Fotografia de uma membrana intacta carregando 200 μL de PBS tingido (azul) no lado apical. A borda da membrana enrolada ao redor da inserção é indicada por setas brancas. (B) Fotografia da mesma membrana após o rompimento. O PBS está vazando através da membrana. (C) Gráfico mostrando a permeação de uma molécula fluorescente de 3 kDa durante 36 h através de uma membrana de seda ou de uma membrana PET disponível comercialmente, mantida em condições padrão de cultura de células por 9 dias. (D) Imagem de campo claro de uma membrana antes de rasgar. (E) Imagem de campo claro da mesma membrana após o rompimento. A área defeituosa é indicada pelo contorno tracejado azul. (F) Vista ampliada do rasgo mostrado em D com a borda da membrana rasgada indicada por setas azuis. Barras de escala = 1 mm (D,E), 200 μm (F). Abreviaturas: FN = fibronectina; PBS = solução salina tamponada com fosfato; PET = poli(tereftalato de etileno). Clique aqui para ver uma versão maior desta figura.
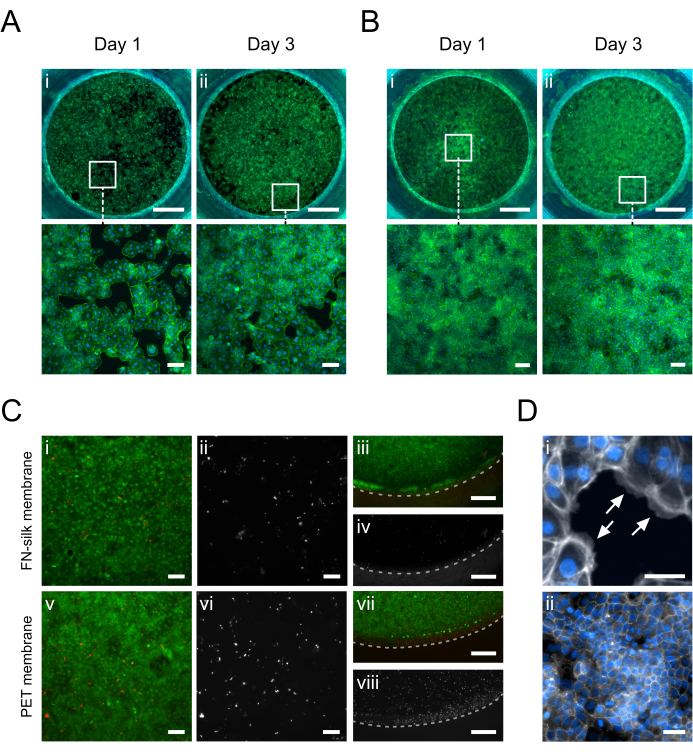
Figura 5: Queratinócitos (HaCaT) cultivados na membrana FN-seda. No dia 1, os queratinócitos aderiram e cobriram uniformemente a área da superfície da membrana no lado apical (IA) ou basal (II) (faloidina, verde). No dia 3, uma monocamada confluente é estabelecida no lado apical (A.ii) ou basal (B.ii) (faloidina, verde). (C) Avaliação da viabilidade celular na membrana de seda (i-iv) em comparação com uma membrana PET comercial (v-viii) no centro (i, ii, v, vi) e periferia (iii, iv, vii, viii) da camada celular. As células vivas são mostradas em verde (i, iii, v, vii) e as células mortas em vermelho (i, iii, v, vii) ou branco (ii, iv, vi, viii). A linha tracejada marca a interfase membrana-inserção. (D) Ampliado em detalhes, (i) indicando (setas brancas) adesão celular à membrana (faloidina, branca) e (ii) uma rede de junção apertada formada após 3 dias em cultura (ZO-1, branco). Barras de escala = 1 mm (linha superior: A,B), 100 μm (linha inferior: A,B,Ci, ii, v, vi), 500 μm (C iii, iv, vii, viii), 50 μm (D). Clique aqui para ver uma versão maior desta figura.
Tabela 1: Visão geral de trabalhos anteriores em que as membranas foram integradas em inserções de cultura de células. Abreviaturas: PCL = policaprolactona; PEGDA = diacrilato de poli (etilenoglicol); PLGA = poli(ácido lático-co-glicólico); PDMS = Polidimetilsiloxano; PC = Policarbonato; RSS = Proteína recombinante da seda da aranha; PLCL = Poli(lactídeo-co-caprolactona); RHSIF = Proteínas de filamento intermediário de lodo de peixe-bruxa recombinante Clique aqui para baixar esta tabela.
Tabela 2: Visão geral do trabalho anterior resumindo os diferentes tipos de células cultivadas nas membranas FN-seda. FN-4repCT (FN-silk) é uma versão curta da seda de arrasto de Euprosthenops australis, que é produzida e funcionalizada de forma recombinante com um motivo RGD de fibronectina em nível genético. Esta proteína é usada em todos os casos resumidos aqui. Clique aqui para baixar esta tabela.
Tabela 3: Solução de problemas. Clique aqui para baixar esta tabela.
Arquivo Suplementar 1: Arquivo de design (.stl) para impressão 3D das inserções. Clique aqui para baixar este arquivo.
Arquivo suplementar 2: Protocolo para impressão, pós-tratamento e esterilização ao usar a impressora e a resina especificadas na Tabela de Materiais. Clique aqui para baixar este arquivo.
Figura S1 suplementar: Esquema do padrão sugerido para uso ao colocar a solução de seda FN na placa de 48 poços. Clique aqui para baixar este arquivo.
Discussão
O protocolo aqui descrito descreve uma maneira simples de fazer inserções de cultura de células biologicamente relevantes. Começa com a impressão das inserções, seguida pela formação e fixação das membranas de seda FN e termina mostrando como as células podem ser semeadas nos lados apical e basal da membrana. Há uma etapa verdadeiramente crítica neste protocolo para garantir o sucesso a longo prazo com culturas de células e é o abaixamento e levantamento das inserções na membrana. A execução bem-sucedida dessas etapas produzirá um sistema de cultura de inserção de membrana de seda capaz de resistir à cultura de células de forma semelhante aos sistemas comercialmente disponíveis com membranas sintéticas. Para garantir isso, foram implementados trilhos-guia nas laterais das inserções personalizadas para evitar que sejam abaixadas em ângulo ou movidas lateralmente no poço, o que levaria à adesão desigual da membrana, gerando pontos fracos e, posteriormente, vazamento. É comum que surjam pequenos problemas ao seguir um protocolo pela primeira vez. Para ajudar o novo usuário a contorná-los, caso ele os experimente ao seguir o protocolo apresentado acima, descrevemos os problemas potenciais e suas soluções na Tabela 3.
A própria membrana demonstrou ser benéfica para modelar diferentes tecidos de barreira (visão geral na Tabela 2); No entanto, deve-se ressaltar que a resina usada para imprimir as inserções aqui contidas não foi extensivamente testada quanto ao seu efeito sobre a viabilidade de outros tipos de células. Embora não tenhamos encontrado nenhum desses problemas até agora, é possível que a resina possa afetar negativamente a viabilidade e o crescimento de algumas células sensíveis. Recomenda-se, portanto, que um teste de viabilidade semelhante ao aqui apresentado seja realizado para verificar a compatibilidade da resina com cada tipo de célula utilizada. Se houver citotoxicidade, deve ser estabelecido um protocolo de cura e/ou lixiviação mais rigoroso para evitar que os monómeros não curados lixiviem com o tempo e prejudiquem as células. Um exemplo de tal protocolo, que foi usado para a resina usada para imprimir as inserções dentro deste protocolo, pode ser encontrado no Arquivo Suplementar 2. Esse protocolo já foi usado anteriormente para preparar inserções para cultura de bEnd.3 endotelial cerebral em membranas de seda por até 8 dias15.
O principal benefício do método apresentado neste trabalho é que ele oferece uma maneira simples de substituir as membranas plásticas atuais em insertos de cultura de tecidos e, como tal, melhorar os modelos estáticos de cultura de tecidos. A principal limitação é que o usuário precisa ter acesso a equipamentos de impressão 3D ou comprar tempo em uma instalação para imprimir suas inserções. No entanto, se necessário, isso pode ser contornado usando inserções comerciais de cultura de tecidos após a remoção de suas membranas. Além disso, embora as membranas de seda, em essência, possam ser usadas como inserções regulares de cultura de tecidos, elas são mais finas e de composição proteica e, portanto, mais sensíveis do que suas contrapartes comerciais sintéticas atuais. Portanto, eles exigem um manuseio mais cuidadoso pelos usuários e precisam ser mantidos úmidos para manter sua elasticidade. Deve-se notar que as membranas podem suportar alongamento e insuflação16,17, tornando-as adequadas, por exemplo, para emular o movimento respiratório. Mesmo assim, é provável que novos usuários quebrem algumas membranas nos estágios iniciais, mas à medida que sua experiência de manuseio de membrana aumenta, espera-se que a taxa de sucesso aumente. Se os problemas persistirem, o usuário deve consultar a Tabela 3 para solução de problemas.
Durante a última década, várias alternativas aos insertos plásticos comerciais foram apresentadas (Tabela 1), e toda vez que o desempenho das culturas de células foi comparado, as novas membranas, mais biologicamente relevantes, produziram melhores resultados do que suas contrapartes plásticas comerciais 2,5,6,7,14,22. Isso foi observado principalmente em termos de função de barreira aprimorada 2,5,6,7,14,22, mas também na formação de crescimento celular mais nativo 14 e aumento das interações através da membrana em sistemas de co-cultura 7. Essa tendência foi observada anteriormente para as membranas de seda FN ao estabelecer um modelo de parede de vaso sanguíneo. Neste estudo, HDMEC e células musculares lisas (SMCs) foram cultivadas em lados opostos da membrana. Foi demonstrado que os SMCs secretaram uma ECM mais espessa quando co-cultivados com o HDMEC nas membranas de seda FN em comparação com as membranas PET comerciais. Da mesma forma, o HDMEC estabeleceu uma barreira mais apertada nas membranas de seda FN17. Os melhores resultados da cultura de células são provavelmente devidos à melhor comunicação celular e mais condições de cultura in vivo. A membrana FN-silk se aproxima muito mais do BM nativo em termos de espessura, estrutura e propriedades mecânicas. O BM nativo tem entre 20 nm e 3 μm22 de espessura, as membranas PET 10 μm e as membranas FN-seda em torno de 1 μm, caindo bem dentro da faixa nativa. A estrutura da membrana FN-silk também é nanofibrilar16, assim como a BM22 nativa, enquanto a membrana PET consiste em plástico com poros gravados, geralmente entre 0,4 μm e 8 μm de diâmetro7. As membranas PET também são muito mais rígidas que a MO, tendo um módulo de Young em torno de 2 GPa, em comparação com a MO que varia de kPa a MPa, mas geralmente é citada em torno de 250-500 kPa22. As membranas de seda FN têm um módulo de Young de 115 kPa16, que se enquadra nas condições nativas. Deve-se notar também que, uma vez que as células são cultivadas na membrana, sua força se torna o fator dominante, não a própria membrana17. No final, deve-se notar também que a funcionalização integrada da proteína FN-seda garante que as células adiram diretamente à membrana e, como tal, um revestimento não será necessário. Para as membranas PET, muitas vezes é padrão revestir com uma proteína ECM para garantir a adesão celular adequada7.
Ao comparar a membrana FN-silk com outras abordagens usadas para substituir a membrana PET (visão geral na Tabela 1), a principal vantagem do nosso método é o uso da proteína da seda funcionalizada produzida recombinantemente. Isso garante reprodutibilidade e condições de cultura definidas em contraste com outros materiais derivados de animais à base de proteínas, como o colágeno. Observe novamente que a funcionalização da proteína garante que nenhum revestimento seja necessário, pois as células aderem bem às membranascomo é 17. Além disso, a produção de membranas à base de seda aqui descrita é baseada na automontagem e não requer nenhuma configuração complexa ou o uso de produtos químicos agressivos, ao contrário de muitas outras técnicas que dependem, por exemplo, da eletrofiação. A adesão espontânea da membrana ao inserto também elimina a necessidade de manuseio manual associado a insertos de duas partes, colagem e anéis de montagem de silicone, simplificando assim o dimensionamento e permitindo fácil reprodutibilidade em qualquer laboratório. Além da produção fácil, nosso método é fácil de adaptar às necessidades experimentais do usuário, uma vez que diferentes materiais de inserção podem ser usados e a espessura da membrana pode ser ajustada ajustando a concentração de seda da solução inicial16. Por fim, este protocolo pode produzir, até onde sabemos, a membrana autônoma mais fina até o momento conectada a uma inserção de cultura de tecidos, permitindo a maior semelhança com a membrana basal nativa.
O protocolo de formação e manuseio de membranas de seda apresentado aqui é simples de usar para qualquer pessoa acostumada a trabalhar com inserções de cultura de tecidos em um laboratório de cultura de células. É uma maneira simples de fazer a transição das membranas plásticas para uma contraparte mais in vivo, que permite a geração de modelos de tecido mais relevantes usando vários tipos de células (Tabela 2). As membranas de seda podem suportar a cultura de células em seus lados apical ou basal, bem como co-culturas de diferentes tipos de células bilateralmente17. Os modelos de tecido de barreira desenvolvidos nas membranas de seda podem ser usados para a mesma gama de aplicações que as inserções de cultura de tecidos, incluindo exames de drogas e estudos de permeação e infecção. Para os casos em que a diafonia entre diferentes tipos de células é de interesse, eles demonstraram superar as inserções de TC devido às suas propriedades mais in vivo 17.
Divulgações
L.G. trabalha e M.H. tem ações na Spiber Technologies AB, a empresa que produz a proteína FN-silk.
Agradecimentos
Os autores gostariam de agradecer à Spiber Technologies AB por fornecer a proteína de seda de aranha funcionalizada recombinante e à Eline Freeze por imprimir uma grande parte das inserções impressas em 3D.
Materiais
| Name | Company | Catalog Number | Comments |
| CHEMICALS | |||
| Alexa Fluor 488 | Invitrogen; Thermo Fisher Scientific | A-21121 | Goat anti-mouse, Dilution 1:500 |
| Alexa Fluor 488 Phalloidin | Invitrogen; Thermo Fisher Scientific | A12379 | Dilution 1:400 |
| anti-ZO-1 (1A12) antibody | Invitrogen; Thermo Fisher Scientific | 33-9100 | Mouse anti-human, Monoclonal, Dilution 1:200 |
| Dextran, Alexa Fluor 680; 3,000 MW, Anionic | Invitrogen; Thermo Fisher Scientific | D34681 | Diluted 2,5% (w/v) in 200 ul of culture medium |
| DMEM/F-12 | Gibco; Thermo Fisher Scientific | 31330095 | Supplemented with 5% v/v FBS and 1% v/v Penicillin-Streptomycin |
| Ethanol | Solveco | 1326 | 70% (CAS-no 64-17-5) |
| Fetal Bovine Serum, qualified, heat inactivated, United States | Gibco; Thermo Fisher Scientific | 16140071 | |
| FN-silk | Spiber technologies AB | Store at -80 °C | |
| Isopropanol, EMPARTA ACS analytical reagent | Supelco | 1096342511 | ≥99.5% (CAS-no 67-63-0) |
| Live/Dead Viability/Cytotoxicity Kit | Invitrogen; Thermo Fisher Scientific | L3224 | |
| PBS | Swedish Veterinary Agency / Statens veterinärmedicinska anstalt | 992420 | without Ca and Mg, filtered |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco; Thermo Fisher Scientific | 11548876 | |
| MATERIAL | |||
| Dental LT Clear Resin | Denthouse | #DLCL-01 | |
| HaCaT cells | CLS | 300493 | |
| Nunc Cell-Culture Treated Multidishes 24-well | Fisher Scientific | 10604903 | |
| Nunc Cell-Culture Treated Multidishes 48-wel | Fisher Scientific | 10644901 | |
| TC insert, for 24-well plates, PET, transparent | Sarstedt | 83.3932.041 | pore size: 0.4 µm |
| ThinCert Cell Culture Inserts, translusent membrane (PET) | Greiner | 662640 | pore size: 0.4 µm |
| EQUIPMENT | |||
| EVOM meter with chopsticks | World Precision Instruments (WPI) Germany, GMBH | ||
| Form 3B | FormLabs | ||
| Form Wash | FormLabs | ||
| Form Cure | FormLabs | ||
| Isotemp General Purpose Deluxe Water Baths | Fisherbrand | ||
| Inverted fluorescence microscope Eclipse Ti | Nikon | ||
| Inverted fluorescence microscope DMI6000 B | Leica | ||
| Laminar flow hood Ninosafe, class II | Labolutions | ||
| Midi CO2 Incubator, 40 L | Thermo Scientific |
Referências
- Kumar, P., Kedaria, D., Mahapatra, C., Mohandas, M., Chatterjee, K. A designer cell culture insert with a nanofibrous membrane toward engineering an epithelial tissue model validated by cellular nanomechanics. Nanoscale Adv. 3 (16), 4714-4725 (2021).
- Wang, Y., et al. Ultrathin and handleable nanofibrous net as a novel biomimetic basement membrane material for endothelial barrier formation. Colloids Surf B Biointerfaces. 219, 112775(2022).
- Jain, P., Rauer, S. B., Möller, M., Singh, S. Mimicking the natural basement membrane for advanced tissue engineering. Biomacromolecules. 23 (8), 3081-3103 (2022).
- Eom, S., Park, S. M., Han, S. J., Kim, J. W., Kim, D. S. One-step fabrication of a tunable nanofibrous well insert via electrolyte-assisted electrospinning. RSC Advances. 7 (61), 38300-38306 (2017).
- Kim, D., Eom, S., Park, S. M., Hong, H., Kim, D. S. A collagen gel-coated, aligned nanofiber membrane for enhanced endothelial barrier function. Sci Rep. 9 (1), 1-11 (2019).
- Ebrahim, N. A., et al. Porous honeycomb film membranes enhance endothelial barrier integrity in human vascular wall bilayer model compared to standard track-etched membranes. J Biomed Mater Res A. 111 (5), 701-713 (2023).
- Zakharova, M., et al. Transwell-integrated 2 µm thick transparent polydimethylsiloxane membranes with controlled pore sizes and distribution to model the blood-brain barrier. Advanced Materials Technologies. 6 (12), 2100138(2021).
- Park, S., et al. Use of elastic, porous, and ultrathin co-culture membranes to control the endothelial barrier function via cell alignment. Advanced Functional Materials. 31 (9), 2008172(2021).
- Youn, J., et al. Facile and adhesive-free method for bonding nanofiber membrane onto thermoplastic polystyrene substrate to fabricate 3D cell culture platforms. Materials Today Bio. 20, 100648(2023).
- Liu, H., et al. Electrohydrodynamic jet-printed ultrathin polycaprolactone scaffolds mimicking Bruch’s membrane for retinal pigment epithelial tissue engineering. Int J Bioprint. 8 (3), 550(2022).
- Dogan, A. A., Dufva, M. Customized 3D-printed stackable cell culture inserts tailored with bioactive membranes. Sci Rep. 12 (1), 1-12 (2022).
- Rohde, F., Danz, K., Jung, N., Wagner, S., Windbergs, M. Electrospun scaffolds as cell culture substrates for the cultivation of an in vitro blood–brain barrier model using human induced pluripotent stem cells. Pharmaceutics. 14 (6), 1308(2022).
- Slater, S. C., et al. An in vitro model of the glomerular capillary wall using electrospun collagen nanofibres in a bioartificial composite basement membrane. PLoS ONE. 6 (6), e20802(2011).
- Harris, T. I., et al. Utilizing recombinant spider silk proteins to develop a synthetic Bruch’s membrane for modeling the retinal pigment epithelium. ACS Biomater Sci Eng. 5 (8), 4023-4036 (2019).
- Hjelm, L. C., Hedhammar, M., Löfblom, J. In blood–brain barrier model based on recombinant spider silk protein nanomembranes for evaluation of transcytosis capability of biomolecules. Biochem Biophys Res Commun. 669, 77-84 (2023).
- Gustafsson, L., et al. Recombinant spider silk forms tough and elastic nanomembranes that are protein-permeable and support cell attachment and growth. Advanced Functional Materials. 30 (40), 2002982(2020).
- Tasiopoulos, C. P., Gustafsson, L., Van Der Wijngaart, W., Hedhammar, M. Fibrillar nanomembranes of recombinant spider silk protein support cell co-culture in an in vitro blood vessel wall model. ACS Biomater Sci Eng. 7 (7), 3332-3339 (2021).
- Marino, A., Baronio, M., Buratti, U., Mele, E., Ciofani, G. Porous optically transparent cellulose acetate scaffolds for biomimetic blood-brain barrier in vitro models. Front Bioeng Biotechnol. 9, 630063(2021).
- Schramm, R. A., Koslow, M. H., Nelson, D. A., Larsen, M., Castracane, J. A novel impedance biosensor for measurement of trans-epithelial resistance in cells cultured on nanofiber scaffolds. Biosensors. 7 (3), 35(2017).
- Qi, D., et al. Establishment of a human iPSC- and nanofiber-based microphysiological blood-brain barrier system. ACS Appl Mater Interfaces. 10 (26), 21825-21835 (2018).
- Rickabaugh, E., Weatherston, D., Harris, T. I., Jones, J. A., Vargis, E. Engineering a biomimetic in vitro model of Bruch’s membrane using hagfish slime intermediate filament proteins. ACS Biomater Sci Eng. 9 (8), 5051-5061 (2023).
- Choi, J. W., Youn, J., Kim, D. S., Park, T. E. Human iPS-derived blood-brain barrier model exhibiting enhanced barrier properties empowered by engineered basement membrane. Biomaterials. 293, 121983(2023).
- Widhe, M., Shalaly, N. D., Hedhammar, M. A fibronectin mimetic motif improves integrin mediated cell biding to recombinant spider silk matrices. Biomaterials. 74, 256-266 (2016).
- Johansson, U., et al. Assembly of functionalized silk together with cells to obtain proliferative 3D cultures integrated in a network of ECM-like microfibers. Sci Rep. 9 (1), 1-13 (2019).
- Widhe, M., Johansson, U., Hillerdahl, C. O., Hedhammar, M. Recombinant spider silk with cell binding motifs for specific adherence of cells. Biomaterials. 34 (33), 8223-8224 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados