Method Article
Mimic della membrana basale nanofibrillare in seta di ragno funzionalizzata ricombinante in inserti di coltura tissutale su misura
In questo articolo
Riepilogo
Gli inserti per colture tissutali con membrane in plastica sono lo standard d'oro nei laboratori di coltura cellulare come supporti permeabili per stabilire strati cellulari e modelli di tessuti barriera. Qui, presentiamo un metodo semplice per sostituire la membrana di plastica con una membrana biologicamente più rilevante costituita da una proteina di seta di ragno funzionalizzata ricombinante.
Abstract
La replicazione delle barriere tissutali è fondamentale per generare modelli in vitro rilevanti per la valutazione di nuove terapie. Oggi, questo viene comunemente fatto utilizzando inserti per colture tissutali con una membrana plastica, che genera un lato apicale e uno basale. Oltre a fornire supporto alle cellule, queste membrane sono ben lungi dall'emulare la loro controparte nativa, la membrana basale, che è una matrice nanofibrillare a base di proteine. In questo lavoro, mostriamo un modo semplice per migliorare considerevolmente la rilevanza biologica degli inserti di coltura tissutale sostituendo la membrana di plastica con una composta da una proteina di seta di ragno funzionalizzata ricombinante pura. La membrana di seta si forma attraverso l'autoassemblaggio e aderirà spontaneamente a un inserto di coltura tissutale privo di membrana, dove può fornire supporto alle cellule. Gli inserti per colture tissutali progettati su misura possono essere stampati utilizzando una stampante 3D standard, seguendo le istruzioni fornite nel protocollo, oppure possono essere acquistati e utilizzati quelli commerciali. Questo protocollo mostra come viene impostato il sistema di coltura con membrane di seta in inserti e, successivamente, come possono essere implementate le stesse tecniche di coltura cellulare che vengono utilizzate con gli inserti tradizionali disponibili in commercio.
Introduzione
I modelli in vitro in grado di replicare le barriere tissutali hanno ricevuto una crescente attenzione grazie alla loro applicabilità nella sperimentazione di nuove terapie e nella facilitazione della comprensione dei meccanismi fondamentali della malattia 1,2. Per ricreare accuratamente il microambiente nativo, è fondamentale ricapitolare la funzione della membrana basale (BM), un complesso di matrice extracellulare (ECM) altamente specializzato. Il midollo osseo esiste in quasi tutti i tessuti del corpo umano, dove fornisce supporto alle cellule endoteliali ed epiteliali e le separa dal tessuto sottostante 2,3. Oltre a fornire supporto fisico, il midollo osseo regola e mantiene anche i segnali biochimici tra le cellule e il tessuto circostante. Queste funzioni vitali rendono necessaria la progettazione di scaffold che assomiglino alla struttura, nonché alle caratteristiche meccaniche e funzionali del BM3 nativo.
Uno dei modi più comuni per imitare il midollo osseo in vitro oggi è attraverso l'uso di inserti per colture tissutali disponibili in commercio (inserti TC). Si tratta essenzialmente di cilindri di plastica con una membrana permeabile che divide la camera in lati apicali e basolaterali 4,5. Sebbene facili da usare, le membrane degli inserti commerciali sono generalmente rigide, incise a binario e realizzate con polimeri come poli(carbonato) (PC) e poli(etilene tereftalato) (PET)3,4,6. Sono flessibili in termini di diametro, densità dei pori e dimensioni e possono essere rivestiti per migliorare l'adesione cellulare, ma mancano di tutte le altre caratteristiche rilevanti del BM,come lo spessore 6 comparabile, la porosità interconnessa, l'architettura fibrosa e il modulo elastico 3 rilevante.
La standardizzazione degli inserti TC e la loro facilità d'uso ha ispirato diversi gruppi, tra cui il nostro, a sostituire la membrana in plastica con una controparte più simile a quella in vivo (panoramica nella Tabella 1). I materiali utilizzati vanno da polimeri come il polidimetilsilossano (PDMS)7, il poli(lattide-co-caprolattone) (PLCL)8 e il policaprolattone (PCL)4,9,10 a materiali a base di proteine come la gelatina 2,11,12, il collagene 5,13 e la seta di ragno ricombinante 14,15,16,17. Le membrane di questi materiali sono state fissate in vari modi, sia agli inserti disponibili in commercio da cui la membrana è stata rimossa 4,7,8,10,12,13,14,16,18,19,20,21 , nonché a inserti progettati su misura realizzati mediante stampa 3D 1,11,15,17,20 o stampaggio a iniezione 9,22. Tuttavia, la maggior parte di questi sono ancora lontani dall'assomigliare al BM nativo in termini di spessore, dove le repliche vanno da centinaia di11,18 fino a pochi micrometri 5,10,14,21,22. Molti di essi richiedono anche una formazione complessa e/o metodi di fissaggio manuale 1,7,13,14,18,19,21, rendendo difficile il ridimensionamento e la replicazione in altri laboratori.
In questo articolo, presentiamo un metodo semplice per formare e attaccare una membrana di seta agli inserti e mostriamo come coltivare le cellule su entrambi i lati della membrana. Le membrane di seta sono formate attraverso l'autoassemblaggio della proteina FN-4RepCT (FN-silk) all'interfaccia liquido-aria di una soluzione in piedi16,17. FN-silk è una versione corta prodotta in modo ricombinante di Major Ampullulate Spidroin 1 da Euprosthenops australis, funzionalizzata con un motivo RGD derivato dalla fibronectina23. È stato dimostrato che si assembla in matrici fibrillari che promuovono l'adesione, la crescita e la migrazione cellulare 15,16,17,23,24,25. Il metodo per l'applicazione della membrana sull'inserto si basa sull'adesione spontanea ed è stato trovato adatto per gli inserti disponibili in commercio da cui la membrana è stata rimossa16, nonché per gli inserti stampati in 3D in acido polilattico (PLA)17 e Dental LT15. Questo documento descrive in dettaglio come questo metodo viene utilizzato per gli inserti stampati da Dental LT. Dopo che le membrane FN-silk sono state attaccate agli inserti, possono, in sostanza, essere trattate come inserti standard per colture tissutali commerciali. In breve, presentiamo un metodo semplice per generare modelli in vitro più rilevanti di barriere tissutali sostituendo le membrane plastiche con una membrana di seta FN a base di proteine.
Protocollo
1. 3D-stampa di inserti
- Scaricare il file . File di progettazione STL (JoVe_Silk_Insert.stl) dal file supplementare 1.
- Prepara i file per la stampa aprendoli nel pacchetto software dedicato alla conversione di un file . STL in un file di stampa per la stampante 3D in uso.
- Utilizza il software dedicato per aggiungere i supporti. La struttura portante è progettata dal software e la quantità necessaria dipenderà dalla stampante e dal software utilizzato. Orientare l'inserto in modo che né la piattaforma di costruzione né i supporti tocchino il fondo.
- Stampa il numero desiderato di inserti utilizzando una resina biocompatibile (come Dental LT o BioMed) o un filamento (come il PLA) adatto alla stampante 3D in uso.
NOTA: Assicurarsi che il materiale sia in grado di resistere a un processo di sterilizzazione adeguato come la sterilizzazione in autoclave, l'irradiazione o l'immersione con etanolo. - Staccare gli inserti stampati dalla piattaforma di stampa e rimuovere la struttura di supporto stampata dalla parte finita.
- Se si utilizza una stampante a resina, lavorare gli inserti utilizzando il protocollo standard fornito dal produttore.
NOTA: La lavorazione può variare a seconda della resina utilizzata. Il protocollo utilizzato per la resina utilizzata nel presente documento è fornito nel File supplementare 2. - Sterilizzare gli inserti utilizzando una tecnica adatta al materiale scelto.
NOTA: Le raccomandazioni sono l'autoclave, l'irradiazione o l'immersione in etanolo al 70% o una combinazione di questi. Se si utilizza una stampante a resina, potrebbe essere necessario un ampio protocollo di lisciviazione per ottenere una biocompatibilità ottimale. Fare riferimento al protocollo fornito nel file supplementare 2 per una raccomandazione. - Assicurarsi che gli inserti siano completamente asciutti e conservarli sterili fino all'uso.
2. Formazione di membrane FN-seta
- Riempi una scatola con ghiaccio secco e portala nel congelatore a -80 °C.
- Raccogliere le fiale di seta FN dal congelatore a -80 °C e immergerle in ghiaccio secco per il trasporto. Portare le fiale di seta FN in una cabina di sicurezza biologica ed eseguire i passaggi successivi. Posizionare le fiale di seta FN in un rack per provette da microcentrifuga per scongelarle senza toccarle eccessivamente.
- Mentre la seta FN si sta scongelando, disimballare la piastra a 48 pozzetti. Una volta che la seta FN si è completamente scongelata, procedere al passaggio successivo entro 10 minuti, preferibilmente il prima possibile.
- Diluire la soluzione di FN-seta in PBS refrigerato o a temperatura ambiente alla concentrazione desiderata, preferibilmente 1,8 mg/mL. Pipettare 550 μL di soluzione di FN-seta direttamente sul fondo di un pozzetto vuoto nella piastra a 48 pozzetti. Pipettare la soluzione di FN-seta fino a preparare il numero desiderato di membrane.
NOTA: Evitare di introdurre bolle d'aria e rimuovere immediatamente eventuali bolle d'aria con una pipetta. Non utilizzare pozzetti nella riga A o F o nella colonna 1 o 8, né pozzetti adiacenti (vedere lo schema nella Figura S1 supplementare). - Posizionare il coperchio sulla piastra a 48 pozzetti e posizionarla all'interno di una scatola sterile più grande per fornire un ambiente sterile durante l'incubazione.
- Spostare con cautela la scatola dalla cabina di sicurezza biologica e lasciarla in condizioni ambientali in un luogo indisturbato senza un flusso d'aria significativo durante la notte.
3. Adesione delle membrane FN-seta agli inserti
- Il giorno successivo, portare gli inserti sterili nella camera di sicurezza biologica.
- Riportare la grande scatola sterile contenente la piastra da 48 pozzetti con le membrane in seta FN nella cabina di sicurezza biologica ed eseguire i passaggi successivi. Sollevare con cautela la piastra a 48 pozzetti dalla grande scatola sterile.
- Verificare visivamente la formazione della membrana osservando l'intorbidamento nei pozzetti e aprire il coperchio della piastra a 48 pozzetti contenente le membrane. Prelevare un inserto utilizzando una pinzetta sterile e guidare l'inserto verso il basso sulla membrana fino a quando i manici dell'inserto toccano la parte superiore del pozzetto, come mostrato nella Figura 1. Mantenere la parte inferiore dell'inserto parallela alla parte inferiore della piastra.
- Ripetere il passaggio 3.3 fino a quando gli inserti non sono stati calati su tutte le membrane formate. Posizionare il coperchio sopra la piastra a 48 pozzetti, quindi rimettere la piastra nella scatola sterile. Lasciare la piastra indisturbata per 2 ore in condizioni ambientali per consentire alle membrane di aderire agli inserti.
- Preriscaldare il terreno di coltura o PBS a 37 °C.
- Disimballare una piastra a 24 pozzetti.
- Trascorse 2 ore, rimuovere la piastra a 48 pozzetti dalla scatola e aprire il coperchio. Utilizzando una pinzetta sterile, afferrare un inserto per i manici e sollevarlo dalla piastra a 48 pozzetti.
- Subito dopo il sollevamento, riempire l'inserto con terreno di coltura preriscaldato o PBS. Utilizzare 100 μl di terreno di coltura se si procede con la semina sul lato basale o 200 μl se si procede con la semina sul lato apicale. Se le membrane devono essere conservate per un uso successivo, utilizzare invece 200 μl di PBS.
CHECKPOINT: Se il liquido viene trattenuto sopra la membrana, il sollevamento ha avuto successo. Se il liquido gocciola sul banco, la membrana perde e deve essere ignorata. - Posizionare l'inserto in un pozzetto vuoto della piastra a 24 pozzetti.
- Sollevare tutti gli inserti dalla piastra a 48 pozzetti e trasferirli nella piastra a 24 pozzetti. Riempire i pozzetti con 1.000 μL di terreno di coltura se si procede con la semina cellulare o il PBS per la conservazione, mantenendo la piastra leggermente inclinata.
NOTA: È importante che il bordo della membrana sia al di sotto del livello del liquido (Figura 2). - Se le cellule devono essere seminate immediatamente, procedere alla sezione 4 o 5 a seconda del lato della membrana in cui le cellule devono essere seminate. In caso contrario, posizionare il coperchio sulla piastra a 24 pozzetti e metterla in frigorifero (4 °C) o in un'incubatrice a 37 °C. Se inserito nell'incubatrice, rabboccare il PBS ogni due giorni per garantire il mantenimento del volume necessario.
4. Semina cellulare sul lato apicale della membrana
NOTA: Se le membrane sono state conservate nel PBS, sostituire il PBS con un terreno di coltura preriscaldato come descritto nella sezione 6.
- Raccogli le cellule. Preparare la sospensione cellulare in modo tale che il numero desiderato di cellule per membrana sia presente in 20-50 μl di sospensione. Risospendere per ottenere la concentrazione cellulare desiderata.
- Utilizzando una pipetta P100 o P200, aspirare 20-50 μl della sospensione cellulare. Puntando il puntale della pipetta verso il centro della membrana, tenere il puntale a 1-2 mm di distanza dalla superficie del terreno di coltura all'interno dell'inserto e premere lentamente lo stantuffo della pipetta per creare una gocciolina sul bordo del puntale. Portare la gocciolina a contatto con il terreno di coltura all'interno dell'inserto.
NOTA: Tenere la pipetta perpendicolare alla superficie di lavoro. - Ripetere il passaggio 4.2 per le membrane rimanenti. Risospendere il patrimonio cellulare dopo aver seminato cinque membrane per garantire una distribuzione cellulare omogenea. Muovere la piastra a forma di otto per garantire una migliore distribuzione cellulare sulla membrana.
- Coltura in condizioni standard (37 °C e 5% CO2) e cambio del terreno ogni due giorni.
5. Semina cellulare sul lato basale della membrana
NOTA: Se le membrane sono state conservate in PBS, sostituire il PBS con 100 μL di terreno di crescita preriscaldato e riempire i pozzetti con 1 mL di terreno di crescita preriscaldato come descritto nella sezione 6.
- Raccogliere le cellule e preparare la sospensione cellulare in modo tale che il numero desiderato di cellule per membrana sia presente in 20 μl di sospensione. Risospendere per ottenere la concentrazione cellulare desiderata.
- Disimballare e aprire il coperchio di una capsula di Petri. Assicurarsi che l'altezza della capsula di Petri sia sufficiente per accogliere gli inserti senza che il fondo tocchi il coperchio.
- Usando una pinzetta, sollevare l'inserto dalla piastra a 24 pozzetti, lasciando il terreno di coltura nei pozzetti. Usando una serie di pinzette in ciascuna mano, capovolgere l'inserto in modo che il lato basale sia rivolto verso l'alto e il lato apicale sia rivolto verso l'area di lavoro. Posizionare l'inserto capovolto nella piastra di Petri come nella Figura 3C. Ripetere l'operazione per gli inserti rimanenti.
NOTA: Non rimuovere il terreno di coltura sul lato apicale. Manterrà la membrana bagnata durante l'incubazione. - Risospendere la parte di coltura per garantire una distribuzione uniforme delle cellule nella soluzione e aspirare 20 μl di sospensione cellulare con una pipetta P100 o P200. Puntando il puntale della pipetta verso il centro della membrana, tenere il puntale a 1-2 mm di distanza dalla membrana e premere lentamente lo stantuffo della pipetta per creare una gocciolina sul bordo del puntale. Tenere la pipetta perpendicolare alla superficie della membrana e lasciare che la gocciolina cada sulla membrana. Ripetere per le membrane rimanenti.
NOTA: Risospendere il ceppo cellulare dopo aver seminato cinque membrane per garantire una distribuzione uniforme delle cellule. - Posizionare il coperchio sulla piastra di Petri, portare la piastra di Petri e la piastra a 24 pozzetti nell'incubatore e incubare gli inserti con le cellule in condizioni standard (37 °C e 5 % di CO2) per 30 minuti.
- Portare la piastra a 24 pozzetti contenente il terreno di coltura e la piastra di Petri nella cappa di sicurezza biologica. Apri entrambi i coperchi e usando una serie di pinzette in ciascuna mano, prendi un inserto e capovolgilo in modo che il lato apicale della membrana sia ora rivolto verso l'alto e il lato basale verso il basso.
- Utilizzando una pipetta P200, aggiungere 200 μl di terreno di coltura all'interno dell'inserto. Posizionare l'inserto in uno dei pozzetti preriempiti della piastra a 24 pozzetti e ripetere l'operazione per le membrane rimanenti.
- Coltura in condizioni standard (37 °C e 5% CO2) e cambio del terreno ogni due giorni.
6. Cambiamento medio delle colture in condizioni sommerse
- Preparare una nuova piastra a 24 pozzetti con il terreno di coltura fresco aggiungendo 1.000 μl/pozzetto. Usando una pinzetta, sollevare un inserto dalla piastra a 24 pozzetti, inclinarlo leggermente e rimuovere il terreno dal lato apicale.
- Aggiungere 200 μl di terreno di coltura fresco all'interno dell'inserto. Posizionare l'inserto in un pozzetto preriempito con terreno di coltura fresco. Ripetere per tutte le membrane.
7. Cambiamento medio di colture in condizioni di trasporto aereo
- Usando una pinzetta, sollevare l'inserto e posizionarlo in un pozzetto vuoto di una piastra a 24 pozzetti. Ripetere per altre quattro membrane.
- Inclinare leggermente la piastra a 24 pozzetti e aggiungere lentamente 1.000 μl di terreno di coltura fresco all'interno di ciascun pozzetto. Ripetere per le membrane rimanenti.
8. Misurazione della resistenza elettrica transepiteliale (TEER)
- Preparare una piastra a 24 pozzetti con 1.000 μL di terreno di coltura o PBS all'interno dei pozzetti e trasferire le membrane al suo interno. Assicurarsi di avere 200 μl della soluzione corrispondente sopra la membrana.
- Utilizzando un set di pinzette, stabilizzare bene l'inserto all'interno della piastra premendo delicatamente sui bracci dell'inserto. Senza rimuovere le pinzette, inserire l'elettrodo TEER nel pozzetto e registrare la misurazione.
- Rimuovere l'elettrodo e quindi sollevare le pinzette.
- Ripetere i passaggi 8.2-8.3 per le membrane rimanenti.
Risultati
Fotografie rappresentative degli inserti
Le fotografie degli inserti prima e dopo il rilascio dalla piattaforma di stampa sono mostrate nella Figura 3A, B. Un'immagine di un inserto finito da cui è stato rimosso il supporto è mostrata nella Figura 3C. Il risultato è un lotto di inserti stampati in 3D, pronti per la sterilizzazione e il successivo utilizzo.
Sollevamento e movimentazione di membrane FN-silk
Uno schema generale della formazione della membrana FN-seta e del sollevamento manuale è mostrato nella Figura 1. Il risultato è una serie di inserti con una membrana di seta FN attaccata. Per garantire il più alto tasso di successo con il sollevamento di membrane intatte, i passaggi descritti nel protocollo devono essere seguiti con precisione. La Figura 4 mostra le fotografie di una membrana intatta (A,D) e dopo la lacerazione (B,E,F). La lacrima può essere visualizzata con l'uso della microscopia a campo chiaro (Figura 4E, F) e/o con il gocciolamento di liquido attraverso la membrana (Figura 4B). È importante sollevare e abbassare gli inserti perpendicolarmente alla membrana, per assicurarsi che la membrana aderisca uniformemente e si allunghi al di sotto degli inserti. L'adesione della membrana può essere osservata visivamente, come mostrato nella Figura 4A. Se l'inserto viene abbassato come indicato e i livelli del liquido vengono mantenuti come mostrato nella Figura 2, la membrana rimane attaccata all'inserto per lunghi periodi di coltura.
In questo caso, l'adesione della membrana all'inserto è convalidata conducendo un esperimento di permeazione 15,16,17 su membrane che erano state mantenute in condizioni di coltura cellulare standard per 9 giorni. In breve, quando si aggiunge una molecola fluorescente sulla parte superiore della membrana e si misura il segnale nella soluzione sottostante, il profilo di permeazione delle membrane di seta segue quello di un inserto di coltura tissutale disponibile in commercio (Figura 4C), non mostrando perdite in 36 ore di permeazione e indicando che la membrana rimane intatta e attaccata all'inserto. Esperimenti simili sono stati precedentemente condotti con cellule seminate su uno15 o entrambi i lati della membrana di seta17. La forza dell'adesione è stata precedentemente dimostrata utilizzando la macro indentazione16 e i test di gonfiaggio 16,17. Nell'ambito degli esperimenti di macro indentazione, è stato utilizzato uno stilo per allungare la membrana, che si è rotta sotto una forza di 1,4 mN, pur rimanendo attaccata all'inserto16.
Va notato che il tasso di successo del sollevamento di membrane intatte è correlato al materiale e al posttrattamento degli inserti. Con questo protocollo, il 95% delle membrane sollevate utilizzando inserti stampati con la resina utilizzata era appropriato per la semina cellulare, rispetto al 74% quando invece è stata utilizzata una resina comparabile. Ipotizziamo che l'adesione sia aiutata dalle interazioni idrofobiche e dalle forze di van der Waals, e quindi alterando le proprietà del materiale si cambia la forza dell'adesione. Ciò è ulteriormente supportato dal fatto che le membrane non aderiscono bene ai materiali idrofili (dati non mostrati).
Risultati rappresentativi della coltura cellulare sulle membrane FN-seta
Le immagini di immunofluorescenza dei cheratinociti (HaCaT) coltivati sul lato apicale o basale della membrana sono mostrate nella Figura 5. È stato osservato che le cellule aderenti (Figura 5D.i) coprivano uniformemente l'area di coltura il giorno 1, acquisendo la tipica morfologia dei ciottoli dei cheratinociti (Figura 5A.i-B.i). Il giorno 3, i cheratinociti avevano stabilito uno strato confluente (Figura 5A.ii-B.ii) e formato una rete di giunzioni strette (Figura 5D.ii), indicando che stavano assumendo funzioni epiteliali fisiologiche. Gli alti livelli di vitalità cellulare raggiunti nelle matrici FN-seta 15,17,23,24 sono stati presentati anche nella configurazione di coltura con inserto in seta qui descritta. Dopo 3 giorni di coltura, i cheratinociti sono rimasti altamente vitali (Figura 5C.i-iv). Inoltre, non è stata osservata alcuna differenza nella distribuzione delle cellule morte tra il centro (Figura 5C.i-ii) e la periferia della membrana (Figura 5C.iii-iv), non rivelando alcun effetto significativo del materiale dell'inserto sulla vitalità di HaCaT. Nel complesso, il sistema di coltura con inserto in seta offriva una vitalità dei cheratinociti simile (Figura 5i-ii, v-vi) se non migliorata (Figura 5iii-iv, vii-viii) a quella di un sistema commerciale di inserti in membrana in PET.
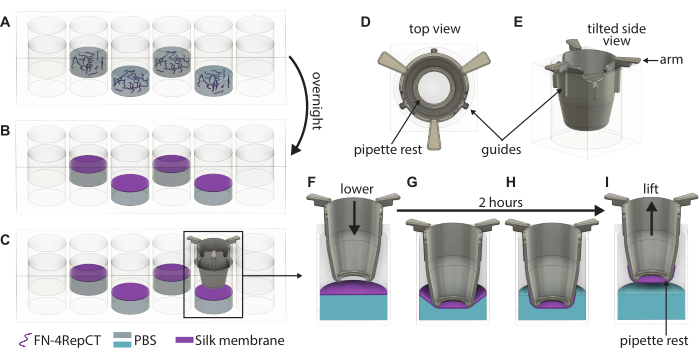
Figura 1: Illustrazione dettagliata della formazione e del sollevamento di singole membrane FN-seta. (A) Riempire ogni secondo pozzetto (evitare la fila/colonna esterna) in una piastra a 48 pozzetti con una soluzione proteica di FN-seta dove (B) si autoassembla in una membrana all'interfaccia liquido-aria durante la notte. (C) Afferrare l'inserto con un paio di pinzette e abbassarlo lentamente sulla membrana utilizzando le guide (D,E) sull'inserto stampato in 3D per assicurarsi che l'inserto sia abbassato perpendicolarmente alla membrana. Ingrandimento dell'adesione della membrana di seta che mostra una sezione trasversale dell'inserto (F) proprio sopra la membrana e (G) quando tocca la membrana di seta. Durante il periodo di incubazione di 2 ore, (H) la membrana di seta si attacca spontaneamente all'inserto, che viene poi (I) utilizzato per sollevare la membrana dall'interfaccia. Abbreviazioni: FN = fibronectina; PBS = soluzione salina tamponata con fosfato. Clicca qui per visualizzare una versione più grande di questa figura.
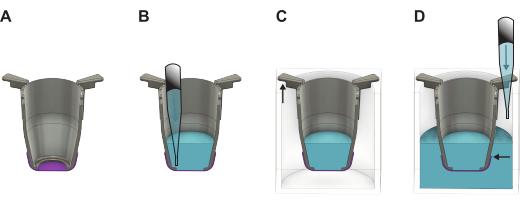
Figura 2: Illustrazione dettagliata che mostra come maneggiare la membrana FN-seta dopo averla sollevata dalla piastra di formazione. (A) L'inserto (grigio) con la membrana (viola) subito dopo il sollevamento. (B) Il liquido (blu) viene aggiunto sul lato apicale della membrana, che poi viene posto in una piastra (C) a 24 pozzetti dove la parte più lunga dei bracci dell'inserto pende dalle pareti e la parte più corta mantiene l'inserto posizionato al centro della piastra. (D) Il liquido viene aggiunto nel pozzo, assicurando che il livello del liquido sia bilanciato e al di sopra del bordo della membrana. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Fotografie degli inserti stampati in 3D. (A) Gli inserti subito dopo essere stati rimossi dalla stampante 3D, sono ancora attaccati alla piastra di stampa. (B) Un inserto dopo essere stato rimosso dalla piastra di stampa, prima di rompere i supporti. (C) Un inserto dopo la rimozione dei supporti. Clicca qui per visualizzare una versione più grande di questa figura.
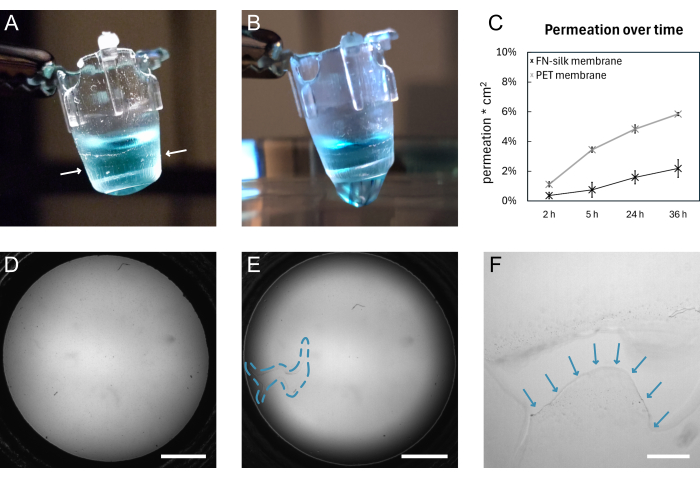
Figura 4: Una membrana FN-seta prima e dopo la rottura. (A) Fotografia di una membrana intatta che trasporta 200 μL di PBS colorato (blu) sul lato apicale. Il tagliente della membrana avvolto attorno all'inserto è indicato da frecce bianche. (B) Fotografia della stessa membrana dopo lo strappo. Il PBS fuoriesce attraverso la membrana. (C) Grafico che mostri la permeazione di una molecola fluorescente di 3 kDa nell'arco di 36 ore attraverso una membrana di seta o una membrana in PET disponibile in commercio mantenuta in condizioni standard di coltura cellulare per 9 giorni. (D) Immagine in campo chiaro di una membrana prima della lacerazione. (E) Immagine in campo chiaro della stessa membrana dopo la lacerazione. L'area difettosa è indicata dal contorno tratteggiato blu. (F) Vista ingrandita della lacrima mostrata in D con il bordo della membrana strappata indicato da frecce blu. Barre della scala = 1 mm (D,E), 200 μm (F). Abbreviazioni: FN = fibronectina; PBS = soluzione salina tamponata con fosfato; PET = poli(etilene tereftalato). Clicca qui per visualizzare una versione più grande di questa figura.
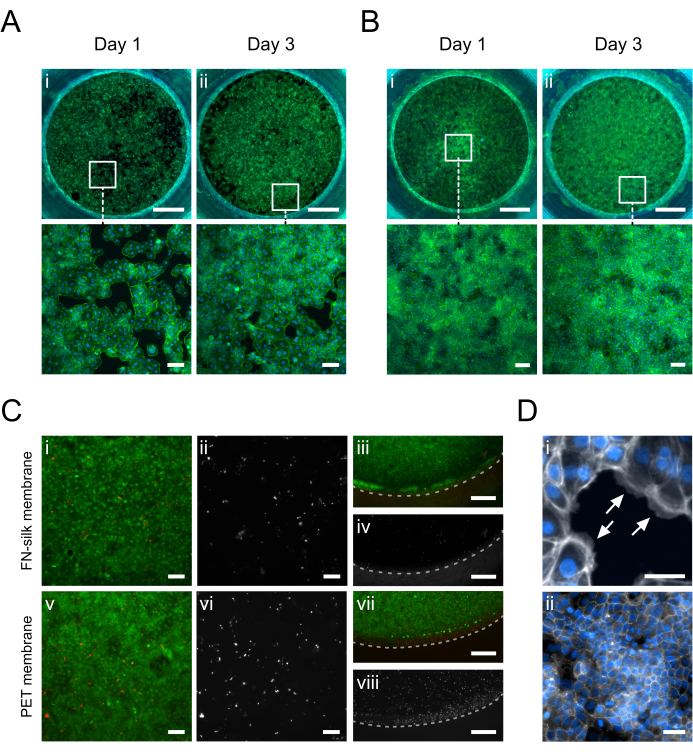
Figura 5: Cheratinociti (HaCaT) coltivati sulla membrana FN-seta. Il giorno 1, i cheratinociti hanno aderito e coperto uniformemente la superficie della membrana sul lato apicale (A.i) o basale (B.i) (falloidina, verde). Il giorno 3, si stabilisce un monostrato confluente sul lato apicale (A.ii) o basale (B.ii) (falloidina, verde). (C) Valutazione della vitalità cellulare sulla membrana di seta (i-iv) rispetto a una membrana in PET commerciale (v-viii) al centro (i, ii, v, vi) e alla periferia (iii, iv, vii, viii) dello strato cellulare. Le cellule vive sono mostrate in verde (i, iii, v, vii) e le cellule morte in rosso (i, iii, v, vii) o bianche (ii, iv, vi, viii). La linea tratteggiata segna l'interfase membrana-inserto. (D) Ingrandito in dettaglio, (i) indicando (frecce bianche) l'adesione cellulare alla membrana (falloidina, bianco) e (ii) una stretta rete di giunzione formata dopo 3 giorni in coltura (ZO-1, bianco). Barre della scala = 1 mm (fila superiore: A,B), 100 μm (riga inferiore: A,B,Ci, ii, v, vi), 500 μm (C iii, iv, vii, viii), 50 μm (D). Clicca qui per visualizzare una versione più grande di questa figura.
Tabella 1: Panoramica dei lavori precedenti in cui le membrane sono state integrate negli inserti per colture cellulari. Abbreviazioni: PCL = policaprolattone; PEGDA = poli (glicole etilenico) diacrilato; PLGA = acido poli(lattico-co-glicolico); PDMS = Polidimetilsilossano; PC = Policarbonato; RSS = Proteina della seta di ragno ricombinante; PLCL = Poli(lattide-co-caprolattone); RHSIF = Proteine del filamento intermedio della melma di hagfish ricombinante Clicca qui per scaricare questa tabella.
Tabella 2: Panoramica dei lavori precedenti che riassumono i diversi tipi di cellule coltivate sulle membrane FN-seta. FN-4repCT (FN-silk) è una versione corta della seta dragline di Euprosthenops australis, che viene prodotta e funzionalizzata in modo ricombinante con un motivo RGD dalla fibronectina a livello genetico. Questa proteina viene utilizzata in tutti i casi qui riassunti. Clicca qui per scaricare questa tabella.
Tabella 3: Risoluzione dei problemi. Clicca qui per scaricare questa tabella.
File supplementare 1: file di progettazione (.stl) per la stampa 3D degli inserti. Clicca qui per scaricare questo file.
File supplementare 2: Protocollo per la stampa, il post-trattamento e la sterilizzazione quando si utilizza la stampante e la resina specificate nella Tabella dei materiali. Clicca qui per scaricare questo file.
Figura S1 supplementare: Schema del modello suggerito per l'uso quando si posiziona la soluzione di seta FN nella piastra a 48 pozzetti. Clicca qui per scaricare questo file.
Discussione
Il protocollo qui descritto delinea un modo semplice per realizzare inserti di coltura cellulare biologicamente rilevanti. Inizia con la stampa degli inserti, seguita dalla formazione e dall'attacco delle membrane di seta FN, e termina con la dimostrazione di come le cellule possono essere seminate sia sul lato apicale che su quello basale della membrana. C'è un passaggio veramente critico in questo protocollo per garantire il successo a lungo termine con le colture cellulari ed è l'abbassamento e il sollevamento degli inserti sulla membrana. L'esecuzione di questi passaggi produrrà un sistema di coltura con inserto in membrana di seta in grado di resistere alla coltura cellulare in modo simile ai sistemi disponibili in commercio con membrane sintetiche. Per garantire ciò, sono state implementate delle guide sui lati degli inserti progettati su misura per evitare che vengano abbassati ad angolo o spostati lateralmente nel pozzetto, il che porterebbe a un'adesione irregolare della membrana, generando punti deboli e conseguenti perdite. È comune che sorgano problemi minori quando si segue un protocollo per la prima volta. Per aiutare il nuovo utente ad aggirarli, nel caso in cui si verifichino seguendo il protocollo presentato sopra, abbiamo delineato i potenziali problemi e le loro soluzioni nella Tabella 3.
La membrana stessa ha dimostrato di essere utile per la modellazione di diversi tessuti barriera (panoramica nella Tabella 2); Tuttavia, va sottolineato che la resina utilizzata per stampare gli inserti qui contenuti non è stata ampiamente testata per il suo effetto sulla vitalità di altri tipi di cellule. Sebbene finora non abbiamo riscontrato problemi di questo tipo, è possibile che la resina possa influire negativamente sulla vitalità e sulla crescita di alcune cellule sensibili. Si raccomanda pertanto di eseguire un test di vitalità simile a quello qui presentato per verificare la compatibilità della resina con ciascun tipo di cella utilizzata. Se si verifica citotossicità, è necessario stabilire un protocollo di polimerizzazione e/o lisciviazione più accurato per evitare che i monomeri non polimerizzati fuoriescano nel tempo e danneggino le cellule. Un esempio di tale protocollo, che è stato utilizzato per la resina utilizzata per stampare gli inserti all'interno di questo protocollo, può essere trovato nel File supplementare 2. Questo protocollo è stato precedentemente utilizzato per preparare inserti per la coltura dell'endotelio cerebrale bEnd.3 su membrane di seta per un massimo di 8 giorni15.
Il vantaggio principale del metodo presentato in questo lavoro è che offre un modo semplice per sostituire le attuali membrane plastiche sugli inserti di coltura tissutale e, in quanto tale, migliorare i modelli statici di coltura tissutale. La limitazione principale è che l'utente ha bisogno di accedere ad apparecchiature di stampa 3D o di acquistare tempo presso una struttura per stampare i propri inserti. Tuttavia, se necessario, questo potrebbe essere aggirato utilizzando inserti di coltura tissutale commerciali dopo aver rimosso le membrane. Inoltre, mentre le membrane di seta, in sostanza, possono essere utilizzate come normali inserti per la coltura dei tessuti, sono più sottili e di composizione proteica e, quindi, più sensibili delle loro attuali controparti sintetiche commerciali. Pertanto, richiedono una manipolazione più attenta da parte degli utenti e devono essere mantenuti bagnati per mantenere la loro elasticità. Va notato che le membrane possono resistere allo stiramento e al gonfiaggio16,17, rendendole adatte, ad esempio, per emulare il movimento respiratorio. Anche così, è probabile che i nuovi utenti rompano alcune membrane nelle fasi iniziali, ma con l'aumentare della loro esperienza di manipolazione delle membrane, si prevede che il tasso di successo aumenti. Se i problemi persistono, l'utente deve fare riferimento alla Tabella 3 per la risoluzione dei problemi.
Durante l'ultimo decennio, sono state presentate diverse alternative agli inserti in plastica commerciali (Tabella 1) e ogni volta che le prestazioni delle colture cellulari sono state confrontate, le nuove membrane biologicamente più rilevanti hanno prodotto risultati migliori rispetto alle loro controparti in plastica commerciali 2,5,6,7,14,22. Ciò è stato osservato principalmente in termini di aumento della funzione di barriera 2,5,6,7,14,22, ma anche nella formazione di una crescita cellulare più nativa 14 e nell'aumento delle interazioni attraverso la membrana nei sistemi di co-coltura 7. Questa tendenza è stata precedentemente osservata per le membrane FN-seta quando si stabilisce un modello di parete dei vasi sanguigni. In questo studio, HDMEC e cellule muscolari lisce (SMC) sono state coltivate su lati opposti della membrana. È stato dimostrato che le SMC secernono una ECM più spessa quando vengono co-coltivate con l'HDMEC sulle membrane FN-seta rispetto alle membrane PET commerciali. Allo stesso modo, l'HDMEC ha stabilito una barriera più stretta sulle membrane FN-seta17. I migliori risultati della coltura cellulare sono probabilmente dovuti a una migliore comunicazione cellulare e a condizioni di coltura più simili in vivo. La membrana FN-seta si avvicina molto di più al BM nativo in termini di spessore, struttura e proprietà meccaniche. Il BM nativo è compreso tra 20 nm e 3 μm22 di spessore, le membrane PET 10 μm e le membrane FN-seta circa 1 μm, rientrando quindi ampiamente nell'intervallo nativo. Anche la struttura della membrana FN-seta è nanofibrillare16, proprio come la BM22 nativa, mentre la membrana in PET è costituita da plastica con pori incisi a traccia, solitamente compresi tra 0,4 μm e 8 μm di diametro7. Le membrane in PET sono anche molto più rigide del BM, avendo un modulo di Young intorno ai 2 GPa, rispetto al BM che varia da kPa a MPa, ma generalmente è citato intorno ai 250-500 kPa22. Le membrane FN-seta hanno un modulo di Young di 115 kPa16, che rientra nelle condizioni native. Va anche notato che una volta che le cellule sono cresciute sulla membrana, la loro forza diventa il fattore dominante, non la membrana stessa17. Infine, va anche notato che la funzionalizzazione integrata della proteina FN-silk assicura che le cellule aderiscano direttamente alla membrana e, pertanto, non sarà necessario un rivestimento. Per le membrane in PET è spesso standard rivestire con una proteina ECM per garantire una corretta adesione cellulare7.
Quando si confronta la membrana FN-seta con altri approcci utilizzati per sostituire la membrana PET (rivisti nella Tabella 1), il vantaggio principale del nostro metodo è l'uso della proteina della seta funzionalizzata prodotta in modo ricombinante. Ciò garantisce la riproducibilità e condizioni di coltura definite in contrasto con altri materiali a base proteica di origine animale come il collagene. Si noti ancora una volta che la funzionalizzazione della proteina assicura che non siano necessari rivestimenti poiché le cellule aderiscono bene alle membrane in quanto è17. Inoltre, la produzione di membrane a base di seta qui descritta si basa sull'autoassemblaggio e non richiede alcuna configurazione complessa o l'uso di prodotti chimici aggressivi, a differenza di molte altre tecniche che si basano, ad esempio, sull'elettrofilatura. L'adesione spontanea della membrana all'inserto elimina anche la necessità di manipolazione manuale associata agli inserti in due parti, all'incollaggio e agli anelli di montaggio in silicone, semplificando così la detartrasi e consentendo una facile riproducibilità in qualsiasi laboratorio. Oltre alla facilità di produzione, il nostro metodo è facile da adattare alle esigenze sperimentali dell'utente poiché è possibile utilizzare diversi materiali di inserimento e regolare lo spessore della membrana regolando la concentrazione di seta della soluzione iniziale16. Infine, questo protocollo può produrre, per quanto ne sappiamo, la membrana autoportante più sottile e sottile fino ad oggi attaccata a un inserto di coltura tissutale, consentendo la massima somiglianza con la membrana basale nativa.
Il protocollo di formazione e manipolazione della membrana di seta qui presentato è semplice da usare per chiunque sia abituato a lavorare con inserti di coltura tissutale in un laboratorio di coltura cellulare. Si tratta di un modo semplice per passare dalle membrane plastiche a una controparte più simile a quella in vivo, che consente la generazione di modelli di tessuto più rilevanti utilizzando vari tipi di cellule (Tabella 2). Le membrane di seta possono supportare la coltura cellulare sui lati apicali o basali, nonché le co-colture di diversi tipi di cellule bilateralmente17. I modelli di tessuto barriera sviluppati sulle membrane di seta possono essere utilizzati per la stessa gamma di applicazioni degli inserti per colture tissutali, compresi gli screening farmacologici e gli studi di permeazione e infezione. Per i casi in cui la diafonia tra diversi tipi di cellule è di interesse, è stato dimostrato che esse superano gli inserti TC grazie alle loro proprietà più simili a quelle in vivo 17.
Divulgazioni
L.G. lavora per Spiber Technologies AB, la società che produce la proteina della seta FN.
Riconoscimenti
Gli autori desiderano ringraziare Spiber Technologies AB per aver fornito la proteina della seta di ragno funzionalizzata ricombinante e Eline Freeze per la stampa di gran parte degli inserti stampati in 3D.
Materiali
| Name | Company | Catalog Number | Comments |
| CHEMICALS | |||
| Alexa Fluor 488 | Invitrogen; Thermo Fisher Scientific | A-21121 | Goat anti-mouse, Dilution 1:500 |
| Alexa Fluor 488 Phalloidin | Invitrogen; Thermo Fisher Scientific | A12379 | Dilution 1:400 |
| anti-ZO-1 (1A12) antibody | Invitrogen; Thermo Fisher Scientific | 33-9100 | Mouse anti-human, Monoclonal, Dilution 1:200 |
| Dextran, Alexa Fluor 680; 3,000 MW, Anionic | Invitrogen; Thermo Fisher Scientific | D34681 | Diluted 2,5% (w/v) in 200 ul of culture medium |
| DMEM/F-12 | Gibco; Thermo Fisher Scientific | 31330095 | Supplemented with 5% v/v FBS and 1% v/v Penicillin-Streptomycin |
| Ethanol | Solveco | 1326 | 70% (CAS-no 64-17-5) |
| Fetal Bovine Serum, qualified, heat inactivated, United States | Gibco; Thermo Fisher Scientific | 16140071 | |
| FN-silk | Spiber technologies AB | Store at -80 °C | |
| Isopropanol, EMPARTA ACS analytical reagent | Supelco | 1096342511 | ≥99.5% (CAS-no 67-63-0) |
| Live/Dead Viability/Cytotoxicity Kit | Invitrogen; Thermo Fisher Scientific | L3224 | |
| PBS | Swedish Veterinary Agency / Statens veterinärmedicinska anstalt | 992420 | without Ca and Mg, filtered |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco; Thermo Fisher Scientific | 11548876 | |
| MATERIAL | |||
| Dental LT Clear Resin | Denthouse | #DLCL-01 | |
| HaCaT cells | CLS | 300493 | |
| Nunc Cell-Culture Treated Multidishes 24-well | Fisher Scientific | 10604903 | |
| Nunc Cell-Culture Treated Multidishes 48-wel | Fisher Scientific | 10644901 | |
| TC insert, for 24-well plates, PET, transparent | Sarstedt | 83.3932.041 | pore size: 0.4 µm |
| ThinCert Cell Culture Inserts, translusent membrane (PET) | Greiner | 662640 | pore size: 0.4 µm |
| EQUIPMENT | |||
| EVOM meter with chopsticks | World Precision Instruments (WPI) Germany, GMBH | ||
| Form 3B | FormLabs | ||
| Form Wash | FormLabs | ||
| Form Cure | FormLabs | ||
| Isotemp General Purpose Deluxe Water Baths | Fisherbrand | ||
| Inverted fluorescence microscope Eclipse Ti | Nikon | ||
| Inverted fluorescence microscope DMI6000 B | Leica | ||
| Laminar flow hood Ninosafe, class II | Labolutions | ||
| Midi CO2 Incubator, 40 L | Thermo Scientific |
Riferimenti
- Kumar, P., Kedaria, D., Mahapatra, C., Mohandas, M., Chatterjee, K. A designer cell culture insert with a nanofibrous membrane toward engineering an epithelial tissue model validated by cellular nanomechanics. Nanoscale Adv. 3 (16), 4714-4725 (2021).
- Wang, Y., et al. Ultrathin and handleable nanofibrous net as a novel biomimetic basement membrane material for endothelial barrier formation. Colloids Surf B Biointerfaces. 219, 112775(2022).
- Jain, P., Rauer, S. B., Möller, M., Singh, S. Mimicking the natural basement membrane for advanced tissue engineering. Biomacromolecules. 23 (8), 3081-3103 (2022).
- Eom, S., Park, S. M., Han, S. J., Kim, J. W., Kim, D. S. One-step fabrication of a tunable nanofibrous well insert via electrolyte-assisted electrospinning. RSC Advances. 7 (61), 38300-38306 (2017).
- Kim, D., Eom, S., Park, S. M., Hong, H., Kim, D. S. A collagen gel-coated, aligned nanofiber membrane for enhanced endothelial barrier function. Sci Rep. 9 (1), 1-11 (2019).
- Ebrahim, N. A., et al. Porous honeycomb film membranes enhance endothelial barrier integrity in human vascular wall bilayer model compared to standard track-etched membranes. J Biomed Mater Res A. 111 (5), 701-713 (2023).
- Zakharova, M., et al. Transwell-integrated 2 µm thick transparent polydimethylsiloxane membranes with controlled pore sizes and distribution to model the blood-brain barrier. Advanced Materials Technologies. 6 (12), 2100138(2021).
- Park, S., et al. Use of elastic, porous, and ultrathin co-culture membranes to control the endothelial barrier function via cell alignment. Advanced Functional Materials. 31 (9), 2008172(2021).
- Youn, J., et al. Facile and adhesive-free method for bonding nanofiber membrane onto thermoplastic polystyrene substrate to fabricate 3D cell culture platforms. Materials Today Bio. 20, 100648(2023).
- Liu, H., et al. Electrohydrodynamic jet-printed ultrathin polycaprolactone scaffolds mimicking Bruch’s membrane for retinal pigment epithelial tissue engineering. Int J Bioprint. 8 (3), 550(2022).
- Dogan, A. A., Dufva, M. Customized 3D-printed stackable cell culture inserts tailored with bioactive membranes. Sci Rep. 12 (1), 1-12 (2022).
- Rohde, F., Danz, K., Jung, N., Wagner, S., Windbergs, M. Electrospun scaffolds as cell culture substrates for the cultivation of an in vitro blood–brain barrier model using human induced pluripotent stem cells. Pharmaceutics. 14 (6), 1308(2022).
- Slater, S. C., et al. An in vitro model of the glomerular capillary wall using electrospun collagen nanofibres in a bioartificial composite basement membrane. PLoS ONE. 6 (6), e20802(2011).
- Harris, T. I., et al. Utilizing recombinant spider silk proteins to develop a synthetic Bruch’s membrane for modeling the retinal pigment epithelium. ACS Biomater Sci Eng. 5 (8), 4023-4036 (2019).
- Hjelm, L. C., Hedhammar, M., Löfblom, J. In blood–brain barrier model based on recombinant spider silk protein nanomembranes for evaluation of transcytosis capability of biomolecules. Biochem Biophys Res Commun. 669, 77-84 (2023).
- Gustafsson, L., et al. Recombinant spider silk forms tough and elastic nanomembranes that are protein-permeable and support cell attachment and growth. Advanced Functional Materials. 30 (40), 2002982(2020).
- Tasiopoulos, C. P., Gustafsson, L., Van Der Wijngaart, W., Hedhammar, M. Fibrillar nanomembranes of recombinant spider silk protein support cell co-culture in an in vitro blood vessel wall model. ACS Biomater Sci Eng. 7 (7), 3332-3339 (2021).
- Marino, A., Baronio, M., Buratti, U., Mele, E., Ciofani, G. Porous optically transparent cellulose acetate scaffolds for biomimetic blood-brain barrier in vitro models. Front Bioeng Biotechnol. 9, 630063(2021).
- Schramm, R. A., Koslow, M. H., Nelson, D. A., Larsen, M., Castracane, J. A novel impedance biosensor for measurement of trans-epithelial resistance in cells cultured on nanofiber scaffolds. Biosensors. 7 (3), 35(2017).
- Qi, D., et al. Establishment of a human iPSC- and nanofiber-based microphysiological blood-brain barrier system. ACS Appl Mater Interfaces. 10 (26), 21825-21835 (2018).
- Rickabaugh, E., Weatherston, D., Harris, T. I., Jones, J. A., Vargis, E. Engineering a biomimetic in vitro model of Bruch’s membrane using hagfish slime intermediate filament proteins. ACS Biomater Sci Eng. 9 (8), 5051-5061 (2023).
- Choi, J. W., Youn, J., Kim, D. S., Park, T. E. Human iPS-derived blood-brain barrier model exhibiting enhanced barrier properties empowered by engineered basement membrane. Biomaterials. 293, 121983(2023).
- Widhe, M., Shalaly, N. D., Hedhammar, M. A fibronectin mimetic motif improves integrin mediated cell biding to recombinant spider silk matrices. Biomaterials. 74, 256-266 (2016).
- Johansson, U., et al. Assembly of functionalized silk together with cells to obtain proliferative 3D cultures integrated in a network of ECM-like microfibers. Sci Rep. 9 (1), 1-13 (2019).
- Widhe, M., Johansson, U., Hillerdahl, C. O., Hedhammar, M. Recombinant spider silk with cell binding motifs for specific adherence of cells. Biomaterials. 34 (33), 8223-8224 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon