Method Article
ナノフィブリル基底膜模倣品 カスタムメイドの組織培養インサートに組換え官能基性クモの糸で作られました
要約
プラスチックメンブレンを使用した組織培養インサートは、細胞層やバリア組織のモデルを確立するための透過性サポートとして、細胞培養ラボのゴールデンスタンダードです。ここでは、プラスチックメンブレンを、組換え官能基化されたクモの糸タンパク質から作られた、より生物学的に関連性のあるメンブレンに置き換える簡単な方法を紹介します。
要約
組織バリアの複製は、新規治療薬を評価するための適切な in vitro モデルを生成するために重要です。今日、これは一般的に、頂端側と基底側を生成するプラスチックメンブレンを備えた組織培養インサートを使用して行われます。これらの膜は、細胞をサポートするだけでなく、天然の対応する基底膜(ナノフィブリラのタンパク質ベースのマトリックス)を模倣することにはほど遠いものです。この研究では、プラスチック膜を純粋な組換え官能基化されたクモの糸タンパク質から作られたものに置き換えることにより、組織培養インサートの生物学的関連性を大幅に改善する簡単な方法を示します。絹の膜は自己組織化によって形成され、膜のない組織培養インサートに自発的に付着し、細胞をサポートすることができます。カスタムデザインの組織培養インサートは、プロトコルに記載されている指示に従って標準の3Dプリンターを使用して印刷することも、市販のものを購入して代わりに使用することもできます。このプロトコールは、インサートにシルクメンブレンを使用した培養システムがどのようにセットアップされ、その後、従来の市販のインサートで使用されているのと同じ細胞培養技術をどのように実装できるかを示しています。
概要
組織バリアを再現できるin vitroモデルは、新規治療法の試験や疾患の基本的なメカニズムの理解に応用できることから、ますます注目されています1,2。本来の微小環境を正確に再現するためには、高度に特殊化された細胞外マトリックス(ECM)複合体である基底膜(BM)の機能を再現することが重要です。BMは人体のほぼすべての組織に存在し、内皮細胞と上皮細胞をサポートし、それらを下にある組織から分離します2,3。BMは、物理的なサポートを提供するだけでなく、細胞と周囲の組織との間の生化学的シグナルを調節し、維持します。これらの重要な機能により、ネイティブBM3の構造に似た足場、およびネイティブBM3の機械的および機能的特性を設計する必要があります。
今日、in vitroでBMを模倣する最も一般的な方法の1つは、市販の組織培養インサート(TCインサート)を使用することです。これらは基本的にプラスチックシリンダーであり、チャンバーを頂端側と基底外側の側面に分割する透過性メンブレンを備えています4,5。使いやすいですが、市販のインサートのメンブレンは一般的に硬く、トラックエッチングされており、ポリ(炭酸塩)(PC)やポリ(エチレンテレフタレート)(PET)3,4,6などのポリマーから作られています。これらは、直径、細孔密度、およびサイズの点で柔軟性があり、細胞接着を強化するためにコーティングすることができますが、同等の厚さ6、相互接続された多孔性、繊維構造、および関連する弾性率3など、BMの他のすべての関連機能を欠いています。
TCインサートの標準化とその使いやすさに触発されて、私たちのグループを含むいくつかのグループが、プラスチックメンブレンをよりin vivoに似たものに置き換えるようになりました(表1で概説)。使用される材料は、ポリジメチルシロキサン(PDMS)7、ポリ(ラクチド-コ-カプロラクトン)(PLCL)8、ポリカプロラクトン(PCL)4,9,10などのポリマーから、ゼラチン2,11,12、コラーゲン5,13、組換えクモの糸14,15,16,17などのタンパク質ベースの材料まで多岐にわたります.これらの材料からのメンブレンは、メンブレンが除去された市販のインサートの両方に対して、種々の方法で取り付けられている4,7,8,10,12,13,14,16,18,19,20,21 、3Dプリント1,11,15,17,20または射出成形9,22によって製造されたカスタム設計のインサートにも対応しています。しかし、これらのほとんどは、レプリカが数百の11,18から数マイクロメートル5,10,14,21,22まで及ぶ厚さの点でネイティブBMに似ていることからはまだ遠いです。また、それらの多くは、複雑な形成方法や手動の取り付け方法1,7,13,14,18,19,21を必要とし、他のラボでのスケーリングや複製を困難にしています。
ここでは、シルクメンブレンを形成してインサートに付着させる簡単な方法を示し、メンブレンの両側で細胞を培養する方法を示します。絹の膜は、立っている溶液16,17の液体-空気界面でのFN−4RepCT(FN絹)タンパク質の自己組織化によって形成される。FN-silkは、Euprosthenops australisからMajor Ampullulate Spidroin 1の組換えで製造されたショートバージョンで、フィブロネクチン23に由来するRGDモチーフで機能化されています。それは、細胞の接着、成長、および移動を促進する線維マトリックスに集合することが示されている15,16,17,23,24,25。インサートへのメンブレンの取り付け方法は、自発的な接着に依存しており、メンブレンが除去された市販のインサート16、ならびにポリ乳酸(PLA)17およびデンタルLT15からの3Dプリントインサートに適していることが見出されている。このホワイトペーパーでは、この方法がDental LTから印刷されるインサートにどのように使用されるかについて詳しく説明します。FNシルクメンブレンは、インサートに接着された後、本質的に、標準的な市販の組織培養インサートのように扱うことができます。要するに、プラスチックメンブレンをタンパク質ベースのFN-silkメンブレンに置き換えることにより、組織バリアのより関連性の高いin vitroモデルを生成する簡単な方法を提示します。
プロトコル
インサートの1. 3D印刷
- をダウンロードします。 補足ファイル1のSTLデザインファイル(JoVe_Silk_Insert.stl)。
- 変換専用のソフトウェアパッケージでファイルを開いて、印刷用のファイルを準備します。STL ファイルを、使用する 3D プリンターの印刷ファイルに変換します。
- 専用のソフトウェアを使用してサポートを追加します。支持構造はソフトウェアによって設計され、必要な量はプリンターと使用するソフトウェアによって異なります。建物のプラットフォームもサポートも底部に触れないように、インサートの向きを変えます。
- 使用する3Dプリンターに適した生体適合性樹脂(Dental LTやBioMedなど)またはフィラメント(PLAなど)を使用して、必要な数のインサートをプリントします。
注:材料がオートクレーブ、照射、エタノール浸漬などの適切な滅菌プロセスに耐えられることを確認してください。 - 印刷されたインサートを印刷プラットフォームから取り外し、印刷された支持構造を完成部品から取り外します。
- レジンプリンターを使用している場合は、メーカーが提供する標準プロトコルを使用してインサートを処理します。
注意:使用するレジンによって加工が異なる場合があります。本明細書で用いるレジンに用いるプロトコールは、 補足ファイル2に記載されている。 - 選択した材料に適した技術を使用してインサートを滅菌します。
注:推奨は、オートクレーブ、照射、または70%エタノールへの浸漬、またはそれらの組み合わせです。レジンプリンターを使用する場合、最適な生体適合性を達成するために、広範な浸出プロトコルが必要になる場合があります。推奨事項については、 補足ファイル2 に記載されているプロトコルを参照してください。 - インサートが完全に乾いていることを確認し、使用するまで滅菌して保管してください。
2. FN-silk膜の形成
- 箱にドライアイスを入れ、-80°Cの冷凍庫に持ち込みます。
- -80°Cの冷凍庫からFNシルクバイアルを回収し、ドライアイスに入れて輸送します。FN-silkバイアルを生物学的安全キャビネットに持って行き、そこでさらに手順を実行します。FN-silkバイアルをマイクロ遠心チューブラックに入れて、過度に触れないように解凍します。
- FNシルクを解凍している間に、48ウェルプレートを開梱します。FNシルクが完全に解凍されたら、10分以内に、できればできるだけ早く次のステップに進みます。
- FN-silk溶液を冷蔵または室温のPBSで所望の濃度、できれば1.8mg / mLに希釈します。550μLのFN-silk溶液を48ウェルプレートの空のウェルの底に直接ピペットで入れます。FN-silk溶液をピペットで動かし、必要な数のメンブレンが調製されるまで行います。
注意: 気泡の侵入を避け、ピペットですぐに気泡を取り除いてください。行AまたはF、列1または8の井戸、または隣接する井戸は使用しないでください( 補足図S1の概略図を参照)。 - 蓋を48ウェルプレートに置き、インキュベーション中に無菌環境を提供するために、より大きな滅菌ボックスの中に置きます。
- 箱を生物学的安全キャビネットから慎重に移動し、一晩中大きな空気の流れのない邪魔されない場所の周囲条件に置いておきます。
3. インサートにFNシルク膜を接着
- 翌日、滅菌インサートを生物学的安全キャビネットに持って行きます。
- FN-silkメンブレンが塗布された48ウェルプレートが入った大きな滅菌ボックスを生物学的安全キャビネットに戻し、そこでさらなる手順を実行します。48ウェルプレートを大きな滅菌ボックスから慎重に持ち上げます。
- ウェル内の濁りを観察し、膜が入っている48ウェルプレートの蓋を開けて、膜形成を目視で確認します。滅菌ピンセットを使用して1つのインサートをピックアップし、 図1に示すように、インサートのハンドルがウェルの上部に触れるまでインサートをメンブレン上にガイドします。インサートの底部をプレートの底部と平行に保ちます。
- インサートが形成されたすべてのメンブレンに下ろされるまで、手順3.3を繰り返します。48ウェルプレートの上に蓋をして、プレートを滅菌ボックスに戻します。プレートを周囲条件で2時間放置して、メンブレンがインサートに付着できるようにします。
- 増殖培地またはPBSを37°Cで予温します。
- 24ウェルプレートを開梱します。
- 2時間が経過したら、48ウェルプレートをボックスから取り出し、蓋を開けます。滅菌ピンセットを使用して、インサートのハンドルを持ち、48ウェルプレートから持ち上げます。
- 持ち上げた直後に、予熱した培地またはPBSでインサートを満たします。基礎側播種を進める場合は100 μL、頂端側播種を進める場合は200 μLの培地を使用します。メンブレンを後で使用するために保管する場合は、代わりに200μLのPBSを使用してください。
チェックポイント:液体がメンブレンの上に保持されている場合、持ち上げは成功しました。液体がベンチに滴り落ちると、メンブレンが漏れるので無視してください。 - インサートを24ウェルプレートの空のウェルに入れます。
- すべてのインサートを48ウェルプレートから持ち上げて、24ウェルプレートに移します。プレートを少し傾けたまま、細胞播種またはPBS保存を進める場合は、ウェルに1,000 μLの増殖培地を充填します。
注意: メンブレンの端が液面より下にあることが重要です(図2)。 - 細胞をすぐに播種する場合は、細胞を播種する膜のどちら側に応じてセクション4または5に進みますか。そうでない場合は、24ウェルプレートに蓋をして、冷蔵庫(4°C)または37°Cのインキュベーターに置きます。インキュベーターに入れる場合は、必要な量が維持されるように、2日おきにPBSを補充してください。
4.膜の頂端側での細胞播種
注:メンブレンがPBSに保存されている場合は、セクション6で説明されているように、PBSを予熱した培地と交換します。
- 細胞を収穫します。膜当たり所望の細胞数が懸濁液の20〜50μL中に存在するように、細胞懸濁液を調製する。再懸濁して、目的の細胞濃度を達成します。
- P100またはP200ピペットを使用して、細胞懸濁液を20〜50μL吸引します。ピペットチップをメンブレンの中心に向けて、チップをインサート内の培地表面から1〜2 mm離し、ピペットプランジャーをゆっくりと押してチップの端に液滴を作成します。液滴をインサート内の培地に接触させます。
注意: ピペットを作業面に対して垂直に保ちます。 - 残りのメンブレンについて手順4.2を繰り返します。5つのメンブレンを播種した後、細胞ストックを再懸濁して、均一な細胞分布を確保します。プレートを8の字型に動かして、メンブレン上の細胞分布を改善します。
- 標準条件(37°Cおよび5%CO2)で培養し、2日ごとに培地を交換します。
5. メンブレン基底側での細胞播種
注:メンブレンがPBSに保存されている場合は、PBSを100 μLの予熱増殖培地と交換し、セクション6で説明されているようにウェルに1 mLの予熱増殖培地を充填します。
- 細胞を回収し、膜あたり所望の細胞数が懸濁液の20μLに存在するように細胞懸濁液を調製します。再懸濁して、目的の細胞濃度を達成します。
- ペトリ皿の蓋を開梱して開きます。ペトリ皿の高さが、インサートの底部が蓋に触れないようにインサートを収容するのに十分な高さであることを確認してください。
- ピンセットを使用して、インサートを24ウェルプレートから持ち上げ、培地をウェルに残します。両手にピンセットのセットを使用して、基底側が上を向き、頂端側が作業領域を向くようにインサートを反転させます。 図3Cのように、逆さにしたインサートをペトリ皿に入れます。残りのインサートについても繰り返します。
注:頂端側の培地を取り出さないでください。インキュベーション中、メンブレンを濡らした状態に保ちます。 - 溶液中の細胞が均一に分布するように細胞ストックを再懸濁し、P100またはP200ピペットで細胞懸濁液の20μLを吸引します。ピペットチップをメンブレンの中心に向け、チップをメンブレンから1〜2 mm離し、ピペットプランジャーをゆっくりと押して、チップの端に液滴を作成します。ピペットをメンブレン表面に対して垂直に保ち、液滴がメンブレンに落ちるのを待ちます。残りのメンブレンについても繰り返します。
注:細胞が均一に分布するように、5つのメンブレンを播種した後、細胞ストックを再懸濁します。 - 蓋をシャーレに置き、シャーレと24ウェルプレートをインキュベーターに持って行き、標準条件(37°Cおよび5%CO2)でインサートを細胞と30分間インキュベートします。
- 培養培地とペトリ皿が入った24ウェルプレートを生物学的に安全なキャビネットに入れます。両方の蓋を開き、両手のピンセットを使用して、1つのインサートを手に取り、メンブレンの頂端側が上を向き、基底側が下を向くように反転させます。
- P200ピペットを使用して、インサート内に200μLの培地を加えます。インサートを24ウェルプレートのプレフィルドウェルの1つにセットし、残りのメンブレンについても繰り返します。
- 標準条件(37°Cおよび5%CO2)で培養し、2日ごとに培地を交換します。
6. 水中での文化の中程度の変化
- 新鮮な培地で新しい24ウェルプレートを調製するには、1,000 μL/ウェルを加えます。ピンセットを使用して、1つのインサートを24ウェルプレートから持ち上げ、わずかに傾けて、培地を頂端側から取り出します。
- インサート内に200μLの新鮮な培地を加えます。新鮮な培地があらかじめ充填されたウェルにインサートを入れます。すべてのメンブレンに対して繰り返します。
7. 空輸条件における文化の媒体変化
- ピンセットを使用してインサートを持ち上げ、24ウェルプレートの空のウェルに入れます。さらに4つのメンブレンについて繰り返します。
- 24ウェルプレートを少し傾け、各プレートウェル内に1,000 μLの新鮮な培地をゆっくりと加えます。残りのメンブレンについても繰り返します。
8. 経上皮電気抵抗(TEER)の測定
- ウェル内に1,000 μLの培地またはPBSを入れた24ウェルプレートを調製し、メンブレンをウェルに移します。対応する溶液が200μLあることを確認してください。
- ピンセットのセットを使用して、インサートアームをそっと押して、プレート内のインサートをしっかりと安定させます。ピンセットを外さずに、TEER電極をウェルに挿入し、測定値を記録します。
- 電極を取り外してから、ピンセットを持ち上げます。
- 残りのメンブレンについて、手順8.2〜8.3を繰り返します。
結果
インサートの代表的な写真
プリントプラットフォームからリリースする前とリリース後のインサートの写真を図3A、Bに示します。サポートが取り外された完成したインサートのイメージを図3Cに示します。その結果、3Dプリントされたインサートのバッチができあがり、滅菌とその後の使用が準備が整います。
FN-silkメンブレンの持ち上げと取り扱い
FNシルク膜の形成と手動吊り上げの一般的な概略図を 図1に示します。その結果、FNシルクメンブレンが取り付けられた多数のインサートが生まれました。無傷のメンブレンを持ち上げることで最高の成功率を確保するには、プロトコルで概説されている手順に正確に従う必要があります。 図4 は、無傷の状態(A、D)と破れた後(B、E、F)の膜の写真を示しています。裂け目は、明視野顕微鏡(図4E、F)および/または膜を通して液体を滴下(図4B)することによって視覚化することができます。メンブレンが均一に付着し、インサートの下に伸びるように、インサートをメンブレンに対して垂直に持ち上げたり下げたりすることが重要です。メンブレンの接着は、 図4Aに示すように視覚的に観察できます。図 2に示すように、インサートを指示どおりに下げ、液面を保てば、メンブレンは長い培養期間を通じてインサートに付着したままになります。
本明細書では、インサートへの膜付着は、標準細胞培養条件下で9日間保持されていた膜上で透過実験15、16、17を行うことによって検証される。簡単に言うと、メンブレンの上に蛍光分子を添加し、下の溶液中のシグナルを測定すると、シルクメンブレンの透過プロファイルは市販の組織培養インサート(図4C)の透過プロファイルに従い、36時間の透過で漏れはなく、メンブレンが無傷のままでインサートに付着していることを示しています。同様の実験は、以前に、絹膜17の一方の15または両側に播種された細胞を用いて行われてきた。接着力の強さは、マクロインデンテーション16およびインフレーションテスト16,17を用いて以前に示されてきた。マクロインデンテーション実験では、スタイラスを使用して膜を引き伸ばし、膜はインサート16に付着したまま1.4mNの力で破裂した。
無傷の膜を持ち上げる成功率は、インサートの材料と後処理に関連していることに注意してください。このプロトコールでは、使用した樹脂でプリントしたインサートを使用して持ち上げたメンブレンの95%が細胞播種に適切であったのに対し、同等の樹脂を代わりに使用した場合の74%が細胞播種に適していました。接着は疎水性相互作用とファンデルワールス力によって助けられ、したがって材料特性を変更すると接着の強度が変化すると推測されます。これは、メンブレンが親水性材料にうまく接着しないという事実によってさらに裏付けられています(データは示されていません)。
FN-silkメンブレンでの細胞培養の代表的な結果
膜の頂端側または基底側で培養されたケラチノサイト(HaCaT)の免疫蛍光画像を図5に示します。接着した細胞(図5D.i)は、典型的なケラチノサイトの丸石の形態(図5A.i-B.i)を獲得しながら、1日目に培養領域を均一に覆うことが観察されました。3日目に、ケラチノサイトはコンフルエント層(図5A.ii-B.ii)を確立し、タイトジャンクションのネットワークを形成し(図5D.ii)、生理学的上皮機能を想定していたことを示しました。FN−シルクマトリックス15,17,23,24で達成された高レベルの細胞生存率は、本明細書に記載のシルク膜インサート培養セットアップでも特徴づけられた。培養で3日後、ケラチノサイトは非常に生存率が高いままでした(図5C.i-iv)。さらに、死細胞の分布には、中心(図5C.i-ii)と膜の周辺(図5C.iii-iv)の間で差は観察されず、挿入材料がHaCaTの生存率に有意な影響を与えないことが示されました。全体として、シルクインサート培養システムは、市販のPET膜インサートシステムと同様の(図5i-ii、v-vi)ケラチノサイトの生存率(図5iii-iv、vii-viii)を提供しました。
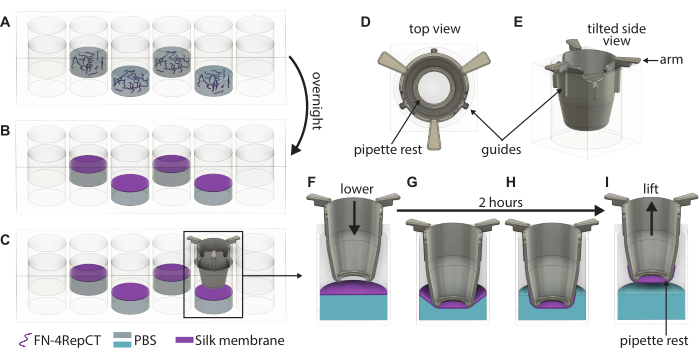
図1:特異なFN-silk膜の形成と持ち上げの詳細な図。 (A)FN-silkタンパク質溶液を48ウェルプレートに2ウェルごとに充填します(外側の行/列は避けてください)、(B)液体と空気の界面で一晩でメンブレンに自己組織化します。(C)ピンセットでインサートをつかみ、3Dプリントされたインサートの(D、E)ガイドを使用してゆっくりとメンブレンに下げ、インサートがメンブレンに対して垂直に下がるようにします。インサート(F)の膜の真上と(G)が絹膜に触れたときのインサートの断面を示す絹膜接着の拡大。2時間のインキュベーション期間にわたって、(H)シルクメンブレンがインサートに自発的に付着し、(I)メンブレンを界面から持ち上げるために使用されます。略語:FN =フィブロネクチン;PBS = リン酸緩衝生理食塩水。 この図の拡大版を表示するには、ここをクリックしてください。
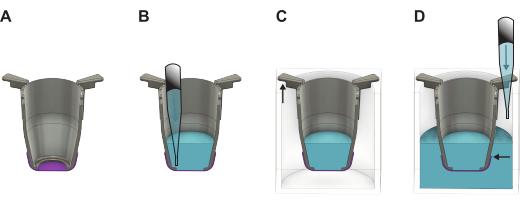
図2:フォーメーションプレートから持ち上げた後のFNシルク膜の取り扱い方法を示す詳細な図(A)インサート(灰色)と持ち上げた直後の膜(紫色)。(B)メンブレンの頂端側に液体(青)を加え、次に(C)24ウェルプレートに入れます。そこでは、インサートアームの長い部分が壁にぶら下がっており、短い部分がインサートをプレートの中央に配置したままにします。(D)液体をウェルに加え、液面がバランスが取れ、メンブレンの端より上にあることを確認します。この図の拡大版を表示するには、ここをクリックしてください。

図3:3Dプリントされたインサートの写真。 (A)3Dプリンターから取り外した直後のインサートは、ビルドプレートに取り付けられたままです。(B)ビルドプレートから取り外した後、サポートを壊す前に1つのインサート。(C)サポートを取り外した後の1つのインサート。 この図の拡大版を表示するには、ここをクリックしてください。
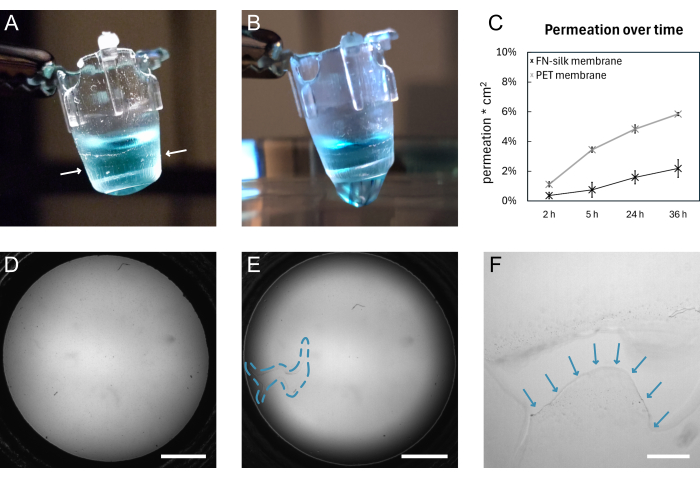
図4:破裂前と破裂後のFN-silk 膜 (A)頂端側に200μLの染色(青)PBSを充填した無傷の膜の写真。インサートに巻き付けられたメンブレンの端は、白い矢印で示されています。(B)引き裂き後の同じ膜の写真。PBSがメンブレンから漏れています。(C)3 kDaの蛍光分子が、標準的な細胞培養条件下で9日間保持されたシルクメンブレンまたは市販のPETメンブレンを通じて36時間にわたって透過する様子を示すプロット。(D)引き裂く前の膜の明視野画像。(E)引き裂き後の同じ膜の明視野画像。不良領域は青い破線で示されます。 (F) D に示されている裂け目の拡大図で、破れた膜の端が青い矢印で示されています。スケールバー = 1 mm (D,E)、200 μm (F)。略語:FN =フィブロネクチン;PBS = リン酸緩衝生理食塩水;PET=ポリ(エチレンテレフタレート)。 この図の拡大版を表示するには、ここをクリックしてください。
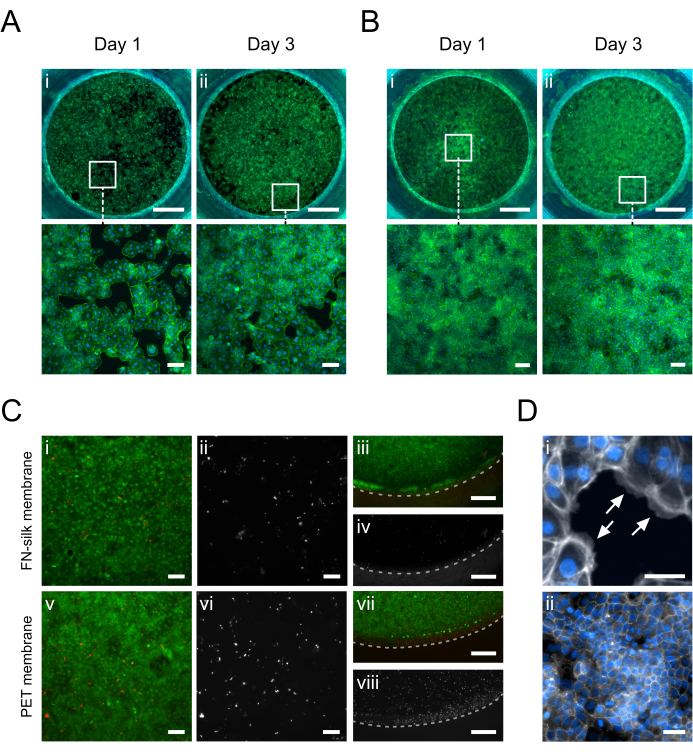
図5:FNシルク膜上で培養したケラチノサイト(HaCaT)。 1日目に、ケラチノサイトは、頂端(A.i)または基底側(B.i)(ファロイジン、緑)の膜の表面領域に付着し、均一に覆っています。3日目に、頂端(A.ii)または基底(B.ii)側(ファロイジン、緑)にコンフルエント単層が確立されます。(C)絹膜(i-iv)と市販のPET膜(v-viii)と細胞層の中心(i、 ii、 v、 vi)および周辺(iii、 iv、 vii、 viii)における細胞生存率の評価。生細胞は緑(i、 iii、 v、 vii)、死細胞は赤(i、 iii、 v、 vii)または白(ii、 iv、 vi、 viii)で示されています。破線はメンブレンインサート間期を示しています。(D)詳細を拡大し、(i)膜への細胞接着(白矢印)細胞の膜への接着(ファロイジン、白)、および(ii)培養3日後に形成されたタイトジャンクションネットワーク(ZO-1、白)を示しています。スケールバー = 1 mm (上段: A,B)、100 μm (下段: A,B,CI, II, V, VI)、500 μm (C iii,iv,vii,viii)、50 μm (D)。 この図の拡大版を表示するには、ここをクリックしてください。
表1:メンブレンを細胞培養インサートに組み込んだ先行研究の概要。 略語:PCL =ポリカプロラクトン。PEGDA =ポリ(エチレングリコール)ジアクリレート;PLGA =ポリ(乳酸-co-グリコール酸);PDMS =ポリジメチルシロキサン;PC =ポリカーボネート;RSS = 組換えクモの糸タンパク質;PLCL =ポリ(ラクチド-コ-カプロラクトン);RHSIF = 組換えヌタウスライム中間フィラメントタンパク質 この表をダウンロードするには、ここをクリックしてください。
表2:FN-silkメンブレンで培養されたさまざまな細胞タイプをまとめた以前の研究の概要。 FN-4repCT(FN-silk)は 、Euprosthenops australis のドラグラインシルクの短縮版で、遺伝子レベルでフィブロネクチンからのRGDモチーフと組換えで生産され、機能化されています。このタンパク質は、ここにまとめたすべてのケースで使用されます。 この表をダウンロードするには、ここをクリックしてください。
表 3: トラブルシューティング。この表をダウンロードするには、ここをクリックしてください。
補足ファイル1:インサートを3Dプリントするためのデザインファイル(.stl)。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル2:材料表に指定されているプリンターとレジンを使用する場合の印刷、後処理、および滅菌のプロトコル。このファイルをダウンロードするには、ここをクリックしてください。
補足図S1:FNシルク溶液を48ウェルプレートに配置する際に推奨されるパターンの概略図。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
本明細書に記載のプロトコールは、生物学的に関連性のある細胞培養インサートを作製する簡単な方法を概説する。それはインサートの印刷から始まり、FN-silk膜の形成と付着に続き、膜の頂端側と基底側の両方に細胞を播種する方法を示すことで終わります。このプロトコールには、細胞培養の長期的な成功を確実にするための真に重要なステップが1つあり、それはメンブレン上のインサートを下げて持ち上げることです。これらのステップを成功裏に実行すれば、合成メンブレンを用いた市販のシステムと同様に、細胞培養に耐えられるシルクメンブレンインサート培養システムが実現します。これを確実にするために、カスタム設計のインサートの側面にガイドレールが実装されており、ウェル内で斜めに下がったり、ウェル内で横に動いたりすると、膜の接着が不均一になり、弱点が発生し、その結果として漏れが発生するのを防ぎます。初めてプロトコルに従うときに小さな問題が発生するのはよくあることです。新しいユーザーが上記のプロトコルに従ってそれらを経験した場合にそれらを回避するのを助けるために、表 3に潜在的な問題とその解決策を概説しました。
メンブレン自体は、さまざまなバリア組織のモデリングに有益であることが示されています( 表2で概説)。しかしながら、本明細書のインサートを印刷するために使用される樹脂は、他の細胞型の生存率に対するその影響について広範囲に試験されていないことを指摘すべきである。これまでのところそのような問題は発生していませんが、樹脂が一部の敏感な細胞の生存率と成長に悪影響を与える可能性があります。したがって、ここで紹介したのと同様の生存率試験を実施して、使用する各細胞タイプに対する樹脂の適合性を確認することをお勧めします。細胞毒性が認められた場合は、未硬化のモノマーが時間の経過とともに浸出して細胞に害を及ぼすのを防ぐために、より徹底的な硬化および/または浸出プロトコルを確立する必要があります。このようなプロトコルの例は、このプロトコル内でインサートを印刷するために使用された樹脂に使用され、 補足ファイル2に見出すことができる。このプロトコルは、以前に絹の膜上のbEnd.3脳内皮の培養のためのインサートを準備するために使用されてきました 最大8日間15。
この研究で紹介した方法の主な利点は、組織培養インサート上の現在のプラスチックメンブレンを交換する簡単な方法を提供し、その結果、静的な組織培養モデルを改善することです。主な制限は、ユーザーが3D印刷機器にアクセスするか、インサートを印刷するために施設で時間を購入する必要があることです。ただし、必要に応じて、メンブレンを除去した後、市販の組織培養インサートを使用することでこれを回避できます。さらに、絹の膜は、本質的に、通常の組織培養インサートとして使用することができるが、それらはより薄く、タンパク質組成であるため、現在の合成商業用メンブレンは、より感度が高い。したがって、それらはユーザーによるより慎重な取り扱いを必要とし、弾力性を維持するために濡れたままにしておく必要があります。膜は伸張および膨張16,17に耐えることができ、例えば呼吸運動をエミュレートするのに適していることに留意すべきである。それでも、新規ユーザーは初期段階で一部のメンブレンを壊すことは考えられますが、メンブレンの取り扱い経験が増えるにつれて、成功率は上がることが予想されます。問題が解決しない場合は、トラブルシューティングのために表3を参照してください。
過去10年間で、市販のプラスチックインサートに代わるいくつかの選択肢が提示され(表1)、細胞培養の性能が比較されるたびに、新しい、より生物学的に関連性のあるメンブレンは、市販のプラスチックの対応物よりも優れた結果を生み出してきました2,5,6,7,14,22。これは主に、バリア機能2,5,6,7,14,22の増強という観点から観察されているが、より天然な細胞増殖の形成14や、共培養系7における膜を介した相互作用の増加にも見られる.この傾向は、血管壁モデルを確立する際のFN-silk膜で以前に観察されました。この研究では、HDMECと平滑筋細胞(SMC)を膜の反対側で成長させました。SMCは、市販のPET膜と比較して、FN-silk膜上でHDMECと共培養すると、より厚いECMを分泌することが示されました。同様に、HDMECはFNシルク膜17により堅固なバリアを確立した。細胞培養の結果が改善されたのは、細胞コミュニケーションの改善とin vivo様培養条件の増加によるものと考えられます。FNシルクメンブレンは、厚さ、構造、および機械的特性の点でネイティブBMにはるかに近づいています。ネイティブBMは20nmから3μmの間、22の薄さ、PETメンブレンは10μm、FN-silkメンブレンは1μm前後であり、したがってネイティブ範囲内に十分収まります。FNシルク膜の構造も、天然のBM22と同様にナノフィブリル16であり、PET膜は、通常直径0.4μmから8μmのトラックエッチングされた細孔を有するプラスチックからなる7。PET膜はまた、BMよりもはるかに硬く、kPaからMPaの範囲のBMと比較して、約2GPaのヤング率を持っていますが、一般的には約250〜500kPa22とされています。FNシルクメンブレンは、ヤング率が115 kPa16で、これはネイティブ条件内に収まります。また、細胞が膜上で増殖すると、膜自体ではなく、それらの強度が支配的な要素になることにも注意すべきである17。最後に、FN-silkタンパク質の統合的な機能化により、細胞が膜に直接付着することが保証され、コーティングが不要になることにも注意する必要があります。PETメンブレンは、適切な細胞接着を確保するためにECMタンパク質でコーティングするのが標準的であることが多い7。
FN-silkメンブレンをPETメンブレン( 表1に概説)を置き換えるために使用される他のアプローチと比較すると、私たちの方法の主な利点は、組換えで生成された官能基化されたシルクタンパク質の使用です。これにより、コラーゲンなどの他のタンパク質ベースの動物由来の材料とは対照的に、再現性と明確な培養条件が保証されます。タンパク質の機能化により、細胞が膜に良好に付着するため、コーティングが不要になることを再度注意してください17。さらに、本明細書に記載の絹ベースの膜の製造は、自己組織化に基づいており、例えば、エレクトロスピニングに依存する他の多くの技術とは異なり、複雑なセットアップまたは過酷な化学物質の使用を必要としない。また、メンブレンがインサートに自発的に接着するため、2つのパーツからなるインサート、接着、シリコン取り付けリングに伴う手作業による取り扱いが不要になり、スケーリングが簡素化され、どのラボでも再現性を高めることができます。容易な生産に加えて、我々の方法は、異なるインサート材料を使用することができ、膜の厚さを初期溶液16の絹濃度を調整することによって調整することができるので、ユーザーの実験ニーズに容易に適応することができる。最後に、このプロトコルは、私たちの知る限り、組織培養インサートに取り付けられたこれまでで最も薄い自立型メンブレンを生み出すことができ、天然の基底膜に最も近い類似性を可能にします。
ここで紹介するシルクメンブレンの形成と取り扱いのプロトコールは、細胞培養ラボで組織培養インサートを扱うことに慣れている人なら誰でも簡単に使用できます。これは、プラスチックメンブレンからより in vivoに似たメンブレンに移行する簡単な方法であり、さまざまな種類の細胞を使用してより関連性の高い組織モデルを生成できます(表2)。絹膜は、それらの頂端側または基底側での細胞培養だけでなく、異なる細胞タイプの両側の共培養もサポートできます17。シルクメンブレン上に開発されたバリア組織モデルは、薬物スクリーニング、浸透および感染研究など、組織培養インサートと同じ範囲のアプリケーションに使用できます。異なる細胞タイプ間のクロストークが興味深い場合、それらは、より in vivoに類似した特性17のためにTCインサートよりも優れていることが示されている。
開示事項
L.G.はFN-silkタンパク質を製造するSpiber Technologies ABに勤務し、M.H.は株式を保有しています。
謝辞
著者らは、組換え官能基化クモの糸タンパク質を提供してくれたSpiber Technologies ABと、3Dプリントされたインサートの大部分をプリントしてくれたEline Freezeに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| CHEMICALS | |||
| Alexa Fluor 488 | Invitrogen; Thermo Fisher Scientific | A-21121 | Goat anti-mouse, Dilution 1:500 |
| Alexa Fluor 488 Phalloidin | Invitrogen; Thermo Fisher Scientific | A12379 | Dilution 1:400 |
| anti-ZO-1 (1A12) antibody | Invitrogen; Thermo Fisher Scientific | 33-9100 | Mouse anti-human, Monoclonal, Dilution 1:200 |
| Dextran, Alexa Fluor 680; 3,000 MW, Anionic | Invitrogen; Thermo Fisher Scientific | D34681 | Diluted 2,5% (w/v) in 200 ul of culture medium |
| DMEM/F-12 | Gibco; Thermo Fisher Scientific | 31330095 | Supplemented with 5% v/v FBS and 1% v/v Penicillin-Streptomycin |
| Ethanol | Solveco | 1326 | 70% (CAS-no 64-17-5) |
| Fetal Bovine Serum, qualified, heat inactivated, United States | Gibco; Thermo Fisher Scientific | 16140071 | |
| FN-silk | Spiber technologies AB | Store at -80 °C | |
| Isopropanol, EMPARTA ACS analytical reagent | Supelco | 1096342511 | ≥99.5% (CAS-no 67-63-0) |
| Live/Dead Viability/Cytotoxicity Kit | Invitrogen; Thermo Fisher Scientific | L3224 | |
| PBS | Swedish Veterinary Agency / Statens veterinärmedicinska anstalt | 992420 | without Ca and Mg, filtered |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco; Thermo Fisher Scientific | 11548876 | |
| MATERIAL | |||
| Dental LT Clear Resin | Denthouse | #DLCL-01 | |
| HaCaT cells | CLS | 300493 | |
| Nunc Cell-Culture Treated Multidishes 24-well | Fisher Scientific | 10604903 | |
| Nunc Cell-Culture Treated Multidishes 48-wel | Fisher Scientific | 10644901 | |
| TC insert, for 24-well plates, PET, transparent | Sarstedt | 83.3932.041 | pore size: 0.4 µm |
| ThinCert Cell Culture Inserts, translusent membrane (PET) | Greiner | 662640 | pore size: 0.4 µm |
| EQUIPMENT | |||
| EVOM meter with chopsticks | World Precision Instruments (WPI) Germany, GMBH | ||
| Form 3B | FormLabs | ||
| Form Wash | FormLabs | ||
| Form Cure | FormLabs | ||
| Isotemp General Purpose Deluxe Water Baths | Fisherbrand | ||
| Inverted fluorescence microscope Eclipse Ti | Nikon | ||
| Inverted fluorescence microscope DMI6000 B | Leica | ||
| Laminar flow hood Ninosafe, class II | Labolutions | ||
| Midi CO2 Incubator, 40 L | Thermo Scientific |
参考文献
- Kumar, P., Kedaria, D., Mahapatra, C., Mohandas, M., Chatterjee, K. A designer cell culture insert with a nanofibrous membrane toward engineering an epithelial tissue model validated by cellular nanomechanics. Nanoscale Adv. 3 (16), 4714-4725 (2021).
- Wang, Y., et al. Ultrathin and handleable nanofibrous net as a novel biomimetic basement membrane material for endothelial barrier formation. Colloids Surf B Biointerfaces. 219, 112775(2022).
- Jain, P., Rauer, S. B., Möller, M., Singh, S. Mimicking the natural basement membrane for advanced tissue engineering. Biomacromolecules. 23 (8), 3081-3103 (2022).
- Eom, S., Park, S. M., Han, S. J., Kim, J. W., Kim, D. S. One-step fabrication of a tunable nanofibrous well insert via electrolyte-assisted electrospinning. RSC Advances. 7 (61), 38300-38306 (2017).
- Kim, D., Eom, S., Park, S. M., Hong, H., Kim, D. S. A collagen gel-coated, aligned nanofiber membrane for enhanced endothelial barrier function. Sci Rep. 9 (1), 1-11 (2019).
- Ebrahim, N. A., et al. Porous honeycomb film membranes enhance endothelial barrier integrity in human vascular wall bilayer model compared to standard track-etched membranes. J Biomed Mater Res A. 111 (5), 701-713 (2023).
- Zakharova, M., et al. Transwell-integrated 2 µm thick transparent polydimethylsiloxane membranes with controlled pore sizes and distribution to model the blood-brain barrier. Advanced Materials Technologies. 6 (12), 2100138(2021).
- Park, S., et al. Use of elastic, porous, and ultrathin co-culture membranes to control the endothelial barrier function via cell alignment. Advanced Functional Materials. 31 (9), 2008172(2021).
- Youn, J., et al. Facile and adhesive-free method for bonding nanofiber membrane onto thermoplastic polystyrene substrate to fabricate 3D cell culture platforms. Materials Today Bio. 20, 100648(2023).
- Liu, H., et al. Electrohydrodynamic jet-printed ultrathin polycaprolactone scaffolds mimicking Bruch’s membrane for retinal pigment epithelial tissue engineering. Int J Bioprint. 8 (3), 550(2022).
- Dogan, A. A., Dufva, M. Customized 3D-printed stackable cell culture inserts tailored with bioactive membranes. Sci Rep. 12 (1), 1-12 (2022).
- Rohde, F., Danz, K., Jung, N., Wagner, S., Windbergs, M. Electrospun scaffolds as cell culture substrates for the cultivation of an in vitro blood–brain barrier model using human induced pluripotent stem cells. Pharmaceutics. 14 (6), 1308(2022).
- Slater, S. C., et al. An in vitro model of the glomerular capillary wall using electrospun collagen nanofibres in a bioartificial composite basement membrane. PLoS ONE. 6 (6), e20802(2011).
- Harris, T. I., et al. Utilizing recombinant spider silk proteins to develop a synthetic Bruch’s membrane for modeling the retinal pigment epithelium. ACS Biomater Sci Eng. 5 (8), 4023-4036 (2019).
- Hjelm, L. C., Hedhammar, M., Löfblom, J. In blood–brain barrier model based on recombinant spider silk protein nanomembranes for evaluation of transcytosis capability of biomolecules. Biochem Biophys Res Commun. 669, 77-84 (2023).
- Gustafsson, L., et al. Recombinant spider silk forms tough and elastic nanomembranes that are protein-permeable and support cell attachment and growth. Advanced Functional Materials. 30 (40), 2002982(2020).
- Tasiopoulos, C. P., Gustafsson, L., Van Der Wijngaart, W., Hedhammar, M. Fibrillar nanomembranes of recombinant spider silk protein support cell co-culture in an in vitro blood vessel wall model. ACS Biomater Sci Eng. 7 (7), 3332-3339 (2021).
- Marino, A., Baronio, M., Buratti, U., Mele, E., Ciofani, G. Porous optically transparent cellulose acetate scaffolds for biomimetic blood-brain barrier in vitro models. Front Bioeng Biotechnol. 9, 630063(2021).
- Schramm, R. A., Koslow, M. H., Nelson, D. A., Larsen, M., Castracane, J. A novel impedance biosensor for measurement of trans-epithelial resistance in cells cultured on nanofiber scaffolds. Biosensors. 7 (3), 35(2017).
- Qi, D., et al. Establishment of a human iPSC- and nanofiber-based microphysiological blood-brain barrier system. ACS Appl Mater Interfaces. 10 (26), 21825-21835 (2018).
- Rickabaugh, E., Weatherston, D., Harris, T. I., Jones, J. A., Vargis, E. Engineering a biomimetic in vitro model of Bruch’s membrane using hagfish slime intermediate filament proteins. ACS Biomater Sci Eng. 9 (8), 5051-5061 (2023).
- Choi, J. W., Youn, J., Kim, D. S., Park, T. E. Human iPS-derived blood-brain barrier model exhibiting enhanced barrier properties empowered by engineered basement membrane. Biomaterials. 293, 121983(2023).
- Widhe, M., Shalaly, N. D., Hedhammar, M. A fibronectin mimetic motif improves integrin mediated cell biding to recombinant spider silk matrices. Biomaterials. 74, 256-266 (2016).
- Johansson, U., et al. Assembly of functionalized silk together with cells to obtain proliferative 3D cultures integrated in a network of ECM-like microfibers. Sci Rep. 9 (1), 1-13 (2019).
- Widhe, M., Johansson, U., Hillerdahl, C. O., Hedhammar, M. Recombinant spider silk with cell binding motifs for specific adherence of cells. Biomaterials. 34 (33), 8223-8224 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved