Method Article
Özel Yapım Doku Kültürü Eklerinde Rekombinant İşlevselleştirilmiş Örümcek İpeğinden Yapılmış Nanofibriler Bazal Membran Taklidi
Bu Makalede
Özet
Plastik membranlı doku kültürü ekleri, hücre katmanları ve bariyer doku modelleri oluşturmak için geçirgen destekler olarak hücre kültürü laboratuvarlarında altın standarttır. Burada, plastik zarı, rekombinant işlevselleştirilmiş bir örümcek ipeği proteininden yapılmış biyolojik olarak daha ilgili bir zarla değiştirmek için basit bir yöntem sunuyoruz.
Özet
Doku bariyerlerinin çoğaltılması, yeni terapötiklerin değerlendirilmesi için ilgili in vitro modellerin üretilmesi için kritik öneme sahiptir. Günümüzde, bu yaygın olarak apikal ve bazal bir taraf oluşturan plastik bir zarlı doku kültürü ekleri kullanılarak yapılmaktadır. Hücreler için destek sağlamanın yanı sıra, bu zarlar, nanofibriller, protein bazlı bir matris olan doğal muadillerini, bazal zarı taklit etmekten çok uzaktır. Bu çalışmada, plastik zarı saf rekombinant işlevselleştirilmiş örümcek ipeği proteininden yapılmış bir zarla değiştirerek doku kültürü eklerinin biyolojik uygunluğunu önemli ölçüde iyileştirmenin basit bir yolunu gösteriyoruz. İpek zar, kendi kendine birleşme yoluyla oluşur ve hücreler için destek sağlayabileceği zarsız bir doku kültürü ekine kendiliğinden yapışır. Özel olarak tasarlanmış doku kültürü ekleri, protokolde verilen talimatlar izlenerek standart bir 3D yazıcı kullanılarak basılabilir veya bunun yerine ticari olanlar satın alınabilir ve kullanılabilir. Bu protokol, eklerde ipek zarlı kültür sisteminin nasıl kurulduğunu ve daha sonra, geleneksel, ticari olarak temin edilebilen kesici uçlarla kullanılan aynı hücre kültürleme tekniklerinin nasıl uygulanabileceğini gösterir.
Giriş
Doku bariyerlerini kopyalayabilen in vitro modeller, yeni terapötiklerin test edilmesinde uygulanabilirlikleri ve temel hastalık mekanizmalarının anlaşılmasını kolaylaştırmaları nedeniyle artan ilgi görmüştür 1,2. Doğal mikro ortamı doğru bir şekilde yeniden oluşturmak için, son derece uzmanlaşmış bir hücre dışı matris (ECM) kompleksi olan bazal zarın (BM) işlevini özetlemek çok önemlidir. BM, insan vücudundaki hemen hemen her dokuda bulunur, burada endotel ve epitel hücrelerine destek sağlar ve onları alttaki dokudan ayırır 2,3. Fiziksel destek sağlamanın ötesinde, BM ayrıca hücreler ve çevresindeki doku arasındaki biyokimyasal sinyalleri düzenler ve korur. Bu hayati işlevler, yapıya benzeyen iskelelerin yanı sıra yerel BM3'ün mekanik ve işlevsel özelliklerinin tasarlanmasını gerekli kılar.
Günümüzde BM'yi in vitro olarak taklit etmenin en yaygın yollarından biri, ticari olarak temin edilebilen doku kültürü eklerinin (TC-ekleri) kullanılmasıdır. Bunlar esasen, odayı apikal ve bazolateral taraflaraayıran geçirgen bir zara sahip plastik silindirlerdir 4,5. Kullanımı kolay olmakla birlikte, ticari eklerdeki membranlar genellikle serttir, raylarla aşındırılmıştır ve poli (karbonat) (PC) ve poli (etilen tereftalat) (PET) gibi polimerlerden yapılmıştır3,4,6. Çap, gözenek yoğunluğu ve boyut açısından esnektirler ve hücre yapışmasını arttırmak için kaplanabilirler, ancak karşılaştırılabilir kalınlık6, birbirine bağlı gözeneklilik, lifli mimari ve ilgili elastik modül3 gibi BM'nin diğer tüm ilgili özelliklerinden yoksundurlar.
TC eklerinin standardizasyonu ve kullanım kolaylığı, bizimki de dahil olmak üzere birçok gruba, plastik membranı daha in vivo benzeri bir muadiliyle değiştirme konusunda ilham vermiştir (Tablo 1'de gözden geçirilmiştir). Kullanılan malzemeler, Polidimetilsiloksan (PDMS)7, Poli(laktit-ko-kaprolakton) (PLCL)8 ve polikaprolakton (PCL)4,9,10 gibi polimerlerden jelatin 2,11,12, kollajen 5,13 ve rekombinant örümcek ipeği 14,15,16,17 gibi protein bazlı malzemelere kadar uzanmaktadır. Bu malzemelerden elde edilen membranlar, her ikisi de membranın çıkarıldığı ticari olarak temin edilebilen eklereçeşitli şekillerde bağlanmıştır 4,7,8,10,12,13,14,16,18,19,20,21 , ayrıca 3D baskı 1,11,15,17,20 veya enjeksiyon kalıplama 9,22 yoluyla üretilen özel tasarlanmış eklere. Bununla birlikte, bunların çoğu, kopyaların yüzlerce 11,18'den birkaç mikrometreyekadar 5,10,14,21,22 arasında değiştiği kalınlık açısından yerel BM'ye benzemekten hala çok uzaktır. Birçoğu ayrıca karmaşık oluşturma ve/veya manuel bağlantı yöntemleri 1,7,13,14,18,19,21 gerektirir ve bu da diğer laboratuvarlarda ölçeklendirme ve çoğaltmayı zorlaştırır.
Burada, ipek bir zar oluşturmak ve eklere bağlamak için basit bir yöntem sunuyoruz ve zarın her iki tarafındaki hücrelerin nasıl kültürleneceğini gösteriyoruz. İpek zarlar, FN-4RepCT (FN-ipek) proteininin duran bir çözeltinin16,17 sıvı-hava arayüzünde kendi kendine birleştirilmesiyle oluşturulur. FN-ipek, fibronektin23'ten türetilen bir RGD motifi ile işlevselleştirilmiş, Euprosthenops australis'ten Major Ampullulate Spidroin 1'in rekombinant olarak üretilen kısa bir versiyonudur. Hücre yapışmasını, büyümesini ve göçünü destekleyen fibriler matrisler halinde bir araya geldiği gösterilmiştir 15,16,17,23,24,25. Membranın kesici uç üzerine tutturulması yöntemi, kendiliğinden yapışmaya dayanır ve membranınçıkarıldığı ticari olarak temin edilebilen kesici uçlar 16 ve ayrıca polilaktik asit (PLA)17 ve Dental LT15'ten 3D baskılı kesici uçlar için uygun bulunmuştur. Bu makale, Dental LT'den yazdırılan ekler için bu yöntemin nasıl kullanıldığını detaylandırmaktadır. FN-ipek membranlar eklere takıldıktan sonra, özünde standart ticari doku kültürü ekleri gibi muamele edilebilirler. Kısacası, plastik membranları protein bazlı, FN-ipek membran ile değiştirerek daha uygun in vitro doku bariyerleri modelleri oluşturmak için basit bir yöntem sunuyoruz.
Protokol
1. 3D kesici uçların baskısı
- İndirin. Ek Dosya 1'den STL tasarım dosyası (JoVe_Silk_Insert.stl).
- Dosyaları, bir dönüştürmeye adanmış yazılım paketinde açarak yazdırmaya hazırlayın. STL dosyasını, kullanılmakta olan 3D yazıcı için bir yazdırma dosyasına dönüştürün.
- Destek eklemek için özel yazılımı kullanın. Destekleyici yapı yazılım tarafından tasarlanmıştır ve gereken miktar yazıcıya ve kullanılan yazılıma bağlı olacaktır. Ek parçayı, ne bina platformu ne de destekler tabana değmeyecek şekilde yönlendirin.
- Kullanılan 3D yazıcıya uygun biyouyumlu bir reçine (Dental LT veya BioMed gibi) veya filament (PLA gibi) kullanarak istenen sayıda kesici uç yazdırın.
NOT: Malzemenin otoklavlama, ışınlama veya etanole batırma gibi uygun bir sterilizasyon işlemine dayanabileceğinden emin olun. - Basılı ekleri baskı platformundan ayırın ve yazdırılan destek yapısını bitmiş parçadan çıkarın.
- Reçine yazıcı kullanıyorsanız, ekleri üretici tarafından sağlanan standart protokolü kullanarak işleyin.
NOT: İşleme, hangi reçinenin kullanıldığına bağlı olarak değişebilir. Burada kullanılan reçine için kullanılan protokol Ek Dosya 2'de verilmiştir. - Tercih edilen malzemeye uygun bir teknik kullanarak ekleri sterilize edin.
NOT: Öneriler, otoklavlama, ışınlama veya %70 etanole daldırma veya bunların bir kombinasyonudur. Bir reçine yazıcı kullanılıyorsa, optimum biyouyumluluk elde etmek için kapsamlı bir sızıntı protokolü gerekebilir. Bir öneri için Ek Dosya 2'de sağlanan protokole bakın. - Eklerin tamamen kuru olduğundan emin olun ve kullanana kadar steril olarak saklayın.
2. FN-ipek zarların oluşumu
- Bir kutuyu kuru buzla doldurun ve -80 °C dondurucuya getirin.
- FN ipek şişeleri -80 °C dondurucudan toplayın ve nakliye için kuru buza koyun. FN ipek şişelerini biyolojik bir güvenlik kabinine getirin ve orada daha fazla adım atın. FN ipek şişelerini aşırı dokunmadan çözmek için bir mikrosantrifüj tüp rafına yerleştirin.
- FN ipeği çözülürken, 48 oyuklu plakayı ambalajından çıkarın. FN ipeği tamamen çözüldükten sonra, 10 dakika içinde, tercihen daha erken bir sonraki adıma geçin.
- FN-ipek çözeltisini soğutulmuş veya oda sıcaklığında PBS'de istenen konsantrasyona, tercihen 1.8 mg / mL'ye seyreltin. 550 μL FN-ipek solüsyonunu doğrudan 48 oyuklu plakadaki boş bir kuyunun dibine pipetleyin. İstenilen sayıda membran hazırlanana kadar FN-ipek solüsyonunu pipetleyin.
NOT: Hava kabarcıkları oluşturmaktan kaçının ve hava kabarcıklarını hemen bir pipetle çıkarın. Satır A veya F veya sütun 1 veya 8'deki kuyuları veya bitişik kuyuları kullanmayın ( Ek Şekil S1'deki şemaya bakın). - Kapağı 48 oyuklu plakaya yerleştirin ve inkübasyon sırasında steril bir ortam sağlamak için daha büyük, steril bir kutunun içine yerleştirin.
- Kutuyu biyolojik güvenlik kabininden dikkatlice çıkarın ve gece boyunca önemli bir hava akışı olmadan bozulmamış bir yerde ortam koşullarında bırakın.
3. FN-ipek membranların eklere yapıştırılması
- Ertesi gün, steril ekleri biyolojik güvenlik kabinine getirin.
- FN ipek membranlı 48 oyuklu plakayı içeren büyük steril kutuyu biyolojik güvenlik kabinine geri getirin ve orada daha fazla adım atın. 48 oyuklu plakayı büyük steril kutudan dikkatlice kaldırın.
- Kuyulardaki bulanıklığı gözlemleyerek membran oluşumunu görsel olarak doğrulayın ve membranları içeren 48 oyuklu plakanın kapağını açın. Steril cımbız kullanarak bir kesici ucu alın ve Ek parçayı, Şekil 1'de gösterildiği gibi parçanın tutamakları kuyunun üst kısmına değene kadar zarın üzerine doğru yönlendirin. Ek parçanın alt kısmını plakanın altına paralel tutun.
- Oluşturulan tüm membranların üzerine ekler indirilene kadar adım 3.3'ü tekrarlayın. Kapağı 48 oyuklu plakanın üzerine yerleştirin ve ardından plakayı steril kutuya geri koyun. Membranların uçlara yapışmasını sağlamak için plakayı ortam koşullarında 2 saat boyunca rahatsız edilmeden bırakın.
- Büyüme ortamını veya PBS'yi 37 °C'de önceden ısıtın.
- 24 oyuklu bir plakayı ambalajından çıkarın.
- 2 saat geçtikten sonra, 48 oyuklu plakayı kutudan çıkarın ve kapağı açın. Steril cımbız kullanarak, bir parçayı kollarından tutun ve 48 oyuklu plakadan kaldırın.
- Kaldırdıktan hemen sonra, eki önceden ısıtılmış kültür ortamı veya PBS ile doldurun. Bazal yan tohumlama ile devam ediyorsanız 100 μL kültür ortamı veya apikal yan tohumlama ile devam ediyorsanız 200 μL kültür ortamı kullanın. Membranlar daha sonra kullanılmak üzere saklanacaksa, bunun yerine 200 μL PBS kullanın.
KONTROL NOKTASI: Sıvı zarın üzerinde tutulursa, kaldırma başarılı olmuştur. Tezgahın üzerine sıvı damlarsa, membran sızar ve göz ardı edilmelidir. - Ek parçayı 24 oyuklu plakanın boş bir kuyusuna yerleştirin.
- Tüm ekleri 48 oyuklu plakadan kaldırın ve 24 oyuklu plakaya aktarın. Plakayı hafifçe eğik tutarken hücre tohumlama veya depolama için PBS ile devam ediyorsanız kuyuları 1.000 μL büyüme ortamı ile doldurun.
NOT: Membranın kenarının sıvı seviyesinin altında olması önemlidir (Şekil 2). - Hücreler hemen tohumlanacaksa, hücrelerin zarın hangi tarafından tohumlanacağına bağlı olarak bölüm 4 veya 5'e geçin. Değilse, kapağı 24 oyuklu plakaya yerleştirin ve buzdolabına (4 °C) veya 37 °C'lik bir inkübatöre koyun. İnkübatöre yerleştirilirse, gerekli hacmin korunduğundan emin olmak için PBS'yi her iki günde bir doldurun.
4. Zarın apikal tarafında hücre tohumlaması
NOT: Membranlar PBS'de saklanmışsa, PBS'yi bölüm 6'da açıklandığı gibi önceden ısıtılmış kültür ortamıyla değiştirin.
- Hücreleri hasat edin. Hücre süspansiyonunu, süspansiyonun 20-50 μL'sinde zar başına istenen sayıda hücre bulunacak şekilde hazırlayın. İstenen hücre konsantrasyonunu elde etmek için yeniden askıya alın.
- Bir P100 veya P200 pipeti kullanarak, hücre süspansiyonunun 20-50 μL'sini aspire edin. Pipet ucunu zarın merkezine doğru doğrultarak, ucu ekin içindeki kültür ortamı yüzeyinden 1-2 mm uzakta tutun ve ucun kenarında bir damlacık oluşturmak için pipet pistonuna yavaşça bastırın. Damlacığı, ekin içindeki kültür ortamı ile temas ettirin.
NOT: Pipeti çalışma yüzeyine dik tutun. - Kalan membranlar için adım 4.2'yi tekrarlayın. Homojen hücre dağılımını sağlamak için beş zarı tohumladıktan sonra hücre stoğunu yeniden askıya alın. Zar üzerinde daha iyi hücre dağılımı sağlamak için plakayı sekiz şeklinde hareket ettirin.
- Standart koşullar altında (37 °C ve %5 CO2) kültür yapın ve her iki günde bir ortam değiştirin.
5. Zarın bazal tarafında hücre tohumlaması
NOT: Membranlar PBS'de saklanmışsa, PBS'yi 100 μL önceden ısıtılmış büyüme ortamı ile değiştirin ve kuyucukları bölüm 1'da açıklandığı gibi 6 mL önceden ısıtılmış büyüme ortamı ile doldurun.
- Hücreleri hasat edin ve hücre süspansiyonunu, süspansiyonun 20 μL'sinde zar başına istenen sayıda hücre bulunacak şekilde hazırlayın. İstenen hücre konsantrasyonunu elde etmek için yeniden askıya alın.
- Bir Petri kabının ambalajını açın ve kapağını açın. Petri kabının yüksekliğinin, alt kısımları kapağa değmeden ekleri yerleştirmek için yeterli olduğundan emin olun.
- Cımbız kullanarak, ek parçayı 24 oyuklu plakadan kaldırın ve kültür ortamını kuyucuklarda bırakın. Her iki elinizde bir dizi cımbız kullanarak, ek parçayı bazal taraf yukarı bakacak ve apikal taraf çalışma alanına bakacak şekilde ters çevirin. Ters çevrilmiş eki Şekil 3C'deki gibi Petri kabına yerleştirin. Kalan ekler için tekrarlayın.
NOT: Apikal taraftaki kültür ortamını çıkarmayın. Kuluçka sırasında zarı ıslak tutacaktır. - Çözeltide eşit hücre dağılımını sağlamak için hücre stoğunu yeniden süspanse edin ve bir P100 veya P200 pipeti ile 20 μL hücre süspansiyonunu aspire edin. Pipet ucunu zarın merkezine doğru doğrultarak, ucu zardan 1-2 mm uzakta tutun ve ucun kenarında bir damlacık oluşturmak için pipet pistonuna yavaşça bastırın. Pipeti membran yüzeyine dik tutun ve damlacığın membranın üzerine düşmesine izin verin. Kalan zarlar için tekrarlayın.
NOT: Eşit hücre dağılımını sağlamak için beş zarı tohumladıktan sonra hücre stoğunu yeniden askıya alın. - Kapağı Petri kabının üzerine yerleştirin, Petri kabını ve 24 oyuklu plakayı inkübatöre getirin ve ekleri hücrelerle birlikte standart koşullar altında (37 ° C ve% 5 CO2) 30 dakika inkübe edin.
- Kültür ortamı içeren 24 oyuklu plakayı ve Petri kabını biyolojik olarak güvenli kabine getirin. Her iki kapağı da açın ve her iki elinizde bir cımbız seti kullanarak, bir ek parçayı alın ve zarın apikal tarafı şimdi yukarı ve bazal tarafı aşağı bakacak şekilde ters çevirin.
- Bir P200 pipeti kullanarak, ekin içine 200 μL kültür ortamı ekleyin. Ek parçayı 24 oyuklu plakanın önceden doldurulmuş kuyucuklarından birine yerleştirin ve kalan membranlar için tekrarlayın.
- Standart koşullar altında (37 °C ve %5 CO2) kültür yapın ve her iki günde bir ortam değiştirin.
6. Batık koşullarda kültürlerin orta değişimi
- 1.000 μL / kuyu ekleyerek taze kültür ortamı ile 24 oyuklu yeni bir plaka hazırlayın. Cımbız kullanarak, 24 oyuklu plakadan bir parçayı kaldırın, hafifçe eğin ve ortamı apikal taraftan çıkarın.
- Ekin içine 200 μL taze kültür ortamı ekleyin. Ek parçayı, taze kültür ortamı ile önceden doldurulmuş bir kuyuya yerleştirin. Tüm membranlar için tekrarlayın.
7. Hava ikmal koşullarında kültürlerin orta derecede değişmesi
- Cımbız kullanarak, eki kaldırın ve 24 oyuklu bir plakanın boş bir kuyusuna yerleştirin. Dört zar daha için tekrarlayın.
- 24 oyuklu plakayı hafifçe eğin ve her bir plakanın içine yavaşça 1.000 μL taze kültür ortamı ekleyin. Kalan zarlar için tekrarlayın.
8. Transepitelyal elektrik direncinin ölçülmesi (TEER)
- Kuyucukların içinde 1.000 μL kültür ortamı veya PBS bulunan 24 oyuklu bir plaka hazırlayın ve zarları içine aktarın. Zarın üzerinde karşılık gelen çözeltiden 200 μL bulunduğundan emin olun.
- Bir cımbız seti kullanarak, kesici uç kollarına hafifçe bastırarak kesici ucu plakanın içinde iyice sabitleyin. Cımbızı çıkarmadan, TEER elektrodunu kuyuya yerleştirin ve ölçümü kaydedin.
- Elektrodu çıkarın ve ardından cımbızı kaldırın.
- Kalan membranlar için 8.2-8.3 adımlarını tekrarlayın.
Sonuçlar
Eklerin temsili fotoğrafları
Baskı platformundan serbest bırakılmadan önce ve sonra eklerin fotoğrafları Şekil 3A,B'de gösterilmiştir. Desteğin çıkarıldığı bitmiş bir ek parçanın görüntüsü Şekil 3C'de gösterilmektedir. Sonuç, sterilizasyon ve müteakip kullanım için hazır bir grup 3D baskılı ektir.
FN-ipek membranların kaldırılması ve taşınması
FN-ipek zar oluşumunun ve manuel kaldırmanın genel bir şeması Şekil 1'de gösterilmiştir. Sonuç, FN ipek membranın takılı olduğu bir dizi kesici uçtur. Sağlam membranların kaldırılmasında en yüksek başarı oranını sağlamak için protokolde belirtilen adımlar tam olarak takip edilmelidir. Şekil 4, bir zarın sağlamken (A,D) ve yırtıldıktan sonra (B,E,F) fotoğraflarını göstermektedir. Yırtılma, parlak alan mikroskobu (Şekil 4E,F) kullanılarak ve/veya sıvının zardan damlatılmasıyla (Şekil 4B) görselleştirilebilir. Membranın eşit şekilde yapışmasını ve eklerin altına gerilmesini sağlamak için ekleri zara dik olarak kaldırmak ve indirmek önemlidir. Membran yapışması, Şekil 4A'da gösterildiği gibi görsel olarak gözlemlenebilir. Kesici uç talimat verildiği gibi indirilirse ve sıvı seviyeleri Şekil 2'de gösterildiği gibi tutulursa, zar uzun kültür periyotları boyunca kesici uça bağlı kalır.
Burada, inserte membran bağlantısı, 9 gün boyunca standart hücre kültürü koşulları altında tutulan membranlar üzerinde bir geçirgenlik deneyi 15,16,17 yapılarak doğrulanmıştır. Kısaca, zarın üzerine bir floresan molekülü eklenirken ve aşağıdaki çözeltideki sinyali ölçerken, ipek zarların geçirgenlik profili, ticari olarak temin edilebilen bir doku kültürü ekinin profilini takip eder (Şekil 4C), 36 saatlik geçirgenlikten fazla sızıntı göstermez ve zarın hem sağlam kaldığını hem de eke bağlı kaldığını gösterir. Benzer deneyler daha önce ipek zarın17 bir15 veya her iki tarafına ekilen hücrelerle de gerçekleştirilmişti. Yapışmanın gücü daha önce makro girinti16 ve şişirme testleri16,17 kullanılarak gösterilmiştir. Makro girinti deneylerinde, 1.4 mN'lik bir kuvvet altında yırtılan zarı germek için bir kalem kullanıldıve ek parçaya 16 bağlı kaldı.
Sağlam membranların kaldırılmasının başarı oranının, eklerin materyali ve son işlemi ile ilgili olduğu unutulmamalıdır. Bu protokolle, kullanılan reçine ile basılmış ekler kullanılarak kaldırılan zarların %95'i hücre tohumlaması için uygunken, bunun yerine karşılaştırılabilir bir reçine kullanıldığında bu oran %74'tü. Yapışmanın hidrofobik etkileşimler ve van der Waals kuvvetleri tarafından desteklendiğini ve bu nedenle malzeme özelliklerinin değiştirilmesinin yapışmanın gücünü değiştirdiğini tahmin ediyoruz. Bu, membranların hidrofilik malzemelere iyi yapışmaması gerçeğiyle daha da desteklenir (veriler gösterilmemiştir).
FN-ipek membranlar üzerinde hücre kültürünün temsili sonuçları
Membranın apikal veya bazal tarafında kültürlenen keratinositlerin (HaCaT) immünofloresan görüntüleri Şekil 5'te gösterilmiştir. Yapışan hücrelerin (Şekil 5D.i), tipik keratinosit parke taşı morfolojisini elde ederken (Şekil 5A.i-B.i) 1. günde kültür alanını eşit şekilde kapladığı gözlendi.3. Günde, keratinositler birleşik bir tabaka oluşturmuş (Şekil 5A.ii-B.ii) ve sıkı bağlantılardan oluşan bir ağ oluşturmuşlardı (Şekil 5D.ii), bu da fizyolojik epitel fonksiyonlarını üstlendiklerini gösteriyordu. FN-ipek matrisleri 15,17,23,24'te elde edilen yüksek hücre canlılığı seviyeleri, burada açıklanan ipek zar eki kültür kurulumunda da yer aldı. Kültürde 3 gün sonra, keratinositler oldukça canlı kaldı (Şekil 5C.i-iv). Ek olarak, zarın merkezi (Şekil 5C.i-ii) ile çevresi (Şekil 5C.iii-iv) arasında ölü hücrelerin dağılımında herhangi bir fark gözlenmemiştir, bu da ek materyalin HaCaT'ın canlılığı üzerinde önemli bir etkisi olmadığını ortaya koymuştur. Genel olarak, ipek ekleme kültür sistemi, ticari bir PET membran ekleme sistemininkiyle benzer bir (Şekil 5iii-iv, vii-viii) keratinosit canlılığı sunmuştur (Şekil 5iii-iv, v-vi).
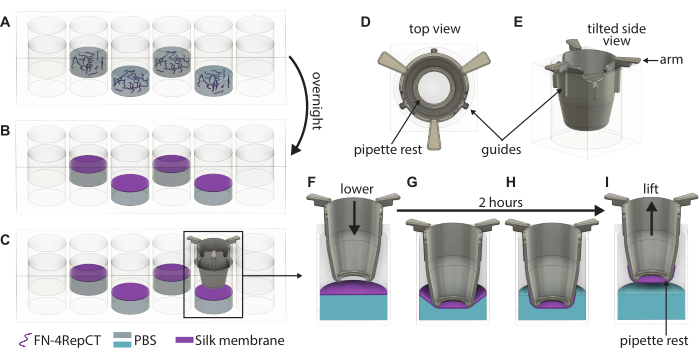
Şekil 1: Tekil FN-ipek zarların oluşumu ve kaldırılmasının ayrıntılı gösterimi. (A) Her saniye kuyuyu (dış sıra/sütundan kaçının) 48 oyuklu bir plakada FN-ipek protein çözeltisi ile doldurun, burada (B) gece boyunca sıvı-hava arayüzünde bir zara kendi kendine birleşir. (C) Parçayı bir cımbızla tutun ve ek parçanın zara dik olarak indirildiğinden emin olmak için 3D baskılı ek üzerindeki (D,E) kılavuzları kullanarak yavaşça zarın üzerine indirin. İpek zar yapışmasının büyütülmesi, ekin (F) zarın hemen üzerinde ve (G) ipek zara temas ederken bir kesitini gösterir. 2 saatlik inkübasyon süresi boyunca, (H) ipek zar kendiliğinden eke yapışır, bu daha sonra (I) zarı arayüzden kaldırmak için kullanılır. Kısaltmalar: FN = fibronektin; PBS = fosfat tamponlu tuzlu su. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
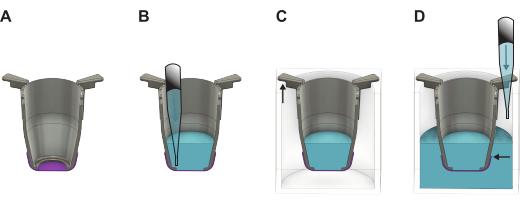
Şekil 2: FN-ipek zarın oluşum plakasından kaldırıldıktan sonra nasıl işleneceğini gösteren ayrıntılı çizim. (A) Kaldırmadan hemen sonra zarlı (mor) ek parça (gri). (B) Membranın apikal tarafına sıvı (mavi) eklenir, daha sonra kesici uç kollarının daha uzun kısmının duvarlara asıldığı ve daha kısa olan kısmın ek parçayı plakanın merkezinde konumlandırdığı (C) 24 oyuklu bir plakaya yerleştirilir. (D) Kuyuya sıvı eklenir, böylece sıvı seviyesinin dengeli ve zarın kenarının üzerinde olması sağlanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: 3D baskılı eklerin fotoğrafları. (A) Ekler, 3D yazıcıdan çıkarıldıktan hemen sonra, hala yapı plakasına bağlı. (B) Destekleri kırmadan önce, yapı plakasından çıkarıldıktan sonra bir kesici uç. (C) Destekler çıkarıldıktan sonra bir kesici uç. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
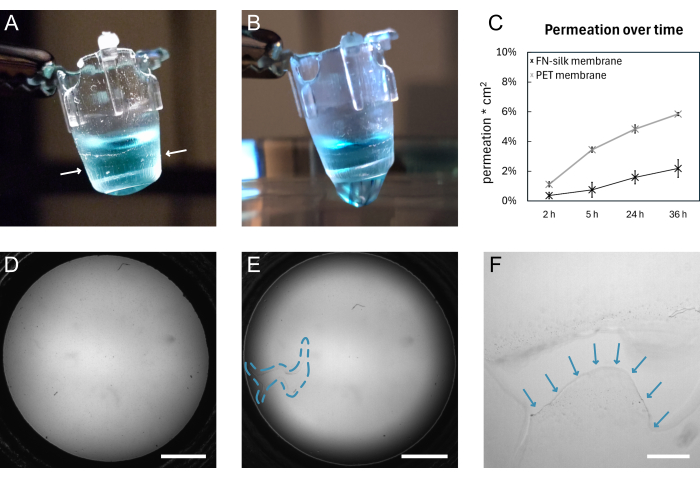
Şekil 4: Kırılmadan önce ve sonra bir FN-ipek zarı. (A) Apikal tarafta 200 μL boyalı (mavi) PBS taşıyan sağlam bir zarın fotoğrafı. Ek parçanın etrafına sarılan zar kenarı beyaz oklarla gösterilir. (B) Aynı zarın yırtıldıktan sonra çekilmiş fotoğrafı. PBS zardan sızıyor. (C) 3 kDa'lık bir floresan molekülün, 9 gün boyunca standart hücre kültürü koşulları altında tutulan bir ipek zar veya ticari olarak temin edilebilen bir PET zarı yoluyla 36 saat boyunca nüfuz etmesini gösteren çizim. (D) Yırtılmadan önce bir zarın parlak alan görüntüsü. (E) Yırtılmadan sonra aynı zarın parlak alan görüntüsü. Arızalı alan mavi kesikli anahat ile gösterilir. (F) D'de gösterilen yırtığın büyütülmüş görünümü, yırtık zarın kenarı mavi oklarla gösterilmiş. Ölçek çubukları = 1 mm (D,E), 200 μm (F). Kısaltmalar: FN = fibronektin; PBS = fosfat tamponlu salin; PET = poli (etilen tereftalat). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
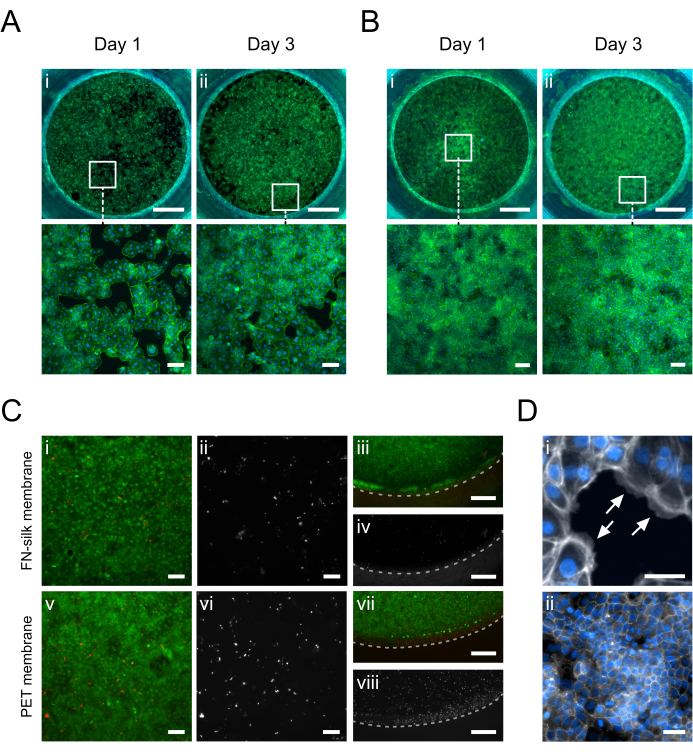
Şekil 5: FN-ipek zarı üzerinde kültürlenmiş keratinositler (HaCaT). 1. Günde, keratinositler apikal (A.i) veya bazal taraftaki (B.i) zarın yüzey alanına yapışmış ve eşit şekilde kaplamıştır (falloidin, yeşil). 3. Günde, apikal (A.ii) veya bazal (B.ii) tarafta (falloidin, yeşil) birleşik bir tek tabaka oluşturulur. (C) Hücre tabakasının merkezinde (i, ii, v, vi) ve çevresinde (iii, iv, vii, viii) bulunan ticari bir PET zar (v-viii) ile karşılaştırıldığında ipek zar (i-iv) üzerindeki hücre canlılığının değerlendirilmesi. Canlı hücreler yeşil (i, iii, v, vii) ve ölü hücreler kırmızı (i, iii, v, vii) veya beyaz (ii, iv, vi, viii) olarak gösterilir. Kesikli çizgi, membran ekleme interfazını işaretler. (D) Ayrıntılı olarak yakınlaştırılmış, (i) hücrenin zara yapışmasını (beyaz oklar) gösterir (falloidin, beyaz) ve (ii) kültürde 3 gün sonra oluşan sıkı bir bağlantı ağı (ZO-1, beyaz). Ölçek çubukları = 1 mm (üst sıra: A,B), 100 μm (alt sıra: A,B,Ci, ii, v, vi), 500 μm (C iii, iv, vii, viii), 50 μm (D). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Membranların hücre kültürü eklerine entegre edildiği önceki çalışmalara genel bakış. Kısaltmalar: PCL = polikaprolakton; PEGDA = poli (etilen glikol) diakrilat; PLGA = poli (laktik-ko-glikolik asit); PDMS = Polidimetilsiloksan; PC = Polikarbonat; RSS = Rekombinant örümcek ipek proteini; PLCL = Poli (laktid-ko-kaprolakton); RHSIF = Rekombinant hagfish balçık ara filament proteinleri Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 2: FN-ipek zarları üzerinde kültürlenen farklı hücre tiplerini özetleyen önceki çalışmalara genel bakış. FN-4repCT (FN-ipek), Euprosthenops australis'in genetik düzeyde fibronektinden bir RGD motifi ile rekombinant olarak üretilen ve işlevselleştirilen halatlı ipeğinin kısa bir versiyonudur. Bu protein burada özetlenen tüm durumlarda kullanılır. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 3: Sorun Giderme. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Ek Dosya 1: Ekleri 3B yazdırmak için tasarım dosyası (.stl). Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 2: Malzeme Tablosunda belirtilen yazıcı ve reçine kullanılırken yazdırma, son işlem ve sterilizasyon protokolü. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil S1: FN-ipek çözeltisini 48 oyuklu plakaya yerleştirirken kullanılması önerilen desenin şeması. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Burada açıklanan protokol, biyolojik olarak ilgili hücre kültürü eklerini yapmanın basit bir yolunu ana hatlarıyla belirtir. Eklerin basılmasıyla başlar, ardından FN-ipek zarların oluşumu ve bağlanması ile devam eder ve hücrelerin zarın hem apikal hem de bazal taraflarına nasıl tohumlanabileceğini göstermekle sona erer. Bu protokolde, hücre kültürlerinde uzun vadeli başarıyı sağlamak için gerçekten kritik bir adım vardır ve bu, eklerin zar üzerine indirilmesi ve kaldırılmasıdır. Bu adımların başarılı bir şekilde uygulanması, sentetik membranlara sahip ticari olarak mevcut sistemlere benzer şekilde hücre kültürüne dayanabilen bir ipek membran ekleme kültür sistemi verecektir. Bunu sağlamak için, özel olarak tasarlanmış kesici uçların yanlarına, düzgün olmayan membran yapışmasına, zayıf noktalar oluşturmasına ve ardından sızıntıya yol açacak şekilde belirli bir açıyla indirilmelerini veya kuyuda yanlara doğru hareket etmelerini önlemek için kılavuz raylar uygulanmıştır. Bir protokolü ilk kez takip ederken küçük sorunların ortaya çıkması yaygın bir durumdur. Yeni kullanıcının bunları atlatmasına yardımcı olmak için, yukarıda sunulan protokolü takip ederken bunları yaşamaları durumunda, olası sorunları ve çözümlerini Tablo 3'te özetledik.
Zarın kendisinin farklı bariyer dokularını modellemek için faydalı olduğu gösterilmiştir ( Tablo 2'de gözden geçirilmiştir); Bununla birlikte, buradaki ekleri basmak için kullanılan reçinenin, diğer hücre tiplerinin canlılığı üzerindeki etkisi açısından kapsamlı bir şekilde test edilmediğine dikkat edilmelidir. Şimdiye kadar böyle bir sorunla karşılaşmamış olsak da, reçinenin bazı hassas hücrelerin canlılığını ve büyümesini olumsuz yönde etkilemesi mümkündür. Bu nedenle, reçinenin kullanılan her hücre tipi ile uyumluluğunu doğrulamak için burada sunulana benzer bir canlılık testinin yapılması önerilir. Sitotoksisite yaşanırsa, kürlenmemiş monomerlerin zamanla sızmasını ve hücrelere zarar vermesini önlemek için daha kapsamlı bir kürleme ve/veya sızma protokolü oluşturulmalıdır. Bu protokol içindeki ekleri yazdırmak için kullanılan reçine için kullanılan böyle bir protokolün bir örneği, Ek Dosya 2'de bulunabilir. Bu protokol daha önce ipek membranlar üzerinde bEnd.3 beyin endotelyalinin 8 güne kadar kültürlenmesi için ekler hazırlamak için kullanılmıştır15.
Bu çalışmada sunulan yöntemin temel faydası, doku kültürü ekleri üzerindeki mevcut plastik zarları değiştirmek ve bu nedenle statik doku kültürü modellerini iyileştirmek için basit bir yol sunmasıdır. Ana sınırlama, kullanıcının 3D baskı ekipmanına erişmesi veya eklerini yazdırmak için bir tesiste zaman satın alması gerektiğidir. Bununla birlikte, gerekirse, zarları çıkarıldıktan sonra ticari doku kültürü ekleri kullanılarak bu durum atlatılabilir. Ek olarak, ipek zarlar, özünde, normal doku kültürü ekleri olarak kullanılabilirken, daha ince ve protein bileşimine sahiptirler ve bu nedenle mevcut sentetik ticari muadillerinden daha hassastırlar. Bu nedenle, kullanıcılar tarafından daha dikkatli kullanılmaları ve elastikiyetlerini korumak için ıslak tutulmaları gerekir. Membranların gerilmeye ve şişmeye16,17 dayanabileceğine dikkat edilmelidir, bu da onları örneğin solunum hareketini taklit etmek için uygun hale getirir. Buna rağmen, yeni kullanıcıların ilk aşamalarda bazı zarları kırması muhtemeldir, ancak zar işleme deneyimleri arttıkça başarı oranının artması beklenmektedir. Sorun devam ederse, kullanıcı sorun giderme için Tablo 3'e başvurmalıdır.
Son on yılda, ticari plastik eklere çeşitli alternatifler sunulmuştur (Tablo 1) ve hücre kültürlerinin performansı her karşılaştırıldığında, yeni, biyolojik olarak daha ilgili zarlar, ticari plastik muadillerinden daha iyi sonuçlar vermiştir 2,5,6,7,14,22. Bu, öncelikle gelişmiş bariyer fonksiyonu 2,5,6,7,14,22 açısından değil, aynı zamanda daha doğal benzeri hücre büyümesininoluşumunda 14 ve ko-kültür sistemlerinde zar yoluyla artan etkileşimlerde7 gözlenmiştir. Bu eğilim daha önce bir kan damarı duvarı modeli oluşturulurken FN-ipek zarlar için gözlemlenmiştir. Bu çalışmada, HDMEC ve düz kas hücreleri (SMC'ler) zarın karşıt taraflarında büyütüldü. SMC'lerin, ticari PET membranlara kıyasla FN-ipek membranlar üzerinde HDMEC ile birlikte kültürlendiğinde daha kalın bir ECM salgıladığı gösterilmiştir. Benzer şekilde, HDMEC FN-ipek membranlar17 üzerinde daha sıkı bir bariyer oluşturdu. İyileştirilmiş hücre kültürü sonuçları, muhtemelen gelişmiş hücresel iletişimden ve daha fazla in vivo benzeri kültür koşullarından kaynaklanmaktadır. FN-ipek zar, kalınlık, yapı ve mekanik özellikler açısından doğal BM'ye çok daha yakındır. Doğal BM 20 nm ile 3 μmarasında 22 incedir, PET membranlar 10 μm ve FN-ipek membranlar yaklaşık 1 μm civarındadır, bu nedenle doğal aralığa iyi bir şekilde girer. FN-ipek zarın yapısı da tıpkı doğal BM22 gibi nanofibriler16 iken, PET zarı, genellikle çapı 0,4 μm ile 8 μm arasında olan, iz ile oyulmuş gözeneklere sahip plastikten oluşur7. PET membranlar ayrıca BM'den çok daha serttir, kPa ile MPa arasında değişen BM'ye kıyasla 2 GPa civarında bir Young modülüne sahiptir, ancak genellikle 250-500 kPa22 civarında belirtilir. FN-ipek membranlar, doğal koşullara giren 115 kPa16'lık bir Young modülüne sahiptir. Ayrıca, hücreler zar üzerinde büyütüldükten sonra, zarın kendisi değil, kuvvetlerinin baskın faktör haline geldiğine de dikkat edilmelidir17. Sonuç olarak, FN-ipek proteininin entegre işlevselleştirilmesinin, hücrelerin doğrudan zara yapışmasını sağladığı ve bu nedenle bir kaplamanın gerekli olmayacağı da belirtilmelidir. PET membranlar için, uygun hücre yapışmasını sağlamak için bir ECM proteini ile kaplanması genellikle standarttır7.
FN-ipek zarı, PET zarının yerini almak için kullanılan diğer yaklaşımlarla karşılaştırıldığında ( Tablo 1'de gözden geçirilmiştir), yöntemimizin ana avantajı, rekombinant olarak üretilen işlevselleştirilmiş ipek proteininin kullanılmasıdır. Bu, kollajen gibi diğer protein bazlı, hayvansal türevli materyallerin aksine tekrarlanabilirliği ve tanımlanmış kültür koşullarını sağlar. Proteinin işlevselleştirilmesinin, hücrelerin17 olduğu gibi zarlara iyi yapıştığı için herhangi bir kaplamaya ihtiyaç duyulmamasını sağladığına dikkat edin. Ayrıca, burada açıklanan ipek bazlı zarların üretimi, kendi kendine montaja dayanır ve örneğin elektroeğirmeye dayanan diğer birçok tekniğin aksine, herhangi bir karmaşık kurulum veya sert kimyasalların kullanılmasını gerektirmez. Membranın kesici uca kendiliğinden yapışması, iki parçalı kesici uçlar, yapıştırma ve silikon montaj halkaları ile ilişkili manuel kullanım ihtiyacını da ortadan kaldırır, böylece ölçeklendirmeyi basitleştirir ve herhangi bir laboratuvarda kolay tekrarlanabilirlik sağlar. Kolay üretime ek olarak, farklı kesici uç malzemeleri kullanılabildiğinden ve ilk çözeltinin16 ipek konsantrasyonu ayarlanarak membran kalınlığı ayarlanabildiğinden, yöntemimizin kullanıcının deneysel ihtiyaçlarına uyarlanması kolaydır. Son olarak, bu protokol, bildiğimiz kadarıyla, bir doku kültürü ekine bağlı en güncel en ince serbest duran membranı verebilir ve doğal bazal membrana en yakın benzerliği sağlar.
Burada sunulan ipek zar oluşumu ve işleme protokolü, bir hücre kültürü laboratuvarında doku kültürü ekleri ile çalışmaya alışkın olan herkes için kullanımı kolaydır. Plastik zarlardan daha in vivo benzeri bir muadili ile geçişin basit bir yoludur, bu da çeşitli hücre türleri kullanılarak daha ilgili doku modellerinin oluşturulmasına izin verir (Tablo 2). İpek zarları, apikal veya bazal taraflarında hücre kültürünü ve ayrıca iki taraflı olarak farklı hücre tiplerinin ko-kültürlerini destekleyebilir17. İpek membranlar üzerinde geliştirilen bariyer doku modelleri, ilaç taramaları, penetrasyon ve enfeksiyon çalışmaları dahil olmak üzere doku kültürü ekleri ile aynı uygulama yelpazesi için kullanılabilir. Farklı hücre tipleri arasındaki karışmanın ilgi çekici olduğu durumlar için, daha in vivo benzeri özellikleri nedeniyle TC eklerinden daha iyi performans gösterdikleri gösterilmiştir17.
Açıklamalar
L.G., FN-ipek proteini üreten Spiber Technologies AB'de çalışıyor ve M.H.'nin hisseleri var.
Teşekkürler
Yazarlar, rekombinant işlevselleştirilmiş örümcek ipek proteinini sağladığı için Spiber Technologies AB'ye ve 3D baskılı eklerin büyük bir bölümünü basmak için Eline Freeze'e teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| CHEMICALS | |||
| Alexa Fluor 488 | Invitrogen; Thermo Fisher Scientific | A-21121 | Goat anti-mouse, Dilution 1:500 |
| Alexa Fluor 488 Phalloidin | Invitrogen; Thermo Fisher Scientific | A12379 | Dilution 1:400 |
| anti-ZO-1 (1A12) antibody | Invitrogen; Thermo Fisher Scientific | 33-9100 | Mouse anti-human, Monoclonal, Dilution 1:200 |
| Dextran, Alexa Fluor 680; 3,000 MW, Anionic | Invitrogen; Thermo Fisher Scientific | D34681 | Diluted 2,5% (w/v) in 200 ul of culture medium |
| DMEM/F-12 | Gibco; Thermo Fisher Scientific | 31330095 | Supplemented with 5% v/v FBS and 1% v/v Penicillin-Streptomycin |
| Ethanol | Solveco | 1326 | 70% (CAS-no 64-17-5) |
| Fetal Bovine Serum, qualified, heat inactivated, United States | Gibco; Thermo Fisher Scientific | 16140071 | |
| FN-silk | Spiber technologies AB | Store at -80 °C | |
| Isopropanol, EMPARTA ACS analytical reagent | Supelco | 1096342511 | ≥99.5% (CAS-no 67-63-0) |
| Live/Dead Viability/Cytotoxicity Kit | Invitrogen; Thermo Fisher Scientific | L3224 | |
| PBS | Swedish Veterinary Agency / Statens veterinärmedicinska anstalt | 992420 | without Ca and Mg, filtered |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco; Thermo Fisher Scientific | 11548876 | |
| MATERIAL | |||
| Dental LT Clear Resin | Denthouse | #DLCL-01 | |
| HaCaT cells | CLS | 300493 | |
| Nunc Cell-Culture Treated Multidishes 24-well | Fisher Scientific | 10604903 | |
| Nunc Cell-Culture Treated Multidishes 48-wel | Fisher Scientific | 10644901 | |
| TC insert, for 24-well plates, PET, transparent | Sarstedt | 83.3932.041 | pore size: 0.4 µm |
| ThinCert Cell Culture Inserts, translusent membrane (PET) | Greiner | 662640 | pore size: 0.4 µm |
| EQUIPMENT | |||
| EVOM meter with chopsticks | World Precision Instruments (WPI) Germany, GMBH | ||
| Form 3B | FormLabs | ||
| Form Wash | FormLabs | ||
| Form Cure | FormLabs | ||
| Isotemp General Purpose Deluxe Water Baths | Fisherbrand | ||
| Inverted fluorescence microscope Eclipse Ti | Nikon | ||
| Inverted fluorescence microscope DMI6000 B | Leica | ||
| Laminar flow hood Ninosafe, class II | Labolutions | ||
| Midi CO2 Incubator, 40 L | Thermo Scientific |
Referanslar
- Kumar, P., Kedaria, D., Mahapatra, C., Mohandas, M., Chatterjee, K. A designer cell culture insert with a nanofibrous membrane toward engineering an epithelial tissue model validated by cellular nanomechanics. Nanoscale Adv. 3 (16), 4714-4725 (2021).
- Wang, Y., et al. Ultrathin and handleable nanofibrous net as a novel biomimetic basement membrane material for endothelial barrier formation. Colloids Surf B Biointerfaces. 219, 112775(2022).
- Jain, P., Rauer, S. B., Möller, M., Singh, S. Mimicking the natural basement membrane for advanced tissue engineering. Biomacromolecules. 23 (8), 3081-3103 (2022).
- Eom, S., Park, S. M., Han, S. J., Kim, J. W., Kim, D. S. One-step fabrication of a tunable nanofibrous well insert via electrolyte-assisted electrospinning. RSC Advances. 7 (61), 38300-38306 (2017).
- Kim, D., Eom, S., Park, S. M., Hong, H., Kim, D. S. A collagen gel-coated, aligned nanofiber membrane for enhanced endothelial barrier function. Sci Rep. 9 (1), 1-11 (2019).
- Ebrahim, N. A., et al. Porous honeycomb film membranes enhance endothelial barrier integrity in human vascular wall bilayer model compared to standard track-etched membranes. J Biomed Mater Res A. 111 (5), 701-713 (2023).
- Zakharova, M., et al. Transwell-integrated 2 µm thick transparent polydimethylsiloxane membranes with controlled pore sizes and distribution to model the blood-brain barrier. Advanced Materials Technologies. 6 (12), 2100138(2021).
- Park, S., et al. Use of elastic, porous, and ultrathin co-culture membranes to control the endothelial barrier function via cell alignment. Advanced Functional Materials. 31 (9), 2008172(2021).
- Youn, J., et al. Facile and adhesive-free method for bonding nanofiber membrane onto thermoplastic polystyrene substrate to fabricate 3D cell culture platforms. Materials Today Bio. 20, 100648(2023).
- Liu, H., et al. Electrohydrodynamic jet-printed ultrathin polycaprolactone scaffolds mimicking Bruch’s membrane for retinal pigment epithelial tissue engineering. Int J Bioprint. 8 (3), 550(2022).
- Dogan, A. A., Dufva, M. Customized 3D-printed stackable cell culture inserts tailored with bioactive membranes. Sci Rep. 12 (1), 1-12 (2022).
- Rohde, F., Danz, K., Jung, N., Wagner, S., Windbergs, M. Electrospun scaffolds as cell culture substrates for the cultivation of an in vitro blood–brain barrier model using human induced pluripotent stem cells. Pharmaceutics. 14 (6), 1308(2022).
- Slater, S. C., et al. An in vitro model of the glomerular capillary wall using electrospun collagen nanofibres in a bioartificial composite basement membrane. PLoS ONE. 6 (6), e20802(2011).
- Harris, T. I., et al. Utilizing recombinant spider silk proteins to develop a synthetic Bruch’s membrane for modeling the retinal pigment epithelium. ACS Biomater Sci Eng. 5 (8), 4023-4036 (2019).
- Hjelm, L. C., Hedhammar, M., Löfblom, J. In blood–brain barrier model based on recombinant spider silk protein nanomembranes for evaluation of transcytosis capability of biomolecules. Biochem Biophys Res Commun. 669, 77-84 (2023).
- Gustafsson, L., et al. Recombinant spider silk forms tough and elastic nanomembranes that are protein-permeable and support cell attachment and growth. Advanced Functional Materials. 30 (40), 2002982(2020).
- Tasiopoulos, C. P., Gustafsson, L., Van Der Wijngaart, W., Hedhammar, M. Fibrillar nanomembranes of recombinant spider silk protein support cell co-culture in an in vitro blood vessel wall model. ACS Biomater Sci Eng. 7 (7), 3332-3339 (2021).
- Marino, A., Baronio, M., Buratti, U., Mele, E., Ciofani, G. Porous optically transparent cellulose acetate scaffolds for biomimetic blood-brain barrier in vitro models. Front Bioeng Biotechnol. 9, 630063(2021).
- Schramm, R. A., Koslow, M. H., Nelson, D. A., Larsen, M., Castracane, J. A novel impedance biosensor for measurement of trans-epithelial resistance in cells cultured on nanofiber scaffolds. Biosensors. 7 (3), 35(2017).
- Qi, D., et al. Establishment of a human iPSC- and nanofiber-based microphysiological blood-brain barrier system. ACS Appl Mater Interfaces. 10 (26), 21825-21835 (2018).
- Rickabaugh, E., Weatherston, D., Harris, T. I., Jones, J. A., Vargis, E. Engineering a biomimetic in vitro model of Bruch’s membrane using hagfish slime intermediate filament proteins. ACS Biomater Sci Eng. 9 (8), 5051-5061 (2023).
- Choi, J. W., Youn, J., Kim, D. S., Park, T. E. Human iPS-derived blood-brain barrier model exhibiting enhanced barrier properties empowered by engineered basement membrane. Biomaterials. 293, 121983(2023).
- Widhe, M., Shalaly, N. D., Hedhammar, M. A fibronectin mimetic motif improves integrin mediated cell biding to recombinant spider silk matrices. Biomaterials. 74, 256-266 (2016).
- Johansson, U., et al. Assembly of functionalized silk together with cells to obtain proliferative 3D cultures integrated in a network of ECM-like microfibers. Sci Rep. 9 (1), 1-13 (2019).
- Widhe, M., Johansson, U., Hillerdahl, C. O., Hedhammar, M. Recombinant spider silk with cell binding motifs for specific adherence of cells. Biomaterials. 34 (33), 8223-8224 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır