Method Article
맞춤형 조직 배양 인서트에 재조합 기능성 거미줄로 만든 Nanofibrillar 기저막 모방
요약
플라스틱 멤브레인이 있는 조직 배양 삽입물은 세포 배양 실험실에서 세포층과 장벽 조직 모델을 확립하기 위한 투과성 지지체로서 황금 표준입니다. 여기에서, 우리는 플라스틱 멤브레인을 재조합 기능화된 거미줄 단백질로부터 만들어진 생물학적으로 더 관련성이 높은 멤브레인으로 대체하는 간단한 방법을 제시한다.
초록
조직 장벽을 복제하는 것은 새로운 치료법을 평가하기 위한 관련 in vitro 모델을 생성하는 데 중요합니다. 오늘날, 이것은 일반적으로 플라스틱 멤브레인이 있는 조직 배양 삽입물을 사용하여 수행되며, 이는 정점과 기저 측면을 생성합니다. 세포를 지지하는 것 외에도, 이러한 막은 나노 섬유, 단백질 기반 매트릭스인 원래의 대응물인 기저막(basement membrane)을 모방하는 것과는 거리가 멉니다. 이 연구에서는 플라스틱 멤브레인을 순수 재조합 기능성 거미줄 단백질로 만든 멤브레인으로 교체하여 조직 배양 삽입물의 생물학적 관련성을 상당히 향상시키는 간단한 방법을 보여줍니다. 실크 멤브레인은 자체 조립을 통해 형성되며 멤브레인이 없는 조직 배양 삽입물에 자발적으로 부착되어 세포를 지지할 수 있습니다. 맞춤형 조직 배양 삽입물은 프로토콜에 제공된 지침에 따라 표준 3D 프린터를 사용하여 인쇄하거나 상업용 삽입물을 구입하여 대신 사용할 수 있습니다. 이 프로토콜은 인서트에 실크 멤브레인을 사용하는 배양 시스템이 어떻게 설정되는지, 그리고 이후에 기존의 상업적으로 이용 가능한 인서트에 사용되는 것과 동일한 세포 배양 기술을 구현할 수 있는 방법을 보여줍니다.
서문
조직 장벽을 복제할 수 있는 체외 모델은 새로운 치료법을 테스트하고 근본적인 질병 메커니즘에 대한 이해를 촉진하는 데 적용할 수 있기 때문에 점점 더 많은 관심을 받고 있습니다 1,2. 본래의 미세환경을 정확하게 재현하기 위해서는 고도로 전문화된 세포외기질(ECM) 복합체인 기저막(BM)의 기능을 재현하는 것이 중요합니다. BM은 인체의 거의 모든 조직에 존재하며, 내피 및 상피 세포를 지지하고 기저 조직 2,3에서 분리합니다. BM은 물리적 지원을 제공하는 것 외에도 세포와 주변 조직 사이의 생화학적 신호를 조절하고 유지합니다. 이러한 중요한 기능으로 인해 기본 BM3의 기계적 및 기능적 특성뿐만 아니라 구조를 유사한 스캐폴드를 설계해야 합니다.
오늘날 체외에서 BM을 모방하는 가장 일반적인 방법 중 하나는 상업적으로 이용 가능한 조직 배양 삽입물(TC-삽입물)을 사용하는 것입니다. 이들은 본질적으로 챔버를 정점과 기저측면(4,5)으로 나누는 투과성 멤브레인이 있는 플라스틱 실린더입니다. 상업용 인서트의 멤브레인은 사용하기 쉽지만 일반적으로 단단하고 트랙 에칭되며 폴리(탄산염)(PC) 및 폴리(에틸렌 테레프탈레이트)(PET)3,4,6과 같은 폴리머로 만들어집니다. 직경, 공극 밀도 및 크기 측면에서 유연하며 셀 접착력을 향상시키기 위해 코팅할 수 있지만 유사한 두께6, 상호 연결된 다공성, 섬유 구조 및 관련 탄성 계수3와 같은 BM의 다른 모든 관련 기능이 부족합니다.
TC 인서트의 표준화와 사용 편의성은 당사를 포함한 여러 그룹에서 플라스틱 멤브레인을 생체 내와 유사한 제품으로 교체하도록 영감을 주었습니다(표 1 개요). 사용된 재료는 폴리디메틸실록산(PDMS)7, 폴리(락타이드-코-카프로락톤)(PLCL)8 및 폴리카프로락톤(PCL)4,9,10과 같은 폴리머에서 젤라틴 2,11,12, 콜라겐 5,13 및 재조합 거미줄 14,15,16,17과 같은 단백질 기반 재료에 이르기까지 다양합니다. 이들 물질로부터의 멤브레인은 멤브레인이 제거된 상업적으로 이용 가능한 인서트에 다양한 방식으로 부착되었다(4,7,8,10,12,13,14,16,18,19,20,21), 3D 프린팅 1,11,15,17,20 또는 사출 성형 9,22를 통해 제조된 맞춤형 인서트도 있습니다. 그러나 이들 중 대부분은 여전히 두께 측면에서 기본 BM과 닮지 않았으며, 복제품은 수백11,18에서 몇 마이크로미터 5,10,14,21,22에 이릅니다. 또한 이들 중 다수는 복잡한 형성 및/또는 수동 부착 방법 1,7,13,14,18,19,21을 필요로 하므로 다른 실험실에서 확장 및 복제가 어렵습니다.
여기에서는 실크 멤브레인을 형성하고 인서트에 부착하는 간단한 방법을 제시하고 멤브레인의 양쪽에서 세포를 배양하는 방법을 보여줍니다. 실크 막은 스탠딩 용액16,17의 액체-공기 계면에서 FN-4RepCT(FN-실크) 단백질의 자체 조립을 통해 형성됩니다. FN-silk는 Euprosthenops australis의 Major Ampullulate Spidroin 1의 재조합으로 생산된 짧은 버전으로, 피브로넥틴23에서 파생된 RGD 모티브로 기능화되었습니다. 세포 접착, 성장 및 이동을 촉진하는 섬유소 매트릭스로 조립되는 것으로 나타났습니다 15,16,17,23,24,25. 인서트에 멤브레인을 부착하는 방법은 자발적 접착에 의존하며, 멤브레인이 제거된 상업적으로 이용 가능한 인서트(16)뿐만 아니라 폴리락트산(PLA)17 및 Dental LT(15)의 3D 프린팅 인서트에도 적합한 것으로 밝혀졌다. 이 백서에서는 Dental LT에서 인쇄된 인서트에 이 방법을 사용하는 방법에 대해 자세히 설명합니다. FN-실크 멤브레인을 인서트에 부착한 후에는 본질적으로 표준 상업용 조직 배양 인서트처럼 취급할 수 있습니다. 요컨대, 우리는 플라스틱 멤브레인을 단백질 기반의 FN-실크 멤브레인으로 대체하여 조직 장벽의 보다 관련성 있는 in vitro 모델을 생성하는 간단한 방법을 제시합니다.
프로토콜
인서트의 1. 3D 프린팅
- 를 다운로드합니다. 보충 파일 1의 STL 설계 파일(JoVe_Silk_Insert.stl).
- 변환 전용 소프트웨어 패키지에서 파일을 열어 인쇄할 파일을 준비합니다. STL 파일을 사용 중인 3D 프린터의 인쇄 파일로 변환합니다.
- 전용 소프트웨어를 사용하여 지원을 추가하십시오. 지지 구조는 소프트웨어에 의해 설계되었으며 필요한 양은 프린터와 사용 중인 소프트웨어에 따라 다릅니다. 건물 플랫폼이나 지지대가 바닥에 닿지 않도록 인서트의 방향을 지정합니다.
- 사용 중인 3D 프린터에 적합한 생체 적합성 레진(예: Dental LT 또는 BioMed) 또는 필라멘트(예: PLA)를 사용하여 원하는 수의 인서트를 인쇄합니다.
알림: 재료가 고압멸균, 방사선 조사 또는 에탄올 침지와 같은 적절한 멸균 과정을 견딜 수 있는지 확인하십시오. - 인쇄 플랫폼에서 인쇄된 인서트를 분리하고 완성된 부품에서 인쇄된 지지 구조를 제거합니다.
- 수지 프린터를 사용하는 경우 제조업체에서 제공하는 표준 프로토콜을 사용하여 인서트를 처리하십시오.
알림: 사용하는 수지에 따라 가공이 달라질 수 있습니다. 본 명세서에 사용된 레진에 사용된 프로토콜은 보충 파일 2에 제공된다. - 선택한 재료에 적합한 기술을 사용하여 인서트를 멸균하십시오.
알림: 권장 사항은 고압멸균, 방사선 조사 또는 70% 에탄올 또는 이들의 조합에 담그는 것입니다. 수지 프린터를 사용하는 경우 최적의 생체 적합성을 달성하기 위해 광범위한 침출 프로토콜이 필요할 수 있습니다. 권장 사항은 보충 파일 2 에 제공된 프로토콜을 참조하십시오. - 인서트가 완전히 건조되었는지 확인하고 사용할 때까지 멸균 상태로 보관하십시오.
2. FN-실크 멤브레인의 형성
- 상자에 드라이아이스를 채우고 -80 °C 냉동고로 가져옵니다.
- -80 °C 냉동고에서 FN-실크 바이알을 수거하여 드라이아이스에 넣어 운반합니다. FN-silk 바이알을 생물 안전 작업대로 가져와 추가 단계를 수행합니다. FN-실크 바이알을 마이크로 원심분리기 튜브 랙에 넣어 과도하게 만지지 않고 해동합니다.
- FN-실크가 해동되는 동안 48웰 플레이트의 포장을 풉니다. FN-실크가 완전히 해동되면 10분 이내에, 가급적이면 더 빨리 다음 단계로 진행하십시오.
- FN-실크 용액을 냉장 또는 실온 PBS에 원하는 농도(바람직하게는 1.8mg/mL)로 희석합니다. 550 μL의 FN-silk 용액을 48웰 플레이트의 빈 웰 바닥에 직접 피펫팅합니다. 원하는 수의 멤브레인이 준비될 때까지 FN-silk 용액을 피펫팅합니다.
알림: 기포가 유입되지 않도록 하고 피펫으로 즉시 기포를 제거하십시오. 행 A 또는 F 또는 열 1 또는 8의 웰이나 인접한 웰을 사용하지 마십시오( 추가 그림 S1의 개략도 참조). - 48웰 플레이트에 뚜껑을 덮고 더 큰 멸균 상자 안에 넣어 배양 중에 멸균 환경을 제공합니다.
- 생물 안전 작업대에서 상자를 조심스럽게 옮기고 밤새 큰 공기 흐름이 없는 방해받지 않는 장소의 주변 조건에 그대로 두십시오.
3. FN-실크 멤브레인을 인서트에 접착
- 다음 날, 멸균 삽입물을 생물 안전 작업대로 가져옵니다.
- FN-실크 멤브레인이 있는 48웰 플레이트가 들어 있는 대형 멸균 상자를 생물 안전 작업대로 다시 가져오고 추가 단계를 수행합니다. 대형 멸균 상자에서 48웰 플레이트를 조심스럽게 들어 올립니다.
- 웰의 탁도를 관찰하여 멤브레인 형성을 육안으로 확인하고 멤브레인이 포함된 48웰 플레이트의 뚜껑을 엽니다. 멸균 핀셋을 사용하여 인서트 하나를 집어 들고 그림 1과 같이 인서트의 손잡이가 웰 상단에 닿을 때까지 인서트를 멤브레인 위로 안내합니다. 인서트의 바닥을 플레이트의 바닥과 평행하게 유지하십시오.
- 인서트가 형성된 모든 멤브레인 위로 내려갈 때까지 3.3단계를 반복합니다. 48웰 플레이트 위에 뚜껑을 덮은 다음 플레이트를 멸균 상자에 다시 넣습니다. 멤브레인이 인서트에 부착될 수 있도록 주변 조건에서 2시간 동안 플레이트를 방해하지 않도록 두십시오.
- 성장 배지 또는 PBS를 37°C에서 예열합니다.
- 24웰 플레이트의 포장을 풉니다.
- 2시간이 지나면 상자에서 48웰 플레이트를 제거하고 뚜껑을 엽니다. 멸균 핀셋을 사용하여 인서트의 손잡이를 잡고 48웰 플레이트에서 들어 올립니다.
- 들어 올린 직후 인서트를 예열된 배양 배지 또는 PBS로 채우십시오. 기저 측 시딩을 진행하는 경우 100 μL의 배양 배지를 사용하거나 정점 측 시딩을 진행하는 경우 200 μL를 사용하십시오. 나중에 사용하기 위해 멤브레인을 보관해야 하는 경우 대신 200μL의 PBS를 사용하십시오.
체크포인트: 액체가 멤브레인 위에 유지되면 리프팅에 성공한 것입니다. 액체가 벤치에 떨어지면 멤브레인이 누출되므로 무시해야 합니다. - 인서트를 24웰 플레이트의 빈 웰에 놓습니다.
- 48웰 플레이트에서 모든 인서트를 들어올려 24웰 플레이트로 옮깁니다. 플레이트를 약간 기울어진 상태로 유지하면서 세포 파종 또는 보관을 위한 PBS를 진행하는 경우 웰에 1,000μL의 성장 배지를 채웁니다.
알림: 멤브레인의 가장자리가 액체 레벨 아래에 있는 것이 중요합니다(그림 2). - 세포를 즉시 파종해야 하는 경우, 세포가 파종될 멤브레인의 어느 쪽에 따라 섹션 4 또는 5로 진행합니다. 그렇지 않은 경우 24웰 플레이트의 뚜껑을 덮고 냉장고(4°C) 또는 37°C 인큐베이터에 넣습니다. 인큐베이터에 넣는 경우 필요한 양이 유지되도록 이틀에 한 번씩 PBS를 보충합니다.
4. 멤브레인의 정점 쪽에 세포 파종
알림: 멤브레인을 PBS에 보관한 경우 섹션 6에 설명된 대로 PBS를 예열된 배양 배지로 교체하십시오.
- 세포를 채취합니다. 멤브레인당 원하는 수의 세포가 현탁액의 20-50 μL에 존재하도록 셀 현탁액을 준비합니다. 원하는 세포 농도를 얻기 위해 재현탁합니다.
- P100 또는 P200 피펫을 사용하여 세포 현탁액의 20-50μL를 흡입합니다. 피펫 팁을 멤브레인 중앙을 향하게 하여 팁을 인서트 내부의 배양 매체 표면에서 1-2mm 떨어진 곳에 두고 피펫 플런저를 천천히 눌러 팁 가장자리에 물방울을 만듭니다. 방울을 인서트 내부의 배양 배지에 접촉시킵니다.
알림: 피펫을 작업 표면에 수직으로 유지하십시오. - 나머지 멤브레인에 대해 4.2단계를 반복합니다. 균일한 세포 분포를 보장하기 위해 5개의 멤브레인을 파종한 후 세포 스톡을 재현탁시킵니다. 멤브레인에서 더 나은 세포 분포를 보장하기 위해 플레이트를 8자 모양으로 움직입니다.
- 표준 조건(37°C 및 5% CO2)에서 배양하고 이틀에 한 번씩 배지를 교체합니다.
5. 멤브레인의 기저 쪽에 세포 파종
참고: 멤브레인이 PBS에 보관된 경우 섹션 6에 설명된 대로 PBS를 100μL의 예열된 성장 배지로 교체하고 웰을 1mL의 예열된 성장 배지로 채웁니다.
- 세포를 수확하고 멤브레인당 원하는 수의 세포가 20μL의 현탁액에 존재하도록 세포 현탁액을 준비합니다. 원하는 세포 농도를 얻기 위해 재현탁합니다.
- 페트리 접시의 포장을 풀고 뚜껑을 엽니다. 페트리 접시의 높이가 바닥이 뚜껑에 닿지 않도록 삽입물을 수용할 수 있을 만큼 충분한지 확인하십시오.
- 핀셋을 사용하여 24웰 플레이트에서 삽입물을 들어 올리고 배양 배지를 웰에 남겨 둡니다. 양손에 핀셋 세트를 사용하여 기저 면이 위쪽을 향하고 정점 면이 작업 영역을 향하도록 인서트를 뒤집습니다. 그림 3C와 같이 거꾸로 된 인서트를 페트리 접시에 놓습니다. 나머지 인서트에 대해 반복합니다.
참고: 정점 쪽의 배양 배지를 제거하지 마십시오. 배양 중에 멤브레인을 젖은 상태로 유지합니다. - 용액에서 세포가 균일하게 분포하도록 세포 스톡을 재현탁하고 P100 또는 P200 피펫으로 세포 현탁액의 20μL를 흡입합니다. 피펫 팁을 멤브레인 중앙을 향하게 하고 팁을 멤브레인에서 1-2mm 떨어진 곳에 두고 피펫 플런저를 천천히 눌러 팁 가장자리에 물방울을 만듭니다. 피펫을 멤브레인 표면에 수직으로 유지하고 물방울이 멤브레인 위로 떨어지도록 합니다. 나머지 멤브레인에 대해 반복합니다.
참고: 균일한 세포 분포를 보장하기 위해 5개의 멤브레인을 파종한 후 세포 스톡을 재현탁하십시오. - 페트리 접시에 뚜껑을 덮고 페트리 접시와 24웰 플레이트를 인큐베이터로 가져온 다음 표준 조건(37°C 및 5% CO2)에서 30분 동안 세포와 함께 삽입물을 배양합니다.
- 배양 배지가 들어 있는 24웰 플레이트와 페트리 접시를 생물학적으로 안전한 캐비닛으로 가져옵니다. 양쪽 뚜껑을 열고 양손에 핀셋 세트를 사용하여 하나의 인서트를 집어 들어 멤브레인의 정점 쪽이 위쪽을 향하고 기저 쪽이 아래쪽을 향하도록 뒤집습니다.
- P200 피펫을 사용하여 삽입물 내부에 200μL의 배양 배지를 추가합니다. 인서트를 24웰 플레이트의 미리 채워진 웰 중 하나에 놓고 나머지 멤브레인에 대해 반복합니다.
- 표준 조건(37°C 및 5% CO2)에서 배양하고 이틀에 한 번씩 배지를 교체합니다.
6. 수중 조건에서 문화의 매체 변화
- 1,000 μL/웰을 추가하여 새로운 배양 배지로 새로운 24웰 플레이트를 준비합니다. 핀셋을 사용하여 24웰 플레이트에서 인서트 하나를 들어 올려 약간 기울인 다음 정점 쪽에서 매체를 제거합니다.
- 인서트 내부에 200μL의 신선한 배양 배지를 추가합니다. 신선한 배양 배지로 미리 채워진 웰에 삽입물을 넣습니다. 모든 멤브레인에 대해 반복합니다.
7. 공수 조건에서 문화의 중간 변화
- 핀셋을 사용하여 인서트를 들어 올려 24웰 플레이트의 빈 웰에 넣습니다. 4개의 멤브레인에 대해 반복합니다.
- 24웰 플레이트를 약간 기울이고 각 플레이트 웰 내부에 1,000μL의 신선한 배양 배지를 천천히 추가합니다. 나머지 멤브레인에 대해 반복합니다.
8. 경상피 전기 저항(TEER) 측정
- 웰 내부에 1,000μL의 배양 배지 또는 PBS가 있는 24웰 플레이트를 준비하고 멤브레인을 플레이트로 옮깁니다. 멤브레인 위에 해당 용액이 200μL가 있는지 확인하십시오.
- 핀셋 세트를 사용하여 인서트 암을 부드럽게 눌러 플레이트 내부의 인서트를 잘 고정합니다. 핀셋을 제거하지 않고 TEER 전극을 웰에 삽입하고 측정값을 기록합니다.
- 전극을 제거한 다음 핀셋을 들어 올립니다.
- 나머지 멤브레인에 대해 8.2-8.3단계를 반복합니다.
결과
인서트의 대표 사진
인쇄 플랫폼에서 분리되기 전과 후의 인서트 사진은 그림 3A, B에 나와 있습니다. 지지대가 제거된 완성된 인서트의 이미지가 그림 3C에 나와 있습니다. 그 결과 멸균 및 후속 사용이 가능한 3D 프린팅 인서트 배치가 탄생했습니다.
FN-실크 멤브레인의 리프팅 및 핸들링
FN-실크 멤브레인 형성 및 수동 리프팅의 일반적인 개략도는 그림 1에 나와 있습니다. 그 결과 FN-실크 멤브레인이 부착된 여러 인서트가 생성됩니다. 손상되지 않은 멤브레인을 들어 올릴 때 가장 높은 성공률을 보장하려면 프로토콜에 설명된 단계를 정확하게 따라야 합니다. 그림 4는 멤브레인이 손상되지 않은 상태(A,D)와 찢어진 후(B,E,F)의 사진을 보여줍니다. 찢어짐은 명시야 현미경(그림 4E,F)을 사용하거나 멤브레인을 통한 액체 방울(그림 4B)로 시각화할 수 있습니다. 멤브레인에 수직인 인서트를 들어 올리고 내려 멤브레인이 균일하게 접착되고 인서트 아래로 늘어나도록 하는 것이 중요합니다. 멤브레인 접착은 그림 4A와 같이 육안으로 관찰할 수 있습니다. 지시에 따라 인서트를 내리고 그림 2와 같이 액체 레벨을 유지하면 멤브레인은 장기간 배양 기간 동안 인서트에 부착된 상태로 유지됩니다.
여기서, 삽입물에 대한 멤브레인 부착은 9일 동안 표준 세포 배양 조건 하에서 유지된 멤브레인에 대해 투과 실험 15,16,17을 수행함으로써 검증된다. 간단히 말해서, 멤브레인 위에 형광 분자를 추가하고 아래 용액의 신호를 측정할 때 실크 멤브레인의 투과 프로파일은 시판되는 조직 배양 삽입물(그림 4C)의 투과 프로파일을 따르며, 36시간의 투과 동안 누출이 없음을 나타내고 멤브레인이 온전한 상태로 유지되고 삽입물에 부착되어 있음을 나타냅니다. 유사한 실험이 실크막(17)의 일방(15) 또는 양면에 파종된 세포로 이전에 수행된 바 있다. 접착 강도는 이전에 매크로 압흔(macro indentation)16 및 팽창 테스트(16,17)를 사용하여 입증되었습니다. 매크로 압흔 실험에서, 스타일러스를 사용하여 멤브레인을 늘렸으며, 멤브레인은 인서트(16)에 부착된 상태로 유지된 상태에서 1.4mN의 힘으로 파열되었습니다.
손상되지 않은 멤브레인을 들어 올리는 성공률은 인서트의 재료 및 후처리와 관련이 있다는 점에 유의해야 합니다. 이 프로토콜에서는 사용된 레진으로 프린트된 인서트를 사용하여 들어올린 멤브레인의 95%가 세포 파종에 적합했으며, 유사한 레진을 대신 사용한 경우에는 74%가 적합했습니다. 우리는 접착력이 소수성 상호 작용과 반 데르 발스 힘에 의해 도움을 받는다고 추측하며, 따라서 재료 특성을 변경하면 접착 강도가 변경됩니다. 이것은 멤브레인이 친수성 물질에 잘 부착되지 않는다는 사실에 의해 더욱 뒷받침됩니다(데이터는 표시되지 않음).
FN-silk membrane에 대한 세포 배양의 대표적인 결과
멤브레인의 정점 또는 기저 쪽에서 배양된 각질세포(HaCaT)의 면역형광 이미지는 그림 5에 나와 있습니다. 부착된 세포(그림 5D.i)는 전형적인 각질세포 조약돌 형태(그림 5A.i-B.i) 를 획득하면서 1일차에 배양 영역을 균일하게 덮는 것으로 관찰되었습니다.3일째 되는 날, 각질세포는 합류층(confluent layer)을 형성하고(그림 5A.ii-B.ii) 긴밀한 연접 네트워크(그림 5D.ii)를 형성했는데, 이는 이들이 생리적 상피 기능을 가정하고 있음을 나타냅니다. FN-실크 매트릭스 15,17,23,24에서 달성된 높은 수준의 세포 생존력은 또한 본원에 기술된 실크막-삽입 배양 설정에서 특징지어졌다. 배양 3일 후, 각질형성세포는 높은 생존율을 유지했습니다(그림 5C.i-iv). 또한, 중심(그림 5C.i-ii)과 멤브레인 주변부(그림 5C.iii-iv) 사이에서 죽은 세포의 분포에 차이가 관찰되지 않았으며, 이는 삽입 재료가 HaCaT의 생존력에 미치는 유의미한 영향을 나타내지 않았습니다. 전반적으로, 실크 삽입 배양 시스템은 상용 PET 멤브레인 삽입 시스템과 유사한(그림 5i-ii, v-vi) 개선되지는 않았지만 (그림 5iii-iv, vii-viii) 각질 세포 생존력을 제공했습니다.
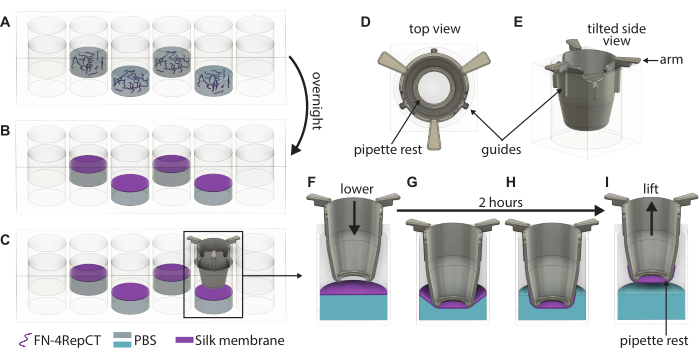
그림 1: 단일 FN-실크 멤브레인의 형성 및 융기에 대한 자세한 그림. (A) 48웰 플레이트에 두 번째 웰(바깥쪽 행/열 제외)을 FN-실크 단백질 용액으로 채우고, (B) 밤새 액체-공기 계면에서 멤브레인으로 자체 조립됩니다. (C) 핀셋으로 인서트를 잡고 3D 프린팅 인서트의 (D,E) 가이드를 사용하여 인서트가 멤브레인에 수직으로 내려가도록 천천히 멤브레인 위로 내립니다. 실크 멤브레인 접착력의 확대경은 멤브레인 바로 위의 인서트 (F)와 실크 멤브레인에 닿을 때의 (G)의 단면을 보여줍니다. 2시간의 배양 기간 동안 (H) 실크 멤브레인은 인서트에 자발적으로 부착된 다음 (I) 계면에서 멤브레인을 들어 올리는 데 사용됩니다. 약어: FN = 피브로넥틴; PBS = 인산염 완충 식염수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
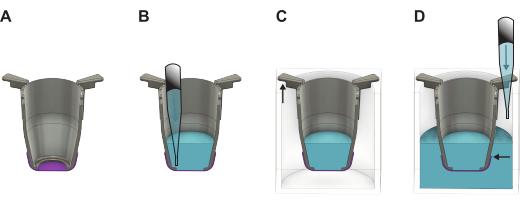
그림 2: FN-실크 멤브레인을 포메이션 플레이트에서 들어 올린 후 처리하는 방법을 보여주는 자세한 그림. (A) 들어 올린 직후 멤브레인(보라색)이 있는 인서트(회색). (B) 멤브레인의 정점 쪽에 액체(파란색)를 첨가한 다음 인서트 암의 긴 부분이 벽에 매달려 있고 짧은 부분은 인서트를 플레이트 중앙에 위치시키는 (C) 24웰 플레이트에 배치됩니다. (D) 액체를 웰에 첨가하여 액체 레벨이 균형을 이루고 멤브레인 가장자리 위에 있도록 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 3D 프린팅 인서트의 사진. (A) 3D 프린터에서 제거한 직후 인서트는 여전히 빌드 플레이트에 부착되어 있습니다. (B) 빌드 플레이트에서 제거한 후 지지대를 파손하기 전에 인서트 1개. (C) 지지대를 제거한 후 인서트 1회. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
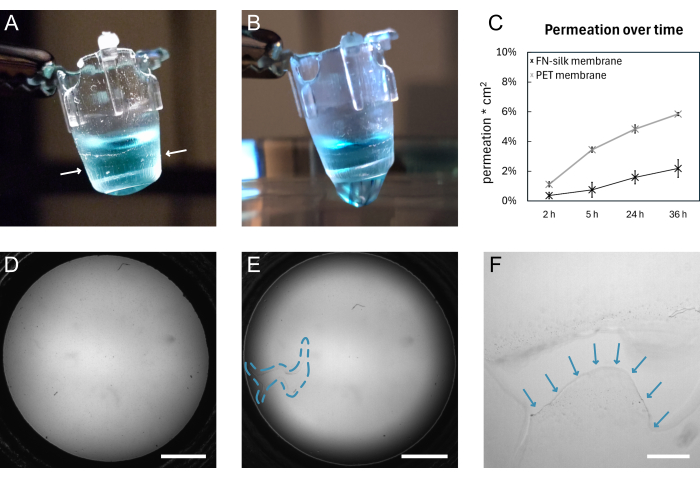
그림 4: 파손 전과 후의 FN-실크 멤브레인. (A) 정점 쪽에 200μL의 염색된(파란색) PBS를 운반하는 온전한 멤브레인의 사진. 인서트를 감싸고 있는 멤브레인 가장자리는 흰색 화살표로 표시됩니다. (B) 찢어진 후 동일한 멤브레인의 사진. PBS가 멤브레인을 통해 누출되고 있습니다. (C) 표준 세포 배양 조건에서 9일 동안 유지된 실크 멤브레인 또는 상업적으로 이용 가능한 PET 멤브레인을 통해 36시간 동안 3kDa 형광 분자의 투과를 보여주는 플롯. (D) 찢어지기 전의 멤브레인의 명시야 이미지. (E) 찢어진 후 동일한 멤브레인의 명시야 이미지. 결함이 있는 영역은 파란색 점선 윤곽선으로 표시됩니다. (F) D 에 표시된 찢어진 부분의 확대 보기와 찢어진 막의 가장자리가 파란색 화살표로 표시되어 있습니다. 스케일 바 = 1mm(D,E), 200μm(F). 약어: FN = 피브로넥틴; PBS = 인산염 완충 식염수; PET = 폴리(에틸렌 테레프탈레이트). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
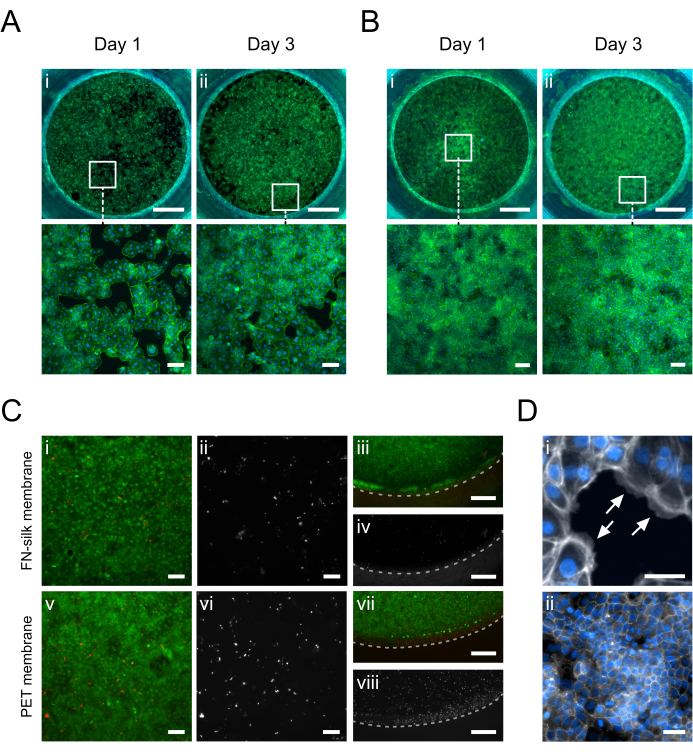
그림 5: FN-실크 막에서 배양된 각질세포(HaCaT). 1일차에는 각질세포가 정점(A.i) 또는 기저면(B.i)(팔로이딘, 녹색)의 막 표면적을 부착하고 균일하게 덮었습니다. 3일째에는 정점(A.ii) 또는 기저(B.ii) 쪽(phalloidin, 녹색)에 합류 단층이 형성됩니다. (C) 세포층의 중심(i, ii, v, vi) 및 주변(iii, iv, vii, viii)에서 상업용 PET 막(v-viii)과 비교한 실크막(i-iv)의 세포 생존력 평가. 살아있는 세포는 녹색(i, iii, v, vii)으로 표시되고 죽은 세포는 빨간색(i, iii, v, vii) 또는 흰색(ii, iv, vi, viii)으로 표시됩니다. 점선은 멤브레인-인서트 계면을 표시합니다. (D) 자세히 확대, (i) 세포막에 대한 세포 접착(흰색 화살표)(phalloidin, 흰색) 및 (ii) 배양 3일 후 형성된 긴밀한 접합 네트워크(ZO-1, 흰색)를 나타냅니다. 스케일 바 = 1 mm (상단 행: A,B), 100 μm (하단 행: A,B,Ci, ii, v, vi), 500 μm (C iii, iv, vii, viii), 50 μm (D). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 멤브레인이 세포 배양 삽입물에 통합된 이전 작업의 개요. 약어: PCL = 폴리카프로락톤; PEGDA = 폴리(에틸렌 글리콜) 디아크릴레이트; PLGA = 폴리(젖산-코-글리콜산); PDMS = 폴리디메틸실록산; PC = 폴리카보네이트; RSS = 재조합 거미줄 단백질; PLCL = 폴리(락타이드-코-카프로락톤); RHSIF = 재조합 먹장어 슬라임 중간 필라멘트 단백질 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: FN-실크 멤브레인에서 배양된 다양한 세포 유형을 요약한 이전 작업의 개요. FN-4repCT(FN-silk)는 Euprosthenops australis 의 드래그라인 실크의 짧은 버전으로, 유전적 수준에서 피브로넥틴의 RGD 모티브로 재조합 생산 및 기능화됩니다. 이 단백질은 여기에 요약된 모든 경우에 사용됩니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 3: 문제 해결. 이 표를 다운로드하려면 여기를 클릭하십시오.
추가 파일 1: 인서트를 3D 프린팅하기 위한 설계 파일(.stl). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 2: 재료 표에 명시된 프린터 및 수지 사용 시 인쇄, 후처리 및 멸균을 위한 프로토콜. 이 파일을 다운로드하려면 여기를 클릭하십시오.
추가 그림 S1: FN-실크 용액을 48웰 플레이트에 배치할 때 사용하도록 제안된 패턴의 개략도. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
본 명세서에 설명된 프로토콜은 생물학적으로 관련된 세포 배양 삽입물을 만드는 간단한 방법을 개략적으로 설명합니다. 인서트를 인쇄하는 것으로 시작하여 FN-실크 멤브레인의 형성 및 부착으로 시작하여 멤브레인의 정점과 기저 측면 모두에 세포를 파종하는 방법을 보여주는 것으로 끝납니다. 세포 배양의 장기적인 성공을 보장하기 위해 이 프로토콜에서 진정으로 중요한 단계가 하나 있는데, 그것은 멤브레인에 삽입물을 내리고 들어 올리는 것입니다. 이러한 단계를 성공적으로 수행하면 합성 멤브레인을 사용하는 상업적으로 이용 가능한 시스템과 유사하게 세포 배양을 견딜 수 있는 실크 멤브레인 삽입 배양 시스템을 얻을 수 있습니다. 이를 보장하기 위해 맞춤 설계된 인서트의 측면에 가이드 레일을 구현하여 웰에서 비스듬히 내려가거나 옆으로 이동하여 고르지 않은 멤브레인 접착으로 이어져 약점을 생성하고 결과적으로 누출을 방지하는 것을 방지했습니다. 프로토콜을 처음 따를 때 사소한 문제가 발생하는 것이 일반적입니다. 새로운 사용자가 위에 제시된 프로토콜을 따르는 동안 이러한 문제를 경험하는 경우 이를 우회할 수 있도록 표 3에 잠재적인 문제와 해당 솔루션을 간략하게 설명했습니다.
멤브레인 자체는 다양한 장벽 조직을 모델링하는 데 유익한 것으로 나타났습니다( 표 2에서 개요). 그러나, 본원의 삽입물을 프린트하는 데 사용되는 수지는 다른 세포 유형의 생존력에 미치는 영향에 대해 광범위하게 테스트되지 않았다는 점을 지적해야 한다. 지금까지 이러한 문제가 발생하지 않았지만 수지가 일부 민감한 세포의 생존력과 성장에 부정적인 영향을 미칠 수 있습니다. 따라서 여기에 제시된 것과 유사한 생존도 테스트를 수행하여 사용된 각 세포 유형과 수지의 호환성을 확인하는 것이 좋습니다. 세포 독성이 발생하는 경우, 시간이 지남에 따라 경화되지 않은 단량체가 침출되어 세포에 해를 끼치는 것을 방지하기 위해 보다 철저한 경화 및/또는 침출 프로토콜을 수립해야 합니다. 이 프로토콜 내에서 인서트를 인쇄하는 데 사용되는 레진에 사용된 이러한 프로토콜의 예는 보충 파일 2에서 찾을 수 있습니다. 이 프로토콜은 이전에 최대 8일 동안 실크 막에 bEnd.3 뇌 내피를 배양하기 위한 삽입물을 준비하는 데 사용되었다15.
이 연구에서 제시된 방법의 주요 이점은 조직 배양 삽입물에서 현재 플라스틱 멤브레인을 대체하는 간단한 방법을 제공하여 정적 조직 배양 모델을 개선할 수 있다는 것입니다. 주요 제한 사항은 사용자가 3D 프린팅 장비에 액세스하거나 인서트를 프린팅하기 위해 시설에서 시간을 구매해야 한다는 것입니다. 그러나 필요한 경우 멤브레인을 제거한 후 상업용 조직 배양 삽입물을 사용하여 이를 우회할 수 있습니다. 또한 실크 멤브레인은 본질적으로 일반 조직 배양 삽입물로 사용할 수 있지만 더 얇고 단백질 구성이 풍부하여 현재의 합성 상업용 제품보다 더 민감합니다. 따라서 사용자가 보다 세심하게 다루어야 하며 탄력을 유지하기 위해 젖은 상태를 유지해야 합니다. 멤브레인은 스트레칭 및 팽창(16,17)을 견딜 수 있어, 예를 들어 호흡 동작을 에뮬레이트하는 데 적합하다는 점에 유의해야 한다. 그렇다 하더라도, 신규 사용자가 초기 단계에서 일부 멤브레인을 파괴할 가능성은 있지만, 멤브레인 취급 경험이 증가함에 따라 성공률이 높아질 것으로 예상됩니다. 문제가 계속되면 사용자는 문제 해결을 위해 표 3을 참조해야 합니다.
지난 10년 동안 상업용 플라스틱 인서트에 대한 몇 가지 대안이 제시되었으며(표 1), 세포 배양의 성능을 비교할 때마다 생물학적으로 더 관련성이 높은 새로운 멤브레인이 상업용 플라스틱 제품보다 더 나은 결과를 생성했습니다 2,5,6,7,14,22. 이는 주로 장벽 기능(barrier function)2,5,6,7,14,22 향상이라는 측면에서 관찰되었지만, 공동 배양 시스템(co-culture system)7에서 세포막을 통한 상호작용 증가(native-like cell growth)14 및 보다 원시적인 세포 성장(native-like cell growth)의 형성 및 증가된 상호작용(interactions)에서도 관찰되었다 . 이러한 경향은 이전에 혈관 벽 모델을 설정할 때 FN-실크 막에 대해 관찰되었습니다. 이 연구에서 HDMEC와 평활근 세포(SMC)는 막의 반대쪽에서 성장했습니다. SMC는 상업용 PET 멤브레인에 비해 FN-실크 멤브레인에서 HDMEC와 공동 배양할 때 더 두꺼운 ECM을 분비하는 것으로 나타났습니다. 유사하게, HDMEC는 FN-실크 멤브레인(17)에 더 엄격한 장벽을 설정하였다. 개선된 세포 배양 결과는 세포 통신이 개선되고 in vivo와 같은 배양 조건이 더 많아졌기 때문일 수 있습니다. FN-실크 멤브레인은 두께, 구조 및 기계적 특성 측면에서 기본 BM에 훨씬 더 가깝습니다. 네이티브 BM은 20nm에서 3μm사이로 22 얇고, PET 멤브레인은 10 μm, FN-실크 멤브레인은 약 1 μm이므로 네이티브 범위에 잘 속합니다. FN-실크 멤브레인의 구조는 네이티브 BM22와 마찬가지로 나노피브릴라16이며, PET 멤브레인은일반적으로 직경이 0.4μm에서 8μm 사이인 트랙 에칭 기공이 있는 플라스틱으로 구성됩니다7. PET 멤브레인은 또한 BM보다 훨씬 더 단단하며, kPa에서 MPa까지의 BM에 비해 약 2GPa의 영률을 갖지만 일반적으로 약 250-500kPa22로 인용됩니다. FN-실크 멤브레인은 115kPa16의 영률을 가지며 이는 기본 조건에 속합니다. 또한 세포막에서 세포가 성장하면 세포막 자체가 아니라 세포의 강도가 지배적인 요인이 된다는 점에 유의해야 한다17. 결국, FN-silk 단백질의 통합 기능화는 세포가 막에 직접 부착되도록 보장하므로 코팅이 필요하지 않다는 점도 유의해야 합니다. PET 멤브레인의 경우, 적절한 세포 접착을 보장하기 위해 ECM 단백질로 코팅하는 것이 표준인 경우가 많다7.
FN-실크 멤브레인을 PET 멤브레인을 대체하는 데 사용되는 다른 접근법과 비교할 때( 표 1 개요), 당사 방법의 주요 장점은 재조합으로 생산된 기능성 실크 단백질을 사용한다는 것입니다. 이는 콜라겐과 같은 다른 단백질 기반, 동물 유래 물질과 대조하여 재현성과 정의된 배양 조건을 보장합니다. 단백질의 기능화는 세포가 그대로 막에 잘 부착되기 때문에 코팅이 필요하지 않다는 것을 다시 한 번 확인하십시오17. 더욱이, 본원에 기술된 실크-기반 멤브레인의 생산은 자기 조립에 기초하며, 예를 들어 전기방사에 의존하는 많은 다른 기술과 달리, 어떠한 복잡한 설정이나 가혹한 화학물질의 사용을 필요로 하지 않는다. 멤브레인이 인서트에 자발적으로 접착되기 때문에 2액형 인서트, 접착 및 실리콘 마운팅 링과 관련된 수동 처리의 필요성이 제거되어 스케일링이 단순화되고 모든 실험실에서 쉽게 재현할 수 있습니다. 용이한 생산 외에도, 당사의 방법은 다양한 인서트 재료를 사용할 수 있고 초기 용액(16)의 실크 농도를 조정하여 멤브레인 두께를 조정할 수 있기 때문에 사용자의 실험적 요구에 쉽게 적응할 수 있습니다. 마지막으로, 이 프로토콜은 우리가 아는 한 조직 배양 삽입물에 부착된 현재까지 가장 얇은 독립형 멤브레인을 생성할 수 있으며, 이를 통해 기본 기저막과 가장 유사한 모습을 가질 수 있습니다.
여기에 제시된 silk membrane formation and handling 프로토콜은 세포 배양 실험실에서 조직 배양 삽입물을 사용하는 데 익숙한 사람이라면 누구나 쉽게 사용할 수 있습니다. 이는 플라스틱 멤브레인에서 보다 in vivov와 유사한 대응물로 전환하는 간단한 방법이며, 이를 통해 다양한 유형의 세포를 사용하여 보다 관련성이 높은 조직 모델을 생성할 수 있습니다(표 2). 실크 멤브레인은 정점 또는 기저 쪽에서 세포 배양을 지원할 수 있을 뿐만 아니라 양측적으로 다른 세포 유형의 공동 배양을 지원할 수 있습니다17. 실크 멤브레인에서 개발된 장벽 조직 모델은 약물 스크리닝, 투과 및 감염 연구를 포함하여 조직 배양 삽입물과 동일한 응용 분야에 사용할 수 있습니다. 상이한 세포 유형 간의 혼선이 관심의 대상인 경우, 이들은 생체 내와 유사한 특성으로 인해 TC-insert를 능가하는 것으로 나타났다17.
공개
L.G.는 FN-실크 단백질을 생산하는 회사인 Spiber Technologies AB의 주식을 보유하고 있습니다.
감사의 말
저자들은 재조합 기능성 거미줄 단백질을 제공한 Spiber Technologies AB와 3D 프린팅 인서트의 상당 부분을 프린팅한 Eline Freeze에 감사를 표하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| CHEMICALS | |||
| Alexa Fluor 488 | Invitrogen; Thermo Fisher Scientific | A-21121 | Goat anti-mouse, Dilution 1:500 |
| Alexa Fluor 488 Phalloidin | Invitrogen; Thermo Fisher Scientific | A12379 | Dilution 1:400 |
| anti-ZO-1 (1A12) antibody | Invitrogen; Thermo Fisher Scientific | 33-9100 | Mouse anti-human, Monoclonal, Dilution 1:200 |
| Dextran, Alexa Fluor 680; 3,000 MW, Anionic | Invitrogen; Thermo Fisher Scientific | D34681 | Diluted 2,5% (w/v) in 200 ul of culture medium |
| DMEM/F-12 | Gibco; Thermo Fisher Scientific | 31330095 | Supplemented with 5% v/v FBS and 1% v/v Penicillin-Streptomycin |
| Ethanol | Solveco | 1326 | 70% (CAS-no 64-17-5) |
| Fetal Bovine Serum, qualified, heat inactivated, United States | Gibco; Thermo Fisher Scientific | 16140071 | |
| FN-silk | Spiber technologies AB | Store at -80 °C | |
| Isopropanol, EMPARTA ACS analytical reagent | Supelco | 1096342511 | ≥99.5% (CAS-no 67-63-0) |
| Live/Dead Viability/Cytotoxicity Kit | Invitrogen; Thermo Fisher Scientific | L3224 | |
| PBS | Swedish Veterinary Agency / Statens veterinärmedicinska anstalt | 992420 | without Ca and Mg, filtered |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco; Thermo Fisher Scientific | 11548876 | |
| MATERIAL | |||
| Dental LT Clear Resin | Denthouse | #DLCL-01 | |
| HaCaT cells | CLS | 300493 | |
| Nunc Cell-Culture Treated Multidishes 24-well | Fisher Scientific | 10604903 | |
| Nunc Cell-Culture Treated Multidishes 48-wel | Fisher Scientific | 10644901 | |
| TC insert, for 24-well plates, PET, transparent | Sarstedt | 83.3932.041 | pore size: 0.4 µm |
| ThinCert Cell Culture Inserts, translusent membrane (PET) | Greiner | 662640 | pore size: 0.4 µm |
| EQUIPMENT | |||
| EVOM meter with chopsticks | World Precision Instruments (WPI) Germany, GMBH | ||
| Form 3B | FormLabs | ||
| Form Wash | FormLabs | ||
| Form Cure | FormLabs | ||
| Isotemp General Purpose Deluxe Water Baths | Fisherbrand | ||
| Inverted fluorescence microscope Eclipse Ti | Nikon | ||
| Inverted fluorescence microscope DMI6000 B | Leica | ||
| Laminar flow hood Ninosafe, class II | Labolutions | ||
| Midi CO2 Incubator, 40 L | Thermo Scientific |
참고문헌
- Kumar, P., Kedaria, D., Mahapatra, C., Mohandas, M., Chatterjee, K. A designer cell culture insert with a nanofibrous membrane toward engineering an epithelial tissue model validated by cellular nanomechanics. Nanoscale Adv. 3 (16), 4714-4725 (2021).
- Wang, Y., et al. Ultrathin and handleable nanofibrous net as a novel biomimetic basement membrane material for endothelial barrier formation. Colloids Surf B Biointerfaces. 219, 112775(2022).
- Jain, P., Rauer, S. B., Möller, M., Singh, S. Mimicking the natural basement membrane for advanced tissue engineering. Biomacromolecules. 23 (8), 3081-3103 (2022).
- Eom, S., Park, S. M., Han, S. J., Kim, J. W., Kim, D. S. One-step fabrication of a tunable nanofibrous well insert via electrolyte-assisted electrospinning. RSC Advances. 7 (61), 38300-38306 (2017).
- Kim, D., Eom, S., Park, S. M., Hong, H., Kim, D. S. A collagen gel-coated, aligned nanofiber membrane for enhanced endothelial barrier function. Sci Rep. 9 (1), 1-11 (2019).
- Ebrahim, N. A., et al. Porous honeycomb film membranes enhance endothelial barrier integrity in human vascular wall bilayer model compared to standard track-etched membranes. J Biomed Mater Res A. 111 (5), 701-713 (2023).
- Zakharova, M., et al. Transwell-integrated 2 µm thick transparent polydimethylsiloxane membranes with controlled pore sizes and distribution to model the blood-brain barrier. Advanced Materials Technologies. 6 (12), 2100138(2021).
- Park, S., et al. Use of elastic, porous, and ultrathin co-culture membranes to control the endothelial barrier function via cell alignment. Advanced Functional Materials. 31 (9), 2008172(2021).
- Youn, J., et al. Facile and adhesive-free method for bonding nanofiber membrane onto thermoplastic polystyrene substrate to fabricate 3D cell culture platforms. Materials Today Bio. 20, 100648(2023).
- Liu, H., et al. Electrohydrodynamic jet-printed ultrathin polycaprolactone scaffolds mimicking Bruch’s membrane for retinal pigment epithelial tissue engineering. Int J Bioprint. 8 (3), 550(2022).
- Dogan, A. A., Dufva, M. Customized 3D-printed stackable cell culture inserts tailored with bioactive membranes. Sci Rep. 12 (1), 1-12 (2022).
- Rohde, F., Danz, K., Jung, N., Wagner, S., Windbergs, M. Electrospun scaffolds as cell culture substrates for the cultivation of an in vitro blood–brain barrier model using human induced pluripotent stem cells. Pharmaceutics. 14 (6), 1308(2022).
- Slater, S. C., et al. An in vitro model of the glomerular capillary wall using electrospun collagen nanofibres in a bioartificial composite basement membrane. PLoS ONE. 6 (6), e20802(2011).
- Harris, T. I., et al. Utilizing recombinant spider silk proteins to develop a synthetic Bruch’s membrane for modeling the retinal pigment epithelium. ACS Biomater Sci Eng. 5 (8), 4023-4036 (2019).
- Hjelm, L. C., Hedhammar, M., Löfblom, J. In blood–brain barrier model based on recombinant spider silk protein nanomembranes for evaluation of transcytosis capability of biomolecules. Biochem Biophys Res Commun. 669, 77-84 (2023).
- Gustafsson, L., et al. Recombinant spider silk forms tough and elastic nanomembranes that are protein-permeable and support cell attachment and growth. Advanced Functional Materials. 30 (40), 2002982(2020).
- Tasiopoulos, C. P., Gustafsson, L., Van Der Wijngaart, W., Hedhammar, M. Fibrillar nanomembranes of recombinant spider silk protein support cell co-culture in an in vitro blood vessel wall model. ACS Biomater Sci Eng. 7 (7), 3332-3339 (2021).
- Marino, A., Baronio, M., Buratti, U., Mele, E., Ciofani, G. Porous optically transparent cellulose acetate scaffolds for biomimetic blood-brain barrier in vitro models. Front Bioeng Biotechnol. 9, 630063(2021).
- Schramm, R. A., Koslow, M. H., Nelson, D. A., Larsen, M., Castracane, J. A novel impedance biosensor for measurement of trans-epithelial resistance in cells cultured on nanofiber scaffolds. Biosensors. 7 (3), 35(2017).
- Qi, D., et al. Establishment of a human iPSC- and nanofiber-based microphysiological blood-brain barrier system. ACS Appl Mater Interfaces. 10 (26), 21825-21835 (2018).
- Rickabaugh, E., Weatherston, D., Harris, T. I., Jones, J. A., Vargis, E. Engineering a biomimetic in vitro model of Bruch’s membrane using hagfish slime intermediate filament proteins. ACS Biomater Sci Eng. 9 (8), 5051-5061 (2023).
- Choi, J. W., Youn, J., Kim, D. S., Park, T. E. Human iPS-derived blood-brain barrier model exhibiting enhanced barrier properties empowered by engineered basement membrane. Biomaterials. 293, 121983(2023).
- Widhe, M., Shalaly, N. D., Hedhammar, M. A fibronectin mimetic motif improves integrin mediated cell biding to recombinant spider silk matrices. Biomaterials. 74, 256-266 (2016).
- Johansson, U., et al. Assembly of functionalized silk together with cells to obtain proliferative 3D cultures integrated in a network of ECM-like microfibers. Sci Rep. 9 (1), 1-13 (2019).
- Widhe, M., Johansson, U., Hillerdahl, C. O., Hedhammar, M. Recombinant spider silk with cell binding motifs for specific adherence of cells. Biomaterials. 34 (33), 8223-8224 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유