Method Article
Membrana basal nanofibrilar imitadora hecha de seda de araña funcionalizada recombinante en insertos de cultivo de tejidos hechos a medida
En este artículo
Resumen
Los insertos de cultivo de tejidos con membranas de plástico son el estándar de oro en los laboratorios de cultivo celular como soportes permeables para establecer capas celulares y modelos de tejidos de barrera. En este artículo, presentamos un método simple para reemplazar la membrana de plástico con una membrana biológicamente más relevante hecha de una proteína de seda de araña funcionalizada recombinante.
Resumen
La replicación de las barreras tisulares es fundamental para generar modelos in vitro relevantes para evaluar nuevas terapias. Hoy en día, esto se hace comúnmente utilizando insertos de cultivo de tejidos con una membrana de plástico, que genera un lado apical y otro basal. Además de proporcionar soporte a las células, estas membranas están lejos de emular a su contraparte nativa, la membrana basal, que es una matriz nanofibrilar basada en proteínas. En este trabajo, mostramos una forma sencilla de mejorar considerablemente la relevancia biológica de los insertos de cultivo de tejidos mediante la sustitución de la membrana plástica por una hecha de una proteína de seda de araña funcionalizada recombinante pura. La membrana de seda se forma a través del autoensamblaje y se adherirá espontáneamente a un inserto de cultivo de tejidos sin membrana, donde puede proporcionar soporte a las células. Los insertos de cultivo de tejidos diseñados a medida se pueden imprimir con una impresora 3D estándar, siguiendo las instrucciones proporcionadas en el protocolo, o se pueden comprar y usar comerciales en su lugar. Este protocolo muestra cómo se configura el sistema de cultivo con membranas de seda en insertos y, posteriormente, cómo se pueden implementar las mismas técnicas de cultivo celular que se utilizan con los insertos tradicionales disponibles comercialmente.
Introducción
Los modelos in vitro que pueden replicar las barreras tisulares han recibido cada vez más atención debido a su aplicabilidad en el ensayo de nuevas terapias y a la facilitación de la comprensión de los mecanismos fundamentales de la enfermedad 1,2. Para recrear con precisión el microambiente nativo, es fundamental recapitular la función de la membrana basal (BM), un complejo de matriz extracelular (MEC) altamente especializado. El BM existe en casi todos los tejidos del cuerpo humano, donde proporciona soporte a las células endoteliales y epiteliales y las separa del tejido subyacente 2,3. Más allá de proporcionar soporte físico, el BM también regula y mantiene las señales bioquímicas entre las células y el tejido circundante. Estas funciones vitales hacen necesario el diseño de andamios que se asemejen a la estructura, así como a las características mecánicas y funcionales del BM3 nativo.
Una de las formas más comunes de imitar el BM in vitro hoy en día es mediante el uso de insertos de cultivo de tejidos disponibles comercialmente (insertos TC). Se trata esencialmente de cilindros de plástico con una membrana permeable que divide la cámara en lados apical y basolateral 4,5. Si bien son fáciles de usar, las membranas de los insertos comerciales son generalmente rígidas, grabadas y hechas de polímeros como poli(carbonato) (PC) y poli(tereftalato de etileno) (PET)3,4,6. Son flexibles en términos de diámetro, densidad de poros y tamaño y pueden recubrirse para mejorar la adhesión celular, pero carecen de todas las demás características relevantes del BM, como un grosor comparable6, porosidad interconectada, arquitectura fibrosa y módulo elástico3 relevante.
La estandarización de los insertos TC y su facilidad de uso ha inspirado a varios grupos, incluido el nuestro, a reemplazar la membrana de plástico por una contraparte más similar a la in vivo (vista general en la Tabla 1). Los materiales utilizados van desde polímeros como el polidimetilsiloxano (PDMS)7, la poli(lactida-co-caprolactona) (PLCL)8 y la policaprolactona (PCL)4,9,10 hasta materiales a base de proteínas como la gelatina 2,11,12, el colágeno 5,13 y la seda de araña recombinante 14,15,16,17. Las membranas de estos materiales se han unido de varias maneras, tanto a los insertos disponibles comercialmente de los que se ha eliminado la membrana 4,7,8,10,12,13,14,16,18,19,20,21 , así como a insertos diseñados a medida fabricados mediante impresión 3D 1,11,15,17,20 o moldeo por inyección 9,22. Sin embargo, la mayoría de estos todavía están lejos de parecerse al BM nativo en términos de grosor, donde las réplicas van desde centenas11,18 hasta unos pocos micrómetros 5,10,14,21,22. Muchos de ellos también requieren una formación compleja y/o métodos de fijación manual 1,7,13,14,18,19,21, lo que dificulta el escalado y la replicación en otros laboratorios.
Aquí, presentamos un método simple para formar y unir una membrana de seda a los insertos y mostramos cómo cultivar células a ambos lados de la membrana. Las membranas de seda se forman a través del autoensamblaje de la proteína FN-4RepCT (FN-silk) en la interfaz líquido-aire de una solución estancada16,17. FN-silk es una versión corta producida recombinantemente de Major Ampullulate Spidroin 1 de Euprosthenops australis, funcionalizada con un motivo RGD derivado de la fibronectina23. Se ha demostrado que se ensambla en matrices fibrilares que promueven la adhesión, el crecimiento y la migración celular 15,16,17,23,24,25. El método de fijación de la membrana en el inserto se basa en la adhesión espontánea y se ha encontrado adecuado para los insertos disponibles comercialmente de los que se ha extraído la membrana16, así como para los insertos impresos en 3D de ácido poliláctico (PLA)17 y Dental LT15. Este documento detalla cómo se utiliza este método para los insertos impresos de Dental LT. Una vez que las membranas de seda FN se han unido a los insertos, pueden, en esencia, tratarse como insertos comerciales estándar de cultivo de tejidos. En resumen, presentamos un método sencillo para generar modelos in vitro más relevantes de barreras tisulares mediante la sustitución de membranas de plástico por una membrana de seda FN basada en proteínas.
Protocolo
1. 3D-impresión de insertos
- Descargue el archivo . Archivo de diseño STL (JoVe_Silk_Insert.stl) del Archivo Suplementario 1.
- Prepare los archivos para imprimir abriéndolos en el paquete de software dedicado a convertir un archivo . STL a un archivo de impresión para la impresora 3D que se está utilizando.
- Utilice el software dedicado para agregar soportes. La estructura de soporte está diseñada por el software, y la cantidad necesaria dependerá de la impresora y del software que se utilice. Oriente el inserto de modo que ni la plataforma del edificio ni los soportes toquen la parte inferior.
- Imprima el número deseado de insertos utilizando una resina biocompatible (como Dental LT o BioMed) o filamento (como PLA) adecuado para la impresora 3D que se está utilizando.
NOTA: Asegúrese de que el material pueda soportar un proceso de esterilización adecuado, como el autoclave, la irradiación o la inmersión en etanol. - Separe los insertos impresos de la plataforma de impresión y retire la estructura de soporte impresa de la pieza terminada.
- Si utilizas una impresora de resina, procesa los insertos utilizando el protocolo estándar proporcionado por el fabricante.
NOTA: El procesamiento puede variar en función de la resina que se utilice. El protocolo utilizado para la resina utilizada en este documento se proporciona en el Archivo Complementario 2. - Esterilice los insertos utilizando una técnica adecuada para el material elegido.
NOTA: Las recomendaciones son la esterilización en autoclave, la irradiación o la inmersión en etanol al 70%, o una combinación de ambos. Si se utiliza una impresora de resina, es posible que se necesite un amplio protocolo de lixiviación para lograr una biocompatibilidad óptima. Consulte el protocolo proporcionado en el Archivo Suplementario 2 para obtener una recomendación. - Asegúrese de que los insertos estén completamente secos y guárdelos estériles hasta su uso.
2. Formación de membranas de seda FN
- Llene una caja con hielo seco y llévela al congelador a -80 °C.
- Recoja los viales de seda FN del congelador a -80 °C y colóquelos en hielo seco para su transporte. Lleve los viales de seda FN a un gabinete de seguridad biológica y realice los pasos adicionales allí. Coloque los viales de seda FN en una rejilla de tubos de microcentrífuga para descongelarlos sin tocarlos en exceso.
- Mientras la seda FN se descongela, desempaque la placa de 48 pocillos. Una vez que la seda FN se haya descongelado por completo, continúe con el siguiente paso dentro de los 10 minutos, preferiblemente lo más pronto.
- Diluya la solución de FN-silk en PBS refrigerado o a temperatura ambiente hasta la concentración deseada, preferiblemente 1,8 mg/mL. Pipetear 550 μL de solución de FN-silk directamente en el fondo de un pocillo vacío en la placa de 48 pocillos. Pipetear la solución de FN-silk hasta que se haya preparado el número deseado de membranas.
NOTA: Evite introducir burbujas de aire y elimine las burbujas de aire inmediatamente con una pipeta. No utilice los pozos de la fila A o F o de la columna 1 u 8, ni los pozos adyacentes (véase el esquema de la figura suplementaria S1). - Coloque la tapa en la placa de 48 pocillos y colóquela dentro de una caja estéril más grande para proporcionar un entorno estéril durante la incubación.
- Retire con cuidado la caja del armario de seguridad biológica y déjela en condiciones ambientales en un lugar tranquilo y sin un flujo de aire significativo durante la noche.
3. Adherencia de membranas de seda FN a los insertos
- Al día siguiente, lleve los insertos estériles al gabinete de seguridad biológica.
- Lleve la gran caja estéril que contiene la placa de 48 pocillos con las membranas FN-silk al armario de seguridad biológica y realice allí los siguientes pasos. Levante con cuidado la placa de 48 pocillos de la caja estéril grande.
- Verifique visualmente la formación de membranas observando la turbidez en los pocillos y abra la tapa de la placa de 48 pocillos que contiene las membranas. Tome un inserto con pinzas estériles y guíe el inserto hacia abajo sobre la membrana hasta que las manijas del inserto toquen la parte superior del pocillo, como se muestra en la Figura 1. Mantenga la parte inferior del inserto paralela a la parte inferior de la placa.
- Repita el paso 3.3 hasta que los insertos se hayan bajado sobre todas las membranas formadas. Coloque la tapa encima de la placa de 48 pocillos y luego vuelva a colocar la placa en la caja estéril. Deje la placa intacta durante 2 h en condiciones ambientales para permitir que las membranas se adhieran a los insertos.
- Precalentar el medio de crecimiento o PBS a 37 °C.
- Desempaque una placa de 24 pocillos.
- Una vez que hayan pasado 2 h, retire la placa de 48 pocillos de la caja y abra la tapa. Con pinzas estériles, sostenga un inserto por sus asas y levántelo de la placa de 48 pocillos.
- Inmediatamente después de levantar, llene el inserto con medio de cultivo precalentado o PBS. Utilice 100 μL de medio de cultivo si se procede a la siembra del lado basal o 200 μL si se procede a la siembra del lado apical. Si las membranas se van a almacenar para su uso posterior, utilice 200 μL de PBS en su lugar.
PUNTO DE CONTROL: Si el líquido se retiene por encima de la membrana, el levantamiento se realizó correctamente. Si el líquido gotea sobre el banco, la membrana gotea y debe ignorarse. - Coloque el inserto en un pocillo vacío de la placa de 24 pocillos.
- Levante todos los insertos de la placa de 48 pocillos y transfiéralos a la placa de 24 pocillos. Llene los pocillos con 1.000 μL de medio de crecimiento si se procede con la siembra de células o PBS para el almacenamiento mientras mantiene la placa ligeramente inclinada.
NOTA: Es importante que el borde de la membrana esté por debajo del nivel del líquido (Figura 2). - Si las células se van a sembrar de inmediato, proceda a la sección 4 o 5 dependiendo del lado de la membrana en el que se siembran las células. De lo contrario, coloque la tapa en la placa de 24 pocillos y colóquela en el refrigerador (4 ° C) o en una incubadora a 37 ° C. Si se coloca en la incubadora, reponga el PBS cada dos días para asegurarse de que se mantenga el volumen necesario.
4. Siembra celular en el lado apical de la membrana
NOTA: Si las membranas se han almacenado en PBS, reemplace el PBS con un medio de cultivo precalentado como se describe en la sección 6.
- Cosecha las células. Prepare la suspensión celular de manera que el número deseado de células por membrana esté presente en 20-50 μL de la suspensión. Vuelva a suspender para lograr la concentración celular deseada.
- Con una pipeta P100 o P200, aspire 20-50 μL de la suspensión celular. Apuntando la punta de la pipeta hacia el centro de la membrana, mantenga la punta a 1-2 mm de distancia de la superficie del medio de cultivo dentro del inserto y presione lentamente el émbolo de la pipeta para crear una gota en el borde de la punta. Ponga la gota en contacto con el medio de cultivo dentro del inserto.
NOTA: Mantenga la pipeta perpendicular a la superficie de trabajo. - Repita el paso 4.2 para las membranas restantes. Vuelva a suspender el stock celular después de sembrar cinco membranas para garantizar una distribución celular homogénea. Mueva la placa en forma de ocho para garantizar una mejor distribución celular en la membrana.
- Cultivo en condiciones estándar (37 °C y 5% de CO2) y cambio de medio cada dos días.
5. Siembra celular en el lado basal de la membrana
NOTA: Si las membranas se han almacenado en PBS, reemplace el PBS con 100 μL de medio de crecimiento precalentado y llene los pocillos con 1 mL de medio de crecimiento precalentado como se describe en la sección 6.
- Coseche las células y prepare la suspensión celular de modo que el número deseado de células por membrana esté presente en 20 μL de la suspensión. Vuelva a suspender para lograr la concentración celular deseada.
- Desempaque y abra la tapa de una placa de Petri. Asegúrese de que la altura de la placa de Petri sea suficiente para acomodar los insertos sin que sus fondos toquen la tapa.
- Con unas pinzas, levante el inserto para sacarlo de la placa de 24 pocillos, dejando el medio de cultivo en los pocillos. Con un juego de pinzas en cada mano, invierta el inserto de modo que el lado basal mire hacia arriba y el lado apical mire hacia el área de trabajo. Coloque el inserto invertido en la placa de Petri como se muestra en la Figura 3C. Repita el procedimiento para los insertos restantes.
NOTA: No retire el medio de cultivo por el lado apical. Mantendrá la membrana húmeda durante la incubación. - Vuelva a suspender el material celular para garantizar una distribución celular uniforme en la solución y aspire 20 μL de la suspensión celular con una pipeta P100 o P200. Apuntando la punta de la pipeta hacia el centro de la membrana, mantenga la punta a 1-2 mm de distancia de la membrana y presione lentamente el émbolo de la pipeta para crear una gota en el borde de la punta. Mantenga la pipeta perpendicular a la superficie de la membrana y permita que la gota caiga sobre la membrana. Repita para las membranas restantes.
NOTA: Vuelva a suspender el stock de células después de sembrar cinco membranas para asegurar una distribución uniforme de las células. - Coloque la tapa en la placa de Petri, lleve la placa de Petri y la placa de 24 pocillos a la incubadora e incube los insertos con las celdas en condiciones estándar (37 °C y 5 % de CO2) durante 30 min.
- Lleve la placa de 24 pocillos que contiene el medio de cultivo y la placa de Petri al gabinete de seguridad biológica. Abra ambos párpados y, con un juego de pinzas en cada mano, tome un inserto e inviértalo de modo que el lado apical de la membrana mire hacia arriba y el lado basal hacia abajo.
- Con una pipeta P200, añada 200 μL de medio de cultivo dentro del inserto. Coloque el inserto en uno de los pocillos precargados de la placa de 24 pocillos y repita para las membranas restantes.
- Cultivo en condiciones estándar (37 °C y 5% de CO2) y cambio de medio cada dos días.
6. Cambio medio de cultivos en condiciones sumergidas
- Prepare una nueva placa de 24 pocillos con el medio de cultivo fresco añadiendo 1.000 μL/pocillo. Con unas pinzas, levante un inserto de la placa de 24 pocillos, inclínelo ligeramente y retire el medio del lado apical.
- Añada 200 μL de medio de cultivo fresco dentro del inserto. Coloque el inserto en un pocillo que esté prellenado con medio de cultivo fresco. Repita para todas las membranas.
7. Cambio medio de cultivos en condiciones de transporte aéreo
- Con unas pinzas, levante el inserto y colóquelo en un hueco vacío de una placa de 24 pocillos. Repita para cuatro membranas más.
- Incline ligeramente la placa de 24 pocillos y agregue lentamente 1,000 μL de medio de cultivo fresco dentro de cada pocillo de la placa. Repita para las membranas restantes.
8. Medición de la resistencia eléctrica transepitelial (TEER)
- Prepare una placa de 24 pocillos con 1.000 μL de medio de cultivo o PBS dentro de los pocillos y transfiera las membranas a ella. Asegúrese de tener 200 μL de la solución correspondiente por encima de la membrana.
- Con un juego de pinzas, estabilice bien el inserto dentro de la placa presionando suavemente los brazos del inserto. Sin quitar las pinzas, inserte el electrodo TEER en el pocillo y registre la medición.
- Retire el electrodo y luego levante las pinzas.
- Repita los pasos 8.2-8.3 para las membranas restantes.
Resultados
Fotografías representativas de los insertos
En la Figura 3A, B se muestran fotografías de los insertos antes y después de la salida de la plataforma de impresión. En la Figura 3C se muestra una imagen de un inserto terminado del que se ha retirado el soporte. El resultado es un lote de insertos impresos en 3D, listos para su esterilización y posterior uso.
Elevación y manipulación de membranas de seda FN
En la Figura 1 se muestra un esquema general de la formación de la membrana de seda FN y el levantamiento manual. El resultado es una serie de insertos con una membrana de seda FN adjunta. Para garantizar la mayor tasa de éxito con el levantamiento de membranas intactas, se deben seguir con precisión los pasos descritos en el protocolo. La Figura 4 muestra fotografías de una membrana mientras está intacta (A,D) y después de desgarrarse (B,E,F). El desgarro se puede visualizar con el uso de microscopía de campo claro (Figura 4E, F) y/o mediante el goteo de líquido a través de la membrana (Figura 4B). Es importante levantar y bajar los insertos perpendiculares a la membrana, para asegurarse de que la membrana se adhiera uniformemente y se estire por debajo de los insertos. La adhesión de la membrana se puede observar visualmente, como se muestra en la Figura 4A. Si el inserto se baja según las instrucciones y los niveles de líquido se mantienen como se muestra en la Figura 2, la membrana permanece unida al inserto durante largos períodos de cultivo.
En este trabajo, se valida la unión de la membrana al inserto mediante la realización de un experimento de permeación 15,16,17 en membranas que se han mantenido en condiciones estándar de cultivo celular durante 9 días. Brevemente, cuando se agrega una molécula fluorescente en la parte superior de la membrana y se mide la señal en la solución a continuación, el perfil de permeación de las membranas de seda sigue el de un inserto de cultivo de tejidos disponible comercialmente (Figura 4C), lo que no muestra fugas durante 36 h de permeación e indica que la membrana permanece intacta y unida al inserto. Experimentos similares se han llevado a cabo previamente con células sembradas en uno15 o ambos lados de la membrana de seda17. La fuerza de la adherencia se ha demostrado previamente utilizando macro indentación16 y pruebas de inflado 16,17. Dentro de los experimentos de macro indentación, se utilizó una aguja para estirar la membrana, que se rompió bajo una fuerza de 1,4 mN, mientras permanecía unida al inserto16.
Cabe señalar que la tasa de éxito del levantamiento de membranas intactas está relacionada con el material y el postratamiento de los insertos. Con este protocolo, el 95% de las membranas levantadas con insertos impresos con la resina utilizada eran apropiadas para la siembra de células, en comparación con el 74% cuando se utilizó una resina comparable. Especulamos que la adhesión es ayudada por interacciones hidrofóbicas y fuerzas de van der Waals, y por lo tanto la alteración de las propiedades del material cambia la fuerza de la adhesión. Esto se ve respaldado por el hecho de que las membranas no se adhieren bien a los materiales hidrófilos (datos no mostrados).
Resultados representativos del cultivo celular en las membranas de seda FN
En la Figura 5 se muestran imágenes de inmunofluorescencia de queratinocitos (HaCaT) cultivados en el lado apical o basal de la membrana. Se observó que las células adheridas (Figura 5D.i) cubrían uniformemente el área de cultivo el día 1 mientras adquirían la morfología típica de adoquines de queratinocitos (Figura 5A.i-B.i). El día 3, los queratinocitos habían establecido una capa confluente (Figura 5A.ii-B.ii) y formaban una red de uniones estrechas (Figura 5D.ii), lo que indicaba que estaban asumiendo funciones epiteliales fisiológicas. Los altos niveles de viabilidad celular alcanzados en las matrices de sedaFN 15,17,23,24 también se presentaron en la configuración de cultivo de membrana de seda descrita en este documento. Después de 3 días en cultivo, los queratinocitos se mantuvieron altamente viables (Figura 5C.i-iv). Además, no se observaron diferencias en la distribución de las células muertas entre el centro (Figura 5C.i-ii) y la periferia de la membrana (Figura 5C.iii-iv), lo que no revela ningún efecto significativo del material del inserto en la viabilidad de HaCaT. En general, el sistema de cultivo con insertos de seda ofrecía una viabilidad de queratinocitos similar (Figura 5i-ii, v-vi), si no mejorada (Figura 5iii-iv, vii-viii), a la de un sistema comercial de insertos de membrana de PET.
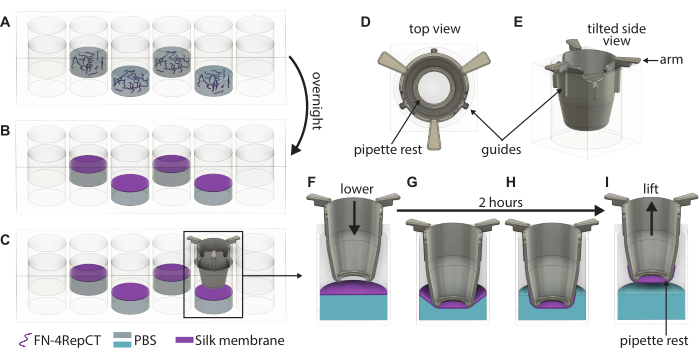
Figura 1: Ilustración detallada de la formación y levantamiento de membranas singulares de seda FN. (A) Llene cada segundo pocillo (evite la fila/columna exterior) en una placa de 48 pocillos con una solución de proteína de seda FN donde (B) se autoensambla en una membrana en la interfaz líquido-aire durante la noche. (C) Agarre el inserto con un par de pinzas y bájelo lentamente sobre la membrana utilizando las guías (D,E) del inserto impreso en 3D para asegurarse de que el inserto baje perpendicular a la membrana. Aumento de la adherencia de la membrana de seda que muestra una sección transversal del inserto (F) justo encima de la membrana y (G) cuando toca la membrana de seda. Durante el período de incubación de 2 horas, (H) la membrana de seda se adhiere espontáneamente al inserto, que luego (I) se usa para levantar la membrana de la interfaz. Abreviaturas: FN = fibronectina; PBS = solución salina tamponada con fosfato. Haga clic aquí para ver una versión más grande de esta figura.
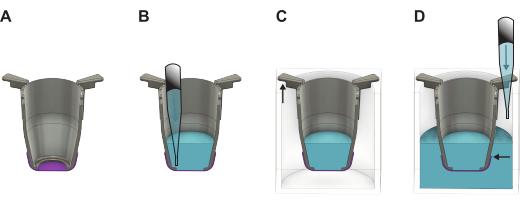
Figura 2: Ilustración detallada que muestra cómo manipular la membrana FN-silk después de levantarla de la placa de formación. (A) El inserto (gris) con la membrana (púrpura) directamente después de levantarla. (B) Se agrega líquido (azul) en el lado apical de la membrana, que luego se coloca en una placa (C) de 24 pocillos donde la parte más larga de los brazos del inserto cuelga de las paredes y la parte más corta mantiene el inserto posicionado en el centro de la placa. (D) Se agrega líquido al pozo, asegurando que el nivel de líquido esté equilibrado y por encima del borde de la membrana. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Fotografías de los insertos impresos en 3D. (A) Los insertos directamente después de ser retirados de la impresora 3D, todavía unidos a la placa de construcción. (B) Un inserto después de ser retirado de la placa de construcción, antes de romper los soportes. (C) Un inserto después de que se hayan retirado los soportes. Haga clic aquí para ver una versión más grande de esta figura.
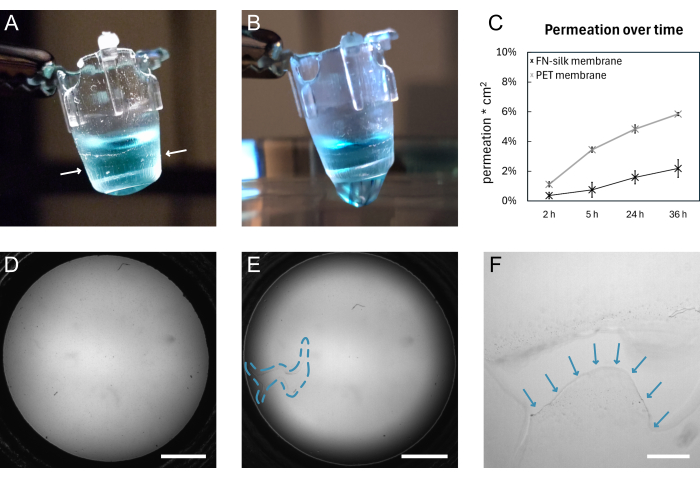
Figura 4: Una membrana de seda FN antes y después de romperse. (A) Fotografía de una membrana intacta que contiene 200 μL de PBS teñido (de azul) en el lado apical. El borde de la membrana envuelto alrededor del inserto se indica con flechas blancas. (B) Fotografía de la misma membrana después del desgarro. El PBS se filtra a través de la membrana. (C) Gráfico que muestre la permeabilidad de una molécula fluorescente de 3 kDa durante 36 h a través de una membrana de seda o una membrana de PET disponible comercialmente mantenida en condiciones estándar de cultivo celular durante 9 días. (D) Imagen de campo claro de una membrana antes de desgarrarse. (E) Imagen de campo claro de la misma membrana después del desgarro. El área defectuosa se indica con el contorno discontinuo azul. (F) Vista ampliada del desgarro que se muestra en D con el borde de la membrana desgarrada indicado por flechas azules. Barras de escala = 1 mm (D,E), 200 μm (F). Abreviaturas: FN = fibronectina; PBS = solución salina tamponada con fosfato; PET = poli(tereftalato de etileno). Haga clic aquí para ver una versión más grande de esta figura.
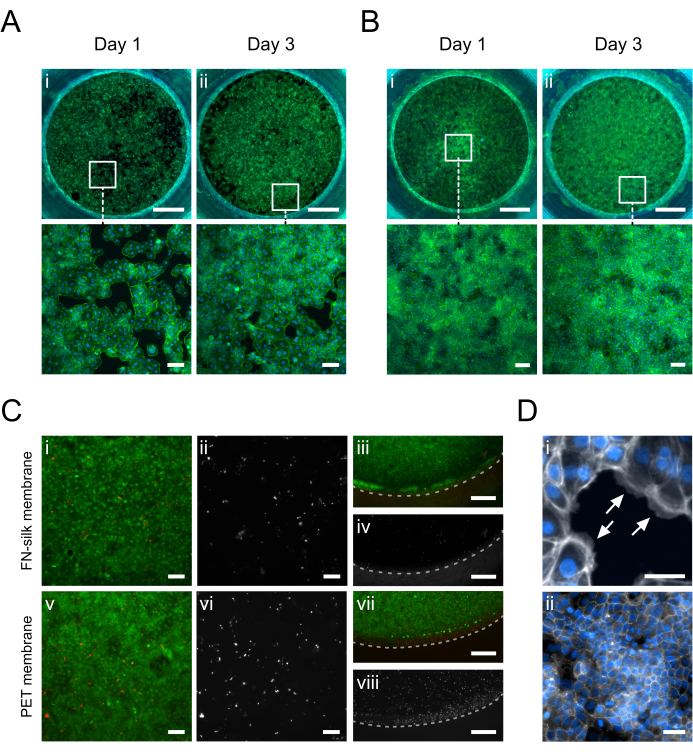
Figura 5: Queratinocitos (HaCaT) cultivados en la membrana de seda FN. En el día 1, los queratinocitos se han adherido y cubierto uniformemente la superficie de la membrana en el lado apical (A.i) o basal (B.i) (faloidina, verde). En el día 3, se establece una monocapa confluente en el lado apical (A.ii) o basal (B.ii) (faloidina, verde). (C) Evaluación de la viabilidad celular en la membrana de seda (i-iv) en comparación con una membrana PET comercial (v-viii) en el centro (i, ii, v, vi) y periferia (iii, iv, vii, viii) de la capa celular. Las células vivas se muestran en verde (i, iii, v, vii) y las células muertas en rojo (i, iii, v, vii) o blanco (ii, iv, vi, viii). La línea discontinua marca la interfase entre la membrana y el inserto. (D) Ampliado en detalle, (i) indicando (flechas blancas) la adhesión de las células a la membrana (faloidina, blanco) y (ii) una red de unión estrecha formada después de 3 días de cultivo (ZO-1, blanco). Barras de escala = 1 mm (fila superior: A,B), 100 μm (fila inferior: A,B,Ci, ii, v, vi), 500 μm (C iii, iv, vii, viii), 50 μm (D). Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Resumen de trabajos previos en los que se han integrado membranas en insertos de cultivo celular. Abreviaturas: PCL = policaprolactona; PEGDA = diacrilato de poli (etilenglicol); PLGA = ácido poli(láctico-co-glicólico); PDMS = polidimetilsiloxano; PC = Policarbonato; RSS = Proteína de seda de araña recombinante; PLCL = Poli(lactida-co-caprolactona); RHSIF = Proteínas de filamento intermedio de baba de pez bruja recombinantes Haga clic aquí para descargar esta tabla.
Tabla 2: Resumen de trabajos previos que resumen los diferentes tipos de células cultivadas en las membranas de seda FN. FN-4repCT (FN-silk) es una versión corta de la seda de arrastre de Euprosthenops australis, que se produce y funcionaliza de forma recombinante con un motivo RGD de fibronectina a nivel genético. Esta proteína se utiliza en todos los casos aquí resumidos. Haga clic aquí para descargar esta tabla.
Tabla 3: Solución de problemas. Haga clic aquí para descargar esta tabla.
Archivo complementario 1: Archivo de diseño (.stl) para la impresión 3D de los insertos. Haga clic aquí para descargar este archivo.
Archivo complementario 2: Protocolo de impresión, postratamiento y esterilización cuando se utiliza la impresora y la resina especificadas en la Tabla de Materiales. Haga clic aquí para descargar este archivo.
Figura suplementaria S1: Esquema del patrón sugerido para usar al colocar la solución de seda FN en la placa de 48 pocillos. Haga clic aquí para descargar este archivo.
Discusión
El protocolo descrito en este documento describe una forma sencilla de hacer insertos de cultivo celular biológicamente relevantes. Comienza con la impresión de los insertos, seguido de la formación y fijación de las membranas de seda FN, y termina mostrando cómo se pueden sembrar células tanto en el lado apical como en el basal de la membrana. Hay un paso verdaderamente crítico en este protocolo para garantizar el éxito a largo plazo con los cultivos celulares y es el descenso y elevación de los insertos en la membrana. La ejecución exitosa de estos pasos producirá un sistema de cultivo con inserto de membrana de seda capaz de soportar el cultivo celular de manera similar a los sistemas disponibles comercialmente con membranas sintéticas. Para garantizar esto, se han implementado rieles guía en los lados de los insertos diseñados a medida para evitar que se bajen en ángulo o se muevan lateralmente en el pozo, lo que provocaría una adherencia desigual de la membrana, generando puntos débiles y posteriormente fugas. Es común que surjan problemas menores al seguir un protocolo por primera vez. Para ayudar al nuevo usuario a eludirlos, en caso de que los experimente mientras sigue el protocolo presentado anteriormente, hemos descrito los problemas potenciales y sus soluciones en la Tabla 3.
Se ha demostrado que la membrana en sí misma es beneficiosa para modelar diferentes tejidos de barrera (se describe en la Tabla 2); Sin embargo, debe señalarse que la resina utilizada para imprimir los insertos en este documento no ha sido ampliamente probada para determinar su efecto sobre la viabilidad de otros tipos de células. Aunque hasta ahora no nos hemos encontrado con ningún problema de este tipo, es posible que la resina pueda afectar negativamente a la viabilidad y el crecimiento de algunas células sensibles. Por lo tanto, se recomienda realizar una prueba de viabilidad similar a la que se presenta aquí para verificar la compatibilidad de la resina con cada tipo de célula utilizada. Si se experimenta citotoxicidad, se debe establecer un protocolo de curado y/o lixiviación más exhaustivo para evitar que los monómeros no curados se filtren con el tiempo y dañen las células. Un ejemplo de este tipo de protocolo, que se utilizó para la resina utilizada para imprimir los insertos dentro de este protocolo, se puede encontrar en el Archivo Suplementario 2. Este protocolo se ha utilizado previamente para preparar insertos para el cultivo de bEnd.3 endotelial cerebral en membranas de seda durante un máximo de 8 días15.
El principal beneficio del método presentado en este trabajo es que ofrece una forma sencilla de reemplazar las membranas plásticas actuales en los insertos de cultivo de tejidos y, como tal, mejorar los modelos estáticos de cultivo de tejidos. La principal limitación es que el usuario necesita acceso a equipos de impresión 3D o comprar tiempo en una instalación para imprimir sus insertos. Sin embargo, si es necesario, esto podría evitarse mediante el uso de insertos comerciales de cultivo de tejidos después de quitar sus membranas. Además, aunque las membranas de seda, en esencia, pueden utilizarse como insertos regulares de cultivo de tejidos, son más delgadas y de composición proteica y, por lo tanto, más sensibles que sus contrapartes comerciales sintéticas actuales. Por lo tanto, requieren un manejo más cuidadoso por parte de los usuarios y deben mantenerse húmedos para mantener su elasticidad. Cabe destacar que las membranas pueden soportar el estiramiento y el inflado16,17, lo que las hace adecuadas, por ejemplo, para emular el movimiento de la respiración. Aun así, es probable que los nuevos usuarios rompan algunas membranas en las etapas iniciales, pero a medida que aumenta su experiencia en el manejo de membranas, se espera que la tasa de éxito aumente. Si los problemas persisten, el usuario debe consultar la Tabla 3 para solucionar problemas.
Durante la última década, se han presentado varias alternativas a los insertos plásticos comerciales (Tabla 1), y cada vez que se ha comparado el rendimiento de los cultivos celulares, las nuevas membranas biológicamente más relevantes han producido mejores resultados que sus contrapartes plásticas comerciales 2,5,6,7,14,22. Esto se ha observado principalmente en términos de una mayor función de barrera 2,5,6,7,14,22, pero también en la formación de un crecimiento celular más nativo14 y un aumento de las interacciones a través de la membrana en sistemas de cocultivo 7 . Esta tendencia se ha observado previamente para las membranas de seda FN al establecer un modelo de pared de vasos sanguíneos. En este estudio, se cultivaron HDMEC y células de músculo liso (SMC) en lados opuestos de la membrana. Se demostró que las SMC segregaron una MEC más gruesa cuando se cocultivaron con el HDMEC en las membranas de seda FN en comparación con las membranas de PET comerciales. Del mismo modo, el HDMEC estableció una barrera más estricta en las membranas de seda FN17. Es probable que la mejora de los resultados del cultivo celular se deba a una mejor comunicación celular y a unas condiciones de cultivo más similares a las del cultivo in vivo. La membrana de seda FN se acerca mucho más a la BM nativa en términos de grosor, estructura y propiedades mecánicas. El BM nativo tiene entre 20 nm y 3 μm degrosor, las membranas de PET de 10 μm y las membranas de seda FN alrededor de 1 μm, por lo que se encuentran dentro del rango nativo. La estructura de la membrana FN-silk también es nanofibrilar16, al igual que el BM22 nativo, mientras que la membrana PET consiste en plástico con poros grabados, generalmente entre 0,4 μm y 8 μm de diámetro7. Las membranas de PET también son mucho más rígidas que las BM, teniendo un módulo de Young de alrededor de 2 GPa, en comparación con el BM que varía de kPa a MPa, pero generalmente se cita alrededor de 250-500 kPa22. Las membranas de seda FN tienen un módulo de Young de 115 kPa16, que se encuentra dentro de las condiciones nativas. También debe tenerse en cuenta que una vez que las células crecen en la membrana, su fuerza se convierte en el factor dominante, no la membrana en símisma 17. Al final, también hay que tener en cuenta que la funcionalización integrada de la proteína FN-seda asegura que las células se adhieran directamente a la membrana y, por tanto, no será necesario un recubrimiento. En el caso de las membranas de PET, a menudo es estándar recubrir con una proteína ECM para garantizar una adhesión celular adecuada7.
Al comparar la membrana de seda FN con otros enfoques utilizados para reemplazar la membrana PET (revisada en la Tabla 1), la principal ventaja de nuestro método es el uso de la proteína de seda funcionalizada producida recombinantemente. Esto garantiza la reproducibilidad y las condiciones de cultivo definidas en contraste con otros materiales de origen animal basados en proteínas, como el colágeno. Nótese de nuevo que la funcionalización de la proteína asegura que no se necesiten recubrimientos, ya que las células se adhieren bien a las membranas, ya que es17. Además, la producción de membranas a base de seda descrita en este documento se basa en el autoensamblaje y no requiere ninguna configuración compleja ni el uso de productos químicos agresivos, a diferencia de muchas otras técnicas que se basan, por ejemplo, en el electrohilado. La adhesión espontánea de la membrana al inserto también elimina la necesidad de manipulación manual asociada con los insertos de dos partes, el encolado y los anillos de montaje de silicona, lo que simplifica el escalado y permite una fácil reproducibilidad en cualquier laboratorio. Además de la producción fácil, nuestro método es fácil de adaptar a las necesidades experimentales del usuario, ya que se pueden utilizar diferentes materiales de inserto y se puede ajustar el espesor de la membrana ajustando la concentración de seda de la solución inicial16. Por último, este protocolo puede producir, hasta la fecha, la membrana independiente más delgada unida a un inserto de cultivo de tejidos, lo que permite la semejanza más cercana con la membrana basal nativa.
El protocolo de formación y manipulación de membranas de seda que se presenta aquí es fácil de usar para cualquier persona acostumbrada a trabajar con insertos de cultivo de tejidos en un laboratorio de cultivo celular. Es una forma sencilla de pasar de las membranas de plástico a una contraparte más similar a la in vivo, lo que permite la generación de modelos de tejido más relevantes utilizando varios tipos de células (Tabla 2). Las membranas de seda pueden soportar cultivos celulares en sus lados apical o basal, así como cocultivos de diferentes tipos de células bilateralmente17. Los modelos de tejido de barrera desarrollados en las membranas de seda se pueden utilizar para la misma gama de aplicaciones que los insertos de cultivo de tejidos, incluidos los cribados de fármacos y los estudios de permeabilidad e infección. Para los casos en los que la diafonía entre diferentes tipos de células es de interés, se ha demostrado que superan a los insertos TC debido a sus propiedades más in vivo 17.
Divulgaciones
L.G. trabaja para y M.H. tiene acciones en Spiber Technologies AB, la empresa que produce la proteína de seda FN.
Agradecimientos
Los autores desean agradecer a Spiber Technologies AB por proporcionar la proteína de seda de araña funcionalizada recombinante y a Eline Freeze por imprimir una gran parte de los insertos impresos en 3D.
Materiales
| Name | Company | Catalog Number | Comments |
| CHEMICALS | |||
| Alexa Fluor 488 | Invitrogen; Thermo Fisher Scientific | A-21121 | Goat anti-mouse, Dilution 1:500 |
| Alexa Fluor 488 Phalloidin | Invitrogen; Thermo Fisher Scientific | A12379 | Dilution 1:400 |
| anti-ZO-1 (1A12) antibody | Invitrogen; Thermo Fisher Scientific | 33-9100 | Mouse anti-human, Monoclonal, Dilution 1:200 |
| Dextran, Alexa Fluor 680; 3,000 MW, Anionic | Invitrogen; Thermo Fisher Scientific | D34681 | Diluted 2,5% (w/v) in 200 ul of culture medium |
| DMEM/F-12 | Gibco; Thermo Fisher Scientific | 31330095 | Supplemented with 5% v/v FBS and 1% v/v Penicillin-Streptomycin |
| Ethanol | Solveco | 1326 | 70% (CAS-no 64-17-5) |
| Fetal Bovine Serum, qualified, heat inactivated, United States | Gibco; Thermo Fisher Scientific | 16140071 | |
| FN-silk | Spiber technologies AB | Store at -80 °C | |
| Isopropanol, EMPARTA ACS analytical reagent | Supelco | 1096342511 | ≥99.5% (CAS-no 67-63-0) |
| Live/Dead Viability/Cytotoxicity Kit | Invitrogen; Thermo Fisher Scientific | L3224 | |
| PBS | Swedish Veterinary Agency / Statens veterinärmedicinska anstalt | 992420 | without Ca and Mg, filtered |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco; Thermo Fisher Scientific | 11548876 | |
| MATERIAL | |||
| Dental LT Clear Resin | Denthouse | #DLCL-01 | |
| HaCaT cells | CLS | 300493 | |
| Nunc Cell-Culture Treated Multidishes 24-well | Fisher Scientific | 10604903 | |
| Nunc Cell-Culture Treated Multidishes 48-wel | Fisher Scientific | 10644901 | |
| TC insert, for 24-well plates, PET, transparent | Sarstedt | 83.3932.041 | pore size: 0.4 µm |
| ThinCert Cell Culture Inserts, translusent membrane (PET) | Greiner | 662640 | pore size: 0.4 µm |
| EQUIPMENT | |||
| EVOM meter with chopsticks | World Precision Instruments (WPI) Germany, GMBH | ||
| Form 3B | FormLabs | ||
| Form Wash | FormLabs | ||
| Form Cure | FormLabs | ||
| Isotemp General Purpose Deluxe Water Baths | Fisherbrand | ||
| Inverted fluorescence microscope Eclipse Ti | Nikon | ||
| Inverted fluorescence microscope DMI6000 B | Leica | ||
| Laminar flow hood Ninosafe, class II | Labolutions | ||
| Midi CO2 Incubator, 40 L | Thermo Scientific |
Referencias
- Kumar, P., Kedaria, D., Mahapatra, C., Mohandas, M., Chatterjee, K. A designer cell culture insert with a nanofibrous membrane toward engineering an epithelial tissue model validated by cellular nanomechanics. Nanoscale Adv. 3 (16), 4714-4725 (2021).
- Wang, Y., et al. Ultrathin and handleable nanofibrous net as a novel biomimetic basement membrane material for endothelial barrier formation. Colloids Surf B Biointerfaces. 219, 112775(2022).
- Jain, P., Rauer, S. B., Möller, M., Singh, S. Mimicking the natural basement membrane for advanced tissue engineering. Biomacromolecules. 23 (8), 3081-3103 (2022).
- Eom, S., Park, S. M., Han, S. J., Kim, J. W., Kim, D. S. One-step fabrication of a tunable nanofibrous well insert via electrolyte-assisted electrospinning. RSC Advances. 7 (61), 38300-38306 (2017).
- Kim, D., Eom, S., Park, S. M., Hong, H., Kim, D. S. A collagen gel-coated, aligned nanofiber membrane for enhanced endothelial barrier function. Sci Rep. 9 (1), 1-11 (2019).
- Ebrahim, N. A., et al. Porous honeycomb film membranes enhance endothelial barrier integrity in human vascular wall bilayer model compared to standard track-etched membranes. J Biomed Mater Res A. 111 (5), 701-713 (2023).
- Zakharova, M., et al. Transwell-integrated 2 µm thick transparent polydimethylsiloxane membranes with controlled pore sizes and distribution to model the blood-brain barrier. Advanced Materials Technologies. 6 (12), 2100138(2021).
- Park, S., et al. Use of elastic, porous, and ultrathin co-culture membranes to control the endothelial barrier function via cell alignment. Advanced Functional Materials. 31 (9), 2008172(2021).
- Youn, J., et al. Facile and adhesive-free method for bonding nanofiber membrane onto thermoplastic polystyrene substrate to fabricate 3D cell culture platforms. Materials Today Bio. 20, 100648(2023).
- Liu, H., et al. Electrohydrodynamic jet-printed ultrathin polycaprolactone scaffolds mimicking Bruch’s membrane for retinal pigment epithelial tissue engineering. Int J Bioprint. 8 (3), 550(2022).
- Dogan, A. A., Dufva, M. Customized 3D-printed stackable cell culture inserts tailored with bioactive membranes. Sci Rep. 12 (1), 1-12 (2022).
- Rohde, F., Danz, K., Jung, N., Wagner, S., Windbergs, M. Electrospun scaffolds as cell culture substrates for the cultivation of an in vitro blood–brain barrier model using human induced pluripotent stem cells. Pharmaceutics. 14 (6), 1308(2022).
- Slater, S. C., et al. An in vitro model of the glomerular capillary wall using electrospun collagen nanofibres in a bioartificial composite basement membrane. PLoS ONE. 6 (6), e20802(2011).
- Harris, T. I., et al. Utilizing recombinant spider silk proteins to develop a synthetic Bruch’s membrane for modeling the retinal pigment epithelium. ACS Biomater Sci Eng. 5 (8), 4023-4036 (2019).
- Hjelm, L. C., Hedhammar, M., Löfblom, J. In blood–brain barrier model based on recombinant spider silk protein nanomembranes for evaluation of transcytosis capability of biomolecules. Biochem Biophys Res Commun. 669, 77-84 (2023).
- Gustafsson, L., et al. Recombinant spider silk forms tough and elastic nanomembranes that are protein-permeable and support cell attachment and growth. Advanced Functional Materials. 30 (40), 2002982(2020).
- Tasiopoulos, C. P., Gustafsson, L., Van Der Wijngaart, W., Hedhammar, M. Fibrillar nanomembranes of recombinant spider silk protein support cell co-culture in an in vitro blood vessel wall model. ACS Biomater Sci Eng. 7 (7), 3332-3339 (2021).
- Marino, A., Baronio, M., Buratti, U., Mele, E., Ciofani, G. Porous optically transparent cellulose acetate scaffolds for biomimetic blood-brain barrier in vitro models. Front Bioeng Biotechnol. 9, 630063(2021).
- Schramm, R. A., Koslow, M. H., Nelson, D. A., Larsen, M., Castracane, J. A novel impedance biosensor for measurement of trans-epithelial resistance in cells cultured on nanofiber scaffolds. Biosensors. 7 (3), 35(2017).
- Qi, D., et al. Establishment of a human iPSC- and nanofiber-based microphysiological blood-brain barrier system. ACS Appl Mater Interfaces. 10 (26), 21825-21835 (2018).
- Rickabaugh, E., Weatherston, D., Harris, T. I., Jones, J. A., Vargis, E. Engineering a biomimetic in vitro model of Bruch’s membrane using hagfish slime intermediate filament proteins. ACS Biomater Sci Eng. 9 (8), 5051-5061 (2023).
- Choi, J. W., Youn, J., Kim, D. S., Park, T. E. Human iPS-derived blood-brain barrier model exhibiting enhanced barrier properties empowered by engineered basement membrane. Biomaterials. 293, 121983(2023).
- Widhe, M., Shalaly, N. D., Hedhammar, M. A fibronectin mimetic motif improves integrin mediated cell biding to recombinant spider silk matrices. Biomaterials. 74, 256-266 (2016).
- Johansson, U., et al. Assembly of functionalized silk together with cells to obtain proliferative 3D cultures integrated in a network of ECM-like microfibers. Sci Rep. 9 (1), 1-13 (2019).
- Widhe, M., Johansson, U., Hillerdahl, C. O., Hedhammar, M. Recombinant spider silk with cell binding motifs for specific adherence of cells. Biomaterials. 34 (33), 8223-8224 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados