Method Article
Membrane basale nanofibrillaire en soie d’araignée fonctionnalisée recombinante dans des inserts de culture tissulaire sur mesure
Dans cet article
Résumé
Les inserts de culture tissulaire avec membranes en plastique sont la référence dans les laboratoires de culture cellulaire en tant que supports perméables pour établir des couches cellulaires et des modèles de tissus barrières. Ici, nous présentons une méthode simple pour remplacer la membrane plastique par une membrane plus pertinente sur le plan biologique, fabriquée à partir d’une protéine de soie d’araignée fonctionnalisée recombinante.
Résumé
La réplication des barrières tissulaires est essentielle pour générer des modèles in vitro pertinents pour l’évaluation de nouvelles thérapies. Aujourd’hui, cela se fait couramment à l’aide d’inserts de culture tissulaire avec une membrane en plastique, ce qui génère un côté apical et un côté basal. En plus de fournir un soutien aux cellules, ces membranes sont loin d’imiter leur homologue natif, la membrane basale, qui est une matrice nanofibrillaire à base de protéines. Dans ce travail, nous montrons un moyen simple d’améliorer considérablement la pertinence biologique des inserts de culture tissulaire en remplaçant la membrane plastique par une membrane fabriquée à partir d’une protéine de soie d’araignée fonctionnalisée recombinante pure. La membrane de soie se forme par auto-assemblage et adhère spontanément à un insert de culture tissulaire sans membrane, où elle peut fournir un support aux cellules. Des inserts de culture tissulaire conçus sur mesure peuvent être imprimés à l’aide d’une imprimante 3D standard, en suivant les instructions fournies dans le protocole, ou des inserts commerciaux peuvent être achetés et utilisés à la place. Ce protocole montre comment le système de culture avec des membranes de soie dans des inserts est mis en place et, par la suite, comment les mêmes techniques de culture cellulaire que celles utilisées avec des inserts traditionnels disponibles dans le commerce peuvent être mises en œuvre.
Introduction
Les modèles in vitro capables de reproduire les barrières tissulaires ont fait l’objet d’une attention croissante en raison de leur applicabilité à l’essai de nouvelles thérapies et à la compréhension des mécanismes fondamentaux de la maladie 1,2. Pour recréer avec précision le microenvironnement natif, il est essentiel de récapituler la fonction de la membrane basale (BM), un complexe de matrice extracellulaire (ECM) hautement spécialisé. Le BM existe dans presque tous les tissus du corps humain, où il fournit un soutien aux cellules endothéliales et épithéliales et les sépare des tissus sous-jacents 2,3. En plus de fournir un soutien physique, le BM régule et maintient également les signaux biochimiques entre les cellules et les tissus environnants. Ces fonctions vitales rendent nécessaire la conception d’échafaudages qui ressemblent à la structure, ainsi qu’aux caractéristiques mécaniques et fonctionnelles du BM3 natif.
L’une des façons les plus courantes d’imiter la BM in vitro aujourd’hui est d’utiliser des inserts de culture tissulaire disponibles dans le commerce (TC-inserts). Il s’agit essentiellement de cylindres en plastique avec une membrane perméable qui divise la chambre en côtés apical et basolatéral 4,5. Bien que faciles à utiliser, les membranes des inserts commerciaux sont généralement rigides, gravées sur chenilles et fabriquées à partir de polymères tels que le poly(carbonate) (PC) et le poly(téréphtalate d’éthylène) (PET)3,4,6. Ils sont flexibles en termes de diamètre, de densité de pores et de taille et peuvent être recouverts pour améliorer l’adhérence cellulaire, mais il leur manque toutes les autres caractéristiques pertinentes du BM, telles que l’épaisseur comparable6, la porosité interconnectée, l’architecture fibreuse et le module d’élasticité3.
La standardisation des inserts TC et leur facilité d’utilisation ont inspiré plusieurs groupes, dont le nôtre, à remplacer la membrane plastique par une contrepartie plus proche de celle in vivo (vue d’ensemble dans le tableau 1). Les matériaux utilisés vont des polymères tels que le polydiméthylsiloxane (PDMS)7, le poly(lactide-co-caprolactone) (PLCL)8 et la polycaprolactone (PCL)4,9,10 aux matériaux à base de protéines tels que la gélatine 2,11,12, le collagène 5,13 et la soie d’araignée recombinante 14,15,16,17. Les membranes de ces matériaux ont été fixées de diverses manières, à la fois à des inserts disponibles dans le commerce d’où la membrane a été retirée 4,7,8,10,12,13,14,16,18,19,20,21 , ainsi qu’aux inserts conçus sur mesure fabriqués par impression 3D 1,11,15,17,20 ou moulage par injection 9,22. Cependant, la plupart d’entre eux sont encore loin de ressembler au BM natif en termes d’épaisseur, où les répliques vont de centaines11,18 à quelques micromètres 5,10,14,21,22. Beaucoup d’entre eux nécessitent également une formation complexe et/ou des méthodes de fixation manuelles 1,7,13,14,18,19,21, ce qui rend la mise à l’échelle et la réplication difficiles dans d’autres laboratoires.
Ici, nous présentons une méthode simple pour former et fixer une membrane de soie aux inserts et montrons comment cultiver des cellules de chaque côté de la membrane. Les membranes de soie sont formées par l’auto-assemblage de la protéine FN-4RepCT (FN-silk) à l’interface liquide-air d’une solution debout16,17. FN-silk est une version courte produite de manière recombinante de Major Ampullulate Spidroin 1 d’Euprosthenops australis, fonctionnalisée avec un motif RGD dérivé de la fibronectine23. Il a été démontré qu’il s’assemble en matrices fibrillaires qui favorisent l’adhésion, la croissance et la migration cellulaires 15,16,17,23,24,25. La méthode de fixation de la membrane sur l’insert repose sur l’adhérence spontanée et s’est avérée adaptée aux inserts disponibles dans le commerce dont la membrane a été retirée16, ainsi qu’aux inserts imprimés en 3D à partir d’acide polylactique (PLA)17 et de Dental LT15. Cet article détaille comment cette méthode est utilisée pour les inserts imprimés à partir de Dental LT. Une fois que les membranes FN-silk ont été fixées aux inserts, ils peuvent, en substance, être traités comme des inserts de culture tissulaire commerciaux standard. En bref, nous présentons une méthode simple pour générer des modèles in vitro plus pertinents de barrières tissulaires en remplaçant les membranes plastiques par une membrane FN-soie à base de protéines.
Protocole
1. 3D-impression d’inserts
- Téléchargez le fichier . Fichier de conception STL (JoVe_Silk_Insert.stl) du Fichier supplémentaire 1.
- Préparez les fichiers pour l’impression en les ouvrant dans le progiciel dédié à la conversion d’un fichier . STL en un fichier d’impression pour l’imprimante 3D utilisée.
- Utilisez le logiciel dédié pour ajouter des supports. La structure de support est conçue par le logiciel, et la quantité nécessaire dépendra de l’imprimante et du logiciel utilisé. Orientez l’insert de manière à ce que ni la plate-forme de construction ni les supports ne touchent le fond.
- Imprimez le nombre souhaité d’inserts à l’aide d’une résine biocompatible (telle que Dental LT ou BioMed) ou d’un filament (tel que PLA) adapté à l’imprimante 3D utilisée.
REMARQUE : Assurez-vous que le matériau peut résister à un processus de stérilisation approprié tel que l’autoclavage, l’irradiation ou l’immersion à l’éthanol. - Détachez les inserts imprimés de la plate-forme d’impression et retirez la structure de support imprimée de la pièce finie.
- Si vous utilisez une imprimante à résine, traitez les inserts en utilisant le protocole standard fourni par le fabricant.
REMARQUE : Le traitement peut varier en fonction de la résine utilisée. Le protocole utilisé pour la résine utilisée dans le présent document est fourni dans le dossier supplémentaire 2. - Stérilisez les inserts à l’aide d’une technique adaptée au matériau choisi.
REMARQUE : Les recommandations sont l’autoclavage, l’irradiation ou l’immersion dans de l’éthanol à 70%, ou une combinaison de ceux-ci. Si vous utilisez une imprimante à résine, un protocole de lixiviation étendu peut être nécessaire pour obtenir une biocompatibilité optimale. Reportez-vous au protocole fourni dans le fichier supplémentaire 2 pour une recommandation. - Assurez-vous que les inserts sont complètement secs et rangez-les stériles jusqu’à utilisation.
2. Formation des membranes de soie FN
- Remplissez une boîte de glace carbonique et apportez-la au congélateur à -80 °C.
- Récupérez les flacons FN-silk dans le congélateur à -80 °C et placez-les dans de la glace carbonique pour le transport. Apportez les flacons FN-silk dans une enceinte de sécurité biologique et effectuez les étapes suivantes là-bas. Placez les flacons FN-silk dans un support de tube de microcentrifugation pour les décongeler sans les toucher excessivement.
- Pendant que la soie FN décongèle, déballez la plaque à 48 puits. Une fois que la soie FN a complètement décongelé, passez à l’étape suivante dans les 10 minutes, de préférence le plus tôt possible.
- Diluer la solution de soie FN dans du PBS réfrigéré ou à température ambiante à la concentration souhaitée, de préférence 1,8 mg/mL. Pipeter 550 μL de solution FN-silk directement dans le fond d’un puits vide dans la plaque à 48 puits. Pipetez la solution FN-silk jusqu’à ce que le nombre souhaité de membranes ait été préparé.
REMARQUE : Évitez d’introduire des bulles d’air et retirez immédiatement toutes les bulles d’air avec une pipette. N’utilisez pas les puits de la rangée A ou F ou de la colonne 1 ou 8, ni les puits adjacents (voir le schéma à la figure supplémentaire S1). - Placez le couvercle sur la plaque à 48 puits et placez-le dans une boîte stérile plus grande pour fournir un environnement stérile pendant l’incubation.
- Retirez délicatement la boîte de l’enceinte de sécurité biologique et laissez-la dans des conditions ambiantes dans un endroit non perturbé sans circulation d’air importante pendant la nuit.
3. Collage des membranes en soie FN aux inserts
- Le lendemain, apportez les inserts stériles dans l’enceinte de sécurité biologique.
- Ramenez la grande boîte stérile contenant la plaque à 48 puits avec les membranes FN-silk dans l’enceinte de sécurité biologique et effectuez d’autres étapes là-bas. Soulevez avec précaution la plaque à 48 puits de la grande boîte stérile.
- Vérifiez visuellement la formation des membranes en observant la turbidité dans les puits et ouvrez le couvercle de la plaque de 48 puits contenant les membranes. Prenez un insert à l’aide d’une pince à épiler stérile et guidez-le vers le bas sur la membrane jusqu’à ce que les poignées de l’insert touchent le haut du puits, comme illustré à la figure 1. Gardez le bas de l’insert parallèle au bas de la plaque.
- Répétez l’étape 3.3 jusqu’à ce que les inserts aient été abaissés sur toutes les membranes formées. Placez le couvercle sur la plaque à 48 puits, puis remettez la plaque dans la boîte stérile. Laissez la plaque intacte pendant 2 h dans des conditions ambiantes pour permettre aux membranes d’adhérer aux inserts.
- Préchauffez le milieu de croissance ou PBS à 37 °C.
- Déballez une assiette à 24 puits.
- Une fois les 2 h écoulées, retirez la plaque à 48 puits de la boîte et ouvrez le couvercle. À l’aide d’une pince à épiler stérile, tenez un insert par ses poignées et retirez-le de la plaque à 48 puits.
- Directement après le levage, remplissez l’insert avec un milieu de culture préchauffé ou PBS. Utiliser 100 μL de milieu de culture si vous procédez à l’ensemencement du côté basal ou 200 μL si vous procédez au semis du côté apical. Si les membranes doivent être stockées pour une utilisation ultérieure, utilisez plutôt 200 μL de PBS.
POINT DE CONTRÔLE : Si le liquide est retenu au-dessus de la membrane, le soulèvement a réussi. Si du liquide s’écoule sur le banc, la membrane fuit et doit être ignorée. - Placez l’insert dans un puits vide de la plaque à 24 puits.
- Soulevez tous les inserts de la plaque à 48 puits et transférez-les sur la plaque à 24 puits. Remplissez les puits avec 1 000 μL de milieu de croissance si vous procédez à l’ensemencement cellulaire ou au PBS pour le stockage tout en gardant la plaque légèrement inclinée.
REMARQUE : Il est important que le bord de la membrane soit en dessous du niveau du liquide (Figure 2). - Si les cellules doivent être ensemencées immédiatement, passez à la section 4 ou 5 selon le côté de la membrane où les cellules doivent être ensemencées. Si ce n’est pas le cas, placez le couvercle sur la plaque à 24 puits et placez-la soit au réfrigérateur (4 °C), soit dans un incubateur à 37 °C. S’il est placé dans l’incubateur, réapprovisionnez le PBS tous les deux jours pour vous assurer que le volume nécessaire est maintenu.
4. Ensemencement cellulaire sur la face apicale de la membrane
REMARQUE : Si les membranes ont été stockées dans du PBS, remplacez le PBS par un milieu de culture préchauffé comme décrit dans la section 6.
- Récoltez les cellules. Préparez la suspension cellulaire de manière à ce que le nombre souhaité de cellules par membrane soit présent dans 20 à 50 μL de la suspension. Remettez en suspension pour atteindre la concentration cellulaire souhaitée.
- À l’aide d’une pipette P100 ou P200, aspirez 20 à 50 μL de la suspension cellulaire. En orientant la pointe de la pipette vers le centre de la membrane, maintenez la pointe à 1 à 2 mm de la surface du milieu de culture à l’intérieur de l’insert et appuyez lentement sur le piston de la pipette pour créer une gouttelette sur le bord de la pointe. Mettez la gouttelette en contact avec le milieu de culture à l’intérieur de l’insert.
REMARQUE : Gardez la pipette perpendiculaire à la surface de travail. - Répétez l’étape 4.2 pour les membranes restantes. Remettre le stock cellulaire en suspension après avoir ensemencement cinq membranes pour assurer une distribution cellulaire homogène. Déplacez la plaque en forme de huit pour assurer une meilleure répartition des cellules sur la membrane.
- Cultiver dans des conditions standard (37 °C et 5% CO2) et changer de milieu tous les deux jours.
5. Ensemencement cellulaire sur la face basale de la membrane
REMARQUE : Si les membranes ont été stockées dans du PBS, remplacez le PBS par 100 μL de milieu de croissance préchauffé et remplissez les puits avec 1 mL de milieu de croissance préchauffé comme décrit à la section 6.
- Récoltez les cellules et préparez la suspension cellulaire de manière à ce que le nombre souhaité de cellules par membrane soit présent dans 20 μL de la suspension. Remettez en suspension pour atteindre la concentration cellulaire souhaitée.
- Déballez et ouvrez le couvercle d’une boîte de Pétri. Assurez-vous que la hauteur de la boîte de Pétri est suffisante pour accueillir les inserts sans que leur fond ne touche le couvercle.
- À l’aide d’une pince à épiler, soulevez l’insert de la plaque à 24 puits, en laissant le milieu de culture dans les puits. À l’aide d’une pince à épiler dans chaque main, inversez l’insert de sorte que la face basale soit tournée vers le haut et que la face apicale fasse face à la zone de travail. Placez l’insert inversé dans la boîte de Pétri comme sur la figure 3C. Répétez l’opération pour les inserts restants.
REMARQUE : Ne retirez pas le milieu de culture du côté apical. Il gardera la membrane humide pendant l’incubation. - Remettez le stock de cellules en suspension pour assurer une distribution uniforme des cellules dans la solution et aspirez 20 μL de la suspension cellulaire avec une pipette P100 ou P200. En pointant la pointe de la pipette vers le centre de la membrane, maintenez la pointe à 1-2 mm de la membrane et appuyez lentement sur le piston de la pipette pour créer une gouttelette sur le bord de la pointe. Gardez la pipette perpendiculaire à la surface de la membrane et laissez la gouttelette tomber sur la membrane. Répétez l’opération pour les membranes restantes.
REMARQUE : Remettre en suspension le stock cellulaire après avoir semé cinq membranes pour assurer une distribution uniforme des cellules. - Placez le couvercle sur la boîte de Pétri, amenez la boîte de Pétri et la plaque à 24 puits dans l’incubateur et incubez les inserts avec les cellules dans des conditions standard (37 °C et 5 % de CO2) pendant 30 min.
- Introduisez la plaque à 24 puits contenant le milieu de culture et la boîte de Pétri dans l’enceinte de sécurité biologique. Ouvrez les deux couvercles et, à l’aide d’une pince à épiler dans chaque main, prenez un insert et retournez-le de sorte que la face apicale de la membrane soit maintenant tournée vers le haut et la face basale vers le bas.
- À l’aide d’une pipette P200, ajoutez 200 μL de milieu de culture à l’intérieur de l’insert. Placez l’insert dans l’un des puits préremplis de la plaque de 24 puits et répétez l’opération pour les membranes restantes.
- Cultiver dans des conditions standard (37 °C et 5% CO2) et changer de milieu tous les deux jours.
6. Changement moyen des cultures dans des conditions submergées
- Préparez une nouvelle plaque de 24 puits avec le milieu de culture frais en ajoutant 1 000 μL/puits. À l’aide d’une pince à épiler, soulevez un insert de la plaque à 24 puits, inclinez-le légèrement et retirez le milieu du côté apical.
- Ajouter 200 μL de milieu de culture frais à l’intérieur de l’insert. Placez l’insert dans un puits pré-rempli de milieu de culture frais. Répétez l’opération pour toutes les membranes.
7. Changement moyen des cultures dans les conditions de transport aérien
- À l’aide d’une pince à épiler, soulevez l’insert et placez-le dans un puits vide d’une plaque de 24 puits. Répétez l’opération pour quatre autres membranes.
- Inclinez légèrement la plaque à 24 puits et ajoutez lentement 1 000 μL de milieu de culture frais à l’intérieur de chaque puits de plaque. Répétez l’opération pour les membranes restantes.
8. Mesure de la résistance électrique transépithéliale (TEER)
- Préparez une plaque de 24 puits avec 1 000 μL de milieu de culture ou PBS à l’intérieur des puits et transférez-y les membranes. Assurez-vous d’avoir 200 μL de la solution correspondante au-dessus de la membrane.
- À l’aide d’une pince à épiler, stabilisez bien l’insert à l’intérieur de la plaque en appuyant doucement sur les bras de l’insert. Sans retirer la pince à épiler, insérez l’électrode TEER dans le puits et enregistrez la mesure.
- Retirez l’électrode, puis soulevez la pince à épiler.
- Répétez les étapes 8.2-8.3 pour les membranes restantes.
Résultats
Photographies représentatives des encarts
Des photographies des inserts avant et après leur libération de la plate-forme d’impression sont illustrées aux figures 3A et B. La figure 3C montre l’image d’un insert fini dont le support a été retiré. Le résultat est un lot d’inserts imprimés en 3D, prêts pour la stérilisation et l’utilisation ultérieure.
Levage et manutention des membranes FN-silk
Un schéma général de la formation de la membrane FN-soie et du levage manuel est illustré à la figure 1. Le résultat est un certain nombre d’inserts avec une membrane FN-silk attachée. Pour garantir le taux de réussite le plus élevé avec le levage des membranes intactes, les étapes décrites dans le protocole doivent être suivies avec précision. La figure 4 montre des photographies d’une membrane intacte (A, D) et après déchirure (B, E, F). La déchirure peut être visualisée à l’aide de la microscopie à fond clair (Figure 4E, F) et/ou par l’écoulement d’un liquide à travers la membrane (Figure 4B). Il est important de soulever et d’abaisser les inserts perpendiculairement à la membrane, pour s’assurer que la membrane adhère uniformément et s’étire sous les inserts. L’adhérence de la membrane peut être observée visuellement, comme le montre la figure 4A. Si l’insert est abaissé comme indiqué et que les niveaux de liquide sont maintenus comme indiqué à la figure 2, la membrane reste attachée à l’insert pendant de longues périodes de culture.
Ici, la fixation de la membrane à l’insert est validée en menant une expérience de perméation 15,16,17 sur des membranes qui avaient été conservées dans des conditions de culture cellulaire standard pendant 9 jours. En bref, lors de l’ajout d’une molécule fluorescente sur le dessus de la membrane et de la mesure du signal dans la solution en dessous, le profil de perméation des membranes de soie suit celui d’un insert de culture tissulaire disponible dans le commerce (Figure 4C), ne montrant aucune fuite sur 36 h de perméation et indiquant que la membrane reste à la fois intacte et attachée à l’insert. Des expériences similaires ont déjà été menées avec des cellules ensemencées sur l’un des15 ou les deux côtés de la membrane de soie17. La force de l’adhérence a déjà été démontrée à l’aide de la macro-indentation16 et des tests de gonflage 16,17. Dans le cadre des expériences de macro-indentation, un stylet a été utilisé pour étirer la membrane, qui s’est rompue sous une force de 1,4 mN, tout en restant attachée à l’insert16.
Il convient de noter que le taux de réussite du levage des membranes intactes est lié au matériau et au post-traitement des inserts. Avec ce protocole, 95 % des membranes soulevées à l’aide d’inserts imprimés avec la résine utilisée étaient appropriées pour l’ensemencement cellulaire, contre 74 % lorsqu’une résine comparable était utilisée à la place. Nous supposons que l’adhérence est favorisée par les interactions hydrophobes et les forces de van der Waals, et donc que la modification des propriétés du matériau modifie la force de l’adhérence. Ceci est également étayé par le fait que les membranes n’adhèrent pas bien aux matériaux hydrophiles (données non présentées).
Résultats représentatifs de la culture cellulaire sur les membranes FN-soie
La figure 5 montre des images d’immunofluorescence de kératinocytes (HaCaT) cultivés sur la face apicale ou basale de la membrane. On a observé que les cellules adhérentes (Figure 5D.i) couvraient uniformément la zone de culture le jour 1 tout en acquérant la morphologie typique des galets kératinocytes (Figure 5A.i-B.i). Au jour 3, les kératinocytes avaient établi une couche confluente (Figure 5A.ii-B.ii) et formé un réseau de jonctions serrées (Figure 5D.ii), indiquant qu’ils assumaient des fonctions épithéliales physiologiques. Les niveaux élevés de viabilité cellulaire atteints dans les matrices de soie FN 15,17,23,24 ont également été mis en évidence dans la configuration de culture à insertion de membrane de soie décrite ici. Après 3 jours de culture, les kératinocytes sont restés très viables (Figure 5C.i-iv). De plus, aucune différence dans la distribution des cellules mortes n’a été observée entre le centre (Figure 5C.i-ii) et la périphérie de la membrane (Figure 5C.iii-iv), ne révélant aucun effet significatif du matériau d’insertion sur la viabilité de HaCaT. Dans l’ensemble, le système de culture à insert en soie offrait une viabilité kératinocytaire similaire (Figure 5i-ii, v-vi) sinon améliorée (Figure 5iii-iv, vii-viii) à celle d’un système commercial d’insertion à membrane en PET.
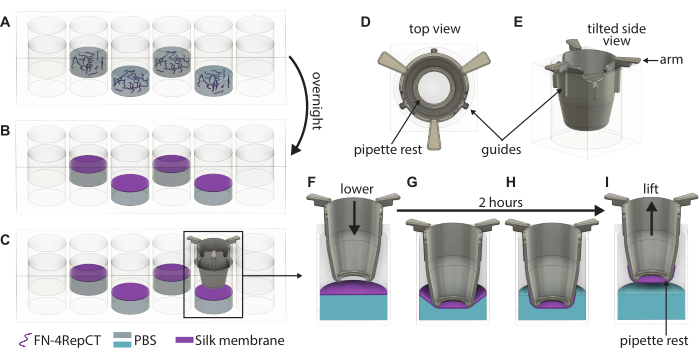
Figure 1 : Illustration détaillée de la formation et du soulèvement de membranes singulières en soie FN. (A) Remplissez un puits sur deux (évitez la rangée/colonne extérieure) dans une plaque de 48 puits avec une solution de protéine de soie FN où (B) elle s’auto-assemble en une membrane à l’interface liquide-air pendant la nuit. (C) Saisissez l’insert à l’aide d’une pince à épiler et abaissez-le lentement sur la membrane à l’aide des guides (D,E) sur l’insert imprimé en 3D pour vous assurer que l’insert est abaissé perpendiculairement à la membrane. Grossissement de l’adhérence de la membrane de soie montrant une section transversale de l’insert (F) juste au-dessus de la membrane et (G) lorsqu’il touche la membrane de soie. Au cours de la période d’incubation de 2 h, (H) la membrane de soie se fixe spontanément à l’insert, qui est ensuite (I) utilisé pour soulever la membrane de l’interface. Abréviations : FN = fibronectine ; PBS = solution saline tamponnée au phosphate. Veuillez cliquer ici pour voir une version agrandie de cette figure.
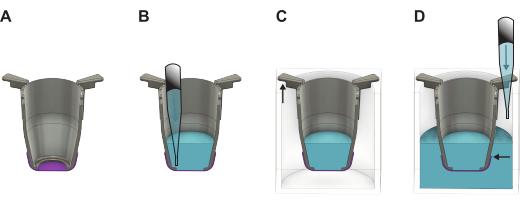
Figure 2 : Illustration détaillée montrant comment manipuler la membrane FN-soie après l’avoir soulevée de la plaque de formation. (A) L’insert (gris) avec la membrane (violette) directement après le levage. (B) Le liquide (bleu) est ajouté sur le côté apical de la membrane, qui est ensuite placé dans une plaque (C) à 24 puits où la partie la plus longue des bras d’insertion est suspendue aux parois, et la partie la plus courte maintient l’insert positionné au centre de la plaque. (D) Du liquide est ajouté dans le puits, en veillant à ce que le niveau de liquide soit équilibré et au-dessus du bord de la membrane. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Photographies des inserts imprimés en 3D. (A) Les inserts directement après avoir été retirés de l’imprimante 3D, toujours fixés à la plaque de construction. (B) Un insert après avoir été retiré de la plaque de construction, avant de casser les supports. (C) Un insert après que les supports ont été retirés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
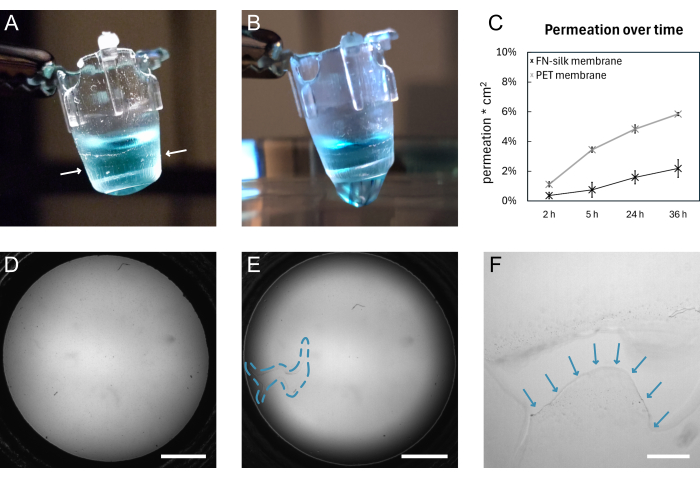
Figure 4 : Une membrane en soie FN avant et après la rupture. (A) Photographie d’une membrane intacte portant 200 μL de PBS teint (bleu) sur la face apicale. Le bord de la membrane enroulé autour de l’insert est indiqué par des flèches blanches. (B) Photographie de la même membrane après déchirure. Le PBS fuit à travers la membrane. (C) Graphique montrant la perméation d’une molécule fluorescente de 3 kDa pendant 36 h à travers une membrane de soie ou une membrane PET disponible dans le commerce et conservée dans des conditions de culture cellulaire standard pendant 9 jours. (D) Image en fond clair d’une membrane avant déchirure. (E) Image en fond clair de la même membrane après déchirure. La zone défectueuse est indiquée par le contour en pointillés bleus. (F) Vue agrandie de la déchirure représentée en D avec le bord de la membrane déchirée indiqué par des flèches bleues. Barres d’échelle = 1 mm (D,E), 200 μm (F). Abréviations : FN = fibronectine ; PBS = solution saline tamponnée au phosphate ; PET = poly(téréphtalate d’éthylène). Veuillez cliquer ici pour voir une version agrandie de cette figure.
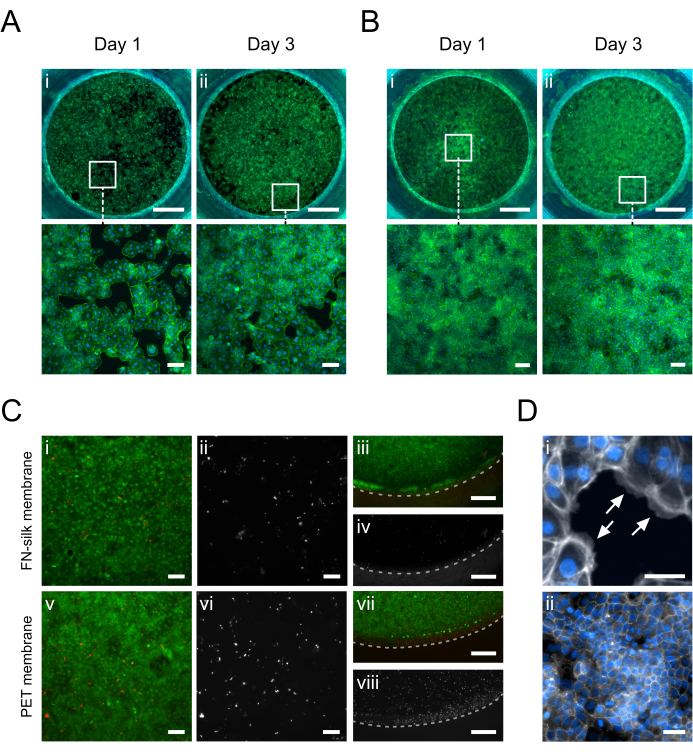
Figure 5 : Kératinocytes (HaCaT) cultivés sur la membrane de soie FN. Au jour 1, les kératinocytes ont adhéré et recouvert uniformément la surface de la membrane sur la face apicale (A.i) ou basale (B.i) (phalloïdine, verte). Au jour 3, une monocouche confluente s’établit sur le côté apical (A.ii) ou basal (B.ii) (phalloïdine, vert). (C) Évaluation de la viabilité cellulaire sur la membrane de soie (i-iv) par rapport à une membrane PET commerciale (v-viii) au centre (i, ii, v, vi) et à la périphérie (iii, iv, vii, viii) de la couche cellulaire. Les cellules vivantes sont indiquées en vert (i, iii, v, vii) et les cellules mortes en rouge (i, iii, v, vii) ou en blanc (ii, iv, vi, viii). La ligne pointillée marque l’interphase entre la membrane et l’insert. (D) Zoom en détail, (i) indiquant (flèches blanches) l’adhésion cellulaire à la membrane (phalloïdine, blanc) et (ii) un réseau de jonctions serrées formé après 3 jours de culture (ZO-1, blanc). Barres d’échelle = 1 mm (rangée du haut : A, B), 100 m (rangée du bas : A, B, Ci, ii, v, vi), 500 m (C iii, iv, vii, viii), 50 m (D). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Vue d’ensemble des travaux antérieurs où des membranes ont été intégrées dans des inserts de culture cellulaire. Abréviations : PCL = polycaprolactone ; PEGDA = diacrylate de poly (éthylène glycol) ; PLGA = poly(acide lactique-co-glycolique) ; PDMS = Polydiméthylsiloxane ; PC = Polycarbonate ; RSS = Protéine de soie d’araignée recombinante ; PLCL = Poly(lactide-co-caprolactone) ; RHSIF = Protéines de filament intermédiaire de bave de myxine recombinante Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Vue d’ensemble des travaux antérieurs résumant les différents types de cellules cultivées sur les membranes FN-soie. FN-4repCT (FN-silk) est une version courte de la soie de dragline d’Euprosthenops australis, qui est produite de manière recombinante et fonctionnalisée avec un motif RGD de la fibronectine au niveau génétique. Cette protéine est utilisée dans tous les cas résumés ici. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 3 : Dépannage. Veuillez cliquer ici pour télécharger ce tableau.
Dossier supplémentaire 1 : Fichier de conception (.stl) pour l’impression 3D des inserts. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 2 : Protocole d’impression, de post-traitement et de stérilisation lors de l’utilisation de l’imprimante et de la résine spécifiées dans la table des matériaux. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire S1 : Schéma du motif suggéré pour le placement de la solution de soie FN dans la plaque à 48 puits. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Le protocole décrit ici décrit un moyen simple de fabriquer des inserts de culture cellulaire biologiquement pertinents. Il commence par l’impression des inserts, suivi de la formation et de la fixation des membranes FN-soie, et se termine par la démonstration de comment les cellules peuvent être ensemencées à la fois sur les côtés apical et basal de la membrane. Il y a une étape vraiment critique dans ce protocole pour assurer le succès à long terme des cultures cellulaires et c’est l’abaissement et le soulèvement des inserts sur la membrane. L’exécution réussie de ces étapes permettra d’obtenir un système de culture à insertion de membrane de soie capable de résister à la culture cellulaire de la même manière que les systèmes disponibles dans le commerce avec des membranes synthétiques. Pour ce faire, des rails de guidage ont été mis en place sur les côtés des inserts conçus sur mesure afin d’éviter qu’ils ne soient abaissés en biais ou déplacés latéralement dans le puits, ce qui entraînerait une adhérence inégale de la membrane, générant des points faibles et par conséquent des fuites. Il est courant que des problèmes mineurs surviennent lors du premier suivi d’un protocole. Pour aider le nouvel utilisateur à les contourner, s’il en fait l’expérience en suivant le protocole présenté ci-dessus, nous avons décrit les problèmes potentiels et leurs solutions dans le tableau 3.
La membrane elle-même s’est avérée bénéfique pour la modélisation de différents tissus barrières (vue d’ensemble dans le tableau 2) ; Cependant, il convient de souligner que la résine utilisée pour imprimer les inserts ici n’a pas été testée de manière approfondie pour son effet sur la viabilité d’autres types de cellules. Bien que nous n’ayons pas rencontré de tels problèmes jusqu’à présent, il est possible que la résine puisse affecter négativement la viabilité et la croissance de certaines cellules sensibles. Il est donc recommandé d’effectuer un test de viabilité similaire à celui présenté ici afin de vérifier la compatibilité de la résine avec chaque type de cellule utilisé. En cas de cytotoxicité, un protocole de durcissement et/ou de lixiviation plus approfondi doit être établi pour empêcher les monomères non durcis de s’échapper au fil du temps et d’endommager les cellules. Un exemple d’un tel protocole, qui a été utilisé pour la résine utilisée pour imprimer les encarts à l’intérieur de ce protocole, se trouve dans le fichier supplémentaire 2. Ce protocole a déjà été utilisé pour préparer des inserts pour la culture de l’endothélium cérébral bEnd.3 sur des membranes de soie jusqu’à 8 jours15.
Le principal avantage de la méthode présentée dans ce travail est qu’elle offre un moyen simple de remplacer les membranes plastiques actuelles sur les inserts de culture tissulaire et, par conséquent, d’améliorer les modèles de culture tissulaire statique. La principale limitation est que l’utilisateur a besoin d’accéder à l’équipement d’impression 3D ou de passer du temps dans une installation pour imprimer ses inserts. Cependant, si nécessaire, cela pourrait être contourné en utilisant des inserts de culture tissulaire commerciaux après avoir retiré leurs membranes. De plus, bien que les membranes de soie, en substance, puissent être utilisées comme inserts de culture tissulaire réguliers, elles sont plus minces et de composition protéique, et donc plus sensibles que leurs homologues commerciaux synthétiques actuels. Par conséquent, ils nécessitent une manipulation plus soigneuse de la part des utilisateurs et doivent être maintenus humides pour maintenir leur élasticité. Il convient de noter que les membranes peuvent résister à l’étirement et au gonflage16,17, ce qui les rend adaptées, par exemple, pour imiter le mouvement de la respiration. Même ainsi, il est probable que les nouveaux utilisateurs briseront certaines membranes dans les premières étapes, mais à mesure que leur expérience de manipulation des membranes augmente, le taux de réussite devrait augmenter. Si des problèmes persistent, l’utilisateur doit se référer au Tableau 3 pour le dépannage.
Au cours de la dernière décennie, plusieurs alternatives aux inserts en plastique commerciaux ont été présentées (tableau 1), et chaque fois que les performances des cultures cellulaires ont été comparées, les nouvelles membranes plus pertinentes sur le plan biologique ont donné de meilleurs résultats que leurs homologues en plastique commerciaux 2,5,6,7,14,22. Cela a été principalement observé en termes d’amélioration de la fonction barrière 2,5,6,7,14,22, mais aussi dans la formation d’une croissance cellulaire plus native14 et une augmentation des interactions à travers la membrane dans les systèmes de co-culture 7 . Cette tendance a déjà été observée pour les membranes FN-soie lors de l’établissement d’un modèle de paroi de vaisseau sanguin. Dans cette étude, le HDMEC et les cellules musculaires lisses (SMC) ont été cultivés de part et d’autre de la membrane. Il a été démontré que les SMC sécrétaient une ECM plus épaisse lorsqu’ils étaient co-cultivés avec le HDMEC sur les membranes FN-silk par rapport aux membranes PET commerciales. De même, le HDMEC a établi une barrière plus étanche sur les membranes FN-silk17. L’amélioration des résultats de la culture cellulaire est probablement due à une meilleure communication cellulaire et à des conditions de culture plus proches de celles des in vivo. La membrane FN-silk se rapproche beaucoup plus de la BM native en termes d’épaisseur, de structure et de propriétés mécaniques. La BM native est comprise entre 20 nm et 3 μm22 mince, les membranes PET 10 μm et les membranes FN-soie autour de 1 μm, se situant ainsi bien dans la gamme native. La structure de la membrane FN-soie est également nanofibrillaire16, tout comme la BM22 native, tandis que la membrane PET est constituée de plastique avec des pores gravés sur traces, généralement entre 0,4 μm et 8 μm de diamètre7. Les membranes en PET sont également beaucoup plus rigides que les BM, avec un module de Young d’environ 2 GPa, par rapport à la BM qui varie de kPa à MPa, mais est généralement citée autour de 250-500 kPa22. Les membranes en soie FN ont un module de Young de 115 kPa16, ce qui correspond aux conditions natives. Il convient également de noter qu’une fois que les cellules sont cultivées sur la membrane, leur force devient le facteur dominant, et non la membrane elle-même17. En fin de compte, il convient également de noter que la fonctionnalisation intégrée de la protéine FN-soie garantit que les cellules adhèrent directement à la membrane et qu’en tant que telle, un revêtement ne sera pas nécessaire. Pour les membranes TEP, il est souvent standard d’enrober d’une protéine ECM pour assurer une bonne adhésion cellulaire7.
Lorsque l’on compare la membrane FN-soie avec d’autres approches utilisées pour remplacer la membrane PET (vue d’ensemble dans le tableau 1), le principal avantage de notre méthode est l’utilisation de la protéine de soie fonctionnalisée produite par recombinaison. Cela garantit la reproductibilité et des conditions de culture définies, contrairement à d’autres matériaux d’origine animale à base de protéines tels que le collagène. Notons encore que la fonctionnalisation de la protéine garantit qu’aucun enrobage n’est nécessaire car les cellules adhèrent bien aux membranes puisqu’il est17. De plus, la production de membranes à base de soie décrite ici est basée sur l’auto-assemblage et ne nécessite aucune configuration complexe ni l’utilisation de produits chimiques agressifs, contrairement à de nombreuses autres techniques qui reposent, par exemple, sur l’électrofilage. L’adhérence spontanée de la membrane à l’insert élimine également le besoin de manipulation manuelle associée aux inserts en deux parties, au collage et aux bagues de montage en silicone, simplifiant ainsi la mise à l’échelle et permettant une reproductibilité facile dans n’importe quel laboratoire. En plus de la facilité de production, notre méthode est facile à adapter aux besoins expérimentaux de l’utilisateur puisque différents matériaux d’insert peuvent être utilisés et que l’épaisseur de la membrane peut être ajustée en ajustant la concentration en soie de la solution initiale16. Enfin, ce protocole peut donner, à notre connaissance, la membrane autoportante la plus mince à ce jour, attachée à un insert de culture tissulaire, permettant la ressemblance la plus proche avec la membrane basale native.
Le protocole de formation et de manipulation des membranes de soie présenté ici est simple à utiliser pour toute personne habituée à travailler avec des inserts de culture tissulaire dans un laboratoire de culture cellulaire. Il s’agit d’un moyen simple de passer des membranes en plastique à une homologue plus proche de celle in vivo, ce qui permet de générer des modèles de tissus plus pertinents à l’aide de divers types de cellules (tableau 2). Les membranes de soie peuvent supporter la culture cellulaire sur leurs faces apicales ou basales ainsi que les co-cultures de différents types de cellules bilatéralement17. Les modèles de tissus barrières développés sur les membranes en soie peuvent être utilisés pour la même gamme d’applications que les inserts de culture tissulaire, y compris les criblages de médicaments et les études de perméation et d’infection. Dans les cas où la diaphonie entre différents types de cellules est intéressante, il a été démontré qu’elles surpassent les inserts TC en raison de leurs propriétés plus similaires in vivo 17.
Déclarations de divulgation
L.G. travaille pour et M.H. a des actions dans Spiber Technologies AB, la société qui produit la protéine FN-silk.
Remerciements
Les auteurs tiennent à remercier Spiber Technologies AB pour avoir fourni la protéine de soie d’araignée fonctionnalisée recombinante et Eline Freeze pour l’impression d’une grande partie des inserts imprimés en 3D.
matériels
| Name | Company | Catalog Number | Comments |
| CHEMICALS | |||
| Alexa Fluor 488 | Invitrogen; Thermo Fisher Scientific | A-21121 | Goat anti-mouse, Dilution 1:500 |
| Alexa Fluor 488 Phalloidin | Invitrogen; Thermo Fisher Scientific | A12379 | Dilution 1:400 |
| anti-ZO-1 (1A12) antibody | Invitrogen; Thermo Fisher Scientific | 33-9100 | Mouse anti-human, Monoclonal, Dilution 1:200 |
| Dextran, Alexa Fluor 680; 3,000 MW, Anionic | Invitrogen; Thermo Fisher Scientific | D34681 | Diluted 2,5% (w/v) in 200 ul of culture medium |
| DMEM/F-12 | Gibco; Thermo Fisher Scientific | 31330095 | Supplemented with 5% v/v FBS and 1% v/v Penicillin-Streptomycin |
| Ethanol | Solveco | 1326 | 70% (CAS-no 64-17-5) |
| Fetal Bovine Serum, qualified, heat inactivated, United States | Gibco; Thermo Fisher Scientific | 16140071 | |
| FN-silk | Spiber technologies AB | Store at -80 °C | |
| Isopropanol, EMPARTA ACS analytical reagent | Supelco | 1096342511 | ≥99.5% (CAS-no 67-63-0) |
| Live/Dead Viability/Cytotoxicity Kit | Invitrogen; Thermo Fisher Scientific | L3224 | |
| PBS | Swedish Veterinary Agency / Statens veterinärmedicinska anstalt | 992420 | without Ca and Mg, filtered |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco; Thermo Fisher Scientific | 11548876 | |
| MATERIAL | |||
| Dental LT Clear Resin | Denthouse | #DLCL-01 | |
| HaCaT cells | CLS | 300493 | |
| Nunc Cell-Culture Treated Multidishes 24-well | Fisher Scientific | 10604903 | |
| Nunc Cell-Culture Treated Multidishes 48-wel | Fisher Scientific | 10644901 | |
| TC insert, for 24-well plates, PET, transparent | Sarstedt | 83.3932.041 | pore size: 0.4 µm |
| ThinCert Cell Culture Inserts, translusent membrane (PET) | Greiner | 662640 | pore size: 0.4 µm |
| EQUIPMENT | |||
| EVOM meter with chopsticks | World Precision Instruments (WPI) Germany, GMBH | ||
| Form 3B | FormLabs | ||
| Form Wash | FormLabs | ||
| Form Cure | FormLabs | ||
| Isotemp General Purpose Deluxe Water Baths | Fisherbrand | ||
| Inverted fluorescence microscope Eclipse Ti | Nikon | ||
| Inverted fluorescence microscope DMI6000 B | Leica | ||
| Laminar flow hood Ninosafe, class II | Labolutions | ||
| Midi CO2 Incubator, 40 L | Thermo Scientific |
Références
- Kumar, P., Kedaria, D., Mahapatra, C., Mohandas, M., Chatterjee, K. A designer cell culture insert with a nanofibrous membrane toward engineering an epithelial tissue model validated by cellular nanomechanics. Nanoscale Adv. 3 (16), 4714-4725 (2021).
- Wang, Y., et al. Ultrathin and handleable nanofibrous net as a novel biomimetic basement membrane material for endothelial barrier formation. Colloids Surf B Biointerfaces. 219, 112775(2022).
- Jain, P., Rauer, S. B., Möller, M., Singh, S. Mimicking the natural basement membrane for advanced tissue engineering. Biomacromolecules. 23 (8), 3081-3103 (2022).
- Eom, S., Park, S. M., Han, S. J., Kim, J. W., Kim, D. S. One-step fabrication of a tunable nanofibrous well insert via electrolyte-assisted electrospinning. RSC Advances. 7 (61), 38300-38306 (2017).
- Kim, D., Eom, S., Park, S. M., Hong, H., Kim, D. S. A collagen gel-coated, aligned nanofiber membrane for enhanced endothelial barrier function. Sci Rep. 9 (1), 1-11 (2019).
- Ebrahim, N. A., et al. Porous honeycomb film membranes enhance endothelial barrier integrity in human vascular wall bilayer model compared to standard track-etched membranes. J Biomed Mater Res A. 111 (5), 701-713 (2023).
- Zakharova, M., et al. Transwell-integrated 2 µm thick transparent polydimethylsiloxane membranes with controlled pore sizes and distribution to model the blood-brain barrier. Advanced Materials Technologies. 6 (12), 2100138(2021).
- Park, S., et al. Use of elastic, porous, and ultrathin co-culture membranes to control the endothelial barrier function via cell alignment. Advanced Functional Materials. 31 (9), 2008172(2021).
- Youn, J., et al. Facile and adhesive-free method for bonding nanofiber membrane onto thermoplastic polystyrene substrate to fabricate 3D cell culture platforms. Materials Today Bio. 20, 100648(2023).
- Liu, H., et al. Electrohydrodynamic jet-printed ultrathin polycaprolactone scaffolds mimicking Bruch’s membrane for retinal pigment epithelial tissue engineering. Int J Bioprint. 8 (3), 550(2022).
- Dogan, A. A., Dufva, M. Customized 3D-printed stackable cell culture inserts tailored with bioactive membranes. Sci Rep. 12 (1), 1-12 (2022).
- Rohde, F., Danz, K., Jung, N., Wagner, S., Windbergs, M. Electrospun scaffolds as cell culture substrates for the cultivation of an in vitro blood–brain barrier model using human induced pluripotent stem cells. Pharmaceutics. 14 (6), 1308(2022).
- Slater, S. C., et al. An in vitro model of the glomerular capillary wall using electrospun collagen nanofibres in a bioartificial composite basement membrane. PLoS ONE. 6 (6), e20802(2011).
- Harris, T. I., et al. Utilizing recombinant spider silk proteins to develop a synthetic Bruch’s membrane for modeling the retinal pigment epithelium. ACS Biomater Sci Eng. 5 (8), 4023-4036 (2019).
- Hjelm, L. C., Hedhammar, M., Löfblom, J. In blood–brain barrier model based on recombinant spider silk protein nanomembranes for evaluation of transcytosis capability of biomolecules. Biochem Biophys Res Commun. 669, 77-84 (2023).
- Gustafsson, L., et al. Recombinant spider silk forms tough and elastic nanomembranes that are protein-permeable and support cell attachment and growth. Advanced Functional Materials. 30 (40), 2002982(2020).
- Tasiopoulos, C. P., Gustafsson, L., Van Der Wijngaart, W., Hedhammar, M. Fibrillar nanomembranes of recombinant spider silk protein support cell co-culture in an in vitro blood vessel wall model. ACS Biomater Sci Eng. 7 (7), 3332-3339 (2021).
- Marino, A., Baronio, M., Buratti, U., Mele, E., Ciofani, G. Porous optically transparent cellulose acetate scaffolds for biomimetic blood-brain barrier in vitro models. Front Bioeng Biotechnol. 9, 630063(2021).
- Schramm, R. A., Koslow, M. H., Nelson, D. A., Larsen, M., Castracane, J. A novel impedance biosensor for measurement of trans-epithelial resistance in cells cultured on nanofiber scaffolds. Biosensors. 7 (3), 35(2017).
- Qi, D., et al. Establishment of a human iPSC- and nanofiber-based microphysiological blood-brain barrier system. ACS Appl Mater Interfaces. 10 (26), 21825-21835 (2018).
- Rickabaugh, E., Weatherston, D., Harris, T. I., Jones, J. A., Vargis, E. Engineering a biomimetic in vitro model of Bruch’s membrane using hagfish slime intermediate filament proteins. ACS Biomater Sci Eng. 9 (8), 5051-5061 (2023).
- Choi, J. W., Youn, J., Kim, D. S., Park, T. E. Human iPS-derived blood-brain barrier model exhibiting enhanced barrier properties empowered by engineered basement membrane. Biomaterials. 293, 121983(2023).
- Widhe, M., Shalaly, N. D., Hedhammar, M. A fibronectin mimetic motif improves integrin mediated cell biding to recombinant spider silk matrices. Biomaterials. 74, 256-266 (2016).
- Johansson, U., et al. Assembly of functionalized silk together with cells to obtain proliferative 3D cultures integrated in a network of ECM-like microfibers. Sci Rep. 9 (1), 1-13 (2019).
- Widhe, M., Johansson, U., Hillerdahl, C. O., Hedhammar, M. Recombinant spider silk with cell binding motifs for specific adherence of cells. Biomaterials. 34 (33), 8223-8224 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon