Method Article
Нанофибриллярная имитаторная базальная мембрана из рекомбинантного функционализированного паучьего шелка во вставках для тканевых культур по индивидуальному заказу
В этой статье
Резюме
Вставки для тканевых культур с пластиковыми мембранами являются золотым стандартом в лабораториях клеточных культур в качестве проницаемых носителей для создания клеточных слоев и моделей барьерных тканей. В данной работе мы представляем простой способ замены пластиковой мембраны на более биологически значимую мембрану, изготовленную из рекомбинантного функционализированного белка паучьего шелка.
Аннотация
Репликация тканевых барьеров имеет решающее значение для создания релевантных моделей in vitro для оценки новых методов лечения. Сегодня это обычно делается с помощью вставок для тканевых культур с пластиковой мембраной, которая генерирует апикальную и базальную сторону. Помимо обеспечения поддержки клеток, эти мембраны далеки от подражания своему родному аналогу, базальной мембране, которая представляет собой нанофибриллярную матрицу на основе белка. В этой работе мы показываем простой способ значительно повысить биологическую значимость вставок для тканевых культур путем замены пластиковой мембраны на мембрану, изготовленную из чистого рекомбинантного функционализированного белка паучьего шелка. Шелковая мембрана формируется в результате самосборки и спонтанно прилипает к безмембранной вставке для культуры тканей, где она может обеспечить поддержку клеток. Вкладыши для тканевых культур, разработанные по индивидуальному заказу, могут быть напечатаны с помощью стандартного 3D-принтера, следуя инструкциям, приведенным в протоколе, или вместо них можно приобрести и использовать коммерческие. Этот протокол показывает, как устроена система культивирования с шелковыми мембранами во вставках и, впоследствии, как могут быть реализованы те же методы культивирования клеток, которые используются с традиционными, коммерчески доступными вставками.
Введение
Модели in vitro, которые могут воспроизводить тканевые барьеры, привлекают все большее внимание из-за их применимости при тестировании новых методов лечения и облегчения понимания фундаментальных механизмов заболевания 1,2. Чтобы точно воссоздать нативное микроокружение, крайне важно повторить функцию базальной мембраны (БМ), высокоспециализированного комплекса внеклеточного матрикса (ВКМ). КМ существует почти в каждой ткани человеческого организма, где он обеспечивает поддержку эндотелиальных и эпителиальных клеток и отделяет их от нижележащей ткани 2,3. Помимо обеспечения физической поддержки, КМ также регулирует и поддерживает биохимические сигналы между клетками и окружающими тканями. Эти жизненно важные функции обуславливают необходимость проектирования лесов, которые напоминают по конструкции, а также механическим и функциональным характеристикам родного BM3.
Одним из наиболее распространенных способов имитации КМ in vitro на сегодняшний день является использование коммерчески доступных инсертов для тканевых культур (ТС-вкладыши). По сути это пластиковые цилиндры с проницаемой мембраной, которая делит камеру на апикальную и базолатеральную стороны 4,5. Несмотря на простоту в использовании, мембраны в коммерческих вставках, как правило, жесткие, травленые и изготовлены из полимеров, таких как поликарбонат (PC) и полиэтилентерефталат (PET)3,4,6. Они являются гибкими с точки зрения диаметра, плотности пор и размера и могут быть покрыты для улучшения адгезии клеток, но не имеют всех других существенных характеристик БМ, таких как сопоставимая толщина6, взаимосвязанная пористость, волокнистая архитектура и соответствующий модуль упругости3.
Стандартизация вставок TC и простота их использования вдохновили несколько групп, включая нашу, на замену пластиковой мембраны на более in vivo аналоги (см. Таблицу 1). Используемые материалы варьируются от полимеров, таких как полидиметилсилоксан (PDMS)7, поли(лактид-ко-капролактон) (PLCL)8 и поликапролактон (PCL)4,9,10, до белковых материалов, таких как желатин 2,11,12, коллаген 5,13 и рекомбинантный паучий шелк 14,15,16,17. Мембраны из этих материалов крепились различными способами, как к коммерчески доступным вставкам, из которых была удалена мембрана 4,7,8,10,12,13,14,16,18,19,20,21 , а также к изготовленным по индивидуальному заказу вставкам, изготовленным методом 3D-печати 1,11,15,17,20 или литья под давлением 9,22. Тем не менее, большинство из них все еще далеки от того, чтобы напоминать родную БМ с точки зрения толщины, где реплики варьируются от сотен11,18 до нескольких микрометров 5,10,14,21,22. Многие из них также требуют сложных методов формирования и/или ручного прикрепления 1,7,13,14,18,19,21, что затрудняет масштабирование и репликацию в других лабораториях.
В данной работе мы представляем простой метод формирования и прикрепления шелковой мембраны к вставкам и показываем, как культивировать клетки по обе стороны мембраны. Шелковые мембраны формируются путем самосборки белка FN-4RepCT (FN-шелк) на границе раздела жидкость-воздух стоячего раствора16,17. FN-шелк представляет собой рекомбинантно производимую короткую версию Major Ampullulate Spidroin 1 из Euprosthenops australis, функционализированную мотивом RGD, полученным изфибронектина 23. Было показано, что он собирается в фибриллярные матрицы, которые способствуют адгезии, росту и миграции клеток 15,16,17,23,24,25. Метод крепления мембраны на вставке основан на спонтанной адгезии и был признан подходящим для коммерчески доступных вставок, из которых мембрана была удалена16, а также для напечатанных на 3D-принтере вставок из полимолочной кислоты (PLA)17 и Dental LT15. В этом документе подробно описано, как этот метод используется для вкладышей, напечатанных из Dental LT. После того, как мембраны из FN-шелка были прикреплены к вкладышам, они, по сути, могут обрабатываться как стандартные коммерческие вкладыши для тканевых культур. Короче говоря, мы представляем простой метод создания более актуальных in vitro моделей тканевых барьеров путем замены пластиковых мембран на белковую мембрану из FN-шелка.
протокол
1. 3D-печать вкладышей
- Загрузите файл . Файл проекта STL (JoVe_Silk_Insert.stl) из Дополнительного файла 1.
- Подготовьте файлы к печати, открыв их в программном пакете, предназначенном для преобразования . STL в файл печати для используемого 3D-принтера.
- Используйте специальное программное обеспечение для добавления опор. Несущая конструкция разрабатывается программным обеспечением, а необходимое количество будет зависеть от принтера и используемого программного обеспечения. Сориентируйте вставку так, чтобы ни строительная платформа, ни опоры не касались дна.
- Напечатайте желаемое количество вставок с помощью биосовместимой смолы (например, Dental LT или BioMed) или филамента (например, PLA), подходящей для используемого 3D-принтера.
ПРИМЕЧАНИЕ: Убедитесь, что материал может выдержать подходящий процесс стерилизации, такой как автоклавирование, облучение или погружение в этанол. - Отсоедините напечатанные вставки от печатной платформы и снимите напечатанную несущую конструкцию с готовой детали.
- Если вы используете принтер со смолой, обрабатывайте вставки в соответствии со стандартным протоколом, предоставленным производителем.
ПРИМЕЧАНИЕ: Обработка может варьироваться в зависимости от используемой смолы. Протокол, используемый для смолы, используемой в настоящем документе, представлен в Дополнительном файле 2. - Стерилизуйте вставки с помощью техники, подходящей для выбранного материала.
ПРИМЕЧАНИЕ: Рекомендуется автоклавирование, облучение или погружение в 70% этанол или их комбинацию. При использовании принтера на основе смолы для достижения оптимальной биосовместимости может потребоваться обширный протокол выщелачивания. Обратитесь к протоколу, приведенному в Дополнительном файле 2 для получения рекомендаций. - Убедитесь, что вкладыши полностью высохли, и храните их стерильно до использования.
2. Формирование FN-шелковых мембран
- Наполните коробку сухим льдом и отнесите ее в морозильную камеру при температуре -80 °C.
- Соберите флаконы с шелком FN из морозильной камеры при температуре -80 °C и поместите их в сухой лед для транспортировки. Поместите флаконы FN-шелка в шкаф биологической безопасности и выполните там дальнейшие действия. Поместите флаконы с шелком FN в штатив для пробирок микроцентрифуги для размораживания, не прикасаясь к ним чрезмерно.
- Пока FN-шелк оттаивает, распакуйте 48-луночную пластину. Как только FN-шелк полностью оттает, переходите к следующему этапу в течение 10 минут, желательно как можно скорее.
- Раствор FN-шелка развести в охлажденном состоянии или при комнатной температуре PBS до нужной концентрации, предпочтительно 1,8 мг/мл. Пипетка 550 мкл раствора FN-silk непосредственно на дно пустой лунки в 48-луночном планшете. Пипеткой наносите раствор FN-шелка до тех пор, пока не будет приготовлено нужное количество мембран.
ПРИМЕЧАНИЕ: Избегайте попадания пузырьков воздуха и немедленно удаляйте пузырьки воздуха с помощью пипетки. Не используйте скважины в строке A или F или столбце 1 или 8, а также соседние скважины (см. схему на дополнительном рисунке S1). - Закройте 48-луночный планшет крышкой и поместите его в более крупную стерильную коробку, чтобы обеспечить стерильную среду во время инкубации.
- Осторожно переместите коробку из шкафа биологической безопасности и оставьте ее на ночь в невозмутимом месте без значительного потока воздуха.
3. Приклеивание шелковых мембран FN к вставкам
- На следующий день принесите стерильные вкладыши в шкаф биологической безопасности.
- Принесите большую стерильную коробку, содержащую 48-луночный планшет с мембранами FN-silk, обратно в шкаф биологической безопасности и выполните дальнейшие действия там. Осторожно поднимите 48-луночный планшет из большой стерильной коробки.
- Визуально проверьте образование мембраны, наблюдая за помутнением в лунках, и откройте крышку 48-луночного планшета, содержащего мембраны. Возьмите одну вставку с помощью стерильного пинцета и направьте вставку вниз на мембрану до тех пор, пока ручки вкладыша не коснутся верхней части лунки, как показано на рисунке 1. Нижняя часть вкладыша должна быть параллельна нижней части пластины.
- Повторяйте шаг 3.3 до тех пор, пока вставки не будут опущены на все сформированные мембраны. Накройте крышку на 48-луночную пластину, а затем поставьте пластину обратно в стерильную коробку. Оставьте пластину в покое на 2 часа при температуре окружающей среды, чтобы мембраны прилипли к вставкам.
- Подогрейте питательную среду или PBS до 37 °C.
- Распакуйте планшет на 24 лунки.
- По прошествии 2 часов извлеките 48-луночный планшет из коробки и откройте крышку. С помощью стерильного пинцета возьмите вставку за ручки и поднимите ее из 48-луночной пластины.
- Сразу после подъема заполните вкладыш предварительно подогретой питательной средой или PBS. Используйте 100 мкл питательной среды, если вы продолжаете базальный боковой посев, или 200 μл, если продолжаете апикальный боковой посев. Если мембраны будут храниться для последующего использования, используйте вместо них 200 мкл PBS.
КОНТРОЛЬНАЯ ТОЧКА: Если жидкость задерживается над мембраной, лифтинг прошел успешно. Если жидкость капает на скамейку, мембрана протекает, и на нее следует не обращать внимания. - Поместите вкладыш в пустую лунку 24-луночного планшета.
- Извлеките все вкладыши из 48-луночного планшета и перенесите их на 24-луночный планшет. Заполните лунки 1 000 μл питательной среды, если вы продолжаете посев ячеек или PBS для хранения, сохраняя пластину слегка наклоненной.
ПРИМЕЧАНИЕ: Важно, чтобы край мембраны находился ниже уровня жидкости (Рисунок 2). - Если клетки должны быть засеяны немедленно, перейдите к разделу 4 или 5 в зависимости от того, с какой стороны мембраны клетки должны быть засеяны. Если нет, закройте крышку на 24-луночной пластине и поместите ее либо в холодильник (4 °C), либо в инкубатор с температурой 37 °C. При помещении в инкубатор пополняйте PBS каждые два дня, чтобы обеспечить поддержание необходимого объема.
4. Посев клеток на апикальную сторону мембраны
ПРИМЕЧАНИЕ: Если мембраны хранились в PBS, замените PBS предварительно подогретой питательной средой, как описано в разделе 6.
- Соберите клетки с прахом. Приготовьте клеточную суспензию таким образом, чтобы желаемое количество клеток на мембрану присутствовало в 20-50 мкл суспензии. Повторно суспендируйте для достижения желаемой концентрации клеток.
- С помощью пипетки Р100 или Р200 аспирируйте 20-50 мкл клеточной суспензии. Направив наконечник пипетки к центру мембраны, держите наконечник на расстоянии 1-2 мм от поверхности питательной среды внутри вставки и медленно нажимайте на поршень пипетки, чтобы создать каплю на краю наконечника. Доведите каплю до контакта с питательной средой внутри вкладыша.
ПРИМЕЧАНИЕ: Держите пипетку перпендикулярно рабочей поверхности. - Повторите шаг 4.2 для остальных мембран. Ресуспендирование клеточного фонда после засеивания пяти мембран для обеспечения однородного распределения клеток. Перемещайте пластину по схеме восьмерки, чтобы обеспечить лучшее распределение клеток на мембране.
- Культивируют в стандартных условиях (37 °C и 5%CO2) и меняют среду каждые два дня.
5. Посев клеток на базальную сторону мембраны
ПРИМЕЧАНИЕ: Если мембраны хранились в PBS, замените PBS 100 мкл предварительно подогретой питательной среды и заполните лунки 1 мл предварительно подогретой питательной среды, как описано в разделе 6.
- Соберите клетки и приготовьте клеточную суспензию таким образом, чтобы желаемое количество клеток на мембрану присутствовало в 20 мкл суспензии. Повторно суспендируйте для достижения желаемой концентрации клеток.
- Распакуйте и откройте крышку чашки Петри. Убедитесь, что высота чашки Петри достаточна для размещения вкладышей без соприкосновения их дна с крышкой.
- С помощью пинцета поднимите вкладыш из 24-луночной пластины, оставив питательную среду в лунках. С помощью набора пинцетов в каждой руке переверните вставку так, чтобы базальная сторона была обращена вверх, а апикальная сторона – к рабочей зоне. Поместите перевернутую вставку в чашку Петри, как показано на рисунке 3C. Повторите то же самое для остальных вставок.
ПРИМЕЧАНИЕ: Не удаляйте питательную среду с верхушечной стороны. Это сохранит мембрану влажной во время инкубации. - Повторно суспендируйте клеточный материал, чтобы обеспечить равномерное распределение клеток в растворе, и аспирируйте 20 мкл клеточной суспензии с помощью пипетки P100 или P200. Направив наконечник пипетки к центру мембраны, держите наконечник на расстоянии 1-2 мм от мембраны и медленно нажимайте на поршень пипетки, чтобы на краю наконечника образовалась капля. Держите пипетку перпендикулярно поверхности мембраны и дайте капле упасть на мембрану. Повторите то же самое для остальных мембран.
ПРИМЕЧАНИЕ: Ресуспендия клеточного фонда после засеивания пяти мембран для обеспечения равномерного распределения клеток. - Закройте чашку Петри крышкой, поднесите чашку Петри и 24-луночный планшет к инкубатору и инкубируйте вкладыши с ячейками в стандартных условиях (37 °C и 5 %CO2) в течение 30 минут.
- Поместите 24-луночный планшет с питательной средой и чашку Петри в шкаф биологической безопасности. Откройте обе крышки и с помощью набора пинцетов в каждой руке возьмите по одной вставке и переверните ее так, чтобы апикальная сторона мембраны теперь была обращена вверх, а базальная — вниз.
- С помощью пипетки P200 добавьте 200 мкл питательной среды внутрь вкладыша. Поместите вставку в одну из предварительно заполненных лунок 24-луночного планшета и повторите для остальных мембран.
- Культивируют в стандартных условиях (37 °C и 5%CO2) и меняют среду каждые два дня.
6. Смена среды культур в погружных условиях
- Приготовьте новую 24-луночную тарелку со свежей питательной средой, добавив 1 000 μл/лунку. С помощью пинцета приподнимите одну вставку из 24-луночного планшета, слегка наклоните его и удалите среду с апикальной стороны.
- Добавьте 200 μL свежей питательной среды внутрь вкладыша. Поместите вкладыш в лунку, предварительно заполненную свежей питательной средой. Повторите для всех мембран.
7. Средняя смена культур в условиях воздушного транспорта
- С помощью пинцета поднимите вкладыш и поместите его в пустую лунку 24-луночного планшета. Повторите то же самое еще для четырех мембран.
- Слегка наклоните 24-луночный планшет и медленно добавьте 1 000 μл свежей питательной среды в каждую лунку планшета. Повторите то же самое для остальных мембран.
8. Измерение трансэпителиального электрического сопротивления (TEER)
- Подготовьте 24-луночный планшет с 1 000 мкл питательной среды или PBS внутри лунок и перенесите в него мембраны. Убедитесь, что над мембраной находится 200 μл соответствующего раствора.
- С помощью набора пинцетов хорошо стабилизируйте вставку внутри пластины, аккуратно надавливая на рычаги вставки. Не снимая пинцет, вставьте электрод TEER в лунку и запишите измерение.
- Снимите электрод, а затем поднимите пинцет.
- Повторите шаги 8.2-8.3 для остальных мембран.
Результаты
Репрезентативные фотографии вкладышей
Фотографии вкладышей до и после снятия с печатной платформы показаны на рисунках 3A, B. Изображение готовой вставки, с которой была снята опора, показано на рисунке 3C. В результате получается партия напечатанных на 3D-принтере вкладышей, готовых к стерилизации и последующему использованию.
Подъем и перемещение мембран FN-silk
Общая схема формирования мембраны FN-silk и ручного лифтинга представлена на рисунке 1. В результате получается ряд вставок с прикрепленной мембраной из FN-шелка. Чтобы обеспечить наивысший процент успеха при подтяжке неповрежденных мембран, необходимо точно следовать шагам, изложенным в протоколе. На рисунке 4 показаны фотографии мембраны в неповрежденном состоянии (A,D) и после разрыва (B,E,F). Разрыв может быть визуализирован с помощью светлопольной микроскопии (рис. 4E, F) и/или путем капания жидкости через мембрану (рис. 4B). Важно поднимать и опускать вставки перпендикулярно мембране, следить за тем, чтобы мембрана прилегала равномерно и растягивалась ниже вставок. Адгезия мембраны может наблюдаться визуально, как показано на рисунке 4А. Если вкладыш опускается в соответствии с инструкциями и уровень жидкости поддерживается, как показано на рисунке 2, мембрана остается прикрепленной к вкладышу в течение длительных периодов культивирования.
В настоящем описании присоединение мембраны к вкладышу валидируется путем проведения эксперимента по проникновению 15,16,17 на мембранах, которые выдерживались в стандартных условиях культивирования клеток в течение 9 дней. Вкратце, при добавлении флуоресцентной молекулы поверх мембраны и измерении сигнала в приведенном ниже растворе профиль проникновения шелковых мембран соответствует профилю коммерчески доступной вставки для тканевой культуры (рис. 4C), показывая отсутствие утечки в течение 36 часов проникновения и указывая на то, что мембрана остается как неповрежденной, так и прикрепленной к вкладышу. Подобные эксперименты ранее проводились с клетками, засеяннымина одной или обеих сторонах шелковой мембраны17. Прочность адгезии ранее была показана с помощью макроиндентирования16 и тестов на надувание 16,17. В рамках экспериментов по макроиндентированию с помощью стилуса растягивали мембрану, которая разрывалась под действием силы 1,4 мН, оставаясь прикрепленной к вставке16.
Следует отметить, что вероятность успешного лифтинга интактных мембран связана с материалом и последующей обработкой вкладышей. При использовании этого протокола 95% мембран, поднятых с помощью вставок, напечатанных используемой смолой, были пригодны для посева клеток, по сравнению с 74% при использовании сопоставимой смолы. Мы предполагаем, что адгезии способствуют гидрофобные взаимодействия и силы Ван-дер-Ваальса, и, таким образом, изменение свойств материала изменяет силу адгезии. Это также подтверждается тем фактом, что мембраны плохо прилипают к гидрофильным материалам (данные не показаны).
Репрезентативные результаты культивирования клеток на мембранах FN-шелка
Иммунофлуоресцентные изображения кератиноцитов (HaCaT), культивируемых на апикальной или базальной стороне мембраны, показаны на рисунке 5. Наблюдалось, что адгезивные клетки (рис. 5D.i) равномерно покрывают область культивирования в 1-й день, приобретая типичную морфологию булыжника кератиноцитов (рис. 5A.i-B.i). На 3-й день кератиноциты образовали сливающийся слой (рис. 5A.ii-B.ii) и образовали сеть плотных соединений (рис. 5D.ii), что указывает на то, что они выполняют физиологические эпителиальные функции. Высокие уровни жизнеспособности клеток, достигнутые в FN-шелковых матрицах 15,17,23,24, также были отмечены в описанной здесь культуре с шелковой мембраной-вставкой. После 3 дней бактериологического исследования кератиноциты оставались высокожизнеспособными (рисунок 5C.i-iv). Кроме того, не наблюдалось никакой разницы в распределении мертвых клеток между центром (рисунок 5C.i-ii) и периферией мембраны (рисунок 5C.iii-iv), что не выявило существенного влияния материала вкладыша на жизнеспособность HaCaT. В целом, культуральная система с шелковыми вставками обеспечивает аналогичную (рис. 5i-ii, v-vi), если не улучшенную (рис. 5iii-iv, vii-viii) жизнеспособность кератиноцитов с коммерческой системой мембран-вставки из ПЭТ.
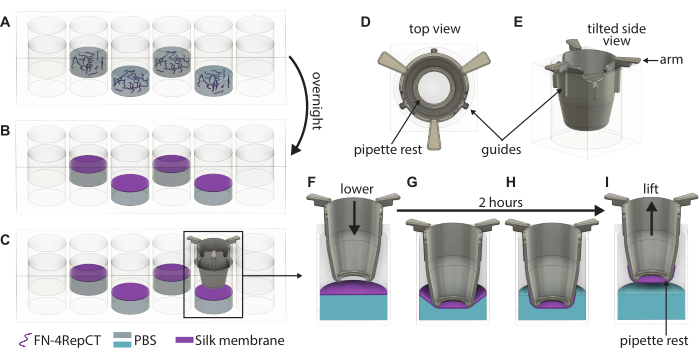
Рисунок 1: Подробная иллюстрация формирования и подтяжки одиночных мембран из FN-шелка. (А) Заполните каждую вторую лунку (избегайте внешнего ряда/столбца) в 48-луночном планшете раствором белка FN-шелка, где (В) он самоорганизуется в мембрану на границе жидкость-воздух в течение ночи. (C) Возьмитесь за вставку пинцетом и медленно опустите ее на мембрану, используя направляющие (D,E) на напечатанной на 3D-принтере вставки, чтобы убедиться, что вставка опущена перпендикулярно мембране. Увеличение адгезии шелковой мембраны, показывающее поперечное сечение вставки (F) прямо над мембраной и (G) при соприкосновении с шелковой мембраной. В течение 2-часового инкубационного периода (H) шелковая мембрана самопроизвольно прикрепляется к вкладышу, который затем (I) используется для подъема мембраны из интерфейса. Сокращения: FN = фибронектин; PBS = фосфатно-солевой буфер. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
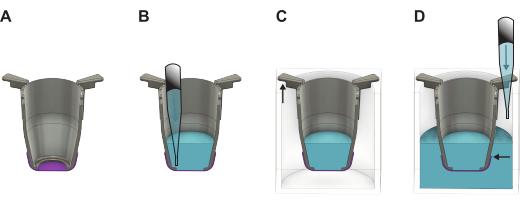
Рисунок 2: Подробная иллюстрация, показывающая, как обращаться с мембраной FN-silk после ее подъема с формовочной пластины. (A) Вставка (серая) с мембраной (фиолетовая) сразу после подъема. (B) Жидкость (синяя) добавляется на апикальную сторону мембраны, которая затем помещается в (C) 24-луночный планшет, где длинная часть рукавов вкладыша висит на стенках, а более короткая часть удерживает вставку в центре пластины. (D) Жидкость добавляется в колодец, следя за тем, чтобы уровень жидкости был сбалансированным и находился выше края мембраны. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Фотографии напечатанных на 3D-принтере вставок. (A) Вставки сразу после извлечения из 3D-принтера, все еще прикрепленные к рабочей пластине. (B) Одна вставка после снятия с рабочей пластины, перед поломкой опор. (C) Одна вставка после снятия опор. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
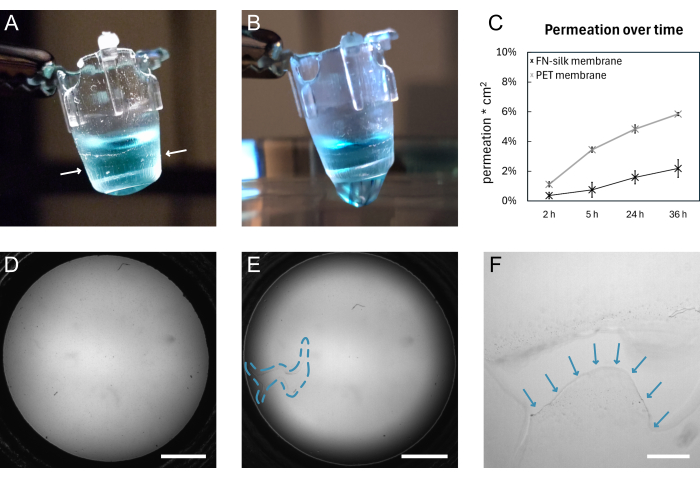
Рисунок 4: Мембрана из FN-шелка до и после разрыва. (A) Фотография неповрежденной мембраны, несущей 200 μL окрашенного (синего) PBS на апикальной стороне. Край мембраны, обернутый вокруг вставки, обозначен белыми стрелками. (B) Фотография той же мембраны после разрыва. PBS просачивается через мембрану. (C) График, показывающий проникновение флуоресцентной молекулы 3 кДа в течение 36 ч через шелковую мембрану или коммерчески доступную ПЭТ-мембрану, содержащуюся в стандартных условиях клеточной культуры в течение 9 дней. (D) Светлопольное изображение мембраны до разрыва. (E) Светлопольное изображение той же мембраны после разрыва. Дефектный участок обозначается синим пунктирным контуром. (F) Увеличенный вид разрыва, показанного на рисунке D , с краем разорванной мембраны, обозначенным синими стрелками. Масштабные линейки = 1 мм (D,E), 200 μм (F). Сокращения: FN = фибронектин; PBS = фосфатно-солевой буфер; ПЭТ = полиэтилентерефталат. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
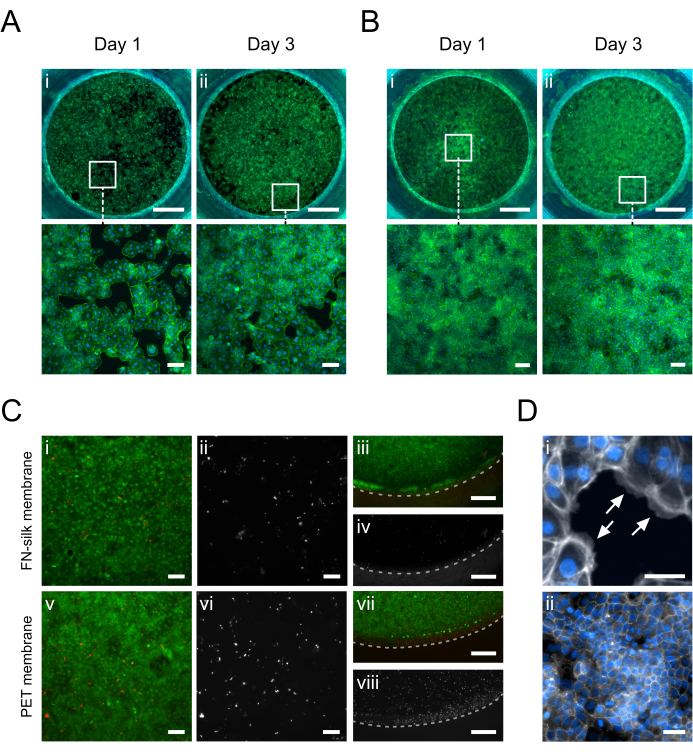
Рисунок 5: Кератиноциты (HaCaT), культивируемые на мембране FN-шелка. В 1-й день кератиноциты прилипли и равномерно покрыли поверхность мембраны на апикальной (A.i) или базальной стороне (B.i) (фаллоидин, зеленый). На 3-й день на апикальной (A.ii) или базальной (B.ii) стороне устанавливается сливающийся монослой (фаллоидин, зеленый). (C) Оценка жизнеспособности клеток на шелковой мембране (i-iv) по сравнению с коммерческой ПЭТ-мембраной (v-viii) в центре (i, ii, v, vi) и периферии (iii, iv, vii, viii) клеточного слоя. Живые клетки показаны зеленым цветом (i, iii, v, vii), а мертвые клетки — красным (i, iii, v, vii) или белым (ii, iv, vi, viii). Пунктирной линией обозначен межфазный переход мембраны и вставки. (D) увеличенный в деталях, (i) указывающий (белые стрелки) на адгезию клеток к мембране (фаллоидин, белый) и (ii) плотную сеть соединений, образовавшуюся после 3 дней в культуре (ZO-1, белый). Масштабные линейки = 1 мм (верхний ряд: A,B), 100 μм (нижний ряд: A,B,Ci, ii, v, vi), 500 μм (C iii, iv, vii, viii), 50 μм (D). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 1: Обзор предыдущих работ, в которых мембраны были интегрированы во вставки для клеточных культур. Сокращения: PCL = поликапролактон; PEGDA = поли(этиленгликоль) диакрилат; PLGA = поли(молочная-ко-гликолевая кислота); PDMS = Полидиметилсилоксан; ПК = Поликарбонат; RSS = Рекомбинантный белок паучьего шелка; PLCL = поли(лактид-ко-капролактон); RHSIF = Рекомбинантные белки промежуточных нитей слизи миксины Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Обзор предыдущих работ, обобщающих различные типы клеток, культивируемых на мембранах FN-шелка. FN-4repCT (FN-шелк) представляет собой короткую версию драглайна шелка Euprosthenops australis, который рекомбинантно производится и функционализируется с мотивом RGD из фибронектина на генетическом уровне. Этот белок используется во всех случаях, изложенных здесь. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 3: Устранение неполадок. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительный файл 1: Файл дизайна (.stl) для 3D-печати вставок. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2: Протокол печати, последующей обработки и стерилизации при использовании принтера и смолы, указанных в таблице материалов. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S1: Схема схемы, которую предлагается использовать при размещении раствора FN-шелка в 48-луночной пластине. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Описанный здесь протокол описывает простой способ изготовления биологически значимых вставок для клеточных культур. Она начинается с печати вставок, за которой следует формирование и прикрепление мембран из FN-шелка, и заканчивается демонстрацией того, как клетки могут быть засажены как на апикальной, так и на базальной стороне мембраны. В этом протоколе есть один действительно важный шаг для обеспечения долгосрочного успеха с клеточными культурами, и это опускание и подъем вставок на мембрану. Успешное выполнение этих этапов позволит получить культуральную систему с шелковой мембраной, способную выдерживать культивирование клеток аналогично коммерчески доступным системам с синтетическими мембранами. Для этого по бокам специально разработанных вставок были установлены направляющие, предотвращающие их опускание под углом или боковое перемещение в скважине, что может привести к неравномерному сцеплению мембраны, образованию слабых мест и последующей утечке. Как правило, при первом следовании протоколу возникают незначительные проблемы. Чтобы помочь новому пользователю обойти их, если он столкнется с ними при следовании представленному выше протоколу, мы описали потенциальные проблемы и их решения в таблице 3.
Было показано, что сама мембрана полезна для моделирования различных барьерных тканей (см. Таблицу 2); Однако следует отметить, что смола, используемая для печати вставок в настоящем документе, не подвергалась тщательным испытаниям на предмет ее влияния на жизнеспособность других типов клеток. Хотя до сих пор мы не сталкивались с подобными проблемами, не исключено, что смола может негативно повлиять на жизнеспособность и рост некоторых чувствительных клеток. Поэтому рекомендуется провести испытание на жизнеспособность, аналогичное представленному здесь, для проверки совместимости смолы с каждым типом используемых ячеек. При возникновении цитотоксичности следует разработать более тщательный протокол отверждения и/или выщелачивания, чтобы предотвратить выщелачивание неотвержденных мономеров с течением времени и нанесение вреда клеткам. Пример такого протокола, который использовался для смолы, используемой для печати вкладышей в рамках этого протокола, можно найти в Дополнительном файле 2. Этот протокол ранее использовался для подготовки вкладышей для культивирования эндотелия мозга bEnd.3 на шелковых мембранах на срок до 8 дней15.
Основное преимущество метода, представленного в данной работе, заключается в том, что он предлагает простой способ замены существующих пластиковых мембран на вставках для тканевых культур и, таким образом, улучшает статические модели тканевых культур. Основное ограничение заключается в том, что пользователю необходим доступ к оборудованию для 3D-печати или чтобы купить время на объекте для печати своих вкладышей. Однако, при необходимости, это можно обойти, используя коммерческие вставки для культуры тканей после удаления их мембран. Кроме того, в то время как шелковые мембраны, по сути, могут быть использованы в качестве обычных вставок для культуры тканей, они тоньше и имеют белковый состав, и, следовательно, более чувствительны, чем их современные синтетические коммерческие аналоги. Следовательно, они требуют более бережного обращения со стороны пользователей и должны оставаться влажными для поддержания их эластичности. Следует отметить, что мембраны выдерживают растяжение и надувание16,17, что делает их пригодными, например, для имитации дыхательных движений. Тем не менее, вполне вероятно, что новые пользователи сломают некоторые мембраны на начальных стадиях, но по мере того, как их опыт работы с мембранами увеличивается, ожидается, что вероятность успеха будет увеличиваться. Если проблемы не устранены, пользователь должен обратиться к таблице 3 для устранения неполадок.
В течение последнего десятилетия было представлено несколько альтернатив коммерческим пластиковым вставкам (Таблица 1), и каждый раз, когда сравнивались характеристики клеточных культур, новые, более биологически значимые мембраны давали лучшие результаты, чем их коммерческие пластиковые аналоги 2,5,6,7,14,22. Это наблюдалось в первую очередь с точки зрения усиления барьерной функции 2,5,6,7,14,22, а также формирования более нативного клеточного роста 14 и увеличения взаимодействий через мембрану в системах совместного культивирования 7. Эта тенденция ранее наблюдалась для мембран FN-шелка при построении модели стенки кровеносного сосуда. В этом исследовании HDMEC и гладкомышечные клетки (SMC) были выращены на противоположных сторонах мембраны. Показано, что SMC секретируют более толстый ECM при совместном культивировании с HDMEC на FN-шелковых мембранах по сравнению с коммерческими ПЭТ-мембранами. Аналогичным образом, HDMEC установил более плотный барьер на мембранах FN-silk17. Улучшение результатов клеточной культуры, вероятно, связано с улучшением клеточной коммуникации и в большей степени в условиях культивирования, подобного vivo. Мембрана FN-silk значительно приближается к родной БМ по толщине, структуре и механическим свойствам. Нативная БМ имеет толщину от 20 нм до 3 мкм22, ПЭТ-мембраны 10 мкм, а FN-шелковые мембраны около 1 мкм, таким образом, хорошо попадая в нативный диапазон. Структура мембраны FN-silk также нанофибриллярная16, как и у нативной BM22, в то время как мембрана ПЭТ состоит из пластика с вытравленными порами, обычно диаметром от 0,4 до 8μм7. Мембраны из ПЭТ также намного более жесткие, чем БМ, имея модуль Юнга около 2 ГПа, по сравнению с БМ, который колеблется от кПа до МПа, но обычно составляет около 250-500 кПа22. Мембраны из FN-шелка имеют модуль Юнга 115 кПа16, что соответствует естественным условиям. Следует также отметить, что как только клетки выращиваются на мембране, доминирующим фактором становится их прочность, ане сама мембрана. В конце концов, следует также отметить, что интегрированная функционализация белка FN-шелка гарантирует, что клетки прилипают непосредственно к мембране, и поэтому покрытие не потребуется. Для ПЭТ-мембран часто стандартным является покрытие белком ECM для обеспечения надлежащей клеточной адгезии7.
При сравнении FN-шелковой мембраны с другими подходами, используемыми для замены ПЭТ-мембраны (см. Таблицу 1), основным преимуществом нашего метода является использование рекомбинантно полученного функционализированного белка шелка. Это обеспечивает воспроизводимость и определенные условия культивирования в отличие от других белковых материалов животного происхождения, таких как коллаген. Заметим еще раз, что функционализация белка гарантирует, что оболочки не требуются, так как клетки хорошо прилипают к мембранам, как это17. Более того, описанное здесь производство мембран на основе шелка основано на самостоятельной сборке и не требует какой-либо сложной настройки или использования агрессивных химических веществ, в отличие от многих других техник, которые опираются, например, на электроспиннинг. Спонтанное сцепление мембраны со вставкой также устраняет необходимость в ручном обращении, связанном с двухкомпонентными вставками, склейкой и силиконовыми монтажными кольцами, тем самым упрощая масштабирование и обеспечивая легкую воспроизводимость в любой лаборатории. В дополнение к легкому производству, наш метод легко адаптировать к экспериментальным потребностям пользователя, поскольку можно использовать различные материалы вставок и регулировать толщину мембраны путем регулировки концентрации шелка в исходном растворе16. Наконец, насколько нам известно, этот протокол может дать самую тонкую отдельно стоящую мембрану, прикрепленную к вкладышу для культуры ткани, что обеспечивает максимальное сходство с нативной базальной мембраной.
Представленный здесь протокол формирования и обработки шелковой мембраны прост в использовании для всех, кто привык работать со вставками для тканевых культур в лаборатории клеточных культур. Это простой способ перехода от пластиковых мембран к более in vivo-подобным аналогам, что позволяет создавать более релевантные модели тканей с использованием различных типов клеток (Таблица 2). Шелковые мембраны могут поддерживать клеточную культуру на их апикальной или базальной стороне, а также кокультуры различных типов клеток на двустороннейоснове17. Модели барьерной ткани, разработанные на шелковых мембранах, могут быть использованы для того же спектра задач, что и вставки для тканевых культур, включая скрининг лекарств и исследования проникания и инфекций. В тех случаях, когда перекрестные помехи между различными типами клеток представляют интерес, было показано, что они превосходят TC-вставки благодарясвоим свойствам, более подобным in vivo.
Раскрытие информации
Л.Г. работает в компании Spiber Technologies AB, которая производит белок FN-шелка, а М.Х. владеет акциями компании, производящей белок FN-шелка.
Благодарности
Авторы хотели бы поблагодарить Spiber Technologies AB за предоставление рекомбинантного функционализированного белка паучьего шелка и Eline Freeze за печать большой части 3D-печатных вставок.
Материалы
| Name | Company | Catalog Number | Comments |
| CHEMICALS | |||
| Alexa Fluor 488 | Invitrogen; Thermo Fisher Scientific | A-21121 | Goat anti-mouse, Dilution 1:500 |
| Alexa Fluor 488 Phalloidin | Invitrogen; Thermo Fisher Scientific | A12379 | Dilution 1:400 |
| anti-ZO-1 (1A12) antibody | Invitrogen; Thermo Fisher Scientific | 33-9100 | Mouse anti-human, Monoclonal, Dilution 1:200 |
| Dextran, Alexa Fluor 680; 3,000 MW, Anionic | Invitrogen; Thermo Fisher Scientific | D34681 | Diluted 2,5% (w/v) in 200 ul of culture medium |
| DMEM/F-12 | Gibco; Thermo Fisher Scientific | 31330095 | Supplemented with 5% v/v FBS and 1% v/v Penicillin-Streptomycin |
| Ethanol | Solveco | 1326 | 70% (CAS-no 64-17-5) |
| Fetal Bovine Serum, qualified, heat inactivated, United States | Gibco; Thermo Fisher Scientific | 16140071 | |
| FN-silk | Spiber technologies AB | Store at -80 °C | |
| Isopropanol, EMPARTA ACS analytical reagent | Supelco | 1096342511 | ≥99.5% (CAS-no 67-63-0) |
| Live/Dead Viability/Cytotoxicity Kit | Invitrogen; Thermo Fisher Scientific | L3224 | |
| PBS | Swedish Veterinary Agency / Statens veterinärmedicinska anstalt | 992420 | without Ca and Mg, filtered |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco; Thermo Fisher Scientific | 11548876 | |
| MATERIAL | |||
| Dental LT Clear Resin | Denthouse | #DLCL-01 | |
| HaCaT cells | CLS | 300493 | |
| Nunc Cell-Culture Treated Multidishes 24-well | Fisher Scientific | 10604903 | |
| Nunc Cell-Culture Treated Multidishes 48-wel | Fisher Scientific | 10644901 | |
| TC insert, for 24-well plates, PET, transparent | Sarstedt | 83.3932.041 | pore size: 0.4 µm |
| ThinCert Cell Culture Inserts, translusent membrane (PET) | Greiner | 662640 | pore size: 0.4 µm |
| EQUIPMENT | |||
| EVOM meter with chopsticks | World Precision Instruments (WPI) Germany, GMBH | ||
| Form 3B | FormLabs | ||
| Form Wash | FormLabs | ||
| Form Cure | FormLabs | ||
| Isotemp General Purpose Deluxe Water Baths | Fisherbrand | ||
| Inverted fluorescence microscope Eclipse Ti | Nikon | ||
| Inverted fluorescence microscope DMI6000 B | Leica | ||
| Laminar flow hood Ninosafe, class II | Labolutions | ||
| Midi CO2 Incubator, 40 L | Thermo Scientific |
Ссылки
- Kumar, P., Kedaria, D., Mahapatra, C., Mohandas, M., Chatterjee, K. A designer cell culture insert with a nanofibrous membrane toward engineering an epithelial tissue model validated by cellular nanomechanics. Nanoscale Adv. 3 (16), 4714-4725 (2021).
- Wang, Y., et al. Ultrathin and handleable nanofibrous net as a novel biomimetic basement membrane material for endothelial barrier formation. Colloids Surf B Biointerfaces. 219, 112775(2022).
- Jain, P., Rauer, S. B., Möller, M., Singh, S. Mimicking the natural basement membrane for advanced tissue engineering. Biomacromolecules. 23 (8), 3081-3103 (2022).
- Eom, S., Park, S. M., Han, S. J., Kim, J. W., Kim, D. S. One-step fabrication of a tunable nanofibrous well insert via electrolyte-assisted electrospinning. RSC Advances. 7 (61), 38300-38306 (2017).
- Kim, D., Eom, S., Park, S. M., Hong, H., Kim, D. S. A collagen gel-coated, aligned nanofiber membrane for enhanced endothelial barrier function. Sci Rep. 9 (1), 1-11 (2019).
- Ebrahim, N. A., et al. Porous honeycomb film membranes enhance endothelial barrier integrity in human vascular wall bilayer model compared to standard track-etched membranes. J Biomed Mater Res A. 111 (5), 701-713 (2023).
- Zakharova, M., et al. Transwell-integrated 2 µm thick transparent polydimethylsiloxane membranes with controlled pore sizes and distribution to model the blood-brain barrier. Advanced Materials Technologies. 6 (12), 2100138(2021).
- Park, S., et al. Use of elastic, porous, and ultrathin co-culture membranes to control the endothelial barrier function via cell alignment. Advanced Functional Materials. 31 (9), 2008172(2021).
- Youn, J., et al. Facile and adhesive-free method for bonding nanofiber membrane onto thermoplastic polystyrene substrate to fabricate 3D cell culture platforms. Materials Today Bio. 20, 100648(2023).
- Liu, H., et al. Electrohydrodynamic jet-printed ultrathin polycaprolactone scaffolds mimicking Bruch’s membrane for retinal pigment epithelial tissue engineering. Int J Bioprint. 8 (3), 550(2022).
- Dogan, A. A., Dufva, M. Customized 3D-printed stackable cell culture inserts tailored with bioactive membranes. Sci Rep. 12 (1), 1-12 (2022).
- Rohde, F., Danz, K., Jung, N., Wagner, S., Windbergs, M. Electrospun scaffolds as cell culture substrates for the cultivation of an in vitro blood–brain barrier model using human induced pluripotent stem cells. Pharmaceutics. 14 (6), 1308(2022).
- Slater, S. C., et al. An in vitro model of the glomerular capillary wall using electrospun collagen nanofibres in a bioartificial composite basement membrane. PLoS ONE. 6 (6), e20802(2011).
- Harris, T. I., et al. Utilizing recombinant spider silk proteins to develop a synthetic Bruch’s membrane for modeling the retinal pigment epithelium. ACS Biomater Sci Eng. 5 (8), 4023-4036 (2019).
- Hjelm, L. C., Hedhammar, M., Löfblom, J. In blood–brain barrier model based on recombinant spider silk protein nanomembranes for evaluation of transcytosis capability of biomolecules. Biochem Biophys Res Commun. 669, 77-84 (2023).
- Gustafsson, L., et al. Recombinant spider silk forms tough and elastic nanomembranes that are protein-permeable and support cell attachment and growth. Advanced Functional Materials. 30 (40), 2002982(2020).
- Tasiopoulos, C. P., Gustafsson, L., Van Der Wijngaart, W., Hedhammar, M. Fibrillar nanomembranes of recombinant spider silk protein support cell co-culture in an in vitro blood vessel wall model. ACS Biomater Sci Eng. 7 (7), 3332-3339 (2021).
- Marino, A., Baronio, M., Buratti, U., Mele, E., Ciofani, G. Porous optically transparent cellulose acetate scaffolds for biomimetic blood-brain barrier in vitro models. Front Bioeng Biotechnol. 9, 630063(2021).
- Schramm, R. A., Koslow, M. H., Nelson, D. A., Larsen, M., Castracane, J. A novel impedance biosensor for measurement of trans-epithelial resistance in cells cultured on nanofiber scaffolds. Biosensors. 7 (3), 35(2017).
- Qi, D., et al. Establishment of a human iPSC- and nanofiber-based microphysiological blood-brain barrier system. ACS Appl Mater Interfaces. 10 (26), 21825-21835 (2018).
- Rickabaugh, E., Weatherston, D., Harris, T. I., Jones, J. A., Vargis, E. Engineering a biomimetic in vitro model of Bruch’s membrane using hagfish slime intermediate filament proteins. ACS Biomater Sci Eng. 9 (8), 5051-5061 (2023).
- Choi, J. W., Youn, J., Kim, D. S., Park, T. E. Human iPS-derived blood-brain barrier model exhibiting enhanced barrier properties empowered by engineered basement membrane. Biomaterials. 293, 121983(2023).
- Widhe, M., Shalaly, N. D., Hedhammar, M. A fibronectin mimetic motif improves integrin mediated cell biding to recombinant spider silk matrices. Biomaterials. 74, 256-266 (2016).
- Johansson, U., et al. Assembly of functionalized silk together with cells to obtain proliferative 3D cultures integrated in a network of ECM-like microfibers. Sci Rep. 9 (1), 1-13 (2019).
- Widhe, M., Johansson, U., Hillerdahl, C. O., Hedhammar, M. Recombinant spider silk with cell binding motifs for specific adherence of cells. Biomaterials. 34 (33), 8223-8224 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены