Method Article
نقص التروية الشرياني الحشوي القابل للانعكاس والاحتقان الوريدي وسوء التروية المشترك عن طريق بضع البطن في خط الوسط في الفئران
In This Article
Summary
تقدم هذه المقالة إجراء موحدا لسوء التروية الخاضع للرقابة والقابل للعكس للأعضاء الحشوية في نماذج الفئران. الهدف هو تحفيز حالات سوء التروية هذه بدرجة عالية من اليقين المنهجي والتحكم مع الحفاظ على البساطة التقنية ومرونة الخطأ.
Abstract
إلى جانب الإنتان والأورام الخبيثة ، فإن سوء التروية هو السبب الرئيسي الثالث لتدهور الأنسجة وآلية مرضية رئيسية لمختلف الحالات الطبية والجراحية. على الرغم من التطورات الهامة مثل جراحة المجازة ، وإجراءات الأوعية الدموية ، والأكسجين الغشائي خارج الجسم ، وبدائل الدم الاصطناعية ، إلا أن سوء تروية الأنسجة ، وخاصة الأعضاء الحشوية ، لا يزال يمثل مشكلة ملحة في رعاية المرضى. الطلب على مزيد من البحث حول العمليات الطبية الحيوية والتدخلات المحتملة مرتفع. النماذج البيولوجية الصالحة لها أهمية قصوى في تمكين هذا النوع من البحث. نظرا للجوانب متعددة العوامل لأبحاث تروية الأنسجة ، والتي لا تشمل بيولوجيا الخلية فحسب ، بل تشمل أيضا علم التشريح الدقيق للأوعية الدموية والريولوجيا ، يتطلب النموذج المناسب درجة من التعقيد البيولوجي لا يمكن أن يوفرها سوى نموذج حيواني ، مما يجعل القوارض النموذج الواضح المفضل. يمكن تمييز سوء تروية الأنسجة إلى ثلاث حالات متميزة: (1) نقص تروية الشرياني المعزول ، (2) الاحتقان الوريدي المعزول ، و (3) سوء التروية المشترك. تقدم هذه المقالة بروتوكولا مفصلا خطوة بخطوة للتحريض الخاضع للرقابة والعكس لهذه الأنواع الثلاثة من سوء التروية الحشوية عن طريق بضع البطن وتثبيت الشريان الأورطي البطني والوريد السدفي في الفئران ، مما يؤكد أهمية المنهجية الجراحية الدقيقة لضمان نتائج موحدة ويمكن الاعتماد عليها. تشمل الأمثلة الرئيسية للتطبيقات المحتملة لهذا النموذج تطوير والتحقق من صحة طرق التصوير المبتكرة أثناء الجراحة ، مثل التصوير الفائق الطيفي (HSI) ، لتصور سوء تروية الجهاز الهضمي وأمراض النساء والمسالك البولية بشكل موضوعي وتمييزه.
Introduction
في حين أن الآثار المترتبة على الحرمان من نضح الأنسجة في شكل حالات سوء تروية الأنسجة الموضعية أو الجهازية قد تم التعرف عليها منذ فترة طويلة ، إلا أنها لا تزال قائمة كأحد الأسباب الرئيسية للمراضة والوفيات في كل من الولايات المتحدة وأوروبا1. حالات سوء التروية هذه هي السبب الرئيسي الثالث لتدهور الأنسجة ، بعد الأورام الخبيثة والالتهاب الإنتاني ، ولكن لها مجموعة أوسع بكثير من الأصول مقارنة بالاثنينالأخيرين 2.
يتراوح هذا الطيف من الآليات المحلية مثل الرجفان الأذيني مع انسداد الانسداد الخثاري ، وتضيق الأوعية ، والتشريح علاجي المنشأ أو المؤلم ، إلى الآليات الجهازية مثل قصور القلب أو الصدمة ، والإنتان ، ونقص حجم الدم ، وظواهر السرقة. تكمن هذه الآليات المتنوعة في مجموعة متنوعة من الحالات الطبية والجراحية. أدت المراضة والوفيات الكبيرة المرتبطة بهذه الحالات إلى توجيه الاهتمام الطبي نحو إجراءات إعادة تدفق الدم إلى الأنسجة غير المصابة بالذهر من أجل إحباط النخر واستعادة وظيفة الأعضاء على مر العقود.
نتج عن هذا الجهد البحثي مجموعة متنوعة من الحلول الصيدلانية والطبية والجراحية لاستعادة نضح الأعضاء الفسيولوجية ، بما في ذلك التقدم في جراحة المجازة4 ، وإجراءات الأوعية الدموية5 ، والأكسجين الغشائي خارج الجسم6،7 ، ونضح آلة الأعضاء أثناء الزرع8 ، وبدائل الدم الاصطناعية9.
ومع ذلك ، على الرغم من هذه التطورات المهمة ، لا يزال سوء التروية ، وخاصة الأعضاء الحشوية ، قضية ملحة في رعاية المرضى ، والطلب على مزيد من البحث حول العمليات الطبية الحيوية واستراتيجيات الإنقاذ مرتفع. النماذج البيولوجية الصالحة لها أهمية قصوى في تمكين هذا النوع من البحث. نظرا للجوانب متعددة العوامل لأبحاث تروية الأنسجة ، والتي لا تشمل بيولوجيا الخلية فحسب ، بل تشمل أيضا علم التشريح الدقيق للأوعية الدموية والريولوجيا ، يتطلب النموذج المناسب درجة من التعقيد البيولوجي لا يمكن أن يوفرها سوى كائن حي نموذجي كامل ، مما يجعل القوارض النموذج الواضح المفضل.
يمكن تمييز سوء تروية الأنسجة إلى ثلاث حالات متميزة: نقص تروية الشرياني المعزول ، والاحتقان الوريدي المعزول ، وسوء التروية المشترك10. تشمل السيناريوهات ذات الصلة سريريا لهذه الحالات (1) نقص تروية الشرايين: الرجفان الأذيني مع انسداد الانسداد الخثاري ، أو الصمات الإنتانية ، أو تضيق الأوعية الدموية ، أو تسلخ الأوعية الدموية علاجي المنشأ أو الرضحية ، أو لقط القلب ، أو قصور القلب أو الصدمة ، أو تسلخ الأبهر ، والإنتان ونقص حجم الدم ، والانسداد الشرياني الشديد بسبب الانقباض الخارجي ، أو انسداد الشريان الرئوي ، أو أمراض انسداد الأوعية الدموية الشريانية المزمنة ، أو ظواهر السرقة ؛ (2) الاحتقان الوريدي: تشريح أو لقط الأوعية الدموية علاجي المنشأ أو الرضحية ، قصور القلب ، تليف الكبد أو تليف الكبد ، الانسداد الوريدي بسبب الانقباض الخارجي ، التخثر الوريدي ، القصور الوريدي ، ومتلازمة بود خياري ؛ (3) سوء التروية المشترك: مجموعات من الحالات المذكورة أعلاه والمراحل المتقدمة من الحالات المذكورة أعلاه ، مثل الاحتقان الوريدي الثانوي بسبب التليف الناجم عن نقص التروية أو نقص تروية الشرايين الثانوي بسبب الاحتفاظ بالاحتقان ، بالإضافة إلى حالات أعضاء معينة مثل الالتهاب الإقفاري (على سبيل المثال ، التهاب القولون الإقفاري) 11،12.
لذلك ، تهدف هذه المقالة إلى تقديم نموذج خطوة بخطوة للحث على إقفار الشرايين الحشوية الخاضع للرقابة والقابل للانعكاس ، والاحتقان الوريدي ، وسوء التروية المشترك عن طريق بضع البطن في خط الوسط في الفئران لكل من تطبيقات البقاء على قيد الحياة وعدم البقاء على قيد الحياة ، كما هو موضح في الشكل 1. يوفر النموذج التجريبي بيئة خاضعة للرقابة لدراسة الديناميكيات متعددة الأوجه لنقص تروية الشرايين والاحتقان الوريدي وعواقبها مجتمعة ، مع محاكاة السيناريوهات ذات الصلة سريريا التي تمت مواجهتها في ظروف مختلفة.
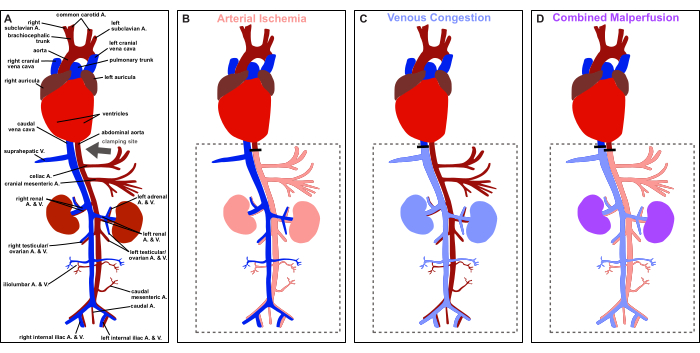
الشكل 1: نظرة عامة على البروتوكول. تصوير تخطيطي لتشريح الفئران الوعائية وتصوير موقع التثبيت (السهم الرمادي). (أ) التروية الفسيولوجية. (ب) نقص تروية الشرايين. (ج) الاحتقان الوريدي. (د) سوء التروية المشتركة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
تم إجراء جميع الأنشطة الحيوانية الموصوفة هنا في مرافق معتمدة وتمت الموافقة عليها من قبل اللجنة المؤسسية لرعاية واستخدامه (IACUC) التابعة لمجلس بادن فورتمبيرغ الإقليمي في كارلسروه ، ألمانيا (35-9185.81 / G-62 / 23). تمت إدارة التجارب وفقا للمعايير المؤسسية ، والقوانين الألمانية لاستخدام ورعايتها ، وتوجيهات مجلس الجماعة الأوروبية (2010/63 / EU) ، وإرشادات ARRIVE. تم استخدام ذكور فئران Sprague Dawley بوزن طلب 400 جرام بعد التأقلم لمدة أسبوع واحد. تفاصيل الكواشف والمعدات المستخدمة في هذه الدراسة مدرجة في جدول المواد.
1. التخدير والتسكين
- تخدير الجرذ بالدواء باتباع البروتوكولات المؤسسية. يوصى باستخدام إيزوفلوران لتحريض التخدير متبوعا بحقن IPP بمقدار 100 مجم / كجم من الكيتامين بوزن الجسم و 4 مجم / كجم من وزن الجسم زيلازين. يمكن تحقيق تسكين إضافي عن طريق حقن SC بمقدار 5 مجم / كجم من الكاربروفين. للحصول على التفاصيل ، يرجى الرجوع إلى Studier-Fischer et al.13.
- ضع مرهم العين على العينين لمنع الجفاف.
- ضمان عمق التجميل المناسب باستخدام اختبار قرصة إصبع القدم باستخدام الملقط الجراحي.
- أعد تقييم وضبط عمق التخدير بانتظام أثناء الجراحة.
2. إعداد الإجراء
- قم بإعداد طاولة التنظيف بجميع المواد والأدوات المطلوبة ، بما في ذلك مشابك الأوعية الدموية الدقيقة القابلة للإطلاق وقضيب (الشكل 2A-C) ، ومشبك الحفر الحاد ، ومقص التحضير الدقيق ، والملقط.
- قم بإعداد خطافات التحضير الجراحي عن طريق طي القنيات بزاوية 135 درجة عند 1 سم إلى الحافة وتوصيلها بأنابيب التروية البلاستيكية عبر قفل Luer-lock جاهز لتطبيق التوتر باستخدام مشبك البعوض الجراحي (الشكل 2D ، E).
- قم بإعداد جهاز التعرض الجراحي للقوارض ، بما في ذلك قضبان التثبيت على شكل حرف Y ووسادة تسخين ، كما هو محدد في Studier-Fischer et al.13.
- تأكد من تحقيق الأكسجين المناسب عن طريق استنشاق الأكسجين بنسبة 100٪ باستخدام قناع الوجه لحديثي الولادة (الشكل 2F).
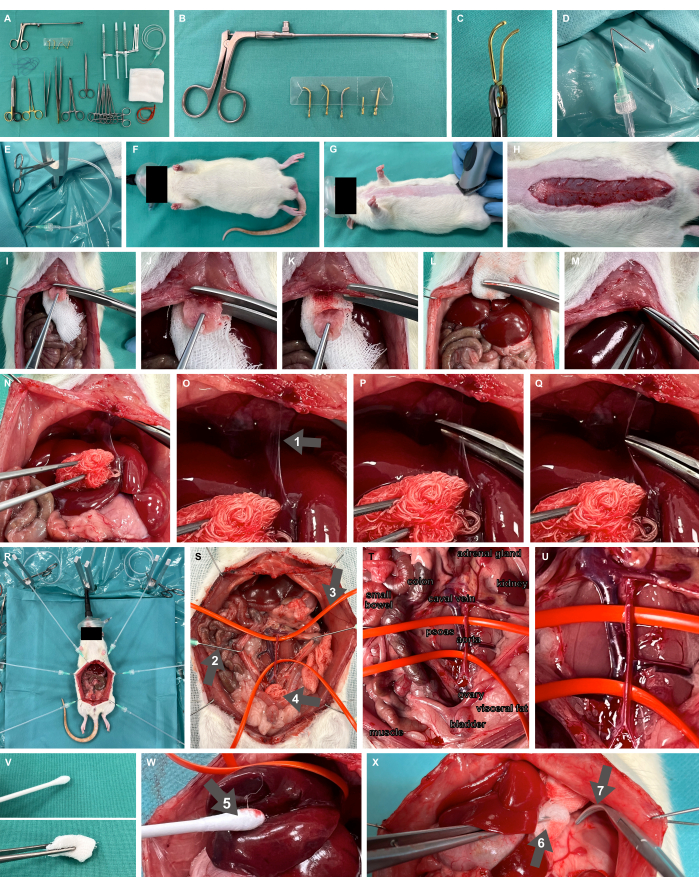
الشكل 2: الإعداد التجريبي والحيواني. (أ) الأدوات والمواد الجراحية المطلوبة. (ب ، ج) مشبك الأوعية الدموية الدقيقة القابلة للإصدار وقضيب. (د ، ه) تستخدم قنية مطوية متصلة بأنبوب التروية كخطاف تحضير جراحي. (إف ، ز) نموذج الفئران مؤكسج بقناع الوجه وحلق. (ح) شق جلدي على طول البطن الكامل. (I-M) استئصال الخنجري والإرقاء. (نيو كيو) التعبئة الكبدية وتسلخ الرباط المنجلي (السهم 1). (R) تطبيق خطافات التحضير والحوامل المعدنية لتعرض الأعضاء بعد شق البطن. (S) التعرض الحشوي الكامل للأوعية الرئيسية للبطن باستخدام خطافات حادة (السهم 2) ، وحلقات أوعية السيليكون (السهم 3) ، والضغط الجراحي (السهم 4). (تي ، يو) الشريان الأورطي البطني والوريد السعفي. (خامسا) أدوات التحضير غير الرضحي. (ث) مقايضة القطن المرطب (السهم 5). (X) ضغط مرطب في ملقط (السهم 6) ومشابك أوفرهولت غير حادة (السهم 7). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. التحضير الجراحي
- حلق موقع الوصول الجراحي لبضع البطن في خط الوسط (الشكل 2G). قم بإجراء شق جلدي على طول البطن المطلوب ، أي حوالي 7 سم (الشكل 2 ح) ، وتقدم مع شق البطن عن طريق تشريح اللفافة ، وقم بخياطة خطافات التحضير الجراحي بأنابيب بلاستيكية متصلة ومشابك البعوض الجراحية عبر الجلد. كشف المقعد الجراحي باستخدام خطافات التحضير الجراحي ، وتطبيق التوتر على الأنسجة.
- تأكد من تشريح الصفاق في الجمجمة فقط حتى بضعة ملليمترات تحت بداية القص ، مع ترك بعض الصفاق سليما. ضع جزءا من الضغط الجراحي أسفل القص (الشكل 2I) وقم بإزالة الخنجري بمقص مادة قوية. اضغط على منطقة الاستئصال باستخدام الضغط الجراحي لتحقيق إرقاء كاف لهذه المنطقة جيدة الانتشار (الشكل 2I-M).
- قم بتعبئة الكبد الظهري الذيلي لفضح الرباط المنجلي (الشكل 2N) وتشريح الرباط (الشكل 2O-Q).
- للتحكم في مرقئ ، اعتمادا على المكان الذي يجب أن يتم فيه تثبيت الأوعية الرئيسية ، قم بإجراء تعرض كامل للحشوية للأوعية الرئيسية للبطن (الشكل 2R) والأوعية المعلقة بحلقات أوعية سيليكون (الشكل 2S-U). يجب استخدام أدوات التحضير اللارضية فقط (الشكل 2V) ، مثل مقايضات القطن المرطب (الشكل 2W) ، والضغط المرطب في الملقط ، والمشابك غير الحادة (الشكل 2X).
4. تحضير وتثبيت الشريان الأورطي البطني لنقص تروية الشرايين
- قم بإجراء الوسط الأيسر لأعضاء البطن العلوية باستخدام أدوات التحضير غير الرضحي للوصول إلى الشريان الكظري الأيسر (الشكل 3A-D).
- حدد الموقع النابض عادة الإنسي للامتداد القحفي للشريان الكظري الأيسر ، مما يشير إلى مسار الشريان الأورطي (الشكل 3E). تقدم عبر الأنسجة الرخوة باستخدام مشابك الفرهولت للتشريح الحاد من أجل الوصول إلى الشريان الأورطي البطني (الشكل 3F ، G).
- قم بحفر الشريان الأورطي البطني في معظم نهاية الجمجمة باستخدام مشابك غير حادة (الشكل 3H-L) وحبال الشريان الأورطي باستخدام حلقة وعاء سيليكون (الشكل 3M-T).
- ضع مشبك الأوعية الدموية الدقيقة المناسب لتمدد الأوعية الدموية باستخدام حلقة السيليكون لإرخاء الشريان الأورطي بطنيا قليلا وتوجيه مشبك الأوعية الدموية الدقيقة لتمدد الأوعية الدموية على طول حلقة السيليكون لضمان لقط الأبهر المعزول (الشكل 3U). اعتمادا على سؤال البحث ، يمكن تحرير مشبك الأوعية الدموية الدقيقة مرة أخرى.
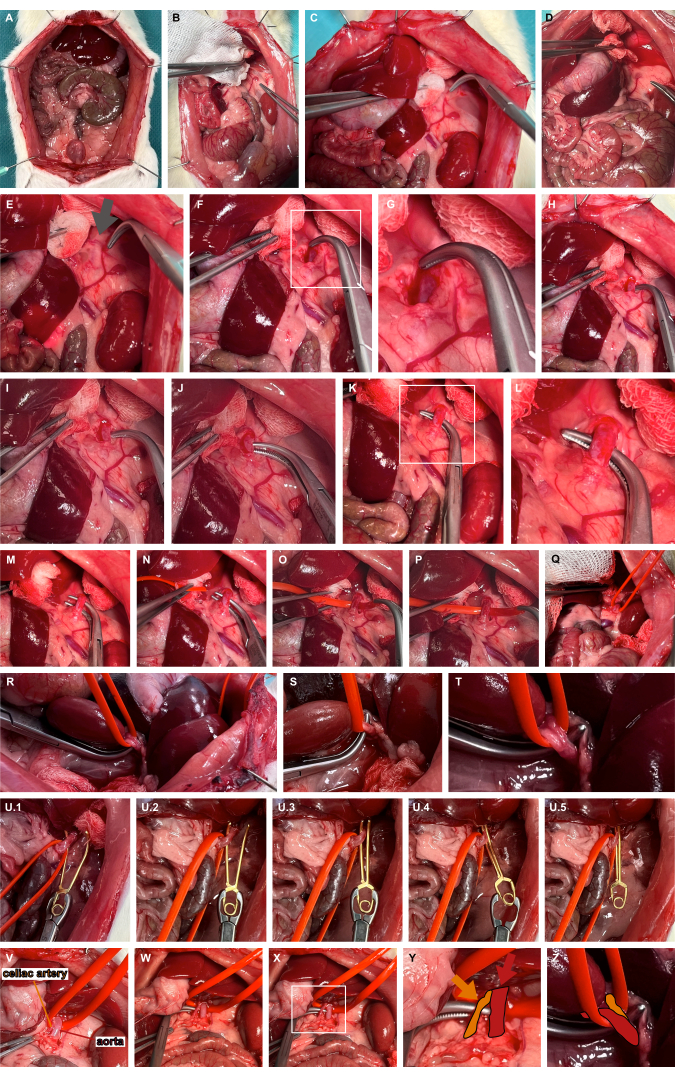
الشكل 3: تحضير وتثبيت الشريان الأورطي البطني. (أ) التعرض للأعضاء الحشوية. (ب - ه) الوسط الأيسر لأعضاء البطن العلوي باستخدام أدوات التحضير غير الرضحي للوصول إلى الشريان الكظري الأيسر. (إف ، ز) تشريح وسطي حاد للشريان الكظري الأيسر في الموقع النابض (السهم الرمادي) من أجل الوصول إلى الشريان الأورطي البطني. (H-L) حفر نفق الشريان الأورطي البطني باستخدام مشابك غير حادة. (إم تي) حبال الشريان الأورطي باستخدام حلقة وعاء سيليكون. (U) تطبيق مشبك الأوعية الدموية الدقيقة لتمدد الأوعية الدموية القابل للإطلاق باستخدام حلقة السيليكون كإرشاد. (الخامس-اليزياء) تصور الشريان البطني (البرتقالي) في إشارة إلى الشريان الأورطي (الأحمر) وحلقة وعاء السيليكون. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. تحضير وتثبيت الوريد البطني فوق الهيباتيك للاحتقان الوريدي
- قم بتعبئة الكبد إلى اليمين باستخدام أدوات التحضير غير الرضحية ، وتشريح الأربطة الكبدية بشكل حاد ، وزيادة جانبي الكبد (الشكل 4A-C).
- افتح المساحة خلف الكبد عند الغطاء الأيسر للحجاب الحاجز باستخدام مشابك أوفرهولت غير حادة (الشكل 4D-G).
- نفق الوريد الاسعفي باستخدام مشابك غير حادة (الشكل 4H-K) وحبال الوريد الكافل باستخدام حلقات وعاء السيليكون (الشكل 4L-O).
- قم بتطبيق مشبك الأوعية الدموية الدقيقة المناسب لتمدد الأوعية الدموية باستخدام حلقة السيليكون لإرخاء الوريد السحري قليلا بطنيا وتوجيه مشبك الأوعية الدموية الدقيقة لتمدد الأوعية الدموية على طول حلقة السيليكون لضمان التثبيت المعزول للوريد السدفي (الشكل 4R).
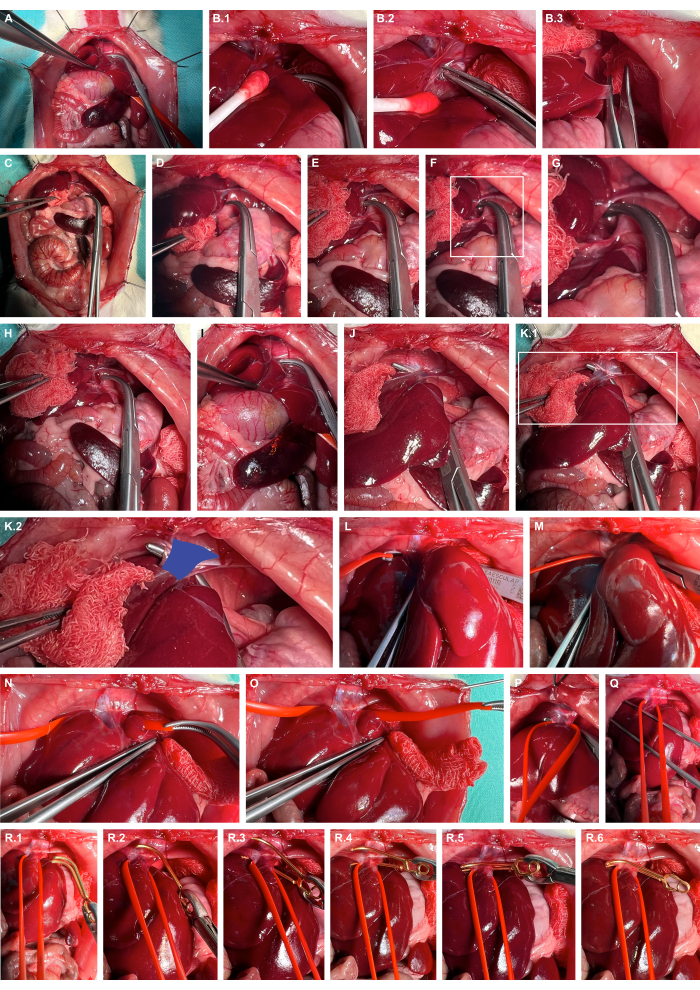
الشكل 4: تحضير وتثبيت الوريد الجفي البطني فوق الهيباتيك. (أ) تعرض الأعضاء الحشوية في الجمجمة. (ب) تعبئة الكبد الواقية للأنسجة والتشريح الحاد للأربطة الكبدية باستخدام أدوات التحضير اللارضحية. (ج) الانضفاء الجانبي على الكبد. (D-G) فتح الفضاء خلف الكبد والتحضير عند الصلب الأيسر من الحجاب الحاجز. (إتش كيه) حفر نفق الوريد السحري (الأزرق) باستخدام مشابك أوفرهولت حادة. (LO) حبال الوريد الكفف باستخدام حلقات وعاء السيليكون. (ف ، س) مجهود التوتر لتقييد تدفق الدم العرفي مبدئيا. (R) تطبيق مشبك الأوعية الدموية الدقيقة لتمدد الأوعية الدموية القابل للإطلاق باستخدام حلقة السيليكون كإرشاد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. لقط الشريان الأورطي البطني والوريد البطني فوق الرحمي لسوء التروية المشترك
- قم بتنفيذ الخطوات المذكورة أعلاه حتى يتم تعليق كل من الشريان الأورطي والوريد الكاشف بحلقات وعاء سيليكون. تقدم مع تطبيق مشبك الأوعية الدموية الدقيقة لتمدد الأوعية الدموية لكلا السفينتين مرة أخرى باستخدام حلقة السيليكون للتوجيه. يوصى بتثبيت الشريان الأورطي أولا وتقليل الوقت المطلوب حتى التثبيت اللاحق لبضع ثوان فقط.
ملاحظة: اعتمادا على السيناريو المطلوب والغرض البحثي ، يمكن أن يستمر سوء التروية أو إطلاقه بعد فترة زمنية محددة ، ويمكن إما القتل الرحيم للحيوانات عن طريق استئصال القلب الحاد (باتباع البروتوكولات المعتمدة مؤسسيا) لتطبيقات عدم البقاء على قيد الحياة ، أو تلقي إغلاق البطن تدريجيا باستخدام الغرز الجراحية في حالة المتابعة المخطط لها وتجارب البقاء على قيد الحياة. بالنسبة للدراسة الحالية ، تم قتل رحيما.
النتائج
تم تنفيذ هذا البروتوكول في 10 ذكور من الفئران (متوسط الوزن 403 جم ± 26 جم) في بيئة غير قابلة للبقاء. تم تحديد معدل النجاح من خلال البقاء على قيد الحياة لأكثر من 20 دقيقة بعد التثبيت الشرياني ، والتثبيت الوريدي ، والتثبيت المشترك لمدة 5 دقائق مع 10 دقائق من إعادة التروية ، كان كل منها 100٪. كان متوسط مدة التحضير من شق الجلد حتى كلا الوعاءين بحلقات سيليكون 11 دقيقة و 45 ثانية ± 3 دقائق و 23 ثانية.
للتحقق من صحة 4 حالات مختلفة من سوء التروية ، تم قياس معلمات مؤشر الأوكسجين (StO2) والتروية (NIR) باستخدام التصوير الفائق الطيفي (HSI) عبر 5 أعضاء حشوية (الشكل 5).
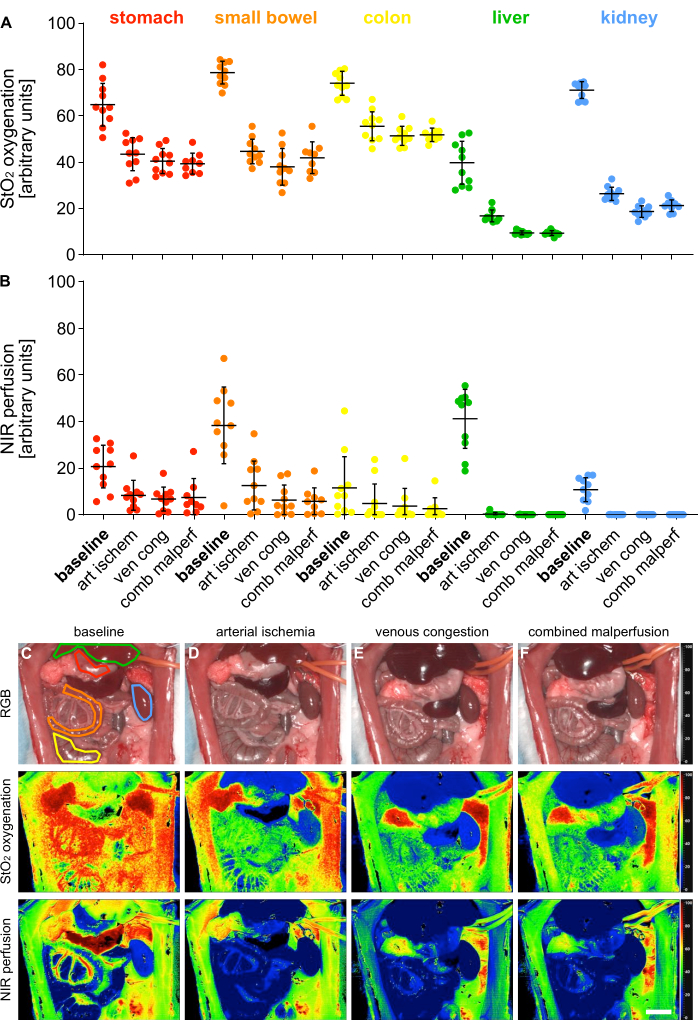
الشكل 5: التحقق من صحة نموذج سوء التروية. (أ ، ب) التقدير الكمي لقيم أكسجة وتروية HSI عبر أربع حالات مختلفة من التروية وخمسة أعضاء حشوية مختلفة مع n = 10. (C-F) RGB وصور فهرس مرمزة بالألوان لتسجيلات HSI التي تحتوي على أعضاء حشوية عبر 4 حالات نضح مختلفة. تشير أشرطة الخطأ إلى الانحراف المعياري. يصور شريط المقياس 5 سم. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
تم توفير القيم في وحدات تعسفية وأظهرت انخفاضا كبيرا في حالات سوء التروية مقارنة بحالة الأعضاء الفسيولوجية (الجدول 1). كانت النتائج الفائقة الطيفية متوافقة مع المنشورات الحديثة التي تشير إلى أنه يمكن تقييم قابلية الأنسجة للبقاء والنضح باستخدام قيم قطع HSI StO2 الخاصة بالأعضاء والتي تطابقت مع القيم التي شوهدت في هذه الدراسة14،15. على سبيل المثال بالنسبة للمعدة ، كانت هذه 64.1٪ (±9.4٪) للتروية الفسيولوجية ، و 43.1٪ (±7.4٪) لإقفار الشرياني ، و 40.5٪ (±5.4٪) للاحتقان الوريدي و 39.3٪ (±4.5٪) لسوء التروية المشتركة.
نظرا لأن هذه كانت تجارب غير قابلة للبقاء على قيد الحياة ، فلا توجد بيانات تجريبية عن النتائج طويلة المدى للحيوانات. ومع ذلك ، تشير دراسات أخرى إلى بقاء 100٪ و 57٪ على مدى 24 ساعة للفئران التي خضعت ل 30 دقيقة و 60 دقيقة من لقط الشريان المساريقيالعلوي 16،17 وربطها بنجاح بمستويات مصل من بروتين الصدمة الحرارية 70. وبالتالي ، قد تكون هذه طريقة ممكنة لتقييم النتائج في دراسات البقاء على قيد الحياة المستقبلية وفقا لأوقات التثبيت المختلفة.
| البارامتر | أرغن | الاساس | نقص تروية الشرايين | الاحتقان الوريدي | التضية المختلطة |
| StO2 | معدة | 64.1٪ (±9.4٪) | 43.1٪ (±7.4٪) | 40.5٪ (±5.4٪) | 39.3٪ (±4.5٪) |
| الأمعاء الدقيقة | 78.4٪ (±5.1٪) | 44.8٪ (±5.5٪) | 38.0٪ (±7.9٪) | 41.9٪ (±6.9٪) | |
| قولون | 74.6٪ (±5.0٪) | 56.0٪ (±6.3٪) | 51.3٪ (±4.1٪) | 51.8٪ (±2.9٪) | |
| كبد | 39.5٪ (±9.7٪) | 16.9٪ (±2.6٪) | 9.5٪ (±0.8٪) | 9.3٪ (±1.1٪) | |
| كلية | 71.0٪ (±3.8٪) | 26.3٪ (±3.0٪) | 18.6٪ (±2.5٪) | 21.2٪ (±2.6٪) | |
| نير | معدة | 20.0٪ (±9.3٪) | 8.3٪ (±6.7٪) | 6.8٪ (±5.1٪) | 7.5٪ (±8.1٪) |
| الأمعاء الدقيقة | 38.6٪ (±17.4٪) | 12.9٪ (±11.0٪) | 6.3٪ (±6.5٪) | 5.7٪ (±5.9٪) | |
| قولون | 12.6٪ (±13.7٪) | 5.3٪ (±8.7٪) | 3.8٪ (±7.5٪) | 2.6٪ (±4.7٪) | |
| كبد | 40.4٪ (±13.1٪) | 0.3٪ (±0.7٪) | 0.0٪ (±0.1٪) | 0.0٪ (±0.0٪) | |
| كلية | 10.4٪ (±5.2٪) | 0.0٪ (±0.0٪) | 0.0٪ (±0.1٪) | 0.0٪ (±0.0٪) |
الجدول 1: معلمات الأنسجة. قيم أكسجة HIS StO2 وقيم نضح NIR في وحدات تعسفية عبر 5 أعضاء حشوية و 4 حالات نضح مختلفة.
Discussion
في حين أن مرض انسداد الشرايين المحيطية (PAOD) وحده ، باعتباره الممثل الأبرز لحالات سوء تروية الأنسجة ، ينتشر بالفعل بحوالي 7٪ ، مما يؤثر على ما يقدر بنحو 8.5 مليون بالغ في الولايات المتحدة وحدها18 ، فإن سوء تروية الأنسجة بشكل عام هو آلية مرضية ذات صلة في غالبية الحالات الجراحية والطبية. وبالتالي ، فإن النماذج الحيوانية المناسبة والقابلة للتكرار ضرورية للغاية لمعالجة أسئلة البحث الجديدة في هذا المجال.
الحالات الديناميكية الوعائية الثلاث التي تتطلب فحصا مميزا هي نقص تروية الشرايين والاحتقان الوريدي وسوء التروية المشترك. من خلال إحداث نقص تروية الشرايين المعزولة ، يمكن للعلماء تحديد التقدم الزمني والمكاني لنقص الأكسجة في الأنسجة بدقة ، والتحقيق في الشلالات الجزيئية المتورطة في إصابة نقص التروية وإعادة التروية ، وموت الخلايا المبرمج الخلوي ، والاستجابات الالتهابية. من خلال المساومة على التصريف الوريدي ، وهو جانب يتم تجاهله في كثير من الأحيان من أمراض الأوعية الدموية ، يمكن للعلماء التحقيق في التفاعل بين التدفق الشرياني وتناقضات التدفق الوريدي ، مما يلقي الضوء على الفيزيولوجيا المرضية للتخثر الوريدي ، وذمة الأنسجة المرتبطة بالاحتقان ، وضعف الدورة الدموية الدقيقة. عند الجمع بين هاتين الحالتين المرضيتين ، يمكن للمرء أن يحقق في الوسط غير التآزري لسوء التروية المشترك ، مما يعكس الفيزيولوجيا المرضية المعقدة التي تواجهها المتلازمات السريرية مثل نقص تروية المساريق الحاد والتهاب القولون الإقفاري.
بالإضافة إلى توضيح الآليات الفيزيولوجية المرضية الأساسية ، فإن القدرة على إحداث نقص تروية الشرايين الحشوية ، والاحتقان الوريدي ، وسوء التروية المشترك في الفئران تعمل كمنصة لا غنى عنها لتقييم فعالية التدخلات الدوائية ، والتقنيات الجراحية ، والاستراتيجيات العلاجية الجديدة ، وطرق التصوير المبتكرة ، خاصة مثل HSI14،19،20،21،22. وبالتالي ، يعد هذا النموذج مكونا رئيسيا في توفير الحقيقة الأرضية المطلوبة للأنسجة البيولوجية اللازمة لتسخير الإمكانات الكاملة ل HSI في تقييم الأنسجة وتحديد حالات التروية. من خلال الاستفادة من هذا الإعداد التجريبي ، يمكن للباحثين تسريع ترجمة النتائج قبل السريرية إلى استراتيجيات قابلة للتطبيق سريريا ، مما يقلل في النهاية من المراضة والوفيات المرتبطة باضطرابات الأوعية الدموية والتروية المتنوعة.
وللتوضيح ، يمكن للباحثين استخدام هذا النموذج للتحقيق في فعالية العوامل الدوائية التي تستهدف مسارات إصابة نقص التروية وإعادة التروية ، مثل مضادات الأكسدة والعوامل المضادة للالتهابات وموسعات الأوعية الدموية ، وبالتالي تحديد فائدتها المحتملة في الممارسة السريرية23،24. بالإضافة إلى ذلك ، يسهل هذا النموذج تقييم الأساليب الجراحية الجديدة ، مثل تقنيات إعادة التوعي المساريقية وإجراءات تخفيف الضغط الوريدي ، مما يوفر رؤى لا تقدر بثمن حول جدواها وسلامتها وفعاليتها على المدى الطويل25،26.
علاوة على ذلك ، يمكن هذا الإطار التجريبي الباحثين من استكشاف التفاعل المعقد بين الخلل الوظيفي في الأوعية الدموية والأمراض المصاحبة الجهازية ، مثل مرض السكري وارتفاع ضغط الدم وتصلب الشرايين ، وبالتالي توضيح الشبكة المعقدة من المسارات الفيزيولوجية المرضية المترابطة التي تنسق تطور أمراض الأوعيةالدموية 27،28.
في حين أن هناك العديد من المنشورات حول سوء التروية الانتقائي للأعضاء المفردة ، مثل الكبد29،30،31أو الكلى ، في الفئران32،33 ، هناك نقص في الأدبيات العلمية التي تعالج سوء تروية الأحشاء الكاملة في الفئران ، ولا يوجد بروتوكول منهجي صراحة. هذا ، إذن ، هو ادعاء هذه المخطوطة. تشمل قيود التقنية المقدمة بشكل أساسي غزو الإجراء ، واعتمادا على مدة سوء التروية ، وتجلط الأعضاء المتتالي ، والخلل الوظيفي ، مما قد يؤدي إلى معاناة ما بعد الجراحة من خلال فشل متعدد الأعضاء أو متلازمة حجرة البطن34 ، 35 ، 36. يمكن أن يساعد التخطيط والتصميم الدقيقون ، اعتمادا على سؤال البحث ، في تحقيق التوازن بين المدة المطلوبة لسوء التروية وعواقبه الفيزيولوجية المرضية.
عند استكشاف الأخطاء وإصلاحها للتحديات الشائعة التي تمت مواجهتها أثناء الإجراء ، يجب لفت الانتباه إلى النقاط والتوصيات التالية: (1) ضمان الإعداد الشامل للمعدات والأدوية مسبقا لتقليل الانقطاعات أثناء الإجراء ؛ (2) قم بإجراء التحكم في مرقئ بدقة عن طريق إعداد وتشريح الطائرات اللاوعائية بعناية. ضع في اعتبارك استخدام ملقط مرقئ ثنائي القطب للإرقاء الكهربائي ، إن وجد ؛ (3) تقليل الصدمات التي لحقت بالأنسجة باستخدام أدوات غير مؤلمة مثل مسحات القطن المرطبة أو الضغط الجراحي المرطب بالملقط عند ملامسة حمة الكبد ؛ (4) ما يقرب من 20٪ من عانت من نزيف حمة الكبد السطحي المنتشر بسبب ظروف الأنسجة الحساسة. ومع ذلك ، توقف النزيف في جميع الحالات بضغط خفيف وصبر. تهدف هذه التوصيات إلى تعزيز الكفاءة الإجرائية وتقليل المضاعفات أثناء تحريض سوء التروية في نماذج الفئران.
عند استئصال الخنجري لتحسين الوصول إلى الوريد السحري ، تأكد من ترك الصفاق الظهري للانتقال بين الخنجري والقص سليما على مدى بضعة ملليمترات. سيكون موقع استئصال الخنجري صلبا وحادا ، مما قد يتسبب في صدمة لحمة الكبد السطحية. لذلك ، يوصى بتعبئة الصفاق القصي الذيلي باستخدام الملقط ولفه حول جذع العظام بشكل فعال ، وتغطيته ودعم الإرقاء. يجب خياطة خطافات التحضير الجراحي من خلال جدار البطن البطني القحفي مع شد الجمجمة بحيث تظل التغطية البريتونية للجذع الخنجري في مكانها.
عند تشريح الرباط المنجلي ، يجب توخي الحذر لتجنب التسبب عن طريق الخطأ في إصابة علاجية المنشأ في الوريد الكبدي ، لأن هذا قد يكون قاتلا للحيوان. نظرا لارتفاع خطر النزيف أثناء تحضير الأوعية الدموية ، يوصى بأن يتم إجراء غالبية التحضير الجراحي عن طريق الانتشار باستخدام مشابك أوفرهولت حادة ، بدلا من استخدام أدوات تشريح حادة. بالإضافة إلى ذلك ، يجب ترطيب حلقات أوعية السيليكون قبل الاستخدام لتقليل احتكاك السطح وتقليل مخاطر صدمة الأنسجة.
عند تطبيق مشبك الأوعية الدموية الدقيقة لتمدد الأوعية الدموية ، من الضروري تصور تشريح الأوعية الدموية بالضبط. على سبيل المثال ، ينشأ الشريان البطني في الجمجمة من الشريان الأورطي البطني. إذا كان الانسداد البطني مطلوبا ، مثل التحقيق في سوء الضخ الكبدي ، فيجب تصور الشريان البطني في إشارة إلى الشريان الأورطي وحلقة وعاء السيليكون. هذا يضمن تضمين الشريان البطني في أنسجة الأوعية الدموية المثبتة (الشكل 2V-Z). كانت هناك حالة واحدة تم فيها وضع المشبك في البداية ذيلية للشريان البطني عن طريق الصدفة. ومع ذلك ، تم التعرف على ذلك على الفور بسبب الانخفاض المفقود في قيم الكبد StO2 ، وتم إجراء إعادة التثبيت المناسبة بنجاح.
خطوة التحضير الأكثر خطورة هي حفر نفق الوريد العروي. تتطلب هذه الخطوة حركات لطيفة وصبرا ، ويجب أن تنتشر المشابك الزائدة فقط عند التأكد من عدم وجود اتصال بالوريد الجفسي. قد يكون من الصعب الحكم على ذلك ، حيث سيظهر الوريد السعفي كنسيج ضام لاوعائي رقيق عند تطبيق ضغط طفيف ، مما يتسبب في اختفاء الدم الموجود في كلا الاتجاهين. هناك أيضا خطر الفتح العرضي للجنبة وإنشاء استرواح الصدر عند حفر نفق الوريد السفن بشكل كبير جدا. يمكن أن يكون هذا من المضاعفات الخطيرة والمهددة للحياة ، خاصة وأن يتنفس تلقائيا ، ولا يمكن اتخاذ تدابير تنفسية غازية. لقد وجد أنه من المفيد سحب أدوات التحضير قليلا والاستمرار بشكل ذيلي لتجنب هذه المضاعفات. في حالات استرواح الصدر المرئي والملائم من الناحية الدموية مع انتفاخ الحجاب الحاجز الكبدي، يمكن التوصية بثقب لمرة واحدة عبر الحجاب الحاجز وشفط الهواء المحاصر باستخدام إبرة 30 جم وحقنة صغيرة كاستراتيجية إنقاذ. تم استخدام هذه التقنية بنجاح في واحد لإنقاذه أثناء الجراحة.
أخيرا ، يجب توخي الحذر بشكل خاص عند تطبيق المشابك الوعائية الدقيقة لتجنب تضمين النسيج الضام المحيط ، مما قد يؤدي إلى انسداد غير كاف للوعاء المطلوب.
في حين أن هذا البروتوكول يهدف إلى أن يكون دليلا خطوة بخطوة لسوء التروية الحشوية العالمي ، يمكن تعديل موقع التثبيت وفقا لسؤال البحث المحدد بسبب إعداد الأوعية الدموية الشاملة والتعبئة الموضحة في الشكل 1T-V. لذلك ، يعد سوء التروية المختار لمجموعات الأعضاء أو الأعضاء المفردة أيضا خيارا عند اختيار موقع التثبيت بشكل بعيد على طول شجرة الأوعية الدموية ، مثل تثبيت الجذع البطني بشكل انتقائي لإقفار الكبد. من خلال تقديم منهجية مفصلة وقابلة للتكرار ، يسهل هذا البروتوكول نهجا موحدا لنقص تروية الشرياني القابل للانعكاس ، والاحتقان الوريدي ، وسوء التروية المشترك في نماذج الفئران ، مما يؤدي إلى تحسين موثوقية البيانات ، والمتانة ، واستقلالية الباحث ، وقابلية المقارنة عبر الدراسات التي أجريت على في المستقبل. وبالتالي ، فإنه يمثل أداة لا غنى عنها في تسليح البحوث الطبية الحيوية ، حيث يقدم نظرة مستقبلية حول التفاعل المعقد بين تسوية الأوعية الدموية وإصابة الأنسجة والتدخلات العلاجية. من خلال تسخير تعدد استخدامات هذا الإعداد التجريبي ، يمكن للباحثين التحقيق في الألغاز حول الفيزيولوجيا المرضية للأوعية الدموية ، وتشكيل آفاق جديدة في الطب الانتقالي ، وتعزيز نتائج المرضى في نهاية المطاف في مجال صحة الأوعية الدموية.
Disclosures
اي.
Acknowledgements
يعرب المؤلفون عن امتنانه لخدمة تخزين البيانات SDS@hd بدعم من وزارة العلوم والبحث والفنون في بادن فورتمبيرغ (MWK) ومؤسسة الأبحاث الألمانية (DFG) من خلال منحة INST 35 / 1314-1 FUGG و INST 35 / 1503-1 FUGG. علاوة على ذلك ، يقر المؤلفون بامتنان بالدعم المقدم من NCT (المركز الوطني لأمراض الأورام في هايدلبرغ ، ألمانيا) من خلال برنامج ما بعد الدكتوراه المنظم وبرنامج جراحة الأورام. كما نعترف بالدعم من خلال أموال الدولة التي وافق عليها برلمان ولاية بادن فورتمبيرغ لتحالف Innovation Campus Health + Life Science Alliance Heidelberg Mannheim من برنامج ما بعد الدكتوراه المنظم لألكسندر ستودييه فيشر: الذكاء الاصطناعي في الصحة (AIH) - تعاون بين DKFZ و EMBL وجامعة هايدلبرغ ومستشفى جامعة هايدلبرغ ومستشفى مانهايم الجامعي والمعهد المركزي للصحة العقلية ، ومعهد ماكس بلانك للبحوث الطبية. علاوة على ذلك ، فإننا نقدر الدعم من خلال معهد DKFZ Hector للسرطان في المركز الطبي الجامعي في مانهايم. بالنسبة لرسوم النشر، نقر بالدعم المالي المقدم من Deutsche Forschungsgemeinschaft ضمن برنامج التمويل "Open Access Publikationskosten" وكذلك من جامعة هايدلبرغ.
Materials
| Name | Company | Catalog Number | Comments |
| Atraumatic preparation forceps | Aesculap | FB395R | DE BAKEY ATRAUMATA atraumatic forceps, straight |
| Blunt overholt clamp | Aesculap | BJ012R | BABY-MIXTER preparation and ligature clamp, bent, 180 mm |
| Cannula | BD (Beckton, Dickinson) | 301300 | BD Microlance 3 cannula 20 G |
| Fixation rods | legefirm | 500343896 | tuning forks used as y-shaped metal fixation rods |
| Heating pad | Royal Gardineer | IP67 | Royal Gardineer Heating Pad Size S, 20 Watt |
| Plastic perfusor tube | M. Schilling GmbH | S702NC150 | connecting tube COEX 150 cm |
| Preparation scissors | Aesculap | BC177R | JAMESON preparation scissors, bent, fine model, blunt/blunt, 150 mm (6") |
| Silicone vessel loop tie | SERAG WIESSNER | SL26 | silicone vessel loop tie 2,5 mm red |
| Spraque Dawley rat | Janvier Labs | RN-SD-M | Spraque Dawley rat |
| Steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
| Yasargil clip | Aesculap | FE795K | YASARGIL Aneurysm Clip System Phynox Temporary (Standard) Clip |
| Yasargil clip applicator | Aesculap | FE558K | YASARGIL Aneurysm Clip Applicator Phynox (Standard) |
References
- Carden, D. L., Granger, D. N. Pathophysiology of ischemia-reperfusion injury. J Pathol. 190 (3), 255-266 (2000).
- Balkwill, F., Mantovani, A. Inflammation and cancer: Back to Virchow. Lancet. 357 (9255), 539-545 (2001).
- Cruz, R. J., Garrido, A. G., Ribeiro, C. M., Harada, T., Rocha-E-Silva, M. Regional blood flow distribution and oxygen metabolism during mesenteric ischemia and congestion. J Surg Res. 161 (1), 54-61 (2010).
- Leng, G. C., Davis, M., Baker, D. Bypass surgery for chronic lower limb ischemia. Cochrane Database Syst Rev. 3, Cd002000 (2000).
- Droc, I., Calinescu, F. B., Droc, G., Blaj, C., Dammrau, R. Aortic stenting. Minim Invasive Ther Allied Technol. 24 (5), 296-304 (2015).
- Le Gall, A., et al. Veno-arterial-ecmo in the intensive care unit: From technical aspects to clinical practice. Anaesth Crit Care Pain Med. 37 (3), 259-268 (2018).
- Napp, L. C., Kühn, C., Bauersachs, J. ECMO in cardiac arrest and cardiogenic. Herz. 42 (1), 27-44 (2017).
- Sousa Da Silva, R. X., Weber, A., Dutkowski, P., Clavien, P. A. Machine perfusion in liver transplantation. Hepatology. 76 (5), 1531-1549 (2022).
- Sen Gupta, A. Bio-inspired nanomedicine strategies for artificial blood components. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 9 (6), 1464 (2017).
- Lu, D., et al. Intramuscular microvascular flow sensing for flap monitoring in a porcine model of arterial and venous occlusion. J Reconstr Microsurg. 39 (3), 231-237 (2023).
- Nguyen, G. K., et al. Novel biomarkers of arterial and venous ischemia in microvascular flaps. PLoS One. 8 (8), e71628 (2013).
- Redlin, M., et al. How near-infrared spectroscopy differentiates between lower body ischemia due to arterial occlusion versus venous outflow obstruction. Ann Thorac Surg. 91 (4), 1274-1276 (2011).
- Studier-Fischer, A., et al. Endotracheal intubation via tracheotomy and subsequent thoracotomy in rats for non-survival applications. J Vis Exp. (205), e66684 (2024).
- Nickel, F., et al. Optimization of anastomotic technique and gastric conduit perfusion with hyperspectral imaging and machine learning in an experimental model for minimally invasive esophagectomy. Eur J Surg Oncol. , 106908 (2023).
- Barberio, M., et al. Quantitative fluorescence angiography versus hyperspectral imaging to assess bowel ischemia: A comparative study in enhanced reality. Surgery. 168 (1), 178-184 (2020).
- Doukas, P., et al. Onset of adverse abdominal events due to intestinal ischemia-reperfusion injury after aortic cross-clamping is associated with elevated hsp70 serum levels in the early postoperative phase. Int J Mol Sci. 23 (23), 15063 (2022).
- Mine, Y., et al. Heat shock protein 70 messenger RNA in rat leukocytes elevates after severe intestinal ischemia-reperfusion. J Surg Res. 242, 342-348 (2019).
- Criqui, M. H., et al. Lower extremity peripheral artery disease: Contemporary epidemiology, management gaps, and future directions: A scientific statement from the American Heart Association. Circulation. 144 (9), e171-e191 (2021).
- Seidlitz, S., et al. Robust deep learning-based semantic organ segmentation in hyperspectral images. Med Image Anal. 80, 102488 (2022).
- Studier-Fischer, A., et al. Icg-augmented hyperspectral imaging for visualization of intestinal perfusion compared to conventional icg fluorescence imaging: An experimental study. Int J Surg. 109 (12), 3883-3895 (2023).
- Studier-Fischer, A., et al. Heiporspectral - the heidelberg porcine hyperspectral imaging dataset of 20 physiological organs. Scientific Data. 10 (1), 414 (2023).
- Studier-Fischer, A., et al. Spectral organ fingerprints for machine learning-based intraoperative tissue classification with hyperspectral imaging in a porcine model. Sci Rep. 12 (1), 11028 (2022).
- Mallick, I. H., Yang, W., Winslet, M. C., Seifalian, A. M. Ischemia-reperfusion injury of the intestine and protective strategies against injury. Dig Dis Sci. 49 (9), 1359-1377 (2004).
- Malekinejad, Z., et al. Prazosin treatment protects brain and heart by diminishing oxidative stress and apoptotic pathways after renal ischemia-reperfusion. Drug Res (Stuttg). 72 (6), 336-342 (2022).
- Feldman, Z. M., et al. Inferior mesenteric artery revascularization can supplement salvage of mesenteric ischemia. J Vasc Surg Cases Innov Tech. 9 (3), 101041 (2023).
- Munley, J. A., et al. Chronic mesenteric ischemia-induced intestinal dysbiosis resolved after revascularization. J Vasc Surg Cases Innov Tech. 9 (2), 101084 (2023).
- Lejay, A., et al. Ischemia reperfusion injury, ischemic conditioning and diabetes mellitus. J Mol Cell Cardiol. 91, 11-22 (2016).
- Huang, D., et al. Macrovascular complications in patients with diabetes and prediabetes. Biomed Res Int. 2017, 7839101 (2017).
- Liu, A., et al. Hmgb1 in the ischemic and non-ischemic liver after selective warm ischemia/reperfusion in rats. Histochem Cell Biol. 135 (5), 443-452 (2011).
- Koc, S., Dogan, H. O., Karatas, O., Erdogan, M. M., Polat, V. Mitochondrial homeostasis and mast cells in experimental hepatic ischemia-reperfusion injury of rats. Turk J Gastroenterol. 33 (9), 777-784 (2022).
- Chu, M. J., Vather, R., Hickey, A. J., Phillips, A. R., Bartlett, A. S. Impact of ischaemic preconditioning on experimental steatotic livers following hepatic ischemia-reperfusion injury: A systematic review. HPB (Oxford). 17 (1), 1-10 (2015).
- Chang, M. W., et al. Sitagliptin protects rat kidneys from acute ischemia-reperfusion injury via upregulation of GLP-1 and GLP-1 receptors. Acta Pharmacol Sin. 36 (1), 119-130 (2015).
- Boys, J. A., Toledo, A. H., Anaya-Prado, R., Lopez-Neblina, F., Toledo-Pereyra, L. H. Effects of dantrolene on ischemia-reperfusion injury in animal models: A review of outcomes in heart, brain, liver, and kidney. J. Investig Med. 58 (7), 875-882 (2010).
- Orihashi, K. Mesenteric ischemia in acute aortic dissection. Surg Today. 46 (5), 509-516 (2016).
- Byard, R. W. Acute mesenteric ischemia and unexpected death. J Forensic Leg Med. 19 (4), 185-190 (2012).
- Łagosz, P., Sokolski, M., Biegus, J., Tycinska, A., Zymlinski, R. Elevated intra-abdominal pressure: A review of current knowledge. World J Clin Cases. 10 (10), 3005-3013 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved