Method Article
Контролируемая обратимая висцеральная артериальная ишемия, венозный застой и комбинированная мальперфузия с помощью срединной лапаротомии у крыс
В этой статье
Резюме
В данной статье представлена стандартизированная процедура контролируемой, обратимой мальперфузии висцеральных органов на моделях крыс. Цель состоит в том, чтобы индуцировать эти мальперфузионные состояния с высокой степенью методологической определенности и контроля, сохраняя при этом техническую простоту и устойчивость к ошибкам.
Аннотация
Наряду с сепсисом и злокачественными новообразованиями, мальперфузия является третьей по значимости причиной деградации тканей и основным патомеханизмом различных медицинских и хирургических состояний. Несмотря на значительные разработки, такие как шунтирование, эндоваскулярные процедуры, экстракорпоральная мембранная оксигенация и искусственные кровезаменители, мальперфузия тканей, особенно висцеральных органов, остается актуальной проблемой в уходе за пациентами. Спрос на дальнейшие исследования биомедицинских процессов и возможных вмешательств высок. Достоверные биологические модели имеют первостепенное значение для проведения такого рода исследований. Из-за многофакторных аспектов исследований перфузии тканей, которые включают в себя не только клеточную биологию, но и сосудистую микроанатомию и реологию, подходящая модель требует такой степени биологической сложности, которую может обеспечить только животная модель, что делает грызунов очевидной моделью выбора. Мальперфузия тканей может быть дифференцирована в три различных состояния: (1) изолированная артериальная ишемия, (2) изолированный венозный застой и (3) комбинированная мальперфузия. В данной статье представлен подробный пошаговый протокол контролируемой и обратимой индукции этих трех типов висцеральной мальперфузии с помощью срединной лапаротомии и пережатия брюшной аорты и вальной вены у крыс, что подчеркивает важность точной хирургической методологии для обеспечения однородных и надежных результатов. Основными примерами возможного применения этой модели являются разработка и валидация инновационных методов интраоперационной визуализации, таких как гиперспектральная визуализация (HSI), для объективной визуализации и дифференциации мальперфузии желудочно-кишечных, гинекологических и урологических органов.
Введение
Несмотря на то, что последствия депривации тканевой перфузии в виде местных или системных состояний мальперфузии тканей давно признаны, они сохраняются в качестве одной из основных причин заболеваемости и смертности как в Соединенных Штатах, так и в Европе1. Эти мальперфузионные состояния являются третьей по значимости причиной деградации тканей после злокачественных новообразований и септического воспаления, но имеют гораздо более широкий спектр происхождения по сравнению с последнимидвумя.
Этот спектр варьируется от местных механизмов, таких как фибрилляция предсердий с тромбоэмболической окклюзией, вазоконстрикцией и ятрогенной или травматической диссекцией, до системных механизмов, таких как сердечная недостаточность или шок, сепсис, гиповолемия и феномен кражи. Эти разнообразные механизмы лежат в основе различных медицинских и хирургических состояний. Значительная заболеваемость и смертность, связанные с этими состояниями, привлекли внимание врачей к процедурам по восстановлению кровотока к мальперфузированным тканям с целью предотвращения некроза и восстановления функции органовна протяжении десятилетий.
Эти исследовательские усилия привели к появлению различных фармацевтических, медицинских и хирургических решений для восстановления физиологической перфузии органов, включая достижения в области шунтирования4, эндоваскулярных процедур5, экстракорпоральной мембранной оксигенации 6,7, перфузии органов во время трансплантации8 и искусственных кровезаменителей9.
Тем не менее, несмотря на эти значительные разработки, мальперфузия, особенно висцеральных органов, остается актуальной проблемой в уходе за пациентами, и спрос на дальнейшие исследования биомедицинских процессов и стратегий спасения высок. Достоверные биологические модели имеют первостепенное значение для проведения такого рода исследований. Из-за многофакторных аспектов исследований перфузии тканей, которые включают в себя не только клеточную биологию, но и сосудистую микроанатомию и реологию, подходящая модель требует такой степени биологической сложности, которую может обеспечить только полный модельный организм, что делает грызунов очевидной моделью выбора.
Мальперфузия тканей может быть дифференцирована в три различных состояния: изолированная артериальная ишемия, изолированный венозный застой и комбинированная мальперфузия10. Клинически значимые сценарии для этих состояний включают: (1) Артериальная ишемия: фибрилляция предсердий с тромбоэмболической окклюзией, септическая эмболия, вазоконстрикция, ятрогенное или травматическое расслоение или пережатие сосудов, сердечная недостаточность или шок, расслоение аорты, сепсис и гиповолемия, крайняя артериальная обструкция из-за наружного сужения, эмболия легочной артерии, хронические заболевания артериальной сосудистой окклюзии или феномен кражи; (2) Венозный застой: ятрогенное или травматическое расслоение или пережатие сосудов, сердечная недостаточность, фиброз или цирроз печени, венозная обструкция из-за наружного сужения, венозный тромбоз, венозная недостаточность и синдром Бадда-Киари; (3) Комбинированная мальперфузия: комбинации вышеуказанных состояний и поздних стадий вышеупомянутых состояний, таких как вторичный венозный застой из-за фиброза, вызванного ишемией, или вторичная артериальная ишемия из-за задержки, вызванной застойным застоем, а также специфические заболевания органов, такие как ишемическое воспаление (например, ишемический колит)11,12.
Таким образом, данная статья направлена на то, чтобы предоставить пошаговую модель для индуцирования контролируемой, обратимой висцеральной артериальной ишемии, венозного застоя и комбинированной мальперфузии с помощью срединной лапаротомии у крыс как для выживания, так и для невыживания, как показано на рисунке 1. Экспериментальная модель предлагает контролируемую среду для изучения многогранной динамики артериальной ишемии, венозного застоя и их комбинированных последствий, эмулируя клинически значимые сценарии, встречающиеся при различных состояниях.
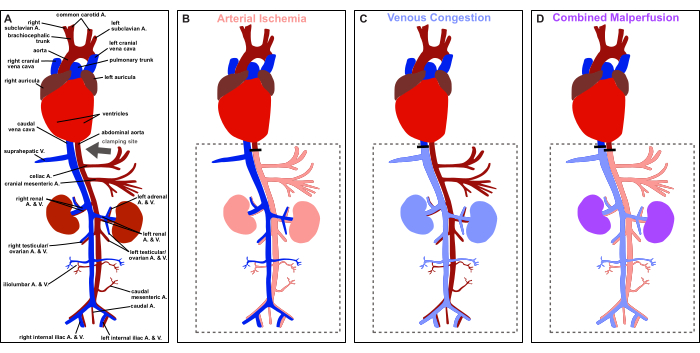
Рисунок 1: Обзор протокола. Схематическое изображение анатомии сосудов крысы и изображение места зажима (серая стрелка). (А) Физиологическая перфузия. (Б) Артериальная ишемия. (В) венозный застой. (D) Комбинированная мальперфузия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
протокол
Все описанные здесь мероприятия с животными проводились в аккредитованных учреждениях и были одобрены Комитетом по институциональному уходу за животными и их использованию (IACUC) Регионального совета Баден-Вюртемберга в Карлсруэ, Германия (35-9185.81/G-62/23). Управление экспериментальными животными осуществлялось в соответствии с институциональными стандартами, немецкими законами об использовании и уходе за животными, директивами Совета Европейского сообщества (2010/63/EU) и руководящими принципами ARRIVE. Самцы крыс Sprague Dawley весом порядка 400 граммов использовались после акклиматизации в течение одной недели. Подробная информация о реагентах и оборудовании, использованных в этом исследовании, приведена в Таблице материалов.
1. Анестезия и обезболивание
- Обезболите крысу лекарством в соответствии с протоколами учреждения. Изофлуран рекомендуется для индукции седативного эффекта с последующим внутривенным введением 100 мг/кг кетамина и 4 мг/кг ксилазина. Дополнительная анальгезия может быть достигнута с помощью внутриканального введения 5 мг/кг карпрофена с массой тела. Для получения подробной информации, пожалуйста, обратитесь к Studier-Fischer et al.13.
- Нанесите офтальмологическую мазь на глаза, чтобы предотвратить сухость.
- Обеспечьте надлежащую глубину обезболивания с помощью теста на щипки пальцев ног с хирургическими щипцами.
- Регулярно переоценивайте и корректируйте глубину анестезии во время операции.
2. Подготовка к процедуре
- Подготовьте стол для скраба со всеми необходимыми материалами и инструментами, включая съемные микрососудистые зажимы и аппликатор (Рисунок 2A-C), тупой зажим для оверхолта, ножницы для тонкой подготовки и щипцы.
- Подготовьте крючки для хирургических препарирований, сложив канюли под углом 135° на расстоянии 1 см от кончика, и подсоедините их к пластиковым перфузионным трубкам с помощью замка Люэра, готовых к натяжению с помощью хирургического зажима от комаров (рис. 2D, E).
- Подготовьте аппарат для хирургического воздействия на грызунов, включая Y-образные фиксирующие стержни и грелку, как указано в Studier-Fischer et al.13.
- Обеспечение надлежащей оксигенации достигается за счет вдыхания 100% кислорода с помощью неонатальной маски для лица (Рисунок 2F).
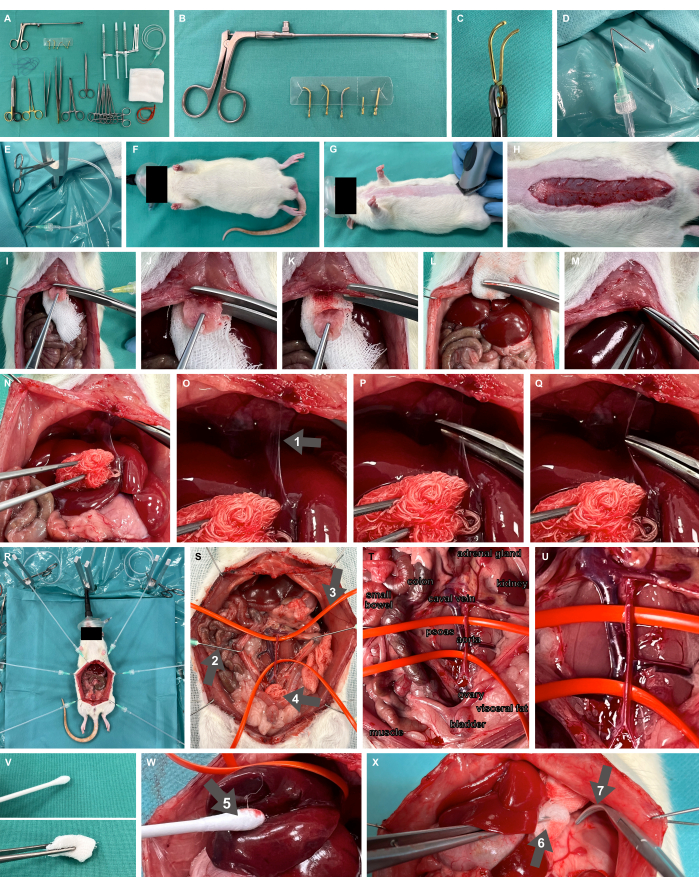
Рисунок 2: Экспериментальная и животная установка. (A) Необходимые хирургические инструменты и материалы. (В,В) Съемный микрососудистый зажим и аппликатор. (Д,Э) В качестве крючка для хирургической подготовки используется сложенная канюля, соединенная с перфузионной трубкой. (Ф,Г) Модель крысы насытилась кислородом с помощью маски для лица и выбрита. (H) Кожный разрез по всей длине живота. (I-M) резекция мечевидной кости и гемостаз. (Н-К) Мобилизация печени и рассечение серповидной связки (стрелка 1). (R) Применение препарирующих крючков и металлических подставок для обнажения органов после лапаротомии. (S) Полное висцеральное обнажение крупных сосудов брюшной полости с использованием тупых крючков (стрелка 2), силиконовых петель сосудов (стрелка 3) и хирургического компресса (стрелка 4). (Т,У) Брюшная аорта и полая вена. (V) Инструменты для атравматической подготовки. (W) Ватный ватный ватный своп (стрелка 5). (X) Увлажненный компресс в щипцах (стрелка 6) и тупых оверхолтовых зажимах (стрелка 7). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
3. Хирургическая подготовка
- Побрейте место хирургического доступа для лапаротомии по средней линии (рисунок 2G). Выполните кожный разрез на желаемой длине живота, т.е. около 7 см (Рисунок 2H), проведите лапаротомию, рассекая фасцию, и прошите через кожу крючки для подготовки хирургического материала с прикрепленными пластиковыми трубками и хирургическими зажимами от комаров. Обнажите хирургическое место с помощью крючков для хирургической подготовки, натягивая ткани.
- Убедитесь, что брюшина рассечена краниально только до нескольких миллиметров ниже начала грудины, оставляя часть брюшины нетронутой. Поместите часть хирургического компресса ниже грудины (рисунок 2I) и резецируйте мечевидный знак ножницами из прочного материала. Надавите на область резекции с помощью хирургического компресса, чтобы добиться достаточного гемостаза этой хорошо перфузированной области (Рисунок 2I-M).
- Мобилизуйте печень дорсо-каудально, чтобы обнажить серповидную связку (рисунок 2N) и рассеките связку (рисунок 2O-Q).
- Для гемостатического контроля, в зависимости от того, где должно быть выполнено пережатие магистральных сосудов, необходимо провести полное висцеральное обнажение магистральных сосудов брюшной полости (рисунок 2R) и сосудов, подвешенных силиконовыми петлями для сосудов (рисунок 2S-U). Следует использовать только инструменты для атравматичной подготовки (Рисунок 2V), такие как увлажняемые ватные ватные ватные сметы (Рисунок 2W), увлажненный компресс в щипцах и тупые накладные зажимы (Рисунок 2X).
4. Подготовка и пережатие брюшной аорты при артериальной ишемии
- Выполните левую медиализацию верхних органов брюшной полости с использованием атравматичных инструментов для получения доступа к левой надпочечниковой артерии (рис. 3A-D).
- Определите пульсирующий участок, как правило, медиально к краниальному расширению левой надпочечниковой артерии, указывающий на течение аорты (рис. 3E). Продвигайтесь через мягкие ткани с помощью оверхолтовых зажимов для тупого рассечения, чтобы получить доступ к брюшной аорте (рис. 3F, G).
- Проведите туннель брюшной аорты на самом краниальном конце с помощью тупых оверхолтовых зажимов (Рисунок 3H-L) и перевяжите аорту с помощью силиконовой петли для сосуда (Рисунок 3M-T).
- Наложите подходящий микрососудистый зажим для аневризмы с помощью силиконовой петли, чтобы слегка вывих аорты вентрально, и направьте микрососудистый зажим аневризмы вдоль силиконовой петли, чтобы гарантировать изолированное пережатие аорты (Рисунок 3U). В зависимости от вопроса исследования, микрососудистый зажим может быть снова освобожден.
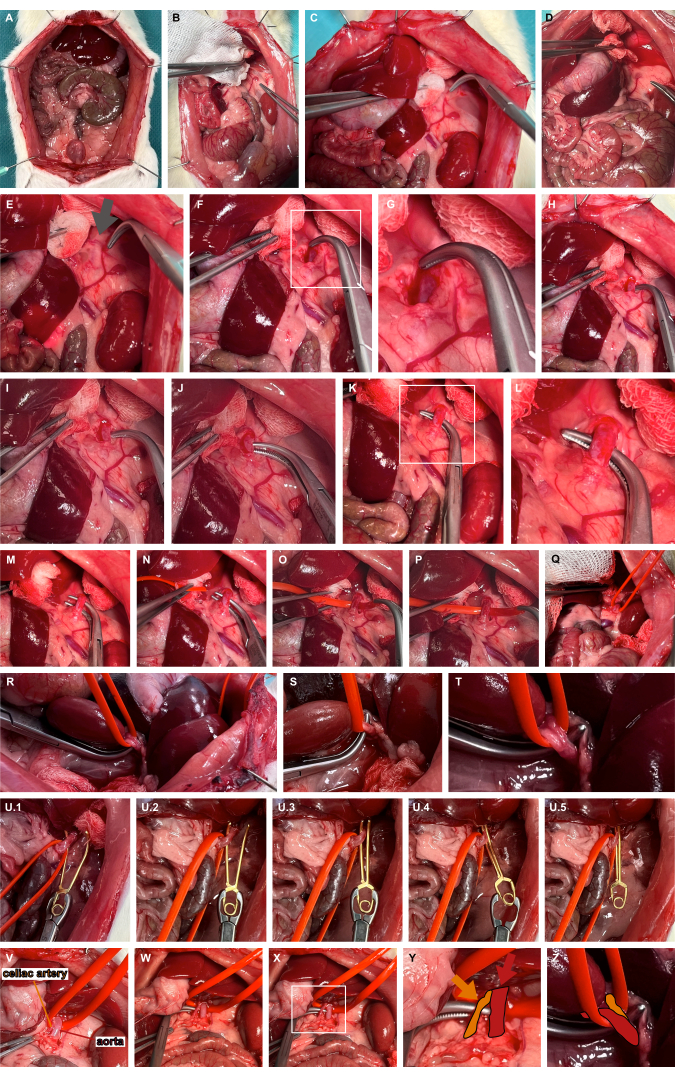
Рисунок 3: Подготовка и пережатие брюшной аорты. (А) Обнажение висцеральных органов. (В-Е) Левая медиализация верхних органов брюшной полости с использованием инструментов атравматичной подготовки для получения доступа к левой надпочечниковой артерии. (Ф,Г) Тупое расслоение медиальной части левой надпочечниковой артерии в месте пульсации (серая стрелка) с целью доступа к брюшной аорте. (Н-Л) Туннелирование брюшной аорты с помощью тупых оверхолтовых зажимов. (М-Т) Перевязка аорты с помощью петли для силиконового сосуда. (U) Наложение микрососудистого зажима для снятия аневризмы с использованием силиконовой петли в качестве руководства. (В-Я) Визуализация чревной артерии (оранжевый) по отношению к аорте (красный) и петли силиконового сосуда. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
5. Препарирование и пережатие надпеченочной брюшной вены при венозном застое
- Мобилизуйте печень вправо с помощью атравматичных инструментов для подготовки, резко рассеките печеночные связки, а затем сделайте печень латерализацией (рисунок 4А-В).
- Откройте запеченочное пространство на левой оболочке диафрагмы с помощью тупых оверхолтовых зажимов (рисунок 4D-G).
- Проложите туннель в вдавленной вене с помощью тупых накладных зажимов (Рисунок 4H-K) и перевяжите кавальную вену с помощью петель для силиконовых сосудов (Рисунок 4L-O).
- Наложите подходящий микрососудистый зажим для аневризмы с помощью силиконовой петли, чтобы слегка вывих венцовой вены вентрально и направьте микрососудистый зажим аневризмы вдоль силиконовой петли, чтобы гарантировать изолированное пережатие кавальной вены (Рисунок 4R).
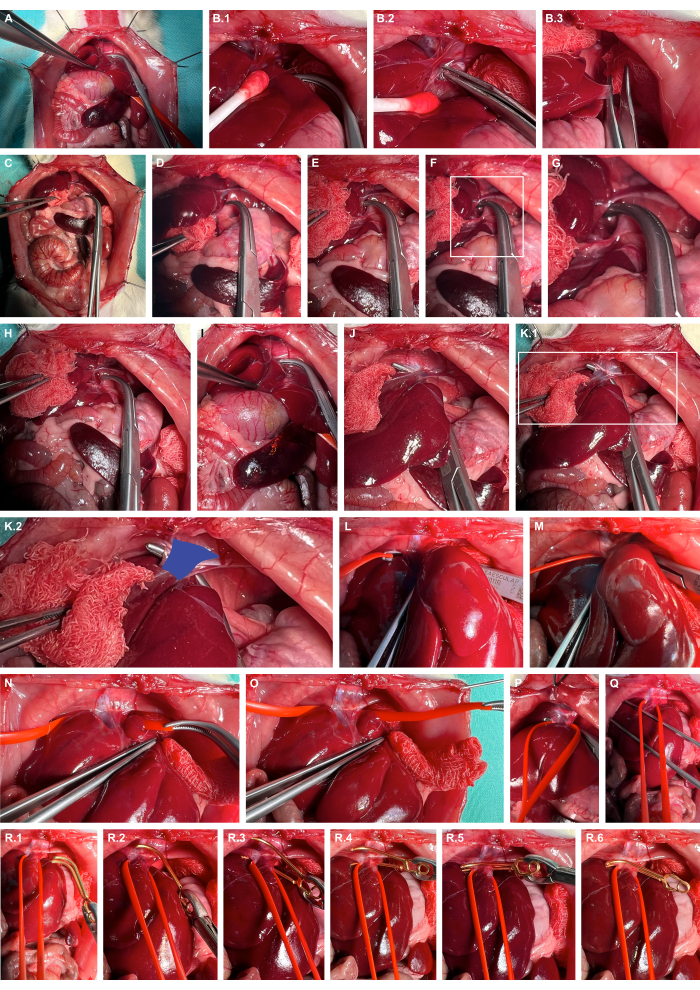
Рисунок 4: Подготовка и пережатие надпеченочной брюшной вены. (А) Обнажение висцеральных органов черепа. (Б) Тканепротекторная мобилизация печени и резкое рассечение связок печени с использованием инструментов атравматического препарирования. (В) Латерализация печени. (Д-Г) Раскрытие ретропеченочного пространства и подготовка к левому голенищу диафрагмы. (Х-К) Туннелирование кавальной вены (синий) с помощью тупых оверхолтовых зажимов. (Л-О) Перевязывание кавальной вены с помощью силиконовых петель для сосудов. (,К) Напряжение для предварительного ограничения кавального кровотока. (R) Наложение микрососудистого зажима для снятия аневризмы с использованием силиконовой петли в качестве руководства. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
6. Пережатие брюшной аорты и надпеченочной брюшной вваловой вены при сочетанной мальперфузии
- Выполняйте описанные выше действия до тех пор, пока аорта и половая вена не будут перевязаны петлями для силиконовых сосудов. Заблаговременно наложите микрососудистый зажим аневризмы на оба сосуда, снова используя силиконовую петлю для наведения. Рекомендуется сначала зажать аорту и свести к минимуму время, необходимое для последующего кавального пережатия, до нескольких секунд.
ПРИМЕЧАНИЕ: В зависимости от желаемого сценария и цели исследования, мальперфузия может быть продолжена или высвобождена через определенный промежуток времени, и животные могут быть либо усыплены путем острой кардиэктомии (в соответствии с институционально утвержденными протоколами) для случаев, не связанных с выживанием, либо получить ступенчатое закрытие брюшной полости с использованием хирургических швов в случае запланированных последующих наблюдений и экспериментов по выживанию. Для настоящего исследования животные были усыплены.
Результаты
Этот протокол был выполнен на 10 самцах крыс (средний вес 403 г ± 26 г) в условиях, не связанных с выживанием. Частота успеха определялась выживаемостью в течение 20 мин после артериального пережатия, венозного пережатия и комбинированного пережатия в течение 5 мин с 10 мин реперфузии, каждая из которых составляла 100%. Средняя продолжительность препарата от разреза кожи до наложения обоих сосудов силиконовыми петлями составила 11 мин 45 с ± 3 мин 23 с.
Для валидации 4 различных состояний мальперфузии были измерены индексные параметры оксигенации (StO2) и перфузии (NIR) с помощью гиперспектральной визуализации (HSI) в 5 висцеральных органах (рис. 5).
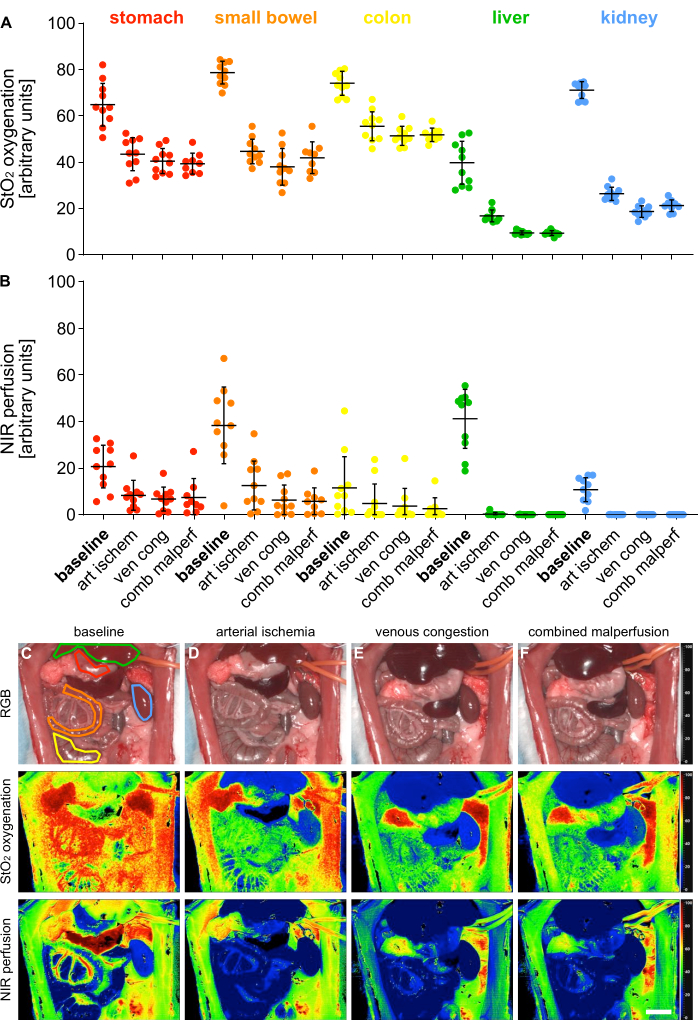
Рисунок 5: Валидация модели мальперфузии. (A,B) Количественная оценка значений оксигенации HSI и перфузии в четырех различных состояниях перфузии и пяти различных висцеральных органах с n = 10 животными. (К-Ж) RGB и цветной индексные изображения записей HSI, содержащих висцеральные органы в 4 различных состояниях перфузии. Полосы погрешностей указывают на стандартное отклонение. Масштабная линейка изображает 5 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.
Значения были представлены в условных единицах и показали достоверное снижение мальперфузионных состояний по сравнению с физиологическим состоянием органа (табл. 1). Гиперспектральные результаты соответствовали недавним публикациям, указывающим на то, что жизнеспособность и перфузия ткани могут быть оценены с использованием органоспецифических пороговых значений HSI StO2, которые совпали со значениями, наблюдаемыми в этом исследовании14,15. В частности, для желудка они составили 64,1% (±9,4%) для физиологической перфузии, 43,1% (±7,4%) для артериальной ишемии, 40,5% (±5,4%) для венозного застоя и 39,3% (±4,5%) для комбинированной мальперфузии.
Поскольку это были эксперименты, не связанные с выживанием, нет экспериментальных данных о долгосрочных результатах жизни животных. Тем не менее, другие исследования сообщают о 100% и 57% выживаемости в течение 24 часов у крыс, которые перенесли 30 и 60 минут пережатия верхней брыжеечной артерии16,17 и успешно коррелируют это с сывороточными уровнями белка теплового шока 70. Следовательно, это может быть возможным методом оценки результатов в будущих исследованиях выживаемости в соответствии с различным временем зажима.
| параметр | орган | базис | Артериальная ишемия | венозный застой | комбинированная мальперфузия |
| СтО2 | желудок | 64,1% (±9,4%) | 43,1% (±7,4%) | 40,5% (±5,4%) | 39,3% (±4,5%) |
| тонкой кишки | 78,4% (±5,1%) | 44,8% (±5,5%) | 38,0% (±7,9%) | 41,9% (±6,9%) | |
| двоеточие | 74.6% (±5.0%) | 56,0% (±6,3%) | 51,3% (±4,1%) | 51,8% (±2,9%) | |
| печень | 39,5% (±9,7%) | 16,9% (±2,6%) | 9,5% (±0,8%) | 9,3% (±1,1%) | |
| почка | 71,0% (±3,8%) | 26,3% (±3,0%) | 18,6% (±2,5%) | 21,2% (±2,6%) | |
| Ближний ИК-диапазон | желудок | 20,0% (±9,3%) | 8,3% (±6,7%) | 6,8% (±5,1%) | 7,5% (±8,1%) |
| тонкой кишки | 38,6% (±17,4%) | 12.9% (±11.0%) | 6,3% (±6,5%) | 5,7% (±5,9%) | |
| двоеточие | 12,6% (±13,7%) | 5,3% (±8,7%) | 3,8% (±7,5%) | 2,6% (±4,7%) | |
| печень | 40,4% (±13,1%) | 0,3% (±0,7%) | 0,0% (±0,1%) | 0.0% (±0.0%) | |
| почка | 10,4% (±5,2%) | 0.0% (±0.0%) | 0,0% (±0,1%) | 0.0% (±0.0%) |
Таблица 1: Параметры тканей. Значения оксигенации HISStO2 и перфузии NIR в произвольных единицах в 5 висцеральных органах и 4 различных состояниях перфузии.
Обсуждение
В то время как окклюзионная болезнь периферических артерий (PAOD), как наиболее заметный представитель тканевых мальперфузионных состояний, уже имеет распространенность около 7%, затрагивая примерно 8,5 миллионов взрослых только в Соединенных Штатах18, тканевая мальперфузия в целом является актуальным патомеханизмом в большинстве хирургических и медицинских состояний. Следовательно, подходящие и воспроизводимые животные модели абсолютно необходимы для решения новых исследовательских вопросов в этой области.
Три сосудистые динамические ситуации, которые требуют отдельного исследования, — это артериальная ишемия, венозный застой и комбинированная мальперфузия. Индуцируя изолированную артериальную ишемию, ученые могут точно очертить временное и пространственное развитие гипоксии тканей, исследуя молекулярные каскады, участвующие в ишемии-реперфузионном повреждении, клеточном апоптозе и воспалительных реакциях. Ставя под угрозу венозный дренаж, часто упускаемый из виду аспект сосудистой патологии, ученые могут исследовать взаимодействие между артериальным притоком и несоответствиями венозного оттока, проливая свет на патофизиологию венозного тромбоза, связанного с застойными явлениями отека тканей и микроциркуляторной дисфункции. При комбинации обеих этих патологических ситуаций можно исследовать дис-синергетическую среду комбинированной мальперфузии, отражая сложную патофизиологию, встречающуюся при клинических синдромах, таких как острая мезентериальная ишемия и ишемический колит.
Помимо выяснения фундаментальных патофизиологических механизмов, способность индуцировать ишемию висцеральных артерий, венозный застой и комбинированную мальперфузию у крыс служит незаменимой платформой для оценки эффективности фармакологических вмешательств, хирургических методов, новых терапевтических стратегий и инновационных методов визуализации, особенно таких как HSI 14,19,20,21,22. Таким образом, данная модель является ключевым компонентом в обеспечении требуемой достоверной информации о биологических тканях, необходимой для использования всего потенциала HSI в оценке тканей и идентификации состояний перфузии. Используя эту экспериментальную установку, исследователи могут ускорить перевод доклинических результатов в клинически жизнеспособные стратегии, что в конечном итоге снижает заболеваемость и смертность, связанные с различными сосудистыми и перфузионными расстройствами.
Например, исследователи могут использовать эту модель для изучения эффективности фармакологических агентов, нацеленных на пути ишемии-реперфузионного повреждения, таких как антиоксиданты, противовоспалительные агенты и сосудорасширяющие средства, тем самым определяя их потенциальную полезность вклинической практике. Кроме того, эта модель облегчает оценку новых хирургических подходов, таких как методы реваскуляризации брыжейки и венозные декомпрессионные процедуры, предоставляя бесценную информацию об их осуществимости, безопасности и долгосрочной эффективности25,26.
Кроме того, эта экспериментальная структура позволяет исследователям исследовать сложное взаимодействие между сосудистой дисфункцией и системными сопутствующими заболеваниями, такими как диабет, гипертония и атеросклероз, тем самым иллюстрируя сложную сеть взаимосвязанных патофизиологических путей, организующих прогрессирование сосудистых заболеваний.
Несмотря на то, что существует несколько публикаций по селективной мальперфузии отдельных органов, таких как печень 29,30,31 или почка, у крыс 32,33, существует нехватка научной литературы, посвященной мальперфузии полных внутренних органов у крыс, и явно отсутствует методический протокол. Таким образом, именно таково утверждение данной рукописи. К ограничениям представленной методики в основном относятся инвазивность процедуры и, в зависимости от длительности мальперфузии, последовательный тромбоз органа и дисфункция, возможно, приводящая к послеоперационным страданиям из-за полиорганной недостаточности или абдоминального компартмент-синдрома 34,35,36. Тщательное планирование и дизайн, в зависимости от исследовательского вопроса, могут помочь сбалансировать необходимую продолжительность мальперфузии и ее патофизиологические последствия.
При устранении распространенных проблем, возникающих во время процедуры, следует обратить внимание на следующие моменты и рекомендации: (1) Обеспечьте тщательную подготовку оборудования и лекарств заранее, чтобы свести к минимуму перерывы во время процедуры; (2) Тщательно выполняйте контроль гемостаза, тщательно подготавливая и рассекая аваскулярные плоскости. Рассмотрите возможность использования биполярных гемостатических щипцов для электрогемостаза, если они доступны; (3) Свести к минимуму травматизацию тканей с помощью нетравматичных инструментов, таких как увлажненные ватные палочки или увлажненный хирургический компресс с щипцами при контакте с паренхимой печени; (4) Примерно у 20% животных наблюдалось диффузное кровотечение из поверхностной паренхимы печени из-за деликатных тканей. Тем не менее, кровотечение останавливалось во всех случаях при легком сжатии и терпении. Эти рекомендации направлены на повышение эффективности процедур и минимизацию осложнений во время индукции мальперфузии на крысовых моделях.
При резекции мечевидного пузыря для улучшения доступа к полой вене убедитесь, что брюшина дорсально до перехода между мечевидным и грудным колесами остается нетронутой на протяжении нескольких миллиметров. Место резекции мечевидного кость будет твердым и острым, что может привести к травме поверхностной паренхимы печени. Поэтому рекомендуется каудально мобилизовать загрудинную брюшину с помощью щипцов и эффективно обернуть вокруг культи кости, охватывая ее и поддерживая гемостаз. Крючки для подготовки к операции должны быть прошиты через краниальную вентральную брюшную стенку с натяжением черепа таким образом, чтобы брюшинный охват мечевидной культи оставался на месте.
При рассечении серповидной связки следует соблюдать осторожность, чтобы случайно не нанести ятрогенное повреждение печеночной вены, так как это может привести к летальному исходу для животного. Из-за высокого риска кровотечения во время подготовки сосудов рекомендуется проводить большую часть хирургической подготовки путем нанесения тупых оверхолтовых зажимов, а не с использованием острых инструментов для препарирования. Кроме того, петли для силиконовых сосудов должны быть увлажнены перед использованием, чтобы уменьшить поверхностное трение и свести к минимуму риск травмирования тканей.
При наложении микрососудистого зажима аневризмы крайне важно визуализировать точную анатомию сосудов. Например, чревная артерия берет начало очень краниально от брюшной аорты. Если требуется целиакическая окклюзия, например, для исследования печеночной мальперфузии, чревная артерия должна быть визуализирована относительно аорты и петли силиконового сосуда. Это гарантирует, что чревная артерия будет включена в зажатую сосудистую ткань (рисунок 2V-Z). Был один случай, когда зажим был первоначально случайно помещен каудально к чревной артерии. Тем не менее, это было быстро распознано из-за отсутствующего падения показателей печени StO2, и была успешно проведена надлежащая рефиксация.
Наиболее опасным этапом подготовки является туннелирование кавальной вены. Этот шаг требует осторожных движений и терпения, а оверхолтовые зажимы следует растягивать только в том случае, если нет уверенности в отсутствии контакта с полой веной. Судить об этом может быть сложно, так как при незначительном сжатии вантовая вена будет выглядеть как тонкая аваскулярная соединительная ткань, в результате чего содержащаяся в ней кровь исчезнет в обоих направлениях. Также существует риск случайного открытия плевры и создания пневмоторакса при слишком краниальном туннелировании кавальной вены. Это может быть серьезным и опасным для жизни осложнением, тем более что животное спонтанно дышит, и никакие инвазивные респираторные меры не могут быть предприняты. Было признано полезным слегка втянуть инструменты для подготовки и продолжать более каудально, чтобы избежать этого осложнения. В случаях гемодинамически значимого и видимого пневмоторакса с выпячиванием печеночной диафрагмы в качестве стратегии спасения может быть рекомендована трансдиафрагмальная однократная пункция и аспирация захваченного воздуха с помощью иглы 30 G и небольшого шприца. Эта методика была успешно применена на одном животном для его интраоперационного сохранения.
Наконец, следует проявлять особую осторожность при наложении микрососудистых зажимов, чтобы избежать включения окружающей соединительной ткани, что может привести к недостаточной окклюзии желаемого сосуда.
Несмотря на то, что этот протокол задуман как пошаговое руководство по глобальной висцеральной мальперфузии, место пережатия может быть скорректировано в соответствии с конкретным исследовательским вопросом благодаря обширной сосудистой подготовке и мобилизации, изображенной на рисунке 1T-V. Поэтому выбранная мальперфузия групп органов или отдельных органов также является вариантом при выборе места пережатия дальше дистально по сосудистому дереву, например, выборочное пережатие чревного ствола при ишемии печени. Предлагая подробную и воспроизводимую методологию, этот протокол способствует стандартизированному подходу к контролируемой обратимой артериальной ишемии, венозному застою и комбинированной мальперфузии в моделях крыс, что приводит к повышению надежности данных, надежности, независимости исследователей и сопоставимости будущих исследований на животных. Следовательно, он представляет собой незаменимый инструмент в арсенале биомедицинских исследований, предлагающий понимание сложного взаимодействия между сосудистыми нарушениями, повреждением тканей и терапевтическими вмешательствами. Используя универсальность этой экспериментальной установки, исследователи могут исследовать тайны сосудистой патофизиологии, открывая новые рубежи в трансляционной медицине и, в конечном итоге, улучшая результаты лечения пациентов в области здоровья сосудов.
Раскрытие информации
Никакой.
Благодарности
Авторы выражают благодарность сервису хранения данных SDS@hd при поддержке Министерства науки, исследований и искусств земли Баден-Вюртемберг (MWK) и Немецкого научно-исследовательского общества (DFG) в рамках грантов INST 35/1314-1 FUGG и INST 35/1503-1 FUGG. Кроме того, авторы выражают благодарность за поддержку со стороны NCT (Национальный центр опухолевых заболеваний в Гейдельберге, Германия) в рамках структурированной программы постдоков и программы хирургической онкологии. Мы также отмечаем поддержку через государственные фонды, утвержденные Ландтаг Баден-Вюртемберг для Инновационного кампусного альянса Health + Life Science Alliance Heidelberg Mannheim в рамках структурированной программы постдоков для Александра Штюдье-Фишера: Искусственный интеллект в здравоохранении (AIH) - сотрудничество DKFZ, EMBL, Гейдельбергского университета, Университетской клиники Гейдельберга, Университетской клиники Мангейма, Центрального института психического здоровья, и Институт медицинских исследований Макса Планка. Кроме того, мы выражаем признательность за поддержку со стороны Института рака Гектора DKFZ при Университетском медицинском центре Мангейма. Что касается платы за публикацию, мы выражаем признательность за финансовую поддержку со стороны Deutsche Forschungsgemeinschaft в рамках программы финансирования «Open Access Publikationskosten», а также от Гейдельбергского университета.
Материалы
| Name | Company | Catalog Number | Comments |
| Atraumatic preparation forceps | Aesculap | FB395R | DE BAKEY ATRAUMATA atraumatic forceps, straight |
| Blunt overholt clamp | Aesculap | BJ012R | BABY-MIXTER preparation and ligature clamp, bent, 180 mm |
| Cannula | BD (Beckton, Dickinson) | 301300 | BD Microlance 3 cannula 20 G |
| Fixation rods | legefirm | 500343896 | tuning forks used as y-shaped metal fixation rods |
| Heating pad | Royal Gardineer | IP67 | Royal Gardineer Heating Pad Size S, 20 Watt |
| Plastic perfusor tube | M. Schilling GmbH | S702NC150 | connecting tube COEX 150 cm |
| Preparation scissors | Aesculap | BC177R | JAMESON preparation scissors, bent, fine model, blunt/blunt, 150 mm (6") |
| Silicone vessel loop tie | SERAG WIESSNER | SL26 | silicone vessel loop tie 2,5 mm red |
| Spraque Dawley rat | Janvier Labs | RN-SD-M | Spraque Dawley rat |
| Steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
| Yasargil clip | Aesculap | FE795K | YASARGIL Aneurysm Clip System Phynox Temporary (Standard) Clip |
| Yasargil clip applicator | Aesculap | FE558K | YASARGIL Aneurysm Clip Applicator Phynox (Standard) |
Ссылки
- Carden, D. L., Granger, D. N. Pathophysiology of ischemia-reperfusion injury. J Pathol. 190 (3), 255-266 (2000).
- Balkwill, F., Mantovani, A. Inflammation and cancer: Back to Virchow. Lancet. 357 (9255), 539-545 (2001).
- Cruz, R. J., Garrido, A. G., Ribeiro, C. M., Harada, T., Rocha-E-Silva, M. Regional blood flow distribution and oxygen metabolism during mesenteric ischemia and congestion. J Surg Res. 161 (1), 54-61 (2010).
- Leng, G. C., Davis, M., Baker, D. Bypass surgery for chronic lower limb ischemia. Cochrane Database Syst Rev. 3, Cd002000 (2000).
- Droc, I., Calinescu, F. B., Droc, G., Blaj, C., Dammrau, R. Aortic stenting. Minim Invasive Ther Allied Technol. 24 (5), 296-304 (2015).
- Le Gall, A., et al. Veno-arterial-ecmo in the intensive care unit: From technical aspects to clinical practice. Anaesth Crit Care Pain Med. 37 (3), 259-268 (2018).
- Napp, L. C., Kühn, C., Bauersachs, J. ECMO in cardiac arrest and cardiogenic. Herz. 42 (1), 27-44 (2017).
- Sousa Da Silva, R. X., Weber, A., Dutkowski, P., Clavien, P. A. Machine perfusion in liver transplantation. Hepatology. 76 (5), 1531-1549 (2022).
- Sen Gupta, A. Bio-inspired nanomedicine strategies for artificial blood components. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 9 (6), 1464 (2017).
- Lu, D., et al. Intramuscular microvascular flow sensing for flap monitoring in a porcine model of arterial and venous occlusion. J Reconstr Microsurg. 39 (3), 231-237 (2023).
- Nguyen, G. K., et al. Novel biomarkers of arterial and venous ischemia in microvascular flaps. PLoS One. 8 (8), e71628 (2013).
- Redlin, M., et al. How near-infrared spectroscopy differentiates between lower body ischemia due to arterial occlusion versus venous outflow obstruction. Ann Thorac Surg. 91 (4), 1274-1276 (2011).
- Studier-Fischer, A., et al. Endotracheal intubation via tracheotomy and subsequent thoracotomy in rats for non-survival applications. J Vis Exp. (205), e66684 (2024).
- Nickel, F., et al. Optimization of anastomotic technique and gastric conduit perfusion with hyperspectral imaging and machine learning in an experimental model for minimally invasive esophagectomy. Eur J Surg Oncol. , 106908 (2023).
- Barberio, M., et al. Quantitative fluorescence angiography versus hyperspectral imaging to assess bowel ischemia: A comparative study in enhanced reality. Surgery. 168 (1), 178-184 (2020).
- Doukas, P., et al. Onset of adverse abdominal events due to intestinal ischemia-reperfusion injury after aortic cross-clamping is associated with elevated hsp70 serum levels in the early postoperative phase. Int J Mol Sci. 23 (23), 15063 (2022).
- Mine, Y., et al. Heat shock protein 70 messenger RNA in rat leukocytes elevates after severe intestinal ischemia-reperfusion. J Surg Res. 242, 342-348 (2019).
- Criqui, M. H., et al. Lower extremity peripheral artery disease: Contemporary epidemiology, management gaps, and future directions: A scientific statement from the American Heart Association. Circulation. 144 (9), e171-e191 (2021).
- Seidlitz, S., et al. Robust deep learning-based semantic organ segmentation in hyperspectral images. Med Image Anal. 80, 102488 (2022).
- Studier-Fischer, A., et al. Icg-augmented hyperspectral imaging for visualization of intestinal perfusion compared to conventional icg fluorescence imaging: An experimental study. Int J Surg. 109 (12), 3883-3895 (2023).
- Studier-Fischer, A., et al. Heiporspectral - the heidelberg porcine hyperspectral imaging dataset of 20 physiological organs. Scientific Data. 10 (1), 414 (2023).
- Studier-Fischer, A., et al. Spectral organ fingerprints for machine learning-based intraoperative tissue classification with hyperspectral imaging in a porcine model. Sci Rep. 12 (1), 11028 (2022).
- Mallick, I. H., Yang, W., Winslet, M. C., Seifalian, A. M. Ischemia-reperfusion injury of the intestine and protective strategies against injury. Dig Dis Sci. 49 (9), 1359-1377 (2004).
- Malekinejad, Z., et al. Prazosin treatment protects brain and heart by diminishing oxidative stress and apoptotic pathways after renal ischemia-reperfusion. Drug Res (Stuttg). 72 (6), 336-342 (2022).
- Feldman, Z. M., et al. Inferior mesenteric artery revascularization can supplement salvage of mesenteric ischemia. J Vasc Surg Cases Innov Tech. 9 (3), 101041 (2023).
- Munley, J. A., et al. Chronic mesenteric ischemia-induced intestinal dysbiosis resolved after revascularization. J Vasc Surg Cases Innov Tech. 9 (2), 101084 (2023).
- Lejay, A., et al. Ischemia reperfusion injury, ischemic conditioning and diabetes mellitus. J Mol Cell Cardiol. 91, 11-22 (2016).
- Huang, D., et al. Macrovascular complications in patients with diabetes and prediabetes. Biomed Res Int. 2017, 7839101 (2017).
- Liu, A., et al. Hmgb1 in the ischemic and non-ischemic liver after selective warm ischemia/reperfusion in rats. Histochem Cell Biol. 135 (5), 443-452 (2011).
- Koc, S., Dogan, H. O., Karatas, O., Erdogan, M. M., Polat, V. Mitochondrial homeostasis and mast cells in experimental hepatic ischemia-reperfusion injury of rats. Turk J Gastroenterol. 33 (9), 777-784 (2022).
- Chu, M. J., Vather, R., Hickey, A. J., Phillips, A. R., Bartlett, A. S. Impact of ischaemic preconditioning on experimental steatotic livers following hepatic ischemia-reperfusion injury: A systematic review. HPB (Oxford). 17 (1), 1-10 (2015).
- Chang, M. W., et al. Sitagliptin protects rat kidneys from acute ischemia-reperfusion injury via upregulation of GLP-1 and GLP-1 receptors. Acta Pharmacol Sin. 36 (1), 119-130 (2015).
- Boys, J. A., Toledo, A. H., Anaya-Prado, R., Lopez-Neblina, F., Toledo-Pereyra, L. H. Effects of dantrolene on ischemia-reperfusion injury in animal models: A review of outcomes in heart, brain, liver, and kidney. J. Investig Med. 58 (7), 875-882 (2010).
- Orihashi, K. Mesenteric ischemia in acute aortic dissection. Surg Today. 46 (5), 509-516 (2016).
- Byard, R. W. Acute mesenteric ischemia and unexpected death. J Forensic Leg Med. 19 (4), 185-190 (2012).
- Łagosz, P., Sokolski, M., Biegus, J., Tycinska, A., Zymlinski, R. Elevated intra-abdominal pressure: A review of current knowledge. World J Clin Cases. 10 (10), 3005-3013 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены