Method Article
Ischemia arteriosa viscerale reversibile controllata, congestione venosa e malperfusione combinata tramite laparotomia della linea mediana nei ratti
In questo articolo
Riepilogo
Questo articolo introduce una procedura standardizzata per la malperfusione controllata e reversibile degli organi viscerali in modelli di ratto. L'obiettivo è quello di indurre questi stati di malperfusione con un alto grado di certezza metodologica e controllo, mantenendo la semplicità tecnica e la resilienza agli errori.
Abstract
Oltre alla sepsi e alla malignità, la malperfusione è la terza causa principale di degradazione dei tessuti e un importante meccanismo patologico per varie condizioni mediche e chirurgiche. Nonostante gli sviluppi significativi come la chirurgia di bypass, le procedure endovascolari, l'ossigenazione extracorporea a membrana e i sostituti artificiali del sangue, la malperfusione tissutale, in particolare degli organi viscerali, rimane un problema urgente nella cura dei pazienti. La domanda di ulteriori ricerche sui processi biomedici e sui possibili interventi è elevata. Modelli biologici validi sono della massima importanza per consentire questo tipo di ricerca. A causa degli aspetti multifattoriali della ricerca sulla perfusione tissutale, che includono non solo la biologia cellulare ma anche la microanatomia vascolare e la reologia, un modello appropriato richiede un grado di complessità biologica che solo un modello animale può fornire, rendendo i roditori il modello più ovvio di scelta. La malperfusione tissutale può essere differenziata in tre condizioni distinte: (1) ischemia arteriosa isolata, (2) congestione venosa isolata e (3) malperfusione combinata. Questo articolo presenta un protocollo dettagliato passo dopo passo per l'induzione controllata e reversibile di questi tre tipi di malperfusione viscerale tramite laparotomia della linea mediana e clampaggio dell'aorta addominale e della vena cavale nei ratti, sottolineando l'importanza di una metodologia chirurgica precisa per garantire risultati uniformi e affidabili. I principali esempi di possibili applicazioni di questo modello includono lo sviluppo e la convalida di modalità di imaging intraoperatorio innovative, come l'imaging iperspettrale (HSI), per visualizzare e differenziare oggettivamente la malperfusione di organi gastrointestinali, ginecologici e urologici.
Introduzione
Sebbene le implicazioni della deprivazione di perfusione tissutale sotto forma di condizioni di malperfusione tissutale locale o sistemica siano state a lungo riconosciute, persistono come una delle cause primarie di morbilità e mortalità sia negli Stati Uniti chein Europa. Queste condizioni di malperfusione sono la terza causa principale di degradazione dei tessuti, dopo la malignità e l'infiammazione settica, ma hanno uno spettro di origini molto più ampio rispetto alle ultime due2.
Questo spettro spazia da meccanismi locali come la fibrillazione atriale con occlusione tromboembolica, vasocostrizione e dissezione iatrogena o traumatica, a meccanismi sistemici come insufficienza cardiaca o shock, sepsi, ipovolemia e fenomeni di furto. Questi diversi meccanismi sono alla base di una varietà di condizioni mediche e chirurgiche. La significativa morbilità e mortalità associate a queste condizioni hanno indirizzato l'attenzione medica verso le procedure per ripristinare il flusso sanguigno nei tessuti malfusi al fine di prevenire la necrosi e ripristinare la funzione degli organi nel corso dei decenni3.
Questo sforzo di ricerca ha portato a una varietà di soluzioni farmaceutiche, mediche e chirurgiche per ripristinare la perfusione fisiologica degli organi, tra cui i progressi nella chirurgia di bypass4, nelle procedure endovascolari5, nell'ossigenazione extracorporea a membrana 6,7, nella perfusione delle macchine d'organo durante il trapianto8 e nei sostituti del sangue artificiale9.
Eppure, nonostante questi sviluppi significativi, la malperfusione, in particolare degli organi viscerali, rimane un problema urgente nella cura dei pazienti e la domanda di ulteriori ricerche sui processi biomedici e sulle strategie di salvataggio è elevata. Modelli biologici validi sono della massima importanza per consentire questo tipo di ricerca. A causa degli aspetti multifattoriali della ricerca sulla perfusione tissutale, che includono non solo la biologia cellulare ma anche la microanatomia vascolare e la reologia, un modello appropriato richiede un grado di complessità biologica che solo un organismo modello completo può fornire, rendendo i roditori il modello più ovvio di scelta.
La malperfusione tissutale può essere differenziata in tre condizioni distinte: ischemia arteriosa isolata, congestione venosa isolata e malperfusione combinata10. Gli scenari clinicamente rilevanti per queste condizioni includono (1) Ischemia arteriosa: fibrillazione atriale con occlusione tromboembolica, emboli settici, vasocostrizione, dissezione o clamping vascolare iatrogeno o traumatico, insufficienza cardiaca o shock, dissezione aortica, sepsi e ipovolemia, ostruzione arteriosa estrema dovuta a costrizione esterna, embolia arteriosa polmonare, malattie occlusive vascolari arteriose croniche o fenomeni di furto; (2) Congestione venosa: dissezione o clamping vascolare iatrogeno o traumatico, insufficienza cardiaca, fibrosi o cirrosi epatica, ostruzione venosa dovuta a costrizione esterna, trombosi venosa, insufficienza venosa e sindrome di Budd-Chiari; (3) Malperfusione combinata: combinazioni delle condizioni di cui sopra e stadi avanzati delle suddette condizioni, come la congestione venosa secondaria dovuta a fibrosi indotta da ischemia o l'ischemia arteriosa secondaria dovuta a ritenzione indotta da congestione, nonché condizioni specifiche degli organi come l'infiammazione ischemica (ad esempio, colite ischemica)11,12.
Questo articolo, quindi, mira a fornire un modello passo-passo per indurre ischemia arteriosa viscerale controllata e reversibile, congestione venosa e malperfusione combinata tramite laparotomia della linea mediana nei ratti per applicazioni sia di sopravvivenza che non di sopravvivenza, come illustrato nella Figura 1. Il modello sperimentale offre un ambiente controllato per lo studio delle dinamiche multiformi dell'ischemia arteriosa, della congestione venosa e delle loro sequele combinate, emulando scenari clinicamente rilevanti incontrati in varie condizioni.
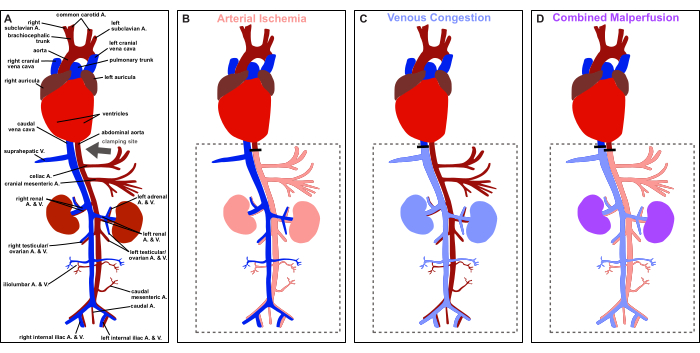
Figura 1: Panoramica del protocollo. Rappresentazione schematica dell'anatomia vascolare del ratto e rappresentazione del sito di serraggio (freccia grigia). (A) Perfusione fisiologica. (B) Ischemia arteriosa. (C) congestione venosa. (D) Malperfusione combinata. Clicca qui per visualizzare una versione più grande di questa figura.
Protocollo
Tutte le attività animali qui descritte sono state condotte in strutture accreditate e approvate dal Comitato Istituzionale per la Cura e l'Uso degli Animali (IACUC) del Consiglio Regionale del Baden-Württemberg a Karlsruhe, Germania (35-9185.81/G-62/23). Gli animali da esperimento sono stati gestiti secondo gli standard istituzionali, le leggi tedesche per l'uso e la cura degli animali, le direttive del Consiglio della Comunità Europea (2010/63/UE) e le linee guida ARRIVE. I ratti maschi Sprague Dawley con un peso dell'ordine di 400 grammi sono stati utilizzati dopo essere stati acclimatati per una settimana. I dettagli dei reagenti e delle attrezzature utilizzate in questo studio sono elencati nella tabella dei materiali.
1. Anestesia e analgesia
- Anestetizzare il ratto con il farmaco seguendo i protocolli istituzionali. L'isoflurano è raccomandato per l'induzione della sedazione seguita da un'iniezione i.p. di 100 mg/kg di ketamina e 4 mg/kg di xilazina di peso corporeo. Un'ulteriore analgesia può essere ottenuta con un'iniezione s.c. di 5 mg/kg di carprofene di peso corporeo. Per i dettagli, si prega di fare riferimento a Studier-Fischer et al.13.
- Applicare un unguento oftalmico sugli occhi per prevenire la secchezza.
- Garantire una corretta profondità analgesica utilizzando il test di pizzicamento delle dita dei piedi con pinza chirurgica.
- Rivalutare e regolare regolarmente la profondità dell'anestesia durante l'intervento chirurgico.
2. Preparazione della procedura
- Preparare il tavolo di lavaggio con tutti i materiali e gli strumenti necessari, inclusi i morsetti microvascolari sganciabili e l'applicatore (Figura 2A-C), il morsetto smussato overholt, la forbice per la preparazione fine e le pinze.
- Preparare i ganci di preparazione chirurgica piegando le cannule con un angolo di 135° a 1 cm rispetto alla punta e collegarle ai tubi di perfusione in plastica tramite Luer-lock, pronti per applicare la tensione utilizzando una pinza chirurgica per zanzare (Figura 2D, E).
- Preparare un apparecchio chirurgico per l'esposizione ai roditori, comprese le aste di fissaggio a forma di Y e un termoforo, come specificato in Studier-Fischer et al.13.
- Assicurarsi che la corretta ossigenazione sia ottenuta attraverso l'inalazione di ossigeno al 100% utilizzando una maschera facciale neonatale (Figura 2F).
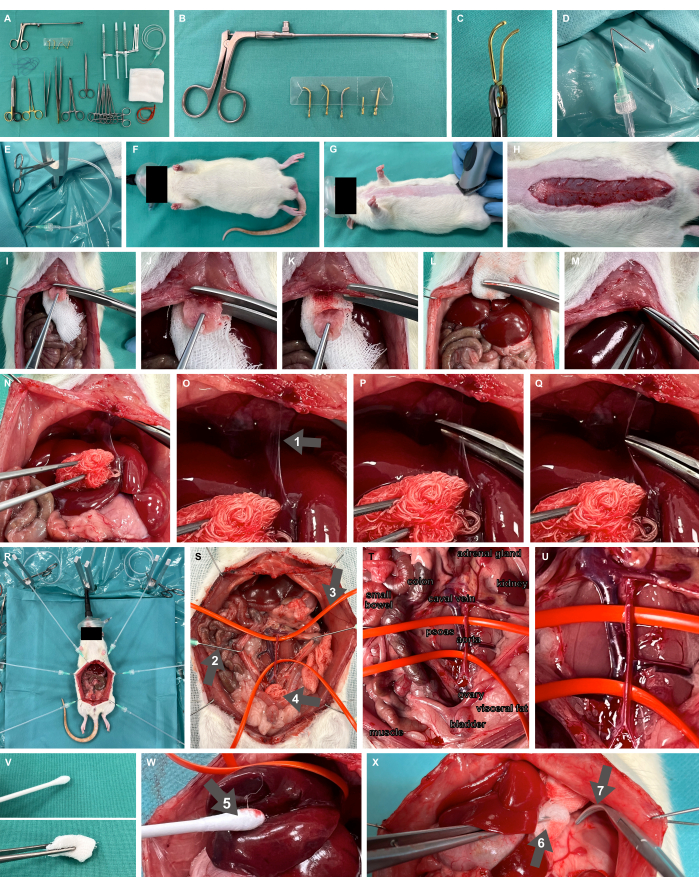
Figura 2: Allestimento sperimentale e animale. (A) Strumenti chirurgici e materiali necessari. (B,C) Morsetto e applicatore microvascolare sganciabile. (D,E) Una cannula piegata collegata a un tubo di perfusione viene utilizzata come gancio per la preparazione chirurgica. (F,G) Modello di ratto ossigenato con una maschera facciale e rasato. (H) Incisione cutanea su tutta la lunghezza addominale. (I-M) resezione dello xifoide ed emostasi. (N-Q) Mobilizzazione epatica e dissezione del legamento falciforme (freccia 1). (R) Applicazione di ganci di preparazione e supporti metallici per l'esposizione degli organi dopo laparotomia. (S) Esposizione viscerale completa dei vasi principali addominali utilizzando ganci smussati (freccia 2), anelli per vasi in silicone (freccia 3) e impacchi chirurgici (freccia 4). (T,U) Aorta addominale e vena cavale. (V) Strumenti di preparazione atraumatica. (W) Ricambio di cotone umidificato (freccia 5). (X) Impacco umidificato in pinze (freccia 6) e morsetti smussati (freccia 7). Clicca qui per visualizzare una versione più grande di questa figura.
3. Preparazione chirurgica
- Radere il sito di accesso chirurgico per una laparotomia della linea mediana (Figura 2G). Eseguire un'incisione cutanea sulla lunghezza addominale desiderata, cioè circa 7 cm (Figura 2H), avanzare con la laparotomia sezionando la fascia e cucire i ganci di preparazione chirurgica con tubi di plastica attaccati e pinze per zanzare chirurgiche attraverso la pelle. Esporre il sito chirurgico utilizzando i ganci di preparazione chirurgica, applicando tensione al tessuto.
- Assicurarsi che il peritoneo venga sezionato cranialmente solo fino a pochi millimetri sotto l'inizio dello sterno, lasciando intatta parte del peritoneo. Posizionare una parte di un impacco chirurgico sotto lo sterno (Figura 2I) e resecare lo xifoide con forbici di materiale forte. Applicare pressione sull'area di resezione utilizzando l'impacco chirurgico per ottenere un'emostasi sufficiente di questa regione ben perfusa (Figura 2I-M).
- Mobilizzare il fegato dorso-caudale per esporre il legamento falciforme (Figura 2N) e sezionare il legamento (Figura 2O-Q).
- Per il controllo emostatico, a seconda di dove deve essere eseguito il clampaggio dei vasi principali, eseguire un'esposizione viscerale completa dei vasi principali addominali (Figura 2R) e dei vasi appesi con anelli di vasi in silicone (Figura 2S-U). Devono essere utilizzati solo strumenti di preparazione atraumatici (Figura 2V), come i ricambi di cotone umidificati (Figura 2W), l'impacco umidificato in pinze e i morsetti smussati (Figura 2X).
4. Preparazione e clampaggio dell'aorta addominale per l'ischemia arteriosa
- Eseguire una medializzazione sinistra degli organi addominali superiori utilizzando strumenti di preparazione atraumatici per accedere all'arteria surrenalica sinistra (Figura 3A-D).
- Identificare il sito pulsante tipicamente mediale all'estensione cranica dell'arteria surrenalica sinistra, indicando il decorso dell'aorta (Figura 3E). Avanzare attraverso i tessuti molli utilizzando i morsetti overholt per la dissezione smussata al fine di accedere all'aorta addominale (Figura 3F, G).
- Scavare un tunnel nell'aorta addominale all'estremità più cranica utilizzando morsetti smussati (Figura 3H-L) e imbracare l'aorta utilizzando un anello per vasi in silicone (Figura 3M-T).
- Applicare un morsetto microvascolare per aneurisma adatto utilizzando l'anello in silicone per lussare leggermente l'aorta ventralmente e guidare il morsetto microvascolare per aneurisma lungo l'anello in silicone per garantire un bloccaggio aortico isolato (Figura 3U). A seconda della domanda di ricerca, il morsetto microvascolare può essere rilasciato di nuovo.
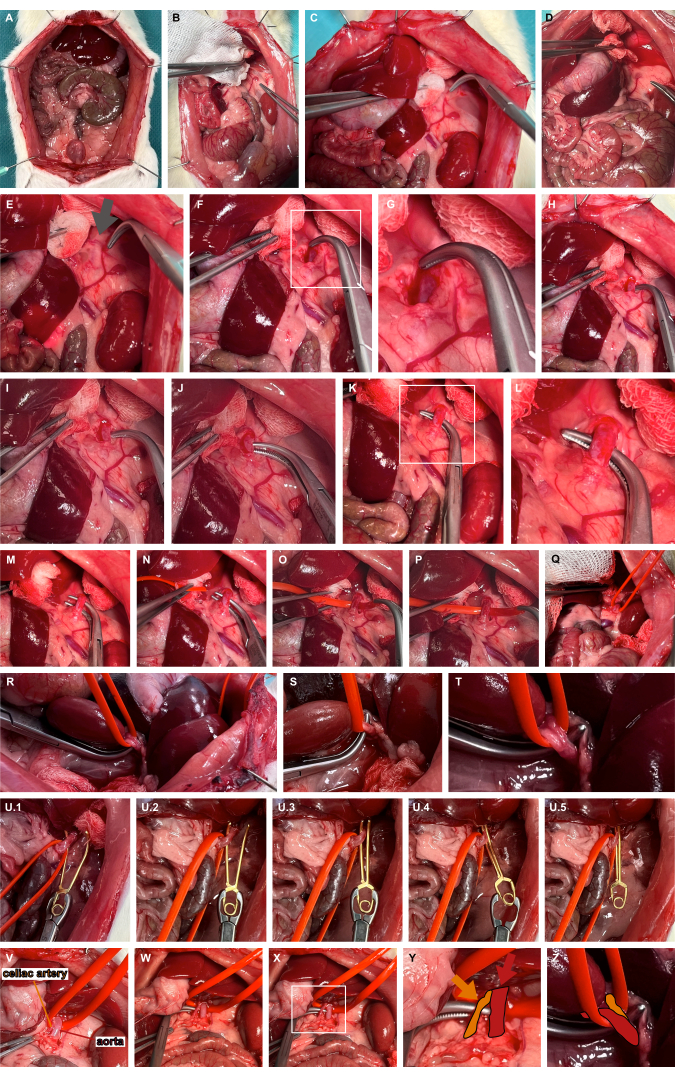
Figura 3: Preparazione e clampaggio dell'aorta addominale. (A) Esposizione degli organi viscerali. (B-E) Medializzazione sinistra degli organi addominali superiori utilizzando strumenti di preparazione atraumatici per accedere all'arteria surrenalica sinistra. (F,G) Dissezione smussa mediale dell'arteria surrenalica sinistra nel sito pulsante (freccia grigia) per accedere all'aorta addominale. (H-L) Tunneling dell'aorta addominale mediante morsetti smussati. (M-T) Imbracatura dell'aorta utilizzando un anello per vasi in silicone. (U) Applicazione di un morsetto microvascolare per aneurisma rilasciabile utilizzando l'ansa in silicone come guida. (V-Z) Visualizzazione dell'arteria celiaca (arancione) in riferimento all'aorta (rosso) e all'ansa del vaso in silicone. Clicca qui per visualizzare una versione più grande di questa figura.
5. Preparazione e clampaggio della vena cavale addominale sopraepatica per la congestione venosa
- Mobilizzare il fegato verso destra utilizzando strumenti di preparazione atraumatici, sezionare bruscamente i legamenti epatici e lateralizzare ulteriormente il fegato (Figura 4A-C).
- Aprire lo spazio retroepatico al crus sinistro del diaframma utilizzando morsetti smussati (Figura 4D-G).
- Scavare un tunnel nella vena cavale utilizzando morsetti smussati (Figura 4H-K) e imbracare la vena cavale utilizzando anelli per vasi in silicone (Figura 4L-O).
- Applicare un morsetto microvascolare per aneurisma adatto utilizzando l'anello in silicone per lussare leggermente la vena cavale ventralmente e guidare il morsetto microvascolare per aneurisma lungo l'anello in silicone per garantire un bloccaggio isolato della vena cavale (Figura 4R).
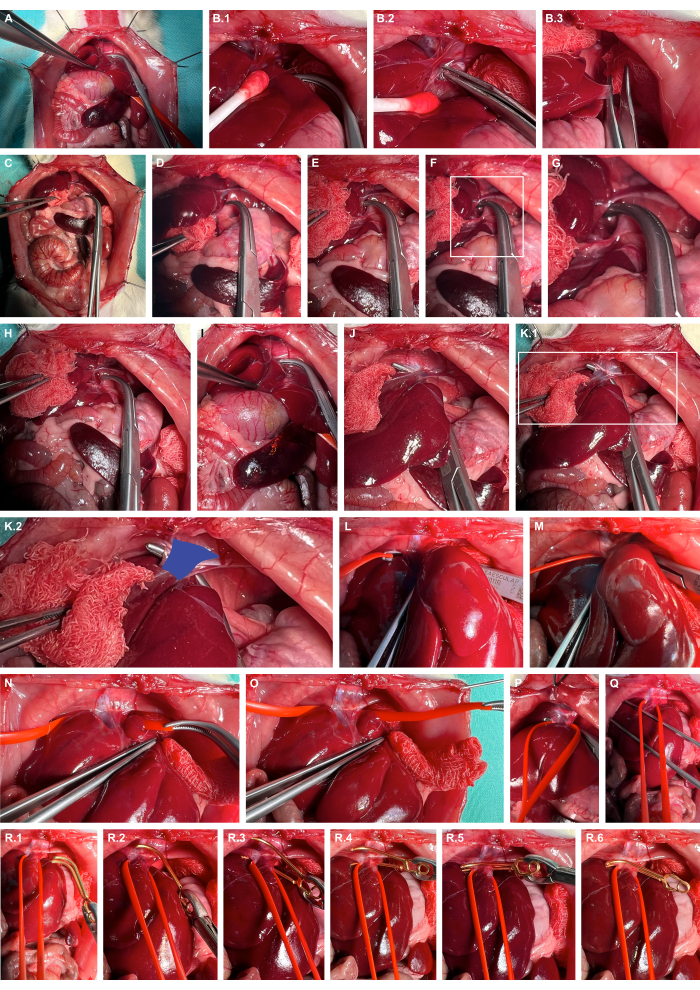
Figura 4: Preparazione e clampaggio della vena cavale addominale sopraepatica. (A) Esposizione degli organi cranici viscerali. (B) Mobilizzazione tissutale protettiva del fegato e dissezione tagliente dei legamenti epatici utilizzando strumenti di preparazione atraumatica. (C) Lateralizzazione del fegato. (D-G) L'apertura dello spazio retroepatico e la preparazione al crus sinistro del diaframma. (H-K) Tunneling della vena cavale (blu) mediante morsetti smussati. (L-O) Imbracatura della vena cavale utilizzando anelli per vasi in silicone. (P,Q) Esercizio di tensione per limitare provvisoriamente il flusso sanguigno della cavalleria. (R) Applicazione di un morsetto microvascolare per aneurisma rilasciabile utilizzando l'ansa in silicone come guida. Clicca qui per visualizzare una versione più grande di questa figura.
6. Clampaggio dell'aorta addominale e della vena cavale addominale sopraepatica per malperfusione combinata
- Eseguire i passaggi precedenti fino a quando sia l'aorta che la vena cavale sono state fissate con anelli per vasi in silicone. Avanzare con l'applicazione del morsetto microvascolare per aneurisma per entrambi i vasi utilizzando nuovamente l'anello in silicone come guida. Si consiglia di bloccare prima l'aorta e ridurre al minimo il tempo necessario fino al successivo bloccaggio cavale a pochi secondi.
NOTA: A seconda dello scenario desiderato e dello scopo della ricerca, la malperfusione può essere continuata o rilasciata dopo un periodo di tempo definito e gli animali possono essere soppressi mediante cardiectomia acuta (seguendo protocolli approvati istituzionalmente) per applicazioni non di sopravvivenza, o ricevere una chiusura addominale graduale utilizzando suture chirurgiche in caso di follow-up pianificati ed esperimenti di sopravvivenza. Per il presente studio, gli animali sono stati soppressi.
Risultati
Questo protocollo è stato eseguito in 10 ratti maschi (peso medio 403 g ± 26 g) in un contesto di non sopravvivenza. Il tasso di successo è stato definito dalla sopravvivenza oltre 20 minuti dopo clampaggio arterioso, clampaggio venoso e clampaggio combinato per 5 minuti con 10 minuti di riperfusione, ciascuno dei quali era del 100%. La durata media della preparazione dall'incisione cutanea fino a quando entrambi i vasi sono stati appesi con anelli di silicone è stata di 11 minuti e 45 secondi ± 3 minuti e 23 secondi.
Per la convalida dei 4 diversi stati di malperfusione, i parametri indice per l'ossigenazione (StO2) e la perfusione (NIR) sono stati misurati utilizzando l'imaging iperspettrale (HSI) su 5 organi viscerali (Figura 5).
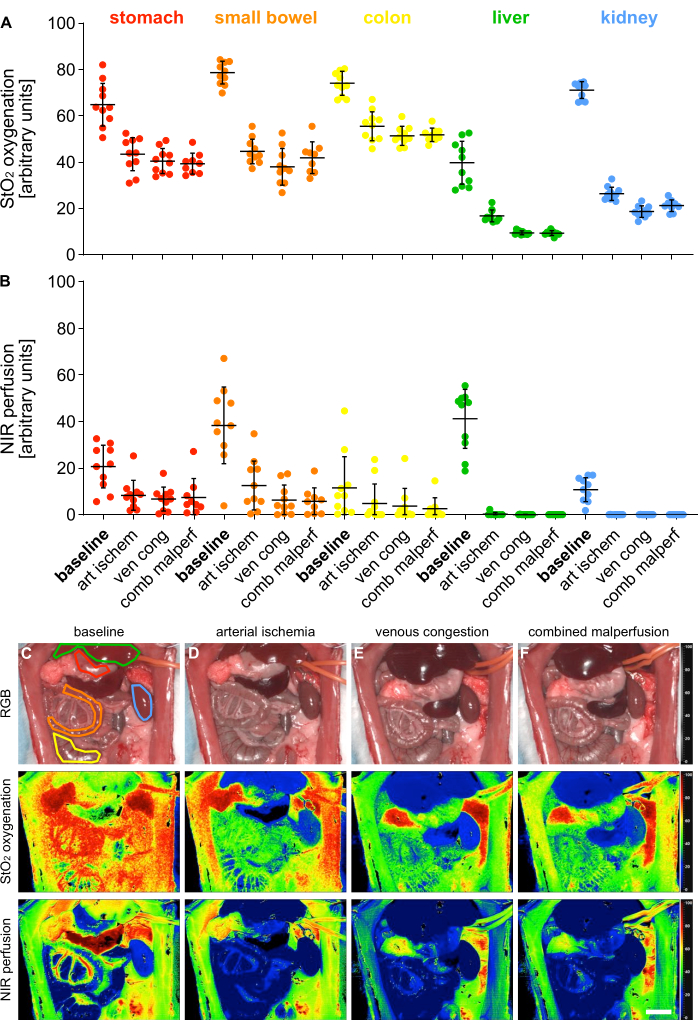
Figura 5: Validazione del modello di malperfusione. (A,B) Quantificazione dei valori di ossigenazione e perfusione dell'HSI in quattro diversi stati di perfusione e cinque diversi organi viscerali con n = 10 animali. (C-F) Immagini indice RGB e codificate a colori di registrazioni HSI contenenti organi viscerali in 4 diversi stati di perfusione. Le barre di errore indicano la deviazione standard. La barra della scala raffigura 5 cm. Clicca qui per visualizzare una versione più grande di questa figura.
I valori sono stati forniti in unità arbitrarie e hanno mostrato una significativa diminuzione degli stati di malperfusione rispetto allo stato fisiologico dell'organo (Tabella 1). I risultati iperspettrali erano in linea con le recenti pubblicazioni che indicavano che la vitalità e la perfusione del tessuto possono essere valutate utilizzando valori di cut-off HSI StO2 organo-specifici che corrispondevano ai valori osservati in questo studio14,15. A titolo esemplificativo per lo stomaco, questi erano il 64,1% (±9,4%) per la perfusione fisiologica, il 43,1% (±7,4%) per l'ischemia arteriosa, il 40,5% (±5,4%) per la congestione venosa e il 39,3% (±4,5%) per la malperfusione combinata.
Poiché si trattava di esperimenti non di sopravvivenza, non ci sono dati sperimentali sui risultati a lungo termine degli animali. Tuttavia, altri studi riportano una sopravvivenza del 100% e del 57% nell'arco di 24 ore per i ratti sottoposti a 30 minuti e 60 minuti di clampaggio dell'arteria mesenterica superiore16,17 e lo hanno correlato con successo con i livelli sierici della proteina da shock termico 70. Di conseguenza, questo potrebbe essere un possibile metodo per valutare i risultati nei futuri studi di sopravvivenza in base ai diversi tempi di clampaggio.
| parametro | organo | riferimento | ischemia arteriosa | congestione venosa | malperfusione combinata |
| StO2 | stomaco | 64,1% (±9,4%) | 43,1% (±7,4%) | 40,5% (±5,4%) | 39,3% (±4,5%) |
| intestino tenue | 78,4% (±5,1%) | 44,8% (±5,5%) | 38,0% (±7,9%) | 41,9% (±6,9%) | |
| colon | 74,6% (±5,0%) | 56,0% (±6,3%) | 51,3% (±4,1%) | 51,8% (±2,9%) | |
| fegato | 39,5% (±9,7%) | 16,9% (±2,6%) | 9,5% (±0,8%) | 9,3% (±1,1%) | |
| rene | 71,0% (±3,8%) | 26,3% (±3,0%) | 18,6% (±2,5%) | 21,2% (±2,6%) | |
| NIR | stomaco | 20,0% (±9,3%) | 8,3% (±6,7%) | 6,8% (±5,1%) | 7,5% (±8,1%) |
| intestino tenue | 38,6% (±17,4%) | 12,9% (±11,0%) | 6,3% (±6,5%) | 5,7% (±5,9%) | |
| colon | 12,6% (±13,7%) | 5,3% (±8,7%) | 3,8% (±7,5%) | 2,6% (±4,7%) | |
| fegato | 40,4% (±13,1%) | 0,3% (±0,7%) | 0,0% (±0,1%) | 0,0% (±0,0%) | |
| rene | 10,4% (±5,2%) | 0,0% (±0,0%) | 0,0% (±0,1%) | 0,0% (±0,0%) |
Tabella 1: Parametri tissutali. Valori di ossigenazione HIS StO2 e perfusione NIR in unità arbitrarie in 5 organi viscerali e 4 diversi stati di perfusione.
Discussione
Mentre la sola malattia occlusiva arteriosa periferica (PAOD), come rappresentante più importante delle condizioni di malperfusione tissutale, ha già una prevalenza di circa il 7%, colpendo circa 8,5 milioni di adulti solo negli Stati Uniti18, la malperfusione tissutale in generale è un meccanismo patologico rilevante nella maggior parte delle condizioni chirurgiche e mediche. Di conseguenza, modelli animali appropriati e riproducibili sono assolutamente necessari per affrontare nuove questioni di ricerca in questo campo.
Le tre situazioni dinamiche vascolari che richiedono un'indagine distintiva sono l'ischemia arteriosa, la congestione venosa e la malperfusione combinata. Inducendo l'ischemia arteriosa isolata, gli scienziati possono delineare con precisione la progressione temporale e spaziale dell'ipossia tissutale, studiando le cascate molecolari implicate nel danno da ischemia-riperfusione, nell'apoptosi cellulare e nelle risposte infiammatorie. Compromettendo il drenaggio venoso, un aspetto spesso trascurato della patologia vascolare, gli scienziati possono studiare l'interazione tra l'afflusso arterioso e le discrepanze del deflusso venoso, facendo luce sulla fisiopatologia della trombosi venosa, dell'edema tissutale correlato alla congestione e della disfunzione microcircolatoria. Combinando entrambe queste situazioni patologiche, si può indagare l'ambiente dissinergico della malperfusione combinata, rispecchiando la complessa fisiopatologia riscontrata nelle sindromi cliniche come l'ischemia mesenterica acuta e la colite ischemica.
Oltre a chiarire i meccanismi fisiopatologici fondamentali, la capacità di indurre l'ischemia arteriosa viscerale, la congestione venosa e la malperfusione combinata nei ratti funge da piattaforma indispensabile per valutare l'efficacia di interventi farmacologici, tecniche chirurgiche, nuove strategie terapeutiche e modalità di imaging innovative, in particolare come HSI 14,19,20,21,22. Questo modello è, quindi, un componente chiave nel fornire la verità di base del tessuto biologico necessaria per sfruttare appieno il potenziale dell'HSI nella valutazione dei tessuti e nell'identificazione degli stati di perfusione. Sfruttando questa configurazione sperimentale, i ricercatori possono accelerare la traduzione dei risultati preclinici in strategie clinicamente valide, riducendo in ultima analisi la morbilità e la mortalità associate a diversi disturbi vascolari e di perfusione.
A titolo illustrativo, i ricercatori possono utilizzare questo modello per studiare l'efficacia di agenti farmacologici che mirano alle vie di danno da ischemia-riperfusione, come antiossidanti, agenti antinfiammatori e vasodilatatori, delineando così la loro potenziale utilità nella pratica clinica23,24. Inoltre, questo modello facilita la valutazione di nuovi approcci chirurgici, come le tecniche di rivascolarizzazione mesenterica e le procedure di decompressione venosa, fornendo preziose informazioni sulla loro fattibilità, sicurezza ed efficacia a lungo termine25,26.
Inoltre, questo quadro sperimentale consente ai ricercatori di esplorare l'intricata interazione tra disfunzione vascolare e comorbidità sistemiche, come diabete, ipertensione e aterosclerosi, illustrando così l'intricata rete di percorsi fisiopatologici interconnessi che orchestrano la progressione della malattia vascolare27,28.
Mentre ci sono diverse pubblicazioni sulla malperfusione selettiva di singoli organi, come il fegato 29,30,31 o il rene, nei ratti32,33, c'è una mancanza di letteratura scientifica che affronti la malperfusione dei visceri completi nei ratti, e non esiste esplicitamente un protocollo metodico. Questa è, quindi, l'affermazione di questo manoscritto. I limiti della tecnica presentata includono principalmente l'invasività della procedura e, a seconda della durata della malperfusione, la trombosi d'organo consecutiva e la disfunzione, che possono portare a sofferenza postoperatoria per insufficienza multiorgano o sindrome compartimentale addominale 34,35,36. Un'attenta pianificazione e progettazione, a seconda della domanda di ricerca, può aiutare a bilanciare la durata richiesta della malperfusione e le sue conseguenze fisiopatologiche.
Quando si risolvono le sfide comuni incontrate durante la procedura, è necessario prestare attenzione ai seguenti punti e raccomandazioni: (1) Garantire un'accurata preparazione delle attrezzature e dei farmaci in anticipo per ridurre al minimo le interruzioni durante la procedura; (2) Eseguire meticolosamente il controllo emostatico preparando e sezionando attentamente i piani avascolari. Prendere in considerazione l'utilizzo di pinze emostatiche bipolari per l'emostasi elettrica, se disponibili; (3) Ridurre al minimo il trauma ai tessuti utilizzando strumenti non traumatici come tamponi di cotone umidificati o impacchi chirurgici umidificati con pinze quando entrano in contatto con il parenchima epatico; (4) Circa il 20% degli animali ha manifestato sanguinamento diffuso del parenchima epatico superficiale a causa di delicate condizioni tissutali. Tuttavia, l'emorragia si è fermata in tutti i casi con una leggera compressione e pazienza. Queste raccomandazioni mirano a migliorare l'efficienza procedurale e ridurre al minimo le complicanze durante l'induzione della malperfusione nei modelli di ratto.
Quando si reseca lo xifoideo per un migliore accesso alla vena cavale, assicurarsi che il peritoneo dorsale alla transizione tra lo xifoideo e lo sterno sia lasciato intatto per alcuni millimetri. Il sito di resezione dello xifoide sarà duro e affilato, causando potenzialmente un trauma al parenchima epatico superficiale. Pertanto, si raccomanda di mobilizzare caudalmente il peritoneo retrosternale utilizzando una pinza e di avvolgerlo efficacemente attorno al moncone osseo, coprendolo e supportando l'emostasi. I ganci di preparazione chirurgica devono essere cuciti attraverso la parete addominale ventrale cranica con tensione cranica in modo che la copertura peritoneale del moncone xifoideo rimanga in posizione.
Quando si disseziona il legamento falciforme, è necessario prestare attenzione per evitare di causare accidentalmente lesioni iatrogene alla vena epatica, poiché ciò potrebbe essere fatale per l'animale. A causa dell'elevato rischio di sanguinamento durante la preparazione vascolare, si raccomanda che la maggior parte della preparazione chirurgica venga eseguita distribuendo con pinze smussate, piuttosto che utilizzare strumenti di dissezione affilati. Inoltre, gli anelli dei vasi in silicone devono essere inumiditi prima dell'uso per ridurre l'attrito superficiale e minimizzare il rischio di traumi tissutali.
Quando si applica il morsetto microvascolare per aneurisma, è fondamentale visualizzare l'esatta anatomia vascolare. Ad esempio, l'arteria celiaca ha origine molto craniale dall'aorta addominale. Se si desidera l'occlusione celiaca, ad esempio per indagare la malperfusione epatica, l'arteria celiaca deve essere visualizzata in riferimento all'aorta e all'ansa del vaso in silicone. Ciò garantisce che l'arteria celiaca sia inclusa nel tessuto vascolare clampato (Figura 2V-Z). C'è stato un caso in cui la pinza è stata inizialmente posizionata caudalmente all'arteria celiaca per errore. Tuttavia, questo è stato prontamente riconosciuto a causa del mancato calo dei valori epatici di StO2 ed è stato eseguito con successo un corretto riclampaggio.
La fase di preparazione più pericolosa è il tunneling della vena cavale. Questo passaggio richiede movimenti delicati e pazienza, e le pinze overholt devono essere allargate solo quando si è certi che non ci sia contatto con la vena cavale. Può essere difficile giudicare questo, poiché la vena cavale apparirà come un sottile tessuto connettivo avascolare quando viene applicata una leggera compressione, causando la scomparsa del sangue contenuto in entrambe le direzioni. C'è anche il rischio di apertura pleurica accidentale e di creazione di uno pneumotorace quando si scava un tunnel della vena cavale troppo cranialmente. Questa può essere una complicanza grave e pericolosa per la vita, soprattutto perché l'animale respira spontaneamente e non possono essere prese misure respiratorie invasive. Si è ritenuto utile ritrarre leggermente gli strumenti di preparazione e continuare più caudalmente per evitare questa complicanza. Nei casi di pneumotorace emodinamicamente rilevante e visibile con rigonfiamento del diaframma epatico, una puntura transdiaframmatica una tantum e l'aspirazione dell'aria intrappolata utilizzando un ago da 30 G e una piccola siringa possono essere raccomandate come strategia di salvataggio. Questa tecnica è stata impiegata con successo in un animale per salvarlo durante l'intervento.
Infine, è necessario prestare particolare attenzione quando si applicano le pinze microvascolari per evitare di includere il tessuto connettivo circostante, che potrebbe portare a un'occlusione insufficiente del vaso desiderato.
Sebbene questo protocollo sia inteso come una guida passo passo per la malperfusione viscerale globale, il sito di serraggio può essere regolato in base alla specifica domanda di ricerca grazie all'ampia preparazione e mobilizzazione vascolare illustrata nella Figura 1T-V. Pertanto, la malperfusione selezionata di gruppi di organi o singoli organi è anche un'opzione quando si sceglie il sito di serraggio più distalmente lungo l'albero vascolare, come il bloccaggio selettivo del tronco celiaco per l'ischemia epatica. Offrendo una metodologia dettagliata e riproducibile, questo protocollo facilita un approccio standardizzato per l'ischemia arteriosa reversibile controllata, la congestione venosa e la malperfusione combinata nei modelli di ratto, portando a un miglioramento dell'affidabilità dei dati, della robustezza, dell'indipendenza del ricercatore e della comparabilità nei futuri studi sugli animali. Di conseguenza, rappresenta uno strumento indispensabile all'interno dell'armamentario della ricerca biomedica, offrendo approfondimenti sulla complessa interazione tra compromissione vascolare, danno tissutale e interventi terapeutici. Sfruttando la versatilità di questa configurazione sperimentale, i ricercatori possono indagare i misteri della fisiopatologia vascolare, forgiando nuove frontiere nella medicina traslazionale e, in ultima analisi, migliorando i risultati dei pazienti nel campo della salute vascolare.
Divulgazioni
Nessuno.
Riconoscimenti
Gli autori ringraziano il servizio di archiviazione dei dati SDS@hd sostenuto dal Ministero della Scienza, della Ricerca e delle Arti del Baden-Württemberg (MWK) e dalla Fondazione tedesca per la ricerca (DFG) attraverso le sovvenzioni INST 35/1314-1 FUGG e INST 35/1503-1 FUGG. Inoltre, gli autori riconoscono con gratitudine il supporto dell'NCT (National Center for Tumor Diseases di Heidelberg, Germania) attraverso il suo programma post-dottorato strutturato e il programma di oncologia chirurgica. Ringraziamo inoltre il sostegno attraverso i fondi statali approvati dal Parlamento del Land Baden-Württemberg per l'Innovation Campus Health + Life Science Alliance Heidelberg Mannheim dal programma postdoc strutturato per Alexander Studier-Fischer: Artificial Intelligence in Health (AIH) - Una collaborazione di DKFZ, EMBL, Università di Heidelberg, Ospedale universitario di Heidelberg, Ospedale universitario di Mannheim, Istituto centrale di salute mentale, e l'Istituto Max Planck per la ricerca medica. Inoltre, ringraziamo il supporto attraverso il DKFZ Hector Cancer Institute presso il Centro medico universitario di Mannheim. Per il pagamento del canone di pubblicazione, ringraziamo il sostegno finanziario della Deutsche Forschungsgemeinschaft nell'ambito del programma di promozione "Open Access Publikationskosten" e dell'Università di Heidelberg.
Materiali
| Name | Company | Catalog Number | Comments |
| Atraumatic preparation forceps | Aesculap | FB395R | DE BAKEY ATRAUMATA atraumatic forceps, straight |
| Blunt overholt clamp | Aesculap | BJ012R | BABY-MIXTER preparation and ligature clamp, bent, 180 mm |
| Cannula | BD (Beckton, Dickinson) | 301300 | BD Microlance 3 cannula 20 G |
| Fixation rods | legefirm | 500343896 | tuning forks used as y-shaped metal fixation rods |
| Heating pad | Royal Gardineer | IP67 | Royal Gardineer Heating Pad Size S, 20 Watt |
| Plastic perfusor tube | M. Schilling GmbH | S702NC150 | connecting tube COEX 150 cm |
| Preparation scissors | Aesculap | BC177R | JAMESON preparation scissors, bent, fine model, blunt/blunt, 150 mm (6") |
| Silicone vessel loop tie | SERAG WIESSNER | SL26 | silicone vessel loop tie 2,5 mm red |
| Spraque Dawley rat | Janvier Labs | RN-SD-M | Spraque Dawley rat |
| Steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
| Yasargil clip | Aesculap | FE795K | YASARGIL Aneurysm Clip System Phynox Temporary (Standard) Clip |
| Yasargil clip applicator | Aesculap | FE558K | YASARGIL Aneurysm Clip Applicator Phynox (Standard) |
Riferimenti
- Carden, D. L., Granger, D. N. Pathophysiology of ischemia-reperfusion injury. J Pathol. 190 (3), 255-266 (2000).
- Balkwill, F., Mantovani, A. Inflammation and cancer: Back to Virchow. Lancet. 357 (9255), 539-545 (2001).
- Cruz, R. J., Garrido, A. G., Ribeiro, C. M., Harada, T., Rocha-E-Silva, M. Regional blood flow distribution and oxygen metabolism during mesenteric ischemia and congestion. J Surg Res. 161 (1), 54-61 (2010).
- Leng, G. C., Davis, M., Baker, D. Bypass surgery for chronic lower limb ischemia. Cochrane Database Syst Rev. 3, Cd002000 (2000).
- Droc, I., Calinescu, F. B., Droc, G., Blaj, C., Dammrau, R. Aortic stenting. Minim Invasive Ther Allied Technol. 24 (5), 296-304 (2015).
- Le Gall, A., et al. Veno-arterial-ecmo in the intensive care unit: From technical aspects to clinical practice. Anaesth Crit Care Pain Med. 37 (3), 259-268 (2018).
- Napp, L. C., Kühn, C., Bauersachs, J. ECMO in cardiac arrest and cardiogenic. Herz. 42 (1), 27-44 (2017).
- Sousa Da Silva, R. X., Weber, A., Dutkowski, P., Clavien, P. A. Machine perfusion in liver transplantation. Hepatology. 76 (5), 1531-1549 (2022).
- Sen Gupta, A. Bio-inspired nanomedicine strategies for artificial blood components. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 9 (6), 1464 (2017).
- Lu, D., et al. Intramuscular microvascular flow sensing for flap monitoring in a porcine model of arterial and venous occlusion. J Reconstr Microsurg. 39 (3), 231-237 (2023).
- Nguyen, G. K., et al. Novel biomarkers of arterial and venous ischemia in microvascular flaps. PLoS One. 8 (8), e71628 (2013).
- Redlin, M., et al. How near-infrared spectroscopy differentiates between lower body ischemia due to arterial occlusion versus venous outflow obstruction. Ann Thorac Surg. 91 (4), 1274-1276 (2011).
- Studier-Fischer, A., et al. Endotracheal intubation via tracheotomy and subsequent thoracotomy in rats for non-survival applications. J Vis Exp. (205), e66684 (2024).
- Nickel, F., et al. Optimization of anastomotic technique and gastric conduit perfusion with hyperspectral imaging and machine learning in an experimental model for minimally invasive esophagectomy. Eur J Surg Oncol. , 106908 (2023).
- Barberio, M., et al. Quantitative fluorescence angiography versus hyperspectral imaging to assess bowel ischemia: A comparative study in enhanced reality. Surgery. 168 (1), 178-184 (2020).
- Doukas, P., et al. Onset of adverse abdominal events due to intestinal ischemia-reperfusion injury after aortic cross-clamping is associated with elevated hsp70 serum levels in the early postoperative phase. Int J Mol Sci. 23 (23), 15063 (2022).
- Mine, Y., et al. Heat shock protein 70 messenger RNA in rat leukocytes elevates after severe intestinal ischemia-reperfusion. J Surg Res. 242, 342-348 (2019).
- Criqui, M. H., et al. Lower extremity peripheral artery disease: Contemporary epidemiology, management gaps, and future directions: A scientific statement from the American Heart Association. Circulation. 144 (9), e171-e191 (2021).
- Seidlitz, S., et al. Robust deep learning-based semantic organ segmentation in hyperspectral images. Med Image Anal. 80, 102488 (2022).
- Studier-Fischer, A., et al. Icg-augmented hyperspectral imaging for visualization of intestinal perfusion compared to conventional icg fluorescence imaging: An experimental study. Int J Surg. 109 (12), 3883-3895 (2023).
- Studier-Fischer, A., et al. Heiporspectral - the heidelberg porcine hyperspectral imaging dataset of 20 physiological organs. Scientific Data. 10 (1), 414 (2023).
- Studier-Fischer, A., et al. Spectral organ fingerprints for machine learning-based intraoperative tissue classification with hyperspectral imaging in a porcine model. Sci Rep. 12 (1), 11028 (2022).
- Mallick, I. H., Yang, W., Winslet, M. C., Seifalian, A. M. Ischemia-reperfusion injury of the intestine and protective strategies against injury. Dig Dis Sci. 49 (9), 1359-1377 (2004).
- Malekinejad, Z., et al. Prazosin treatment protects brain and heart by diminishing oxidative stress and apoptotic pathways after renal ischemia-reperfusion. Drug Res (Stuttg). 72 (6), 336-342 (2022).
- Feldman, Z. M., et al. Inferior mesenteric artery revascularization can supplement salvage of mesenteric ischemia. J Vasc Surg Cases Innov Tech. 9 (3), 101041 (2023).
- Munley, J. A., et al. Chronic mesenteric ischemia-induced intestinal dysbiosis resolved after revascularization. J Vasc Surg Cases Innov Tech. 9 (2), 101084 (2023).
- Lejay, A., et al. Ischemia reperfusion injury, ischemic conditioning and diabetes mellitus. J Mol Cell Cardiol. 91, 11-22 (2016).
- Huang, D., et al. Macrovascular complications in patients with diabetes and prediabetes. Biomed Res Int. 2017, 7839101 (2017).
- Liu, A., et al. Hmgb1 in the ischemic and non-ischemic liver after selective warm ischemia/reperfusion in rats. Histochem Cell Biol. 135 (5), 443-452 (2011).
- Koc, S., Dogan, H. O., Karatas, O., Erdogan, M. M., Polat, V. Mitochondrial homeostasis and mast cells in experimental hepatic ischemia-reperfusion injury of rats. Turk J Gastroenterol. 33 (9), 777-784 (2022).
- Chu, M. J., Vather, R., Hickey, A. J., Phillips, A. R., Bartlett, A. S. Impact of ischaemic preconditioning on experimental steatotic livers following hepatic ischemia-reperfusion injury: A systematic review. HPB (Oxford). 17 (1), 1-10 (2015).
- Chang, M. W., et al. Sitagliptin protects rat kidneys from acute ischemia-reperfusion injury via upregulation of GLP-1 and GLP-1 receptors. Acta Pharmacol Sin. 36 (1), 119-130 (2015).
- Boys, J. A., Toledo, A. H., Anaya-Prado, R., Lopez-Neblina, F., Toledo-Pereyra, L. H. Effects of dantrolene on ischemia-reperfusion injury in animal models: A review of outcomes in heart, brain, liver, and kidney. J. Investig Med. 58 (7), 875-882 (2010).
- Orihashi, K. Mesenteric ischemia in acute aortic dissection. Surg Today. 46 (5), 509-516 (2016).
- Byard, R. W. Acute mesenteric ischemia and unexpected death. J Forensic Leg Med. 19 (4), 185-190 (2012).
- Łagosz, P., Sokolski, M., Biegus, J., Tycinska, A., Zymlinski, R. Elevated intra-abdominal pressure: A review of current knowledge. World J Clin Cases. 10 (10), 3005-3013 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon