Method Article
Isquemia arterial visceral reversible controlada, congestión venosa y malperfusión combinada mediante laparotomía de línea media en ratas
En este artículo
Resumen
Este artículo presenta un procedimiento estandarizado para la malperfusión controlada y reversible de órganos viscerales en modelos de rata. El objetivo es inducir estos estados de malperfusión con un alto grado de certeza metodológica y control, manteniendo la simplicidad técnica y la resistencia al error.
Resumen
Además de la sepsis y la neoplasia maligna, la malperfusión es la tercera causa principal de degradación de los tejidos y un mecanismo patológico importante para diversas afecciones médicas y quirúrgicas. A pesar de los avances significativos, como la cirugía de bypass, los procedimientos endovasculares, la oxigenación por membrana extracorpórea y los sustitutos artificiales de la sangre, la malperfusión de tejidos, especialmente de los órganos viscerales, sigue siendo un problema apremiante en la atención al paciente. La demanda de más investigación sobre los procesos biomédicos y las posibles intervenciones es alta. Los modelos biológicos válidos son de suma importancia para permitir este tipo de investigación. Debido a los aspectos multifactoriales de la investigación de la perfusión tisular, que incluyen no solo la biología celular, sino también la microanatomía vascular y la reología, un modelo apropiado requiere un grado de complejidad biológica que solo un modelo animal puede proporcionar, lo que convierte a los roedores en el modelo obvio de elección. La malperfusión tisular se puede diferenciar en tres afecciones distintas: (1) isquemia arterial aislada, (2) congestión venosa aislada y (3) malperfusión combinada. En este artículo se presenta un detallado protocolo paso a paso para la inducción controlada y reversible de estos tres tipos de malperfusión visceral mediante laparotomía de línea media y pinzamiento de la aorta abdominal y la vena cava en ratas, lo que subraya la importancia de una metodología quirúrgica precisa para garantizar resultados uniformes y fiables. Los principales ejemplos de posibles aplicaciones de este modelo incluyen el desarrollo y la validación de modalidades innovadoras de imágenes intraoperatorias, como las imágenes hiperespectrales (HSI), para visualizar y diferenciar objetivamente la malperfusión de órganos gastrointestinales, ginecológicos y urológicos.
Introducción
Si bien las implicaciones de la privación de perfusión tisular en forma de condiciones de malperfusión tisular local o sistémica han sido reconocidas desde hace mucho tiempo, persisten como una de las principales causas de morbilidad y mortalidad tanto en los Estados Unidos como en Europa1. Estas condiciones de malperfusión son la tercera causa de degradación de tejidos, después de la neoplasia maligna y la inflamación séptica, pero tienen un espectro de orígenes mucho más amplio en comparación con las dos últimas2.
Este espectro abarca desde mecanismos locales como la fibrilación auricular con oclusión tromboembólica, vasoconstricción y disección iatrogénica o traumática, hasta mecanismos sistémicos como la insuficiencia cardíaca o shock, sepsis, hipovolemia y fenómenos de robo. Estos diversos mecanismos subyacen a una variedad de condiciones médicas y quirúrgicas. La importante morbilidad y mortalidad asociadas con estas condiciones ha dirigido la atención médica hacia los procedimientos para restablecer el flujo sanguíneo a los tejidos malfundidos con el fin de prevenir la necrosis y restaurar la función de los órganos a lo largo de las décadas3.
Este esfuerzo de investigación ha dado como resultado una variedad de soluciones farmacéuticas, médicas y quirúrgicas para restaurar la perfusión fisiológica de órganos, incluidos los avances en la cirugía de derivación4, los procedimientos endovasculares5, la oxigenación por membrana extracorpórea 6,7, la perfusión de la máquina de órganos durante el trasplante8 y los sustitutos artificiales de la sangre9.
Sin embargo, a pesar de estos avances significativos, la malperfusión, especialmente de los órganos viscerales, sigue siendo un problema apremiante en la atención al paciente, y la demanda de más investigación sobre procesos biomédicos y estrategias de rescate es alta. Los modelos biológicos válidos son de suma importancia para permitir este tipo de investigación. Debido a los aspectos multifactoriales de la investigación de la perfusión tisular, que incluyen no solo la biología celular sino también la microanatomía vascular y la reología, un modelo apropiado requiere un grado de complejidad biológica que solo un organismo modelo completo puede proporcionar, lo que hace que los roedores sean el modelo obvio de elección.
La malperfusión tisular se puede diferenciar en tres condiciones distintas: isquemia arterial aislada, congestión venosa aislada y malperfusión combinada10. Los escenarios clínicamente relevantes para estas afecciones incluyen (1) isquemia arterial: fibrilación auricular con oclusión tromboembólica, émbolos sépticos, vasoconstricción, disección o pinzamiento vascular iatrogénico o traumático, insuficiencia cardíaca o shock, disección aórtica, sepsis e hipovolemia, obstrucción arterial extrema debido a constricción externa, embolia de la arteria pulmonar, enfermedades oclusivas vasculares arteriales crónicas o fenómenos de robo; (2) Congestión venosa: disección o pinzamiento vascular iatrogénico o traumático, insuficiencia cardíaca, fibrosis hepática o cirrosis, obstrucción venosa por constricción externa, trombosis venosa, insuficiencia venosa y síndrome de Budd-Chiari; (3) Malperfusión combinada: Combinaciones de las condiciones anteriores y etapas avanzadas de las condiciones antes mencionadas, como la congestión venosa secundaria debido a la fibrosis inducida por isquemia o la isquemia arterial secundaria debido a la retención inducida por la congestión, así como condiciones orgánicas específicas como la inflamación isquémica (por ejemplo, colitis isquémica)11,12.
Por lo tanto, este artículo tiene como objetivo proporcionar un modelo paso a paso para inducir isquemia arterial visceral controlada y reversible, congestión venosa y malperfusión combinada a través de laparotomía de línea media en ratas para aplicaciones de supervivencia y no supervivencia, como se muestra en la Figura 1. El modelo experimental ofrece un entorno controlado para estudiar la dinámica multifacética de la isquemia arterial, la congestión venosa y sus secuelas combinadas, emulando escenarios clínicamente relevantes encontrados en diversas afecciones.
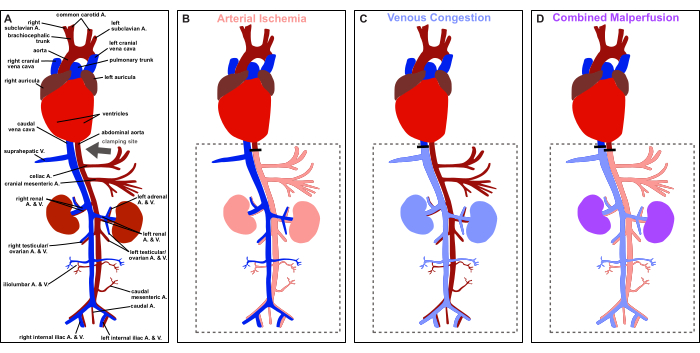
Figura 1: Descripción general del protocolo. Representación esquemática de la anatomía vascular de la rata y representación del sitio de sujeción (flecha gris). A) Perfusión fisiológica. (B) Isquemia arterial. (C) congestión venosa. D) Malperfusión combinada. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
Todas las actividades con animales descritas aquí se llevaron a cabo en instalaciones acreditadas y aprobadas por el Comité Institucional de Cuidado y Uso de Animales (IACUC) del Consejo Regional de Baden-Württemberg en Karlsruhe, Alemania (35-9185.81/G-62/23). Los animales de experimentación se gestionaron de acuerdo con las normas institucionales, las leyes alemanas sobre el uso y el cuidado de los animales, las directivas del Consejo de la Comunidad Europea (2010/63/UE) y las directrices ARRIVE. Se utilizaron ratas macho Sprague Dawley con un peso de pedido de 400 gramos después de haber sido aclimatadas durante una semana. Los detalles de los reactivos y el equipo utilizado en este estudio se enumeran en la Tabla de Materiales.
1. Anestesia y analgesia
- Anestesiar a la rata con la medicación siguiendo los protocolos institucionales. Se recomienda isoflurano para la inducción de la sedación seguida de una inyección i.p. de 100 mg/kg de ketamina para el peso corporal y 4 mg/kg de xilacina para el peso corporal. Se puede lograr analgesia adicional con una inyección s.c. de 5 mg/kg de carprofeno de peso corporal. Para más detalles, véase Studier-Fischer et al.13.
- Aplique ungüento oftálmico en los ojos para prevenir la sequedad.
- Garantice la profundidad analgésica adecuada mediante la prueba de pinzamiento del dedo del pie con pinzas quirúrgicas.
- Vuelva a evaluar y ajuste regularmente la profundidad de la anestesia durante la cirugía.
2. Preparación del procedimiento
- Prepare la mesa de fregado con todos los materiales e instrumentos necesarios, incluidas las pinzas microvasculares desmontables y el aplicador (Figura 2A-C), la pinza roma, la tijera de preparación fina y las pinzas.
- Prepare los ganchos de preparación quirúrgica doblando las cánulas en un ángulo de 135° a 1 cm con respecto a la punta y conéctelas a tubos de perfusión de plástico mediante Luer-lock, listos para aplicar tensión con una pinza quirúrgica para mosquitos (Figura 2D, E).
- Prepare un aparato quirúrgico de exposición a roedores, que incluya varillas de fijación en forma de Y y una almohadilla térmica, como se especifica en Studier-Fischer et al.13.
- Asegúrese de que la oxigenación adecuada se logre a través de la inhalación de oxígeno al 100% con una mascarilla neonatal (Figura 2F).
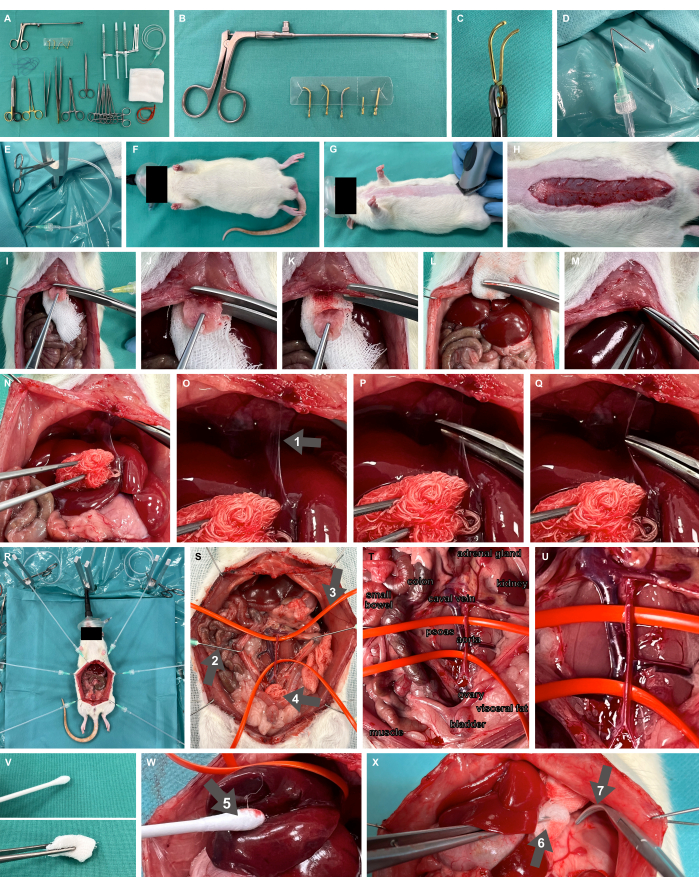
Figura 2: Montaje experimental y animal. (A) Instrumentos quirúrgicos y materiales necesarios. (B,C) Pinza microvascular y aplicador desmontables. (D,E) Una cánula plegada conectada a un tubo de perfusión se utiliza como gancho de preparación quirúrgica. (F,G) Modelo de rata oxigenada con mascarilla y afeitada. (H) Incisión cutánea en toda la longitud abdominal. (I-M) resección del xifoides y la hemostasia. (N-Q) Movilización hepática y disección del ligamento falciforme (flecha 1). (R) Aplicación de ganchos de preparación y soportes metálicos para la exposición de los órganos después de la laparotomía. (S) Exposición visceral completa de los vasos principales abdominales con ganchos romos (flecha 2), asas de vasos de silicona (flecha 3) y compresas quirúrgicas (flecha 4). (T,U) Aorta abdominal y vena cava. (V) Instrumentos de preparación atraumática. (W) Intercambio de algodón humidificado (flecha 5). (X) Compresa humidificada en pinzas (flecha 6) y pinzas romas (flecha 7). Haga clic aquí para ver una versión más grande de esta figura.
3. Preparación quirúrgica
- Rasurar el sitio de acceso quirúrgico para una laparotomía de línea media (Figura 2G). Realizar una incisión cutánea sobre la longitud abdominal deseada, es decir, unos 7 cm (Figura 2H), avanzar con la laparotomía diseccionando la fascia y coser los ganchos de preparación quirúrgica con tubos de plástico adjuntos y pinzas quirúrgicas para mosquitos a través de la piel. Exponga el situs quirúrgico utilizando los ganchos de preparación quirúrgica, aplicando tensión al tejido.
- Asegúrese de que el peritoneo se disece cranealmente solo hasta unos pocos milímetros por debajo del comienzo del esternón, dejando parte del peritoneo intacto. Coloque una parte de una compresa quirúrgica debajo del esternón (Figura 2I) y reseque el xifoides con unas tijeras de material fuerte. Aplique presión en el área de resección con la compresa quirúrgica para lograr una hemostasia suficiente de esta región bien perfundida (Figura 2I-M).
- Movilizar el hígado dorso-caudalmente para exponer el ligamento falciforme (Figura 2N) y diseccionar el ligamento (Figura 2O-Q).
- Para el control hemostático, dependiendo de dónde se deba realizar el pinzamiento de los vasos principales, se debe realizar una exposición visceral completa de los vasos principales abdominales (Figura 2R) y de los vasos colgados con asas de vasos de silicona (Figura 2S-U). Solo se deben utilizar instrumentos de preparación atraumática (Figura 2V), como permutas de algodón humidificadas (Figura 2W), compresas humidificadas en pinzas y pinzas romas (Figura 2X).
4. Preparación y pinzamiento de la aorta abdominal para la isquemia arterial
- Realizar una medialización izquierda de los órganos abdominales superiores utilizando instrumentos de preparación atraumática para acceder a la arteria suprarrenal izquierda (Figura 3A-D).
- Identificar el sitio pulsátil típicamente medial a la extensión craneal de la arteria suprarrenal izquierda, indicando el curso de la aorta (Figura 3E). Avance a través del tejido blando utilizando pinzas sobredimensionadas para la disección roma con el fin de acceder a la aorta abdominal (Figura 3F, G).
- Tunelice la aorta abdominal en el extremo más craneal con pinzas romas (Figura 3H-L) y cabestree la aorta con un asa de vasos de silicona (Figura 3M-T).
- Aplique una pinza microvascular de aneurisma adecuada utilizando el asa de silicona para luxar ligeramente la aorta ventralmente y guíe la pinza microvascular del aneurisma a lo largo del asa de silicona para garantizar un pinzamiento aórtico aislado (Figura 3U). Dependiendo de la pregunta de investigación, la pinza microvascular puede volver a liberarse.
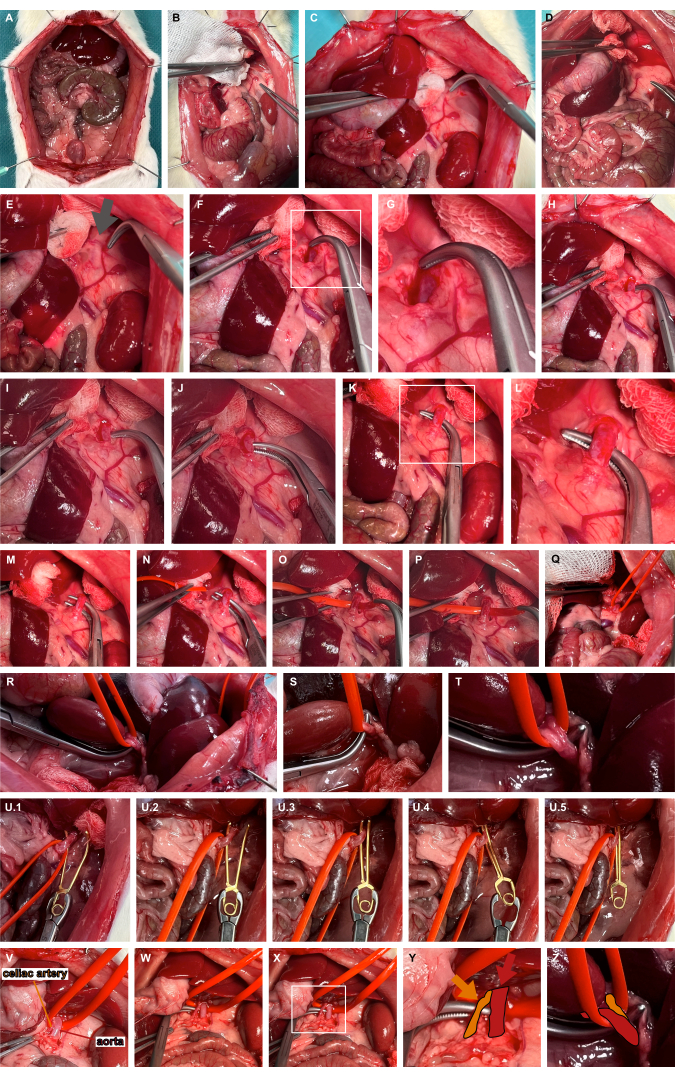
Figura 3: Preparación y pinzamiento de la aorta abdominal. (A) Exposición de los órganos viscerales. (B-E) Medialización izquierda de los órganos abdominales superiores utilizando instrumentos de preparación atraumática para acceder a la arteria suprarrenal izquierda. (F,G) Disección roma medial de la arteria suprarrenal izquierda en el sitio pulsátil (flecha gris) para acceder a la aorta abdominal. (H-L) Tunelización de la aorta abdominal con pinzas romas. (De lunes a viernes) Colgar la aorta con un asa de silicona. (U) Aplicación de una pinza microvascular de aneurisma liberable utilizando el asa de silicona como guía. (V-Z) Visualización de la arteria celíaca (naranja) en referencia a la aorta (rojo) y el asa del vaso de silicona. Haga clic aquí para ver una versión más grande de esta figura.
5. Preparación y pinzamiento de la vena cava abdominal suprahepática para la congestión venosa
- Movilizar el hígado hacia la derecha utilizando instrumentos de preparación atraumática, diseccionar bruscamente los ligamentos hepáticos y lateralizar aún más el hígado (Figura 4A-C).
- Abra el espacio retrohepático en el crus izquierdo del diafragma usando pinzas romas (Figura 4D-G).
- Tunelice la vena cava con pinzas romas (Figura 4H-K) y eslinge la vena cava con asas de silicona para vasos (Figura 4L-O).
- Aplique una pinza microvascular de aneurisma adecuada utilizando el asa de silicona para luxar ligeramente la vena cava ventralmente y guíe la pinza microvascular del aneurisma a lo largo del asa de silicona para garantizar un pinzamiento aislado de la vena cava (Figura 4R).
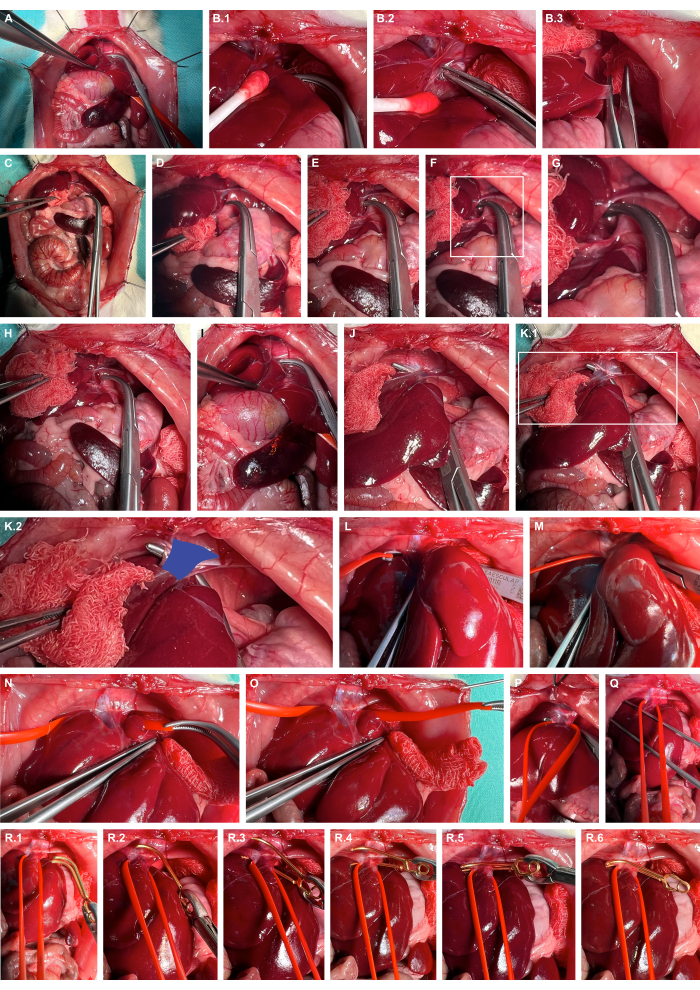
Figura 4: Preparación y pinzamiento de la vena cava abdominal suprahepática. (A) Exposición de órganos viscerales craneales. (B) Movilización tisular protectora del hígado y disección aguda de los ligamentos hepáticos utilizando instrumentos de preparación atraumática. (C) Lateralización del hígado. (D-G) La apertura del espacio retrohepático y la preparación en el crus izquierdo del diafragma. (H-K) Tunelización de la vena cava (azul) mediante abrazaderas romas overholt. (De izquierda a derecha) Eslingado de la vena cava con asas de silicona para los vasos. (P,Q) Ejercicio de tensión para restringir tentativamente el flujo sanguíneo caval. (R) Aplicación de una pinza microvascular de aneurisma liberable utilizando el asa de silicona como guía. Haga clic aquí para ver una versión más grande de esta figura.
6. Pinzamiento de la aorta abdominal y de la vena cava abdominal suprahepática para malperfusión combinada
- Realice los pasos anteriores hasta que tanto la aorta como la vena cava estén colgadas con asas de silicona para los vasos. Avance con la aplicación de la pinza microvascular del aneurisma para ambos vasos nuevamente utilizando el asa de silicona como guía. Se recomienda pinzar primero la aorta y minimizar el tiempo necesario hasta el pinzamiento cavo posterior a solo unos segundos.
NOTA: Dependiendo del escenario deseado y del propósito de la investigación, la malperfusión puede continuarse o liberarse después de un período de tiempo definido, y los animales pueden ser sacrificados mediante cardiectomía aguda (siguiendo protocolos aprobados institucionalmente) para aplicaciones que no sean de supervivencia, o recibir un cierre abdominal escalonado utilizando suturas quirúrgicas en caso de seguimientos planificados y experimentos de supervivencia. Para el presente estudio, los animales fueron sacrificados.
Resultados
Este protocolo se realizó en 10 ratas macho (peso medio 403 g ± 26 g) en un entorno de no supervivencia. La tasa de éxito se definió por la supervivencia a más de 20 min después del pinzamiento arterial, el pinzamiento venoso y el pinzamiento combinado durante 5 min con 10 min de reperfusión, cada uno de los cuales fue del 100%. La duración media de la preparación desde la incisión cutánea hasta la colocación de ambos vasos con asas de silicona fue de 11 min 45 s ± 3 min 23 s.
Para la validación de los 4 estados diferentes de malperfusión, se midieron los parámetros índice de oxigenación (StO2) y perfusión (NIR) mediante imágenes hiperespectrales (HSI) en 5 órganos viscerales (Figura 5).
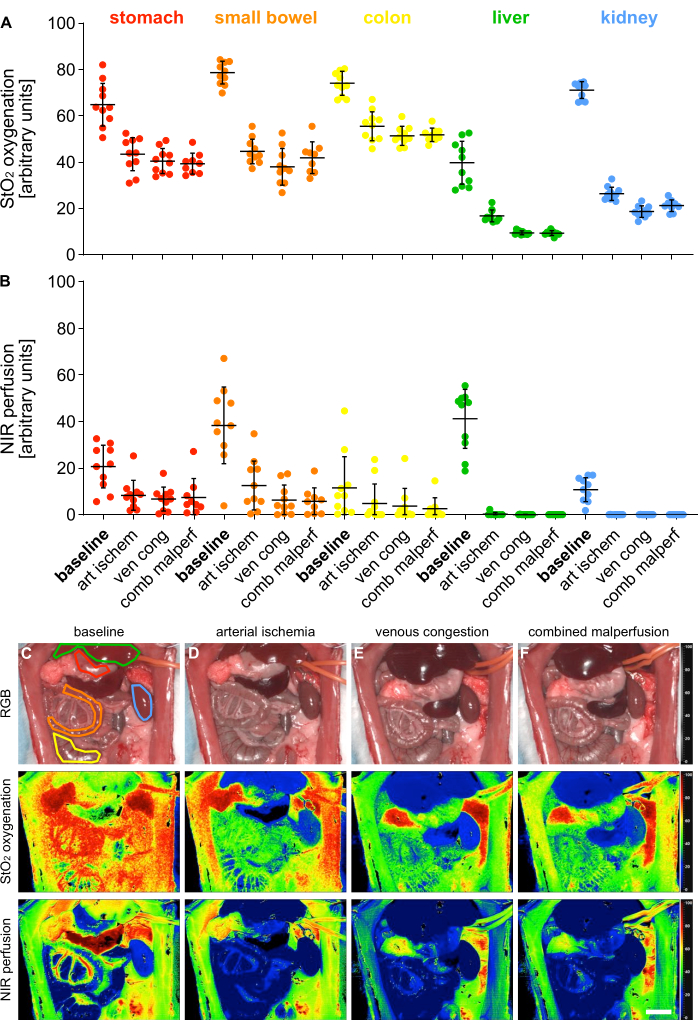
Figura 5: Validación del modelo de malperfusión. (A,B) Cuantificación de los valores de oxigenación y perfusión de HSI en cuatro estados de perfusión diferentes y cinco órganos viscerales diferentes con n = 10 animales. (C-F) Imágenes de índice RGB y codificadas por colores de grabaciones HSI que contienen órganos viscerales en 4 estados de perfusión diferentes. Las barras de error indican la desviación estándar. La barra de escala representa 5 cm. Haga clic aquí para ver una versión más grande de esta figura.
Los valores se proporcionaron en unidades arbitrarias y mostraron una disminución significativa en los estados de malperfusión en comparación con el estado fisiológico de los órganos (Tabla 1). Los resultados hiperespectrales estuvieron en línea con publicaciones recientes que indican que la viabilidad y perfusión del tejido pueden evaluarse utilizando valores de corte HSI StO2 específicos de órgano que coinciden con los valores observados en este estudio14,15. Ejemplarmente para el estómago, fueron el 64,1% (±9,4%) para la perfusión fisiológica, el 43,1% (±7,4%) para la isquemia arterial, el 40,5% (±5,4%) para la congestión venosa y el 39,3% (±4,5%) para la malperfusión combinada.
Dado que estos fueron experimentos sin supervivencia, no hay datos experimentales sobre los resultados a largo plazo de los animales. Sin embargo, otros estudios informan de una supervivencia del 100% y del 57% durante 24 h en ratas que se sometieron a 30 min y 60 min de pinzamiento de la arteria mesentérica superior16,17 y lo correlacionan con éxito con los niveles séricos de proteína de choque térmico 70. En consecuencia, este podría ser un posible método para evaluar los resultados en futuros estudios de supervivencia según los diferentes tiempos de pinzamiento.
| parámetro | órgano | referencia | isquemia arterial | Congestión venosa | Malperfusión combinada |
| StO2 | estómago | 64,1% (±9,4%) | 43,1% (±7,4%) | 40,5% (±5,4%) | 39,3% (±4,5%) |
| intestino delgado | 78,4% (±5,1%) | 44,8% (±5,5%) | 38,0% (±7,9%) | 41,9% (±6,9%) | |
| colon | 74,6% (±5,0%) | 56,0% (±6,3%) | 51,3% (±4,1%) | 51,8% (±2,9%) | |
| hígado | 39,5% (±9,7%) | 16,9% (±2,6%) | 9,5% (±0,8%) | 9,3% (±1,1%) | |
| riñón | 71,0% (±3,8%) | 26,3% (±3,0%) | 18,6% (±2,5%) | 21,2% (±2,6%) | |
| NIR | estómago | 20,0% (±9,3%) | 8,3% (±6,7%) | 6,8% (±5,1%) | 7,5% (±8,1%) |
| intestino delgado | 38,6% (±17,4%) | 12,9% (±11,0%) | 6,3% (±6,5%) | 5,7% (±5,9%) | |
| colon | 12,6% (±13,7%) | 5,3% (±8,7%) | 3,8% (±7,5%) | 2,6% (±4,7%) | |
| hígado | 40,4% (±13,1%) | 0,3% (±0,7%) | 0,0% (±0,1%) | 0.0% (±0.0%) | |
| riñón | 10,4% (±5,2%) | 0.0% (±0.0%) | 0,0% (±0,1%) | 0.0% (±0.0%) |
Tabla 1: Parámetros tisulares. Valores de oxigenación y perfusión NIR de HIS StO2 en unidades arbitrarias en 5 órganos viscerales y 4 estados de perfusión diferentes.
Discusión
Si bien la enfermedad oclusiva arterial periférica (PAOD) por sí sola, como el representante más prominente de las condiciones de malperfusión tisular, ya tiene una prevalencia de alrededor del 7%, afectando a aproximadamente 8,5 millones de adultos solo en los Estados Unidos18, la malperfusión tisular en general es un mecanismo patológico relevante en la mayoría de las afecciones quirúrgicas y médicas. En consecuencia, los modelos animales apropiados y reproducibles son absolutamente necesarios para abordar nuevas preguntas de investigación en este campo.
Las tres situaciones dinámicas vasculares que requieren una investigación específica son la isquemia arterial, la congestión venosa y la malperfusión combinada. Al inducir isquemia arterial aislada, los científicos pueden delinear con precisión la progresión temporal y espacial de la hipoxia tisular, investigando las cascadas moleculares implicadas en la lesión por isquemia-reperfusión, la apoptosis celular y las respuestas inflamatorias. Al comprometer el drenaje venoso, una faceta de la patología vascular que a menudo se pasa por alto, los científicos pueden investigar la interacción entre las discrepancias entre el flujo de entrada y el flujo de salida venoso, arrojando luz sobre la fisiopatología de la trombosis venosa, el edema tisular relacionado con la congestión y la disfunción microcirculatoria. Al combinar estas dos situaciones patológicas, se puede investigar el entorno disérgico de la malperfusión combinada, reflejando la compleja fisiopatología encontrada en síndromes clínicos como la isquemia mesentérica aguda y la colitis isquémica.
Más allá de dilucidar los mecanismos fisiopatológicos fundamentales, la capacidad de inducir isquemia arterial visceral, congestión venosa y malperfusión combinada en ratas sirve como una plataforma indispensable para evaluar la eficacia de intervenciones farmacológicas, técnicas quirúrgicas, nuevas estrategias terapéuticas y modalidades de imagen innovadoras, especialmente como HSI 14,19,20,21,22 . Este modelo es, por lo tanto, un componente clave para proporcionar la información básica de los tejidos biológicos necesaria para aprovechar todo el potencial de la HSI en la evaluación de tejidos y la identificación de estados de perfusión. Al aprovechar esta configuración experimental, los investigadores pueden acelerar la traducción de los hallazgos preclínicos en estrategias clínicamente viables, reduciendo en última instancia la morbilidad y la mortalidad asociadas con diversos trastornos vasculares y de perfusión.
De manera ilustrativa, los investigadores pueden emplear este modelo para investigar la eficacia de agentes farmacológicos dirigidos a las vías de lesión por isquemia-reperfusión, como antioxidantes, agentes antiinflamatorios y vasodilatadores, delineando así su utilidad potencial en la práctica clínica23,24. Además, este modelo facilita la evaluación de nuevos abordajes quirúrgicos, como las técnicas de revascularización mesentérica y los procedimientos de descompresión venosa, proporcionando información valiosa sobre su viabilidad, seguridad y eficacia a largo plazo25,26.
Además, este marco experimental permite a los investigadores explorar la intrincada interacción entre la disfunción vascular y las comorbilidades sistémicas, como la diabetes, la hipertensión y la aterosclerosis, ilustrando así la intrincada red de vías fisiopatológicas interconectadas que orquestan la progresión de la enfermedad vascular27,28.
Si bien existen varias publicaciones sobre la malperfusión selectiva de órganos individuales, como el hígado 29,30,31 o el riñón, en ratas32,33, existe una falta de literatura científica que aborde la malperfusión de las vísceras completas en ratas, y no existe explícitamente un protocolo metódico. Esta es, por lo tanto, la afirmación de este manuscrito. Las limitaciones de la técnica presentada incluyen principalmente la invasividad del procedimiento y, dependiendo de la duración de la malperfusión, la trombosis orgánica consecutiva y la disfunción, que puede llevar a un sufrimiento postoperatorio por fallo multiorgánico o síndrome compartimental abdominal 34,35,36. Una planificación y un diseño cuidadosos, dependiendo de la pregunta de investigación, pueden ayudar a equilibrar la duración requerida de la malperfusión y sus consecuencias fisiopatológicas.
Al solucionar los problemas comunes encontrados durante el procedimiento, se debe prestar atención a los siguientes puntos y recomendaciones: (1) Garantizar una preparación minuciosa del equipo y la medicación de antemano para minimizar las interrupciones durante el procedimiento; (2) Realizar el control hemostático meticulosamente preparando y diseccionando cuidadosamente los planos avasculares. Considere el uso de pinzas hemostáticas bipolares para la hemostasia eléctrica, si está disponible; (3) Minimizar el trauma en los tejidos mediante el uso de instrumentos no traumáticos como hisopos de algodón humidificados o compresas quirúrgicas humidificadas con fórceps al entrar en contacto con el parénquima hepático; (4) Aproximadamente el 20% de los animales experimentaron sangrado difuso por parénquima hepático superficial debido a condiciones tisulares delicadas. Sin embargo, la hemorragia se detuvo en todos los casos con una ligera compresión y paciencia. Estas recomendaciones tienen como objetivo mejorar la eficiencia del procedimiento y minimizar las complicaciones durante la inducción de malperfusión en modelos de rata.
Al resecar el xifoides para mejorar el acceso a la vena cava, asegúrese de que el peritoneo dorsal a la transición entre el xifoides y el esternón quede intacto durante unos pocos milímetros. El sitio de resección del xifoides será duro y agudo, lo que puede causar un traumatismo en el parénquima hepático superficial. Por lo tanto, se recomienda movilizar caudalmente el peritoneo retroesternal con fórceps y envolver alrededor del muñón óseo de manera efectiva, cubriéndolo y sosteniendo la hemostasia. Los ganchos de preparación quirúrgica deben suturarse a través de la pared abdominal ventral craneal con tensión craneal para que la cobertura peritoneal del muñón xifoides permanezca en su lugar.
Al diseccionar el ligamento falciforme, se debe tener cuidado para evitar causar accidentalmente lesiones iatrogénicas en la vena hepática, ya que esto podría ser fatal para el animal. Debido al alto riesgo de sangrado durante la preparación vascular, se recomienda que la mayor parte de la preparación quirúrgica se realice extendiendo con pinzas romas, en lugar de usar instrumentos de disección afilados. Además, los bucles de los vasos de silicona deben humedecerse antes de su uso para reducir la fricción de la superficie y minimizar el riesgo de traumatismo tisular.
Al aplicar la pinza microvascular para aneurismas, es crucial visualizar la anatomía vascular exacta. Por ejemplo, la arteria celíaca se origina muy cranealmente desde la aorta abdominal. Si se desea la oclusión celíaca, como para investigar la malperfusión hepática, la arteria celíaca debe visualizarse en referencia a la aorta y al asa del vaso de silicona. Esto asegura que la arteria celíaca quede incluida en el tejido vascular pinzado (Figura 2V-Z). Hubo un caso en el que la pinza se colocó inicialmente caudal a la arteria celíaca por accidente. Sin embargo, esto se reconoció rápidamente debido a la falta de caída en los valores hepáticos de StO2, y se realizó con éxito la recuperación adecuada.
El paso de preparación más peligroso es el túnel de la vena cava. Este paso requiere movimientos suaves y paciencia, y las pinzas overholt solo deben extenderse cuando se esté seguro de que no hay contacto con la vena cava. Puede ser difícil juzgar esto, ya que la vena cava aparecerá como tejido conectivo avascular delgado cuando se aplique una ligera compresión, lo que hará que la sangre contenida desaparezca en ambas direcciones. También existe el riesgo de apertura pleural accidental y de creación de un neumotórax cuando se tuneliza la vena cava demasiado cranealmente. Esto puede ser una complicación grave y potencialmente mortal, especialmente porque el animal respira espontáneamente y no se pueden tomar medidas respiratorias invasivas. Se ha encontrado que es útil retraer ligeramente los instrumentos de preparación y continuar más caudalmente para evitar esta complicación. En los casos de neumotórax hemodinámicamente relevante y visible con abultamiento del diafragma hepático, se puede recomendar una punción transdiafragmática única y la aspiración del aire atrapado con una aguja de 30 G y una jeringa pequeña como estrategia de rescate. Esta técnica se empleó con éxito en un animal para salvarlo intraoperatoriamente.
Por último, se debe tener especial cuidado al aplicar las pinzas microvasculares para evitar incluir tejido conectivo circundante, lo que podría conducir a una oclusión insuficiente del vaso deseado.
Si bien este protocolo pretende ser una guía paso a paso para la malperfusión visceral global, el sitio de pinzamiento se puede ajustar de acuerdo con la pregunta de investigación específica debido a la amplia preparación y movilización vascular que se muestra en la Figura 1T-V. Por lo tanto, la malperfusión seleccionada de grupos de órganos o de órganos individuales también es una opción cuando se elige el sitio de pinzamiento más distalmente a lo largo del árbol vascular, como el pinzamiento selectivo del tronco celíaco para la isquemia hepática. Al ofrecer una metodología detallada y reproducible, este protocolo facilita un enfoque estandarizado para la isquemia arterial reversible controlada, la congestión venosa y la malperfusión combinada en modelos de ratas, lo que lleva a una mayor confiabilidad de los datos, solidez, independencia del investigador y comparabilidad entre futuros estudios con animales. En consecuencia, representa una herramienta indispensable dentro del arsenal de investigación biomédica, ya que ofrece información sobre la compleja interacción entre el compromiso vascular, la lesión tisular y las intervenciones terapéuticas. Al aprovechar la versatilidad de esta configuración experimental, los investigadores pueden investigar los misterios en torno a la fisiopatología vascular, forjando nuevas fronteras en la medicina traslacional y, en última instancia, mejorando los resultados de los pacientes en el ámbito de la salud vascular.
Divulgaciones
Ninguno.
Agradecimientos
Los autores agradecen el servicio de almacenamiento de datos SDS@hd apoyado por el Ministerio de Ciencia, Investigación y Artes de Baden-Württemberg (MWK) y la Fundación Alemana de Investigación (DFG) a través de las subvenciones INST 35/1314-1 FUGG e INST 35/1503-1 FUGG. Además, los autores agradecen el apoyo del NCT (Centro Nacional de Enfermedades Tumorales de Heidelberg, Alemania) a través de su programa estructurado de postdoctorado y el programa de Oncología Quirúrgica. También reconocemos el apoyo a través de fondos estatales aprobados por el Parlamento del Estado de Baden-Württemberg para la Alianza de Ciencias de la Vida + Salud del Campus de Innovación de Heidelberg Mannheim del programa postdoctoral estructurado para Alexander Studier-Fischer: Inteligencia Artificial en la Salud (AIH) - Una colaboración de DKFZ, EMBL, Universidad de Heidelberg, Hospital Universitario de Heidelberg, Hospital Universitario de Mannheim, Instituto Central de Salud Mental, y el Instituto Max Planck de Investigación Médica. Además, agradecemos el apoyo a través del Instituto de Cáncer DKFZ Hector en el Centro Médico Universitario de Mannheim. Para la tarifa de publicación, agradecemos el apoyo financiero de la Deutsche Forschungsgemeinschaft dentro del programa de financiación "Open Access Publikationskosten", así como de la Universidad de Heidelberg.
Materiales
| Name | Company | Catalog Number | Comments |
| Atraumatic preparation forceps | Aesculap | FB395R | DE BAKEY ATRAUMATA atraumatic forceps, straight |
| Blunt overholt clamp | Aesculap | BJ012R | BABY-MIXTER preparation and ligature clamp, bent, 180 mm |
| Cannula | BD (Beckton, Dickinson) | 301300 | BD Microlance 3 cannula 20 G |
| Fixation rods | legefirm | 500343896 | tuning forks used as y-shaped metal fixation rods |
| Heating pad | Royal Gardineer | IP67 | Royal Gardineer Heating Pad Size S, 20 Watt |
| Plastic perfusor tube | M. Schilling GmbH | S702NC150 | connecting tube COEX 150 cm |
| Preparation scissors | Aesculap | BC177R | JAMESON preparation scissors, bent, fine model, blunt/blunt, 150 mm (6") |
| Silicone vessel loop tie | SERAG WIESSNER | SL26 | silicone vessel loop tie 2,5 mm red |
| Spraque Dawley rat | Janvier Labs | RN-SD-M | Spraque Dawley rat |
| Steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
| Yasargil clip | Aesculap | FE795K | YASARGIL Aneurysm Clip System Phynox Temporary (Standard) Clip |
| Yasargil clip applicator | Aesculap | FE558K | YASARGIL Aneurysm Clip Applicator Phynox (Standard) |
Referencias
- Carden, D. L., Granger, D. N. Pathophysiology of ischemia-reperfusion injury. J Pathol. 190 (3), 255-266 (2000).
- Balkwill, F., Mantovani, A. Inflammation and cancer: Back to Virchow. Lancet. 357 (9255), 539-545 (2001).
- Cruz, R. J., Garrido, A. G., Ribeiro, C. M., Harada, T., Rocha-E-Silva, M. Regional blood flow distribution and oxygen metabolism during mesenteric ischemia and congestion. J Surg Res. 161 (1), 54-61 (2010).
- Leng, G. C., Davis, M., Baker, D. Bypass surgery for chronic lower limb ischemia. Cochrane Database Syst Rev. 3, Cd002000 (2000).
- Droc, I., Calinescu, F. B., Droc, G., Blaj, C., Dammrau, R. Aortic stenting. Minim Invasive Ther Allied Technol. 24 (5), 296-304 (2015).
- Le Gall, A., et al. Veno-arterial-ecmo in the intensive care unit: From technical aspects to clinical practice. Anaesth Crit Care Pain Med. 37 (3), 259-268 (2018).
- Napp, L. C., Kühn, C., Bauersachs, J. ECMO in cardiac arrest and cardiogenic. Herz. 42 (1), 27-44 (2017).
- Sousa Da Silva, R. X., Weber, A., Dutkowski, P., Clavien, P. A. Machine perfusion in liver transplantation. Hepatology. 76 (5), 1531-1549 (2022).
- Sen Gupta, A. Bio-inspired nanomedicine strategies for artificial blood components. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 9 (6), 1464 (2017).
- Lu, D., et al. Intramuscular microvascular flow sensing for flap monitoring in a porcine model of arterial and venous occlusion. J Reconstr Microsurg. 39 (3), 231-237 (2023).
- Nguyen, G. K., et al. Novel biomarkers of arterial and venous ischemia in microvascular flaps. PLoS One. 8 (8), e71628 (2013).
- Redlin, M., et al. How near-infrared spectroscopy differentiates between lower body ischemia due to arterial occlusion versus venous outflow obstruction. Ann Thorac Surg. 91 (4), 1274-1276 (2011).
- Studier-Fischer, A., et al. Endotracheal intubation via tracheotomy and subsequent thoracotomy in rats for non-survival applications. J Vis Exp. (205), e66684 (2024).
- Nickel, F., et al. Optimization of anastomotic technique and gastric conduit perfusion with hyperspectral imaging and machine learning in an experimental model for minimally invasive esophagectomy. Eur J Surg Oncol. , 106908 (2023).
- Barberio, M., et al. Quantitative fluorescence angiography versus hyperspectral imaging to assess bowel ischemia: A comparative study in enhanced reality. Surgery. 168 (1), 178-184 (2020).
- Doukas, P., et al. Onset of adverse abdominal events due to intestinal ischemia-reperfusion injury after aortic cross-clamping is associated with elevated hsp70 serum levels in the early postoperative phase. Int J Mol Sci. 23 (23), 15063 (2022).
- Mine, Y., et al. Heat shock protein 70 messenger RNA in rat leukocytes elevates after severe intestinal ischemia-reperfusion. J Surg Res. 242, 342-348 (2019).
- Criqui, M. H., et al. Lower extremity peripheral artery disease: Contemporary epidemiology, management gaps, and future directions: A scientific statement from the American Heart Association. Circulation. 144 (9), e171-e191 (2021).
- Seidlitz, S., et al. Robust deep learning-based semantic organ segmentation in hyperspectral images. Med Image Anal. 80, 102488 (2022).
- Studier-Fischer, A., et al. Icg-augmented hyperspectral imaging for visualization of intestinal perfusion compared to conventional icg fluorescence imaging: An experimental study. Int J Surg. 109 (12), 3883-3895 (2023).
- Studier-Fischer, A., et al. Heiporspectral - the heidelberg porcine hyperspectral imaging dataset of 20 physiological organs. Scientific Data. 10 (1), 414 (2023).
- Studier-Fischer, A., et al. Spectral organ fingerprints for machine learning-based intraoperative tissue classification with hyperspectral imaging in a porcine model. Sci Rep. 12 (1), 11028 (2022).
- Mallick, I. H., Yang, W., Winslet, M. C., Seifalian, A. M. Ischemia-reperfusion injury of the intestine and protective strategies against injury. Dig Dis Sci. 49 (9), 1359-1377 (2004).
- Malekinejad, Z., et al. Prazosin treatment protects brain and heart by diminishing oxidative stress and apoptotic pathways after renal ischemia-reperfusion. Drug Res (Stuttg). 72 (6), 336-342 (2022).
- Feldman, Z. M., et al. Inferior mesenteric artery revascularization can supplement salvage of mesenteric ischemia. J Vasc Surg Cases Innov Tech. 9 (3), 101041 (2023).
- Munley, J. A., et al. Chronic mesenteric ischemia-induced intestinal dysbiosis resolved after revascularization. J Vasc Surg Cases Innov Tech. 9 (2), 101084 (2023).
- Lejay, A., et al. Ischemia reperfusion injury, ischemic conditioning and diabetes mellitus. J Mol Cell Cardiol. 91, 11-22 (2016).
- Huang, D., et al. Macrovascular complications in patients with diabetes and prediabetes. Biomed Res Int. 2017, 7839101 (2017).
- Liu, A., et al. Hmgb1 in the ischemic and non-ischemic liver after selective warm ischemia/reperfusion in rats. Histochem Cell Biol. 135 (5), 443-452 (2011).
- Koc, S., Dogan, H. O., Karatas, O., Erdogan, M. M., Polat, V. Mitochondrial homeostasis and mast cells in experimental hepatic ischemia-reperfusion injury of rats. Turk J Gastroenterol. 33 (9), 777-784 (2022).
- Chu, M. J., Vather, R., Hickey, A. J., Phillips, A. R., Bartlett, A. S. Impact of ischaemic preconditioning on experimental steatotic livers following hepatic ischemia-reperfusion injury: A systematic review. HPB (Oxford). 17 (1), 1-10 (2015).
- Chang, M. W., et al. Sitagliptin protects rat kidneys from acute ischemia-reperfusion injury via upregulation of GLP-1 and GLP-1 receptors. Acta Pharmacol Sin. 36 (1), 119-130 (2015).
- Boys, J. A., Toledo, A. H., Anaya-Prado, R., Lopez-Neblina, F., Toledo-Pereyra, L. H. Effects of dantrolene on ischemia-reperfusion injury in animal models: A review of outcomes in heart, brain, liver, and kidney. J. Investig Med. 58 (7), 875-882 (2010).
- Orihashi, K. Mesenteric ischemia in acute aortic dissection. Surg Today. 46 (5), 509-516 (2016).
- Byard, R. W. Acute mesenteric ischemia and unexpected death. J Forensic Leg Med. 19 (4), 185-190 (2012).
- Łagosz, P., Sokolski, M., Biegus, J., Tycinska, A., Zymlinski, R. Elevated intra-abdominal pressure: A review of current knowledge. World J Clin Cases. 10 (10), 3005-3013 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados