Methods Article
Ischémie artérielle viscérale réversible contrôlée, congestion veineuse et malperfusion combinée par laparotomie médiane chez le rat
Dans cet article
Résumé
Cet article présente une procédure standardisée pour la malperfusion contrôlée et réversible des organes viscéraux dans des modèles de rats. L’objectif est d’induire ces états de malperfusion avec un haut degré de certitude méthodologique et de contrôle tout en maintenant la simplicité technique et la résilience aux erreurs.
Résumé
Outre la septicémie et la malignité, la malperfusion est la troisième cause de dégradation des tissus et un mécanisme pathologique majeur pour diverses conditions médicales et chirurgicales. Malgré des développements importants tels que le pontage, les procédures endovasculaires, l’oxygénation par membrane extracorporelle et les substituts sanguins artificiels, la malperfusion tissulaire, en particulier des organes viscéraux, reste un problème pressant dans les soins aux patients. La demande de recherches supplémentaires sur les processus biomédicaux et les interventions possibles est élevée. Des modèles biologiques valides sont de la plus haute importance pour permettre ce type de recherche. En raison des aspects multifactoriels de la recherche sur la perfusion tissulaire, qui incluent non seulement la biologie cellulaire, mais aussi la microanatomie vasculaire et la rhéologie, un modèle approprié nécessite un degré de complexité biologique que seul un modèle animal peut fournir, ce qui fait des rongeurs le modèle de choix évident. La malperfusion tissulaire peut être différenciée en trois conditions distinctes : (1) l’ischémie artérielle isolée, (2) la congestion veineuse isolée et (3) la malperfusion combinée. Cet article présente un protocole détaillé, étape par étape, pour l’induction contrôlée et réversible de ces trois types de malperfusion viscérale par laparotomie médiane et clampage de l’aorte abdominale et de la veine cave chez le rat, soulignant l’importance d’une méthodologie chirurgicale précise pour garantir des résultats uniformes et fiables. Parmi les principaux exemples d’applications possibles de ce modèle, citons le développement et la validation de modalités d’imagerie peropératoire innovantes, telles que l’imagerie hyperspectrale (HSI), pour visualiser objectivement et différencier la malperfusion des organes gastro-intestinaux, gynécologiques et urologiques.
Introduction
Bien que les implications de la privation de perfusion tissulaire sous la forme de malperfusions tissulaires locales ou systémiques soient reconnues depuis longtemps, elles persistent comme l’une des principales causes de morbidité et de mortalité aux États-Unis et en Europe1. Ces conditions de malperfusion sont la troisième cause de dégradation des tissus, après la malignité et l’inflammation septique, mais ont un spectre d’origines beaucoup plus large par rapport aux deux dernières2.
Ce spectre s’étend de mécanismes locaux tels que la fibrillation auriculaire avec occlusion thromboembolique, la vasoconstriction et la dissection iatrogène ou traumatique, à des mécanismes systémiques tels que l’insuffisance ou le choc cardiaque, la septicémie, l’hypovolémie et les phénomènes de vol. Ces divers mécanismes sous-tendent une variété de conditions médicales et chirurgicales. La morbidité et la mortalité importantes associées à ces affections ont orienté l’attention médicale vers les procédures visant à rétablir le flux sanguin vers les tissus malperfusés afin de prévenir la nécrose et de restaurer la fonction des organes au cours des décennies3.
Cet effort de recherche a abouti à une variété de solutions pharmaceutiques, médicales et chirurgicales pour restaurer la perfusion physiologique des organes, y compris des progrès dans la chirurgie de pontage4, les procédures endovasculaires5, l’oxygénation par membrane extracorporelle 6,7, la perfusion de machines d’organes lors de la transplantation8 et les substituts sanguins artificiels9.
Pourtant, malgré ces développements significatifs, la malperfusion, en particulier des organes viscéraux, reste un problème pressant dans les soins aux patients, et la demande de recherches supplémentaires sur les processus biomédicaux et les stratégies de sauvetage est élevée. Des modèles biologiques valides sont de la plus haute importance pour permettre ce type de recherche. En raison des aspects multifactoriels de la recherche sur la perfusion tissulaire, qui incluent non seulement la biologie cellulaire, mais aussi la microanatomie vasculaire et la rhéologie, un modèle approprié nécessite un degré de complexité biologique que seul un organisme modèle complet peut fournir, ce qui fait des rongeurs le modèle de choix évident.
La malperfusion tissulaire peut être différenciée en trois conditions distinctes : l’ischémie artérielle isolée, la congestion veineuse isolée et la malperfusion combinée10. Les scénarios cliniquement pertinents pour ces affections comprennent (1) l’ischémie artérielle : fibrillation auriculaire avec occlusion thromboembolique, embolie septique, vasoconstriction, dissection ou clampage vasculaire iatrogène ou traumatique, insuffisance ou choc cardiaque, dissection aortique, septicémie et hypovolémie, obstruction artérielle extrême due à une constriction externe, embolie artérielle pulmonaire, maladies oculaires artérielles chroniques ou phénomènes de vol ; (2) Congestion veineuse : dissection ou clampage vasculaire iatrogène ou traumatique, insuffisance cardiaque, fibrose hépatique ou cirrhose, obstruction veineuse due à une constriction externe, thrombose veineuse, insuffisance veineuse et syndrome de Budd-Chiari ; (3) Malperfusion combinée : Combinaisons des affections ci-dessus et des stades avancés des affections susmentionnées, telles que la congestion veineuse secondaire due à une fibrose induite par l’ischémie ou l’ischémie artérielle secondaire due à la rétention induite par la congestion, ainsi que des affections organiques spécifiques comme l’inflammation ischémique (par exemple, la colite ischémique)11,12.
Cet article vise donc à fournir un modèle étape par étape pour induire une ischémie artérielle viscérale contrôlée et réversible, une congestion veineuse et une malperfusion combinée par laparotomie médiane chez le rat pour des applications de survie et de non-survie, comme illustré à la figure 1. Le modèle expérimental offre un environnement contrôlé pour l’étude de la dynamique multidimensionnelle de l’ischémie artérielle, de la congestion veineuse et de leurs séquelles combinées, imitant des scénarios cliniquement pertinents rencontrés dans diverses conditions.
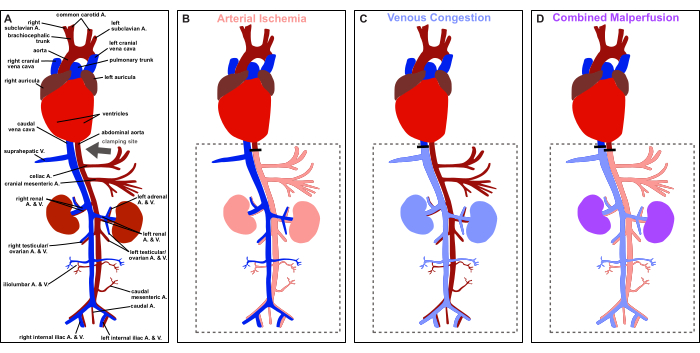
Figure 1 : Vue d’ensemble du protocole. Représentation schématique de l’anatomie vasculaire du rat et représentation du site de serrage (flèche grise). (A) Perfusion physiologique. (B) Ischémie artérielle. (C) la congestion veineuse. (D) Malperfusion combinée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
Toutes les activités animales décrites ici ont été menées dans des installations accréditées et approuvées par le Comité institutionnel de protection et d’utilisation des animaux (IACUC) du Conseil régional du Bade-Wurtemberg à Karlsruhe, en Allemagne (35-9185.81/G-62/23). Les animaux d’expérimentation ont été gérés conformément aux normes institutionnelles, aux lois allemandes sur l’utilisation et le soin des animaux, aux directives du Conseil de la Communauté européenne (2010/63/UE) et aux directives ARRIVE. Des rats Sprague Dawley mâles d’un poids de 400 grammes ont été utilisés après avoir été acclimatés pendant une semaine. Les détails des réactifs et de l’équipement utilisés dans cette étude sont énumérés dans la table des matériaux.
1. Anesthésie et analgésie
- Anesthésier le rat avec le médicament en suivant les protocoles de l’établissement. L’isoflurane est recommandé pour l’induction d’une sédation suivie d’une injection intraveineuse de 100 mg/kg de kétamine et de 4 mg/kg de xylazine en poids corporel. Une analgésie supplémentaire peut être obtenue avec une injection sous-cutanée de 5 mg/kg de carprofène de poids corporel. Pour plus de détails, veuillez vous référer à Studier-Fischer et al.13.
- Appliquez une pommade ophtalmique sur les yeux pour prévenir la sécheresse.
- Garantissez une profondeur d’analgésique appropriée à l’aide du test de pincement des orteils avec une pince chirurgicale.
- Réévaluez et ajustez régulièrement la profondeur de l’anesthésie pendant la chirurgie.
2. Préparation de la procédure
- Préparez la table de récurage avec tout le matériel et les instruments nécessaires, y compris les pinces microvasculaires amovibles et l’applicateur (figures 2A-C), la pince à émoussée, les ciseaux de préparation fine et les pinces.
- Préparez les crochets de préparation chirurgicale en pliant les canules à un angle de 135° à 1 cm par rapport à l’extrémité et reliez-les à des tubes de perfusion en plastique via Luer-lock, prêts à appliquer une tension à l’aide d’une pince anti-moustiques chirurgicale (Figure 2D,E).
- Préparez un appareil d’exposition chirurgicale pour rongeurs, y compris des tiges de fixation en forme de Y et un coussin chauffant, comme spécifié dans Studier-Fischer et al.13.
- Assurez-vous qu’une bonne oxygénation est obtenue en inhalant 100 % d’oxygène à l’aide d’un masque facial néonatal (figure 2F).
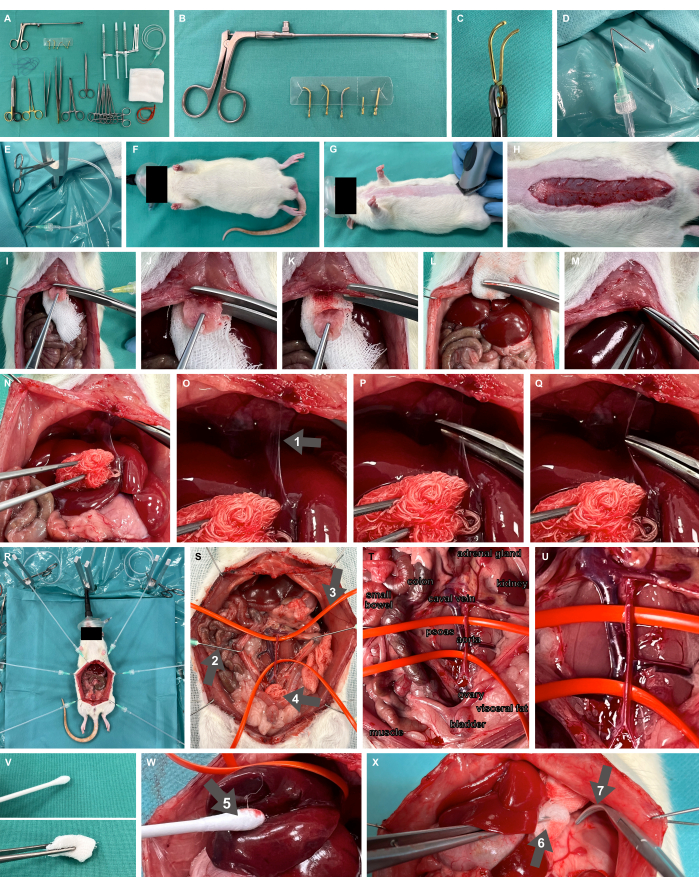
Figure 2 : Dispositif expérimental et animal. (A) Instruments et matériaux chirurgicaux nécessaires. (B, C) Pince microvasculaire et applicateur amovibles. (D, E) Une canule pliée reliée à un tube de perfusion sert de crochet de préparation chirurgicale. (F,G) Modèle de rat oxygéné avec un masque facial et rasé. (H) Incision cutanée sur toute la longueur abdominale. (I-M) résection de la xiphoïde et hémostase. (N-Q) Mobilisation hépatique et dissection du ligament falciforme (flèche 1). (R) Application de crochets de préparation et de supports métalliques pour l’exposition des organes après laparotomie. (S) Exposition viscérale complète des principaux vaisseaux abdominaux à l’aide de crochets émoussés (flèche 2), de boucles vasculaires en silicone (flèche 3) et d’une compresse chirurgicale (flèche 4). (T,U) Aorte abdominale et veine cavale. (V) Instruments de préparation atraumatique. (W) Tampon de coton humidifié (flèche 5). (X) Compresse humidifiée à l’aide d’une pince (flèche 6) et de pinces à émoussé (flèche 7). Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Préparation chirurgicale
- Rasez le site d’accès chirurgical pour une laparotomie médiane (Figure 2G). Effectuez une incision cutanée sur la longueur abdominale souhaitée, c’est-à-dire environ 7 cm (Figure 2H), avancez avec la laparotomie en disséquant le fascia et cousez les crochets de préparation chirurgicale avec des tubes en plastique attachés et des pinces anti-moustiques chirurgicales à travers la peau. Exposez le situs chirurgical à l’aide des crochets de préparation chirurgicale, en appliquant une tension sur le tissu.
- Assurez-vous que le péritoine est disséqué crânien uniquement jusqu’à quelques millimètres sous le début du sternum, en laissant une partie du péritoine intacte. Placez une partie d’une compresse chirurgicale sous le sternum (Figure 2I) et réséquez le xiphoïde avec des ciseaux à matériau puissant. Appliquez une pression sur la zone de résection à l’aide de la compresse chirurgicale pour obtenir une hémostase suffisante de cette région bien irriguée (Figure 2I-M).
- Mobiliser le foie dorso-caudalement pour exposer le ligament falciforme (Figure 2N) et disséquer le ligament (Figure 2O-Q).
- Pour le contrôle hémostatique, en fonction de l’endroit où le clampage des principaux vaisseaux doit être effectué, effectuez une exposition viscérale complète des principaux vaisseaux abdominaux (Figure 2R) et des vaisseaux suspendus avec des boucles de vaisseaux en silicone (Figure 2S-U). Seuls des instruments de préparation atraumatique doivent être utilisés (figure 2V), tels que des tampons de coton humidifiés (figure 2W), des compresses humidifiées dans des pinces et des pinces à surplomb émoussées (figure 2X).
4. Préparation et clampage de l’aorte abdominale pour l’ischémie artérielle
- Effectuer une médialisation gauche des organes abdominaux supérieurs à l’aide d’instruments de préparation atraumatique pour accéder à l’artère surrénale gauche (Figure 3A-D).
- Identifiez le site pulsatoire généralement médial à l’extension crânienne de l’artère surrénale gauche, indiquant le trajet de l’aorte (Figure 3E). Avancez à travers les tissus mous à l’aide de pinces superposées pour une dissection contondante afin d’accéder à l’aorte abdominale (figures 3F, G).
- Creusez un tunnel dans l’aorte abdominale à l’extrémité la plus crânienne à l’aide de pinces émoussées (figure 3H-L) et élinguez l’aorte à l’aide d’une boucle vasculaire en silicone (figure 3M-T).
- Appliquez une pince microvasculaire d’anévrisme appropriée à l’aide de la boucle en silicone pour luxer légèrement l’aorte ventralement et guidez la pince microvasculaire d’anévrisme le long de la boucle en silicone pour garantir un clampage aortique isolé (Figure 3U). En fonction de la question de recherche, la pince microvasculaire peut être relâchée.
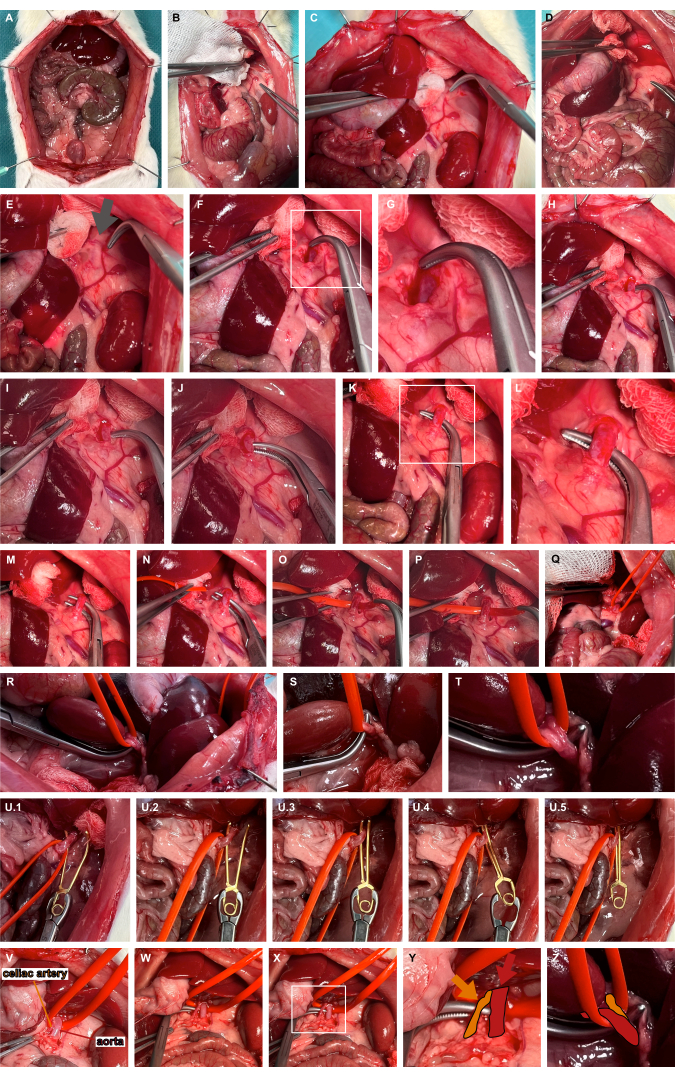
Figure 3 : Préparation et clampage de l’aorte abdominale. (A) Exposition des organes viscéraux. (B-E) Medialisation gauche des organes abdominaux supérieurs à l’aide d’instruments de préparation atraumatique pour accéder à l’artère surrénale gauche. (F,G) Dissection contondante médiale de l’artère surrénale gauche au site pulsant (flèche grise) afin d’accéder à l’aorte abdominale. (H-L) Tunnellisation de l’aorte abdominale à l’aide de pinces émoussées. (M-T) Élingage de l’aorte à l’aide d’une boucle vasculaire en silicone. (U) Application d’une pince microvasculaire d’anévrisme amovible en utilisant la boucle en silicone comme guide. (V-Z) Visualisation de l’artère cœliaque (orange) en référence à l’aorte (rouge) et à l’anse du vaisseau en silicone. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Préparation et clampage de la veine cave abdominale sus-hépatique pour la congestion veineuse
- Mobiliser le foie vers la droite à l’aide d’instruments de préparation atraumatique, disséquer nettement les ligaments hépatiques et latéraliser davantage le foie (Figure 4A-C).
- Ouvrez l’espace rétrohépatique au niveau de la partie gauche du diaphragme à l’aide de pinces à émoussé (Figure 4D-G).
- Creusez un tunnel dans la veine cave à l’aide de pinces émoussées (figure 4H-K) et élinguez la veine cave à l’aide de boucles vasculaires en silicone (figure 4L-O).
- Appliquer une pince microvasculaire d’anévrisme appropriée à l’aide de la boucle en silicone pour luxer légèrement la veine cave ventralement et guider la pince microvasculaire d’anévrisme le long de la boucle en silicone pour garantir un clampage isolé de la veine cave (Figure 4R).
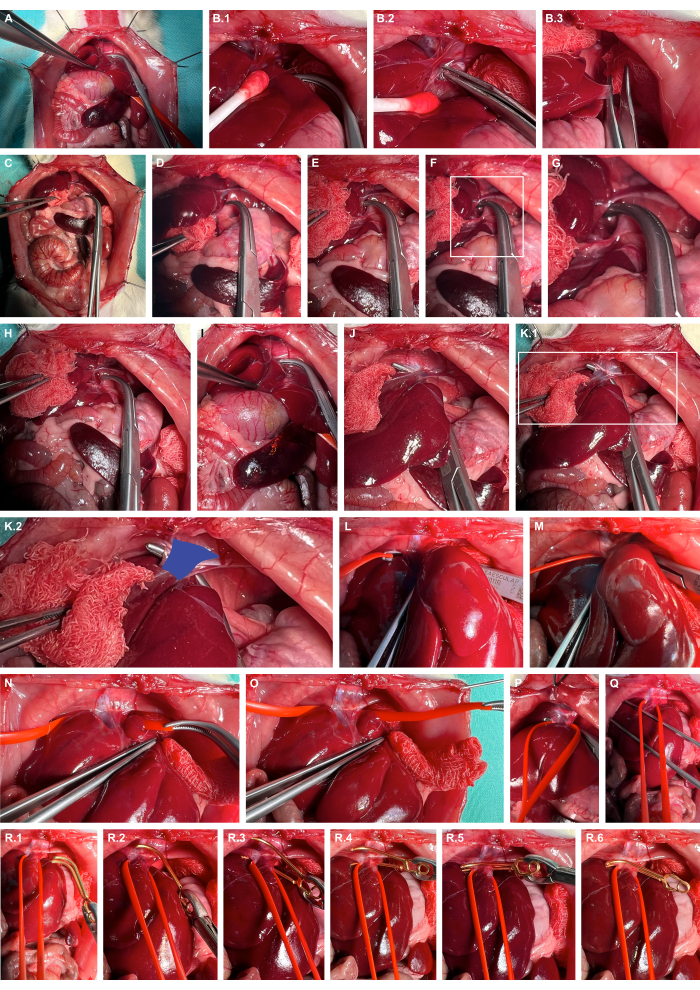
Figure 4 : Préparation et clampage de la veine cave abdominale sus-hépatique. (A) Exposition des organes viscéraux crâniens. (B) Mobilisation protectrice tissulaire du foie et dissection nette des ligaments hépatiques à l’aide d’instruments de préparation atraumatique. (C) Latéralisation du foie. (D-G) L’ouverture de l’espace rétrohépatique et la préparation au niveau des crus gauches du diaphragme. (H-K) Creusement tunnel de la veine cave (bleu) à l’aide de pinces à overholt émoussées. (De gauche à droite) Élingage de la veine cave à l’aide de boucles vasculaires en silicone. (P,Q) Exercice de la tension pour restreindre provisoirement le flux sanguin caveal. (R) Application d’une pince microvasculaire d’anévrisme amovible en utilisant la boucle en silicone comme guide. Veuillez cliquer ici pour voir une version agrandie de cette figure.
6. Clampage de l’aorte abdominale et de la veine cave abdominale suprahépatique pour malperfusion combinée
- Effectuez les étapes ci-dessus jusqu’à ce que l’aorte et la veine cave soient suspendues avec des boucles de vaisseau en silicone. Passez à l’application de la pince microvasculaire d’anévrisme pour les deux vaisseaux, à nouveau en utilisant la boucle en silicone pour le guidage. Il est recommandé de serrer d’abord l’aorte et de minimiser le temps nécessaire jusqu’au serrage ultérieur de la cavité à seulement quelques secondes.
REMARQUE : Selon le scénario souhaité et l’objectif de la recherche, la malperfusion peut être poursuivie ou libérée après une période de temps définie, et les animaux peuvent soit être euthanasiés par cardectomie tranchante (selon les protocoles approuvés par l’institution) pour des applications non de survie, soit recevoir une fermeture abdominale progressive à l’aide de sutures chirurgicales en cas de suivis planifiés et d’expériences de survie. Pour la présente étude, les animaux ont été euthanasiés.
Résultats
Ce protocole a été réalisé chez 10 rats mâles (poids moyen 403 g ± 26 g) dans un contexte de non-survie. Le taux de réussite a été défini par la survie plus de 20 minutes après le clampage artériel, le clampage veineux et le clampage combiné pendant 5 min avec 10 min de reperfusion, chacun étant de 100 %. La durée moyenne de la préparation, de l’incision cutanée jusqu’à ce que les deux vaisseaux soient suspendus avec des boucles en silicone, était de 11 min 45 s ± 3 min 23 s.
Pour valider les 4 états de malperfusion différents, les paramètres d’indice d’oxygénation (StO2) et de perfusion (NIR) ont été mesurés à l’aide de l’imagerie hyperspectrale (HSI) sur 5 organes viscéraux (Figure 5).
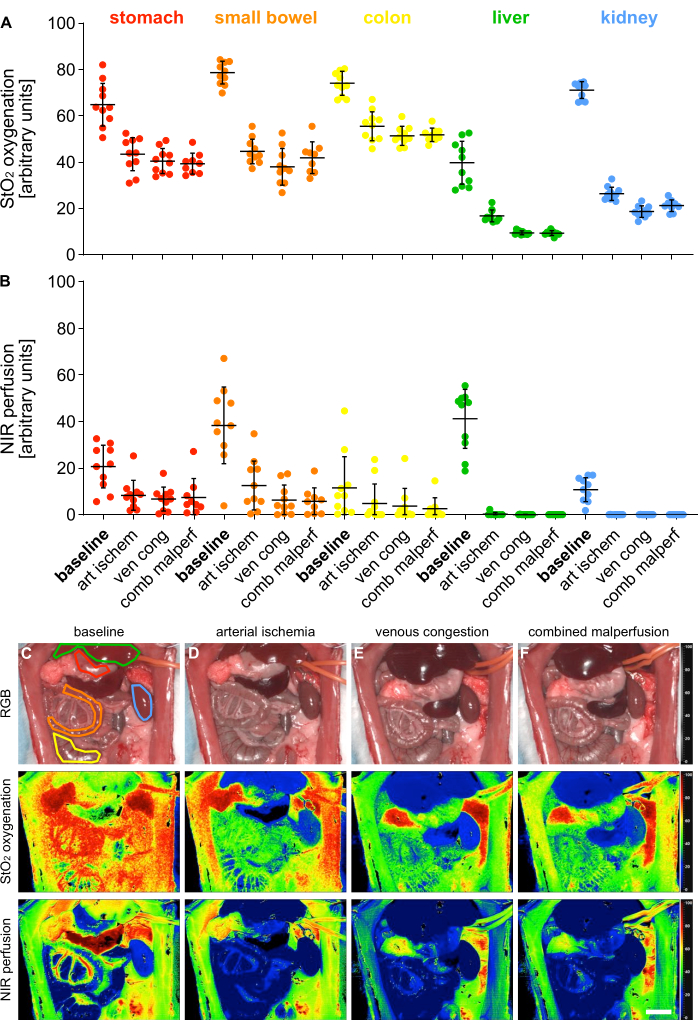
Figure 5 : Validation du modèle de malperfusion. (A,B) Quantification des valeurs d’oxygénation et de perfusion HSI à travers quatre états de perfusion différents et cinq organes viscéraux différents avec n = 10 animaux. (C-F) Images d’index RVB et à code couleur des enregistrements HSI contenant des organes viscéraux dans 4 états de perfusion différents. Les barres d’erreur indiquent l’écart-type. La barre d’échelle représente 5 cm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les valeurs ont été fournies en unités arbitraires et ont montré une diminution significative des états de malperfusion par rapport à l’état physiologique des organes (tableau 1). Les résultats hyperspectraux étaient conformes aux publications récentes indiquant que la viabilité et la perfusion des tissus peuvent être évaluées à l’aide de valeurs seuils HSI StO2 spécifiques à un organe qui correspondaient aux valeurs observées dans cette étude14,15. De manière exemplaire pour l’estomac, il s’agissait de 64,1 % (±9,4 %) pour la perfusion physiologique, 43,1 % (±7,4 %) pour l’ischémie artérielle, 40,5 % (±5,4 %) pour la congestion veineuse et 39,3 % (±4,5 %) pour la malperfusion combinée.
Comme il s’agissait d’expériences de non-survie, il n’existe pas de données expérimentales sur les résultats à long terme des animaux. Cependant, d’autres études rapportent une survie de 100% et 57% sur 24 heures pour des rats qui ont subi 30 minutes et 60 minutes de clampage supérieur de l’artère mésentérique16,17 et l’ont corrélé avec succès avec les niveaux sériques de Heat Shock Protein 70. Par conséquent, il pourrait s’agir d’une méthode possible pour évaluer les résultats dans les futures études de survie en fonction de différents temps de serrage.
| paramètre | organe | ligne de base | ischémie artérielle | congestion veineuse | Malperfusion combinée |
| StO2 | estomac | 64,1 % (±9,4 %) | 43,1 % (±7,4 %) | 40,5 % (±5,4 %) | 39,3 % (±4,5 %) |
| intestin grêle | 78,4 % (±5,1 %) | 44,8 % (±5,5 %) | 38,0 % (±7,9 %) | 41,9 % (±6,9 %) | |
| côlon | 74,6 % (±5,0 %) | 56,0 % (±6,3 %) | 51,3 % (±4,1 %) | 51,8 % (±2,9 %) | |
| foie | 39,5 % (±9,7 %) | 16,9 % (±2,6 %) | 9,5 % (±0,8 %) | 9,3 % (±1,1 %) | |
| rein | 71,0 % (±3,8 %) | 26,3 % (±3,0 %) | 18,6 % (±2,5 %) | 21,2 % (±2,6 %) | |
| NIR | estomac | 20,0 % (±9,3 %) | 8,3 % (±6,7 %) | 6,8 % (±5,1 %) | 7,5 % (±8,1 %) |
| intestin grêle | 38,6 % (±17,4 %) | 12,9 % (±11,0 %) | 6,3 % (±6,5 %) | 5,7 % (±5,9 %) | |
| côlon | 12,6 % (±13,7 %) | 5,3 % (±8,7 %) | 3,8 % (±7,5 %) | 2,6 % (±4,7 %) | |
| foie | 40,4 % (±13,1 %) | 0,3 % (±0,7 %) | 0,0 % (±0,1 %) | 0,0 % (±0,0 %) | |
| rein | 10,4 % (±5,2 %) | 0,0 % (±0,0 %) | 0,0 % (±0,1 %) | 0,0 % (±0,0 %) |
Tableau 1 : Paramètres tissulaires. Valeurs d’oxygénation et de perfusion NIR de HIS StO2 en unités arbitraires dans 5 organes viscéraux et 4 états de perfusion différents.
Discussion
Alors que la maladie occlusive artérielle périphérique (AOMI) à elle seule, en tant que représentant le plus important des conditions de malperfusion tissulaire, a déjà une prévalence d’environ 7%, affectant environ 8,5 millions d’adultes rien qu’aux États-Unis18, la malperfusion tissulaire en général est un mécanisme pathologique pertinent dans la majorité des conditions chirurgicales et médicales. Par conséquent, des modèles animaux appropriés et reproductibles sont absolument nécessaires pour répondre à de nouvelles questions de recherche dans ce domaine.
Les trois situations dynamiques vasculaires qui nécessitent une investigation distincte sont l’ischémie artérielle, la congestion veineuse et la malperfusion combinée. En induisant une ischémie artérielle isolée, les scientifiques peuvent délimiter avec précision la progression temporelle et spatiale de l’hypoxie tissulaire, en étudiant les cascades moléculaires impliquées dans les lésions d’ischémie-reperfusion, l’apoptose cellulaire et les réponses inflammatoires. En compromettant le drainage veineux, une facette souvent négligée de la pathologie vasculaire, les scientifiques peuvent étudier l’interaction entre les écarts d’entrée et de sortie artérielles, mettant en lumière la physiopathologie de la thrombose veineuse, de l’œdème tissulaire lié à la congestion et du dysfonctionnement microcirculatoire. En combinant ces deux situations pathologiques, on peut étudier le milieu dys-synergique de la malperfusion combinée, reflétant la physiopathologie complexe rencontrée dans les syndromes cliniques tels que l’ischémie mésentérique aiguë et la colite ischémique.
Au-delà de l’élucidation des mécanismes physiopathologiques fondamentaux, la capacité d’induire une ischémie artérielle viscérale, une congestion veineuse et une malperfusion combinée chez le rat constitue une plate-forme indispensable pour évaluer l’efficacité des interventions pharmacologiques, des techniques chirurgicales, des nouvelles stratégies thérapeutiques et des modalités d’imagerie innovantes, en particulier telles que HSI 14,19,20,21,22. Ce modèle est donc un élément clé pour fournir la vérité de terrain sur les tissus biologiques nécessaire pour exploiter le plein potentiel de l’IHH dans l’évaluation des tissus et l’identification des états de perfusion. En tirant parti de ce dispositif expérimental, les chercheurs peuvent accélérer la traduction des résultats précliniques en stratégies cliniquement viables, réduisant ainsi la morbidité et la mortalité associées à divers troubles vasculaires et de perfusion.
À titre d’illustration, les chercheurs peuvent utiliser ce modèle pour étudier l’efficacité d’agents pharmacologiques ciblant les voies de lésion d’ischémie-reperfusion, tels que les antioxydants, les agents anti-inflammatoires et les vasodilatateurs, délimitant ainsi leur utilité potentielle dans la pratique clinique23,24. De plus, ce modèle facilite l’évaluation de nouvelles approches chirurgicales, telles que les techniques de revascularisation mésentérique et les procédures de décompression veineuse, fournissant des informations inestimables sur leur faisabilité, leur innocuité et leur efficacité à long terme25,26.
De plus, ce cadre expérimental permet aux chercheurs d’explorer l’interaction complexe entre le dysfonctionnement vasculaire et les comorbidités systémiques, telles que le diabète, l’hypertension et l’athérosclérose, illustrant ainsi le réseau complexe de voies physiopathologiques interconnectées orchestrant la progression de la maladie vasculaire27,28.
Bien qu’il existe plusieurs publications sur la malperfusion sélective d’organes uniques, tels que le foie 29,30,31 ou les reins, chez le rat 32,33, il y a un manque de littérature scientifique traitant de la malperfusion des viscères complets chez le rat, et il n’y a explicitement aucun protocole méthodique. C’est donc l’affirmation de ce manuscrit. Les limites de la technique présentée comprennent principalement le caractère invasif de la procédure et, en fonction de la durée de la malperfusion, une thrombose organique consécutive et un dysfonctionnement, pouvant entraîner des souffrances postopératoires par défaillance multiviscérale ou syndrome des loges abdominaux 34,35,36. Une planification et une conception minutieuses, en fonction de la question de recherche, peuvent aider à équilibrer la durée requise de la malperfusion et ses conséquences physiopathologiques.
Lors du dépannage des problèmes courants rencontrés pendant l’intervention, il faut attirer l’attention sur les points et les recommandations suivants : (1) Assurer une préparation minutieuse de l’équipement et des médicaments à l’avance afin de minimiser les interruptions pendant l’intervention ; (2) Effectuer méticuleusement le contrôle hémostatique en préparant et en disséquant soigneusement les plans avasculaires. Envisagez d’utiliser une pince hémostatique bipolaire pour l’hémostase électrique, si disponible ; (3) Minimiser les traumatismes aux tissus en utilisant des instruments non traumatiques tels que des cotons-tiges humidifiés ou des compresses chirurgicales humidifiées avec des pinces lors du contact avec le parenchyme hépatique ; (4) Environ 20 % des animaux ont présenté une hémorragie superficielle diffuse du parenchyme hépatique en raison d’affections tissulaires délicates. Cependant, l’hémorragie s’est arrêtée dans tous les cas avec une légère compression et de la patience. Ces recommandations visent à améliorer l’efficacité de la procédure et à minimiser les complications lors de l’induction de la malperfusion chez les modèles de rats.
Lors de la résection du xiphoïde pour un meilleur accès à la veine cave, assurez-vous que le péritoine dorsal à la transition entre le xiphoïde et le sternum est laissé intact sur quelques millimètres. Le site de résection du xiphoïde sera dur et tranchant, causant potentiellement un traumatisme au parenchyme hépatique superficiel. Par conséquent, il est recommandé de mobiliser le péritoine rétrosternal caudalement à l’aide d’une pince et de l’enrouler efficacement autour du moignon osseux, en le couvrant et en soutenant l’hémostase. Les crochets de préparation chirurgicale doivent être cousus à travers la paroi abdominale ventrale crânienne avec une tension crânienne afin que la couverture péritonéale du moignon xiphoïde reste en place.
Lors de la dissection du ligament falciforme, il faut prendre soin d’éviter de causer accidentellement des lésions iatrogènes à la veine hépatique, car cela pourrait être fatal à l’animal. En raison du risque élevé de saignement pendant la préparation vasculaire, il est recommandé que la majorité de la préparation chirurgicale soit effectuée en étalant avec des pinces émoussées, plutôt qu’en utilisant des instruments de dissection tranchants. De plus, les boucles des vaisseaux en silicone doivent être humidifiées avant l’utilisation afin de réduire la friction de surface et de minimiser le risque de traumatisme tissulaire.
Lors de l’application de la pince microvasculaire d’anévrisme, il est crucial de visualiser l’anatomie vasculaire exacte. Par exemple, l’artère cœliaque prend naissance de manière très crânienne à partir de l’aorte abdominale. Si une occlusion cœliaque est souhaitée, par exemple pour étudier une malperfusion hépatique, l’artère cœliaque doit être visualisée en référence à l’aorte et à la boucle du vaisseau en silicone. Cela permet de s’assurer que l’artère cœliaque est incluse dans le tissu vasculaire clampé (Figure 2V-Z). Il y a eu un cas dans lequel la pince a d’abord été placée caudale à l’artère cœliaque par accident. Cependant, cela a été rapidement reconnu en raison de la baisse manquante des valeurs hépatiques de StO2, et un reclampage approprié a été effectué avec succès.
L’étape de préparation la plus dangereuse est le creusement d’un tunnel dans la veine cavale. Cette étape nécessite des mouvements doux et de la patience, et les pinces de recouvrement ne doivent être écartées que lorsqu’il est certain qu’il n’y a pas de contact avec la veine cavale. Il peut être difficile d’en juger, car la veine cave apparaîtra comme un mince tissu conjonctif avasculaire lorsqu’une légère compression est appliquée, ce qui fera disparaître le sang contenu dans les deux sens. Il existe également un risque d’ouverture pleurale accidentelle et de création d’un pneumothorax en creusant un tunnel trop profond dans la veine cave. Il peut s’agir d’une complication grave et potentiellement mortelle, d’autant plus que l’animal respire spontanément et qu’aucune mesure respiratoire invasive ne peut être prise. Il s’est avéré utile de rétracter légèrement les instruments de préparation et de continuer plus caudalement pour éviter cette complication. Dans les cas de pneumothorax hémodynamiquement pertinent et visible avec gonflement du diaphragme hépatique, une ponction transdiaphragmatique unique et une aspiration de l’air emprisonné à l’aide d’une aiguille de 30 G et d’une petite seringue peuvent être recommandées comme stratégie de sauvetage. Cette technique a été utilisée avec succès chez un animal pour le sauver en peropératoire.
Enfin, des précautions particulières doivent être prises lors de l’application des pinces microvasculaires pour éviter d’inclure le tissu conjonctif environnant, ce qui pourrait entraîner une occlusion insuffisante du vaisseau souhaité.
Bien que ce protocole soit conçu comme un guide étape par étape pour la malperfusion viscérale globale, le site de clampage peut être ajusté en fonction de la question de recherche spécifique en raison de la préparation et de la mobilisation vasculaires étendues décrites dans la figure 1T-V. Par conséquent, la malperfusion sélectionnée de groupes d’organes ou d’organes uniques est également une option lors du choix du site de clampage plus distal le long de l’arbre vasculaire, comme le clampage sélectif du tronc cœliaque pour l’ischémie hépatique. En offrant une méthodologie détaillée et reproductible, ce protocole facilite une approche standardisée de l’ischémie artérielle réversible contrôlée, de la congestion veineuse et de la malperfusion combinée dans des modèles de rats, ce qui permet d’améliorer la fiabilité des données, la robustesse, l’indépendance des chercheurs et la comparabilité entre les futures études animales. Par conséquent, il représente un outil indispensable au sein de l’arsenal de recherche biomédicale, offrant un aperçu de l’interaction complexe entre l’atteinte vasculaire, les lésions tissulaires et les interventions thérapeutiques. En exploitant la polyvalence de ce dispositif expérimental, les chercheurs peuvent étudier les mystères de la physiopathologie vasculaire, forger de nouvelles frontières en médecine translationnelle et, en fin de compte, améliorer les résultats des patients dans le domaine de la santé vasculaire.
Déclarations de divulgation
Aucun.
Remerciements
Les auteurs remercient le service de stockage de données SDS@hd soutenu par le ministère des Sciences, de la Recherche et des Arts du Bade-Wurtemberg (MWK) et la Fondation allemande pour la recherche (DFG) par le biais des subventions INST 35/1314-1 FUGG et INST 35/1503-1 FUGG. De plus, les auteurs remercient le NCT (National Center for Tumor Diseases à Heidelberg, en Allemagne) pour son soutien par le biais de son programme postdoctoral structuré et du programme d’oncologie chirurgicale. Nous saluons également le soutien par le biais de fonds publics approuvés par le Parlement du Land de Bade-Wurtemberg à l’Innovation Campus Health + Life Science Alliance Heidelberg Mannheim dans le cadre du programme postdoctoral structuré d’Alexander Studier-Fischer : Intelligence artificielle dans la santé (AIH) - Une collaboration entre DKFZ, EMBL, Université de Heidelberg, Hôpital universitaire de Heidelberg, Hôpital universitaire de Mannheim, Institut central de santé mentale, et l’Institut Max Planck de recherche médicale. De plus, nous reconnaissons le soutien de l’Institut du cancer DKFZ Hector du Centre médical universitaire de Mannheim. Pour les frais de publication, nous reconnaissons le soutien financier de la Deutsche Forschungsgemeinschaft dans le cadre du programme d’encouragement « Open Access Publikationskosten » ainsi que de l’Université de Heidelberg.
matériels
| Name | Company | Catalog Number | Comments |
| Atraumatic preparation forceps | Aesculap | FB395R | DE BAKEY ATRAUMATA atraumatic forceps, straight |
| Blunt overholt clamp | Aesculap | BJ012R | BABY-MIXTER preparation and ligature clamp, bent, 180 mm |
| Cannula | BD (Beckton, Dickinson) | 301300 | BD Microlance 3 cannula 20 G |
| Fixation rods | legefirm | 500343896 | tuning forks used as y-shaped metal fixation rods |
| Heating pad | Royal Gardineer | IP67 | Royal Gardineer Heating Pad Size S, 20 Watt |
| Plastic perfusor tube | M. Schilling GmbH | S702NC150 | connecting tube COEX 150 cm |
| Preparation scissors | Aesculap | BC177R | JAMESON preparation scissors, bent, fine model, blunt/blunt, 150 mm (6") |
| Silicone vessel loop tie | SERAG WIESSNER | SL26 | silicone vessel loop tie 2,5 mm red |
| Spraque Dawley rat | Janvier Labs | RN-SD-M | Spraque Dawley rat |
| Steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
| Yasargil clip | Aesculap | FE795K | YASARGIL Aneurysm Clip System Phynox Temporary (Standard) Clip |
| Yasargil clip applicator | Aesculap | FE558K | YASARGIL Aneurysm Clip Applicator Phynox (Standard) |
Références
- Carden, D. L., Granger, D. N. Pathophysiology of ischemia-reperfusion injury. J Pathol. 190 (3), 255-266 (2000).
- Balkwill, F., Mantovani, A. Inflammation and cancer: Back to Virchow. Lancet. 357 (9255), 539-545 (2001).
- Cruz, R. J., Garrido, A. G., Ribeiro, C. M., Harada, T., Rocha-E-Silva, M. Regional blood flow distribution and oxygen metabolism during mesenteric ischemia and congestion. J Surg Res. 161 (1), 54-61 (2010).
- Leng, G. C., Davis, M., Baker, D. Bypass surgery for chronic lower limb ischemia. Cochrane Database Syst Rev. 3, Cd002000 (2000).
- Droc, I., Calinescu, F. B., Droc, G., Blaj, C., Dammrau, R. Aortic stenting. Minim Invasive Ther Allied Technol. 24 (5), 296-304 (2015).
- Le Gall, A., et al. Veno-arterial-ecmo in the intensive care unit: From technical aspects to clinical practice. Anaesth Crit Care Pain Med. 37 (3), 259-268 (2018).
- Napp, L. C., Kühn, C., Bauersachs, J. ECMO in cardiac arrest and cardiogenic. Herz. 42 (1), 27-44 (2017).
- Sousa Da Silva, R. X., Weber, A., Dutkowski, P., Clavien, P. A. Machine perfusion in liver transplantation. Hepatology. 76 (5), 1531-1549 (2022).
- Sen Gupta, A. Bio-inspired nanomedicine strategies for artificial blood components. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 9 (6), 1464 (2017).
- Lu, D., et al. Intramuscular microvascular flow sensing for flap monitoring in a porcine model of arterial and venous occlusion. J Reconstr Microsurg. 39 (3), 231-237 (2023).
- Nguyen, G. K., et al. Novel biomarkers of arterial and venous ischemia in microvascular flaps. PLoS One. 8 (8), e71628 (2013).
- Redlin, M., et al. How near-infrared spectroscopy differentiates between lower body ischemia due to arterial occlusion versus venous outflow obstruction. Ann Thorac Surg. 91 (4), 1274-1276 (2011).
- Studier-Fischer, A., et al. Endotracheal intubation via tracheotomy and subsequent thoracotomy in rats for non-survival applications. J Vis Exp. (205), e66684 (2024).
- Nickel, F., et al. Optimization of anastomotic technique and gastric conduit perfusion with hyperspectral imaging and machine learning in an experimental model for minimally invasive esophagectomy. Eur J Surg Oncol. , 106908 (2023).
- Barberio, M., et al. Quantitative fluorescence angiography versus hyperspectral imaging to assess bowel ischemia: A comparative study in enhanced reality. Surgery. 168 (1), 178-184 (2020).
- Doukas, P., et al. Onset of adverse abdominal events due to intestinal ischemia-reperfusion injury after aortic cross-clamping is associated with elevated hsp70 serum levels in the early postoperative phase. Int J Mol Sci. 23 (23), 15063 (2022).
- Mine, Y., et al. Heat shock protein 70 messenger RNA in rat leukocytes elevates after severe intestinal ischemia-reperfusion. J Surg Res. 242, 342-348 (2019).
- Criqui, M. H., et al. Lower extremity peripheral artery disease: Contemporary epidemiology, management gaps, and future directions: A scientific statement from the American Heart Association. Circulation. 144 (9), e171-e191 (2021).
- Seidlitz, S., et al. Robust deep learning-based semantic organ segmentation in hyperspectral images. Med Image Anal. 80, 102488 (2022).
- Studier-Fischer, A., et al. Icg-augmented hyperspectral imaging for visualization of intestinal perfusion compared to conventional icg fluorescence imaging: An experimental study. Int J Surg. 109 (12), 3883-3895 (2023).
- Studier-Fischer, A., et al. Heiporspectral - the heidelberg porcine hyperspectral imaging dataset of 20 physiological organs. Scientific Data. 10 (1), 414 (2023).
- Studier-Fischer, A., et al. Spectral organ fingerprints for machine learning-based intraoperative tissue classification with hyperspectral imaging in a porcine model. Sci Rep. 12 (1), 11028 (2022).
- Mallick, I. H., Yang, W., Winslet, M. C., Seifalian, A. M. Ischemia-reperfusion injury of the intestine and protective strategies against injury. Dig Dis Sci. 49 (9), 1359-1377 (2004).
- Malekinejad, Z., et al. Prazosin treatment protects brain and heart by diminishing oxidative stress and apoptotic pathways after renal ischemia-reperfusion. Drug Res (Stuttg). 72 (6), 336-342 (2022).
- Feldman, Z. M., et al. Inferior mesenteric artery revascularization can supplement salvage of mesenteric ischemia. J Vasc Surg Cases Innov Tech. 9 (3), 101041 (2023).
- Munley, J. A., et al. Chronic mesenteric ischemia-induced intestinal dysbiosis resolved after revascularization. J Vasc Surg Cases Innov Tech. 9 (2), 101084 (2023).
- Lejay, A., et al. Ischemia reperfusion injury, ischemic conditioning and diabetes mellitus. J Mol Cell Cardiol. 91, 11-22 (2016).
- Huang, D., et al. Macrovascular complications in patients with diabetes and prediabetes. Biomed Res Int. 2017, 7839101 (2017).
- Liu, A., et al. Hmgb1 in the ischemic and non-ischemic liver after selective warm ischemia/reperfusion in rats. Histochem Cell Biol. 135 (5), 443-452 (2011).
- Koc, S., Dogan, H. O., Karatas, O., Erdogan, M. M., Polat, V. Mitochondrial homeostasis and mast cells in experimental hepatic ischemia-reperfusion injury of rats. Turk J Gastroenterol. 33 (9), 777-784 (2022).
- Chu, M. J., Vather, R., Hickey, A. J., Phillips, A. R., Bartlett, A. S. Impact of ischaemic preconditioning on experimental steatotic livers following hepatic ischemia-reperfusion injury: A systematic review. HPB (Oxford). 17 (1), 1-10 (2015).
- Chang, M. W., et al. Sitagliptin protects rat kidneys from acute ischemia-reperfusion injury via upregulation of GLP-1 and GLP-1 receptors. Acta Pharmacol Sin. 36 (1), 119-130 (2015).
- Boys, J. A., Toledo, A. H., Anaya-Prado, R., Lopez-Neblina, F., Toledo-Pereyra, L. H. Effects of dantrolene on ischemia-reperfusion injury in animal models: A review of outcomes in heart, brain, liver, and kidney. J. Investig Med. 58 (7), 875-882 (2010).
- Orihashi, K. Mesenteric ischemia in acute aortic dissection. Surg Today. 46 (5), 509-516 (2016).
- Byard, R. W. Acute mesenteric ischemia and unexpected death. J Forensic Leg Med. 19 (4), 185-190 (2012).
- Łagosz, P., Sokolski, M., Biegus, J., Tycinska, A., Zymlinski, R. Elevated intra-abdominal pressure: A review of current knowledge. World J Clin Cases. 10 (10), 3005-3013 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon