A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التحليل الكهربائي للنسخ المتماثل من خلال تكرارات الحمض النووي المعرضة للبنية داخل episome البشري القائم على SV40
In This Article
Summary
هنا ، نحدد إجراء تحليل تطور النسخ المتماثل من خلال التكرارات المسببة للأمراض والمعرضة للهيكل باستخدام الرحلان الكهربائي للهلام ثنائي الأبعاد.
Abstract
ظهر الرحلان الكهربائي الهلامي المحايد / المحايد ثنائي الأبعاد (2DGE) كتقنية معيارية لتحليل تكرار الحمض النووي من خلال العوائق الطبيعية. يصف هذا البروتوكول كيفية تحليل تطور شوكة النسخ المتماثل من خلال تكرارات الحمض النووي المعرضة للهيكل والقابلة للتوسيع داخل episome القائم على فيروس simian 40 (SV40) في الخلايا البشرية. باختصار ، عند تعداء البلازميد إلى الخلايا البشرية ، يتم عزل المواد الوسيطة للنسخ المتماثل بواسطة بروتوكول هيرت المعدل ومعالجتها بإنزيم تقييد DpnI لإزالة الحمض النووي غير المكرر. ثم يتم هضم المواد الوسيطة بواسطة إنزيمات التقييد المناسبة لوضع تكرار الاهتمام داخل النصف الأصلي البعيد لجزء من الحمض النووي بطول 3-5 كيلو بايت. يتم فصل وسيطات النسخ المتماثل إلى بعدين متعامدين ، أولا حسب الحجم ثم حسب الشكل. بعد تهجين اللطخة الجنوبية ، يسمح هذا النهج للباحثين بملاحظة توقف الشوكة عند تكرارات مختلفة لتشكيل الهيكل على النصف التنازلي من النسخ المتماثل Y-arc. علاوة على ذلك ، يسمح هذا الوضع لموقع المماطلة بتصور النتائج المختلفة لتوقف الشوكة بوساطة متكررة ، مثل انعكاس الشوكة ، وظهور شوكة متقاربة ، وإعادة تشغيل الشوكة لإعادة التركيب.
Introduction
التكرارات الترادفية القصيرة (STR) هي صغيرة ، عادة ما تكون من 2-9 أزواج أساسية (bp) ، وهي تسلسلات متكررة من الحمض النووي تشكل حوالي 3٪ من الجينوم البشري1. تلعب STR دورا مهما في تنظيم الجينات2. ومع ذلك ، فإن تكوينها المتكرر يجعلها عرضة لتكوين بنية ثانوية للحمض النووي غير المتعارف عليها وعدم الاستقرار الجيني اللاحق3،4. من الحلزونات اليسرى إلى دبابيس الشعر / الصليبيات ، إلى الحلزونات ثلاثية وأربعة تقطعت بهم السبل ، تسبب هياكل الحمض النووي البديلة هذه تحديات جوهرية للرد. الشرط الأساسي الطبيعي لتكوين الهيكل الثانوي هو فك الحمض النووي ، وهو شرط أساسي لتكرار الحمض النووي. يمثل هذا لغزا فريدا لعمل الجينوم حيث يمكن أن تتشكل العديد من هذه الهياكل أثناء النسخ المتماثل ، مما يعيق التقدم المتكرر ويتسبب في النهاية في توقف شوكة النسخ المتماثل5،6،7 ، أو في الحالات الشديدة ، انهيار الشوكة وكسر الحمض النووي8،9. ثبت أن إعادة تشغيل الشوكات المتوقفة ومسارات إصلاح الحمض النووي تؤدي إلى تكرار عدم الاستقرار ، مثل التوسعات المتكررة10،11 وإعادة ترتيب الجينوم المعقدة (CGR) 12،13. يمكن أن تؤدي هذه الأحداث إلى تطور ما يقرب من 60 مرضا بشريا تعرف باسم اضطرابات التمدد المتكرر ، بما في ذلك متلازمة X الهشة ، ومرض هنتنغتون ، ورنح فريدريش ، وغيرها14،15 بالإضافة إلى أمراض CGR ، مثل متلازمة إيمانويل16. لذلك ، لفهم آليات المرض البشري التي يحركها عدم الاستقرار المتكرر بشكل أفضل ، من الضروري دراسة تفاصيل تقدم شوكة النسخ المتماثل من خلال تلك التكرارات.
ظهرت تقنية لدراسة تقدم النسخ المتماثل في منتصف الثمانينيات عندما سعى بروير وفانجمان إلى تقديم دليل مباشر على أن بدء النسخ المتماثل في خميرة الخميرة يحدث في تسلسل النسخ المتماثل المستقل (المعروف باسم ARS) عناصر17. من خلال القيام بذلك ، قاموا بفصل هياكل وسيطات تكاثر الخميرة في الاغاروز ، وتكييف طريقة سابقة من Bell and Byers تعرف باسم الرحلان الكهربائي الهلامي المحايد / المحايد ثنائي الأبعاد (2DGE) 18. استخدمت هذه التقنية حقيقة أن الحمض النووي غير الخطي ينتقل بشكل مختلف في هلام الاغاروز عن ما يعادله الخطي من نفس الكتلة. وبشكل أكثر تحديدا ، في 2DGE ، يتم فصل الحمض النووي المعزول في بعدين متعامدين ، أولا حسب الحجم أولا ثم بشكل أساسي حسب الشكل ، لإنشاء خريطة شاملة للنسخ المتماثل في منطقة معينة ذات أهمية. في ورقتهم الأصلية ، أظهر بروير وفانغمان هذا على أنه قوس يتكون من هياكل "Y بسيطة" أو شوكات النسخ المتماثل التي تربط الحمض النووي غير المكرر بنظرائهم المكررين. يصفون أيضا الوسيطات الأخرى المرصودة بأنها "فقاعات" و "Ys مزدوجة" ، تمثل أصول النسخ المتماثل والشوكات المتقاربة ، على التوالي.
يمكن استخدام 2DGE لدراسة المجموعات النسبية لوسيطات تكرار الحمض النووي في وقت معين. لذلك ، إذا كانت مجموعة واحدة من الوسطاء أكثر انتشارا من أخرى ، فسيكون هذا واضحا عند التصور. هذا يجعل 2DGE أداة مفيدة بشكل خاص لدراسة تقدم النسخ المتماثل من خلال التسلسلات الصعبة ، مثل تكرارات تشكيل الهيكل. على سبيل المثال ، إذا كانت المنطقة التي تم تحليلها تحتوي على تسلسل قادر على إحداث توقف شوكة النسخ المتماثل ، فسيظهر هذا على شكل انتفاخ على القوس (الشكل 1 أ) ، مما يشير إلى تراكم شوكات النسخ المتماثل في هذا الموضع. يمكن ملاحظة ذلك من خلال تكرار كل من تسلسل التكرار لتشكيل دبوس الشعر في الخميرة19،20،21 والتكرارات المكونة للثلاثية في الخلايا البشرية22،23،24. بالإضافة إلى التوقف ، يمكن استخدام 2DGE لمراقبة هياكل الحمض النووي التي لا تتوافق مع Ys البسيط القياسي الذي تم تشكيله أثناء النسخ المتماثل ، كما في حالة المواد الوسيطة المؤتلفة25. هذه المواد الوسيطة لها هيكل أثقل وأكثر تشعبا على شكل X ، وبالتالي ، تسافر بشكل أبطأ في كل من البعدين الأول والثاني من شوكات النسخ المتماثل القياسية. يمكن أيضا ملاحظة نتائج مماثلة فيما يتعلق بانعكاس شوكة النسخالمتماثل 20،24،26. استجابة لإجهاد النسخ المتماثل القوي ، ثبت أن الخلايا حقيقية النواة تستخدم انعكاس شوكة النسخ المتماثل لإنقاذ الشوكات المتوقفة. هذه الشوكات المعكوسة لها وزن جزيئي مماثل للشوكات المتوقفة. ومع ذلك ، فإن هيكل قدم الدجاج ينتج عنه حركة كهربائية أبطأ في البعد الثاني بالنسبة إلى المكملات على شكل حرف Y ، مما يؤدي إلى امتداد لأعلى وخارج القوس.
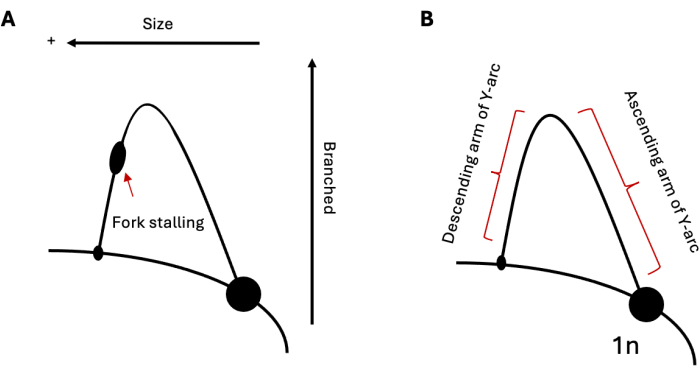
الشكل 1: تحليل الرحلان الكهربائي للهلام 2D لتكرار الحمض النووي. (أ) تخطيطي لنموذج 2DGE يصور النسخ المتماثل من خلال تكرار تشكيل الهيكل القادر على إحداث توقف الشوكة. الحجم والهيكل المتوسط سيؤثران على الحركة الكهربية. (ب) عينة من القوس Y مع أذرع صاعدة وهابطة على التوالي. الاختصار: 2DGE = رحلان كهربائي هلامي محايد / محايد ثنائي الأبعاد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
بطبيعة الحال ، يتعلق أحد أهم جوانب 2DGE بجودة وكمية المواد الوسيطة للنسخ المتماثل. ومع ذلك ، فإن دقة تحليل 2DGE للنسخ المتماثل من خلال المواقع الداخلية في خلايا الثدييات غير كافية لتسلسل هدف نسخة واحدة داخل الجينوم البشري ثنائي الصبغيات 6 × 109 نقطة أساس ، على الرغم من أنه تم إجراؤه للجينات متعددة النسخ ، مثل موضع DHFR المضخمبشكل كبير 27 أو الحمض النووي الريبيالريبوسومي 28. يعد النسخ المتماثل المستند إلى SV40 وسيلة فعالة وجيدة التميز لدراسة النسخ المتماثل في الخلايا حقيقية النواة29. إنه يوفر نموذجا موثوقا به للتكرار حقيقيات النواة الذي يستخدم معظم آلية المضيف لتكرار الجينوم الفيروسي ، والذي يتم تقسيمه في نيوكليوسومات عند الإصابة30،31. هناك استثناءان ملحوظان من ثدييات الثدييات هما أن مستضد T (Tag) ، بدلا من مركب CMG المضيف ، يعمل كهليكاز DNA متماثل ، ودلتا بوليميراز الحمض النووي تصنع خيوط الحمض النووي الرائدة والمتأخرة32. لقد استفدنا من هذا النظام من خلال وضع امتدادات مسببة للأمراض من تكرارات تشكيل الهيكل في اتجاه مجرى النهر من أصل SV40 للنسخ المتماثل داخل البلازميد الذي تم إنشاؤه في الأصل في مختبر ماسيمولوبيز 22. الأهم من ذلك ، أن هذا البلازميد يحتوي أيضا على ترميز الجين ل Tag نفسه ، مما يؤدي إلى تكراره التأسيسي والقوي للغاية عند التعدي إلى مجموعة متنوعة من الخلايا البشرية المستنبتة. تؤدي هذه الميزة إلى ظهور كمية كبيرة من المنتجات ، وهي مثالية لتحليل 2DGE للمواد الوسيطة التي تشكلت أثناء واستجابة لتكرار التكرارات المسببة للأمراض في الخلايا البشرية. هنا ، نصف طريقة مفصلة لتصور تكرار تكرارات تشكيل الهيكل داخل episome البشري القائم على SV40 باستخدام الرحلان الكهربائي للهلام ثنائي الأبعاد.
Access restricted. Please log in or start a trial to view this content.
Protocol
ملاحظة: يجب أن يحتوي البلازميد المصمم لتحليل 2DGE الموضح في خلايا الثدييات على أصل SV40 للنسخ المتماثل عدة كيلو بايت من التكرارات المعرضة للهيكل (الشكل 2). يجب أن يؤخذ في الاعتبار التوليف الرائد والمتأخر عند اختيار الاتجاه بالنسبة إلى الأصل الذي يجب استنساخ التكرارات في البلازميد.

الشكل 2: هضم البلازميد المحتوي على تكرار لتحليل 2DGE. يتم تصوير التكرارات المعرضة للهيكل بعدة كيلو بايت في اتجاه مجرى النهر من شوكة النسخ المتماثل المتحركة لليمين. سيضع الهضم باستخدام القواطع الفريدة 1 و 2 تسلسل التكرار على الذراع الهابط للقوس Y ، بالنظر إلى التسلسل الذي يتجاوز نقطة منتصف الطريق للجزء المهضوم. الاختصار: 2DGE = رحلان كهربائي هلامي محايد / محايد ثنائي الأبعاد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. تعداء البلازميد إلى خلايا الثدييات
- قم بزرع 600,000 خلية HEK293T في صفيحة زراعة الأنسجة مقاس 10 سم قبل التعدي. اسمح للخلايا بالتعافي عند 37 درجة مئوية بين عشية وضحاها.
ملاحظة: يمكن استخدام العديد من خطوط الخلايا لهذه التجربة، على الرغم من أن الخلايا التي تحتوي على علامة SV40 موصى بها للحصول على أفضل النتائج. تنبيه: تعتبر الخلايا HEK293T BSL-2 ويجب تنفيذ جميع أعمال الاستزراع في خزانة السلامة الحيوية باستخدام تقنية التعقيم المناسبة ومعدات الوقاية الشخصية المناسبة. - عندما تصل الخلايا إلى التقاء 60٪ ، قم بنقل 8 ميكروغرام من الحمض النووي البلازميد المحتوي على التكرار في الخلايا المصنفة باستخدام كواشف التعداء المناسبة وفقا لبروتوكول الشركة المصنعة.
- إذا لم يتم عزل المواد الوسيطة في هذه المرحلة الزمنية ، فقم بشفط الوسائط القديمة واستبدلها ب 10 مل من الوسائط الجديدة بعد 24 ساعة.
- ابدأ في جمع الخلايا 24-48 ساعة بعد التعدي.
- قم بشفط الوسائط وغسلها بعناية باستخدام 10 مل من محلول ملحي مخزن بالفوسفات (PBS). افصل الخلايا واجمعها باستخدام 0.5 مل من التربسين وقم بتدويرها عند 340 × جم لمدة 4 دقائق.
- استنشق المادة الطافية واغسل كريات الخلية باستخدام PBS. قم بالدوران مرة أخرى عند 340 × جم لمدة 4 دقائق واستنشق المادة الطافية.
ملاحظة: يمكن إيقاف التجربة مؤقتا هنا عن طريق تجميد كريات الخلايا عند -80 درجة مئوية. لقد وجدنا أفضل دقة عزل النسخ المتماثل الوسيط 48 ساعة بعد التعدي. ومع ذلك ، فقد أسفرت 24 ساعة عن نتائج قابلة للتطبيق.
2. عزل المواد الوسيطة للنسخ المتماثل
- أعد تعليق الخلايا في 1.5 مل من محلول تحلل هيرت المعدل [10 ملي مولار تريس حمض الهيدروكلوريك (الرقم الهيدروجيني 7.5) ، 10 ملي مولار حمض الإيثيلين ديامين تترا أسيتيك (EDTA)] في 50 مل من الأنابيب المخروطية وابدأ تحلل الخلايا.
- أضف كبريتات دوديسيل الصوديوم (SDS) إلى التركيز النهائي بنسبة 0.6٪ (حوالي 650 ميكرولتر من المخزون 2٪ SDS) والبروتيناز K إلى التركيز النهائي البالغ 100 ميكروغرام / مل (حوالي 10 ميكرولتر من المخزون 20 مجم / مل بروتيناز K) لإزالة نوكليازات.
- تخلط برفق عن طريق سحب العينات حتى تصبح متجانسة وتحتضن الخليط عند 37 درجة مئوية لمدة 90 دقيقة على الأقل.
- قم بزيادة تركيز كلوريد الصوديوم إلى 1 متر (حوالي 540 ميكرولتر من المرق 5 م كلوريد الصوديوم) واخلطه برفق حتى يتجانس. احتضن طوال الليل (18-24 ساعة) عند 4 درجات مئوية للسماح بهطول بقايا الخلية والحمض النووي الريبي والبروتين عن طريق التمليح.
ملاحظة: سيكون الخليط شديد اللزوجة ، لذا توخ الحذر والتحلي بالصبر أثناء الخلط جيدا. - في اليوم التالي ، افصل الحمض النووي عن بقايا الخلية والحمض النووي الريبي والبروتين.
- الطرد المركزي الخليط على حرارة 29,500 × جم لمدة 45 دقيقة عند 4 درجات مئوية.
- انقل المادة الطافية التي تحتوي على الحمض النووي ، وأضف حجما واحدا من الفينول: الكلوروفورم: كحول الأيزواميل 25:24: 1 (v / v) ، واخلطه لفترة وجيزة حتى يتجانس.
تنبيه: الفينول: الكلوروفورم: كحول الأيزواميل مادة خطرة ويجب التعامل معها باستخدام معدات الوقاية الشخصية المناسبة في غطاء الدخان الكيميائي. - جهاز طرد مركزي مرة أخرى عند 15,000 × جم لمدة 5 دقائق في درجة حرارة الغرفة. انقل الطبقة المائية إلى أنبوب مخروطي جديد.
- تسريع وغسل الحمض النووي المعزول.
- أضف حجما واحدا من الأيزوبروبانول النقي واحتضنه في درجة حرارة الغرفة لمدة 5 دقائق على الأقل. قم بتدوير الحمض النووي عند 15,000 × جم لمدة 30 دقيقة عند 4 درجات مئوية.
- صب المادة الطافية واغسل الحبيبات بالإيثانول البارد 70٪ لإزالة الملح الزائد.
- قم بالدوران مرة أخرى عند 15,000 × جم لمدة 30 دقيقة عند 4 درجات مئوية ، وجفف في الهواء ، وأعد تعليق الحبيبات برفق في المخزن المؤقت Tris-EDTA (TE) (10 ملي تريس-حمض الهيدروكلوريك ، 1 ملي EDTA).
ملاحظة: يمكن إيقاف التجربة مؤقتا هنا ، ويمكن تجميد العينات عند -20 درجة مئوية ؛ ومع ذلك ، يجب تجنب دورة التجميد / الذوبان لأن هذا يمكن أن يقلل من جودة المواد الوسيطة لتكرار الحمض النووي.
3. إعداد العينة والرحلان الكهربائي للهلام ثنائي الأبعاد
- استيعاب المواد الوسيطة المعزولة لتكرار البلازميد.
- أضف 100 وحدة من إنزيمات التقييد المناسبة إلى العينة لهضم الحمض النووي البلازميد ، ووضع التسلسل المحتوي على التكرار على وجه التحديد على النصف الأصلي البعيد من الجزء الخطي (الشكل 2). بالإضافة إلى ذلك ، أضف DpnI لقطع الحمض النووي الميثيلي ، وبالتالي إزالة أي حمض نووي بلازميد لم يتم تكراره بالكامل في الخلايا البشرية المستنبتة.
ملاحظة: للحصول على أفضل النتائج ، يجب أن تكون إنزيمات التقييد عبارة عن قواطع فريدة تنتج جزءا من 3-5 كيلو بايت يضع التسلسل المعرض للهيكل على الذراع الهابط للقوس Y. - احتضان العينات عند 37 درجة مئوية لمدة 6-10 ساعات للسماح بهضم البلازميد الكامل.
- قم بترسيب الحمض النووي إما ب 2.5 حجم من الإيثانول النقي البارد واحتضانه عند -20 درجة مئوية طوال الليل ، أو أضف حجما واحدا من الأيزوبروبانول واحتضانه في درجة حرارة الغرفة لمدة 5 دقائق.
- الطرد المركزي العينات المهضومة والمترسبة عند 15,000 × جم لمدة 30 دقيقة عند 4 درجات مئوية.
- صب المادة الطافية وغسل العينة بالإيثانول البارد 70٪. تدور مرة أخرى عند 15,000 × جم لمدة 30 دقيقة عند 4 درجات مئوية.
- صب المادة الطافية ، وجففها في الهواء لمدة 10 دقائق ، وأعد تعليق العينات في 15 ميكرولتر من المخزن المؤقت TE.
- أضف 100 وحدة من إنزيمات التقييد المناسبة إلى العينة لهضم الحمض النووي البلازميد ، ووضع التسلسل المحتوي على التكرار على وجه التحديد على النصف الأصلي البعيد من الجزء الخطي (الشكل 2). بالإضافة إلى ذلك ، أضف DpnI لقطع الحمض النووي الميثيلي ، وبالتالي إزالة أي حمض نووي بلازميد لم يتم تكراره بالكامل في الخلايا البشرية المستنبتة.
- تحضير جل الاغاروز ذو البعد الأول بنسبة 0.4-0.5٪ في 1x Tris-borate-EDTA (TBE) (89 ملي ملي قاعدة تريس ، 89 ملي حمض البوريك ، 2 ملي EDTA). اترك المحلول يتماسك لمدة 1 ساعة على الأقل.
- ابدأ في تحميل العينات في البعد الأول.
- قم بتحميل السلم في أول 3 سم بالنسبة إلى الحافة الموجودة في أقصى يسار الجل. بعد ذلك ، قم بتحميل العينات المحضرة بالكامل ، مع ضمان 3 سم بين كل زوج.
- قم بتشغيل الجل في 1x TBE لمدة 19-24 ساعة عند 0.85 فولت / سم لفصل المواد الوسيطة فيما يتعلق بحجمها. تأكد من تغطية الغرفة لحماية العينات من الضوء ، مما قد يتسبب في تلف الحمض النووي.
- في اليوم التالي ، قم بإزالة الجل من المخزن المؤقت وتقدير موقع الجزء الخطي المهضوم باستخدام المسطرة.
- استئصال أول 3 سم من الجل الذي يحتوي على السلم وصمة عار الجزء الجل في 1x TBE يحتوي على 0.3 ميكروغرام / مل من بروميد الإيثيديوم لمدة 10-15 دقيقة. تصور السلم باستخدام نظام توثيق الجل.
- أضف 1.3 سم إلى الموقع المقدر ، مما ينتج عنه القيمة أ. ثم اطرح 7.5 سم من القيمة أ ، مما ينتج عنه القيمة ب. قم بمحاذاة المسطرة مقابل جل البعد الأول وقم بقصها أفقيا عند القيمتين a و b. ثم قم بقص المساحة البالغة 3 سم عموديا المخصصة لكل عينة. راجع الشكل 3 للحصول على مخطط مرئي.
- في صينية صب جديدة ، قم بتدوير الأجزاء في اتجاه عقارب الساعة وضعها في موضع آبار العينة (الشكل 3).
- تحضير هلام الاغاروز ذو البعد الثاني بتركيز 1-1.3٪ في 1x TBE عند 0.3 ميكروغرام / مل بروميد الإيثيديوم.
- عند التبريد إلى حوالي 55 درجة مئوية ، اسكب جل البعد الثاني فوق أجزاء البعد الأول المستديرة واتركه يتجمد لمدة 1 ساعة على الأقل.
- انقل البعد الثاني إلى غرفة بها 1x TBE عند 0.3 ميكروغرام / مل بروميد الإيثيديوم ، واترك الجل يتوازن لمدة 30 دقيقة على الأقل.
- قم بتشغيل الجل ، مغطى مرة أخرى ، لمدة 9-10 ساعات عند 4.23 فولت / سم عند 4 درجات مئوية لفصل المواد الوسيطة فيما يتعلق بشكلها.
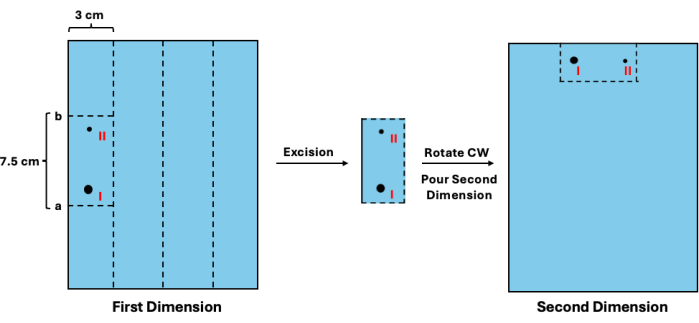
الشكل 3: استئصال المواد الوسيطة من البعد الأول قبل فصل البعد الثاني. بعد تصور السلم ، يمكن تقدير حركة الأجزاء غير المكررة. (ط) يمكن بعد ذلك استخدام هذه القيمة لتحديد مواقع القطع المناسبة (أ و ب) لاستئصالها ونظيراتها المنسوخة (ثانيا). يجب بعد ذلك تدوير قسم الجل ووضعه في موضع الآبار لفصل البعد الثاني. الاختصار: CW = في اتجاه عقارب الساعة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. النشاف الجنوبي والتهجين مع مسبار ذو علامات راديوية
- قم بإزالة جل البعد الثاني من الغرفة وقم بتنقية شظايا الحمض النووي لمدة 10 دقائق في محلول 0.24 M HCl مع هزاز لطيف. اشطف الجل بالماء منزوع الأيونات وانقعه في 0.4 متر هيدروكسيد الصوديوم لمدة 10-15 دقيقة.
تنبيه: حمض الهيدروكلوريك وهيدروكسيد الصوديوم مسببان للتآكل ويجب التعامل معهما باستخدام معدات الوقاية الشخصية المناسبة في غطاء الدخان الكيميائي. - ابدأ في تجميع اللطخة الجنوبية لتسهيل نقل المواد الوسيطة المنفصلة من الجل إلى الغشاء. راجع الشكل 4 للحصول على مخطط شامل.
- املأ وعاءا بحجم كاف ب 1 لتر من 0.4 M هيدروكسيد الصوديوم.
- قم بمحاذاة لوح زجاجي طويل عبر الحاوية وقم بطي (على طول الطول) ورقتين طويلتين من ورق الكروماتوغرافيا بشكل عمودي عبر الصفيحة الزجاجية ، وتمتد إلى حاوية هيدروكسيد الصوديوم.
- بلل الجزء العلوي من الورقة باستخدام هيدروكسيد الصوديوم وقم بإزالة أي فقاعات هواء تحت سطحها بعناية.
- انقع ثلاث أوراق من ورق الكروماتوغرافيا باستخدام هيدروكسيد الصوديوم وضعها فوق الورق المطوي ، مع إزالة أي فقاعات مرة أخرى.
- اقلب جل البعد الثاني رأسا على عقب وانقله فوق الأوراق.
- بلل غشاء نايلون موجب الشحنة (حجم المسام 0.45 ميكرومتر) بماء DI وضعه فوق الجل.
- أخيرا ، أضف ثلاث أوراق أخرى ، مبللة بماء DI ، فوق الغشاء.
- قم بتغطية أي هيدروكسيد الصوديوم المكشوف في الحاوية السفلية بغلاف بلاستيكي لمنع التبخر. ضع كومة من المناديل أو المناشف الورقية فوق البقعة ، مع التأكد من ارتفاعها 0.3-0.5 متر. ضع وزنا في الأعلى ، واضغط على اللطخة بأكملها لتسهيل العمل الشعري الضيق. اترك يومين على الأقل حتى ينتقل الحمض النووي إلى الغشاء.
ملاحظة: يعتمد طول وعرض ورق الكروماتوغرافيا والغشاء على حجم هلام الاغاروز المستخدم في البعد الثاني. للحصول على النقل الأكثر كفاءة ، استخدم الورق والأغشية بنفس أبعاد الجل.
- بعد النقل ، قم بربط الحمض النووي بالغشاء باستخدام الوصلة المتشابكة للأشعة فوق البنفسجية عند 120 ميكروجول / سم2 لمدة دقيقة واحدة.
ملاحظة: يمكن إيقاف التجربة مؤقتا هنا عن طريق وضع الغشاء في واقي محكم الإغلاق وجاف ونظيف في درجة حرارة الغرفة. - اغسل الغشاء 2x لمدة 5 دقائق باستخدام 2x سترات الصوديوم المالحة (SSC buffer) (0.3 M كلوريد الصوديوم ، 0.03 M سترات الصوديوم).
- قم بتهجين الغشاء مسبقا باستخدام 0.18 مل / سم2 من مخزن التهجين الخاص ب Church & Gilbert [1 ملي مولار EDTA ، 1٪ ألبومين مصل بقري (BSA) ، 0.5 م فوسفات الصوديوم ، 7٪ SDS] عند 65 درجة مئوية ، يدور في حاضنة تهجين لمدة ساعتين على الأقل.
ملاحظة: قد يتم تهجين الغشاء مسبقا لعدة أيام. - قم بإعداد المسبار الملصق بالإشعاع باستخدام α-32P dATP أو dCTP ومجموعة وضع العلامات على الحمض النووي وفقا لبروتوكول الشركة المصنعة.
تنبيه: تعتبر dNTPs ذات العلامات الراديوية خطرة ، ويجب ارتداء معدات الوقاية الشخصية المناسبة عند التعامل معها. يجب تنفيذ جميع الأعمال المشعة خلف التدريع ، ويجب مراقبة الأفراد المدربين لامتصاص الإشعاع باستخدام مقاييس الجرعات.- صمم جزءا من الحمض النووي الخطي 400-900 نقطة أساس مكملا للتسلسل المهضوم التقييدي (الشكل 2) وقم بتضخيم الجزء باستخدام تفاعل البوليميراز المتسلسل (PCR).
ملاحظة: نوصي بالحصول على جزء PCR من 50-100 نانوغرام / ميكرولتر - اجمع بين 100 نانوغرام من جزء PCR التكميلي مع DNA Pol I ، وجزء Klenow (3 '5' exo-) ، وأوليغوس ديكانوكليوتيد عشوائي.
- قم بتغيير طبيعة الجزء عند 100 درجة مئوية لمدة 10 دقائق.
- أضف 5 وحدات من DNA Pol I ، وجزء Klenow (3 '5' exo-) ، و 50 μCi من α-32P dNTP ، و 30-50 ميكرولتر من مزيج dNTP ناقص في نوع dNTP الموسوم بالإشعاع إلى العينة.
- احتضان عند 37 درجة مئوية لمدة 10 دقائق للسماح بالبلمرة ودمج dNTP المليء بالإشعاع.
- أضف 30-50 ميكرولتر من نوع dNTP الغائب سابقا إلى العينة واحتضانه عند 37 درجة مئوية لمدة 10 دقائق.
- قم بتنقية الجزء الملصق بالإشعاع باستخدام عمود دوران عند 3,000 × جم لمدة دقيقتين.
- صمم جزءا من الحمض النووي الخطي 400-900 نقطة أساس مكملا للتسلسل المهضوم التقييدي (الشكل 2) وقم بتضخيم الجزء باستخدام تفاعل البوليميراز المتسلسل (PCR).
- أضف مسبارا مسجلا إلى 50 مل من مخزن التهجين واحتضنه بالغشاء طوال الليل عند 65 درجة مئوية يدور في حاضنة تهجين.
- في اليوم التالي ، قم بإزالة المسبار واغسل الغشاء 2x بمخزن الغسيل 1 (0.1x SSC ، 0.1٪ SDS) عند 42 درجة مئوية و 2x مع مخزن الغسيل 2 (2x SSC ، 0.1٪ SDS) عند 65 درجة مئوية.
ملاحظة: يجب إجراء جميع عمليات الغسيل بدورات سريعة لمدة 15 دقيقة في الحاضنة. - جفف الغشاء لمدة 10 دقائق وضعه في واقي رقيق وشفاف. قم بتخزين الغشاء المغلق في شريط متحكم فيه ومقاوم للإشعاع مع شاشة حساسة للفوسفور. اترك الغشاء يتعرض للشاشة لمدة 1-10 أيام.
- تصور النتائج باستخدام جهاز تصوير جزيئي حيوي تم تعيينه على التصوير الفوسفوري. اغسل وأعد تعريضه إذا لزم الأمر.
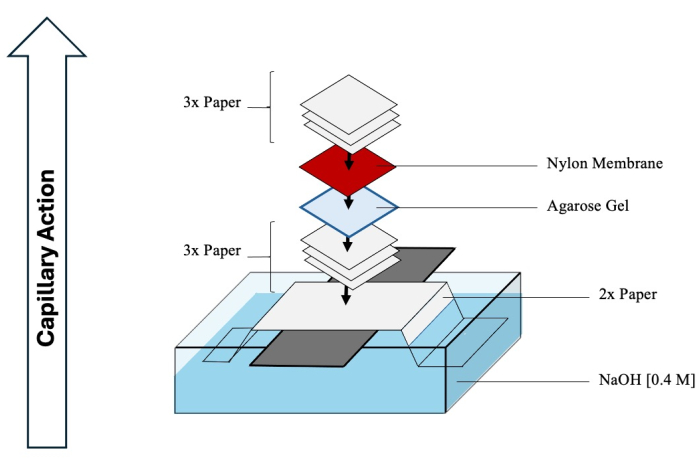
الشكل 4: تجميع اللطخة الجنوبية. تخطيطي شامل لجهاز نموذجي يستخدم لنقل اللطخة الجنوبية للمواد الوسيطة من البعد الثاني إلى غشاء نايلون. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
النتائج
إذا نجحت ، عند التصور ، يمكن ملاحظة قوس حاد من شوكات النسخ المتماثل يمتد لأعلى وخارج من بقعة 1n الضخمة (الشكل 5 أ). يحدد حجم الجزء، أو النسبة المئوية التي يتم نسخها نسخا، إمكانية تنقل الجزء في البعد الأول. عندما تطور الوسطاء بنية أكثر ترابطا ، فإنها ستبدأ في ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
يوفر 2DGE صورة شبه كمية وشاملة للمجموعات النسبية للمواد الوسيطة التي تنشأ أثناء تكرار تسلسل معين. بالنظر إلى أنه يجب الحفاظ على الهياكل الجزيئية الهشة لشوكات النسخ المتماثل طوال هذا الإجراء ، يجب توخي الحذر الشديد لمنع القص الفيزيائي والتمسخ الكيميائي. لذلك ، يوصى بشدة ب?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
نشكر خورخي سيبريان وأناستازيا راستوكينا اللذين بدأا في تطوير هذا النهج في مختبرنا ، وماسيمو لوبيز لتزويدنا ببلازميد pML113 ونصائح لا تقدر بثمن ، وإيلي دوكساني على المناقشات الثاقبة ، وأعضاء مختبر ميركين لدعمهم. يتم دعم العمل في مختبر ميركين من قبل المعهد الوطني للعلوم الطبية العامة [R35GM130322] و NSF-BSF [2153071].
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 10x TBE Buffer | Bio Rad | 1610733 | |
| 20x SSC Buffer | Fisher Scientific | BP1325-1 | |
| 293T cells | ATCC | CRL-3216 | |
| a-32P dATP, 3000 Ci/mmol | Revvity | BLU512H250UC | |
| Agarose | Fisher Scientific | BP160-500 | |
| Amersham Hybond-N+ | Fisher Scientific | RPN303B | |
| BAS Storage Phosphor Screens | Fisher Scientific | 28956482 | |
| Church and Gibert's hybriddization buffer | Fisher Scientific | 50-103-5408 | |
| DecaLabel DNA labeling kit | ThermoFisher Scientific | K0622 | |
| DMEM, high gluctose, GltaMAX Supplement, pyruvate | ThermoFisher Scientific | 10569010 | |
| DpnI | New England Biolabs | R0176S | Additional restriction enzymes will need to be purchased as well |
| EDTA 0.5 M, pH 8 | Fisher Scientific | BP2482500 | |
| Ethanol, 70% | Fisher Scientific | BP82031GAL | |
| Fetal Bovine Serum | VWR | 97068-085 | |
| Hydrochloric acid solution, 12 M | Millipore Sigma | 13-1683 | |
| Isopropanol | Fisher Scientific | BP26184 | |
| jetPRIME DNA and siRNA Transfection Reagent with Buffer | VWR | 101000027 | |
| MycoZap Plus-CL | VWR | 75870-448 | |
| NaCl | Millipore Sigma | 746398-500G | |
| Nalgene Oak Ridge High-Speed Centrifuge Tubes | ThermoFisher Scientific | 3139-0050 | |
| Phosphate Buffer Saline, pH 7.4 | ThermoFisher Scientific | 10010023 | |
| Phosphate Buffer Saline, pH 7.5 | ThermoFisher Scientific | 10010024 | |
| Proteinase K | ThermoFisher Scientific | EO0491 | |
| Proteinase K | ThermoFisher Scientific | EO0492 | |
| Pure Cellulose Chromatography Paper | Fisher Scientific | 05-714-4 | |
| Pure Cellulose Chromatography Paper | Fisher Scientific | 05-714-5 | |
| Ruler | Fisher Scientific | 09-016 | |
| Scalpel | Fisher Scientific | 12-460-451 | |
| Sodium dodecyl sulfate | Millipore Sigma | 436143-25G | |
| Sodium hydroxide | Fisher Scientific | S25548 | |
| Sorval LYNX 4000 Superspeed Centrifuge | ThermoFisher Scientific | 75006580 | |
| Sub-cell Horizontal Electrophoresis System | Bio Rad | 1704401 | |
| TH13-6 x 50 Swinging Bucket Rotor | ThermoFisher Scientific | 75003010 | |
| Tris-HCl 1 M, pH 7.5 | Fisher Scientific | BP1757-500 | |
| Trypsin-EDTA (0.25%), phenol red | ThermoFisher Scientific | 25200056 |
References
- Liao, X., et al. Repetitive DNA sequence detection and its role in the human genome. Commun Biol. 6 (1), 1-21 (2023).
- Fotsing, S. F., et al. The impact of short tandem repeat variation on gene expression. Nat Genet. 51 (11), 1652-1659 (2019).
- Fan, H., Chu, J. -Y. A brief review of short tandem repeat mutation. GPB. 5 (1), 7-14 (2007).
- Khristich, A. N., Mirkin, S. M. On the wrong DNA track: Molecular mechanisms of repeat-mediated genome instability. J Biol Chem. 295 (13), 4134-4170 (2020).
- Samadashwily, G. M., Raca, G., Mirkin, S. M. Trinucleotide repeats affect DNA replication in vivo. Nat Genet. 17 (3), 298-304 (1997).
- Khristich, A. N., Armenia, J. F., Matera, R. M., Kolchinski, A. A., Mirkin, S. M. Large-scale contractions of Friedreich's ataxia GAA repeats in yeast occur during DNA replication due to their triplex-forming ability. Proc Natl Acad Sci USA. 117 (3), 1628-1637 (2020).
- Shishkin, A. A., et al. Large-scale expansions of Friedreich's ataxia GAA repeats in yeast. Mol Cell. 35 (1), 82-92 (2009).
- Sundararajan, R., Gellon, L., Zunder, R. M., Freudenreich, C. H. Double-strand break repair pathways protect against CAG/CTG repeat expansions, contractions and repeat-mediated chromosomal fragility in Saccharomyces cerevisiae. Genetics. 184 (1), 65-77 (2010).
- Kim, H. -M., et al. Chromosome fragility at GAA tracts in yeast depends on repeat orientation and requires mismatch repair. EMBO J. 27 (21), 2896-2906 (2008).
- Polleys, E. J., House, N. C. M., Freudenreich, C. H. Role of recombination and replication fork restart in repeat instability. DNA Repair. 56, 156-165 (2017).
- Gold, M. A., et al. Restarted replication forks are error-prone and cause CAG repeat expansions and contractions. PLoS Genet. 17 (10), e1009863(2021).
- Lambert, S., et al. Homologous recombination restarts blocked replication forks at the expense of genome rearrangements by template exchange. Mol Cell. 39 (3), 346-359 (2010).
- Burssed, B., Zamariolli, M., Bellucco, F. T., Melaragno, M. I. Mechanisms of structural chromosomal rearrangement formation. Mol Cytogenet. 15 (1), 23(2022).
- Paulson, H. Repeat expansion diseases. Handb Clin Neurol. 147, 105-123 (2018).
- Malik, I., Kelley, C. P., Wang, E., Todd, P. Molecular mechanisms underlying nucleotide repeat expansion disorders. Nat Rev Mol Cell Biol. 22 (9), 589-607 (2021).
- Emanuel, B. S., Zackai, E. H., Medne, L. Emanuel Syndrome. GeneReviews®. Adam, M. P. , University of Washington. Seattle, Seattle, WA. (1993).
- Brewer, B. J., Fangman, W. L. The localization of replication origins on ARS plasmids in S. cerevisiae. Cell. 51 (3), 463-471 (1987).
- Bell, L., Byers, B. Separation of branched from linear DNA by two-dimensional gel electrophoresis. Anal Biochem. 130 (2), 527-535 (1983).
- Voineagu, I., Narayanan, V., Lobachev, K. S., Mirkin, S. M. Replication stalling at unstable inverted repeats: Interplay between DNA hairpins and fork stabilizing proteins. Proc Natl Acad Sci USA. 105 (29), 9936-9941 (2008).
- Nguyen, J. H. G., et al. Differential requirement of Srs2 helicase and Rad51 displacement activities in replication of hairpin-forming CAG/CTG repeats. Nucleic Acids Res. 45 (8), 4519-4531 (2017).
- Krasilnikova, M. M., Mirkin, S. M. Analysis of triplet repeat replication by two-dimensional gel electrophoresis. Trinucleotide Repeat Protocols. Kohwi, Y. , Humana Press. Totowa, NJ. (2004).
- Follonier, C., Oehler, J., Herrador, R., Lopes, M. Friedreich's ataxia-associated GAA repeats induce replication-fork reversal and unusual molecular junctions. Nat Struct Mol Biol. 20 (4), 486-494 (2013).
- Chandok, G. S., Patel, M. P., Mirkin, S. M., Krasilnikova, M. M. Effects of Friedreich's ataxia GAA repeats on DNA replication in mammalian cells. Nucleic Acids Res. 40 (9), 3964-3974 (2012).
- Rastokina, A., et al. Large-scale expansions of Friedreich's ataxia GAA•TTC repeats in an experimental human system: role of DNA replication and prevention by LNA-DNA oligonucleotides and PNA oligomers. Nucleic Acids Res. 51 (16), 8532-8549 (2023).
- Giannattasio, M., et al. Visualization of recombination-mediated damage-bypass by template switching. Nat Struct Mol Biol. 21 (10), 884-892 (2014).
- Hisey, J. A., et al. Pathogenic CANVAS (AAGGG)n repeats stall DNA replication due to the formation of alternative DNA structures. Nucleic Acids Res. 52 (8), 4361-4374 (2024).
- Kalejta, R. F., Lin, H. B., Dijkwel, P. A., Hamlin, J. L. Characterizing replication intermediates in the amplified CHO dihydrofolate reductase domain by two novel gel electrophoretic techniques. Mol Cell Biol. 16 (9), 4923-4931 (1996).
- Little, R. D., Platt, T. H., Schildkraut, C. L. Initiation and termination of DNA replication in human rRNA genes. Mol Cell Biol. 13 (10), 6600-6613 (1993).
- Fanning, E., Zhao, K. SV40 DNA replication: From the A gene to a nanomachine. Virology. 384 (2), 352-359 (2009).
- Sogo, J. M., Stahl, H., Koller, T., Knippers, R. Structure of replicating simian virus 40 minichromosomes: The replication fork, core histone segregation and terminal structures. J Mol Biol. 189 (1), 189-204 (1986).
- Weisshart, K., Taneja, P., Fanning, E. The replication protein A binding site in simian virus 40 (SV40) T antigen and its role in the initial steps of SV40 DNA replication. J Virol. 72 (12), 9771-9781 (1998).
- Sowd, G. A., Fanning, E. A Wolf in sheep's clothing: SV40 co-opts host genome maintenance proteins to replicate viral DNA. PLoS Pathog. 8 (11), e1002994(2012).
- National Library of Medicine: National Center for Biotechnology Information. BLAST: Basic Local Alignment Search Tool. , https://blast.ncbi.nlm.nih.gov/Blast.cgi (2024).
- Hirt, B. Selective extraction of polyoma DNA from infected mouse cell cultures. J Mol Biol. 26 (2), 365-369 (1967).
- Lopes, M., Foiani, M., Sogo, J. M. Multiple mechanisms control chromosome integrity after replication fork uncoupling and restart at irreparable UV lesions. Mol Cell. 21 (1), 15-27 (2006).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved