A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
علاج جديد لتسرب الصفراء المعقد بعد زراعة الكبد
* These authors contributed equally
In This Article
Summary
يعد تسرب الصفراء من المضاعفات الشائعة بعد زراعة الكبد والتي تؤثر بشكل كبير على تشخيص المرضى. يقدم البروتوكول طريقة جديدة للجمع بين تصوير البنكرياس والقنوات الصفراوية بالمنظار (ERCP) ، ومنظار الصفراو الفرعي ، وتنظير القنوات الصفراوية عبر الكبد عن طريق الجلد (PTCS) لعلاج تسرب الصفراء المعقد بعد زراعة الكبد.
Abstract
يعد تسرب الصفراء من المضاعفات الشائعة بعد زراعة الكبد والتي يمكن علاجها عادة باستخدام تصوير البنكرياس والقنوات الصفراوية بالمنظار (ERCP) ، والتصريف الصفراوي عبر الكبد عن طريق الجلد (PTCD) ، وتنظير القنوات الصفراوية عبر الكبد عن طريق الجلد (PTCS) والجراحة. أبلغنا عن علاج جديد للتسرب الصفراوي يستمر 9 أشهر بعد زراعة الكبد ، حيث كان ERCP و PTCD و PTCS والعلاج الجراحي عبثا. لقد استخدمنا طريقة جديدة للعلاج متعدد المناظير. أولا ، يتم استخدام ERCP وتنظير القنوات الصفراوية للمشغل الفردي عن طريق الفم لوضع دعامة بلاستيكية كعلامة في الطرف البعيد من موقع تسرب الصفراء. ثانيا ، يتم إجراء PTCS من خلال أنبوب PTCD. أثناء العملية ، يتم تحديد الطرف القريب من موقع تسرب الصفراء بواسطة الدعامة البلاستيكية والموجات فوق الصوتية B ، ويتم إعادة بناء استمرارية القناة الصفراوية مؤقتا من خلال سلك التوجيه والقسطرة البولية. ثالثا ، يتم وضع سلك توجيه مزدوج الرأس ، وإزالة القسطرة البولية ، ووضع الدعامات ، وإعادة بناء استمرارية القنوات الصفراوية. في الختام ، وجدنا طريقة جديدة تجمع بين ERCP وتنظير القنوات الصفراوية للمشغل الفردي عن طريق الفم و PTCS لعلاج تسرب الصفراء المعقد بعد زراعة الكبد.
Introduction
أصبحت زراعة الكبد معيارا للرعاية في المرضى الذين يعانون من أمراض الكبد في المرحلة النهائية. بعد زراعة الكبد ، يتأثر ما يقرب من 1/3 من المرضى بمضاعفات القناة الصفراوية ، مما يؤدي إلى مراضة كبيرة وانخفاض بقاء المريض على قيد الحياة ، وهو ما يسمى كعب العرقوب لزراعة الكبد1. التسرب الصفراوي هو ثاني أكثر المضاعفات شيوعا بعد زراعة الكبد ، حيث يبلغ معدل الإصابة 2٪ -21٪ 2،3،4. تشمل الأساليب المستخدمة بشكل شائع لعلاج المضاعفات الصفراوية تصوير البنكرياس والقنوات الصفراوية بالمنظار (ERCP) ، والتصريف الصفراوي عبر الكبد عن طريق الجلد (PTCD) ، وتنظير القنوات الصفراوية عبر الكبد عن طريق الجلد (PTCS) والجراحة5 ، لكنها ليست كلها فعالة.
الهدف من هذه الطريقة هو معالجة التسرب الصفراوي المعقد بعد زراعة الكبد من خلال الجمع بين ERCP وتنظير القنوات الصفراوية للمشغل الفردي عن طريق الفم و PTCS.
ينقسم المبدأ الفني لهذه الطريقة إلى ثلاث خطوات. أولا ، من خلال ERCP وتنظير القنوات الصفراوية للمشغل الفردي ، يتم تحديد الطرف البعيد للتسرب الصفراوي تحت الرؤية المباشرة ، ويتم وضع دعامة بلاستيكية كعلامة. بعد ذلك ، من خلال PTCS ، تحت توجيه الدعامة البلاستيكية ، يتم البحث عن الطرف القريب من التسرب الصفراوي من القناة الكبدية المشتركة تحت الرؤية المباشرة ، وتعيد القسطرة البولية بناء استمرارية القناة الصفراوية. أخيرا ، من خلال ERCP ، يتم استخدام سلك توجيه مزدوج الرأس ، وإزالة القسطرة البولية ، ويتم وضع دعامات القناة الكبدية اليمنى واليسرى لإعادة بناء استمرارية القناة الصفراوية.
تم الإبلاغ عن تنظير القنوات الصفراوية عن طريق الفم (POCS) لأول مرة من قبل اليابان في عام 19766. أبلغ Chen et al.7 لأول مرة عن الجيل الأول من نظام منظار الصفراو المرئي أحادي المشغل ، SpyGlass ، في عام 2007 ، وتم إطلاق الجيل الثاني من SpyGlass (SpyGlass DS) بواسطة Boston في عام 20158. مع تطور الأدوات ، أصبح تنظير القنوات الصفراوية للمشغل الفردي أرق وله وظائف أكثر.
أكبر ميزة لهذه الطريقة هي أنه يمكن إجراؤها تحت الرؤية المباشرة لتنظير القنوات الصفراوية للمشغل الفردي عن طريق الفم ، مما يزيد من معدل نجاح وسلامة العملية9،10،11،12. أبلغ راينر9 عن وضع دعامة ناجح باستخدام نظام الرؤية الصفراوية المباشر في مرضى ما بعد زرع الكبد الذين يعانون من فشل زرع دعامة ERCP ، واقترحوا أن التصور المباشر للفتحة الصغيرة عند تضيق القناة الصفراوية هو الطريقة الوحيدة لتمرير السلك التوجيهي بنجاح.
هذه الطريقة مناسبة للمرضى الذين يعانون من تسرب صفراوي معقد بعد زراعة الكبد والذين لا يمكن علاجهم عن طريق ERCP و PTCD و PTCS والجراحة.
أبلغنا عن حالة رجل يبلغ من العمر 38 عاما كان له تاريخ من مرض كرون والبهاق بالإضافة إلى فشل كبدي حاد مزمن ناجم عن تفشي فيروس التهاب الكبد B. انخفضت وظائف الكبد بمرور الوقت على الرغم من علاجات الكبد الاصطناعية المتكررة. عندما قدم طفل يبلغ من العمر 15 عاما مصابا بموت دماغي كبدا متبرعا مطابقا ، حدث تسرب الصفراء بعد 14 يوما من زراعة الكبد (الشكل 1 أ). تم تركيب أنبوب تصريف تجويف البطن و PTCD على الفور بسبب آلام البطن الحادة والصدمة الإنتانية. بعد التصريف ، تحسنت الصحة العامة للمريض ، وانخفضت كمية الانصباب البريتوني بشكل كبير (الشكل 1 ب).
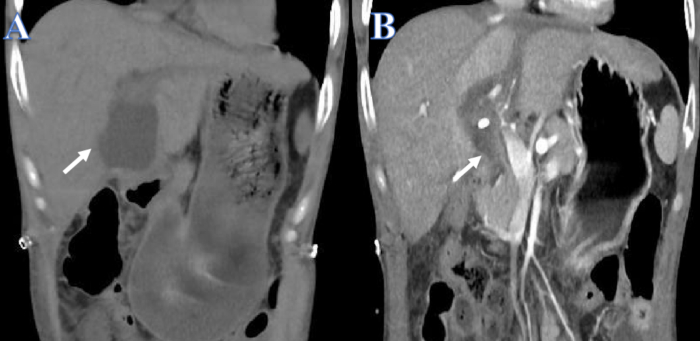
الشكل 1: قبل وبعد تصريف تسرب الصفراء. (أ) يظهر السهم الأبيض السائل قبل الصرف. (ب) يظهر السهم الأبيض السائل بعد الصرف. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
بعد 3 أسابيع ، كانت القناة الصفراوية داخل الكبد غير كافية لدعم سلك التوجيه ، الذي يمر بسهولة عبر القناة الصفراوية داخل الكبد إلى مواقع أخرى ، لذلك فشلت محاولة إعادة بناء القناة الصفراوية من أعلى إلى أسفل من خلال أنبوب PTCD في القنوات الكبدية اليمنى واليسرى (الشكل 2). بعد 4 أسابيع ، لم تنجح محاولة إعادة بناء القناة الصفراوية باستخدام ERCP من الأسفل إلى الأعلى لأن السلك التوجيهي لم يستطع المرور عبر التضيق إلى القناة الصفراوية داخل الكبد (الشكل 3). بعد أسبوعين ، تعذر تحديد موقع القناة الصفراوية المشتركة ، وكان هناك العديد من الحجارة عند تقاطع القنوات الكبدية اليمنى واليسرى في النقير ، مما يجعل من المستحيل إعادة بناء القناة الصفراوية من أعلى إلى أسفل باستخدام PTCS. بعد حوالي 4 أسابيع ، فشلت محاولة إعادة بناء القناة الصفراوية عن طريق فغر الصفراو الصائمي بسبب الالتهاب الواضح والوذمة في الأنسجة المحيطة بالتسرب الصفراوي ، وزاد تاريخ كرون السابق للمريض بشكل كبير من خطر تسرب القناة الصفراوية بعد الجراحة مع الناسور المعوي.
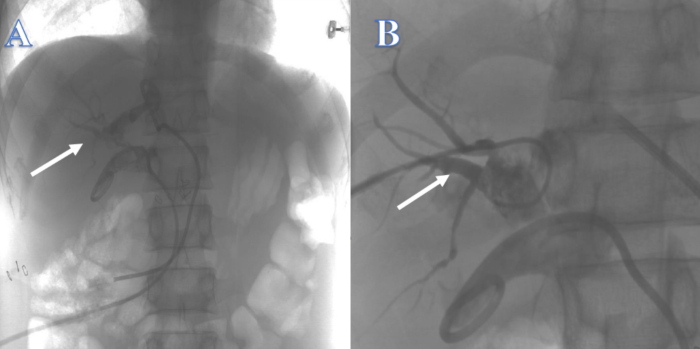
الشكل 2: استمرارية القناة الصفراوية التي أعيد بناؤها بواسطة PTC. (أ) يشير السهم الأبيض إلى محاولة من القناة الكبدية اليسرى. (ب) يشير السهم الأبيض إلى محاولة من القناة الكبدية اليمنى. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: استمرارية القناة الصفراوية التي أعيد بناؤها بواسطة ERCP. لا يمكن أن يدخل السلك التوجيهي إلى القناة الصفراوية داخل الكبد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
هنا ، وجدنا طريقة جديدة للجمع بين ERCP ، وتنظير القنوات الصفراوية للمشغل الفردي عن طريق الفم ، و PTCS لعلاج تسرب الصفراء المعقد بعد زراعة الكبد. تم وضع دعامة بلاستيكية لأول مرة لتحديد الطرف البعيد من تسرب الصفراء من خلال ERCP وتنظير القنوات الصفراوية للمشغل الفردي عن طريق الفم. ثم تم تحديد الطرف القريب من تسرب الصفراء بواسطة الموجات فوق الصوتية PTCS و B ، وأخيرا ، أعيد بناء استمرارية القناة الصفراوية بواسطة ERCP.
Protocol
تتوافق الدراسة مع المبادئ التوجيهية الأخلاقية لإعلان هلسنكي لعام 1975 وتمت الموافقة عليها من قبل لجنة الأخلاقيات في المستشفى التابع الأول لجامعة صن يات صن. تم الحصول على الموافقة المستنيرة من المريض.
1. التحضير قبل الجراحة
- إرشاد المريض للصيام لمدة 6-8 ساعات قبل ERCP. يجب تطبيق البيثيدين 1 ملغ/كغ، أنيسودامين 20 ملغ، حقن ميدازولام 1 ملغ، فلوربيبروفين 100 ملغ عن طريق الوريد، وتتراكائين هيدروكلوريد عن طريق الفم. عندما اختفى منعكس البلعوم ، تم اعتبار التخدير الموضعي بالإضافة إلى التخدير والمسكن ناجحا.
2. وضع دعامة بلاستيكية
- تأكد من وضع المريض في وضع الانبطاح ، وبمجرد أن يكون عمق التخدير مرضيا ، ابدأ الإجراء. أدخل منظار الاثني عشر في الفم ، ومرره عبر المريء والمعدة للوصول إلى الاثني عشر ، وابحث عن حليمة الاثني عشر.
- أدخل سلك التوجيه في القناة الصفراوية المشتركة.
- يجب تطبيق حقن اليوبروميد (تركيز اليود 300 ملغ/مل) بمعدل 2 مل/ثانية من خلال أنبوب ERCP أو PTCD. مراقبة القنوات الصفراوية داخل الكبد وخارج الكبد لتصوير الأقنية الصفراوية بعد الحقن ، وتحديد تضيق القناة الصفراوية. لاحظ أن تضيق القناة الصفراوية يقع في القناة الكبدية المشتركة ولا يمكن تصور القنوات الصفراوية داخل الكبد وخارج الكبد في وقت واحد (الشكل 4 أ).
- قم بتوسيع الفتحة السفلية للقناة الصفراوية المشتركة ببالون توسع 6-8 مم إلى 7 مم عن طريق حقن اليوبروميد في البالون.
- أدخل تنظير القنوات الصفراوية للمشغل الفردي عن طريق الفم لمراقبة القناة الصفراوية ، وابحث عن التضيقات التي لا يمكن تمريرها ، وأدخل سلك التوجيه من خلال التضيق ، متبوعا بالتمدد باستخدام بوجي تمدد صفراوي 6 مم.
- قم بتوسيع التضيق باستخدام بالون تمدد 6-8 مم إلى 7 مم عن طريق حقن اليوبروميد (الشكل 4 ب).
- أدخل تنظير القنوات الصفراوية للمشغل الفردي عن طريق الفم مرة أخرى لمراقبة القناة الصفراوية. لاحظ القناة الصفراوية العمياء مع الحجارة والمواد الندفية ، مع عدم ملاحظة القناة الصفراوية داخل الكبد حتى بعد حقن اليوبروميد.
- ضع دعامة صفراوية بلاستيكية مقاس 7 فهرنهايت × 7 سم في القناة العمياء من خلال التضيق ، وتم وضع الطرف الآخر خارج حليمة الاثني عشر (الشكل 4 ج).
- طوال الإجراء ، قم بتوفير الأكسجين من خلال قنية الأنف بمعدل 3 لتر / دقيقة وراقب عن كثب العلامات الحيوية أثناء ERCP. بعد ذلك ، قم بتوفير أدوية لتثبيط الحمض (إيزوميبرازول 40 مجم BID) ، وتثبيط الإنزيم (أوكتريوتيد 0.6 مجم Q12H) ، والتغذية بالحقن (مستحلب الدهون ، الأحماض الأمينية (17) والجلوكوز (1٪) حقن 1920 مل QD) ، تثبيط الألم (فلوربيبروفين 100 مجم QD) ، وتثبيط العدوى (سيفوبيرازون الصوديوم وسولباكتام الصوديوم للحقن 1.5 جم Q8H). إجراء اختبار الأميليز بعد العملية.
- أكمل العملية واطلب من المريض الصيام حتى ينخفض مستوى الأميليز إلى طبيعته. راقب المريض عن كثب لآلام البطن ، ميلينا ، إلخ.
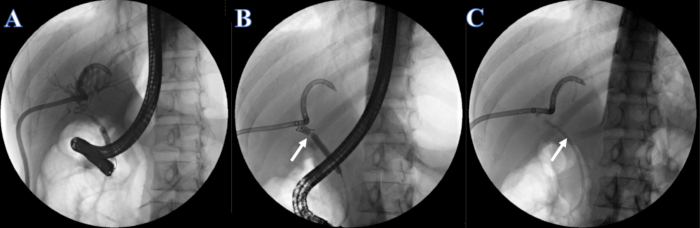
الشكل 4: دعامة بلاستيكية وضعتها ERCP. (أ) تصوير الأشانية الصفراوية PTCD. (ب) يشير السهم الأبيض إلى القسم الضيق. (ج) يشير السهم الأبيض إلى دعامات بلاستيكية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. وضع القسطرة البولية
- بعد 1 أسبوع من الشفاء ، اطلب من المريض الاستلقاء في وضع الاستلقاء وإعطاء التخدير. تطهير جلد شرسوفية باستخدام 0.5٪ يودوفور وقم بتغطيتها بمناشف معقمة.
- بعد التأكد من التخدير المناسب ، أدخل سلك التوجيه على طول أنبوب PTCD ، وقم بإزالة أنبوب PTCD ، وضع أنبوب غمد واقي 20F على طول سلك التوجيه. قم بإزالة السلك التوجيهي وضع منظار الصفراو على طول الغمد.
- اغسل المادة الندفية الصفراء المرصودة في القنوات الصفراوية لفصوص الكبد اليمنى واليسرى بالمحلول الملحي العادي.
- تحديد القناة الكبدية المشتركة عن طريق إيجاد تقاطع القنوات الكبدية اليمنى واليسرى تحت إشراف الموجات فوق الصوتية B. اغسل المادة الندفية الصفراء في فتحة القناة الكبدية المشتركة وقم بتوسيع تضيق القناة الكبدية المشتركة ببالونات 6 مم و 8 مم.
- حدد القناة الصفراوية المشتركة بواسطة الدعامة البلاستيكية الموضوعة في الخطوة 2 تحت توجيه الموجات فوق الصوتية B. أدخل منظار الصفراوات على طول القناة الكبدية المشتركة ، وقم بغسل وتوسيع الجزء الضيق من القناة الكبدية المشتركة بشكل متكرر. افتح الجزء الضيق تماما وابحث عن الدعامة البلاستيكية الموضوعة في الخطوة 2.
- أدخل السلك التوجيهي في حليمة الاثني عشر ، وقم بإزالة الغمد ، وأدخل قسطرة بولية 12F على طول سلك التوجيه إلى الاثني عشر. بمجرد الانتهاء من ذلك ، قم بإزالة السلك التوجيهي.
- قم بخياطة الجلد بإبرة مستدقة وخياطة غير قابلة للامتصاص 0-0 / T وربط الخيط على الجلد والقسطرة البولية.
- إعادة المريض إلى الجناح وإعطاء دواء لتثبيط الأحماض (إيزوميبرازول 40 مجم BID) ، تثبيط الإنزيم (أوكتريوتيد 0.6 مجم Q12H) ، التغذية بالحقن (مستحلب الدهون ، الأحماض الأمينية (17) والجلوكوز (1٪) حقن 1920 مل QD) ، تثبيط الألم (فلوربيبروفين 100 مجم QD) ، وتثبيط العدوى (سيفوبيرازون الصوديوم وسولباكتام الصوديوم للحقن 1.5 جم Q8H). إجراء اختبار الأميليز بعد العملية.
- اطلب من المريض الصيام حتى ينخفض مستوى الأميليز إلى طبيعته. راقب المريض عن كثب لآلام البطن ، ميلينا ، إلخ.
4. وضع الدعامة الصفراوية
- بعد 1 أسبوع من الشفاء ، ضع الدعامة الصفراوية. اطلب من المريض الاستلقاء في وضعية الانبطاح وإعطاء التخدير. افحص الدعامة البلاستيكية والقسطرة البولية لتكون في مكانها (الشكل 5 أ).
- عند التخدير المناسب ، أدخل منظار الاثني عشر في الفم ، ومرره عبر المريء والمعدة ، والوصول إلى الاثني عشر وابحث عن حليمة الاثني عشر. حدد القسطرة البولية ونهايات الدعامة البلاستيكية وقم بإزالة الدعامة البلاستيكية من الفم.
- أدخل سلك التوجيه مزدوج الرأس على طول القسطرة البولية. تأكد من الدخول الصحيح لسلك التوجيه إلى الاثني عشر ثم قم بتثبيته بمشبك جسم غريب ، ويمر عبر الاثني عشر والمعدة والمريء ، وإزالته من الفم.
- قطع خط تثبيت الجلد للقسطرة البولية وإزالة القسطرة البولية. تحت التنظير الفلوري بالأشعة السينية ، اضبط الطرف الآخر من سلك التوجيه مزدوج الرأس في القناة الكبدية اليمنى عن طريق سحب سلك التوجيه مزدوج الرأس من جانب الفم (الشكل 5 ب).
- أدخل سلكا توجيهيا آخر في القناة الكبدية اليسرى (الشكل 5 ب).
- ضع قناة صفراوية مزدوجة ضفيرة 7 فهرنهايت × 7 سم في القناة الكبدية اليسرى (الشكل 5 ج) ، ودعامة بلاستيكية للقناة الصفراوية 8.5 فهرنهايت × 12 سم في القناة الكبدية اليمنى ، مع الطرف الآخر المؤدي من حليمة الاثني عشر (الشكل 5 د).
- طوال الإجراء ، قم بتوفير الأكسجين من خلال قنية الأنف بمعدل 3 لتر / دقيقة وراقب عن كثب العلامات الحيوية أثناء ERCP. بعد ذلك ، قم بتوفير أدوية لتثبيط الحمض (إيزوميبرازول 40 مجم BID) ، وتثبيط الإنزيم (أوكتريوتيد 0.6 مجم Q12H) ، والتغذية بالحقن (مستحلب الدهون ، الأحماض الأمينية (17) والجلوكوز (1٪) حقن 1920 مل QD) ، تثبيط الألم (فلوربيبروفين 100 مجم QD) ، وتثبيط العدوى (سيفوبيرازون الصوديوم وسولباكتام الصوديوم للحقن 1.5 جم Q8H). قم بإجراء اختبار الأميليز بعد العملية.
- أكمل العملية. اطلب من المريض الصيام حتى ينخفض مستوى الأميليز إلى طبيعته. راقب المريض عن كثب لآلام البطن ، ميلينا ، إلخ.
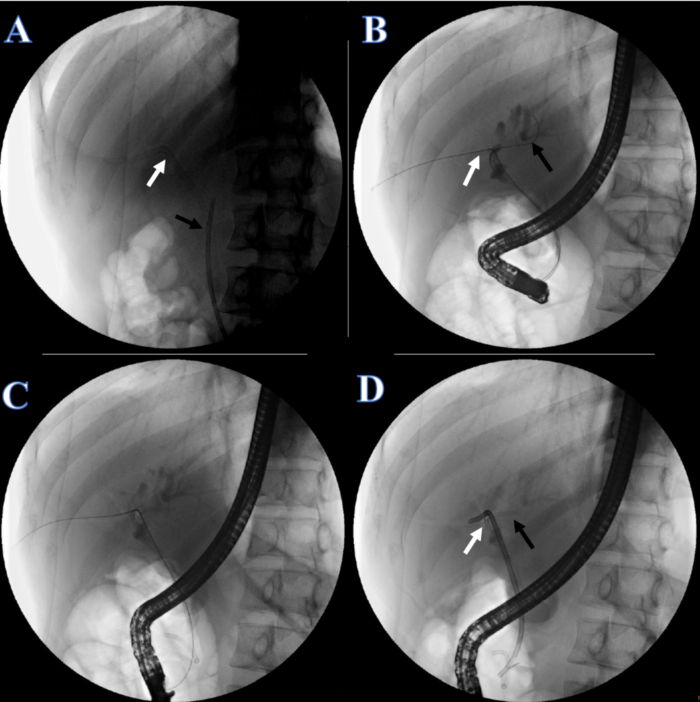
الشكل 5: استمرارية القناة الصفراوية التي أعيد بناؤها بواسطة ERCP. (أ) يشير السهم الأبيض إلى أنبوب PTCD. يشير السهم الأسود إلى الدعامة البلاستيكية. (ب) يشير السهم الأبيض إلى سلك التوجيه المزدوج عبر القناة الكبدية اليمنى. يشير السهم الأسود إلى سلك توجيه عبر القناة الكبدية اليسرى. (ج) دعامة بلاستيكية للقناة الكبدية اليسرى. (د) يشير السهم الأبيض إلى الدعامة البلاستيكية للقناة الكبدية اليمنى. يشير السهم الأسود إلى الدعامة البلاستيكية للقناة الكبدية اليسرى. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
نصف طريقة جديدة تجمع بين ERCP وتنظير القنوات الصفراوية للمشغل الفردي عن طريق الفم و PTCS لعلاج تسرب الصفراء المعقد بعد زراعة الكبد. لإعادة بناء استمرارية القناة الصفراوية ، وضعنا قناة صفراوية مزدوجة ضفيرة 7F × 7 سم في القناة الكبدية اليسرى (الشكل ...
Discussion
في الدراسة ، وجدنا طريقة جديدة للجمع بين ERCP وتنظير القنوات الصفراوية للمشغل الفردي عن طريق الفم و PTCS لعلاج تسرب الصفراء المعقد بعد زراعة الكبد. كانت الخطوات الرئيسية لهذه الطريقة كما يلي: أولا ، تحت تنظير القنوات الصفراوية للمشغل الفردي عن طريق الفم ، تم تحديد نهاية تسرب...
Disclosures
ويعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
ودعم هذا العمل بمنح من المؤسسة الوطنية للعلوم الطبيعية في الصين (81873591)؛ مؤسسة قوانغدونغ للعلوم الطبيعية (2022A1515011052) ؛ مشروع تخطيط العلوم والتكنولوجيا في مقاطعة قوانغدونغ (2018A050506030) ؛ برنامج العلوم والتكنولوجيا في قوانغتشو (201704020073); إسقاط بناء المختبرات الرئيسية لمقاطعة قوانغدونغ بشأن التبرع بالأعضاء والمناعة بزراعة الأعضاء (2013A061401007 و 2017B030314018) ؛ وقاعدة التعاون الدولي لمقاطعة قوانغدونغ للعلوم والتكنولوجيا (زرع الأعضاء) (2015B050501002).
Materials
| Name | Company | Catalog Number | Comments |
| Biliary stent | Boston Scientific | M00533560 | 7 F*7 cm |
| Branch choledochoscope | Leinzett | LAN-EP-2612 | |
| Disposable electric snare | Boston Scientific | M00562320 | |
| Disposable sphincterotomy knife | Boston Scientific | M00545170 | |
| Electronic choledochoscope | Olympus | / | |
| Electronic duodenum mirror | Olympus | / | |
| Guidewire | Boston Scientific | M00556140 | |
| Guidewire guided the dilated balloon catheter | Boston Scientific | M00558600 | |
| Integrated biliary stent | Boston Scientific | M00539210 | 7 F*7 cm |
| Integrated biliary stent | Boston Scientific | M00539280 | 8.5 F*12 cm |
References
- Duffy, J. P., et al. Long-term patient outcome and quality of life after liver transplantation: Analysis of 20-year survivors. Ann Surg. 252 (4), 652-661 (2010).
- Riediger, C., et al. T-tube or no t-tube in the reconstruction of the biliary tract during orthotopic liver transplantation: Systematic review and meta-analysis. Liver Transpl. 16 (6), 705-717 (2010).
- Wojcicki, M., Milkiewicz, P., Silva, M. Biliary tract complications after liver transplantation: A review. Dig Surg. 25 (4), 245-257 (2008).
- Thuluvath, P. J., Pfau, P. R., Kimmey, M. B., Ginsberg, G. G. Biliary complications after liver transplantation: The role of endoscopy. Endoscopy. 37 (9), 857-863 (2005).
- Macías-Gómez, C., Dumonceau, J. M. Endoscopic management of biliary complications after liver transplantation: An evidence-based review. World J Gastrointest Endosc. 7 (6), 606-616 (2015).
- Nakajima, M., Akasaka, Y., Fukumoto, K., Mitsuyoshi, Y., Kawai, K. Peroral cholangiopancreatosocopy (pcps) under duodenoscopic guidance. Am J Gastroenterol. 66 (3), 241-247 (1976).
- Chen, Y. K., et al. Single-operator cholangioscopy in patients requiring evaluation of bile duct disease or therapy of biliary stones (with videos). Gastrointest Endosc. 74 (4), 805-814 (2011).
- Kulpatcharapong, S., Pittayanon, R. S. J. K., Rerknimitr, R. Diagnostic performance of different cholangioscopes in patients with biliary strictures: A systematic review. Endoscopy. 52 (3), 174-185 (2020).
- Rainer, F., et al. A novel way to avoid reoperation for biliary strictures after liver transplantation: Cholangioscopy-assisted guidewire placement. Endoscopy. 51 (11), E314-E316 (2019).
- Bokemeyer, A., et al. Digital single-operator cholangioscopy: A useful tool for selective guidewire placements across complex biliary strictures. Surg Endosc. 33 (3), 731-737 (2019).
- Woo, Y. S., et al. Spyglass cholangioscopy-assisted guidewire placement for post-ldlt biliary strictures: A case series. Surg Endosc. 30 (9), 3897-3903 (2016).
- Martins, F. P., Seleti, S. M. R., Contini, M. L., Ga, D. E. P., Ferrari, A. P. Is there a place for cholangioscopic evaluation of biliary anastomotic stricture after deceased donor liver transplant. Arq Gastroenterol. 57 (4), 347-353 (2020).
- Magro, B., Tacelli, M., Mazzola, A., Conti, F., Celsa, C. Biliary complications after liver transplantation: Current perspectives and future strategies. Hepatobiliary Surg Nutr. 10 (1), 76-92 (2021).
- Arain, M. A., Attam, R., Freeman, M. L. Advances in endoscopic management of biliary tract complications after liver transplantation. Liver Transpl. 19 (5), 482-498 (2013).
- Tsujino, T., et al. Endoscopic management of biliary complications after adult living donor liver transplantation. Am J Gastroenterol. 101 (10), 2230-2236 (2006).
- López Álvarez, M., Otero, M., Vázquez Millán, M. A., Suárez López, F., Alonso Aguirre, P. Endoscopic treatment of biliary complications after liver transplantation. Rev Esp Enferm Dig. 112 (8), 605-608 (2020).
- Alves, A. R., Gomes, D., Furtado, E., Tomé, L. Efficacy of endoscopic retrograde cholangiopancreatography in the treatment of biliary complications following liver transplant: 10 years of a single-centre experience. GE Port J Gastroenterol. 25 (1), 10-17 (2018).
- Yasen, A., et al. Efficiency of percutaneous transhepatic cholangioscopy in the treatment of biliary complications after liver transplantation. HPB (Oxford). 25 (4), 463-471 (2023).
- Zimmerman, M. A., et al. resolution of biliary complications after living and deceased donor liver transplantation: A report from the adult-to-adult living donor liver transplantation cohort study consortium. Liver Transpl. 19 (3), 259-267 (2013).
- Moy, B. T., Birk, J. W. A review on the management of biliary complications after orthotopic liver transplantation. J Clin Transl Hepatol. 7 (1), 61-71 (2019).
- Wadhawan, M., Kumar, A. Management issues in post living donor liver transplant biliary strictures. World J Hepatol. 8 (10), 461-470 (2016).
- Enochsson, L., et al. Nationwide, population-based data from 11,074 ercp procedures from the swedish registry for gallstone surgery and ercp. Gastrointest Endosc. 72 (6), 1175-1184 (2010).
- Khan, M. A., et al. Endoscopic ultrasound-guided biliary drainage: A systematic review and meta-analysis. Dig Dis Sci. 61 (3), 684-703 (2016).
- Dhir, V., et al. Endoscopic ultrasonography-guided biliary and pancreatic duct interventions. Dig Endosc. 29 (4), 472-485 (2017).
- Derdeyn, J., Laleman, W. Current role of endoscopic cholangioscopy. Curr Opin Gastroenterol. 34 (5), 301-308 (2018).
- Iwashita, T., Doi, S., Yasuda, I. Endoscopic ultrasound-guided biliary drainage: A review. Clin J Gastroenterol. 7 (2), 94-102 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved