É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Novo tratamento para vazamento de bile complexa após transplante de fígado
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O vazamento biliar é uma complicação comum após o transplante de fígado que afeta significativamente o prognóstico dos pacientes. O protocolo apresenta um novo método de combinação de colangiopancreatografia retrógrada endoscópica (CPRE), coledocoscópio de ramo e colangioscopia trans-hepática percutânea (PTCS) para o tratamento de extravasamento biliar complexo após transplante hepático.
Resumo
O vazamento biliar é uma complicação comum após o transplante de fígado que geralmente pode ser curada com colangiopancreatografia retrógrada endoscópica (CPRE), drenagem colangial trans-hepática percutânea (PTCD), colangioscopia trans-hepática percutânea (PTCS) e cirurgia. Relatamos um novo tratamento para vazamento biliar com duração de 9 meses após o transplante hepático, durante o qual ERCP, PTCD, PTCS e terapia cirúrgica foram em vão. Usamos um novo método de tratamento multiendoscópico. Primeiro, a CPRE e a colangioscopia peroral de operador único são usadas para colocar um stent plástico como marcador na extremidade distal do local do vazamento biliar. Em segundo lugar, o PTCS é realizado através do tubo PTCD. Durante a operação, a extremidade proximal do local do vazamento biliar é localizada pelo stent plástico e ultrassom B, e a continuidade do trato biliar é temporariamente reconstruída através do fio-guia e do cateter urinário. Terceiro, um fio-guia de duas cabeças é colocado, o cateter urinário é removido, os stents são colocados e a continuidade biliar é reconstruída. Em conclusão, encontramos um novo método que combina CPRE, colangioscopia peroral de operador único e PTCS para tratar o vazamento biliar complexo após transplante de fígado.
Introdução
O transplante de fígado tornou-se um padrão de tratamento em pacientes com doença hepática em estágio terminal. Após o transplante hepático, aproximadamente 1/3 dos pacientes são acometidos por complicações do trato biliar, e estas resultam em morbidade significativa e diminuição da sobrevida do paciente, o que é chamado de calcanhar de Aquiles do transplante hepático1. O vazamento biliar é a segunda complicação mais comum após o transplante hepático, com incidência de 2% a 21%2,3,4. As abordagens comumente utilizadas para o tratamento de complicações biliares envolvem colangiopancreatografia retrógrada endoscópica (CPRE), drenagem colangiosa trans-hepática percutânea (PTCD), colangioscopia trans-hepática percutânea (PTCS) e cirurgia5, mas nem todas são eficazes.
O objetivo deste método é abordar o vazamento biliar complexo após o transplante de fígado, combinando CPRE, colangioscopia peroral de operador único e PTCS.
O princípio técnico deste método é dividido em três etapas. Primeiramente, por meio de CPRE e colangioscopia peroral de operador único, a extremidade distal do vazamento biliar é identificada sob visão direta e um stent plástico é colocado como marcador. Em seguida, através da CPPT, sob a orientação do stent plástico, a extremidade proximal do vazamento biliar é pesquisada a partir do ducto hepático comum sob visão direta, e o cateter urinário reconstrói a continuidade do trato biliar. Por fim, por meio da CPRE, é utilizado um fio-guia de duas cabeças, o cateter urinário é removido e os stents dos ductos hepáticos esquerdo e direito são colocados para reconstruir a continuidade biliar.
A colangioscopia peroral (POCS) foi relatada pela primeira vez pelo Japão em 19766. Chen et al.7 relataram pela primeira vez o sistema de coledocoscópio de visualização de operador único de primeira geração, SpyGlass, em 2007, e o SpyGlass de segunda geração (SpyGlass DS) foi lançado por Boston em 20158. Com o desenvolvimento dos instrumentos, a colangioscopia peroral de operador único tornou-se mais fina e tem mais funções.
A maior vantagem desse método é que ele pode ser realizado sob a visão direta da colangioscopia peroral de operador único, o que aumenta a taxa de sucesso e a segurança da operação9,10,11,12. Rainer9 relatou a colocação bem-sucedida do stent usando um sistema de visão biliar direta em pacientes pós-transplante de fígado com falha no implante do stent ERCP, e eles sugeriram que a visualização direta da pequena abertura na estenose biliar era a única maneira de passar com sucesso o fio-guia.
Este método é adequado para pacientes com vazamento biliar complexo após transplante de fígado que não podem ser curados por ERCP, PTCD, PTCS e cirurgia.
Relatamos o caso de um homem de 38 anos com história de doença de Crohn e vitiligo, além de insuficiência hepática aguda crônica provocada por um surto do vírus da hepatite B. A função hepática diminuiu ao longo do tempo, apesar dos repetidos tratamentos hepáticos artificiais. Quando uma criança de 15 anos com morte encefálica forneceu um fígado de doador compatível, o vazamento de bile ocorreu 14 dias após o transplante de fígado (Figura 1A). O tubo de drenagem da cavidade abdominal e o PTCD foram instalados imediatamente devido à dor abdominal aguda e choque séptico. Após a drenagem, a saúde geral do paciente melhorou e a quantidade de derrame peritoneal foi bastante reduzida (Figura 1B).
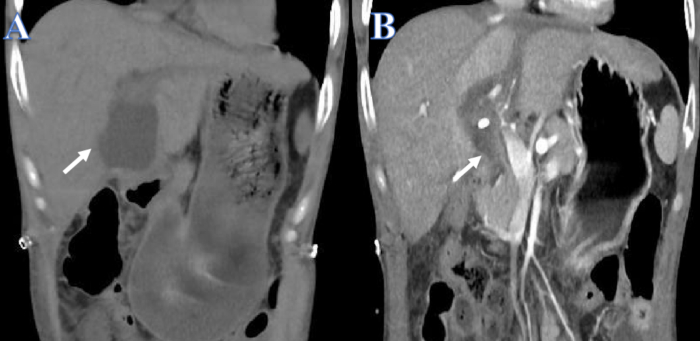
Figura 1: Antes e depois da drenagem do vazamento biliar. (A) A seta branca mostra o fluido antes da drenagem. (B) A seta branca mostra o fluido após a drenagem. Clique aqui para ver uma versão maior desta figura.
Após 3 semanas, o ducto biliar intra-hepático era insuficiente para suportar o fio-guia, que passava facilmente pelo ducto biliar intra-hepático para outros locais, de modo que a tentativa de reconstruir o trato biliar de cima para baixo através do tubo PTCD nos ductos hepáticos esquerdo e direito falhou (Figura 2). Após 4 semanas, uma tentativa de reconstrução das vias biliares usando CPRE de baixo para cima não teve sucesso porque o fio-guia não conseguiu passar pela estenose para o ducto biliar intra-hepático (Figura 3). Após 2 semanas, o ducto colédoco não pôde ser localizado e havia vários cálculos na junção dos ductos hepáticos esquerdo e direito no hilar, impossibilitando a reconstrução do trato biliar de cima para baixo com PTCS. Cerca de 4 semanas depois, uma tentativa de reconstrução do trato biliar por coledochojejunostomia falhou devido à inflamação e edema óbvios do tecido ao redor do vazamento biliar, e a história prévia de Crohn do paciente aumentou muito o risco de vazamento biliar pós-operatório com fístula intestinal.
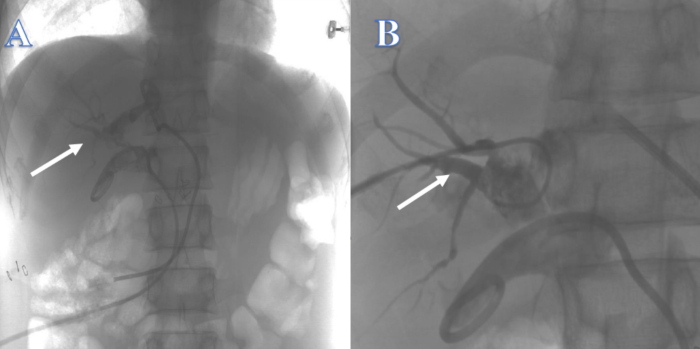
Figura 2: Continuidade biliar reconstruída por PTC. (A) A seta branca indica uma tentativa do ducto hepático esquerdo. (B) A seta branca indica uma tentativa do ducto hepático direito. Clique aqui para ver uma versão maior desta figura.

Figura 3: Continuidade biliar reconstruída por CPRE. O fio-guia não conseguia entrar no ducto biliar intra-hepático. Clique aqui para ver uma versão maior desta figura.
Aqui, encontramos um novo método de combinação de CPRE, colangioscopia peroral de operador único e PTCS para tratar o vazamento complexo de bile após transplante de fígado. Um stent plástico foi colocado primeiro para localizar a extremidade distal do vazamento biliar por meio de CPRE e colangioscopia peroral de operador único. A extremidade proximal do vazamento biliar foi então localizada por PTCS e ultrassom B e, finalmente, a continuidade do trato biliar foi reconstruída por CPRE.
Protocolo
O estudo estava em conformidade com as diretrizes éticas da Declaração de Helsinque de 1975 e foi aprovado pelo Comitê de Ética do Primeiro Hospital Afiliado da Universidade Sun Yat-sen. O consentimento informado foi obtido do paciente.
1. Preparo pré-operatório
- Instrua o paciente a jejuar por 6-8 h antes da CPRE. Administre petidina 1 mg / kg, anisodamina 20 mg, injeção de midazolam 1 mg, flurbiprofeno 100 mg por via intravenosa e cloridrato de tetracaína por via oral. Quando o reflexo faríngeo desapareceu, a anestesia local mais sedação e analgesia foram consideradas bem-sucedidas.
2. Colocação de stent de plástico
- Certifique-se de que o paciente seja colocado em decúbito ventral e, quando a profundidade da anestesia for satisfatória, inicie o procedimento. Insira o duodenoscópio na boca, passe-o pelo esôfago e estômago para alcançar o duodeno e encontre a papila duodenal.
- Insira o fio-guia no ducto colédoco.
- Administre injeção de ioprometo (concentração de iodo 300 mg / mL) a uma taxa de 2 mL / s através do tubo ERCP ou PTCD. Observe os ductos biliares intra-hepáticos e extra-hepáticos para colangiografia após a injeção e identifique a estenose do ducto biliar. Observe que a estenose do ducto biliar está localizada no ducto hepático comum e os ductos biliares intra-hepáticos e extra-hepáticos não podem ser visualizados simultaneamente (Figura 4A).
- Dilate a abertura inferior do ducto colédoco com um balão de dilatação de 6-8 mm para 7 mm injetando ioprometo no balão.
- Insira a colangioscopia peroral de operador único para observar o ducto biliar, encontre estenoses que não podem ser passadas e insira o fio-guia através da estenose, seguida de dilatação com um bougie dilatador biliar de 6 mm.
- Dilate a estenose com um balão de dilatação de 6-8 mm para 7 mm injetando injeção de ioprometo ( Figura 4B ).
- Insira a colangioscopia peroral de operador único novamente para observar o ducto biliar. Observe o ducto biliar cego com cálculos e material floculante, sem nenhum ducto biliar intra-hepático observado mesmo após a injeção de ioprometo.
- Coloque um stent biliar plástico 7F x 7 cm no ducto cego através da estenose, e a outra extremidade foi colocada fora da papila duodenal (Figura 4C).
- Durante todo o procedimento, forneça oxigênio através de uma cânula nasal a 3 L/min e monitore de perto os sinais vitais durante a CPRE. Em seguida, forneça medicamentos para inibição ácida (Esomeprazol 40 mg BID), inibição enzimática (Octreotida 0,6 mg Q12H), nutrição parenteral (Emulsão de Gordura, Aminoácidos (17) e Glicose (1%) Injeção 1920 mL QD), inibição da dor (Flurbiprofeno 100mg QD) e inibição de infecção (Cefoperazona Sódica e Sulbactam Sódico para Injeção 1,5 g Q8H). Realize um teste de amilase após a operação.
- Conclua a operação e instrua o paciente a jejuar até que o nível de amilase caia ao normal. Observe atentamente o paciente quanto a dores abdominais, melena, etc.
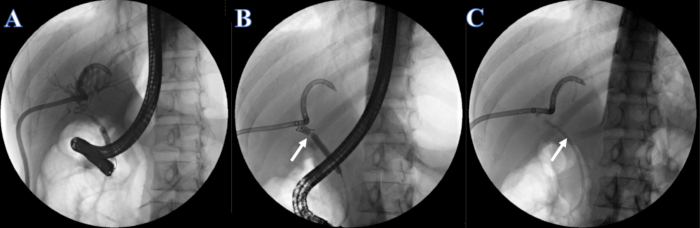
Figura 4: Stent plástico colocado por CPRE. (A) Colangiografia PTCD. (B) A seta branca indica a seção estreita. (C) A seta branca indica stent de plástico. Clique aqui para ver uma versão maior desta figura.
3. Colocação de cateter urinário
- Após 1 semana de recuperação, instrua o paciente a deitar-se em decúbito dorsal e administrar anestesia. Desinfete a pele do epigástrio com 0,5% de iodóforo e cubra com toalhas estéreis.
- Depois de confirmar a anestesia adequada, insira o fio-guia ao longo do tubo PTCD, remova o tubo PTCD e coloque um tubo de bainha protetora 20F ao longo do fio-guia. Remova o fio-guia e coloque um coledocoscópio ao longo da bainha.
- Lave o material floculante amarelo observado nos ductos biliares dos lobos do fígado direito e esquerdo com solução salina normal.
- Identifique o ducto hepático comum encontrando a junção dos ductos hepáticos esquerdo e direito sob a orientação do ultrassom B. Lave o material floculante amarelo na abertura do ducto hepático comum e dilate a estenose do ducto hepático comum com balões de 6 mm e 8 mm.
- Identifique o ducto colédoco pelo stent plástico colocado na etapa 2 sob orientação de ultrassom B. Insira o coledocoscópio ao longo do ducto hepático comum e lave e dilate o segmento estenótico do ducto hepático comum repetidamente. Abra o segmento estenótico completamente e encontre o stent plástico colocado no passo 2.
- Insira o fio-guia na papila duodenal, remova a bainha e insira um cateter urinário 12F ao longo do fio-guia até o duodeno. Uma vez feito isso, remova o fio-guia.
- Costure a pele com uma agulha cônica e sutura não absorvível 0-0/T e dê um nó na sutura na pele e no cateter urinário.
- Retorne o paciente à enfermaria e administre medicamentos para inibição ácida (Esomeprazol 40 mg BID), inibição enzimática (Octreotida 0,6 mg Q12H), nutrição parenteral (Emulsão de Gordura, Aminoácidos (17) e Glicose (1%) Injeção 1920 mL QD), inibição da dor (Flurbiprofeno 100 mg QD) e inibição de infecção (Cefoperazona Sódica e Sulbactam Sódico para Injeção 1,5 g Q8H). Realize um teste de amilase após a operação.
- Instrua o paciente a jejuar até que o nível de amilase caia ao normal. Observe atentamente o paciente quanto a dores abdominais, melena, etc.
4. Colocação de stent biliar
- Após 1 semana de recuperação, coloque o stent biliar. Instrua o paciente a deitar em decúbito ventral e administrar anestesia. Verifique se o stent plástico e o cateter urinário estão no lugar (Figura 5A).
- Após anestesia adequada, insira o duodenoscópio na boca, passe-o pelo esôfago e estômago, alcance o duodeno e encontre a papila duodenal. Identifique o cateter urinário e as extremidades do stent plástico e remova o stent plástico da boca.
- Insira o fio-guia de duas cabeças ao longo do cateter urinário. Garanta a entrada correta do fio-guia no duodeno e, em seguida, prenda com uma pinça de corpo estranho, passando pelo duodeno, estômago e esôfago e removido da boca.
- Corte a linha de fixação da pele do cateter urinário e remova o cateter urinário. Sob fluoroscopia de raios-X, ajuste a outra extremidade do fio-guia de duas cabeças no ducto hepático direito, puxando o fio-guia de duas cabeças do lado da boca (Figura 5B).
- Insira outro fio-guia no ducto hepático esquerdo (Figura 5B).
- Coloque um ducto biliar duplo pigtail de 7F x 7 cm no ducto hepático esquerdo (Figura 5C) e um stent plástico do ducto biliar de 8,5 F x 12 cm no ducto hepático direito, com a outra extremidade saindo da papila duodenal (Figura 5D).
- Durante todo o procedimento, forneça oxigênio através de uma cânula nasal a 3 L/min e monitore de perto os sinais vitais durante a CPRE. Em seguida, forneça medicamentos para inibição ácida (Esomeprazol 40 mg BID), inibição enzimática (Octreotida 0,6 mg Q12H), nutrição parenteral (Emulsão de Gordura, Aminoácidos (17) e Glicose (1%) Injeção 1920 mL QD), inibição da dor (Flurbiprofeno 100mg QD) e inibição de infecção (Cefoperazona Sódica e Sulbactam Sódico para Injeção 1,5 g Q8H). Realize um teste de amilase após a operação.
- Conclua a operação. Instrua o paciente a jejuar até que o nível de amilase caia ao normal. Observe atentamente o paciente quanto a dores abdominais, melena, etc.
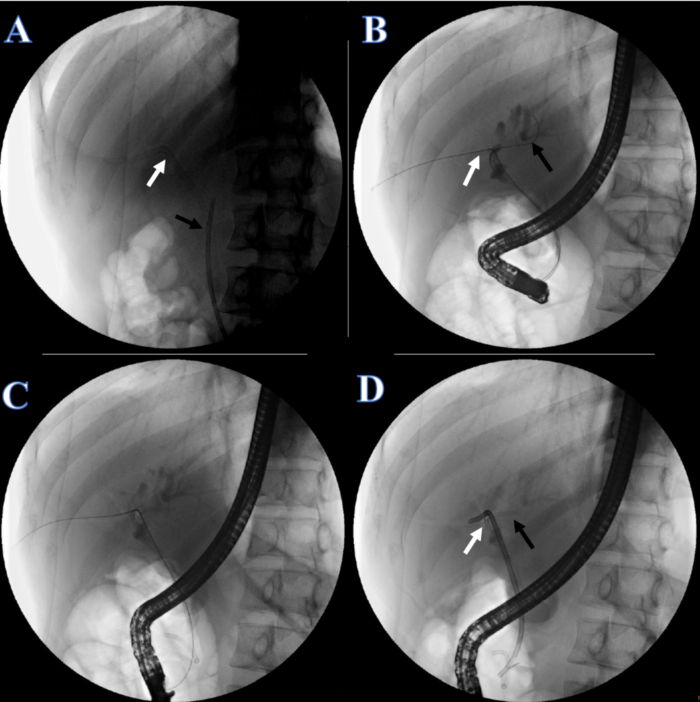
Figura 5: Continuidade biliar reconstruída por CPRE. (A) A seta branca indica o tubo PTCD. A seta preta indica o stent de plástico. (B) A seta branca indica o fio-guia duplo através do ducto hepático direito. A seta preta indica um fio-guia através do ducto hepático esquerdo. (C) Um stent plástico para o ducto hepático esquerdo. (D) A seta branca indica o stent plástico para o ducto hepático direito. A seta preta indica o stent plástico para o ducto hepático esquerdo. Clique aqui para ver uma versão maior desta figura.
Resultados
Descrevemos um novo método que combina CPRE, colangioscopia peroral de operador único e PTCS para tratar o vazamento biliar complexo após transplante de fígado. Para reconstruir a continuidade biliar, colocamos um ducto biliar duplo pigtail de 7F x 7 cm no ducto hepático esquerdo (Figura 5C) e um stent plástico do ducto biliar de 8,5 F x 12 cm no ducto hepático direito (Figura 5D), usando ...
Discussão
No estudo, encontramos um novo método de combinação de CPRE, colangioscopia peroral de operador único e PTCS para o tratamento de vazamento biliar complexo após transplante de fígado. As principais etapas desse método foram as seguintes: primeiro, sob a colangioscopia peroral de operador único, o fim do vazamento biliar foi identificado e um stent plástico foi colocado. Em segundo lugar, sob a orientação do ultrassom B, as estenoses comuns do ducto hepático foram observadas e...
Divulgações
Os autores declaram não haver conflito de interesses.
Agradecimentos
Este trabalho foi apoiado por doações da Fundação Nacional de Ciências Naturais da China (81873591); a Fundação de Ciências Naturais de Guangdong (2022A1515011052); o Projeto de Planejamento de Ciência e Tecnologia da Província de Guangdong (2018A050506030); o Programa de Ciência e Tecnologia de Guangzhou (201704020073); a Projeção de Construção do Laboratório Chave da Província de Guangdong sobre Imunologia de Doação e Transplante de Órgãos (2013A061401007 e 2017B030314018); e a Base de Ciência e Tecnologia de Cooperação Internacional da Província de Guangdong (Transplante de Órgãos) (2015B050501002).
Materiais
| Name | Company | Catalog Number | Comments |
| Biliary stent | Boston Scientific | M00533560 | 7 F*7 cm |
| Branch choledochoscope | Leinzett | LAN-EP-2612 | |
| Disposable electric snare | Boston Scientific | M00562320 | |
| Disposable sphincterotomy knife | Boston Scientific | M00545170 | |
| Electronic choledochoscope | Olympus | / | |
| Electronic duodenum mirror | Olympus | / | |
| Guidewire | Boston Scientific | M00556140 | |
| Guidewire guided the dilated balloon catheter | Boston Scientific | M00558600 | |
| Integrated biliary stent | Boston Scientific | M00539210 | 7 F*7 cm |
| Integrated biliary stent | Boston Scientific | M00539280 | 8.5 F*12 cm |
Referências
- Duffy, J. P., et al. Long-term patient outcome and quality of life after liver transplantation: Analysis of 20-year survivors. Ann Surg. 252 (4), 652-661 (2010).
- Riediger, C., et al. T-tube or no t-tube in the reconstruction of the biliary tract during orthotopic liver transplantation: Systematic review and meta-analysis. Liver Transpl. 16 (6), 705-717 (2010).
- Wojcicki, M., Milkiewicz, P., Silva, M. Biliary tract complications after liver transplantation: A review. Dig Surg. 25 (4), 245-257 (2008).
- Thuluvath, P. J., Pfau, P. R., Kimmey, M. B., Ginsberg, G. G. Biliary complications after liver transplantation: The role of endoscopy. Endoscopy. 37 (9), 857-863 (2005).
- Macías-Gómez, C., Dumonceau, J. M. Endoscopic management of biliary complications after liver transplantation: An evidence-based review. World J Gastrointest Endosc. 7 (6), 606-616 (2015).
- Nakajima, M., Akasaka, Y., Fukumoto, K., Mitsuyoshi, Y., Kawai, K. Peroral cholangiopancreatosocopy (pcps) under duodenoscopic guidance. Am J Gastroenterol. 66 (3), 241-247 (1976).
- Chen, Y. K., et al. Single-operator cholangioscopy in patients requiring evaluation of bile duct disease or therapy of biliary stones (with videos). Gastrointest Endosc. 74 (4), 805-814 (2011).
- Kulpatcharapong, S., Pittayanon, R. S. J. K., Rerknimitr, R. Diagnostic performance of different cholangioscopes in patients with biliary strictures: A systematic review. Endoscopy. 52 (3), 174-185 (2020).
- Rainer, F., et al. A novel way to avoid reoperation for biliary strictures after liver transplantation: Cholangioscopy-assisted guidewire placement. Endoscopy. 51 (11), E314-E316 (2019).
- Bokemeyer, A., et al. Digital single-operator cholangioscopy: A useful tool for selective guidewire placements across complex biliary strictures. Surg Endosc. 33 (3), 731-737 (2019).
- Woo, Y. S., et al. Spyglass cholangioscopy-assisted guidewire placement for post-ldlt biliary strictures: A case series. Surg Endosc. 30 (9), 3897-3903 (2016).
- Martins, F. P., Seleti, S. M. R., Contini, M. L., Ga, D. E. P., Ferrari, A. P. Is there a place for cholangioscopic evaluation of biliary anastomotic stricture after deceased donor liver transplant. Arq Gastroenterol. 57 (4), 347-353 (2020).
- Magro, B., Tacelli, M., Mazzola, A., Conti, F., Celsa, C. Biliary complications after liver transplantation: Current perspectives and future strategies. Hepatobiliary Surg Nutr. 10 (1), 76-92 (2021).
- Arain, M. A., Attam, R., Freeman, M. L. Advances in endoscopic management of biliary tract complications after liver transplantation. Liver Transpl. 19 (5), 482-498 (2013).
- Tsujino, T., et al. Endoscopic management of biliary complications after adult living donor liver transplantation. Am J Gastroenterol. 101 (10), 2230-2236 (2006).
- López Álvarez, M., Otero, M., Vázquez Millán, M. A., Suárez López, F., Alonso Aguirre, P. Endoscopic treatment of biliary complications after liver transplantation. Rev Esp Enferm Dig. 112 (8), 605-608 (2020).
- Alves, A. R., Gomes, D., Furtado, E., Tomé, L. Efficacy of endoscopic retrograde cholangiopancreatography in the treatment of biliary complications following liver transplant: 10 years of a single-centre experience. GE Port J Gastroenterol. 25 (1), 10-17 (2018).
- Yasen, A., et al. Efficiency of percutaneous transhepatic cholangioscopy in the treatment of biliary complications after liver transplantation. HPB (Oxford). 25 (4), 463-471 (2023).
- Zimmerman, M. A., et al. resolution of biliary complications after living and deceased donor liver transplantation: A report from the adult-to-adult living donor liver transplantation cohort study consortium. Liver Transpl. 19 (3), 259-267 (2013).
- Moy, B. T., Birk, J. W. A review on the management of biliary complications after orthotopic liver transplantation. J Clin Transl Hepatol. 7 (1), 61-71 (2019).
- Wadhawan, M., Kumar, A. Management issues in post living donor liver transplant biliary strictures. World J Hepatol. 8 (10), 461-470 (2016).
- Enochsson, L., et al. Nationwide, population-based data from 11,074 ercp procedures from the swedish registry for gallstone surgery and ercp. Gastrointest Endosc. 72 (6), 1175-1184 (2010).
- Khan, M. A., et al. Endoscopic ultrasound-guided biliary drainage: A systematic review and meta-analysis. Dig Dis Sci. 61 (3), 684-703 (2016).
- Dhir, V., et al. Endoscopic ultrasonography-guided biliary and pancreatic duct interventions. Dig Endosc. 29 (4), 472-485 (2017).
- Derdeyn, J., Laleman, W. Current role of endoscopic cholangioscopy. Curr Opin Gastroenterol. 34 (5), 301-308 (2018).
- Iwashita, T., Doi, S., Yasuda, I. Endoscopic ultrasound-guided biliary drainage: A review. Clin J Gastroenterol. 7 (2), 94-102 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados