Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Nuevo tratamiento para la fuga compleja de bilis después de un trasplante de hígado
* Estos autores han contribuido por igual
En este artículo
Resumen
La fuga de bilis es una complicación común después del trasplante de hígado que afecta significativamente el pronóstico de los pacientes. El protocolo presenta un nuevo método que combina la colangiopancreatografía retrógrada endoscópica (CPRE), el coledochoscopio de rama y la colangioscopia transhepática percutánea (PTCS) para el tratamiento de la fuga compleja de bilis después del trasplante hepático.
Resumen
La fuga de bilis es una complicación común después del trasplante de hígado que generalmente se puede curar con colangiopancreatografía retrógrada endoscópica (CPRE), drenaje colangial transhepático percutáneo (PTCD), colangioscopia transhepática percutánea (PTCS) y cirugía. Presentamos un tratamiento novedoso para la fuga biliar que duró 9 meses después del trasplante hepático, durante los cuales la CERP, PTCD, PTCS y la terapia quirúrgica fueron en vano. Hemos utilizado un nuevo método de tratamiento multiendoscópico. En primer lugar, se utilizan la CPRE y la colangioscopia peroral de un solo operador para colocar un stent de plástico como marcador en el extremo distal del sitio de fuga de bilis. En segundo lugar, el PTCS se realiza a través del tubo PTCD. Durante la operación, el stent plástico y la ecografía B localizan el extremo proximal del sitio de fuga biliar, y se reconstruye temporalmente la continuidad de la vía biliar a través de la guía y el catéter urinario. En tercer lugar, se coloca una guía de doble cabeza, se retira el catéter urinario, se colocan los stents y se reconstruye la continuidad biliar. En conclusión, hemos encontrado un nuevo método que combina CPRE, colangioscopia peroral de un solo operador y PTCS para tratar la fuga compleja de bilis después del trasplante hepático.
Introducción
El trasplante de hígado se ha convertido en un estándar de atención en pacientes con enfermedad hepática en etapa terminal. Después del trasplante hepático, aproximadamente 1/3 delos pacientes se ven afectados por complicaciones de la vía biliar, y éstas resultan en una morbilidad significativa y una disminución de la supervivencia del paciente, lo que se denomina el talón de Aquiles del trasplante hepático1. La fuga biliar es la segunda complicación más frecuente tras el trasplante hepático, con una incidencia del 2%-21%2,3,4. Los abordajes comúnmente utilizados para el tratamiento de las complicaciones biliares incluyen la colangiopancreatografía retrógrada endoscópica (CPRE), el drenaje colangial transhepático percutáneo (ECPT), la colangioscopia transhepática percutánea (STPT) y la cirugía5, pero no todos son efectivos.
El objetivo de este método es abordar la fuga biliar compleja después del trasplante de hígado mediante la combinación de CPRE, colangioscopia peroral de un solo operador y PTCS.
El principio técnico de este método se divide en tres pasos. En primer lugar, mediante CPRE y colangioscopia peroral de un solo operador, se identifica el extremo distal de la fuga biliar bajo visión directa y se coloca un stent plástico como marcador. A continuación, a través del PTCS, bajo la guía del stent plástico, se busca el extremo proximal de la fuga biliar del conducto hepático común bajo visión directa, y el catéter urinario reconstruye la continuidad de la vía biliar. Por último, a través de la CPRE se utiliza una guía de doble cabeza, se retira el catéter urinario y se colocan los stents del conducto hepático izquierdo y derecho para reconstruir la continuidad biliar.
La colangioscopia peroral (POCS) fue reportada por primera vez por Japón en 19766. Chen et al.7 informaron por primera vez sobre el sistema de coledocóscopio de visualización de un solo operador de primera generación, SpyGlass, en 2007, y el SpyGlass de segunda generación (SpyGlass DS) fue lanzado por Boston en 20158. Con el desarrollo de los instrumentos, la colangioscopia peroral de un solo operador se ha vuelto más delgada y tiene más funciones.
La mayor ventaja de este método es que se puede realizar bajo la visión directa de la colangioscopia peroral de un solo operador, lo que aumenta la tasa de éxito y la seguridad de la operación 9,10,11,12. Rainer9 informó sobre la colocación exitosa de un stent utilizando un sistema de visión biliar directa en pacientes post-trasplante de hígado con fracaso en la implantación de un stent de CPRE, y sugirieron que la visualización directa de la pequeña abertura en la estenosis biliar era la única forma de pasar con éxito la guía.
Este método es adecuado para pacientes con fuga biliar compleja después de un trasplante de hígado que no se pueden curar con ERCP, PTCD, PTC y cirugía.
Presentamos el caso de un hombre de 38 años que presentaba antecedentes de enfermedad de Crohn y vitíligo, además de insuficiencia hepática aguda sobre crónica provocada por un brote del virus de la hepatitis B. La función hepática disminuyó con el tiempo a pesar de los repetidos tratamientos con hígado artificial. Cuando un niño de 15 años con muerte encefálica proporcionó un hígado de donante compatible, se produjo una fuga de bilis 14 días después del trasplante de hígado (Figura 1A). El tubo de drenaje de la cavidad abdominal y el PTCD se instalaron de inmediato debido al dolor abdominal agudo y al shock séptico. Tras el drenaje, la salud general del paciente mejoró y la cantidad de derrame peritoneal se redujo considerablemente (Figura 1B).
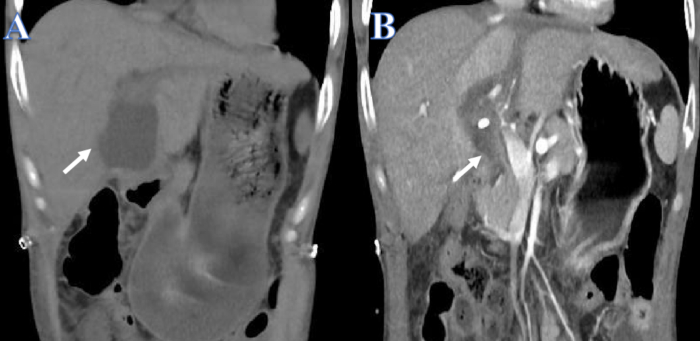
Figura 1: Antes y después del drenaje de la fuga de bilis. (A) La flecha blanca muestra el líquido antes del drenaje. (B) La flecha blanca muestra el líquido después del drenaje. Haga clic aquí para ver una versión más grande de esta figura.
A las 3 semanas, la vía biliar intrahepática era insuficiente para soportar la guía, que pasaba fácilmente a través de la vía biliar intrahepática a otras localizaciones, por lo que el intento de reconstruir la vía biliar de arriba a abajo a través de la sonda PTCD en las vías hepáticas izquierda y derecha fracasó (Figura 2). A las 4 semanas, el intento de reconstruir la vía biliar mediante CPRE de abajo hacia arriba no tuvo éxito porque la guía no pudo pasar a través de la estenosis hacia la vía biliar intrahepática (Figura 3). Después de 2 semanas, no se pudo localizar el colédoco y había numerosos cálculos en la unión de los conductos hepáticos izquierdo y derecho en el hiliar, lo que imposibilitó la reconstrucción de la vía biliar de arriba a abajo con PTCS. Aproximadamente 4 semanas después, un intento de reconstrucción de la vía biliar mediante coledocooyeyunostomía fracasó debido a la evidente inflamación y edema del tejido que rodeaba la fuga biliar, y los antecedentes previos de Crohn del paciente aumentaron en gran medida el riesgo de fuga biliar postoperatoria con fístula intestinal.
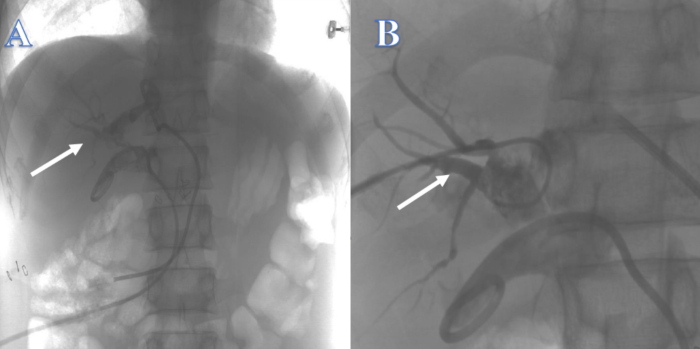
Figura 2: Continuidad biliar reconstruida por PTC. (A) La flecha blanca indica un intento desde el conducto hepático izquierdo. (B) La flecha blanca indica un intento desde el conducto hepático derecho. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Continuidad biliar reconstruida por CPRE. La guía no pudo entrar en el conducto biliar intrahepático. Haga clic aquí para ver una versión más grande de esta figura.
Aquí, hemos encontrado un nuevo método que combina la CPRE, la colangioscopia peroral de un solo operador y el PTCS para tratar la fuga compleja de bilis después del trasplante hepático. Primero se colocó un stent de plástico para localizar el extremo distal de la fuga biliar a través de CPRE y colangioscopia peroral de un solo operador. A continuación, se localizó el extremo proximal de la fuga biliar mediante PTCS y ecografía B y, finalmente, se reconstruyó la continuidad de la vía biliar mediante CPRE.
Protocolo
El estudio se ajustó a las directrices éticas de la Declaración de Helsinki de 1975 y fue aprobado por el Comité de Ética del Primer Hospital Afiliado de la Universidad Sun Yat-sen. Se obtuvo el consentimiento informado del paciente.
1. Preparación preoperatoria
- Indique al paciente que ayune durante 6-8 horas antes de la CPRE. Administrar petidina 1 mg/kg, anisodamina 20 mg, midazolam inyectable 1 mg, flurbiprofeno 100 mg por vía intravenosa y clorhidrato de tetracaína por vía oral. Cuando el reflejo faríngeo desapareció, la anestesia local más sedación y analgesia se consideraron exitosas.
2. Colocación de stents de plástico
- Asegúrese de que el paciente esté en posición prona y, una vez que la profundidad de la anestesia sea satisfactoria, inicie el procedimiento. Inserte el duodenoscopio en la boca, páselo a través del esófago y el estómago para llegar al duodeno y encontrar la papila duodenal.
- Inserte la guía en el conducto biliar común.
- Administrar yopromida inyectable (concentración de yodo 300 mg/mL) a razón de 2 mL/s a través de la sonda de CPRE o PTCD. Observar los conductos biliares intrahepáticos y extrahepáticos para la colangiografía después de la inyección e identificar la estenosis del conducto biliar. Nótese que la estenosis del conducto biliar se localiza en el conducto hepático común y los conductos biliares intrahepáticos y extrahepáticos no se pueden visualizar simultáneamente (Figura 4A).
- Dilatar la abertura inferior del conducto biliar común con un balón de dilatación de 6-8 mm a 7 mm inyectando iopromida en el balón.
- Inserte la colangioscopia peroral de un solo operador para observar el conducto biliar, encontrar estenosis que no se pueden atravesar e insertar la guía a través de la estenosis, seguida de dilatación con un bucucho dilatador biliar de 6 mm.
- Dilatar la estenosis con un balón de dilatación de 6-8 mm a 7 mm inyectando yopromida inyectable (Figura 4B).
- Inserte de nuevo la colangioscopia peroral de un solo operador para observar el conducto biliar. Obsérvese el conducto biliar ciego con cálculos y material floculante, sin que se observe ningún conducto biliar intrahepático incluso después de la inyección de iopromida.
- Se colocó un stent biliar de plástico de 7F x 7 cm en el conducto ciego a través de la estenosis, y el otro extremo se colocó fuera de la papila duodenal (Figura 4C).
- Durante todo el procedimiento, suministre oxígeno a través de una cánula nasal a 3 L/min y controle de cerca los signos vitales durante la CPRE. Luego, proporcione medicamentos para la inhibición ácida (Esomeprazol 40 mg BID), la inhibición enzimática (Octreotida 0.6 mg Q12H), la nutrición parenteral (Emulsión de grasa, Aminoácidos (17) y Glucosa (1%) Inyección 1920 mL QD), inhibición del dolor (Flurbiprofeno 100mg QD) e inhibición de infecciones (Cefoperazone Sodium y Sulbactam Sodium for Injection 1.5 g Q8H). Realice una prueba de amilasa después de la operación.
- Complete la operación e instruya al paciente que ayune hasta que el nivel de amilasa baje a la normalidad. Observar de cerca al paciente para detectar dolor abdominal, melena, etc.
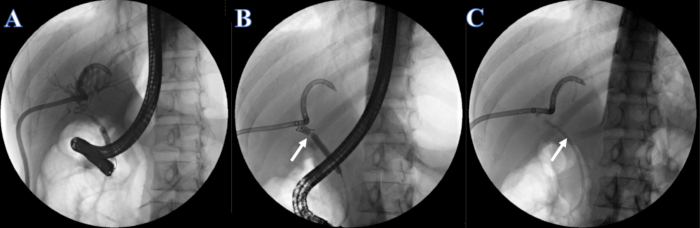
Figura 4: Stent plástico colocado por CPRE. (A) Colangiografía PTCD. (B) La flecha blanca indica la sección estrecha. (C) La flecha blanca indica stent de plástico. Haga clic aquí para ver una versión más grande de esta figura.
3. Colocación de catéteres urinarios
- Después de 1 semana de recuperación, indique al paciente que se acueste en posición supina y administre anestesia. Desinfectar la piel del epigastrio con yodóforo al 0,5% y cubrir con toallas estériles.
- Después de confirmar la anestesia adecuada, inserte la guía a lo largo del tubo de PTCD, retire el tubo de PTCD y coloque un tubo de funda protectora 20F a lo largo de la guía. Retire la guía y coloque un coledocoscopio a lo largo de la vaina.
- Enjuague el material floculante amarillo observado en los conductos biliares de los lóbulos hepáticos derecho e izquierdo con solución salina normal.
- Identificar el conducto hepático común encontrando la unión de los conductos hepáticos izquierdo y derecho bajo la guía de la ecografía B. Enjuague el material floculante amarillo en la abertura del conducto hepático común y dilate la estenosis del conducto hepático común con balones de 6 mm y 8 mm.
- Identificar el colédoco mediante el stent de plástico colocado en el paso 2 bajo guía ecográfica B. Inserte el coledoscopio a lo largo del conducto hepático común y enjuague y dilate el segmento estenótico del conducto hepático común repetidamente. Abra el segmento estenótico por completo y busque el stent de plástico colocado en el paso 2.
- Inserte la guía en la papila duodenal, retire la vaina e inserte un catéter urinario 12F a lo largo de la guía hasta el duodeno. Una vez hecho esto, retire el cable guía.
- Coser la piel con una aguja cónica y una sutura no absorbible 0-0/T y anudar la sutura en la piel y el catéter urinario.
- Regrese al paciente a la sala y administre medicamentos para la inhibición ácida (Esomeprazol 40 mg dos veces al día), la inhibición enzimática (Octreotida 0,6 mg cada 12 H), la nutrición parenteral (Emulsión de grasa, Aminoácidos (17) y Glucosa (1%) Inyección 1920 mL QD), la inhibición del dolor (Flurbiprofeno 100 mg QD) y la inhibición de infecciones (Cefoperazone Sódico y Sulbactam Sódico para inyección 1,5 g Q8H). Realice una prueba de amilasa después de la operación.
- Indique al paciente que ayune hasta que el nivel de amilasa baje a la normalidad. Observar de cerca al paciente para detectar dolor abdominal, melena, etc.
4. Colocación de stent biliar
- Después de 1 semana de recuperación, coloque el stent biliar. Indique al paciente que se acueste en posición prona y administre anestesia. Verifique que el stent de plástico y el catéter urinario estén colocados (Figura 5A).
- Tras la anestesia adecuada, se introduce el duodenoscopio en la boca, se pasa por el esófago y el estómago, se llega al duodeno y se encuentra la papila duodenal. Identifique el catéter urinario y los extremos del stent de plástico y retire el stent de plástico de la boca.
- Inserte el alambre guía de doble cabeza a lo largo del catéter urinario. Asegure la entrada correcta de la guía en el duodeno y luego pinza con una pinza de cuerpo extraño, pasando a través del duodeno, el estómago y el esófago, y retírela de la boca.
- Corte la línea de fijación de la piel del catéter urinario y retire el catéter urinario. Bajo fluoroscopia de rayos X, ajuste el otro extremo del alambre guía de doble cabeza en el conducto hepático derecho tirando del alambre guía de doble cabeza desde el lado de la boca (Figura 5B).
- Inserte otra guía en el conducto hepático izquierdo (Figura 5B).
- Coloque un conducto biliar doble de 7 F x 7 cm en el conducto hepático izquierdo (Figura 5C) y un stent plástico de 8,5 F x 12 cm en el conducto hepático derecho, con el otro extremo saliendo de la papila duodenal (Figura 5D).
- Durante todo el procedimiento, suministre oxígeno a través de una cánula nasal a 3 L/min y controle de cerca los signos vitales durante la CPRE. Luego, proporcione medicamentos para la inhibición ácida (Esomeprazol 40 mg BID), la inhibición enzimática (Octreotida 0.6 mg Q12H), la nutrición parenteral (Emulsión de grasa, Aminoácidos (17) y Glucosa (1%) Inyección 1920 mL QD), inhibición del dolor (Flurbiprofeno 100mg QD) e inhibición de infecciones (Cefoperazone Sodium y Sulbactam Sodium for Injection 1.5 g Q8H). Realice una prueba de amilasa después de la operación.
- Complete la operación. Indique al paciente que ayune hasta que el nivel de amilasa baje a la normalidad. Observar de cerca al paciente para detectar dolor abdominal, melena, etc.
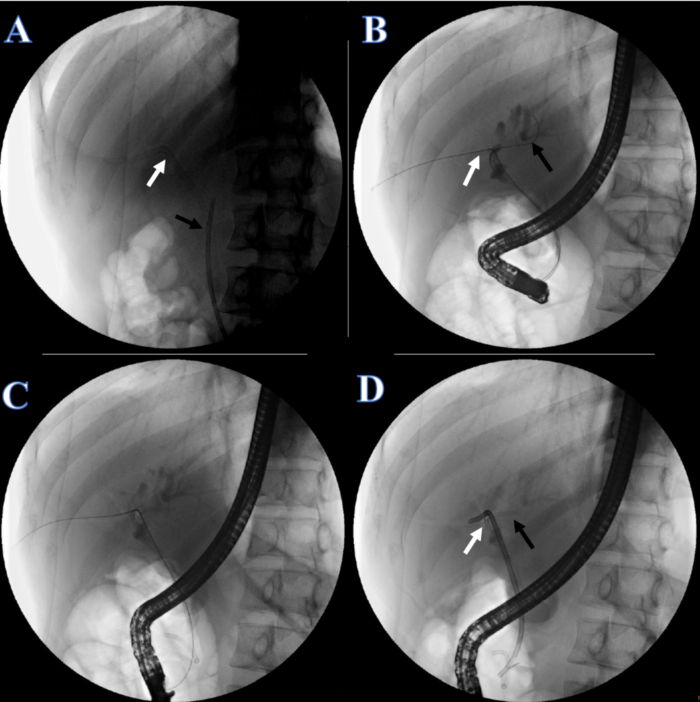
Figura 5: Continuidad biliar reconstruida por CPRE. (A) La flecha blanca indica el tubo de PTCD. La flecha negra indica el stent de plástico. (B) La flecha blanca indica el alambre guía doble a través del conducto hepático derecho. La flecha negra indica un alambre guía a través del conducto hepático izquierdo. (C) Un stent de plástico para el conducto hepático izquierdo. (D) La flecha blanca indica el stent de plástico para el conducto hepático derecho. La flecha negra indica el stent plástico para el conducto hepático izquierdo. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Describimos un nuevo método que combina la CPRE, la colangioscopia peroral de un solo operador y el PTCS para tratar la fuga compleja de bilis después del trasplante hepático. Para reconstruir la continuidad biliar, se colocó un conducto biliar doble pigtail de 7F x 7 cm en el conducto hepático izquierdo (Figura 5C) y un stent plástico de 8,5 F x 12 cm en el conducto hepático derecho (Figura 5D
Discusión
En el estudio, hemos encontrado un nuevo método de combinación de CPRE, colangioscopia peroral de un solo operador y PTCS para el tratamiento de la fuga compleja de bilis después del trasplante hepático. Los pasos clave de este método fueron los siguientes: en primer lugar, bajo la colangioscopia peroral de un solo operador, se identificó el final de la fuga biliar y se colocó un stent plástico. En segundo lugar, bajo la guía de la ecografía B, se observaron y dilataron las est...
Divulgaciones
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Este trabajo fue apoyado por subvenciones de la Fundación Nacional de Ciencias Naturales de China (81873591); la Fundación de Ciencias Naturales de Guangdong (2022A1515011052); el Proyecto de Planificación Científica y Tecnológica de la provincia de Guangdong (2018A050506030); el Programa de Ciencia y Tecnología de Guangzhou (201704020073); la Proyección de Construcción del Laboratorio Clave Provincial de Guangdong sobre Inmunología de Donación y Trasplante de Órganos (2013A061401007 y 2017B030314018); y la Base de Cooperación Internacional de Ciencia y Tecnología de la Provincia de Guangdong (Trasplante de Órganos) (2015B050501002).
Materiales
| Name | Company | Catalog Number | Comments |
| Biliary stent | Boston Scientific | M00533560 | 7 F*7 cm |
| Branch choledochoscope | Leinzett | LAN-EP-2612 | |
| Disposable electric snare | Boston Scientific | M00562320 | |
| Disposable sphincterotomy knife | Boston Scientific | M00545170 | |
| Electronic choledochoscope | Olympus | / | |
| Electronic duodenum mirror | Olympus | / | |
| Guidewire | Boston Scientific | M00556140 | |
| Guidewire guided the dilated balloon catheter | Boston Scientific | M00558600 | |
| Integrated biliary stent | Boston Scientific | M00539210 | 7 F*7 cm |
| Integrated biliary stent | Boston Scientific | M00539280 | 8.5 F*12 cm |
Referencias
- Duffy, J. P., et al. Long-term patient outcome and quality of life after liver transplantation: Analysis of 20-year survivors. Ann Surg. 252 (4), 652-661 (2010).
- Riediger, C., et al. T-tube or no t-tube in the reconstruction of the biliary tract during orthotopic liver transplantation: Systematic review and meta-analysis. Liver Transpl. 16 (6), 705-717 (2010).
- Wojcicki, M., Milkiewicz, P., Silva, M. Biliary tract complications after liver transplantation: A review. Dig Surg. 25 (4), 245-257 (2008).
- Thuluvath, P. J., Pfau, P. R., Kimmey, M. B., Ginsberg, G. G. Biliary complications after liver transplantation: The role of endoscopy. Endoscopy. 37 (9), 857-863 (2005).
- Macías-Gómez, C., Dumonceau, J. M. Endoscopic management of biliary complications after liver transplantation: An evidence-based review. World J Gastrointest Endosc. 7 (6), 606-616 (2015).
- Nakajima, M., Akasaka, Y., Fukumoto, K., Mitsuyoshi, Y., Kawai, K. Peroral cholangiopancreatosocopy (pcps) under duodenoscopic guidance. Am J Gastroenterol. 66 (3), 241-247 (1976).
- Chen, Y. K., et al. Single-operator cholangioscopy in patients requiring evaluation of bile duct disease or therapy of biliary stones (with videos). Gastrointest Endosc. 74 (4), 805-814 (2011).
- Kulpatcharapong, S., Pittayanon, R. S. J. K., Rerknimitr, R. Diagnostic performance of different cholangioscopes in patients with biliary strictures: A systematic review. Endoscopy. 52 (3), 174-185 (2020).
- Rainer, F., et al. A novel way to avoid reoperation for biliary strictures after liver transplantation: Cholangioscopy-assisted guidewire placement. Endoscopy. 51 (11), E314-E316 (2019).
- Bokemeyer, A., et al. Digital single-operator cholangioscopy: A useful tool for selective guidewire placements across complex biliary strictures. Surg Endosc. 33 (3), 731-737 (2019).
- Woo, Y. S., et al. Spyglass cholangioscopy-assisted guidewire placement for post-ldlt biliary strictures: A case series. Surg Endosc. 30 (9), 3897-3903 (2016).
- Martins, F. P., Seleti, S. M. R., Contini, M. L., Ga, D. E. P., Ferrari, A. P. Is there a place for cholangioscopic evaluation of biliary anastomotic stricture after deceased donor liver transplant. Arq Gastroenterol. 57 (4), 347-353 (2020).
- Magro, B., Tacelli, M., Mazzola, A., Conti, F., Celsa, C. Biliary complications after liver transplantation: Current perspectives and future strategies. Hepatobiliary Surg Nutr. 10 (1), 76-92 (2021).
- Arain, M. A., Attam, R., Freeman, M. L. Advances in endoscopic management of biliary tract complications after liver transplantation. Liver Transpl. 19 (5), 482-498 (2013).
- Tsujino, T., et al. Endoscopic management of biliary complications after adult living donor liver transplantation. Am J Gastroenterol. 101 (10), 2230-2236 (2006).
- López Álvarez, M., Otero, M., Vázquez Millán, M. A., Suárez López, F., Alonso Aguirre, P. Endoscopic treatment of biliary complications after liver transplantation. Rev Esp Enferm Dig. 112 (8), 605-608 (2020).
- Alves, A. R., Gomes, D., Furtado, E., Tomé, L. Efficacy of endoscopic retrograde cholangiopancreatography in the treatment of biliary complications following liver transplant: 10 years of a single-centre experience. GE Port J Gastroenterol. 25 (1), 10-17 (2018).
- Yasen, A., et al. Efficiency of percutaneous transhepatic cholangioscopy in the treatment of biliary complications after liver transplantation. HPB (Oxford). 25 (4), 463-471 (2023).
- Zimmerman, M. A., et al. resolution of biliary complications after living and deceased donor liver transplantation: A report from the adult-to-adult living donor liver transplantation cohort study consortium. Liver Transpl. 19 (3), 259-267 (2013).
- Moy, B. T., Birk, J. W. A review on the management of biliary complications after orthotopic liver transplantation. J Clin Transl Hepatol. 7 (1), 61-71 (2019).
- Wadhawan, M., Kumar, A. Management issues in post living donor liver transplant biliary strictures. World J Hepatol. 8 (10), 461-470 (2016).
- Enochsson, L., et al. Nationwide, population-based data from 11,074 ercp procedures from the swedish registry for gallstone surgery and ercp. Gastrointest Endosc. 72 (6), 1175-1184 (2010).
- Khan, M. A., et al. Endoscopic ultrasound-guided biliary drainage: A systematic review and meta-analysis. Dig Dis Sci. 61 (3), 684-703 (2016).
- Dhir, V., et al. Endoscopic ultrasonography-guided biliary and pancreatic duct interventions. Dig Endosc. 29 (4), 472-485 (2017).
- Derdeyn, J., Laleman, W. Current role of endoscopic cholangioscopy. Curr Opin Gastroenterol. 34 (5), 301-308 (2018).
- Iwashita, T., Doi, S., Yasuda, I. Endoscopic ultrasound-guided biliary drainage: A review. Clin J Gastroenterol. 7 (2), 94-102 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados