È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Nuovo trattamento per la perdita biliare complessa dopo il trapianto di fegato
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
La perdita biliare è una complicanza comune dopo il trapianto di fegato che influisce in modo significativo sulla prognosi dei pazienti. Il protocollo presenta un nuovo metodo per combinare la colangiopancreatografia retrograda endoscopica (ERCP), il coledocoscopio di branca e la colangioscopia transepatica percutanea (PTCS) per il trattamento della perdita biliare complessa dopo il trapianto di fegato.
Abstract
La perdita biliare è una complicanza comune dopo il trapianto di fegato che di solito può essere curata con la colangiopancreatografia retrograda endoscopica (ERCP), il drenaggio colangiale transepatico percutaneo (PTCD), la colangioscopia transepatica percutanea (PTCS) e la chirurgia. Riportiamo un nuovo trattamento per la perdita biliare della durata di 9 mesi dopo il trapianto di fegato, durante i quali ERCP, PTCD, PTCS e terapia chirurgica sono stati vani. Abbiamo utilizzato un nuovo metodo di trattamento multiendoscopico. In primo luogo, l'ERCP e la colangioscopia perorale con operatore singolo vengono utilizzate per posizionare uno stent di plastica come marcatore all'estremità distale del sito di perdita biliare. In secondo luogo, la PTCS viene eseguita attraverso il tubo PTCD. Durante l'operazione, l'estremità prossimale del sito di perdita biliare viene localizzata dallo stent plastico e dall'ecografia B e la continuità delle vie biliari viene temporaneamente ricostruita attraverso il filo guida e il catetere urinario. In terzo luogo, viene posizionato un filo guida a doppia testa, il catetere urinario viene rimosso, vengono posizionati gli stent e viene ricostruita la continuità biliare. In conclusione, abbiamo trovato un nuovo metodo che combina ERCP, colangioscopia perorale con operatore singolo e PTCS per trattare la perdita biliare complessa dopo il trapianto di fegato.
Introduzione
Il trapianto di fegato è diventato uno standard di cura nei pazienti con malattia epatica allo stadio terminale. Dopo iltrapianto di fegato, circa 1/3 dei pazienti è affetto da complicanze delle vie biliari, che si traducono in una significativa morbilità e in una ridotta sopravvivenza del paziente, che è chiamato il tallone d'Achille del trapianto di fegato1. La perdita biliare è la seconda complicanza più comune dopo il trapianto di fegato, con un'incidenza del 2%-21%2,3,4. Gli approcci comunemente utilizzati per il trattamento delle complicanze biliari comprendono la colangiopancreatografia retrograda endoscopica (ERCP), il drenaggio colangiale transepatico percutaneo (PTCD), la colangioscopia transepatica percutanea (PTCS) e la chirurgia5, ma non sono tutti efficaci.
L'obiettivo di questo metodo è quello di affrontare le perdite biliari complesse dopo il trapianto di fegato combinando ERCP, colangioscopia perorale con operatore singolo e PTCS.
Il principio tecnico di questo metodo è suddiviso in tre fasi. In primo luogo, attraverso l'ERCP e la colangioscopia perorale con un singolo operatore, l'estremità distale della perdita biliare viene identificata sotto visione diretta e uno stent plastico viene posizionato come marcatore. Quindi, attraverso il PTCS, sotto la guida dello stent plastico, l'estremità prossimale della perdita biliare viene ricercata dal dotto epatico comune sotto visione diretta, e il catetere urinario ricostruisce la continuità delle vie biliari. Infine, attraverso l'ERCP, viene utilizzato un filo guida a doppia testa, il catetere urinario viene rimosso e gli stent del dotto epatico sinistro e destro vengono posizionati per ricostruire la continuità biliare.
La colangioscopia perorale (POCS) è stata segnalata per la prima volta dal Giappone nel 19766. Chen et al.7 hanno riportato per la prima volta il sistema di coledocoscopio di visualizzazione a operatore singolo di prima generazione, SpyGlass, nel 2007, e lo SpyGlass di seconda generazione (SpyGlass DS) è stato lanciato da Boston nel 20158. Con lo sviluppo degli strumenti, la colangioscopia perorale con operatore singolo è diventata più sottile e ha più funzioni.
Il più grande vantaggio di questo metodo è che può essere eseguito sotto la visione diretta della colangioscopia perorale con un solo operatore, il che aumenta il tasso di successo e la sicurezza dell'operazione 9,10,11,12. Rainer9 ha riportato il successo del posizionamento dello stent utilizzando un sistema di visione biliare diretta in pazienti post-trapianto di fegato con fallimento dell'impianto di stent ERCP e hanno suggerito che la visualizzazione diretta della minuscola apertura sulla stenosi biliare era l'unico modo per passare con successo il filo guida.
Questo metodo è adatto per i pazienti con perdite biliari complesse dopo il trapianto di fegato che non possono essere curati con ERCP, PTCD, PTCS e chirurgia.
Riportiamo il caso di un uomo di 38 anni che aveva una storia di morbo di Crohn e vitiligine oltre a insufficienza epatica acuta su cronica causata da un'epidemia del virus dell'epatite B. La funzionalità epatica è diminuita nel tempo nonostante i ripetuti trattamenti di fegato artificiale. Quando un bambino di 15 anni in morte cerebrale ha fornito un fegato da donatore compatibile, la perdita di bile si è verificata 14 giorni dopo il trapianto di fegato (Figura 1A). Il tubo di drenaggio della cavità addominale e il PTCD sono stati installati immediatamente a causa del dolore addominale acuto e dello shock settico. Dopo il drenaggio, la salute generale del paziente è migliorata e la quantità di versamento peritoneale è stata notevolmente ridotta (Figura 1B).
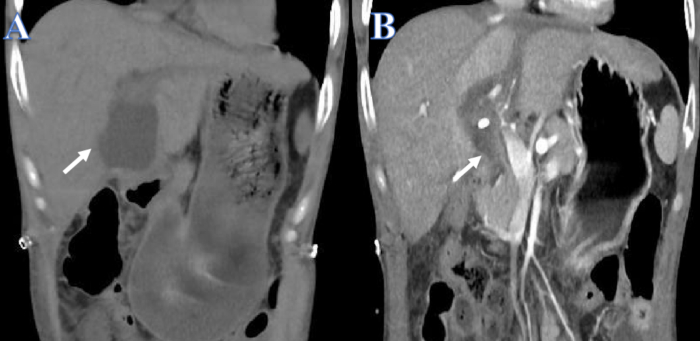
Figura 1: Prima e dopo il drenaggio della perdita biliare. (A) La freccia bianca mostra il fluido prima del drenaggio. (B) La freccia bianca mostra il fluido dopo il drenaggio. Clicca qui per visualizzare una versione più grande di questa figura.
Dopo 3 settimane, il dotto biliare intraepatico era insufficiente a sostenere il filo guida, che passava facilmente attraverso il dotto biliare intraepatico in altre posizioni, quindi il tentativo di ricostruire le vie biliari dall'alto verso il basso attraverso il tubo PTCD nei dotti epatici sinistro e destro è fallito (Figura 2). Dopo 4 settimane, un tentativo di ricostruire le vie biliari utilizzando l'ERCP dal basso verso l'alto non ha avuto successo perché il filo guida non riusciva a passare attraverso la stenosi nel dotto biliare intraepatico (Figura 3). Dopo 2 settimane, non è stato possibile localizzare il dotto biliare comune e c'erano numerosi calcoli alla giunzione dei dotti epatici sinistro e destro nell'ilare, rendendo impossibile ricostruire il tratto biliare da cima a fondo con PTCS. Circa 4 settimane dopo, un tentativo di ricostruire le vie biliari mediante coledocodigiunostomia è fallito a causa dell'evidente infiammazione ed edema del tessuto che circonda la perdita biliare, e la precedente storia di Crohn del paziente ha notevolmente aumentato il rischio di perdita biliare postoperatoria con fistola intestinale.
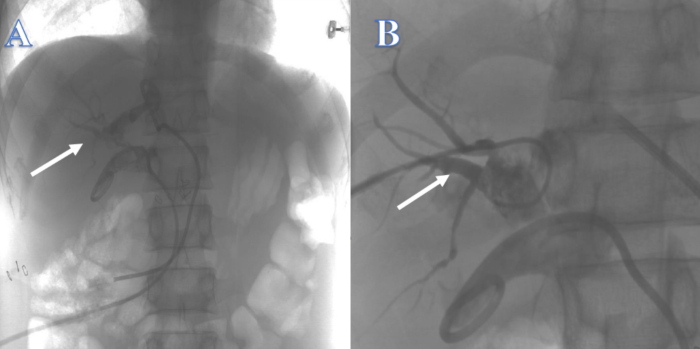
Figura 2: Continuità biliare ricostruita da PTC. (A) La freccia bianca indica un tentativo dal dotto epatico sinistro. (B) La freccia bianca indica un tentativo dal dotto epatico destro. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Continuità biliare ricostruita dall'ERCP. Il filo guida non è riuscito a entrare nel dotto biliare intraepatico. Clicca qui per visualizzare una versione più grande di questa figura.
Qui, abbiamo trovato un nuovo metodo per combinare ERCP, colangioscopia perorale con operatore singolo e PTCS per trattare la perdita biliare complessa dopo il trapianto di fegato. Per prima cosa è stato posizionato uno stent di plastica per localizzare l'estremità distale della perdita biliare attraverso l'ERCP e la colangioscopia perorale con un singolo operatore. L'estremità prossimale della perdita biliare è stata quindi localizzata mediante PTCS ed ecografia B e, infine, la continuità delle vie biliari è stata ricostruita mediante ERCP.
Protocollo
Lo studio è conforme alle linee guida etiche della Dichiarazione di Helsinki del 1975 ed è stato approvato dal Comitato Etico del Primo Ospedale Affiliato dell'Università Sun Yat-sen. Il consenso informato è stato ottenuto dal paziente.
1. Preparazione preoperatoria
- Istruire il paziente a digiunare per 6-8 ore prima dell'ERCP. Somministrare petidina 1 mg/kg, anisolamina 20 mg, midazolam iniettabile 1 mg, flurbiproprofen 100 mg per via endovenosa e tetracaina cloridrato per via orale. Quando il riflesso faringeo scompariva, l'anestesia locale, la sedazione e l'analgesia erano ritenute efficaci.
2. Posizionamento dello stent in plastica
- Assicurarsi che il paziente sia posizionato in posizione prona e, una volta che la profondità dell'anestesia è soddisfacente, iniziare la procedura. Inserire il duodenoscopio in bocca, passarlo attraverso l'esofago e lo stomaco per raggiungere il duodeno e trovare la papilla duodenale.
- Inserire il filo guida nel dotto biliare comune.
- Somministrare iniezione di iodio (concentrazione di iodio 300 mg/mL) alla velocità di 2 mL/s attraverso la provetta ERCP o PTCD. Osservare i dotti biliari intraepatici ed extraepatici per la colangiografia dopo l'iniezione e identificare la stenosi del dotto biliare. Si noti che la stenosi del dotto biliare si trova nel dotto epatico comune e che i dotti biliari intraepatici ed extraepatici non possono essere visualizzati contemporaneamente (Figura 4A).
- Dilatare l'apertura inferiore del dotto biliare comune con un palloncino di dilatazione da 6-8 mm a 7 mm iniettando iopromide nel palloncino.
- Inserire la colangioscopia perorale con un singolo operatore per osservare il dotto biliare, trovare le stenosi che non possono essere attraversate e inserire il filo guida attraverso la stenosi, seguita dalla dilatazione con un bougie dilatatore biliare da 6 mm.
- Dilatare la stenosi con un palloncino di dilatazione da 6-8 mm a 7 mm iniettando iniezione di iopromide (Figura 4B).
- Inserire nuovamente la colangioscopia perorale monooperatore per osservare il dotto biliare. Si noti il dotto biliare cieco con calcoli e materiale flocculante, senza alcun dotto biliare intraepatico osservato anche dopo l'iniezione di iopromide.
- Posizionare uno stent biliare di plastica di 7F x 7 cm nel dotto cieco attraverso la stenosi e l'altra estremità è stata posizionata fuori dalla papilla duodenale (Figura 4C).
- Durante tutta la procedura, fornire ossigeno attraverso una cannula nasale a 3 L/min e monitorare attentamente i segni vitali durante l'ERCP. Quindi, fornire farmaci per l'inibizione dell'acido (Esomeprazolo 40 mg BID), l'inibizione enzimatica (Octreotide 0,6 mg Q12H), la nutrizione parenterale (emulsione di grassi, aminoacidi (17) e glucosio (1%) per iniezione 1920 ml QD), l'inibizione del dolore (Flurbiprofene 100 mg QD) e l'inibizione dell'infezione (Cefoperazone sodico e Sulbactam sodico per iniezione 1,5 g Q8H). Eseguire un test dell'amilasi dopo l'operazione.
- Completare l'operazione e istruire il paziente a digiunare fino a quando il livello di amilasi non scende alla normalità. Osservare attentamente il paziente per dolori addominali, melena, ecc.
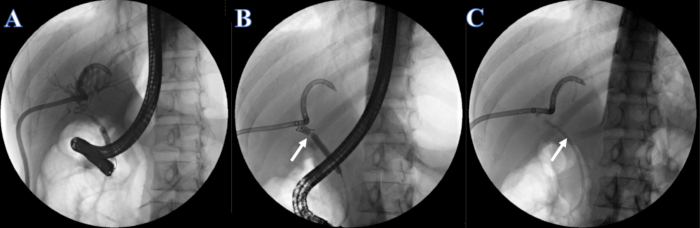
Figura 4: Stent in plastica posizionato da ERCP. (A) Colangiografia PTCD. (B) La freccia bianca indica la sezione stretta. (C) La freccia bianca indica lo stent in plastica. Clicca qui per visualizzare una versione più grande di questa figura.
3. Posizionamento del catetere urinario
- Dopo 1 settimana di recupero, istruire il paziente a sdraiarsi in posizione supina e somministrare l'anestesia. Disinfettare la pelle dell'epigastrio con iodoforo allo 0,5% e coprire con asciugamani sterili.
- Dopo aver confermato la corretta anestesia, inserire il filo guida lungo il tubo PTCD, rimuovere il tubo PTCD e posizionare un tubo della guaina protettiva 20F lungo il filo guida. Rimuovere il filo guida e posizionare un coledocoscopio lungo la guaina.
- Sciacquare il materiale flocculante giallo osservato nei dotti biliari dei lobi epatici destro e sinistro con soluzione fisiologica.
- Identificare il dotto epatico comune trovando la giunzione dei dotti epatici sinistro e destro sotto la guida dell'ecografia B. Sciacquare il materiale flocculante giallo nell'apertura del dotto epatico comune e dilatare la stenosi del dotto epatico comune con palloncini da 6 mm e 8 mm.
- Identificare il dotto biliare comune mediante lo stent di plastica posizionato al passaggio 2 sotto guida ecografica B. Inserire il coledocoscopio lungo il dotto epatico comune e sciacquare e dilatare ripetutamente il segmento stenotico del dotto epatico comune. Aprire completamente il segmento stenotico e trovare lo stent in plastica posizionato al passaggio 2.
- Inserire il filo guida nella papilla duodenale, rimuovere la guaina e inserire un catetere urinario 12F lungo il filo guida fino al duodeno. Una volta fatto, rimuovere il filo guida.
- Cucire la pelle con un ago conico e una sutura non assorbibile 0-0/T e annodare la sutura sulla pelle e sul catetere urinario.
- Riportare il paziente in reparto e somministrare farmaci per l'inibizione dell'acido (Esomeprazolo 40 mg BID), l'inibizione enzimatica (Octreotide 0,6 mg Q12H), la nutrizione parenterale (emulsione di grassi, aminoacidi (17) e glucosio (1%) per iniezione 1920 ml QD), l'inibizione del dolore (Flurbiprofene 100 mg QD) e l'inibizione dell'infezione (Cefoperazone sodico e Sulbactam sodico per iniezione 1,5 g Q8H). Eseguire un test dell'amilasi dopo l'operazione.
- Istruire il paziente a digiunare fino a quando il livello di amilasi non scende alla normalità. Osservare attentamente il paziente per dolori addominali, melena, ecc.
4. Posizionamento dello stent biliare
- Dopo 1 settimana di recupero, posizionare lo stent biliare. Istruire il paziente a sdraiarsi in posizione prona e somministrare l'anestesia. Controllare che lo stent in plastica e il catetere urinario siano in posizione (Figura 5A).
- Dopo un'adeguata anestesia, inserire il duodenoscopio in bocca, passarlo attraverso l'esofago e lo stomaco, raggiungere il duodeno e trovare la papilla duodenale. Identificare il catetere urinario e le estremità dello stent in plastica e rimuovere lo stent in plastica dalla bocca.
- Inserire il filo guida a doppia testa lungo il catetere urinario. Assicurarsi che il filo guida sia inserito correttamente nel duodeno, quindi bloccare con un morsetto per corpi estranei, passando attraverso il duodeno, lo stomaco e l'esofago e rimuovendolo dalla bocca.
- Tagliare la linea di fissazione cutanea del catetere urinario e rimuovere il catetere urinario. In fluoroscopia a raggi X, regolare l'altra estremità del filo guida a doppia testa nel dotto epatico destro tirando il filo guida a doppia testa dal lato della bocca (Figura 5B).
- Inserire un altro filo guida nel dotto epatico sinistro (Figura 5B).
- Posizionare un dotto biliare a doppia treccia di 7 F x 7 cm nel dotto epatico sinistro (Figura 5C) e uno stent in plastica del dotto biliare di 8,5 F x 12 cm nel dotto epatico destro, con l'altra estremità che parte dalla papilla duodenale (Figura 5D).
- Durante tutta la procedura, fornire ossigeno attraverso una cannula nasale a 3 L/min e monitorare attentamente i segni vitali durante l'ERCP. Quindi, fornire farmaci per l'inibizione dell'acido (Esomeprazolo 40 mg BID), l'inibizione enzimatica (Octreotide 0,6 mg Q12H), la nutrizione parenterale (emulsione di grassi, aminoacidi (17) e glucosio (1%) per iniezione 1920 ml QD), l'inibizione del dolore (Flurbiprofene 100 mg QD) e l'inibizione dell'infezione (Cefoperazone sodico e Sulbactam sodico per iniezione 1,5 g Q8H). Eseguire un test dell'amilasi dopo l'operazione.
- Completa l'operazione. Istruire il paziente a digiunare fino a quando il livello di amilasi non scende alla normalità. Osservare attentamente il paziente per dolori addominali, melena, ecc.
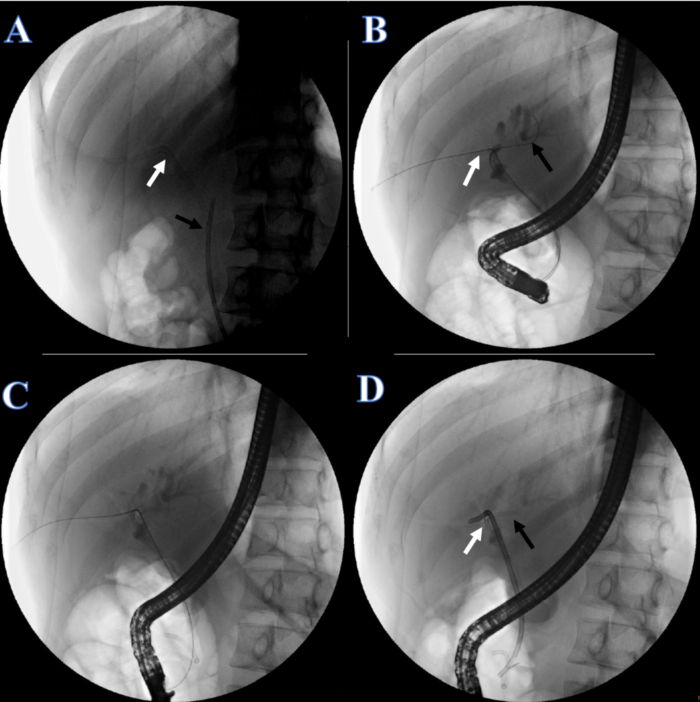
Figura 5: Continuità biliare ricostruita dall'ERCP. (A) La freccia bianca indica il tubo PTCD. La freccia nera indica lo stent in plastica. (B) La freccia bianca indica il doppio filo guida attraverso il dotto epatico destro. La freccia nera indica un filo guida attraverso il dotto epatico sinistro. (C) Uno stent di plastica per il dotto epatico sinistro. (D) La freccia bianca indica lo stent in plastica per il dotto epatico destro. La freccia nera indica lo stent in plastica per il dotto epatico sinistro. Clicca qui per visualizzare una versione più grande di questa figura.
Risultati
Descriviamo un nuovo metodo che combina ERCP, colangioscopia perorale con operatore singolo e PTCS per trattare la perdita biliare complessa dopo il trapianto di fegato. Per ricostruire la continuità biliare, abbiamo posizionato un dotto biliare a doppia treccia di 7 F x 7 cm nel dotto epatico sinistro (Figura 5C) e uno stent in plastica del dotto biliare di 8,5 F x 12 cm nel dotto epatico destro (Figura...
Discussione
Nello studio, abbiamo trovato un nuovo metodo per combinare ERCP, colangioscopia perorale con operatore singolo e PTCS per il trattamento della perdita biliare complessa dopo il trapianto di fegato. I passaggi chiave di questo metodo sono stati i seguenti: in primo luogo, sotto la colangioscopia perorale con un singolo operatore, è stata identificata la fine della perdita biliare ed è stato posizionato uno stent di plastica. In secondo luogo, sotto la guida dell'ecografia B, sono state...
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni della National Natural Science Foundation of China (81873591); la Fondazione per le scienze naturali del Guangdong (2022A1515011052); il progetto di pianificazione scientifica e tecnologica della provincia del Guangdong (2018A050506030); il Programma di Scienza e Tecnologia di Guangzhou (201704020073); la proiezione sulla costruzione del laboratorio chiave provinciale del Guangdong sulla donazione di organi e l'immunologia dei trapianti (2013A061401007 e 2017B030314018); e la base di cooperazione internazionale della provincia del Guangdong per la scienza e la tecnologia (trapianto di organi) (2015B050501002).
Materiali
| Name | Company | Catalog Number | Comments |
| Biliary stent | Boston Scientific | M00533560 | 7 F*7 cm |
| Branch choledochoscope | Leinzett | LAN-EP-2612 | |
| Disposable electric snare | Boston Scientific | M00562320 | |
| Disposable sphincterotomy knife | Boston Scientific | M00545170 | |
| Electronic choledochoscope | Olympus | / | |
| Electronic duodenum mirror | Olympus | / | |
| Guidewire | Boston Scientific | M00556140 | |
| Guidewire guided the dilated balloon catheter | Boston Scientific | M00558600 | |
| Integrated biliary stent | Boston Scientific | M00539210 | 7 F*7 cm |
| Integrated biliary stent | Boston Scientific | M00539280 | 8.5 F*12 cm |
Riferimenti
- Duffy, J. P., et al. Long-term patient outcome and quality of life after liver transplantation: Analysis of 20-year survivors. Ann Surg. 252 (4), 652-661 (2010).
- Riediger, C., et al. T-tube or no t-tube in the reconstruction of the biliary tract during orthotopic liver transplantation: Systematic review and meta-analysis. Liver Transpl. 16 (6), 705-717 (2010).
- Wojcicki, M., Milkiewicz, P., Silva, M. Biliary tract complications after liver transplantation: A review. Dig Surg. 25 (4), 245-257 (2008).
- Thuluvath, P. J., Pfau, P. R., Kimmey, M. B., Ginsberg, G. G. Biliary complications after liver transplantation: The role of endoscopy. Endoscopy. 37 (9), 857-863 (2005).
- Macías-Gómez, C., Dumonceau, J. M. Endoscopic management of biliary complications after liver transplantation: An evidence-based review. World J Gastrointest Endosc. 7 (6), 606-616 (2015).
- Nakajima, M., Akasaka, Y., Fukumoto, K., Mitsuyoshi, Y., Kawai, K. Peroral cholangiopancreatosocopy (pcps) under duodenoscopic guidance. Am J Gastroenterol. 66 (3), 241-247 (1976).
- Chen, Y. K., et al. Single-operator cholangioscopy in patients requiring evaluation of bile duct disease or therapy of biliary stones (with videos). Gastrointest Endosc. 74 (4), 805-814 (2011).
- Kulpatcharapong, S., Pittayanon, R. S. J. K., Rerknimitr, R. Diagnostic performance of different cholangioscopes in patients with biliary strictures: A systematic review. Endoscopy. 52 (3), 174-185 (2020).
- Rainer, F., et al. A novel way to avoid reoperation for biliary strictures after liver transplantation: Cholangioscopy-assisted guidewire placement. Endoscopy. 51 (11), E314-E316 (2019).
- Bokemeyer, A., et al. Digital single-operator cholangioscopy: A useful tool for selective guidewire placements across complex biliary strictures. Surg Endosc. 33 (3), 731-737 (2019).
- Woo, Y. S., et al. Spyglass cholangioscopy-assisted guidewire placement for post-ldlt biliary strictures: A case series. Surg Endosc. 30 (9), 3897-3903 (2016).
- Martins, F. P., Seleti, S. M. R., Contini, M. L., Ga, D. E. P., Ferrari, A. P. Is there a place for cholangioscopic evaluation of biliary anastomotic stricture after deceased donor liver transplant. Arq Gastroenterol. 57 (4), 347-353 (2020).
- Magro, B., Tacelli, M., Mazzola, A., Conti, F., Celsa, C. Biliary complications after liver transplantation: Current perspectives and future strategies. Hepatobiliary Surg Nutr. 10 (1), 76-92 (2021).
- Arain, M. A., Attam, R., Freeman, M. L. Advances in endoscopic management of biliary tract complications after liver transplantation. Liver Transpl. 19 (5), 482-498 (2013).
- Tsujino, T., et al. Endoscopic management of biliary complications after adult living donor liver transplantation. Am J Gastroenterol. 101 (10), 2230-2236 (2006).
- López Álvarez, M., Otero, M., Vázquez Millán, M. A., Suárez López, F., Alonso Aguirre, P. Endoscopic treatment of biliary complications after liver transplantation. Rev Esp Enferm Dig. 112 (8), 605-608 (2020).
- Alves, A. R., Gomes, D., Furtado, E., Tomé, L. Efficacy of endoscopic retrograde cholangiopancreatography in the treatment of biliary complications following liver transplant: 10 years of a single-centre experience. GE Port J Gastroenterol. 25 (1), 10-17 (2018).
- Yasen, A., et al. Efficiency of percutaneous transhepatic cholangioscopy in the treatment of biliary complications after liver transplantation. HPB (Oxford). 25 (4), 463-471 (2023).
- Zimmerman, M. A., et al. resolution of biliary complications after living and deceased donor liver transplantation: A report from the adult-to-adult living donor liver transplantation cohort study consortium. Liver Transpl. 19 (3), 259-267 (2013).
- Moy, B. T., Birk, J. W. A review on the management of biliary complications after orthotopic liver transplantation. J Clin Transl Hepatol. 7 (1), 61-71 (2019).
- Wadhawan, M., Kumar, A. Management issues in post living donor liver transplant biliary strictures. World J Hepatol. 8 (10), 461-470 (2016).
- Enochsson, L., et al. Nationwide, population-based data from 11,074 ercp procedures from the swedish registry for gallstone surgery and ercp. Gastrointest Endosc. 72 (6), 1175-1184 (2010).
- Khan, M. A., et al. Endoscopic ultrasound-guided biliary drainage: A systematic review and meta-analysis. Dig Dis Sci. 61 (3), 684-703 (2016).
- Dhir, V., et al. Endoscopic ultrasonography-guided biliary and pancreatic duct interventions. Dig Endosc. 29 (4), 472-485 (2017).
- Derdeyn, J., Laleman, W. Current role of endoscopic cholangioscopy. Curr Opin Gastroenterol. 34 (5), 301-308 (2018).
- Iwashita, T., Doi, S., Yasuda, I. Endoscopic ultrasound-guided biliary drainage: A review. Clin J Gastroenterol. 7 (2), 94-102 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon