Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Новый метод лечения сложной утечки желчи после трансплантации печени
* Эти авторы внесли равный вклад
В этой статье
Резюме
Подтекание желчи является распространенным осложнением после трансплантации печени, которое существенно влияет на прогноз пациентов. Протокол представляет собой новый метод сочетания эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ), ветвевого холедохоскопа и чрескожной чреспеченочной холангиоскопии (ЧЛХС) для лечения сложных подтечек желчи после трансплантации печени.
Аннотация
Подтекание желчи является распространенным осложнением после трансплантации печени, которое обычно можно вылечить с помощью эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ), чрескожного чреспеченочного холангиального дренажа (ЧТРПГ), чрескожной чреспеченочной холангиоскопии (ЧХПК) и хирургического вмешательства. Мы сообщаем о новом лечении билиарной утечки в течение 9 месяцев после трансплантации печени, во время которой ЭРХПГ, ПТХД, ПТК и хирургическая терапия оказались тщетными. Мы применили новый метод мультиэндоскопического лечения. Во-первых, ЭРХПГ и пероральная холангиоскопия с одним оператором используются для размещения пластикового стента в качестве маркера на дистальном конце места утечки желчи. Во-вторых, PTCS проводится через трубку PTCD. Во время операции проксимальный конец места утечки желчи находится с помощью пластического стента и ультразвукового исследования В, а непрерывность желчевыводящих путей временно восстанавливается с помощью направляющей проволоки и мочевого катетера. В-третьих, устанавливается проводник с двумя головками, удаляется мочевой катетер, устанавливаются стенты и восстанавливается непрерывность желчевыводящих путей. В заключение мы обнаружили новый метод, сочетающий ЭРХПГ, пероральную холангиоскопию и ПТХС для лечения сложной утечки желчи после трансплантации печени.
Введение
Трансплантация печени стала стандартом лечения пациентов с терминальной стадией заболевания печени. После трансплантации печени примерно у 1/3 пациентов возникают осложнения со стороны желчевыводящих путей, что приводит к значительной заболеваемости и снижению выживаемости пациентов, что называется ахиллесовой пятой трансплантации печени1. Утечка желчных путей является вторым по частоте осложнением после трансплантации печени, с частотой 2%-21%2,3,4. Подходы, обычно используемые для лечения билиарных осложнений, включают эндоскопическую ретроградную холангиопанкреатографию (ЭРХПГ), чрескожное чреспеченочное холангиальное дренирование (ПТХД), чрескожную чреспеченочную холангиоскопию (ЧХБС) ихирургию5, но не все они эффективны.
Целью этого метода является устранение сложной утечки желчных путей после трансплантации печени путем сочетания ЭРХПГ, пероральной холангиоскопии и ПТХС.
Технический принцип этого метода делится на три этапа. Во-первых, с помощью ЭРХПГ и пероральной холангиоскопии с одним оператором дистальный конец желчной утечки идентифицируется под прямым зрением, и в качестве маркера помещается пластиковый стент. Затем с помощью ПТХС под руководством пластического стента осуществляется поиск проксимального конца желчной утечки из общего печеночного протока под прямым наблюдением, а мочевой катетер восстанавливает непрерывность желчевыводящих путей. Наконец, с помощью ЭРХПГ используется двусторонняя направляющая проволока, удаляется мочевой катетер, а также устанавливаются стенты левого и правого печеночных протоков для восстановления непрерывности желчевыводящих путей.
Пероральная холангиоскопия (ПОКС) была впервые описана в Японии в 1976году6. Chen et al.7 впервые сообщили о первом поколении однооператорной системы визуализации, SpyGlass, в 2007 году, а второе поколение SpyGlass (SpyGlass DS) было запущено Boston в 2015году8. С развитием инструментов пероральная однооператорная холангиоскопия стала тоньше и имеет больше функций.
Самым большим преимуществом этого метода является то, что он может быть выполнен под непосредственным наблюдением пероральной холангиоскопии, что повышает вероятность успеха и безопасность операции 9,10,11,12. Rainer9 сообщил об успешной установке стента с использованием системы прямого билиарного зрения у пациентов после трансплантации печени с неудачной имплантацией стента ЭРХПГ, и они предположили, что прямая визуализация крошечного отверстия в стриктуре желчевыводящих путей была единственным способом успешного прохождения проводника.
Этот метод подходит для пациентов со сложной утечкой желчных путей после трансплантации печени, которые не могут быть излечены с помощью ЭРХПГ, ПТХД, ПТК и хирургического вмешательства.
Мы сообщаем о случае 38-летнего мужчины, у которого в анамнезе была болезнь Крона и витилиго в дополнение к острой и хронической печеночной недостаточности, вызванной вспышкой вируса гепатита В. Функция печени со временем снижалась, несмотря на повторное лечение искусственной печенью. Когда 15-летнему ребенку со смертью мозга была предоставлена подходящая донорская печень, утечка желчи произошла через 14 дней после трансплантации печени (рис. 1A). Дренажная трубка брюшной полости и ПТХД были установлены сразу из-за острой боли в животе и септического шока. После дренирования общее состояние здоровья пациента улучшилось, а количество перитонеального выпота значительно уменьшилось (Рисунок 1B).
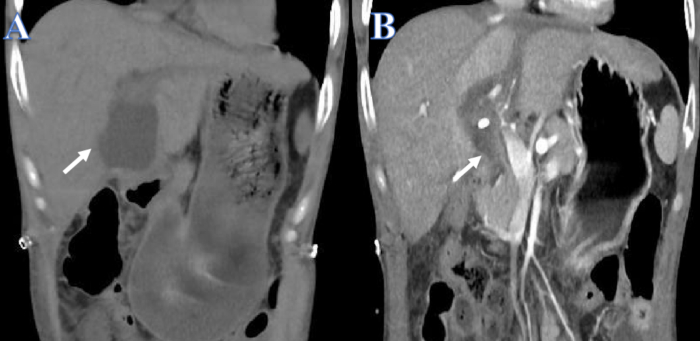
Рисунок 1: До и после дренирования желчных выделений. (A) Белой стрелкой показана жидкость до опорожнения. (B) Белой стрелкой показана жидкость после дренажа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Через 3 недели внутрипеченочный желчный проток был недостаточным для поддержки направляющей проволоки, которая легко проходила через внутрипеченочный желчный проток в другие места, поэтому попытка реконструировать желчевыводящие пути сверху вниз через трубку ПТХД в левом и правом печеночных протоках не увенчалась успехом (рис. 2). Через 4 недели попытка реконструировать желчевыводящие пути с помощью ЭРХПГ снизу вверх не увенчалась успехом, поскольку проводник не мог пройти через стриктуру во внутрипеченочный желчный проток (рис. 3). Через 2 недели общий желчный проток не мог быть локализован, а на стыке левого и правого печеночных протоков в прикорневой зоне образовались многочисленные камни, что сделало невозможным реконструкцию желчевыводящих путей сверху донизу с помощью ПТХС. Примерно через 4 недели попытка реконструировать желчевыводящие пути с помощью холедохееюностомии не увенчалась успехом из-за явного воспаления и отека тканей, окружающих билиарную утечку, а предыдущий анамнез болезни Крона у пациента значительно увеличивал риск послеоперационной утечки желчных путей с кишечной фистулой.
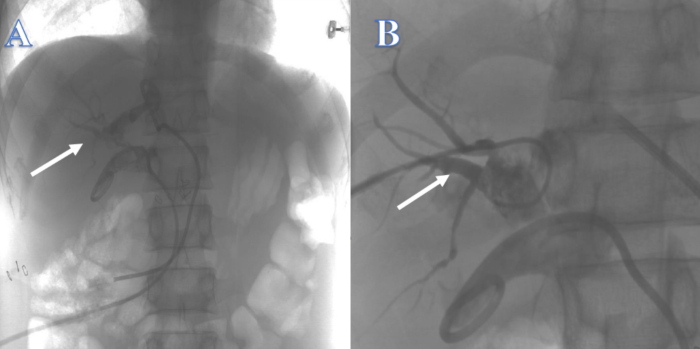
Рисунок 2: Непрерывность желчевыводящих путей реконструирована с помощью ПТК. (А) Белая стрелка указывает на попытку со стороны левого печеночного протока. (Б) Белая стрелка указывает на попытку со стороны правого печеночного протока. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Непрерывность желчевыводящих путей, восстановленная с помощью ЭРХПГ. Проводник не мог попасть во внутрипеченочный желчный проток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Здесь мы обнаружили новый метод сочетания ЭРХПГ, пероральной холангиоскопии и ПТХС для лечения сложной утечки желчи после трансплантации печени. Сначала был установлен пластиковый стент для определения дистального конца утечки желчи с помощью ЭРХПГ и пероральной холангиоскопии. Проксимальный конец утечки желчи был затем обнаружен с помощью ПТХС и В УЗИ, и, наконец, непрерывность желчевыводящих путей была восстановлена с помощью ЭРХПГ.
протокол
Исследование соответствовало этическим принципам Хельсинкской декларации 1975 года и было одобрено Комитетом по этике Первой аффилированной больницы Университета Сунь Ятсена. От пациента было получено информированное согласие.
1. Предоперационная подготовка
- Проинструктируйте пациента голодать в течение 6-8 часов перед ЭРХПГ. Применяйте петидин 1 мг/кг, анизодамин 20 мг, мидазолам инъекционно 1 мг, флурбипрофен 100 мг внутривенно и тетракаина гидрохлорид перорально. Когда глоточный рефлекс исчез, местная анестезия в сочетании с седативным эффектом и анальгезией была признана успешной.
2. Установка пластикового стента
- Убедитесь, что пациент находится в положении лежа, и как только глубина анестезии станет удовлетворительной, начните процедуру. Вставьте дуоденоскоп в рот, пропустите его через пищевод и желудок, чтобы добраться до двенадцатиперстной кишки, и найдите дуоденальный сосочек.
- Вставьте проводник в общий желчный проток.
- Вводите инъекцию йопромида (концентрация йода 300 мг/мл) со скоростью 2 мл/с через трубку ЭРХПГ или ПТДД. Наблюдайте за внутрипеченочными и внепеченочными желчными протоками на предмет холангиографии после инъекции и выявляйте стриктуру желчного протока. Следует отметить, что стриктура желчного протока расположена в общем печеночном протоке, и внутрипеченочные и внепеченочные желчные протоки не могут быть одновременно визуализированы (рисунок 4А).
- Расширить нижнее отверстие общего желчного протока с помощью баллона с расширением 6-8 мм до 7 мм путем введения в баллон иопромида.
- Введите пероральную холангиоскопию для одного оператора, чтобы наблюдать за желчным протоком, найти стриктуры, через которые невозможно пройти, и ввести направляющую проволоку через стриктуру с последующей дилатацией с помощью билиарного расширяющего бужа на 6 мм.
- Расширить стеноз с помощью дилатационного баллона 6-8 мм до 7 мм путем введения инъекции йопромида (рис. 4В).
- Снова введите пероральную холангиоскопию для одного оператора, чтобы наблюдать за желчным протоком. Обратите внимание на слепой желчный проток с камнями и флокулянтным материалом, при этом внутрипеченочный желчный проток не наблюдается даже после введения йопромида.
- Поместите пластиковый билиарный стент размером 7F x 7 см в глухой проток через стриктуру, а другой конец будет помещен из дуоденального сосочка (рис. 4C).
- На протяжении всей процедуры подавайте кислород через носовую канюлю со скоростью 3 л/мин и внимательно следите за жизненно важными показателями во время ЭРХПГ. Затем введите препараты для ингибирования кислот (эзомепразол 40 мг BID), ингибирования ферментов (октреотид 0,6 мг Q12H), парентерального питания (жировая эмульсия, аминокислоты (17) и глюкоза (1%) для инъекций 1920 мл QD), подавления боли (флурбипрофен 100 мг QD) и ингибирования инфекций (цефоперазона натрия и сульбактам натрия для инъекций 1,5 г Q8H). После операции проведите тест на амилазу.
- Завершите операцию и проинструктируйте пациента голодать до тех пор, пока уровень амилазы не упадет до нормы. Внимательно наблюдайте за пациентом на предмет болей в животе, мелены и т.д.
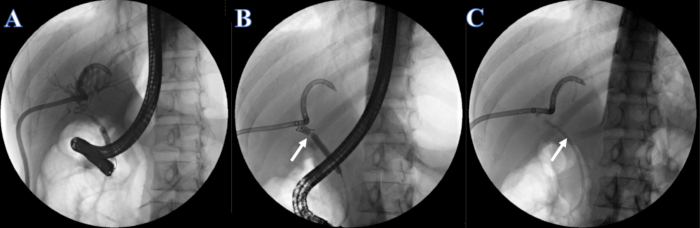
Рисунок 4: Пластиковый стент, установленный ЭРХПГ. (А) Холангиография ПТД. (B) Белая стрелка указывает на узкий участок. (C) Белая стрелка указывает на пластиковый стент. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
3. Установка мочевого катетера
- Через 1 неделю восстановления проинструктируйте пациента лечь в положение лежа на спине и ввести анестезию. Продезинфицируйте кожу эпигастрия 0,5% йодофором и накройте стерильными полотенцами.
- После подтверждения правильной анестезии вставьте проводник вдоль трубки PTCD, извлеките трубку PTCD и поместите защитную трубку с оболочкой 20F вдоль проводника. Снимите проводник и расположите холедохоскоп вдоль ножен.
- Промойте наблюдаемый желтый флокулянт в желчных протоках правой и левой долей печени нормальным физиологическим раствором.
- Определите общий печеночный проток путем нахождения места соединения левого и правого печеночных протоков под контролем В УЗИ. Промойте желтый флокулянт в отверстии общего печеночного протока и расширьте стеноз общего печеночного протока с помощью баллонов 6 мм и 8 мм.
- Определите общий желчный проток с помощью пластикового стента, установленного на этапе 2 под контролем В-УЗИ. Введите холедохоскоп вдоль общего печеночного протока, а также многократно промойте и расширите стенозированный сегмент общего печеночного протока. Полностью откройте стенозирующий сегмент и найдите пластиковый стент, установленный на шаге 2.
- Вставьте проводник в сосочек двенадцатиперстной кишки, снимите тубус и вставьте мочевой катетер 12F вдоль проводника к двенадцатиперстной кишке. Как только это будет сделано, снимите проводник.
- Прошейте кожу конической иглой и 0-0/Т нерассасывающимся швом и завяжите шов на коже и мочевом катетере.
- Верните пациента в палату и дайте лекарство для ингибирования кислоты (Эзомепразол 40 мг BID), ингибирования ферментов (Октреотид 0,6 мг Q12H), парентерального питания (Жировая эмульсия, Аминокислоты (17) и Глюкоза (1%) Инъекции 1920 мл QD), подавления боли (Флурбипрофен 100 мг QD) и подавления инфекции (Цефоперазона натрия и Сульбактама натрия для инъекций 1,5 г Q8H). После операции проведите тест на амилазу.
- Проинструктируйте пациента голодать до тех пор, пока уровень амилазы не упадет до нормы. Внимательно наблюдайте за пациентом на предмет болей в животе, мелены и т.д.
4. Установка билиарного стента
- Через 1 неделю восстановления установите билиарный стент. Проинструктируйте пациента лечь в положение лежа и ввести анестезию. Убедитесь, что пластиковый стент и мочевой катетер установлены (рисунок 5A).
- После правильной анестезии введите дуоденоскоп в рот, пропустите его через пищевод и желудок, дойдите до двенадцатиперстной кишки и найдите дуоденальный сосочек. Определите мочевой катетер и концы пластикового стента и извлеките пластиковый стент изо рта.
- Вставьте двуязычную направляющую проволоку вдоль мочевого катетера. Обеспечьте правильный ввод проводника в двенадцатиперстную кишку, а затем зажмите зажимом инородного тела, проходящим через двенадцатиперстную кишку, желудок и пищевод, и извлекаемым изо рта.
- Разрежьте линию фиксации кожи мочевого катетера и удалите мочевой катетер. Под рентгеноскопией отрегулируйте другой конец двуязычного направляющего провода в правом печеночном протоке, потянув за двуязычный направляющий провод со стороны рта (рис. 5B).
- Вставьте еще одну проводниковую проволоку в левый печеночный проток (рисунок 5B).
- Поместите двойной желчный проток с косичкой размером 7F x 7 см в левый печеночный проток (рис. 5C), а пластиковый стент из желчного протока размером 8,5 F x 12 см в правый печеночный проток, другой конец должен идти от дуоденального сосочка (рис. 5D).
- На протяжении всей процедуры подавайте кислород через носовую канюлю со скоростью 3 л/мин и внимательно следите за жизненно важными показателями во время ЭРХПГ. Затем введите препараты для ингибирования кислот (эзомепразол 40 мг BID), ингибирования ферментов (октреотид 0,6 мг Q12H), парентерального питания (жировая эмульсия, аминокислоты (17) и глюкоза (1%) для инъекций 1920 мл QD), подавления боли (флурбипрофен 100 мг QD) и ингибирования инфекций (цефоперазона натрия и сульбактам натрия для инъекций 1,5 г Q8H). После операции проведите тест на амилазу.
- Завершите операцию. Проинструктируйте пациента голодать до тех пор, пока уровень амилазы не упадет до нормы. Внимательно наблюдайте за пациентом на предмет болей в животе, мелены и т.д.
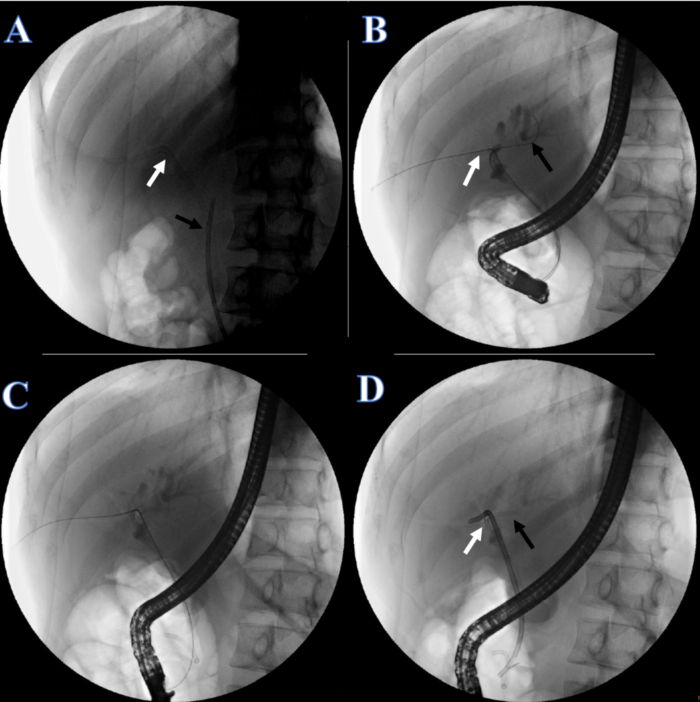
Рисунок 5: Непрерывность желчевыводящих путей восстановлена с помощью ЭРХПГ. (A) Белая стрелка указывает на трубку ПТХД. Черная стрелка указывает на пластиковый стент. (В) Белая стрелка указывает на двойной направляющий провод через правый печеночный проток. Черная стрелка указывает на направляющий провод через левый печеночный проток. (В) Пластический стент для левого печеночного протока. (D) Белая стрелка указывает на пластиковый стент для правого печеночного протока. Черной стрелкой обозначен пластический стент для левого печеночного протока. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Результаты
Мы описываем новый метод, сочетающий ЭРХПГ, пероральную холангиоскопию и ПТХС для лечения сложной утечки желчи после трансплантации печени. Чтобы восстановить непрерывность желчевыводящих путей, мы поместили двойной желчный проток с косичкой разм?...
Обсуждение
В исследовании мы обнаружили новый метод сочетания ЭРХПГ, пероральной холангиоскопии и ПТХС для лечения сложной утечки желчи после трансплантации печени. Ключевые этапы этого метода заключались в следующем: сначала при пероральной холангиоскопии с одним оператором...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Эта работа была поддержана грантами Национального фонда естественных наук Китая (81873591); Гуандунский фонд естественных наук (2022A1515011052); Проект планирования науки и технологий провинции Гуандун (2018A050506030); Научно-техническая программа Гуанчжоу (201704020073); Проект строительства ключевой лаборатории провинции Гуандун по донорству органов и трансплантационной иммунологии (2013A061401007 и 2017B030314018); и База международного сотрудничества провинции Гуандун по науке и технике (трансплантация органов) (2015B050501002).
Материалы
| Name | Company | Catalog Number | Comments |
| Biliary stent | Boston Scientific | M00533560 | 7 F*7 cm |
| Branch choledochoscope | Leinzett | LAN-EP-2612 | |
| Disposable electric snare | Boston Scientific | M00562320 | |
| Disposable sphincterotomy knife | Boston Scientific | M00545170 | |
| Electronic choledochoscope | Olympus | / | |
| Electronic duodenum mirror | Olympus | / | |
| Guidewire | Boston Scientific | M00556140 | |
| Guidewire guided the dilated balloon catheter | Boston Scientific | M00558600 | |
| Integrated biliary stent | Boston Scientific | M00539210 | 7 F*7 cm |
| Integrated biliary stent | Boston Scientific | M00539280 | 8.5 F*12 cm |
Ссылки
- Duffy, J. P., et al. Long-term patient outcome and quality of life after liver transplantation: Analysis of 20-year survivors. Ann Surg. 252 (4), 652-661 (2010).
- Riediger, C., et al. T-tube or no t-tube in the reconstruction of the biliary tract during orthotopic liver transplantation: Systematic review and meta-analysis. Liver Transpl. 16 (6), 705-717 (2010).
- Wojcicki, M., Milkiewicz, P., Silva, M. Biliary tract complications after liver transplantation: A review. Dig Surg. 25 (4), 245-257 (2008).
- Thuluvath, P. J., Pfau, P. R., Kimmey, M. B., Ginsberg, G. G. Biliary complications after liver transplantation: The role of endoscopy. Endoscopy. 37 (9), 857-863 (2005).
- Macías-Gómez, C., Dumonceau, J. M. Endoscopic management of biliary complications after liver transplantation: An evidence-based review. World J Gastrointest Endosc. 7 (6), 606-616 (2015).
- Nakajima, M., Akasaka, Y., Fukumoto, K., Mitsuyoshi, Y., Kawai, K. Peroral cholangiopancreatosocopy (pcps) under duodenoscopic guidance. Am J Gastroenterol. 66 (3), 241-247 (1976).
- Chen, Y. K., et al. Single-operator cholangioscopy in patients requiring evaluation of bile duct disease or therapy of biliary stones (with videos). Gastrointest Endosc. 74 (4), 805-814 (2011).
- Kulpatcharapong, S., Pittayanon, R. S. J. K., Rerknimitr, R. Diagnostic performance of different cholangioscopes in patients with biliary strictures: A systematic review. Endoscopy. 52 (3), 174-185 (2020).
- Rainer, F., et al. A novel way to avoid reoperation for biliary strictures after liver transplantation: Cholangioscopy-assisted guidewire placement. Endoscopy. 51 (11), E314-E316 (2019).
- Bokemeyer, A., et al. Digital single-operator cholangioscopy: A useful tool for selective guidewire placements across complex biliary strictures. Surg Endosc. 33 (3), 731-737 (2019).
- Woo, Y. S., et al. Spyglass cholangioscopy-assisted guidewire placement for post-ldlt biliary strictures: A case series. Surg Endosc. 30 (9), 3897-3903 (2016).
- Martins, F. P., Seleti, S. M. R., Contini, M. L., Ga, D. E. P., Ferrari, A. P. Is there a place for cholangioscopic evaluation of biliary anastomotic stricture after deceased donor liver transplant. Arq Gastroenterol. 57 (4), 347-353 (2020).
- Magro, B., Tacelli, M., Mazzola, A., Conti, F., Celsa, C. Biliary complications after liver transplantation: Current perspectives and future strategies. Hepatobiliary Surg Nutr. 10 (1), 76-92 (2021).
- Arain, M. A., Attam, R., Freeman, M. L. Advances in endoscopic management of biliary tract complications after liver transplantation. Liver Transpl. 19 (5), 482-498 (2013).
- Tsujino, T., et al. Endoscopic management of biliary complications after adult living donor liver transplantation. Am J Gastroenterol. 101 (10), 2230-2236 (2006).
- López Álvarez, M., Otero, M., Vázquez Millán, M. A., Suárez López, F., Alonso Aguirre, P. Endoscopic treatment of biliary complications after liver transplantation. Rev Esp Enferm Dig. 112 (8), 605-608 (2020).
- Alves, A. R., Gomes, D., Furtado, E., Tomé, L. Efficacy of endoscopic retrograde cholangiopancreatography in the treatment of biliary complications following liver transplant: 10 years of a single-centre experience. GE Port J Gastroenterol. 25 (1), 10-17 (2018).
- Yasen, A., et al. Efficiency of percutaneous transhepatic cholangioscopy in the treatment of biliary complications after liver transplantation. HPB (Oxford). 25 (4), 463-471 (2023).
- Zimmerman, M. A., et al. resolution of biliary complications after living and deceased donor liver transplantation: A report from the adult-to-adult living donor liver transplantation cohort study consortium. Liver Transpl. 19 (3), 259-267 (2013).
- Moy, B. T., Birk, J. W. A review on the management of biliary complications after orthotopic liver transplantation. J Clin Transl Hepatol. 7 (1), 61-71 (2019).
- Wadhawan, M., Kumar, A. Management issues in post living donor liver transplant biliary strictures. World J Hepatol. 8 (10), 461-470 (2016).
- Enochsson, L., et al. Nationwide, population-based data from 11,074 ercp procedures from the swedish registry for gallstone surgery and ercp. Gastrointest Endosc. 72 (6), 1175-1184 (2010).
- Khan, M. A., et al. Endoscopic ultrasound-guided biliary drainage: A systematic review and meta-analysis. Dig Dis Sci. 61 (3), 684-703 (2016).
- Dhir, V., et al. Endoscopic ultrasonography-guided biliary and pancreatic duct interventions. Dig Endosc. 29 (4), 472-485 (2017).
- Derdeyn, J., Laleman, W. Current role of endoscopic cholangioscopy. Curr Opin Gastroenterol. 34 (5), 301-308 (2018).
- Iwashita, T., Doi, S., Yasuda, I. Endoscopic ultrasound-guided biliary drainage: A review. Clin J Gastroenterol. 7 (2), 94-102 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены