需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
肝移植后复杂胆漏的新型治疗方法
* 这些作者具有相同的贡献
摘要
胆漏是肝移植后常见的并发症,对患者的预后有显著影响。该方案提出了一种结合内窥镜逆行胰胆管造影 (ERCP)、分支胆总管镜和经皮经肝胆管镜检查 (PTCS) 治疗肝移植后复杂胆漏的新方法。
摘要
胆漏是肝移植后的常见并发症,通常可以通过内窥镜逆行胰胆管造影 (ERCP)、经皮经肝胆管引流 (PTCD)、经皮经肝胆管镜检查 (PTCS) 和手术治愈。我们报道了一种肝移植后持续 9 个月的胆漏新疗法,在此期间 ERCP、PTCD、PTCS 和手术治疗是徒劳的。我们使用了一种新的多内窥镜治疗方法。首先,使用 ERCP 和经口单人胆管镜检查将塑料支架作为标志物放置在胆漏部位的远端。其次,PTCS 通过 PTCD 管进行。术中,通过塑料支架和 B 超定位胆漏部位的近端,通过导丝和导尿管暂时重建胆道的连续性。第三,放置双头导丝,拔除导尿管,放置支架,重建胆道连续性。总之,我们发现了一种结合 ERCP、经口单人胆管镜和 PTCS 治疗肝移植后复杂胆漏的新方法。
引言
肝移植已成为终末期肝病患者的标准治疗。肝移植后,大约 1/3 的患者受到胆道并发症的影响,这些并发症导致严重的并发症和患者生存率降低,这被称为肝移植的阿喀琉斯之踵1。胆漏是仅次于肝移植的第二大常见并发症,发生率为 2%-21%2,3,4。治疗胆道并发症的常用方法包括内窥镜逆行胰胆管造影术 (ERCP)、经皮经肝胆管引流 (PTCD)、经皮经肝胆管镜检查 (PTCS) 和手术5,但它们并不都有效。
该方法的目标是通过结合 ERCP、经口单人胆管镜检查和 PTCS 来解决肝移植后复杂的胆漏。
该方法的技术原理分为三个步骤。首先,通过 ERCP 和经口单人胆管镜检查,在直视下识别胆漏的远端,并放置塑料支架作为标记。然后,通过 PTCS,在塑料支架的引导下,在直视下从肝总管寻找胆漏的近端,导尿管重建胆道的连续性。最后,通过 ERCP,使用双头导丝,拔除导尿管,放置左右肝管支架,重建胆道连续性。
经口胆管镜检查 (POCS) 于 1976 年由日本首次报道6。Chen 等人 7 于 2007 年首次报道了第一代单人可视化胆总镜系统 SpyGlass,第二代 SpyGlass (SpyGlass DS) 于 2015 年由波士顿推出8。随着器械的发展,经口单人胆管镜检查越来越薄,功能也越来越多。
这种方法最大的优点是可以在经口单人胆管镜检查的直接视野下进行,从而提高了手术的成功率和安全性 9,10,11,12。Rainer9 报告了在 ERCP 支架植入失败的肝移植后患者中使用直接胆道视觉系统成功放置支架,他们认为直接观察胆道狭窄处的微小开口是成功通过导丝的唯一方法。
该方法适用于肝移植后复杂胆漏且 ERCP、PTCD、PTCS 和手术无法治愈的患者。
我们报告了一名 38 岁男性的病例,该男子除了因乙型肝炎病毒爆发而引起的慢加急性肝衰竭外,还患有克罗恩病和白癜风。尽管反复进行人工肝治疗,但肝功能随着时间的推移而下降。当一名 15 岁脑死亡儿童提供匹配的供体肝脏时,胆汁渗漏发生在肝移植后 14 天(图 1A)。由于急性腹痛和感染性休克,立即安装了腹腔引流管和 PTCD。引流后,患者的整体健康状况得到改善,腹膜积液量大大减少(图1B)。
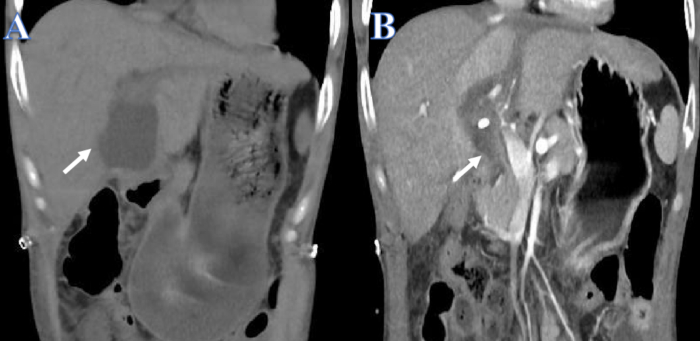
图 1:胆汁渗漏引流前后。 (A) 白色箭头表示引流前的液体。(B) 白色箭头表示引流后的液体。 请单击此处查看此图的较大版本。
3 周后,肝内胆管不足以支撑导丝,导丝很容易穿过肝内胆管到达其他位置,因此尝试通过左右肝管中的 PTCD 管从上到下重建胆道均失败(图2)。4 周后,尝试使用 ERCP 从下到上重建胆道未成功,因为导丝无法穿过狭窄进入肝内胆管(图3)。2 周后,胆总管无法定位,肺门内左右肝管交界处有许多结石,无法用 PTCS 从上到下重建胆道。约 4 周后,由于胆道漏周围组织明显炎症和水肿,尝试通过胆总管空肠吻合术重建胆道失败,且患者既往克罗恩病病史大大增加了术后胆漏伴肠瘘的风险。
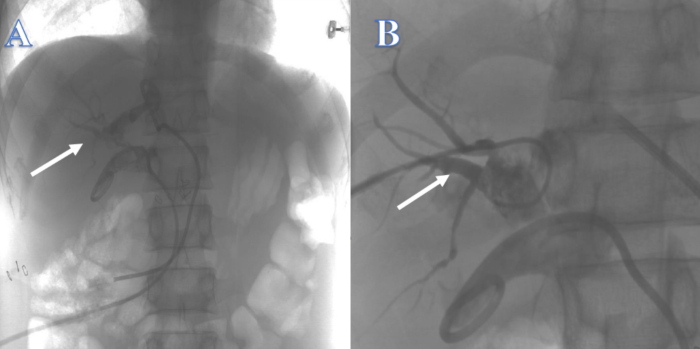
图 2:PTC 重建的胆道连续性。 (A) 白色箭头表示从左肝管尝试。(B) 白色箭头表示来自右肝管的尝试。 请单击此处查看此图的较大版本。

图 3:ERCP 重建的胆道连续性。 导丝无法进入肝内胆管。 请单击此处查看此图的较大版本。
在这里,我们发现了一种结合 ERCP、经口单人胆管镜和 PTCS 治疗肝移植后复杂胆漏的新方法。首先放置塑料支架,通过 ERCP 和经口单人胆管镜检查定位胆漏的远端。然后通过 PTCS 和 B 超声定位胆漏的近端,最后通过 ERCP 重建胆道的连续性。
研究方案
该研究符合 1975 年《赫尔辛基宣言》的伦理准则,并获得了中山大学附属第一医院伦理委员会的批准。已获得患者的知情同意。
1. 术前准备
- 指导患者在 ERCP 前禁食 6-8 小时。培替丁 1 mg/kg、茴诺丹明 20 mg、咪达唑仑注射液 1 mg、氟比洛芬 100 mg 静脉注射和盐酸丁卡因口服。当咽反射消失时,局部麻醉加镇静镇痛被认为成功。
2. 塑料支架置入
- 确保患者处于俯卧位,一旦麻醉深度令人满意,就开始手术。将十二指肠镜插入口中,穿过食道和胃到达十二指肠,找到十二指肠。
- 将导丝插入胆总管。
- 通过 ERCP 或 PTCD 管以 2 mL/s 的速率施用碘丙胺注射液(碘浓度 300 mg/mL)。注射后观察肝内和肝外胆管进行胆管造影,并确定胆管狭窄。请注意,胆管的狭窄位于肝总管中,肝内和肝外胆管不能同时可视化(图 4A)。
- 通过将碘丙胺注射到球囊中,用 6-8 毫米的扩张球囊将胆总管的下部开口扩张至 7 毫米。
- 插入经口单人胆管镜检查,观察胆管,发现无法通过的狭窄,并通过狭窄插入导丝,然后用 6 毫米胆道扩张探条扩张。
- 通过注射碘丙胺注射,用 6-8 毫米的扩张球囊将狭窄扩张至 7 毫米(图 4B)。
- 再次插入经口单人胆管镜检查以观察胆管。请注意带有结石和絮状物质的盲胆管,即使在碘普罗胺注射后也没有观察到肝内胆管。
- 将 7F x 7 cm 塑料胆道支架通过狭窄放入盲管中,另一端从十二指肠中取出(图 4C)。
- 在整个手术过程中,通过鼻插管以 3 L/min 的速度提供氧气,并在 ERCP 期间密切监测生命体征。然后,提供抑酸(埃索美拉唑 40 mg BID)、酶抑制(奥曲肽 0.6 mg Q12H)、肠外营养(脂肪乳剂、氨基酸 (17) 和葡萄糖 (1%) 注射液 1920 mL QD)、疼痛抑制(氟比洛芬 100mg QD)和感染抑制(注射用头孢哌酮钠和舒巴坦钠 1.5 g Q8H)。手术后进行淀粉酶检测。
- 完成手术并指导患者禁食,直到淀粉酶水平降至正常。密切观察患者是否有腹痛、黑便等。
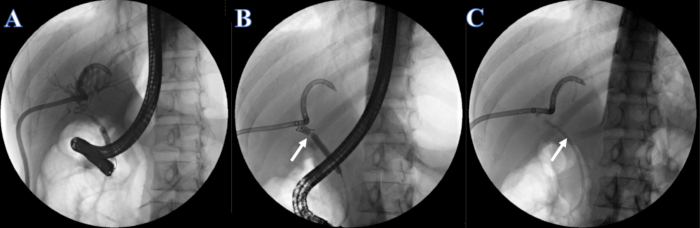
图 4: ERCP 放置的塑料支架。 (A) PTCD 胆管造影术。(B) 白色箭头表示较窄的部分。(C) 白色箭头表示塑料支架。 请单击此处查看此图的较大版本。
3. 放置导尿管
- 恢复 1 周后,指导患者仰卧位并进行麻醉。用 0.5% 碘伏消毒上腹部皮肤,并用无菌毛巾覆盖。
- 确认麻醉正确后,将导丝沿 PTCD 管插入,取出 PTCD 管,沿导丝放置 20F 保护护套管。取下导丝并沿护套放置一个胆总管镜。
- 用生理盐水冲洗左右肝叶胆管中观察到的黄色絮状物质。
- 在 B 超引导下,找到左右肝管交界处,识别肝总管。冲洗肝总管开口处的黄色絮状物质,并用 6 mm 和 8 mm 球囊扩张肝总管狭窄。
- 在 B 超声引导下,通过放置在步骤 2 的塑料支架识别胆总管。沿肝总管插入胆总管,反复冲洗和扩张肝总管的狭窄段。完全打开狭窄段,找到放置在第 2 步的塑料支架。
- 将导丝插入十二指肠,取下护套,沿导丝插入 12F 导尿管至十二指肠。完成后,取下导丝。
- 用锥形针和 0-0/T 不可吸收缝合线缝合皮肤,并在皮肤和导尿管上打结。
- 将患者送回病房,给予抑酸药物(埃索美拉唑 40 mg BID)、酶抑制药物(奥曲肽 0.6 mg Q12H)、肠外营养(脂肪乳剂、氨基酸 (17) 和葡萄糖 (1%) 注射液 1920 mL QD)、疼痛抑制(氟比洛芬 100 mg QD)和感染抑制(注射用头孢哌酮钠和舒巴坦钠 1.5 g Q8H)。手术后进行淀粉酶检测。
- 指导患者禁食,直到淀粉酶水平降至正常。密切观察患者是否有腹痛、黑便等。
4. 胆道支架置入
- 恢复 1 周后,放置胆道支架。指导患者俯卧并进行麻醉。检查塑料支架和导尿管是否就位(图 5A)。
- 适当麻醉后,将十二指肠镜插入口腔,穿过食道和胃,到达十二指肠,找到十二指肠。识别导尿管和塑料支架末端,并从口腔中取出塑料支架。
- 将双头导丝沿导尿管插入。确保导丝正确进入十二指肠,然后用异物夹夹住,穿过十二指肠、胃和食道,从嘴中取出。
- 剪断导尿管的皮肤固定线,取出导尿管。在 X 射线透视下,通过从嘴侧拉动双头导丝,将双头导丝的另一端调整到右肝管中(图 5B)。
- 将另一根导丝插入左肝管(图 5B)。
- 在左肝管中放置一个 7F x 7 cm 的双尾椎胆管(图 5C),在右肝管中放置一个 8.5 F x 12 cm 的胆管塑料支架,另一端从十二指肠引出(图 5D)。
- 在整个手术过程中,通过鼻插管以 3 L/min 的速度提供氧气,并在 ERCP 期间密切监测生命体征。然后,提供抑酸(埃索美拉唑 40 mg BID)、酶抑制(奥曲肽 0.6 mg Q12H)、肠外营养(脂肪乳剂、氨基酸 (17) 和葡萄糖 (1%) 注射液 1920 mL QD)、疼痛抑制(氟比洛芬 100mg QD)和感染抑制(注射用头孢哌酮钠和舒巴坦钠 1.5 g Q8H)。手术后进行淀粉酶检测。
- 完成作。指导患者禁食,直到淀粉酶水平降至正常。密切观察患者是否有腹痛、黑便等。
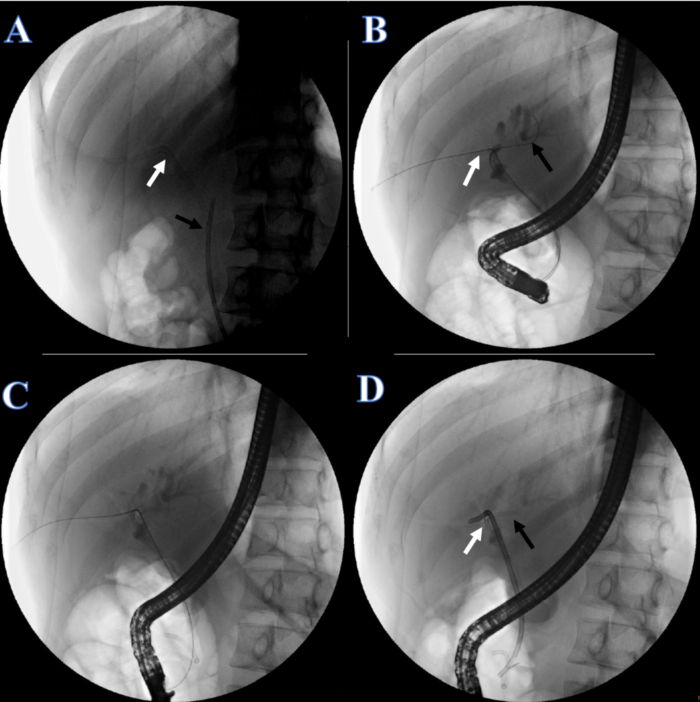
图 5:通过 ERCP 重建的胆道连续性。 (A) 白色箭头表示 PTCD 管。黑色箭头表示塑料支架。(B) 白色箭头表示穿过右肝管的双导丝。黑色箭头表示穿过左肝管的导丝。(C) 用于左肝管的塑料支架。(D) 白色箭头表示右肝管的塑料支架。黑色箭头表示左肝管的塑料支架。 请单击此处查看此图的较大版本。
结果
我们描述了一种结合 ERCP、经口单人胆管镜检查和 PTCS 治疗肝移植后复杂胆漏的新方法。为了重建胆道连续性,我们在左肝管中放置了一个 7F x 7 cm 的双尾纤胆管(图 5C),在右肝管中放置了一个 8.5 F x 12 cm 的胆管塑料支架(图 5D),使用多个内窥镜的组合。
讨论
在这项研究中,我们发现了一种联合 ERCP、经口单人胆管镜检查和 PTCS 治疗肝移植术后复杂胆漏的新方法。该方法的关键步骤如下:首先,在经口单人作胆管镜下,确定胆漏末端,并放置塑料支架。其次,在 B 超引导下,观察肝总管狭窄并扩张,暴露塑料支架。在这两个重要步骤中,有必要在经口单人胆管镜检查的直视下轻柔地进行,以避免胆道穿孔和出血等医源性并发?...
披露声明
作者声明没有利益冲突。
致谢
这项工作得到了中国国家自然科学基金 (81873591) 的资助;广东省自然科学基金(2022A1515011052);广东省科技计划项目(2018A050506030);广州市科学技术计划项目(201704020073);广东省器官捐献与移植免疫学重点实验室建设投影(2013A061401007 和 2017B030314018);广东省科技国际合作基地(器官移植)(2015B050501002)。
材料
| Name | Company | Catalog Number | Comments |
| Biliary stent | Boston Scientific | M00533560 | 7 F*7 cm |
| Branch choledochoscope | Leinzett | LAN-EP-2612 | |
| Disposable electric snare | Boston Scientific | M00562320 | |
| Disposable sphincterotomy knife | Boston Scientific | M00545170 | |
| Electronic choledochoscope | Olympus | / | |
| Electronic duodenum mirror | Olympus | / | |
| Guidewire | Boston Scientific | M00556140 | |
| Guidewire guided the dilated balloon catheter | Boston Scientific | M00558600 | |
| Integrated biliary stent | Boston Scientific | M00539210 | 7 F*7 cm |
| Integrated biliary stent | Boston Scientific | M00539280 | 8.5 F*12 cm |
参考文献
- Duffy, J. P., et al. Long-term patient outcome and quality of life after liver transplantation: Analysis of 20-year survivors. Ann Surg. 252 (4), 652-661 (2010).
- Riediger, C., et al. T-tube or no t-tube in the reconstruction of the biliary tract during orthotopic liver transplantation: Systematic review and meta-analysis. Liver Transpl. 16 (6), 705-717 (2010).
- Wojcicki, M., Milkiewicz, P., Silva, M. Biliary tract complications after liver transplantation: A review. Dig Surg. 25 (4), 245-257 (2008).
- Thuluvath, P. J., Pfau, P. R., Kimmey, M. B., Ginsberg, G. G. Biliary complications after liver transplantation: The role of endoscopy. Endoscopy. 37 (9), 857-863 (2005).
- Macías-Gómez, C., Dumonceau, J. M. Endoscopic management of biliary complications after liver transplantation: An evidence-based review. World J Gastrointest Endosc. 7 (6), 606-616 (2015).
- Nakajima, M., Akasaka, Y., Fukumoto, K., Mitsuyoshi, Y., Kawai, K. Peroral cholangiopancreatosocopy (pcps) under duodenoscopic guidance. Am J Gastroenterol. 66 (3), 241-247 (1976).
- Chen, Y. K., et al. Single-operator cholangioscopy in patients requiring evaluation of bile duct disease or therapy of biliary stones (with videos). Gastrointest Endosc. 74 (4), 805-814 (2011).
- Kulpatcharapong, S., Pittayanon, R. S. J. K., Rerknimitr, R. Diagnostic performance of different cholangioscopes in patients with biliary strictures: A systematic review. Endoscopy. 52 (3), 174-185 (2020).
- Rainer, F., et al. A novel way to avoid reoperation for biliary strictures after liver transplantation: Cholangioscopy-assisted guidewire placement. Endoscopy. 51 (11), E314-E316 (2019).
- Bokemeyer, A., et al. Digital single-operator cholangioscopy: A useful tool for selective guidewire placements across complex biliary strictures. Surg Endosc. 33 (3), 731-737 (2019).
- Woo, Y. S., et al. Spyglass cholangioscopy-assisted guidewire placement for post-ldlt biliary strictures: A case series. Surg Endosc. 30 (9), 3897-3903 (2016).
- Martins, F. P., Seleti, S. M. R., Contini, M. L., Ga, D. E. P., Ferrari, A. P. Is there a place for cholangioscopic evaluation of biliary anastomotic stricture after deceased donor liver transplant. Arq Gastroenterol. 57 (4), 347-353 (2020).
- Magro, B., Tacelli, M., Mazzola, A., Conti, F., Celsa, C. Biliary complications after liver transplantation: Current perspectives and future strategies. Hepatobiliary Surg Nutr. 10 (1), 76-92 (2021).
- Arain, M. A., Attam, R., Freeman, M. L. Advances in endoscopic management of biliary tract complications after liver transplantation. Liver Transpl. 19 (5), 482-498 (2013).
- Tsujino, T., et al. Endoscopic management of biliary complications after adult living donor liver transplantation. Am J Gastroenterol. 101 (10), 2230-2236 (2006).
- López Álvarez, M., Otero, M., Vázquez Millán, M. A., Suárez López, F., Alonso Aguirre, P. Endoscopic treatment of biliary complications after liver transplantation. Rev Esp Enferm Dig. 112 (8), 605-608 (2020).
- Alves, A. R., Gomes, D., Furtado, E., Tomé, L. Efficacy of endoscopic retrograde cholangiopancreatography in the treatment of biliary complications following liver transplant: 10 years of a single-centre experience. GE Port J Gastroenterol. 25 (1), 10-17 (2018).
- Yasen, A., et al. Efficiency of percutaneous transhepatic cholangioscopy in the treatment of biliary complications after liver transplantation. HPB (Oxford). 25 (4), 463-471 (2023).
- Zimmerman, M. A., et al. resolution of biliary complications after living and deceased donor liver transplantation: A report from the adult-to-adult living donor liver transplantation cohort study consortium. Liver Transpl. 19 (3), 259-267 (2013).
- Moy, B. T., Birk, J. W. A review on the management of biliary complications after orthotopic liver transplantation. J Clin Transl Hepatol. 7 (1), 61-71 (2019).
- Wadhawan, M., Kumar, A. Management issues in post living donor liver transplant biliary strictures. World J Hepatol. 8 (10), 461-470 (2016).
- Enochsson, L., et al. Nationwide, population-based data from 11,074 ercp procedures from the swedish registry for gallstone surgery and ercp. Gastrointest Endosc. 72 (6), 1175-1184 (2010).
- Khan, M. A., et al. Endoscopic ultrasound-guided biliary drainage: A systematic review and meta-analysis. Dig Dis Sci. 61 (3), 684-703 (2016).
- Dhir, V., et al. Endoscopic ultrasonography-guided biliary and pancreatic duct interventions. Dig Endosc. 29 (4), 472-485 (2017).
- Derdeyn, J., Laleman, W. Current role of endoscopic cholangioscopy. Curr Opin Gastroenterol. 34 (5), 301-308 (2018).
- Iwashita, T., Doi, S., Yasuda, I. Endoscopic ultrasound-guided biliary drainage: A review. Clin J Gastroenterol. 7 (2), 94-102 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。