このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
肝移植後の複雑性胆汁漏出に対する新規治療法
* これらの著者は同等に貢献しました
要約
胆汁漏出は、肝移植後の一般的な合併症であり、患者の予後に大きな影響を与えます。このプロトコルは、内視鏡的逆行性胆管膵管造影法 (ERCP)、枝胆管鏡、および経皮的経肝胆管鏡検査 (PTCS) を組み合わせる新しい方法を提示します 肝移植後の複雑な胆汁漏出を治療します。
要約
胆汁漏出は、肝移植後の一般的な合併症であり、通常は内視鏡的逆行性胆管膵管造影術(ERCP)、経皮的経肝胆管ドレナージ(PTCD)、経皮的経肝胆管鏡検査(PTCS)、および手術で治癒する可能性があります。肝移植後9ヶ月間の胆道漏出に対する新規治療法を報告し、その間、ERCP、PTCD、PTCS、および外科的治療は無駄でした。私たちは、新しい多内視鏡治療法を採用しました。まず、ERCP と経口単回オペレーター胆管鏡検査を使用して、胆汁漏出部位の遠位端にマーカーとしてプラスチック ステントを配置します。次に、PTCSはPTCDチューブを介して実行されます。手術中、胆汁漏出部位の近位端はプラスチックステントとB超音波によって特定され、胆道の連続性はガイドワイヤーと尿道カテーテルを介して一時的に再構築されます。第三に、双頭ガイドワイヤーを留置し、尿道カテーテルを抜去し、ステントを留置し、胆道の連続性を再構築します。結論として、肝移植後の複雑な胆汁漏出を治療するために、ERCP、経口単管管鏡検査、およびPTCSを組み合わせた新しい方法を見つけました。
概要
肝移植は、末期肝疾患の患者における標準治療となっています。肝移植後、約1/3の患者が胆道合併症に罹患し、その結果、肝移植のアキレス腱と呼ばれる重大な罹患率と生存率の低下が生じます1。胆道漏出は、肝移植に次いで2番目に多い合併症であり、発生率は2%〜21%2,3,4です。胆道合併症の治療に一般的に使用されるアプローチには、内視鏡的逆行性胆管膵管造影(ERCP)、経皮的経肝胆管ドレナージ(PTCD)、経皮的経肝胆管鏡検査(PTCS)、および手術が含まれます5が、すべてが効果的であるわけではありません。
この方法の目標は、ERCP、経口単オペレーター胆管鏡検査、および PTCS を組み合わせることにより、肝移植後の複雑な胆道漏出に対処することです。
この方法の技術原理は、3つのステップに分かれています。まず、ERCP と経口単管管鏡検査により、直視下で胆道漏出の遠位端を特定し、マーカーとしてプラスチック ステントを配置します。次に、PTCSを介して、プラスチックステントのガイダンスの下で、胆道漏出の近位端が直視下で総肝管から検索され、尿道カテーテルが胆道の連続性を再構築します。最後に、ERCPを介して、双頭ガイドワイヤーを使用し、尿道カテーテルを抜去し、左右の肝管ステントを留置して胆道連続性を再構築します。
経口胆管鏡検査(POCS)は、1976年に日本によって初めて報告されました6。Chen et al.7 は、2007 年に第 1 世代のシングルオペレーター可視化胆汁鏡システムである SpyGlass を初めて報告し、第 2 世代の SpyGlass (SpyGlass DS) は 2015 年にボストンから発売されました8。器具の発達により、経口単オペレーター胆管鏡検査は薄くなり、機能も増えてきました。
この方法の最大の利点は、それがペロラルシングルオペレーター胆管鏡検査の直接視力の下で行うことができ、これにより手術の成功率と安全性が向上することです9,10,11,12。Rainer9 は、ERCP ステント留置不全の肝移植後の患者を対象に、直接胆道ビジョン システムを使用したステント留置の成功を報告し、胆道狭窄の小さな開口部を直接視覚化することがガイドワイヤーを成功裏に通過する唯一の方法であることを示唆しました。
この方法は、肝移植後に複雑な胆道漏出があり、ERCP、PTCD、PTCS、および手術では治癒できない患者に適しています。
B型肝炎ウイルスの発生により、クローン病と白斑の既往歴があり、急性から慢性の肝不全を発症した38歳の男性の症例を報告します。人工肝臓治療を繰り返したにもかかわらず、肝機能は時間の経過とともに低下しました。脳死の15歳の子供が一致するドナー肝臓を提供したとき、肝移植の14日後に胆汁漏出が発生しました(図1A)。腹腔ドレナージチューブとPTCDは、急性腹痛と敗血症性ショックのため、すぐに取り付けられました。ドレナージ後、患者の全体的な健康状態は改善し、腹水の量は大幅に減少しました(図1B)。
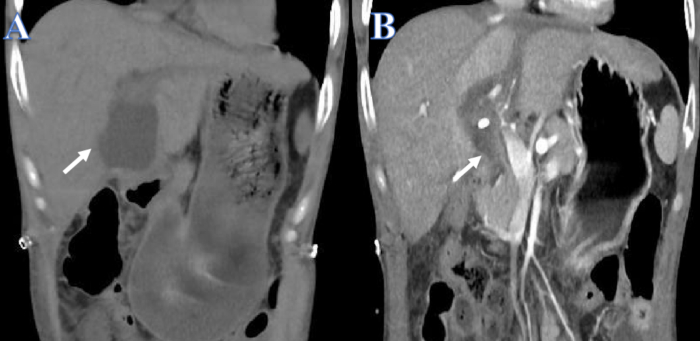
図1:胆汁漏れの排出前と排出後。 (A)白い矢印は排水前の液体を示しています。(B)白矢印はドレナージ後の液体を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
3週間後、肝内胆管がガイドワイヤーを支えるのに十分で、ガイドワイヤーは肝内胆管を通り抜けて他の場所に容易に移動したため、左右の肝管のPTCDチューブを介して胆道を上から下に再建する試みはどちらも失敗しました(図2)。4週間後、ERCPを使用して胆道を下から上に再建する試みは、ガイドワイヤーが狭窄を通って肝内胆管に入ることができなかったため、成功しませんでした(図3)。2週間後、総胆管の位置が特定できなくなり、膝蓋骨の左右の肝管の接合部に多数の結石が存在し、PTCSで胆道を上から下まで再建することができなくなりました。約 4 週間後、胆道空腸吻合術による胆道再建の試みは、胆道漏出周囲の組織の明らかな炎症と浮腫のために失敗し、患者の以前のクローン病の病歴により、腸瘻を伴う術後の胆道漏出のリスクが大幅に増加しました。
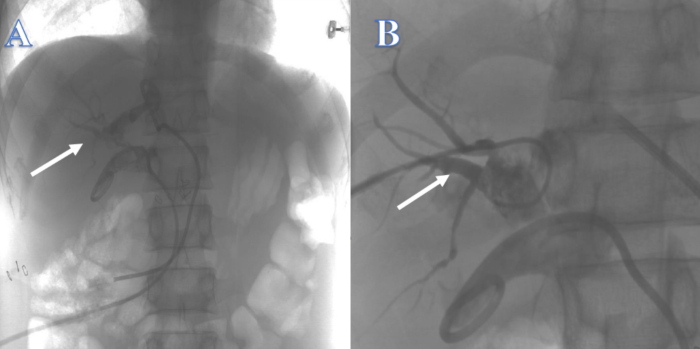
図2:PTCによって再構築された胆道の連続 性 (A)白い矢印は左肝管からの試みを示しています。(B)白い矢印は右肝管からの試みを示しています。 この図の拡大版を表示するには、ここをクリックしてください。

図3:ERCPによって再構築された胆道の連続性。 ガイドワイヤーが肝内胆管に入ることができなかった。 この図の拡大版を表示するには、ここをクリックしてください。
本研究では、肝移植後の複雑な胆汁漏出を治療するために、ERCP、経口単オペレーター胆管鏡検査、PTCSを併用する新しい方法を発見しました。プラスチック製のステントは、ERCP および経口単オペレーター胆管鏡検査を通じて胆汁漏出の遠位端を特定するために最初に配置されました。次に、胆汁漏出の近位端をPTCSとB超音波で特定し、最後に胆道の連続性をERCPで再構築しました。
プロトコル
この研究は、1975年のヘルシンキ宣言の倫理ガイドラインに準拠し、中山大学第一付属病院の倫理委員会によって承認されました。インフォームドコンセントは患者から得られました。
1. 術前準備
- ERCPの前に6〜8時間絶食するように患者に指示します。.ペチジン1 mg / kg、アニソダミン20 mg、ミダゾラム注射1 mg、フルルビプロフェン100 mgを静脈内投与し、塩酸テトラカインを経口投与します。.咽頭反射が消失したとき、局所麻酔と鎮静および鎮痛が成功したと見なされました。
2. プラスチック製ステント留置
- 患者が腹臥位に置かれていることを確認し、麻酔の深さが十分になったら、手順を開始します。十二指腸鏡を口に挿入し、食道と胃に通して十二指腸に到達し、十二指腸乳頭を見つけます。
- ガイドワイヤーを総胆管に挿入します。
- イオプロミド注射(ヨウ素濃度300 mg / mL)をERCPまたはPTCDチューブを通じて2 mL / sの速度で投与します。.注射後の胆管造影のために肝内および肝外の胆管を観察し、胆管の狭窄を特定します。胆管の狭窄は総肝管に位置し、肝内胆管と肝外胆管を同時に視覚化することはできないことに注意してください(図4A)。
- イオプロミドをバルーンに注入することにより、6〜8mmの拡張バルーンで総胆管の下部開口部を7mmに拡張します。.
- 経口単オペレーター胆管鏡検査を挿入して胆管を観察し、通過できない狭窄を見つけ、ガイドワイヤーを狭窄に挿入した後、6mmの胆道拡張ブギで拡張します。
- イオプロミド注射を注入することにより、6〜8 mmの拡張バルーンで狭窄を7 mmに拡張します(図4B)。
- 胆管を観察するために、経口単オペレーター胆管鏡検査を再度挿入します。石や凝集性物質のある盲目の胆管には注意が必要ですが、イオプロミド注射後も肝内胆管は観察されません。
- 7F x 7 cmのプラスチック製胆道ステントを狭窄部からブラインドダクトに留置し、もう一方の端を十二指腸乳頭の外側に配置しました(図4C)。
- 手順全体を通して、鼻カニューレを介して 3 L/min で酸素を供給し、ERCP 中のバイタル サインを綿密に監視します。次に、酸阻害薬(エソメプラゾール40 mg BID)、酵素阻害薬(オクトレオチド0.6 mg Q12H)、非経口栄養薬(脂肪エマルジョン、アミノ酸(17)およびグルコース(1%)注射1920 mL QD)、痛み抑制薬(フルルビプロフェン100mg QD)、および感染抑制薬(セフォペラゾンナトリウムおよびスルバクタムナトリウム注射用1.5 g Q8H)。.手術後にアミラーゼ試験を実施します。
- 手術を完了し、アミラーゼレベルが正常に下がるまで絶食するように患者に指示します。.腹痛、下血などについて患者を注意深く観察します。
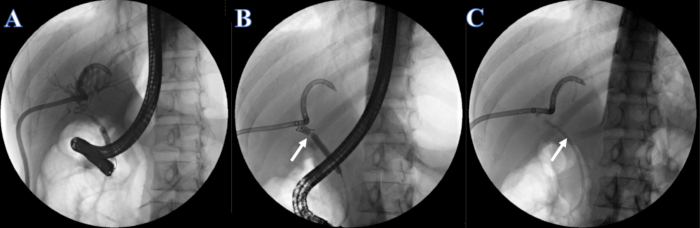
図4: ERCPによって配置されたプラスチックステント。 (A)PTCD胆管造影。(B)白い矢印は狭い部分を示しています。(C)白い矢印はプラスチック製のステントを示しています。 この図の拡大版を表示するには、ここをクリックしてください。
3. 尿道カテーテル留置術
- 回復の1週間後、患者に仰臥位で横になり、麻酔を投与するように指示します。.0.5%ヨードフォアで上腹部の皮膚を消毒し、滅菌タオルで覆います。.
- 適切な麻酔を確認した後、PTCDチューブに沿ってガイドワイヤーを挿入し、PTCDチューブを取り外し、ガイドワイヤーに沿って20F保護シースチューブを配置します。ガイドワイヤーを取り外し、コレドコスコープをシースに沿って配置します。
- 観察された黄色の凝集性物質を左右の肝葉の胆管で洗い流します 生理食塩水。
- B超音波の指導の下で左右の肝管の接合部を見つけることにより、一般的な肝管を特定します。総肝管の開口部に黄色の凝集性材料を洗い流し、6mmおよび8mmのバルーンで総肝管の狭窄を拡張します。
- B超音波ガイダンスの下のステップ2に配置されたプラスチックステントによって総胆管を特定します。総肝管に沿って胆管鏡を挿入し、総肝管の狭窄セグメントを繰り返し洗い流して拡張します。狭窄セグメントを完全に開き、ステップ2で配置されたプラスチックステントを見つけます。
- ガイドワイヤーを十二指腸乳頭に挿入し、シースを取り外し、ガイドワイヤーに沿って12F尿道カテーテルを十二指腸に挿入します。完了したら、ガイドワイヤーを取り外します。
- テーパー針と0-0/T非吸収性縫合糸で皮膚を縫い、縫合糸を皮膚と尿道カテーテルに結びます。
- 患者を病棟に戻し、酸阻害(エソメプラゾール40 mg BID)、酵素阻害(オクトレオチド0.6 mg Q12H)、非経口栄養(脂肪エマルジョン、アミノ酸(17)およびグルコース(1%)注射1920 mL QD)、疼痛抑制(フルルビプロフェン100 mg QD)、および感染抑制(セフォペラゾンナトリウムおよびスルバクタムナトリウム注射用1.5 g Q8H)の薬を投与します。.手術後にアミラーゼ試験を実施します。
- アミラーゼレベルが正常に低下するまで絶食するように患者に指示します。.腹痛、下血などについて患者を注意深く観察します。
4. 胆道ステント留置術
- 回復の1週間後、胆道ステントを留置します。患者に腹臥位で横になり、麻酔を施すように指示します。プラスチック製のステントと尿道カテーテルが所定の位置にあることを確認します(図5A)。
- 適切な麻酔を行ったら、十二指腸鏡を口に挿入し、食道と胃に通し、十二指腸に到達して十二指腸乳頭を見つけます。尿道カテーテルとプラスチック製のステントの端を特定し、プラスチック製のステントを口から取り外します。
- 両頭ガイドワイヤーを尿道カテーテルに沿って挿入します。ガイドワイヤーが十二指腸に正しく挿入されていることを確認してから、異物クランプでクランプし、十二指腸、胃、食道を通過し、口から取り外します。
- 尿道カテーテルの皮膚固定線を切断し、尿道カテーテルを抜去します。X線透視法の下で、両頭ガイドワイヤーを口側から引っ張って、両頭ガイドワイヤーのもう一方の端を右肝管に調整します(図5B)。
- 別のガイドワイヤーを左肝管に挿入します(図5B)。
- 7F x 7 cmのダブルピグテール胆管を左の肝管に留置し(図5C)、8.5 F x 12 cmの胆管プラスチックステントを右の肝管に留置し、もう一方の端を十二指腸乳頭から導きます(図5D)。
- 手順全体を通して、鼻カニューレを介して 3 L/min で酸素を供給し、ERCP 中のバイタル サインを綿密に監視します。次に、酸阻害薬(エソメプラゾール40 mg BID)、酵素阻害薬(オクトレオチド0.6 mg Q12H)、非経口栄養薬(脂肪エマルジョン、アミノ酸(17)およびグルコース(1%)注射1920 mL QD)、痛み抑制薬(フルルビプロフェン100mg QD)、および感染抑制薬(セフォペラゾンナトリウムおよびスルバクタムナトリウム注射用1.5 g Q8H)。.手術後にアミラーゼ試験を実施します。
- 操作を完了します。アミラーゼレベルが正常に低下するまで絶食するように患者に指示します。.腹痛、下血などについて患者を注意深く観察します。
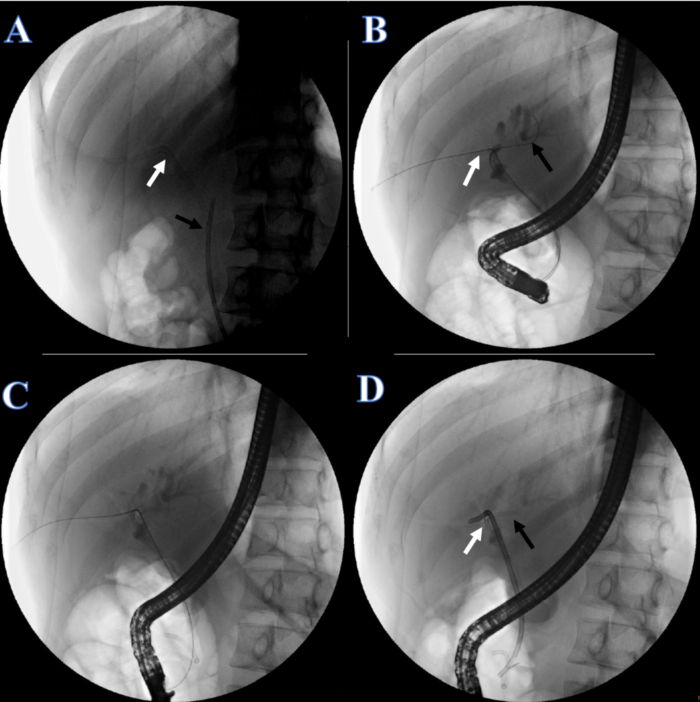
図5:ERCPによって再構築された胆道の連続 性 (A)白い矢印はPTCDチューブを示しています。黒い矢印はプラスチック製のステントを示しています。(B)白い矢印は、右肝管を通る二重ガイドワイヤーを示しています。黒矢印は左肝管を通るガイドワイヤーを示しています。(C)左肝管用のプラスチック製ステント。(D)白い矢印は右肝管のプラスチックステントを示しています。黒い矢印は、左肝管のプラスチック製ステントを示しています。 この図の拡大版を表示するには、ここをクリックしてください。
結果
ERCP、経口単管管鏡検査、およびPTCSを組み合わせて、肝移植後の複雑な胆汁漏出を治療するための新しい方法について説明します。胆道の連続性を再構築するために、複数の内視鏡を組み合わせて、左肝管に7F x 7 cmのダブルピグテール胆管を留置し(図5C)、右肝管に8.5 F x 12 cmの胆管プラスチックステントを留置しました(<...
ディスカッション
本研究では、肝移植後の複雑な胆汁漏出の治療に、ERCP、経口単オペレーター胆管鏡検査、PTCSを組み合わせる新しい方法を発見しました。この方法の主なステップは、まず、経口単オペレーター胆管鏡検査の下で、胆汁漏出の末端を特定し、プラスチックステントを留置しました。次に、B-超音波の指導の下で、一般的な肝管狭窄が観察され、拡張され、プラスチッ?...
開示事項
著者は、利益相反を宣言しません。
謝辞
この研究は、中国国家自然科学基金会(81873591)からの助成金によって支援されました。広東自然科学基金会(2022A1515011052);広東省科学技術計画プロジェクト(2018A050506030);広州科学技術プログラム(201704020073);臓器提供と移植免疫学に関する広東省の主要研究所建設予測(2013A061401007および2017B030314018);広東省科学技術国際協力基地(臓器移植)(2015B050501002)。
資料
| Name | Company | Catalog Number | Comments |
| Biliary stent | Boston Scientific | M00533560 | 7 F*7 cm |
| Branch choledochoscope | Leinzett | LAN-EP-2612 | |
| Disposable electric snare | Boston Scientific | M00562320 | |
| Disposable sphincterotomy knife | Boston Scientific | M00545170 | |
| Electronic choledochoscope | Olympus | / | |
| Electronic duodenum mirror | Olympus | / | |
| Guidewire | Boston Scientific | M00556140 | |
| Guidewire guided the dilated balloon catheter | Boston Scientific | M00558600 | |
| Integrated biliary stent | Boston Scientific | M00539210 | 7 F*7 cm |
| Integrated biliary stent | Boston Scientific | M00539280 | 8.5 F*12 cm |
参考文献
- Duffy, J. P., et al. Long-term patient outcome and quality of life after liver transplantation: Analysis of 20-year survivors. Ann Surg. 252 (4), 652-661 (2010).
- Riediger, C., et al. T-tube or no t-tube in the reconstruction of the biliary tract during orthotopic liver transplantation: Systematic review and meta-analysis. Liver Transpl. 16 (6), 705-717 (2010).
- Wojcicki, M., Milkiewicz, P., Silva, M. Biliary tract complications after liver transplantation: A review. Dig Surg. 25 (4), 245-257 (2008).
- Thuluvath, P. J., Pfau, P. R., Kimmey, M. B., Ginsberg, G. G. Biliary complications after liver transplantation: The role of endoscopy. Endoscopy. 37 (9), 857-863 (2005).
- Macías-Gómez, C., Dumonceau, J. M. Endoscopic management of biliary complications after liver transplantation: An evidence-based review. World J Gastrointest Endosc. 7 (6), 606-616 (2015).
- Nakajima, M., Akasaka, Y., Fukumoto, K., Mitsuyoshi, Y., Kawai, K. Peroral cholangiopancreatosocopy (pcps) under duodenoscopic guidance. Am J Gastroenterol. 66 (3), 241-247 (1976).
- Chen, Y. K., et al. Single-operator cholangioscopy in patients requiring evaluation of bile duct disease or therapy of biliary stones (with videos). Gastrointest Endosc. 74 (4), 805-814 (2011).
- Kulpatcharapong, S., Pittayanon, R. S. J. K., Rerknimitr, R. Diagnostic performance of different cholangioscopes in patients with biliary strictures: A systematic review. Endoscopy. 52 (3), 174-185 (2020).
- Rainer, F., et al. A novel way to avoid reoperation for biliary strictures after liver transplantation: Cholangioscopy-assisted guidewire placement. Endoscopy. 51 (11), E314-E316 (2019).
- Bokemeyer, A., et al. Digital single-operator cholangioscopy: A useful tool for selective guidewire placements across complex biliary strictures. Surg Endosc. 33 (3), 731-737 (2019).
- Woo, Y. S., et al. Spyglass cholangioscopy-assisted guidewire placement for post-ldlt biliary strictures: A case series. Surg Endosc. 30 (9), 3897-3903 (2016).
- Martins, F. P., Seleti, S. M. R., Contini, M. L., Ga, D. E. P., Ferrari, A. P. Is there a place for cholangioscopic evaluation of biliary anastomotic stricture after deceased donor liver transplant. Arq Gastroenterol. 57 (4), 347-353 (2020).
- Magro, B., Tacelli, M., Mazzola, A., Conti, F., Celsa, C. Biliary complications after liver transplantation: Current perspectives and future strategies. Hepatobiliary Surg Nutr. 10 (1), 76-92 (2021).
- Arain, M. A., Attam, R., Freeman, M. L. Advances in endoscopic management of biliary tract complications after liver transplantation. Liver Transpl. 19 (5), 482-498 (2013).
- Tsujino, T., et al. Endoscopic management of biliary complications after adult living donor liver transplantation. Am J Gastroenterol. 101 (10), 2230-2236 (2006).
- López Álvarez, M., Otero, M., Vázquez Millán, M. A., Suárez López, F., Alonso Aguirre, P. Endoscopic treatment of biliary complications after liver transplantation. Rev Esp Enferm Dig. 112 (8), 605-608 (2020).
- Alves, A. R., Gomes, D., Furtado, E., Tomé, L. Efficacy of endoscopic retrograde cholangiopancreatography in the treatment of biliary complications following liver transplant: 10 years of a single-centre experience. GE Port J Gastroenterol. 25 (1), 10-17 (2018).
- Yasen, A., et al. Efficiency of percutaneous transhepatic cholangioscopy in the treatment of biliary complications after liver transplantation. HPB (Oxford). 25 (4), 463-471 (2023).
- Zimmerman, M. A., et al. resolution of biliary complications after living and deceased donor liver transplantation: A report from the adult-to-adult living donor liver transplantation cohort study consortium. Liver Transpl. 19 (3), 259-267 (2013).
- Moy, B. T., Birk, J. W. A review on the management of biliary complications after orthotopic liver transplantation. J Clin Transl Hepatol. 7 (1), 61-71 (2019).
- Wadhawan, M., Kumar, A. Management issues in post living donor liver transplant biliary strictures. World J Hepatol. 8 (10), 461-470 (2016).
- Enochsson, L., et al. Nationwide, population-based data from 11,074 ercp procedures from the swedish registry for gallstone surgery and ercp. Gastrointest Endosc. 72 (6), 1175-1184 (2010).
- Khan, M. A., et al. Endoscopic ultrasound-guided biliary drainage: A systematic review and meta-analysis. Dig Dis Sci. 61 (3), 684-703 (2016).
- Dhir, V., et al. Endoscopic ultrasonography-guided biliary and pancreatic duct interventions. Dig Endosc. 29 (4), 472-485 (2017).
- Derdeyn, J., Laleman, W. Current role of endoscopic cholangioscopy. Curr Opin Gastroenterol. 34 (5), 301-308 (2018).
- Iwashita, T., Doi, S., Yasuda, I. Endoscopic ultrasound-guided biliary drainage: A review. Clin J Gastroenterol. 7 (2), 94-102 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved