A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الزراعة المشتركة للموائع الدقيقة لصحة الكلى والظهارة الورمية لنمذجة تطور سرطان الكلى
In This Article
Summary
هنا ، نقدم بروتوكولات توضح بالتفصيل تعليمات لتنفيذ مزارع الخلايا ثلاثية الأبعاد باستخدام مصفوفات الكولاجين والكولاجين الاغاروز في نظام الفيزيولوجيا الدقيقة. تدعم هذه البروتوكولات الزراعة المشتركة للنبيبات الكلوية القريبة وسرطان الخلايا الكلوية ، مما يحاكي الظروف في الجسم الحي ويتيح التحقيق المتقدم لتفاعلات خلايا سرطان الكلى.
Abstract
مكنت أنظمة الفيزيولوجيا الدقيقة (MPS) من إدخال عناصر فسيولوجية أكثر تعقيدا وذات صلة في النماذج المختبرية ، مما يعيد إنشاء السمات المورفولوجية المعقدة في بيئات ثلاثية الأبعاد مع تفاعلات ديناميكية تفتقر إلى النماذج التقليدية. قمنا بتنفيذ نموذج الزراعة المشتركة لسرطان الخلايا الكلوية (RCC) لإعادة إنشاء الحديث المتبادل بين الأنسجة الكلوية السليمة والخبيثة.
يعتمد هذا النموذج على المنصة متعددة الأعضاء المشار إليها ويتكون من الزراعة المشتركة للنبيبات الكلوية القريبة المعاد بناؤها مع كرويات RCC. تم استخدام الغرف المطبوعة ثلاثية الأبعاد المصممة خصيصا لزراعة خلايا النبيبات الظهارية القريبة الكلوية البشرية (RPTEC) وتسهيل تجميعها الذاتي في نبيبات كلوية موجودة في مصفوفة الكولاجين من النوع الأول. تم تضمين خلايا Caki-1 RCC في مصفوفة كولاجين أجار ، مما أدى لاحقا إلى تشكيل كرويات سرطانية. تم تحسين كل من جل الكولاجين وآجار / الكولاجين للحفاظ على سلامتهما أثناء التروية الدورية وتحمل إجهاد القص خلال فترة زراعة لا تقل عن 7 أيام.
تتيح المواد الهلامية أيضا إمدادات كافية من المغذيات وإفرازات الخلايا. علاوة على ذلك ، فإن المواد الهلامية الأجار / الكولاجين تحد من التكاثر المفرط لخلايا RCC ، مما يضمن حجم كروي متجانس نسبيا. تتكون دوائر الموائع الدقيقة لشريحة MPS من غرفتي استزراع مستقلتين بحجم بئر قياسي مكون من 96 صفيحة دقيقة. تملأ النبيبات الكلوية والمواد الهلامية RCC غرفا منفصلة وتشترك في نفس وسائط الاستزراع ، والتي يتم إعادة تدويرها مرتين في الدقيقة تقريبا. في ظل هذه الظروف ، لاحظنا تنظيم التعبير عن العامل المناعي وإفرازه في الأنابيب الكلوية (إنترلوكين -8 وعامل نخر الورم ألفا). تقوم الأنابيب الكلوية أيضا بتحويل نشاطها الأيضي نحو تحلل السكر تحت تأثير RCC. يوضح هذا النهج الجديد أن MPS القائم على الزراعة المشتركة يمكن أن يضخم تعقيد سرطان الخلايا الكلوية في المختبر ويمكن استخدامه لدراسة تأثير السرطان على الخلايا غير السرطانية.
Introduction
أحدثت التطورات في أنظمة زراعة الخلايا ثلاثية الأبعاد ثورة في هندسة الأنسجة والطب التجديدي من خلال تقديم نماذج أكثر صلة من الناحية الفسيولوجية مقارنة بالثقافات التقليدية ثنائية الأبعاد1،2. في هذه الدراسة ، استخدمنا مصفوفات جل الكولاجين والكولاجين والأغاروز ، نظرا لقدرتها على تقليد بيئة المصفوفة خارج الخلية (ECM) ، وتعزيز السلوك الخلوي والوظيفة الأكثر دقة ، مع التوافق مع ظروف الثقافة الديناميكية المستخدمة.
يلعب الكولاجين ، البروتين الأكثر وفرة في ECM ، دورا مهما في الحفاظ على السلامة الهيكلية والنشاط البيولوجي للأنسجة3. تم تفضيل الكولاجين من النوع الأول ، الذي يتم الحصول عليه عادة من ذيل الفئران ، لتوافقه الحيوي وقدرته على التصويب لتلبية ظروف صلابة المصفوفة المختلفة ، بالإضافة إلى توفير ركيزة مثبتة للخلايا الظهارية4. في مصفوفة الكولاجين ثلاثية الأبعاد ، يتم تزويد الخلايا الكلوية بسقالة تدعم التصاقها وانتشارها وتمايزها. تمكن هذه البيئة الخلايا من إظهار المزيد من الأشكال والسلوكيات الطبيعية ، بما في ذلك أنماط التعبير الجيني والتفاعلات الخلوية التي تعكس في ظروف الجسم الحي 5. وبالتالي ، تم استخدام جل الكولاجين على نطاق واسع في تطبيقات تتراوح من أبحاث السرطان إلى هندسة الأنسجة نظرا لقدرتها على تكرار الأدوار الداعمة والتنظيمية ل ECM.
تم استخدام خط الخلايا الظهارية الأنبوبي الكلوي القريب الخالد RPTEC / TERT1 لتمثيل ظهارة الكلى الصحية. يفرط خط الخلية هذا في التعبير عن النسخ العكسي للتيلوميراز البشري ، مما يمكنه من التكاثر في الثقافة ، مع الحفاظ على نمط ظاهري تمثيلي ل RPTEC. تم استخدام مصفوفة جل الكولاجين من النوع الأول من ذيل الفئران لإعادة إنشاء البيئة المكروية الكلوية. تدعم مصفوفة جل الكولاجين هذه خلايا RPTEC / TERT16 في الحفاظ على خصائصها الأصلية ووظائفها الفسيولوجية. في المقابل ، يتم استخدام مصفوفة هلام الكولاجين والأغاروز الهجينة لزراعة خلايا سرطان الخلايا الكلوية (Caki-1). يضيف Agarose ، وهو عديد السكاريد المشتق من الأعشاب البحرية ، بعدا آخر لأنظمة زراعة الخلايا ثلاثية الأبعاد. إنه قابل للانعكاس حراريا ، مما يسمح بسهولة المناولة والتلاعب أثناء عمليةالتحضير 7. توفر المواد الهلامية Agarose مصفوفة داعمة محايدة تحافظ على بقاء الخلايا وتعزز تكوين الهياكل المعقدة عن طريق تكاثر الخلايا السرطانية. عند دمجه مع الكولاجين ، يستفيد الجل الهجين الناتج من الإشارات الكيميائية الحيوية من الكولاجين والدعم الهيكلي من الاغاروز. يخلق هذا المزيج بيئة مكروية مناسبة لخلايا Caki-1 لسرطان الخلايا الكلوية (RCC)8 للنمو إلى كرويات ويستخدم كنموذج لسرطان الكلى.
يؤكد استخدام هذه المصفوفات ثلاثية الأبعاد المختلفة لخلايا RPTEC / TERT1 و Caki-1 على أهمية تكييف بيئة ECM للاحتياجات المحددة لأنواع الخلايا المختلفة. تم دمج المواد الهلامية التي تتكون من RPTEC ، التي تمثل ظهارة كلوية صحية ، أو خلايا Caki-1 ، التي تمثل RCC ، في نظام ميكروفلويديك يعيد تدوير وسائط الثقافة بين الخلايا ، مما يعرض بشكل فعال نموذج الخلايا الكلوية السليمة لإفرازات RCC ، دون اتصال مباشر. تتكون منصة TissUse HUMUMIC9،10 (يشار إليها من الآن فصاعدا باسم منصة الرقائق متعددة الأعضاء) المستخدمة في هذه الدراسة من شريحة فيزيولوجيا دقيقة مع دائرتين سائلتين مستقلتين ، مع تدفق مدفوع بوحدة نضح خارجية.
Access restricted. Please log in or start a trial to view this content.
Protocol
ملاحظة: تحدد هذه البروتوكولات الخطوات الشاملة لإعداد المواد الهلامية ثلاثية الأبعاد للكولاجين والأغاروز ، وحقن الخلايا ، ونقل العينات ، واستخراجها لمزيد من التحليل. ضبط أوقات وظروف الحضانة بناء على المتطلبات التجريبية المحددة.
1. تحضير مصفوفة جل الكولاجين والأغاروز
- الطباعة ثلاثية الأبعاد
ملاحظة: لإنشاء الشكل المناسب لمصفوفة الهلام ، قمنا بتطوير تصميم غرفة فريد من نوعه يشكل الجل في شكل عضوي ذي صلة من الناحية الفسيولوجية (انظر الملف التكميلي 1).- تصميم الغرف باستخدام برنامج التصميم بمساعدة الكمبيوتر. تتكون الغرفة من أربع مقصورات متوازية: مقصورتان للخلايا ، وحجرة مصفوفة واحدة ، وقناة توصيل (الشكل 1 والشكل 2).
- بناء الغرف عن طريق الطباعة ثلاثية الأبعاد. تذوب فوهة التسخين خيوطا بلاستيكية حيوية وتودع طبقة تلو الأخرى. لاتباع هذا البروتوكول ، استخدم مادة البولي بروبيلين (PP) ، وهي خيوط بلاستيكية حيوية غير سامة ، وطابعة ثلاثية الأبعاد من النوع الديكارتي ، سميت على اسم نظام إحداثيات XYZ.
- أضف ميزة شكل مخروطي عكسي إلى مقصورات الخلية لتوجيه الخلايا إلى القناة.
- أعط شكلا دائريا لحجرة المصفوفة ، وهو أمر بالغ الأهمية لتشكيل هلام الكولاجين.
- قم بتوصيل حجرات الخلية والمصفوفة بقناة (قطرها 0.04 مم ، الشكل 3 ب) ، مما يسمح للخلايا بالتدفق من حجرة الخلية إلى حجرة المصفوفة وتثبيتها على سطح الأنبوب.
- تحضير مصفوفة الكولاجين لزراعة خلايا RPTEC-TERT1
ملاحظة: يضمن هذا الإجراء تحضير مصفوفة الكولاجين بشكل صحيح وتحميلها في الغرفة ، مما يخلق بيئة مناسبة للحقن اللاحق وزراعة خلايا RPTEC / TERT1 ونمو بنية الخلية ثلاثية الأبعاد. تأكد من تنفيذ جميع الخطوات في ظل ظروف معقمة لتجنب التلوث.- قم بإعداد محلول التشابك عن طريق خلط 50 ميكرولتر من جينيبين (30 ملم) مع 50 ميكرولتر من هيدروكسيد الصوديوم (1 م) باستخدام دوامة لضمان الخلط الشامل.
- أضف 1,000 ميكرولتر من الكولاجين من النوع الأول إلى محلول Genipin و NaOH المحضر مع الحفاظ على الخليط على الثلج لمنع التبلور المبكر. امزج المحلول مرة أخرى باستخدام دوامة للحصول على خليط متجانس.
ملاحظة: احتفظ بالمحلول المختلط على الثلج باستمرار لمنع التبلور المبكر. - باستخدام طرف ماصة سعة 1,000 ميكرولتر، اجمع المحلول المحضر بالكامل وأضف 150-200 ميكرولتر من المحلول إلى حجرة المصفوفة في الغرفة المطبوعة ثلاثية الأبعاد.
- دع المصفوفة تتبلمر عن طريق الاحتفاظ بالغرفة في حاضنة ثاني أكسيد الكربون2 عند 37 درجة مئوية لمدة 60-90 دقيقة. أضف 150 ميكرولتر من وسط الاستزراع في الجزء العلوي من المصفوفة واتركه طوال الليل في الحاضنة.
- تحضير مصفوفة الكولاجين والأغاروز وتضمين خلايا Caki-1
ملاحظة: تم استزراع كل من خلايا RPTEC / TERT1 و Caki-1 باستخدام نفس وسط الاستزراع ، الذي يتكون من وسائط الجلوكوز العالية DMEM F-12 المكملة ب ITS (10 ميكروغرام / مل من الأنسولين ، 5.5 ميكروغرام / مل من الترانسفيرين ، و 5 نانوغرام / مل من سيلينيت الصوديوم) ، 10 نانوغرام / مل من عامل نمو البشرة (EGF) ، 36 نانوغرام / مل من الهيدروكورتيزون ، 100 وحدة / مل من البنسلين ، 100 ميكروغرام / مل من الستربتومايسين (5٪ حجم / حجم) ، و 10٪ (حجم / حجم) مصل ربلة الساق الجنينية (FCS).- قم بإذابة مسحوق الاغاروز إما في ماء معقم أو DPBS لتحقيق تركيز نهائي بنسبة 2٪. ضع محلول الاغاروز على كتلة تسخين مضبوطة على 85 درجة مئوية لضمان الذوبان الكامل.
ملاحظة: تعامل مع محلول الاغاروز بعناية بسبب حساسيته لدرجة الحرارة.
- قم بإذابة مسحوق الاغاروز إما في ماء معقم أو DPBS لتحقيق تركيز نهائي بنسبة 2٪. ضع محلول الاغاروز على كتلة تسخين مضبوطة على 85 درجة مئوية لضمان الذوبان الكامل.
- تضمين خلايا Caki-1
- افصل خلايا Caki-1 عن قوارير المزرعة الخاصة بها عن طريق إضافة 1x trypsin-EDTA واحتضانها عند 37 درجة مئوية حتى تنفصل الخلايا. قم بتحييد التربسين 1x عن طريق إضافة حجم متساو من وسط الاستزراع.
- اجمع معلق الخلية وعد الخلايا وأجهزة الطرد المركزي عند 2,500 × جم لمدة 5 دقائق. تخلص من المادة الطافية وأعد تعليق كريات الخلية في وسط مزرعة طازجة إلى تركيز نهائي يبلغ 1 × 103 خلايا / مل (كاكي -1).
ملاحظة: تأكد من خلط تعليق الخلية تماما وخاليه من التكتلات قبل تحميله في الغرفة. - أضف 25 ميكرولتر من تعليق الخلية في أنبوب طرد مركزي دقيق سعة 1.5 مل.
ملاحظة: تأكد من تعقيم المحقنة أو الماصة ومناسبة للتعامل مع الخلايا. - أضف 75 ميكرولتر من الكولاجين من النوع الأول في الأنبوب مع تعليق الخلية والدوامة.
ملاحظة: احتفظي بالخليط على الثلج باستمرار لمنع الهلام المبكر. - أضف 100 ميكرولتر من جل الاغاروز المذاب 2٪ واخلطه بعناية على الدوامة حتى يصبح الجل متجانسا.
ملاحظة: تأكد من التوزيع المتساوي للخلايا داخل الجل. تجنب إدخال فقاعات الهواء أثناء الحقن ، لأنها يمكن أن تعطل توزيع الخلايا وسلامة الجل! - بعد 1 ساعة ، أضف 150 ميكرولتر من الوسائط الخلوية في الجزء العلوي من المصفوفة وقم بإزالتها من الغرفة باستخدام ملعقة. ضع المصفوفات ثلاثية الأبعاد مع الخلايا في صفيحة 24 بئرا مع 1,000 ميكرولتر من وسط الثقافة واحتضانها عند 37 درجة مئوية ، 5٪ ثاني أكسيدالكربون 2.
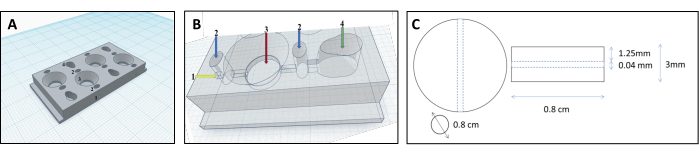
الشكل 1: تصميم غرفة مطبوعة ثلاثية الأبعاد لإعادة بناء الأنابيب الكلوية. (أ ، ب) تمثيل الغرفة المطبوعة ثلاثية الأبعاد المصممة لاستيعاب مصفوفة الكولاجين المتشابكة لإعادة بناء الأنابيب الكلوية. تتكون كل غرفة من أربع حجرات فردية تستخدم لإنتاج كمية متساوية من المواد الهلامية. 1-نقطة إدخال للفتيل ، 2-غرف مسبقة ليتم ملؤها بالأجار فقط لمنع التسرب ، 3-غرفة الكولاجين ، غرفة 4 خلايا. (ج) أبعاد هلام الكولاجين المتشابك والنبيبات الكلوية المدمجة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تحضير الكولاجين والمواد الهلامية أجار الكولاجين. (أ) غرفة مطبوعة ثلاثية الأبعاد مع إدخال خيوط. (ب) يتم توزيع محلول الكولاجين المتشابك في آبار الغرفة (ج) يتم وضع الغرفة المملوءة بمحلول الكولاجين في الحاضنة لتسهيل بلمرة المصفوفة (د) مجموعة خلايا RPTEC-TERT1 قبل الحقن في مصفوفة الكولاجين (ه) إضافة تعليق الخلية في حجرة الخلية في الغرفة (F) إزالة الفتيل بمساعدة الملقط ، مما يمكن الخلايا من ملء البنية الأنبوبية المجوفة داخل المصفوفة (G) تعليق خلايا RCC الممزوجة بالكولاجين في أنبوب 1.5 مل (H) إضافة محلول أجار 2٪ للخلايا لتوليد هلام RCC. (I) يتم وضع المواد الهلامية في الحاضنة لتسهيل هلام المصفوفة (J ، K ، L) إزالة هلام الكولاجين المبلمر مع الأنابيب الكلوية من الغرفة المطبوعة ثلاثية الأبعاد بمساعدة ملعقة ، ووضعها في صفيحة 24 بئرا قبل المعالجة الإضافية (M ، N ، O) إزالة هلام الكولاجين أجار المبلمر بخلايا RCC بمساعدة ملعقة ، ووضعها في صفيحة 24 بئرا قبل مزيد من المعالجة الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 3: تجميع نظام زراعة الموائع الدقيقة. (أ ، ب) فتح مقصورات الثقافة للرقاقة الرطبة 2 باستخدام أداة مخصصة (ج) بعد إزالة وسائط الاستزراع المستخدمة لغسل الرقاقة ، أضف 400 ميكرولتر من وسائط الاستزراع الطازجة. (د ، ه) بعد إزالة المواد الهلامية الكلوية و RCC من ألواح البئر ال 24 ذات الصلة ، ضع كل هلام في حجرة الثقافة لدائرة نضح واحدة لشريحة Humimic باستخدام ملاعق للتعامل مع المواد الهلامية. (إف ، ز) بعد وضع المواد الهلامية في الرقاقة ، يتم إغلاق غرف الاستزراع ، ويتم ربط الرقاقة بوحدة التروية من خلال ثلاث مضخات دقيقة في كل دائرة موائع دقيقة ، متصلة بأنابيب متخصصة. (ح) توضع الرقائق في الحاضنة طوال فترة الاستزراع (I) معلمات التروية المحددة في وحدة التحكم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. حقن خلايا RPTEC / TERT1
- حقن خلايا RPTEC / TERT1
- افصل خلايا RPTEC / TERT1 عن قوارير المزرعة الخاصة بها عن طريق إضافة 1x trypsin-EDTA واحتضانها عند 37 درجة مئوية حتى تنفصل الخلايا.
- قم بتحييد التربسين 1x عن طريق إضافة حجم متساو من وسط الثقافة مع المكملات الغذائية. اجمع تعليق الخلية وجهاز الطرد المركزي عند 2,500 × جم لمدة 5 دقائق.
- تخلص من المادة الطافية وأعد تعليق كريات الخلية في وسط مزرعة طازجة إلى تركيز نهائي يبلغ 1 × 106 خلايا / مل (RPTEC / TERT1). تأكد من خلط تعليق الخلية جيدا وخالي من التكتلات قبل تحميله في الغرفة.
- قم بتحميل 10 ميكرولتر من معلق الخلية المحضر في ماصة دقيقة بطرف 10 ميكرولتر. تأكد من تعقيم الماصة ومناسبة لمعالجة الخلايا. قم بحقن معلق الخلية بعناية في الكولاجين المتصلب (الخطوة 1.2.4) من خلال حجرة الخلية داخل الغرفة.
- قم بإزالة الفتيل برفق باستخدام الملقط ، مما يسمح للخلايا بملء الهيكل الأنبوبي المجوف داخل المصفوفة
ملاحظة: تأكد من التوزيع المتساوي للخلايا داخل الجل. تجنب إدخال فقاعات الهواء أثناء الحقن ، لأنها يمكن أن تعطل توزيع الخلايا وسلامة الجل. - ضع الغرف في حاضنة 37 درجة مئوية ، 5٪ ثاني أكسيد الكربون2 . بعد 60 دقيقة ، أضف 150 ميكرولتر من وسائط الخلية في الجزء العلوي من المصفوفة لتجنب الجفاف. احتضن لمدة 24 ساعة للسماح للخلايا بالتأقلم والاندماج في مصفوفة الجل.
- في اليوم التالي ، قم بإزالة المصفوفة من الغرفة باستخدام ملعقة. ضع المصفوفات ثلاثية الأبعاد مع الخلايا في صفيحة 24 بئرا مع 1,000 ميكرولتر من وسط الاستزراع واحتضانها عند 37 درجة مئوية مع 5٪ ثاني أكسيدالكربون 2.
ملاحظة: ستتم إضافة المواد الهلامية المحضرة إما بالنبيبات الكلوية المعاد بناؤها وكرويات RCC المدمجة إلى نظام السوائل الدقيقة للزراعة المشتركة
3. نضح عينات الخلايا ثلاثية الأبعاد
- نضح الخلايا ثلاثية الأبعاد في نظام رقاقة متعددة الأعضاء
- قم بتوصيل الشريحة بخلية 3D بنظام التروية باستخدام الأنابيب.
- اضبط النظام: التردد: 0.25 هرتز ، الفراغ: -220 ملي بار ، الضغط: 800 ملي بار ، وقم بتوصيل الشريحة 2 بالنظام (الشكل 3).
- زراعة زراعة الخلايا ثلاثية الأبعاد الديناميكية لمدة 5 أيام في حاضنة عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2.
عينات الخلايا 4. 3D بعد جمع التروية
- جمع وتحليل ما بعد التروية
- قم بإزالة المواد الهلامية من نظام التروية واشطفها باستخدام PBS.
- قم بإصلاح المواد الهلامية عن طريق وضع العينات في 2٪ بارافورمالدهيد لمدة 2-3 ساعات في درجة حرارة الغرفة. قم بتخزين العينات الثابتة عند 4 درجات مئوية.
- تلطيخ المواد الهلامية بالأصباغ (على سبيل المثال ، Hoechst33342 ، phalloidin ، ZO1 ، tubulin).
- بعد 5 أيام من التروية باستخدام نظام الرقائق متعدد الأعضاء ، تم إجراء فحوصات وطرق مختلفة على مزارع الخلايا ثلاثية الأبعاد والوسائط التي تم جمعها لتقييم قابلية الخلية للحياة ، والتشكل ، ومستويات التعبير الجيني ، والتعديلات الوظيفية. تحافظ خلايا RPTEC / TERT1 في مصفوفة هلام الكولاجين وخلايا Caki-1 في مصفوفة الكولاجين - الاغاروز على قابلية عالية للبقاء. تأكد من ذلك باستخدام فحوصات الجدوى مثل تلطيخ الحي / الميت.
Access restricted. Please log in or start a trial to view this content.
النتائج
يوفر نظام HUMIMIC بيئة ديناميكية تتيح إمدادات المغذيات والأكسجين بشكل مستمر مع إزالة النفايات الأيضية ، وبالتالي الحفاظ على بقاء الخلية وعملها على مدى فترات طويلة. هذه الأنظمة مفيدة بشكل خاص لإنشاء نماذج معقدة للأعضاء على رقاقة تكرر البيئة المكروية لأنسجة معينة. إنه مصمم ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
يمثل البروتوكول الموصوف في هذه الدراسة تطوير نموذج معقد لسرطان الكلى ، يستفيد من تكامل نوعين متميزين من الخلايا - الخلايا الظهارية الأنبوبية القريبة الكلى (RPTEC / TERT1) وخلايا سرطان الخلايا الكلوية (Caki-1) - داخل مصفوفات هلام الكولاجين والكولاجين والأغاروز المحددة في نظام الم...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
تم دعم مارينا سوموفا من قبل منحة الدكتوراه بجامعة غرايفسفالد - Landesgraduiertenförderungsgesetzes (قانون تمويل الخريجين الحكوميين) في مكلنبورغ-فوربومرن. يود المؤلفون أن يشكروا الدكتور جانوش شون وديرك ستوب من مركز جراحة العظام وجراحة الرضوح وطب إعادة التأهيل ، الطب الجامعي Greifswald على رؤيتهم في زراعة الخلايا ثلاثية الأبعاد وإعداد العينات.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5-2.0 mL tubes | Eppendorf | 003012/10237-20205 | |
| 24-well plates | Sarstedt | 83.3922.500 | |
| 3D printer | Prusa | ||
| Agarose | Carl Roth | 3810.3 | |
| AutoDesk Tinker CAD software | computer-assisted design software | ||
| Caki-1 cells | ATCC | HTB-46 | |
| Caspase activity | Promega | G8090 | Caspase 3/7 assay |
| Cell viability | Promega | G7570 | Cell Titer Glo assay |
| Collagen Type I – rat tail, 3.0 mg/mL | Corning | 354236 | |
| DMEM/12F Medium | PAN Biotech | PO4-41650 | |
| DPBS solution | PAN Biotech | P04-53500 | |
| Epidermal Growth Factor | Merck | E4127 | |
| Fetal Calf Serum | PAN Biotech | P30-3033 | |
| Genipin (30 mM) | Merck | G4796 | |
| HUMIMIC chips 2 | TissUse | multi-organ chips | |
| HUMIMIC control unit | TissUse | multi-organ chip control unit | |
| Hydrocortisone | Merck | H6909 | |
| Incubator (37 °C, 5% CO2) | nd | ||
| Insulin,Sodium selenite,Transferrin (IST) | Merck | I1884 | |
| LDH release | Promega | J2380 | |
| Metal spatula | nd | ||
| NaOH (1 M) | Carl Roth | P031.2 | |
| Petri dishes | Sarstedt | 82.1135.500 | |
| Polypropylene (PP) filament | Verbatin | 55952 | |
| RNA-easy extraction kit | Qiagen | 74104 | |
| RPTEC/TERT cells | ATCC | CRL - 4031 | |
| TNF-alfa ELISA | R&D Systems | DY210-05 | |
| Triiodothyronine (T3 ) | Merck | 709611 | |
| Trypsin-EDTA | PAN Biotech | P10-021100 |
References
- Ainslie, G. R., et al. Microphysiological lung models to evaluate the safety of new pharmaceutical modalities: A biopharmaceutical perspective. Lab Chip. 19 (19), 3152-3161 (2019).
- Van Ness, K. P., et al. Microphysiological systems to assess nonclinical toxicity. Curr Protoc Toxicol. 73, 14.18.1-14.18.28 (2017).
- Majo, S., et al. Impact of extracellular matrix components to renal cell carcinoma behavior. Front Oncol. 10, 625(2020).
- Caetano-Pinto, P., et al. Epidermal growth factor receptor mediates the basolateral uptake of phosphorothioate-modified antisense oligonucleotides in the kidney. Organs-on-a-Chip. 4, 100022(2022).
- Manduca, N., et al. 3D cancer models: One step closer to in vitro human studies. Front Immunol. 14, 1175503(2023).
- Simon, B. R., et al. The RPTEC/TERT1 cell line models key renal cell responses to the environmental toxicants, benzo[a]pyrene and cadmium. Toxicol Rep. 1, 231-242 (2014).
- Ogura, T., et al. Methods of high integrity RNA extraction from cell/agarose construct. BMC Res Notes. 8, 644(2015).
- Glube, N., et al. Caki-1 cells represent an in vitro model system for studying the human proximal tubule epithelium. Nephron Exp Nephrol. 107 (2), e47-e56 (2007).
- Kühnl, J., et al. Characterization of application scenario-dependent pharmacokinetics and pharmacodynamic properties of permethrin and hyperforin in a dynamic skin and liver multi-organ-chip model. Toxicology. 448, 152637(2021).
- Padmyastuti, A., et al. Microfluidic-based prostate cancer model for investigating the secretion of prostate-specific antigen and microRNAs in vitro. Sci Rep. 13 (1), 11623(2023).
- Zhang, X., et al. Cancer-on-a-Chip: Models for studying metastasis. Cancers (Basel). 14 (3), 648(2022).
- Sobczuk, P., et al. Choosing the right animal model for renal cancer research. Transl Oncol. 13 (3), 100745(2020).
- Ewart, L., et al. Performance assessment and economic analysis of a human Liver-Chip for predictive toxicology. Commun Med. 2 (1), 154(2022).
- Caetano-Pinto, P., et al. Kidney cancer and chronic kidney disease: Too close for comfort. Biomedicines. 9 (12), 1761(2021).
- Del Piccolo, N., et al. Tumor-on-chip modeling of organ-specific cancer and metastasis. Adv Drug Deliv Rev. 175, 113798(2021).
- Soo, J. Y. C., et al. Advances in predictive in vitro models of drug-induced nephrotoxicity. Nat Rev Nephrol. 14 (6), 378-393 (2018).
- Chapron, A., et al. An improved vascularized, dual-channel microphysiological system facilitates modeling of proximal tubular solute secretion. ACS Pharmacol Transl Sci. 3 (3), 496-508 (2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved