Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Co-culture microfluidique d’épithélium rénal sain et tumoral pour modéliser la progression du cancer du rein
Dans cet article
Résumé
Ici, nous présentons des protocoles qui détaillent les instructions pour la mise en œuvre de cultures cellulaires 3D utilisant des matrices de collagène et de collagène-agarose dans un système microphysiologique. Ces protocoles prennent en charge la co-culture de sphéroïdes de tubule proximal rénal et de carcinome rénal, simulant des conditions in vivo et permettant une investigation avancée des interactions entre les cellules cancéreuses du rein.
Résumé
Les systèmes microphysiologiques (MPS) ont permis l’introduction d’éléments physiologiques plus complexes et pertinents dans des modèles in vitro , recréant des caractéristiques morphologiques complexes dans des environnements tridimensionnels avec des interactions dynamiques manquantes dans les modèles conventionnels. Nous avons mis en œuvre un modèle de co-culture de carcinome à cellules rénales (RCC) pour recréer l’interaction entre le tissu rénal sain et malin.
Ce modèle est basé sur la plateforme multi-organes référencée et consiste en la co-culture d’un tubule proximal rénal reconstruit avec des sphéroïdes du RCC. Des chambres imprimées en 3D sur mesure ont été utilisées pour cultiver des cellules de tubule proximal épithélial rénal humain (RPTEC) et faciliter leur auto-assemblage en un tubule rénal contenu dans une matrice de collagène de type I. Les cellules RCC Caki-1 ont été intégrées dans une matrice de collagène gélosée, formant par la suite des sphéroïdes cancéreux. Le collagène et l’agar/gels de collagène ont été optimisés pour maintenir leur intégrité pendant la perfusion cyclique et résister au stress de cisaillement pendant une période de culture minimale de 7 jours.
Les gels permettent également un apport adéquat en nutriments et des sécrétions cellulaires. De plus, les gels d’agar/collagène limitent la surprolifération des cellules du RCC, assurant une taille de sphéroïde relativement homogène. Les circuits microfluidiques de la puce MPS comprennent deux chambres de culture indépendantes de la taille d’un puits standard de 96 microplaques. Le tubule rénal et les gels RCC peuplent des chambres distinctes et partagent le même milieu de culture, qui est recirculé environ deux fois par minute. Dans ces conditions, nous avons observé une régulation positive de l’expression et de la sécrétion de facteurs immunitaires dans les tubules rénaux (interleukine-8 et facteur de nécrose tumorale-alpha). Les tubules rénaux déplacent également leur activité métabolique vers la glycolyse sous l’influence du RCC. Cette nouvelle approche démontre qu’une MPS basée sur la co-culture peut amplifier la complexité du RCC in vitro et être utilisée pour étudier l’impact du cancer sur les cellules non tumorales.
Introduction
Les progrès des systèmes de culture cellulaire 3D ont révolutionné l’ingénierie tissulaire et la médecine régénérative en offrant des modèles plus pertinents sur le plan physiologique par rapport aux cultures 2Dtraditionnelles1,2. Dans cette étude, nous avons utilisé des matrices de collagène et de gel de collagène-agarose, compte tenu de leur capacité à imiter l’environnement de la matrice extracellulaire (ECM), favorisant un comportement et une fonction cellulaires plus précis, tout en étant compatibles avec les conditions de culture dynamiques utilisées.
Le collagène, la protéine la plus abondante dans l’ECM, joue un rôle crucial dans le maintien de l’intégrité structurelle et de l’activité biologique des tissus3. Le collagène de type I, généralement obtenu à partir de la queue de rat, a été privilégié pour sa biocompatibilité et sa capacité à être adapté pour répondre à différentes conditions de rigidité matricielle, ainsi que pour fournir un substrat éprouvé pour les cellules épithéliales4. Dans la matrice de collagène 3D, les cellules rénales sont pourvues d’un échafaudage qui favorise leur adhésion, leur prolifération et leur différenciation. Cet environnement permet aux cellules de présenter des morphologies et des comportements plus naturels, y compris des modèles d’expression génique et des interactions cellulaires qui reflètent les conditions in vivo 5. Par conséquent, les gels de collagène ont été largement utilisés dans des applications allant de la recherche sur le cancer à l’ingénierie tissulaire en raison de leur capacité à reproduire les rôles de soutien et de régulation de l’ECM.
La lignée cellulaire épithéliale tubulaire proximale rénale immortalisée RPTEC/TERT1 a été utilisée pour représenter l’épithélium rénal sain. Cette lignée cellulaire surexprime la transcriptase inverse de la télomérase humaine, ce qui lui permet de proliférer en culture, tout en conservant un phénotype RPTEC représentatif. La matrice de gel de collagène de type I de queue de rat a été utilisée pour recréer le microenvironnement rénal. Cette matrice de gel de collagène aide les cellules RPTEC/TERT16 à maintenir leurs caractéristiques natives et leurs fonctions physiologiques. En revanche, une matrice hybride de gel de collagène et d’agarose est utilisée pour la culture de cellules de carcinome à cellules rénales (Caki-1). L’agarose, un polysaccharide dérivé des algues, ajoute une autre dimension aux systèmes de culture cellulaire 3D. Il est thermiquement réversible, ce qui permet une manipulation et une manipulation faciles pendant le processus de préparation7. Les gels d’agarose fournissent une matrice de soutien neutre qui maintient la viabilité cellulaire et favorise la formation de structures complexes en faisant proliférer les cellules cancéreuses. Lorsqu’il est combiné avec du collagène, le gel hybride qui en résulte exploite les signaux biochimiques du collagène et le soutien structurel de l’agarose. Cette combinaison crée un microenvironnement approprié pour le carcinome à cellules rénales (RCC) Caki-1 cellules8 pour la croissance en sphéroïdes et est utilisée comme modèle de cancer du rein.
L’utilisation de ces différentes matrices 3D pour les cellules RPTEC/TERT1 et Caki-1 souligne l’importance d’adapter l’environnement ECM aux besoins spécifiques des différents types de cellules. Les gels comprenant soit des cellules RPTEC, représentant l’épithélium rénal sain, soit des cellules Caki-1, représentant le RCC, ont été combinés dans un système microfluidique qui fait recirculer les milieux de culture entre les cellules, exposant efficacement le modèle de cellules rénales saines aux sécrétions du RCC, sans contact direct. La plateforme HUMUMIC 9,10 de TissUse (ci-après dénommée plateforme de puce multi-organes) utilisée dans cette étude se compose d’une puce de microphysiologie avec deux circuits fluidiques indépendants, dont l’écoulement est piloté par une unité de perfusion externe.
Access restricted. Please log in or start a trial to view this content.
Protocole
REMARQUE : Ces protocoles décrivent les étapes complètes de préparation des gels de collagène-agarose 3D, d’injection de cellules, de perfusion des échantillons et de leur extraction pour une analyse plus approfondie. Ajustez les temps et les conditions d’incubation en fonction des exigences expérimentales spécifiques.
1. Préparation de la matrice de gel de collagène et d’agarose
- Impression 3D
REMARQUE : Pour créer la forme appropriée pour la matrice de gel, nous avons développé une conception de chambre unique qui façonne le gel en une forme organoïde physiologiquement pertinente (voir le fichier supplémentaire 1).- Concevoir les chambres à l’aide d’un logiciel de conception assistée par ordinateur. La chambre comprend quatre compartiments parallèles : deux compartiments cellulaires, un compartiment matriciel et un canal de connexion (Figure 1 et Figure 2).
- Construire les chambres par impression 3D ; Une buse chauffante fait fondre un filament de bioplastique et le dépose couche par couche. Pour suivre ce protocole, utilisez du polypropylène (PP), un filament bioplastique non toxique, et une imprimante 3D de type cartésien, nommée d’après le système de coordonnées XYZ.
- Ajoutez une caractéristique de forme de cône inversé aux compartiments cellulaires pour diriger les cellules dans le canal.
- Donnez une forme ronde au compartiment de la matrice, ce qui est crucial pour la formation du gel de collagène.
- Relier les compartiments des cellules et de la matrice à l’aide d’un canal (diamètre 0,04 mm, figure 3B), permettant aux cellules de s’écouler du compartiment cellulaire vers le compartiment de la matrice et de se fixer à la surface du tube.
- Préparation de la matrice de collagène pour la culture des cellules RPTEC-TERT1
REMARQUE : Cette procédure garantit que la matrice de collagène est préparée correctement et chargée dans la chambre, créant ainsi un environnement approprié pour l’injection et la culture ultérieures de cellules RPTEC/TERT1 et la croissance de la structure cellulaire 3D. Assurez-vous que toutes les étapes sont effectuées dans des conditions stériles pour éviter toute contamination.- Préparez la solution de réticulation en mélangeant 50 μL de Genipin (30 mM) avec 50 μL de NaOH (1 M) à l’aide d’un vortex pour assurer un mélange complet.
- Ajoutez 1 000 μL de collagène de type I à la solution préparée de Genipin et de NaOH tout en maintenant le mélange sur de la glace pour éviter une gélification prématurée. Mélangez à nouveau la solution à l’aide d’un vortex pour obtenir un mélange homogène.
REMARQUE : Gardez la solution mélangée sur de la glace en continu pour éviter une gélification prématurée. - À l’aide d’une pointe de pipette de 1 000 μL, prélevez la totalité de la solution préparée et ajoutez 150 à 200 μL de la solution dans le compartiment matriciel de la chambre imprimée en 3D.
- Laissez la matrice polymériser en maintenant la chambre dans l’incubateur de CO2 à 37 oC pendant 60 à 90 min. Ajoutez 150 μL de milieu de culture sur le dessus de la matrice et laissez-le reposer toute la nuit dans l’incubateur.
- Préparation de la matrice collagène-agarose et enrobage de cellules Caki-1
REMARQUE : Les cellules RPTEC/TERT1 et Caki-1 ont été cultivées à l’aide du même milieu de culture, composé d’un milieu à haute teneur en glucose DMEM F-12 complété par des STI (10 μg/mL d’insuline, 5,5 μg/mL de transferrine et 5 ng/mL de sélénite de sodium), 10 ng/mL de facteur de croissance épidermique (EGF), 36 ng/mL d’hydrocortisone, 100 U/mL de pénicilline, 100 μg/mL de streptomycine (5 % v/v) et 10 % (v/v) de sérum de veau fœtal (SCF).- Dissoudre la poudre d’agarose dans de l’eau stérile ou du DPBS pour atteindre une concentration finale de 2 %. Placez la solution d’agarose sur un bloc chauffant réglé à 85 oC pour assurer une dissolution complète.
REMARQUE : Manipulez la solution d’agarose avec précaution en raison de sa sensibilité à la température.
- Dissoudre la poudre d’agarose dans de l’eau stérile ou du DPBS pour atteindre une concentration finale de 2 %. Placez la solution d’agarose sur un bloc chauffant réglé à 85 oC pour assurer une dissolution complète.
- Intégration des cellules Caki-1
- Détachez les cellules Caki-1 de leurs fioles de culture en ajoutant 1x trypsine-EDTA et en les incubant à 37 °C jusqu’à ce qu’elles se détachent. Neutralisez la trypsine 1x en ajoutant un volume égal de milieu de culture.
- Prélever la suspension cellulaire, compter les cellules et centrifuger à 2 500 × g pendant 5 min. Jeter le surnageant et remettre en suspension les pastilles de cellules dans un milieu de culture frais jusqu’à une concentration finale de 1 × 103 cellules/mL (Caki-1).
REMARQUE : Assurez-vous que la suspension cellulaire est bien mélangée et exempte d’agglomérations avant de la charger dans la chambre. - Ajouter 25 μL de suspension cellulaire dans un tube de microcentrifugation de 1,5 mL.
REMARQUE : Assurez-vous que la seringue ou la pipette est stérilisée et appropriée pour la manipulation des cellules. - Ajoutez 75 μL de collagène de type I dans le tube avec la suspension cellulaire et le vortex.
REMARQUE : Gardez le mélange sur de la glace en continu pour éviter une gélification prématurée. - Ajouter 100 μL de gel d’agarose fondu à 2 % et mélanger soigneusement au vortex jusqu’à ce que le gel devienne homogène.
REMARQUE : Assurez-vous d’une répartition uniforme des cellules dans le gel. Évitez d’introduire des bulles d’air lors de l’injection, car elles peuvent perturber la distribution des cellules et l’intégrité du gel ! - Après 1 h, ajoutez 150 μL de milieu cellulaire en haut de la matrice et retirez-le de la chambre à l’aide d’une spatule. Placez les matrices 3D avec les cellules dans une plaque de 24 puits avec 1 000 μL de milieu de culture et incubez à 37 °C, 5 % de CO2.
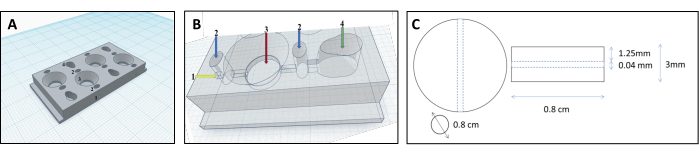
Figure 1 : Conception de la chambre imprimée en 3D pour la reconstruction des tubules rénaux. (A,B) Représentation de la chambre imprimée en 3D conçue pour accueillir une matrice de collagène réticulé afin de reconstruire les tubules rénaux. Chaque chambre se compose de quatre compartiments individuels, qui sont utilisés pour produire une quantité égale de gels. 1-point d’insertion pour le filament, 2-pré-chambres à remplir de gélose uniquement pour éviter les fuites, 3-chambre de collagène, 4-chambre de cellules. (C) Dimensions du gel de collagène réticulé et du tubule rénal intégré. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Préparation des gels de collagène et d’agar-collagène. (A) Chambre imprimée en 3D avec filaments insérés. (B) La solution de collagène réticulé est distribuée dans les puits de la chambre (C) Une chambre remplie de solution de collagène est placée dans l’incubateur pour faciliter la polymérisation de la matrice (D) Collection de cellules RPTEC-TERT1 avant l’injection dans la matrice de collagène (E) Ajout d’une suspension cellulaire dans le compartiment cellulaire de la chambre (F) Retrait du filament à l’aide d’une pince, permettant aux cellules de peupler la structure tubulaire creuse à l’intérieur de la matrice (G) Suspension de cellules RCC mélangées à du collagène dans un tube de 1,5 ml (H) Ajout d’une solution de gélose à 2 % les cellules pour générer le gel RCC. (I) Les gels sont placés dans l’incubateur pour faciliter la gélification matricielle (J, K, L) Retrait du gel de collagène polymérisé avec les tubules rénaux de la chambre imprimée en 3D à l’aide d’une spatule et leur placement dans une plaque à 24 puits avant un traitement ultérieur (M, N, O) Retrait du gel de collagène-gélose polymérisé avec les cellules du RCC à l’aide d’une spatule, et les placer dans une plaque à 24 puits avant de poursuivre le traitement Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 3 : Montage du système de culture microfluidique. (A,B) Ouverture des compartiments de culture de la puce Humimic2 à l’aide d’un outil dédié (C) Après avoir retiré le milieu de culture utilisé pour laver la puce, ajoutez 400 μL de milieu de culture frais. (D, E) Après avoir retiré les gels rénal et RCC des plaques respectives à 24 puits, placez chaque gel dans le compartiment de culture d’un circuit de perfusion unique de la puce Humimic à l’aide de spatules pour manipuler les gels. (F,G) Après avoir positionné les gels dans la puce, les chambres de culture sont scellées et la puce est reliée à l’unité de perfusion par trois micro-pompes dans chaque circuit microfluidique, reliées par des tubes spécialisés. (H) Les puces sont placées dans l’incubateur pendant la durée de la période de culture (I) Paramètres de perfusion définis dans l’unité de contrôle. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Injection de cellules RPTEC/TERT1
- Injection de cellules RPTEC/TERT1
- Détachez les cellules RPTEC/TERT1 de leurs fioles de culture en ajoutant 1x trypsine-EDTA et en les incubant à 37 °C jusqu’à ce qu’elles se détachent.
- Neutralisez la trypsine 1x en ajoutant un volume égal de milieu de culture avec des suppléments. Recueillir la suspension cellulaire et centrifuger à 2 500 × g pendant 5 min.
- Jeter le surnageant et remettre en suspension les pastilles de cellules dans un milieu de culture frais jusqu’à une concentration finale de 1 × 106 cellules/mL (RPTEC/TERT1). Assurez-vous que la suspension cellulaire est bien mélangée et exempte d’agglomérations avant de la charger dans la chambre.
- Chargez 10 μL de la suspension cellulaire préparée dans une micro-pipette avec une pointe de 10 μL. Assurez-vous que la pipette est stérilisée et adaptée à la manipulation des cellules. Injectez soigneusement la suspension cellulaire dans le collagène solidifié (étape 1.2.4) à travers le compartiment cellulaire à l’intérieur de la chambre.
- Retirez délicatement le filament à l’aide d’une pince, permettant aux cellules de peupler la structure tubulaire creuse à l’intérieur de la matrice
REMARQUE : Assurez-vous d’une répartition uniforme des cellules dans le gel. Évitez d’introduire des bulles d’air pendant l’injection, car elles peuvent perturber la distribution cellulaire et l’intégrité du gel. - Placez les chambres dans un incubateur à 37 °C à 5 % de CO2 . Après 60 min, ajoutez 150 μL de milieu cellulaire sur le dessus de la matrice pour éviter le dessèchement. Incuber pendant 24 h pour permettre aux cellules de s’acclimater et de s’intégrer dans la matrice de gel.
- Le lendemain, retirez la matrice de la chambre à l’aide d’une spatule. Placez les matrices 3D avec les cellules dans une plaque de 24 puits avec 1 000 μL de milieu de culture et incubez à 37 °C avec 5 % de CO2.
REMARQUE : Les gels préparés avec le tubule rénal reconstruit et les sphéroïdes RCC intégrés seront ajoutés au système de microfluides pour la co-culture
3. Perfusion d’échantillons de cellules 3D
- Perfusion cellulaire 3D dans le système de puce multi-organes
- Connectez la puce avec la cellule 3D au système de perfusion avec tubulure.
- Réglez le système : fréquence : 0,25 Hz, vide : -220 mbar, pression : 800 mbar et connectez la puce 2 au système (Figure 3).
- Cultivez la culture cellulaire dynamique 3D pendant 5 jours dans un incubateur à 37 °C avec 5 % de CO2.
4. 3D échantillons de cellules après le prélèvement de perfusion
- Prélèvement et analyse post-perfusion
- Retirez les gels du système de perfusion et rincez-les avec du PBS.
- Fixez les gels en plaçant les échantillons dans du paraformaldéhyde à 2 % pendant 2 à 3 h à température ambiante. Stocker les échantillons fixés à 4 ºC.
- Teindre les gels avec des colorants (par exemple, Hoechst33342, phalloïdine, ZO1, tubuline).
- Après 5 jours de perfusion à l’aide du système de puce multi-organes, divers tests et méthodes ont été effectués sur les cultures cellulaires 3D et les milieux collectés pour évaluer la viabilité cellulaire, la morphologie, les niveaux d’expression génique et les ajustements fonctionnels. Les cellules RPTEC/TERT1 dans la matrice de gel de collagène et les cellules Caki-1 dans la matrice de collagène-agarose maintiennent une viabilité élevée ; Confirmez cela à l’aide d’essais de viabilité tels que la coloration vivante/morte.
Access restricted. Please log in or start a trial to view this content.
Résultats
Le système HUMIMIC fournit un environnement dynamique qui permet un apport continu en nutriments et en oxygène tout en éliminant les déchets métaboliques, maintenant ainsi la viabilité et la fonction cellulaires sur de longues périodes. Ces systèmes sont particulièrement utiles pour créer des modèles complexes d’organes sur puce qui reproduisent le microenvironnement de tissus spécifiques. Il est spécialement conçu pour les applications d’organes sur puce et permet le c...
Access restricted. Please log in or start a trial to view this content.
Discussion
Le protocole décrit dans cette étude représente le développement d’un modèle complexe de cancer du rein, tirant parti de l’intégration de deux types de cellules distinctes - les cellules épithéliales tubulaires rénales proximales (RPTEC/TERT1) et les cellules de carcinome à cellules rénales (Caki-1) - au sein de matrices spécifiques de collagène et de gel de collagène-agarose dans un système microfluidique. La préparation des gels de collagène est essentielle au succ...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Maryna Somova a été soutenue par la bourse de doctorat de l’Université de Greifswald - Landesgraduiertenförderungsgesetzes (loi sur le financement public des études supérieures) du Mecklembourg-Poméranie-Occidentale. Les auteurs tiennent à remercier le Dr Janosh Schoon et Dirk Stobe du Centre d’orthopédie, de chirurgie traumatologique et de médecine de réadaptation de l’Université de médecine de Greifswald pour leurs connaissances en matière de culture cellulaire 3D et de préparation d’échantillons.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 1.5-2.0 mL tubes | Eppendorf | 003012/10237-20205 | |
| 24-well plates | Sarstedt | 83.3922.500 | |
| 3D printer | Prusa | ||
| Agarose | Carl Roth | 3810.3 | |
| AutoDesk Tinker CAD software | computer-assisted design software | ||
| Caki-1 cells | ATCC | HTB-46 | |
| Caspase activity | Promega | G8090 | Caspase 3/7 assay |
| Cell viability | Promega | G7570 | Cell Titer Glo assay |
| Collagen Type I – rat tail, 3.0 mg/mL | Corning | 354236 | |
| DMEM/12F Medium | PAN Biotech | PO4-41650 | |
| DPBS solution | PAN Biotech | P04-53500 | |
| Epidermal Growth Factor | Merck | E4127 | |
| Fetal Calf Serum | PAN Biotech | P30-3033 | |
| Genipin (30 mM) | Merck | G4796 | |
| HUMIMIC chips 2 | TissUse | multi-organ chips | |
| HUMIMIC control unit | TissUse | multi-organ chip control unit | |
| Hydrocortisone | Merck | H6909 | |
| Incubator (37 °C, 5% CO2) | nd | ||
| Insulin,Sodium selenite,Transferrin (IST) | Merck | I1884 | |
| LDH release | Promega | J2380 | |
| Metal spatula | nd | ||
| NaOH (1 M) | Carl Roth | P031.2 | |
| Petri dishes | Sarstedt | 82.1135.500 | |
| Polypropylene (PP) filament | Verbatin | 55952 | |
| RNA-easy extraction kit | Qiagen | 74104 | |
| RPTEC/TERT cells | ATCC | CRL - 4031 | |
| TNF-alfa ELISA | R&D Systems | DY210-05 | |
| Triiodothyronine (T3 ) | Merck | 709611 | |
| Trypsin-EDTA | PAN Biotech | P10-021100 |
Références
- Ainslie, G. R., et al. Microphysiological lung models to evaluate the safety of new pharmaceutical modalities: A biopharmaceutical perspective. Lab Chip. 19 (19), 3152-3161 (2019).
- Van Ness, K. P., et al. Microphysiological systems to assess nonclinical toxicity. Curr Protoc Toxicol. 73, 14.18.1-14.18.28 (2017).
- Majo, S., et al. Impact of extracellular matrix components to renal cell carcinoma behavior. Front Oncol. 10, 625(2020).
- Caetano-Pinto, P., et al. Epidermal growth factor receptor mediates the basolateral uptake of phosphorothioate-modified antisense oligonucleotides in the kidney. Organs-on-a-Chip. 4, 100022(2022).
- Manduca, N., et al. 3D cancer models: One step closer to in vitro human studies. Front Immunol. 14, 1175503(2023).
- Simon, B. R., et al. The RPTEC/TERT1 cell line models key renal cell responses to the environmental toxicants, benzo[a]pyrene and cadmium. Toxicol Rep. 1, 231-242 (2014).
- Ogura, T., et al. Methods of high integrity RNA extraction from cell/agarose construct. BMC Res Notes. 8, 644(2015).
- Glube, N., et al. Caki-1 cells represent an in vitro model system for studying the human proximal tubule epithelium. Nephron Exp Nephrol. 107 (2), e47-e56 (2007).
- Kühnl, J., et al. Characterization of application scenario-dependent pharmacokinetics and pharmacodynamic properties of permethrin and hyperforin in a dynamic skin and liver multi-organ-chip model. Toxicology. 448, 152637(2021).
- Padmyastuti, A., et al. Microfluidic-based prostate cancer model for investigating the secretion of prostate-specific antigen and microRNAs in vitro. Sci Rep. 13 (1), 11623(2023).
- Zhang, X., et al. Cancer-on-a-Chip: Models for studying metastasis. Cancers (Basel). 14 (3), 648(2022).
- Sobczuk, P., et al. Choosing the right animal model for renal cancer research. Transl Oncol. 13 (3), 100745(2020).
- Ewart, L., et al. Performance assessment and economic analysis of a human Liver-Chip for predictive toxicology. Commun Med. 2 (1), 154(2022).
- Caetano-Pinto, P., et al. Kidney cancer and chronic kidney disease: Too close for comfort. Biomedicines. 9 (12), 1761(2021).
- Del Piccolo, N., et al. Tumor-on-chip modeling of organ-specific cancer and metastasis. Adv Drug Deliv Rev. 175, 113798(2021).
- Soo, J. Y. C., et al. Advances in predictive in vitro models of drug-induced nephrotoxicity. Nat Rev Nephrol. 14 (6), 378-393 (2018).
- Chapron, A., et al. An improved vascularized, dual-channel microphysiological system facilitates modeling of proximal tubular solute secretion. ACS Pharmacol Transl Sci. 3 (3), 496-508 (2020).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon