需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
肾脏健康和肿瘤上皮细胞的微流控共培养以模拟肾癌进展
摘要
在这里,我们提出了详细说明在微生理系统中使用胶原蛋白和胶原-琼脂糖基质实施 3D 细胞培养的方案。这些方案支持肾近端小管和肾细胞癌球状体共培养,模拟 体内 条件并能够对肾癌细胞相互作用进行高级研究。
摘要
微生理系统 (MPS) 能够将更复杂和相关的生理元素引入 体外 模型,在三维环境中重建错综复杂的形态特征,而传统模型缺乏动态交互。我们实施了肾细胞癌 (RCC) 共培养模型,以重建健康肾组织和恶性肾组织之间的串扰。
该模型基于参考的多器官平台,包括将重建的肾近端小管与 RCC 球体共培养。使用定制设计的 3D 打印腔室培养人肾上皮近端小管细胞 (RPTEC),并促进它们自组装成包含在 I 型胶原基质中的肾小管。Caki-1 RCC 细胞包埋在琼脂胶原基质中,随后形成癌症球状体。胶原蛋白和琼脂/胶原蛋白凝胶都经过优化,可在循环灌流期间保持其完整性,并在最短 7 天的培养期内承受剪切应力。
凝胶还可以提供充足的营养供应和细胞分泌物。此外,琼脂/胶原凝胶限制了 RCC 细胞的过度增殖,确保了相对均匀的球体大小。MPS 芯片微流控回路由两个独立的培养室组成,大小为标准 96 微孔板。肾小管和 RCC 凝胶填充在不同的腔室中,并共享相同的培养基,该培养基大约每分钟再循环两次。在这些条件下,我们观察到肾小管中免疫因子表达和分泌(白细胞介素-8 和肿瘤坏死因子-α)的上调。在 RCC 的影响下,肾小管也将其代谢活动转向糖酵解。这种新方法表明,基于共培养的 MPS 可以在 体外 放大 RCC 的复杂性,并用于研究癌症对非肿瘤细胞的影响。
引言
与传统的 2D 培养相比,3D 细胞培养系统的进步提供了更具生理相关性的模型,从而彻底改变了组织工程和再生医学 1,2。在这项研究中,我们使用了胶原蛋白和胶原-琼脂糖凝胶基质,因为它们能够模拟细胞外基质 (ECM) 环境,促进更准确的细胞行为和功能,同时与所采用的动态培养条件兼容。
胶原蛋白是 ECM 中最丰富的蛋白质,在维持组织的结构完整性和生物活性方面起着至关重要的作用3。I 型胶原蛋白通常来源于大鼠尾巴,因其生物相容性和定制能力而受到青睐,以满足不同的基质刚性条件,以及为上皮细胞提供经过验证的底物4。在 3D 胶原蛋白基质中,肾细胞有一个支架,支持它们的粘附、增殖和分化。这种环境使细胞能够表现出更自然的形态和行为,包括反映 体内 条件的基因表达模式和细胞相互作用5。因此,胶原凝胶因其能够复制 ECM 的支持和调节作用而被广泛用于从癌症研究到组织工程的各种应用。
永生化肾近端肾小管上皮细胞系 RPTEC/TERT1 用于代表健康的肾上皮。该细胞系过表达人端粒酶逆转录酶,使其能够在培养物中增殖,同时保持代表性的 RPTEC 表型。采用大鼠尾胶原 I 型凝胶基质重建肾脏微环境。这种胶原凝胶基质支持 RPTEC/TERT16 细胞维持其天然特性和生理功能。相比之下,杂交胶原-琼脂糖凝胶基质用于培养肾细胞癌 (Caki-1) 细胞。琼脂糖是一种来源于海藻的多糖,为 3D 细胞培养系统增加了另一个维度。它是热可逆的,允许在制备过程中轻松处理和作7.琼脂糖凝胶提供中性支持基质,可维持细胞活力并通过增殖癌细胞促进复杂结构的形成。当与胶原蛋白结合时,所得的杂交凝胶利用了胶原蛋白的生化线索和琼脂糖的结构支持。这种组合为肾细胞癌 (RCC) Caki-1 细胞8 创造了合适的微环境,使其生长成球状体,并用作肾癌模型。
这些不同的 3D 基质用于 RPTEC/TERT1 和 Caki-1 细胞强调了根据不同细胞类型的特定需求定制 ECM 环境的重要性。包含代表健康肾上皮的 RPTEC 或代表 RCC 的 Caki-1 细胞的凝胶结合在一个微流控系统中,该系统在细胞之间再循环培养基,有效地将健康肾细胞模型暴露于 RCC 的分泌物中,而无需直接接触。本研究采用的 TissUse HUMUMIC 平台 9,10(以下简称多器官芯片平台)由一个具有两个独立流体回路的微生理芯片组成,其流动由外部灌注装置驱动。
Access restricted. Please log in or start a trial to view this content.
研究方案
注:这些方案概述了制备 3D 胶原-琼脂糖凝胶、注射细胞、灌注样品和提取样品以供进一步分析的综合步骤。根据特定的实验要求调整孵育时间和条件。
1. 胶原蛋白和琼脂糖凝胶基质的制备
- 3D 打印
注意:为了为凝胶基质创建合适的形状,我们开发了一种独特的腔室设计,将凝胶塑造成生理相关的类器官形式(参见 补充文件 1)。- 使用计算机辅助设计软件设计腔室。腔室包括四个平行的隔室:两个细胞隔室、一个基质隔室和一个连接管(图 1 和 图 2)。
- 通过 3D 打印建造腔室;加热喷嘴熔化生物塑料细丝并逐层沉积。要遵循此协议,请使用聚丙烯 (PP),一种无毒的生物塑料长丝和以 XYZ 坐标系命名的笛卡尔型 3D 打印机。
- 在细胞隔室中添加反向锥形特征,以将细胞引导至耳道中。
- 给基质隔室一个圆形,这对形成胶原蛋白凝胶至关重要。
- 用管道(直径 0.04 mm, 图 3B)连接细胞和基质室,允许细胞从细胞室流入基质室并附着在管表面。
- 制备用于培养 RPTEC-TERT1 细胞的胶原基质
注:该程序可确保正确制备胶原蛋白基质并加载到腔室中,为随后的 RPTEC/TERT1 细胞注射和培养以及 3D 细胞结构的生长创造合适的环境。确保所有步骤都在无菌条件下进行,以避免污染。- 通过使用涡旋将 50 μL Genipin (30 mM) 与 50 μL NaOH (1 M) 混合来制备交联溶液,以确保充分混合。
- 将 1,000 μL I 型胶原蛋白添加到准备好的 Genipin 和 NaOH 溶液中,同时将混合物保持在冰上以防止过早凝胶化。使用涡旋再次混合溶液,以获得均匀的混合物。
注意:将混合溶液持续放在冰上,以防止过早凝胶化。 - 使用 1,000 μL 移液器吸头,收集整个制备的溶液,并将 150-200 μL 溶液添加到 3D 打印腔室的基质室中。
- 通过将腔室在 CO2 培养箱中保持在 37 oC 60-90 分钟,让基质聚合。在基质顶部加入 150 μL 培养基,并在培养箱中放置过夜。
- 胶原-琼脂糖基质的制备和 Caki-1 细胞的包埋
注:RPTEC/TERT1 和 Caki-1 细胞均使用相同的培养基培养,该培养基由补充有 ITS(10 μg/mL 胰岛素、5.5 μg/mL 转铁蛋白和 5 ng/mL 亚硒酸钠)、10 ng/mL 表皮生长因子 (EGF)、36 ng/mL 氢化可的松、100 U/mL 青霉素、 100 μg/mL 链霉素 (5% v/v) 和 10% (v/v) 胎牛血清 (FCS)。- 将琼脂糖粉末溶解在无菌水或 DPBS 中,以达到 2% 的最终浓度。将琼脂糖溶液放在设置为 85 oC 的加热块上,以确保完全溶解。
注:由于其温度敏感性,请小心处理琼脂糖溶液。
- 将琼脂糖粉末溶解在无菌水或 DPBS 中,以达到 2% 的最终浓度。将琼脂糖溶液放在设置为 85 oC 的加热块上,以确保完全溶解。
- Caki-1 细胞包埋
- 通过加入 1x 胰蛋白酶-EDTA 并在 37 °C 下孵育直至细胞分离,将 Caki-1 细胞从其培养瓶中分离。通过添加等体积的培养基来中和 1x 胰蛋白酶。
- 收集细胞悬液,计数细胞,并以 2,500 × g 离心 5 分钟。弃去上清液,将细胞沉淀重悬于新鲜培养基中,至终浓度为 1 × 103 个细胞/mL (Caki-1)。
注:在装入腔室之前,请确保细胞悬液充分混合且没有结块。 - 将 25 μL 细胞悬液添加到 1.5 mL 微量离心管中。
注:确保注射器或移液器已消毒并适合处理细胞。 - 将 75 μL I 型胶原蛋白加入装有细胞悬液并涡旋的试管中。
注意:将混合物持续放在冰上,以防止过早凝胶化。 - 加入 100 μL 2% 熔化的琼脂糖凝胶,并在涡旋中小心混合,直到凝胶变得均匀。
注:确保凝胶内细胞分布均匀。避免在注射过程中引入气泡,因为它们会破坏细胞分布和凝胶完整性! - 1 小时后,在基质顶部加入 150 μL 细胞培养基,然后用刮刀将其从腔室中取出。将含有细胞的 3D 基质置于装有 1,000 μL 培养基的 24 孔板中,并在 37 °C、5% CO2 下孵育。
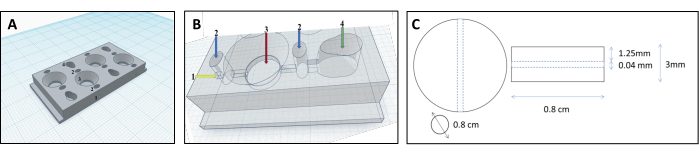
图 1:用于重建肾小管的 3D 打印腔室设计。 (A,B) 3D 打印腔室的表示,该腔室旨在容纳交联胶原蛋白基质以重建肾小管。每个腔室由四个单独的隔室组成,用于产生等量的凝胶。1 个细丝插入点,2 个预室仅填充琼脂以防止泄漏,3 个胶原室,4 个细胞室。(C) 交联胶原凝胶和包埋的肾小管的尺寸。 请单击此处查看此图的较大版本。

图 2:胶原蛋白和琼脂-胶原蛋白凝胶的制备。(A) 插入细丝的 3D 打印腔室。 (B) 将交联的胶原蛋白溶液分配到腔室的孔中 (C) 将装满胶原蛋白溶液的腔室放置在培养箱中以促进基质聚合 (D) 在注射到胶原蛋白基质之前收集 RPTEC-TERT1 细胞 (E) 在腔室的细胞室中添加细胞悬液 (F) 借助镊子去除细丝,使细胞能够在基质内填充空心管状结构 (G) 在 1.5mL 管中混合 RCC 细胞悬浮液 (H) 向细胞中加入 2% 琼脂溶液以生成 RCC 凝胶。 (I) 将凝胶置于培养箱中以促进基质凝胶化 (J,K,L) 借助刮刀从 3D 打印室中取出带有肾小管的聚合胶原凝胶,并在进一步加工前将它们放入 24 孔板中 (M,N,O) 在刮刀的帮助下去除带有 RCC 细胞的聚合胶原琼脂凝胶, 并在进一步处理之前将它们放入 24 孔板 中 请单击此处查看此图的较大版本。

图 3:微流控培养系统的组装。(A,B) 使用专用工具打开 Humimic 芯片2 的培养室 (C) 去除用于清洗芯片的培养基后,加入 400 μL 新鲜培养基。(D,E) 从相应的 24 孔板中取出肾凝胶和 RCC 凝胶后,使用刮刀将每个凝胶放入 Humimic 芯片的单个灌注回路的培养室中以处理凝胶。 (F,G) 将凝胶定位在芯片中后,密封培养室,芯片通过每个微流体回路中的三个微型泵连接到灌注装置,这些微泵通过专用管道连接。(H) 将芯片放置在培养箱中培养期间 (I) 控制单元中设置的灌注参数。请单击此处查看此图的较大版本。
2. 注射 RPTEC/TERT1 细胞
- RPTEC/TERT1 细胞注射液
- 通过加入 1x 胰蛋白酶-EDTA 并在 37 °C 下孵育直至细胞分离,将 RPTEC/TERT1 细胞从培养瓶中分离。
- 通过添加等体积的培养基和补充剂来中和 1x 胰蛋白酶。收集细胞悬液并以 2,500 × g 离心 5 分钟。
- 弃去上清液,将细胞沉淀重悬于新鲜培养基中,至终浓度为 1 × 106 个细胞/mL (RPTEC/TERT1)。在装入腔室之前,确保细胞悬液充分混合且没有团块。
- 将 10 μL 制备好的细胞悬液上样到带有 10 μL 吸头的微量移液器中。确保移液器已消毒并适合处理细胞。通过腔室内的细胞隔室小心地将细胞悬液注射到凝固的胶原蛋白中(步骤 1.2.4)。
- 使用镊子轻轻去除细丝,让细胞填充基质内的空心管状结构
注:确保凝胶内细胞分布均匀。避免在注射过程中引入气泡,因为它们会破坏细胞分布和凝胶完整性。 - 将腔室置于 37 °C、5% CO2 培养箱中。60 分钟后,在基质顶部添加 150 μL 细胞培养基以避免干燥。孵育 24 小时,让细胞适应并整合到凝胶基质中。
- 第二天,用刮刀从腔室中取出基质。将含有细胞的 3D 基质置于装有 1,000 μL 培养基的 24 孔板中,并在 37 °C 和 5% CO2 下孵育。
注:用重建的肾小管和嵌入的 RCC 球体制备的凝胶将被添加到微流体系统中进行共培养
3. 3D 细胞样品的灌注
- 多器官芯片系统中的 3D 细胞灌注
- 通过管道将带有 3D 细胞的芯片连接到灌注系统。
- 设置系统: 频率:0.25 Hz,真空:-220 mbar,压力:800 mbar,并将芯片 2 连接到系统(图 3)。
- 将动态 3D 细胞培养物在 37 °C 和 5% CO2 的培养箱中培养 5 天。
灌流采集后4. 3D细胞样本
- 灌注后采集和分析
- 从灌注系统中取出凝胶并用 PBS 冲洗。
- 将样品在室温下置于 2% 多聚甲醛中 2-3 小时,固定凝胶。将固定样品储存在 4 ºC 下。
- 用染料(例如,Hoechst33342、鬼笔环肽、ZO1、微管蛋白)对凝胶进行染色。
- 使用多器官芯片系统灌注 5 天后,对 3D 细胞培养物和收集的培养基进行各种检测和方法,以评估细胞活力、形态、基因表达水平和功能调整。胶原凝胶基质中的 RPTEC/TERT1 细胞和胶原-琼脂糖基质中的 Caki-1 细胞保持高活力;使用活力测定法(如活/死染色)确认这一点。
Access restricted. Please log in or start a trial to view this content.
结果
HUMIMIC 系统提供了一个动态环境,可在去除代谢废物的同时实现持续的营养和氧气供应,从而在较长时间内维持细胞活力和功能。这些系统特别有利于创建复制特定组织微环境的复杂器官芯片模型。它专为器官芯片应用而设计,可精确控制流体流动和剪切应力,这是模拟组织和器官生理状况的关键因素。
在这项研究中,我们利用 HUMIMIC 灌注系统在三?...
Access restricted. Please log in or start a trial to view this content.
讨论
本研究中描述的方案代表了复杂肾癌模型的开发,利用两种不同的细胞类型——肾近端肾小管上皮细胞 (RPTEC/TERT1) 和肾细胞癌 (Caki-1) 细胞——在微流控系统中的特定胶原蛋白和胶原-琼脂糖凝胶基质中的整合。胶原蛋白凝胶的制备对于该模型的成功至关重要。胶原蛋白和琼脂糖的精确浓度对于在整个灌流过程中保持基质的结构完整性是必要的。在微流体系统内的循?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有需要声明的利益冲突。
致谢
Maryna Somova 得到了梅克伦堡-前波莫瑞州格赖夫斯瓦尔德大学博士奖学金 - Landesgraduiertenförderungsgesetzes(国家毕业生资助法案)的支持。作者要感谢格赖夫斯瓦尔德大学医学院骨科、创伤外科和康复医学中心的 Janosh Schoon 博士和 Dirk Stobe 博士,感谢他们在 3D 细胞培养和样品制备方面的见解。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 1.5-2.0 mL tubes | Eppendorf | 003012/10237-20205 | |
| 24-well plates | Sarstedt | 83.3922.500 | |
| 3D printer | Prusa | ||
| Agarose | Carl Roth | 3810.3 | |
| AutoDesk Tinker CAD software | computer-assisted design software | ||
| Caki-1 cells | ATCC | HTB-46 | |
| Caspase activity | Promega | G8090 | Caspase 3/7 assay |
| Cell viability | Promega | G7570 | Cell Titer Glo assay |
| Collagen Type I – rat tail, 3.0 mg/mL | Corning | 354236 | |
| DMEM/12F Medium | PAN Biotech | PO4-41650 | |
| DPBS solution | PAN Biotech | P04-53500 | |
| Epidermal Growth Factor | Merck | E4127 | |
| Fetal Calf Serum | PAN Biotech | P30-3033 | |
| Genipin (30 mM) | Merck | G4796 | |
| HUMIMIC chips 2 | TissUse | multi-organ chips | |
| HUMIMIC control unit | TissUse | multi-organ chip control unit | |
| Hydrocortisone | Merck | H6909 | |
| Incubator (37 °C, 5% CO2) | nd | ||
| Insulin,Sodium selenite,Transferrin (IST) | Merck | I1884 | |
| LDH release | Promega | J2380 | |
| Metal spatula | nd | ||
| NaOH (1 M) | Carl Roth | P031.2 | |
| Petri dishes | Sarstedt | 82.1135.500 | |
| Polypropylene (PP) filament | Verbatin | 55952 | |
| RNA-easy extraction kit | Qiagen | 74104 | |
| RPTEC/TERT cells | ATCC | CRL - 4031 | |
| TNF-alfa ELISA | R&D Systems | DY210-05 | |
| Triiodothyronine (T3 ) | Merck | 709611 | |
| Trypsin-EDTA | PAN Biotech | P10-021100 |
参考文献
- Ainslie, G. R., et al. Microphysiological lung models to evaluate the safety of new pharmaceutical modalities: A biopharmaceutical perspective. Lab Chip. 19 (19), 3152-3161 (2019).
- Van Ness, K. P., et al. Microphysiological systems to assess nonclinical toxicity. Curr Protoc Toxicol. 73, 14.18.1-14.18.28 (2017).
- Majo, S., et al. Impact of extracellular matrix components to renal cell carcinoma behavior. Front Oncol. 10, 625(2020).
- Caetano-Pinto, P., et al. Epidermal growth factor receptor mediates the basolateral uptake of phosphorothioate-modified antisense oligonucleotides in the kidney. Organs-on-a-Chip. 4, 100022(2022).
- Manduca, N., et al. 3D cancer models: One step closer to in vitro human studies. Front Immunol. 14, 1175503(2023).
- Simon, B. R., et al. The RPTEC/TERT1 cell line models key renal cell responses to the environmental toxicants, benzo[a]pyrene and cadmium. Toxicol Rep. 1, 231-242 (2014).
- Ogura, T., et al. Methods of high integrity RNA extraction from cell/agarose construct. BMC Res Notes. 8, 644(2015).
- Glube, N., et al. Caki-1 cells represent an in vitro model system for studying the human proximal tubule epithelium. Nephron Exp Nephrol. 107 (2), e47-e56 (2007).
- Kühnl, J., et al. Characterization of application scenario-dependent pharmacokinetics and pharmacodynamic properties of permethrin and hyperforin in a dynamic skin and liver multi-organ-chip model. Toxicology. 448, 152637(2021).
- Padmyastuti, A., et al. Microfluidic-based prostate cancer model for investigating the secretion of prostate-specific antigen and microRNAs in vitro. Sci Rep. 13 (1), 11623(2023).
- Zhang, X., et al. Cancer-on-a-Chip: Models for studying metastasis. Cancers (Basel). 14 (3), 648(2022).
- Sobczuk, P., et al. Choosing the right animal model for renal cancer research. Transl Oncol. 13 (3), 100745(2020).
- Ewart, L., et al. Performance assessment and economic analysis of a human Liver-Chip for predictive toxicology. Commun Med. 2 (1), 154(2022).
- Caetano-Pinto, P., et al. Kidney cancer and chronic kidney disease: Too close for comfort. Biomedicines. 9 (12), 1761(2021).
- Del Piccolo, N., et al. Tumor-on-chip modeling of organ-specific cancer and metastasis. Adv Drug Deliv Rev. 175, 113798(2021).
- Soo, J. Y. C., et al. Advances in predictive in vitro models of drug-induced nephrotoxicity. Nat Rev Nephrol. 14 (6), 378-393 (2018).
- Chapron, A., et al. An improved vascularized, dual-channel microphysiological system facilitates modeling of proximal tubular solute secretion. ACS Pharmacol Transl Sci. 3 (3), 496-508 (2020).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。