Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mikrofluidische Co-Kultur von gesunder Niere und Tumorepithel zur Modellierung des Fortschreitens von Nierenkrebs
In diesem Artikel
Zusammenfassung
Hier stellen wir Protokolle vor, die Anweisungen für die Implementierung von 3D-Zellkulturen unter Verwendung von Kollagen- und Kollagen-Agarose-Matrizen in einem mikrophysiologischen System enthalten. Diese Protokolle unterstützen die Co-Kultur von Sphäroiden mit Nierentubuli und Nierenzellkarzinom, simulieren In-vivo-Bedingungen und ermöglichen eine fortschrittliche Untersuchung von Wechselwirkungen mit Nierenkrebszellen.
Zusammenfassung
Mikrophysiologische Systeme (MPS) haben die Einführung komplexerer und relevanterer physiologischer Elemente in In-vitro-Modelle ermöglicht, indem komplizierte morphologische Merkmale in dreidimensionalen Umgebungen mit dynamischen Wechselwirkungen nachgebildet werden, die in herkömmlichen Modellen fehlen. Wir implementierten ein Co-Kulturmodell für Nierenzellkarzinome (RCC), um die Wechselwirkung zwischen gesundem und bösartigem Nierengewebe nachzubilden.
Dieses Modell basiert auf der referenzierten Multiorgan-Plattform und besteht aus der Co-Kultivierung eines rekonstruierten renalen proximalen Tubulus mit RCC-Sphäroiden Speziell entwickelte 3D-gedruckte Kammern wurden verwendet, um menschliche proximale Nierentubulizellen (RPTEC) zu kultivieren und ihre Selbstorganisation zu einem Nierentubuli zu erleichtern, der in einer Kollagen-Typ-I-Matrix enthalten ist. Caki-1-RCC-Zellen wurden in eine Agar-Kollagen-Matrix eingebettet und bildeten anschließend Krebs-Sphäroide. Sowohl Kollagen als auch Agar/Kollagen-Gele wurden optimiert, um ihre Integrität während der zyklischen Perfusion zu erhalten und Scherbelastungen während einer Mindestkulturdauer von 7 Tagen standzuhalten.
Die Gele ermöglichen zudem eine ausreichende Nährstoffversorgung und Zellsekretion. Darüber hinaus begrenzen die Agar/Kollagen-Gele die Überwucherung von RCC-Zellen und sorgen für eine relativ homogene Sphäroidgröße. Die mikrofluidischen Schaltkreise des MPS-Chips bestehen aus zwei unabhängigen Kulturkammern mit der Größe eines Standard-96-Mikrotiterplatten-Wells. Der Nierentubuli und die RCC-Gele besiedeln separate Kammern und teilen sich das gleiche Kulturmedium, das etwa zweimal pro Minute rezirkuliert wird. Unter diesen Bedingungen beobachteten wir eine Hochregulation der Immunfaktorexpression und -sekretion in den Nierentubuli (Interleukin-8 und Tumornekrosefaktor-alpha). Auch die Nierentubuli verlagern unter dem Einfluss von RCC ihre Stoffwechselaktivität in Richtung Glykolyse. Dieser neuartige Ansatz zeigt, dass ein Co-Kultur-basiertes MPS die Komplexität des RCC in vitro verstärken und zur Untersuchung der Auswirkungen von Krebs auf Nicht-Tumorzellen eingesetzt werden kann.
Einleitung
Fortschritte bei 3D-Zellkultursystemen haben das Tissue Engineering und die regenerative Medizin revolutioniert, indem sie im Vergleich zu herkömmlichen 2D-Kulturen physiologisch relevantere Modelle anbieten 1,2. In dieser Studie verwendeten wir Kollagen- und Kollagen-Agarose-Gel-Matrizen, da sie die Umgebung der extrazellulären Matrix (EZM) nachahmen können, ein genaueres zelluläres Verhalten und eine genauere zelluläre Funktion fördern und gleichzeitig mit den verwendeten dynamischen Kulturbedingungen kompatibel sind.
Kollagen, das am häufigsten vorkommende Protein in der EZM, spielt eine entscheidende Rolle bei der Aufrechterhaltung der strukturellen Integrität und biologischen Aktivität von Geweben3. Typ-I-Kollagen, das üblicherweise aus Rattenschwanz gewonnen wird, wurde aufgrund seiner Biokompatibilität und seiner Fähigkeit, an unterschiedliche Matrixsteifigkeitsbedingungen angepasst zu werden, sowie aufgrund seiner Fähigkeit, ein bewährtes Substrat für Epithelzellen zu bieten, bevorzugt4. In der 3D-Kollagenmatrix werden die Nierenzellen mit einem Gerüst versorgt, das ihre Adhäsion, Proliferation und Differenzierung unterstützt. Diese Umgebung ermöglicht es den Zellen, natürlichere Morphologien und Verhaltensweisen zu zeigen, einschließlich Genexpressionsmustern und zellulären Interaktionen, die In-vivo-Bedingungen widerspiegeln5. Folglich wurden Kollagengele aufgrund ihrer Fähigkeit, die unterstützende und regulatorische Rolle der EZM zu replizieren, in großem Umfang in Anwendungen eingesetzt, die von der Krebsforschung bis zum Tissue Engineering reichen.
Die immortalisierte renale proximale tubuläre Epithelzelllinie RPTEC/TERT1 wurde verwendet, um ein gesundes Nierenepithel darzustellen. Diese Zelllinie überexprimiert die humane Telomerase-Reverse-Transkriptase, so dass sie sich in Kultur vermehren kann, während sie einen repräsentativen RPTEC-Phänotyp beibehält. Rattenschwanzkollagen Typ I Gelmatrix wurde verwendet, um die Nierenmikroumgebung nachzubilden. Diese Kollagen-Gel-Matrix unterstützt RPTEC/TERT16-Zellen dabei, ihre nativen Eigenschaften und physiologischen Funktionen zu erhalten. Im Gegensatz dazu wird eine hybride Kollagen-Agarose-Gel-Matrix für die Kultivierung von Nierenzellkarzinomzellen (Caki-1) verwendet. Agarose, ein Polysaccharid, das aus Algen gewonnen wird, fügt 3D-Zellkultursystemen eine weitere Dimension hinzu. Es ist thermisch reversibel und ermöglicht eine einfache Handhabung und Manipulation während des Vorbereitungsprozesses7. Agarose-Gele bieten eine neutrale unterstützende Matrix, die die Lebensfähigkeit der Zellen erhält und die Bildung komplexer Strukturen durch die Proliferation von Krebszellen fördert. In Kombination mit Kollagen nutzt das resultierende Hybridgel die biochemischen Signale von Kollagen und die strukturelle Unterstützung von Agarose. Diese Kombination schafft eine geeignete Mikroumgebung fürdie Caki-1-Zellen des Nierenzellkarzinoms (RCC) 8 für das Wachstum zu Sphäroiden und wird als Modell für Nierenkrebs verwendet.
Die Verwendung dieser unterschiedlichen 3D-Matrizen für RPTEC/TERT1- und Caki-1-Zellen unterstreicht, wie wichtig es ist, die EZM-Umgebung auf die spezifischen Bedürfnisse der verschiedenen Zelltypen zuzuschneiden. Die Gele, die entweder RPTEC, das ein gesundes Nierenepithel darstellt, oder Caki-1-Zellen, die das Nierenzellkarzinom repräsentieren, enthalten, wurden in einem mikrofluidischen System kombiniert, das das Kulturmedium zwischen den Zellen zirkuliert und das gesunde Nierenzellmodell effektiv den Sekreten des Nierenzellkarzinoms ohne direkten Kontakt aussetzt. Die in dieser Studie verwendete TissUse HUMUMIC-Plattform 9,10 (im Folgenden als Multi-Organ-Chip-Plattform bezeichnet) besteht aus einem Mikrophysiologie-Chip mit zwei unabhängigen fluidischen Kreisläufen, deren Strömung von einer externen Perfusionseinheit angetrieben wird.
Access restricted. Please log in or start a trial to view this content.
Protokoll
HINWEIS: Diese Protokolle beschreiben die umfassenden Schritte zur Herstellung von 3D-Kollagen-Agarose-Gelen, zur Injektion von Zellen, zur Perfusion der Proben und zur Extraktion für die weitere Analyse. Passen Sie die Inkubationszeiten und -bedingungen basierend auf spezifischen experimentellen Anforderungen an.
1. Herstellung der Kollagen- und Agarose-Gel-Matrix
- 3D-Druck
HINWEIS: Um die geeignete Form für die Gelmatrix zu schaffen, haben wir ein einzigartiges Kammerdesign entwickelt, das das Gel in eine physiologisch relevante Organoidform bringt (siehe Ergänzende Datei 1).- Entwerfen Sie die Kammern mit computergestützter Konstruktionssoftware. Die Kammer besteht aus vier parallelen Kompartimenten: zwei Zellkompartimenten, einem Matrixkompartiment und einem Verbindungskanal (Abbildung 1 und Abbildung 2).
- Bauen Sie die Kammern durch 3D-Druck; Eine Heizdüse schmilzt ein Biokunststoff-Filament und lagert Schicht für Schicht ab. Um diesem Protokoll zu folgen, verwenden Sie Polypropylen (PP), ein ungiftiges Biokunststoff-Filament, und einen kartesischen 3D-Drucker, der nach dem XYZ-Koordinatensystem benannt ist.
- Fügen Sie den Zellkompartimenten eine Funktion mit umgekehrter Kegelform hinzu, um die Zellen in den Kanal zu leiten.
- Geben Sie dem Matrixkompartiment eine runde Form, die für die Bildung von Kollagengel entscheidend ist.
- Verbinden Sie die Zell- und Matrixkompartimente mit einem Kanal (Durchmesser 0,04 mm, Abbildung 3B), so dass die Zellen aus dem Zellkompartiment in das Matrixkompartiment fließen und sich an der Röhrchenoberfläche anheften können.
- Aufbereitung der Kollagenmatrix für die Kultivierung von RPTEC-TERT1-Zellen
HINWEIS: Dieses Verfahren stellt sicher, dass die Kollagenmatrix korrekt vorbereitet und in die Kammer geladen wird, wodurch eine geeignete Umgebung für die anschließende Injektion und Kultivierung von RPTEC/TERT1-Zellen und das Wachstum der 3D-Zellstruktur geschaffen wird. Stellen Sie sicher, dass alle Schritte unter sterilen Bedingungen durchgeführt werden, um eine Kontamination zu vermeiden.- Bereiten Sie die Vernetzungslösung vor, indem Sie 50 μl Genipin (30 mM) mit 50 μl NaOH (1 M) mit einem Vortex mischen, um eine gründliche Durchmischung zu gewährleisten.
- Fügen Sie der vorbereiteten Genipin-NaOH-Lösung 1.000 μl Kollagen Typ I hinzu, während Sie die Mischung auf Eis halten, um eine vorzeitige Gelierung zu verhindern. Mischen Sie die Lösung erneut mit einem Wirbel, um eine homogene Mischung zu erhalten.
HINWEIS: Halten Sie die gemischte Lösung kontinuierlich auf Eis, um eine vorzeitige Gelierung zu vermeiden. - Sammeln Sie mit einer 1.000-μl-Pipettenspitze die gesamte vorbereitete Lösung und geben Sie 150-200 μl der Lösung in das Matrixfach der 3D-gedruckten Kammer.
- Lassen Sie die Matrix polymerisieren, indem Sie die Kammer im CO2 -Inkubator für 60-90 min bei 37 oC halten. Geben Sie 150 μl Nährmedium auf die Matrix und lassen Sie es über Nacht im Inkubator.
- Präparation der Kollagen-Agarose-Matrix und Einbettung von Caki-1-Zellen
HINWEIS: Sowohl RPTEC/TERT1- als auch Caki-1-Zellen wurden unter Verwendung desselben Kulturmediums kultiviert, bestehend aus DMEM F-12-Medien mit hohem Glukosegehalt, ergänzt mit ITS (10 μg/ml Insulin, 5,5 μg/ml Transferrin und 5 ng/ml Natriumselenit), 10 ng/ml epidermalem Wachstumsfaktor (EGF), 36 ng/ml Hydrocortison, 100 μg/ml Penicillin, 100 μg/ml Streptomycin (5 % v/v) und 10 % (v/v) fötales Kälberserum (FCS).- Lösen Sie Agarosepulver entweder in sterilem Wasser oder DPBS auf, um eine Endkonzentration von 2 % zu erreichen. Geben Sie die Agaroselösung auf einen Heizblock, der auf 85 oC eingestellt ist, um eine vollständige Auflösung zu gewährleisten.
HINWEIS: Gehen Sie aufgrund der Temperaturempfindlichkeit vorsichtig mit der Agaroselösung um.
- Lösen Sie Agarosepulver entweder in sterilem Wasser oder DPBS auf, um eine Endkonzentration von 2 % zu erreichen. Geben Sie die Agaroselösung auf einen Heizblock, der auf 85 oC eingestellt ist, um eine vollständige Auflösung zu gewährleisten.
- Einbettung von Caki-1-Zellen
- Caki-1-Zellen werden aus ihren Kulturflaschen gelöst, indem 1x Trypsin-EDTA hinzugefügt und bei 37 °C inkubiert wird, bis sich die Zellen ablösen. Neutralisieren Sie das 1x Trypsin, indem Sie ein gleiches Volumen Kulturmedium hinzufügen.
- Sammeln Sie die Zellsuspension, zählen Sie die Zellen und zentrifugieren Sie sie 5 Minuten lang bei 2.500 × g . Der Überstand wird verworfen und die Zellpellets in frischem Kulturmedium auf eine Endkonzentration von 1 × 103 Zellen/ml (Caki-1) resuspendiert.
HINWEIS: Stellen Sie sicher, dass die Zellsuspension gründlich gemischt und frei von Klumpen ist, bevor Sie sie in die Kammer laden. - Geben Sie 25 μl Zellsuspension in ein 1,5 mL Mikrozentrifugenröhrchen.
HINWEIS: Stellen Sie sicher, dass die Spritze oder Pipette sterilisiert und für den Umgang mit Zellen geeignet ist. - Geben Sie 75 μl Kollagen Typ I in das Röhrchen mit der Zellsuspension und dem Vortex.
HINWEIS: Halten Sie die Mischung kontinuierlich auf Eis, um eine vorzeitige Gelierung zu vermeiden. - Fügen Sie 100 μl geschmolzenes Agarosegel 2% hinzu und mischen Sie vorsichtig auf dem Wirbel, bis das Gel homogen wird.
HINWEIS: Stellen Sie sicher, dass die Zellen gleichmäßig im Gel verteilt sind. Vermeiden Sie das Einbringen von Luftblasen während der Injektion, da diese die Zellverteilung und die Integrität des Gels stören können! - Geben Sie nach 1 h 150 μl Zellmedium an die Oberseite der Matrix und entfernen Sie es mit einem Spatel aus der Kammer. Legen Sie die 3D-Matrizen mit den Zellen in eine 24-Well-Platte mit 1.000 μl Kulturmedium und inkubieren Sie sie bei 37 °C, 5 % CO2.
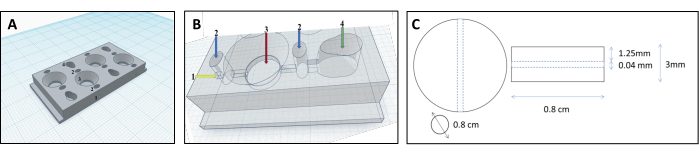
Abbildung 1: 3D-gedrucktes Kammerdesign für die Rekonstruktion von Nierentubuli. (A,B) Darstellung der 3D-gedruckten Kammer, die für eine vernetzte Kollagenmatrix zur Rekonstruktion von Nierentubuli ausgelegt ist. Jede Kammer besteht aus vier einzelnen Kompartimenten, in denen die gleiche Menge an Gelen hergestellt wird. 1 Einführpunkt für das Filament, 2 Vorkammern, die nur mit Agar gefüllt werden, um ein Auslaufen zu verhindern, 3-Kollagen-Kammer, 4-Zellen-Kammer. (C) Abmessungen des vernetzten Kollagengels und des eingebetteten Nierentubuli. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Herstellung von Kollagen- und Agar-Kollagen-Gelen. (A) 3D-gedruckte Kammer mit eingelegten Filamenten. (B) Die vernetzte Kollagenlösung wird in die Vertiefungen der Kammer abgegeben (C) Die mit Kollagenlösung gefüllte Kammer wird in den Inkubator gegeben, um die Matrixpolymerisation zu erleichtern (D) Entnahme von RPTEC-TERT1-Zellen vor der Injektion in die Kollagenmatrix (E) Hinzufügen von Zellsuspension im Zellkompartiment der Kammer (F) Entfernen des Filaments mit Hilfe einer Pinzette, die es den Zellen ermöglicht, die hohle röhrenförmige Struktur in der Matrix zu besiedeln (G) Suspension von RCC-Zellen, die mit Kollagen in einem 1,5-ml-Röhrchen gemischt sind (H) Zugabe von 2%iger Agarlösung zu den Zellen, um das RCC-Gel zu erzeugen. (I) Die Gele werden in den Inkubator gelegt, um die Matrixgelierung zu erleichtern (J,K,L) Entnahme des polymerisierten Kollagengels mit den Nierentubuli aus der 3D-gedruckten Kammer mit Hilfe eines Spatels und Platzieren in einer 24-Well-Platte vor der weiteren Verarbeitung (M,N,O) Entfernen des polymerisierten Kollagen-Agar-Gels mit den RCC-Zellen mit Hilfe eines Spatels, und legen Sie sie vor der Weiterverarbeitung in eine 24-Well-Platte Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Aufbau des mikrofluidischen Kultursystems. (A,B) Öffnen der Kulturkammern des Humimic-Chips2 mit einem speziellen Werkzeug (C) Nachdem Sie das zum Waschen des Chips verwendete Nährmedium entfernt haben, fügen Sie 400 μl frisches Kulturmedium hinzu. (D,E) Nach der Entnahme der Nieren- und RCC-Gele von den jeweiligen 24-Well-Platten wird jedes Gel mit Spateln in das Kulturfach eines einzelnen Perfusionskreislaufs des Humimic-Chips gelegt, um die Gele zu handhaben. (F,G) Nach dem Positionieren der Gele im Chip werden die Kulturkammern versiegelt und der Chip wird über drei Mikropumpen in jedem mikrofluidischen Kreislauf, die durch spezielle Schläuche verbunden sind, mit der Perfusionseinheit verbunden. (H) Die Chips werden für die Dauer der Kulturperiode in den Inkubator gelegt . (I) Perfusionsparameter, die in der Steuereinheit eingestellt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Injektion von RPTEC/TERT1-Zellen
- Injektion von RPTEC/TERT1-Zellen
- RPTEC/TERT1-Zellen werden aus ihren Kulturflaschen gelöst, indem 1x Trypsin-EDTA hinzugefügt und bei 37 °C inkubiert wird, bis sich die Zellen ablösen.
- Neutralisieren Sie das 1x Trypsin, indem Sie ein gleiches Volumen Kulturmedium mit Nahrungsergänzungsmitteln hinzufügen. Die Zellsuspension auffangen und bei 2.500 × g 5 min zentrifugieren.
- Der Überstand wird verworfen und die Zellpellets in frischem Kulturmedium auf eine Endkonzentration von 1 × 106 Zellen/ml (RPTEC/TERT1) resuspendiert. Stellen Sie sicher, dass die Zellsuspension gründlich gemischt und frei von Klumpen ist, bevor Sie sie in die Kammer laden.
- Laden Sie 10 μl der vorbereiteten Zellsuspension in eine Mikropipette mit einer 10-μl-Spitze. Stellen Sie sicher, dass die Pipette sterilisiert und für die Handhabung von Zellen geeignet ist. Die Zellsuspension wird vorsichtig durch das Zellkompartiment in der Kammer in das verfestigte Kollagen (Schritt 1.2.4) injiziert.
- Entfernen Sie das Filament vorsichtig mit einer Pinzette, so dass die Zellen die hohle röhrenförmige Struktur innerhalb der Matrix bevölkern können
HINWEIS: Stellen Sie sicher, dass die Zellen gleichmäßig im Gel verteilt sind. Vermeiden Sie das Einbringen von Luftblasen während der Injektion, da diese die Zellverteilung und die Integrität des Gels stören können. - Stellen Sie die Kammern in einen 37 °C heißen Inkubator mit 5 % CO2 . Geben Sie nach 60 Minuten 150 μl Zellmedium auf die Oberseite der Matrix, um ein Austrocknen zu vermeiden. 24 Stunden inkubieren, damit sich die Zellen akklimatisieren und in die Gelmatrix integrieren können.
- Entfernen Sie am nächsten Tag die Matrize mit einem Spatel aus der Kammer. Legen Sie die 3D-Matrizen mit den Zellen in eine 24-Well-Platte mit 1.000 μl Kulturmedium und inkubieren Sie sie bei 37 °C mit 5 % CO2.
HINWEIS: Die Gele, die entweder mit dem rekonstruierten Nierentubuli und den eingebetteten RCC-Sphäroiden hergestellt wurden, werden dem Mikrofluidsystem für die Co-Kultur zugesetzt
3. Perfusion von 3D-Zellproben
- 3D-Zellperfusion im Multiorgan-Chip-System
- Verbinden Sie den Chip mit der 3D-Zelle mit dem Perfusionssystem über einen Schlauch.
- Stellen Sie das System ein: Frequenz: 0,25 Hz, Vakuum: -220 mbar, Druck: 800 mbar und verbinden Sie Chip 2 mit dem System (Abbildung 3).
- Kultivieren Sie die dynamische 3D-Zellkultur 5 Tage lang in einem Inkubator bei 37 °C mit 5% CO2.
4. 3D von Zellproben nach der Perfusionsentnahme
- Entnahme und Analyse nach der Perfusion
- Nehmen Sie die Gele aus dem Perfusionssystem und spülen Sie sie mit PBS aus.
- Fixieren Sie die Gele, indem Sie die Proben für 2-3 h bei Raumtemperatur in 2%iges Paraformaldehyd legen. Fixierte Proben bei 4 ºC lagern.
- Färben Sie die Gele mit Farbstoffen (z. B. Hoechst33342, Phalloidin, ZO1, Tubulin).
- Nach 5-tägiger Perfusion mit dem Multi-Organ-Chip-System wurden verschiedene Assays und Methoden an den 3D-Zellkulturen und gesammelten Medien durchgeführt, um die Lebensfähigkeit der Zellen, die Morphologie, die Genexpressionsniveaus und die funktionellen Anpassungen zu beurteilen. Die RPTEC/TERT1-Zellen in der Kollagen-Gel-Matrix und die Caki-1-Zellen in der Kollagen-Agarose-Matrix behalten eine hohe Lebensfähigkeit bei; Bestätigen Sie dies mit Viabilitätsassays wie Lebend-/Totfärbung.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Das HUMIMIC-System bietet eine dynamische Umgebung, die eine kontinuierliche Nährstoff- und Sauerstoffversorgung ermöglicht und gleichzeitig Stoffwechselabfälle entfernt, wodurch die Lebensfähigkeit und Funktion der Zellen über längere Zeiträume erhalten bleibt. Diese Systeme sind besonders vorteilhaft für die Erstellung komplexer Organ-on-a-Chip-Modelle, die die Mikroumgebung bestimmter Gewebe nachbilden. Es wurde speziell für Organ-on-a-Chip-Anwendungen entwickelt und ermögli...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Das in dieser Studie beschriebene Protokoll stellt die Entwicklung eines komplexen Nierenkrebsmodells dar, das die Integration von zwei unterschiedlichen Zelltypen - renale proximale tubuläre Epithelzellen (RPTEC/TERT1) und Nierenzellkarzinomzellen (Caki-1) - in spezifische Kollagen- und Kollagen-Agarose-Gel-Matrizen in einem mikrofluidischen System nutzt. Die Zubereitung von Kollagengelen ist entscheidend für den Erfolg dieses Modells. Die genaue Konzentration von Kollagen und Agarose...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Maryna Somova wurde gefördert durch das Promotionsstipendium der Universität Greifswald - Landesgraduiertenförderungsgesetz des Landes Mecklenburg-Vorpommern. Die Autoren danken Dr. Janosh Schoon und Dirk Stobe vom Zentrum für Orthopädie, Unfallchirurgie und Rehabilitationsmedizin der Universitätsmedizin Greifswald für ihre Einblicke in die 3D-Zellkultur und Probenvorbereitung.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.5-2.0 mL tubes | Eppendorf | 003012/10237-20205 | |
| 24-well plates | Sarstedt | 83.3922.500 | |
| 3D printer | Prusa | ||
| Agarose | Carl Roth | 3810.3 | |
| AutoDesk Tinker CAD software | computer-assisted design software | ||
| Caki-1 cells | ATCC | HTB-46 | |
| Caspase activity | Promega | G8090 | Caspase 3/7 assay |
| Cell viability | Promega | G7570 | Cell Titer Glo assay |
| Collagen Type I – rat tail, 3.0 mg/mL | Corning | 354236 | |
| DMEM/12F Medium | PAN Biotech | PO4-41650 | |
| DPBS solution | PAN Biotech | P04-53500 | |
| Epidermal Growth Factor | Merck | E4127 | |
| Fetal Calf Serum | PAN Biotech | P30-3033 | |
| Genipin (30 mM) | Merck | G4796 | |
| HUMIMIC chips 2 | TissUse | multi-organ chips | |
| HUMIMIC control unit | TissUse | multi-organ chip control unit | |
| Hydrocortisone | Merck | H6909 | |
| Incubator (37 °C, 5% CO2) | nd | ||
| Insulin,Sodium selenite,Transferrin (IST) | Merck | I1884 | |
| LDH release | Promega | J2380 | |
| Metal spatula | nd | ||
| NaOH (1 M) | Carl Roth | P031.2 | |
| Petri dishes | Sarstedt | 82.1135.500 | |
| Polypropylene (PP) filament | Verbatin | 55952 | |
| RNA-easy extraction kit | Qiagen | 74104 | |
| RPTEC/TERT cells | ATCC | CRL - 4031 | |
| TNF-alfa ELISA | R&D Systems | DY210-05 | |
| Triiodothyronine (T3 ) | Merck | 709611 | |
| Trypsin-EDTA | PAN Biotech | P10-021100 |
Referenzen
- Ainslie, G. R., et al. Microphysiological lung models to evaluate the safety of new pharmaceutical modalities: A biopharmaceutical perspective. Lab Chip. 19 (19), 3152-3161 (2019).
- Van Ness, K. P., et al. Microphysiological systems to assess nonclinical toxicity. Curr Protoc Toxicol. 73, 14.18.1-14.18.28 (2017).
- Majo, S., et al. Impact of extracellular matrix components to renal cell carcinoma behavior. Front Oncol. 10, 625(2020).
- Caetano-Pinto, P., et al. Epidermal growth factor receptor mediates the basolateral uptake of phosphorothioate-modified antisense oligonucleotides in the kidney. Organs-on-a-Chip. 4, 100022(2022).
- Manduca, N., et al. 3D cancer models: One step closer to in vitro human studies. Front Immunol. 14, 1175503(2023).
- Simon, B. R., et al. The RPTEC/TERT1 cell line models key renal cell responses to the environmental toxicants, benzo[a]pyrene and cadmium. Toxicol Rep. 1, 231-242 (2014).
- Ogura, T., et al. Methods of high integrity RNA extraction from cell/agarose construct. BMC Res Notes. 8, 644(2015).
- Glube, N., et al. Caki-1 cells represent an in vitro model system for studying the human proximal tubule epithelium. Nephron Exp Nephrol. 107 (2), e47-e56 (2007).
- Kühnl, J., et al. Characterization of application scenario-dependent pharmacokinetics and pharmacodynamic properties of permethrin and hyperforin in a dynamic skin and liver multi-organ-chip model. Toxicology. 448, 152637(2021).
- Padmyastuti, A., et al. Microfluidic-based prostate cancer model for investigating the secretion of prostate-specific antigen and microRNAs in vitro. Sci Rep. 13 (1), 11623(2023).
- Zhang, X., et al. Cancer-on-a-Chip: Models for studying metastasis. Cancers (Basel). 14 (3), 648(2022).
- Sobczuk, P., et al. Choosing the right animal model for renal cancer research. Transl Oncol. 13 (3), 100745(2020).
- Ewart, L., et al. Performance assessment and economic analysis of a human Liver-Chip for predictive toxicology. Commun Med. 2 (1), 154(2022).
- Caetano-Pinto, P., et al. Kidney cancer and chronic kidney disease: Too close for comfort. Biomedicines. 9 (12), 1761(2021).
- Del Piccolo, N., et al. Tumor-on-chip modeling of organ-specific cancer and metastasis. Adv Drug Deliv Rev. 175, 113798(2021).
- Soo, J. Y. C., et al. Advances in predictive in vitro models of drug-induced nephrotoxicity. Nat Rev Nephrol. 14 (6), 378-393 (2018).
- Chapron, A., et al. An improved vascularized, dual-channel microphysiological system facilitates modeling of proximal tubular solute secretion. ACS Pharmacol Transl Sci. 3 (3), 496-508 (2020).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten