A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
תרבית משותפת מיקרופלואידית של אפיתל כליות בריא וגידול למודל התקדמות סרטן הכליה
In This Article
Summary
במאמר זה אנו מציגים פרוטוקולים המפרטים הוראות ליישום תרביות תאים תלת-ממדיות באמצעות מטריצות קולגן וקולגן-אגרוז במערכת מיקרופיזיולוגית. פרוטוקולים אלה תומכים בתרבית משותפת של צינורית הכליה הפרוקסימלית וקרצינומה של תאי הכליה, המדמים תנאי in vivo ומאפשרים חקירה מתקדמת של אינטראקציות בין תאי סרטן הכליה.
Abstract
מערכות מיקרופיזיולוגיות (MPS) אפשרו הכנסת אלמנטים פיזיולוגיים מורכבים ורלוונטיים יותר למודלים במבחנה , תוך יצירת תכונות מורפולוגיות מורכבות בסביבות תלת-ממדיות עם אינטראקציות דינמיות חסרות במודלים קונבנציונליים. יישמנו מודל של תרבית משותפת של קרצינומה של תאי הכליה (RCC) כדי ליצור מחדש את הדיבור הצולב, בין רקמת כליות בריאה וממאירה.
מודל זה מבוסס על הפלטפורמה הרב-איברית הנזכרת ומורכב מגידול משותף של צינורית פרוקסימלית כלייתית משוחזרת עם ספרואידים RCC. תאים מודפסים בתלת-ממד שתוכננו במיוחד שימשו לתרבית תאי צינורית פרוקסימליים אפיתליאליים אנושיים (RPTEC) ולהקל על הרכבתם העצמית לצינורית כליה הכלולה במטריצת קולגן מסוג I. תאי RCC Caki-1 הוטמעו במטריצת קולגן אגר, ויצרו לאחר מכן ספרואידים סרטניים. גם קולגן וגם ג'ל אגר/קולגן עברו אופטימיזציה כדי לשמור על שלמותם במהלך זילוח מחזורי ולעמוד בסטרס של גזירה במהלך תקופת תרבית מינימלית של 7 ימים.
הג'לים מאפשרים גם אספקה מספקת של חומרים מזינים והפרשות תאים. יתר על כן, ג'ל אגר/קולגן מגביל את ריבוי היתר של תאי RCC, ומבטיח גודל ספרואידי הומוגני יחסית. המעגלים המיקרופלואידים של שבב MPS מורכבים משני תאי תרבית עצמאיים בגודל של באר סטנדרטית של 96 מיקרו-פלטות. צינורית הכליה וג'ל RCC מאכלסים חדרים נפרדים וחולקים את אותה תרבית, אשר ממוחזרת בערך פעמיים בדקה. בתנאים אלה נצפתה עלייה בוויסות של ביטוי והפרשת גורמים חיסוניים בצינוריות הכליה (אינטרלוקין-8 וגורם נמק גידולי-אלפא). צינוריות הכליה גם מעבירות את הפעילות המטבולית שלהן לכיוון גליקוליזה בהשפעת RCC. גישה חדשנית זו מדגימה כי MPS מבוסס תרבות משותפת יכול להגביר את המורכבות של RCC במבחנה ולשמש לחקר ההשפעה של סרטן על תאים שאינם סרטניים.
Introduction
ההתקדמות במערכות תרביות תאים תלת-ממדיות חוללה מהפכה בהנדסת רקמות וברפואה רגנרטיבית בכך שהיא מציעה מודלים רלוונטיים יותר מבחינה פיזיולוגית בהשוואה לתרביות דו-ממדיות מסורתיות 1,2. במחקר זה השתמשנו במטריצות ג'ל של קולגן וקולגן-אגרוז, בהתחשב ביכולתן לחקות את סביבת המטריצה החוץ תאית (ECM), לקדם התנהגות ותפקוד תאיים מדויקים יותר, תוך התאמה לתנאי התרבית הדינמיים שבהם נעשה שימוש.
קולגן, החלבון הנפוץ ביותר ב-ECM, ממלא תפקיד מכריע בשמירה על שלמות המבנה והפעילות הביולוגית של רקמות3. קולגן מסוג I, שמקורו בדרך כלל בזנב חולדה, הועדף בשל התאימות הביולוגית שלו ויכולתו להיות מותאם לתנאי קשיחות מטריצה שונים, כמו גם לספק מצע מוכח לתאי אפיתל4. במטריצת הקולגן התלת-ממדית, תאי הכליה מקבלים פיגום התומך בהידבקותם, שגשוגם והתמיינותם. סביבה זו מאפשרת לתאים להציג מורפולוגיות והתנהגויות טבעיות יותר, כולל דפוסי ביטוי גנים ואינטראקציות תאיות המשקפות בתנאי in vivo 5. כתוצאה מכך, ג'ל קולגן נמצא בשימוש נרחב ביישומים החל ממחקר סרטן ועד הנדסת רקמות בשל יכולתם לשכפל את התפקידים התומכים והרגולטוריים של ECM.
קו תאי האפיתל הצינורי הפרוקסימלי המונצח RPTEC/TERT1 שימש לייצוג אפיתל כליות בריא. קו תאים זה מבטא יתר על המידה את התעתיק ההפוך של הטלומראז האנושי, ומאפשר לו להתרבות בתרבית, תוך שמירה על פנוטיפ RPTEC מייצג. מטריצת ג'ל קולגן מסוג I של זנב חולדה שימשה ליצירת המיקרו-סביבה הכלייתית. מטריצת ג'ל קולגן זו תומכת בתאי RPTEC/TERT16 בשמירה על המאפיינים והתפקודים הפיזיולוגיים המקוריים שלהם. לעומת זאת, מטריצת ג'ל קולגן-אגרוז היברידית משמשת לגידול תאי קרצינומה של תאי הכליה (Caki-1). אגרוז, רב-סוכר המופק מאצות, מוסיף ממד נוסף למערכות תרביות תאים תלת-ממדיות. הוא הפיך מבחינה תרמית, ומאפשר טיפול ומניפולציה קלים בתהליך ההכנה7. ג'ל אגרוז מספק מטריצה תומכת ניטרלית השומרת על כדאיות התא ומקדמת היווצרות מבנים מורכבים על ידי התרבות תאים סרטניים. בשילוב עם קולגן, הג'ל ההיברידי שנוצר ממנף את הרמזים הביוכימיים מקולגן ואת התמיכה המבנית מאגרוז. שילוב זה יוצר מיקרו-סביבה מתאימה לקרצינומה של תאי הכליה (RCC) Caki-1 cells8 לגדילה לספרואידים ומשמש כמודל סרטן הכליה.
השימוש במטריצות תלת-ממדיות שונות אלה עבור תאי RPTEC/TERT1 ו-Caki-1 מדגיש את החשיבות של התאמת סביבת ECM לצרכים הספציפיים של סוגי תאים שונים. הג'לים המרכיבים RPTEC, המייצג אפיתל כליות בריא, או תאי Caki-1, המייצגים RCC, שולבו במערכת מיקרופלואידית הממחזרת את אמצעי התרבית בין התאים, ובכך חושפת למעשה את מודל תאי הכליה הבריאים להפרשות של RCC, ללא מגע ישיר. פלטפורמת TissUse HUMUMIC 9,10 (להלן פלטפורמת השבבים הרב-איברים) ששימשה במחקר זה מורכבת משבב מיקרופיזיולוגי בעל שני מעגלים זורמים בלתי תלויים, עם זרימה המונעת על ידי יחידת זילוח חיצונית.
Access restricted. Please log in or start a trial to view this content.
Protocol
הערה: פרוטוקולים אלה מתארים את השלבים המקיפים להכנת ג'ל קולגן-אגרוז תלת-ממדי, הזרקת תאים, חילול הדגימות וחילוצן לניתוח נוסף. התאמת זמני הדגירה ותנאי הדגירה בהתבסס על דרישות ניסוי ספציפיות.
1. הכנת מטריצת ג'ל קולגן ואגרוז
- הדפסה תלת מימדית
הערה: כדי ליצור את הצורה המתאימה למטריצת הג'ל, פיתחנו עיצוב תא ייחודי המעצב את הג'ל לצורת אורגנואיד רלוונטית מבחינה פיזיולוגית (ראה קובץ משלים 1).- עצבו את התאים באמצעות תוכנת תכנון בעזרת מחשב. התא מורכב מארבעה תאים מקבילים: שני תאי תאים, תא מטריצה אחד ותעלה מקשרת (איור 1 ואיור 2).
- לבנות את התאים על ידי הדפסה תלת מימדית; פיית חימום ממיסה חוט להט ביופלסטי ושוקעת שכבה אחר שכבה. כדי לעקוב אחר פרוטוקול זה, השתמש בפוליפרופילן (PP), חוט להט ביופלסטי לא רעיל, ובמדפסת תלת-ממד מסוג קרטזית, הקרויה על שם מערכת הקואורדינטות XYZ.
- הוסף תכונת צורת חרוט הפוך לתאי התאים כדי לכוון תאים לתעלה.
- תנו צורה עגולה לתא המטריצה, שהיא חיונית ליצירת ג'ל קולגן.
- חברו את תאי התא והמטריצה באמצעות תעלה (קוטר 0.04 מ"מ, איור 3B), המאפשרת לתאים לזרום מתא התא אל תא המטריצה ולהתחבר למשטח הצינור.
- הכנת מטריצת קולגן לטיפוח תאי RPTEC-TERT1
הערה: הליך זה מבטיח כי מטריצת הקולגן מוכנה כראוי ונטענת לתוך התא, יצירת סביבה מתאימה להזרקה וטיפוח הבאים של תאי RPTEC/TERT1 ולצמיחת מבנה התא התלת-ממדי. ודא שכל השלבים מבוצעים בתנאים סטריליים כדי למנוע זיהום.- הכן את תמיסת הקרוסלינקינג על ידי ערבוב 50 μL של Genipin (30 mM) עם 50 μL של NaOH (1 M) באמצעות מערבולת כדי להבטיח ערבוב יסודי.
- הוסיפו 1,000 מיקרוליטר של קולגן מסוג I לתמיסת Genipin ו-NaOH המוכנה תוך שמירה על התערובת על קרח כדי למנוע ג'לציה מוקדמת. מערבבים את התמיסה שוב באמצעות מערבולת כדי להשיג תערובת הומוגנית.
הערה: יש לשמור את התמיסה המעורבת על קרח ברציפות כדי למנוע ג'לציה מוקדמת. - בעזרת קצה פיפטה של 1,000 μL, אספו את כל התמיסה שהוכנה והוסיפו 150-200 μL של התמיסה לתא המטריצה של התא המודפס בתלת-ממד.
- תן למטריצה להתפלמר על ידי שמירה על התא באינקובטור CO2 ב 37 מעלות צלזיוס למשך 60-90 דקות. מוסיפים 150 מיקרוליטר מדיום תרבית בחלק העליון של המטריצה ומשאירים אותו לילה באינקובטור.
- הכנת מטריצת קולגן-אגרוז והטבעה של תאי Caki-1
הערה: שני תאי RPTEC/TERT1 ותאי Caki-1 גודלו בתרבית באמצעות אותו מדיום תרבית, המורכב ממדיה DMEM F-12 עתירת גלוקוז בתוספת ITS (10 מיקרוגרם/מ"ל אינסולין, 5.5 מיקרוגרם/מ"ל טרנספרין ו-5 נ"ג/מ"ל נתרן סלניט), 10 נ"ג/מ"ל גורם גדילה אפידרמלי (EGF), 36 נ"ג/מ"ל הידרוקורטיזון, 100 U/מ"ל פניצילין, 100 מיקרוגרם/מ"ל סטרפטומיצין (5% v/v), ו-10% (v/v) סרום עגל עוברי (FCS).- יש להמיס אבקת אגרוז במים סטריליים או DPBS כדי להגיע לריכוז סופי של 2%. הניחו את תמיסת האגרוז על בלוק חימום המוגדר לטמפרטורה של 85 מעלות צלזיוס כדי להבטיח המסה מלאה.
הערה: טפל בתמיסת האגרוז בזהירות בשל רגישותה לטמפרטורה.
- יש להמיס אבקת אגרוז במים סטריליים או DPBS כדי להגיע לריכוז סופי של 2%. הניחו את תמיסת האגרוז על בלוק חימום המוגדר לטמפרטורה של 85 מעלות צלזיוס כדי להבטיח המסה מלאה.
- הטבעה של תאי Caki-1
- נתקו תאי Caki-1 מצלוחיות התרבית שלהם על ידי הוספת טריפסין-EDTA 1x ודגירה בטמפרטורה של 37°C עד שהתאים יתנתקו. נטרל את 1x טריפסין על ידי הוספת נפח שווה של מדיום תרבית.
- אספו את תרחיף התא, ספרו תאים וצנטריפוגה במהירות של 2,500 × גרם למשך 5 דקות. יש להשליך את הסופרנאטנט ולהשהות מחדש את כדורי התא בתווך תרבית טרי לריכוז סופי של 1 × 103 תאים/מ"ל (Caki-1).
הערה: ודא שמתלה התא מעורבב היטב וללא גושים לפני הטעינה לתא. - הוסף 25 μL של תרחיף תאים לתוך צינור מיקרוצנטריפוגה 1.5 מ"ל.
הערה: יש לוודא שהמזרק או הפיפטה מעוקרים ומתאימים לטיפול בתאים. - הוסף 75 μL של קולגן מסוג I לתוך הצינור עם תרחיף התא מערבולת.
הערה: יש לשמור את התערובת על קרח ברציפות כדי למנוע ג'לציה מוקדמת. - מוסיפים 100 μL של ג'ל אגרוז מומס 2% ומערבבים בזהירות על מערבולת עד שהג'ל הופך הומוגני.
הערה: ודא פיזור אחיד של התאים בתוך הג'ל. הימנעו מהחדרת בועות אוויר במהלך ההזרקה, מכיוון שהן עלולות לשבש את פיזור התאים ואת שלמות הג'ל! - לאחר 1 שעות, להוסיף 150 μL של מדיה התא בחלק העליון של המטריצה ולהסיר אותו מן החדר באמצעות מרית. מניחים את המטריצות התלת-ממדיות עם התאים בצלחת של 24 בארות עם 1,000 מיקרוליטר של מדיום תרבית ודגרו בטמפרטורה של 37°C, 5% CO2.
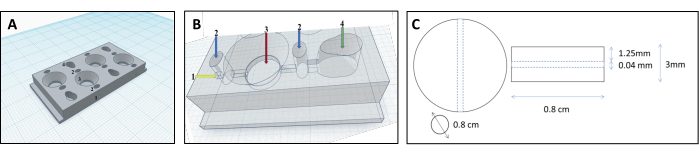
איור 1: עיצוב תא מודפס בתלת-ממד לשחזור צינוריות כליות. (A,B) ייצוג של התא המודפס בתלת-ממד שתוכנן להכיל מטריצת קולגן מוצלבת לשחזור צינוריות כליות. כל תא מורכב מארבעה תאים נפרדים, המשמשים לייצור כמות שווה של ג'לים. 1-נקודת החדרה לחוט הלהט, 2-קדם-תאים למילוי אגר רק למניעת דליפות, תא 3-קולגן, תא 4 תאים. (C) מידות של ג'ל הקולגן הצולבות וצינורית הכליה המשובצת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: הכנת קולגן וג'ל אגר-קולגן. (A) תא מודפס תלת-ממדי עם חוטים מוכנסים. (B) תמיסת הקולגן הצולבת מופצת בבארות התא (C) תא מלא בתמיסת קולגן ממוקם באינקובטור כדי להקל על פילמור המטריקס (D) איסוף תאי RPTEC-TERT1 לפני הזרקה למטריצת הקולגן (E) הוספת תרחיף התא תא התא של התא (F) הסרת חוט הלהט בעזרת מלקחיים, המאפשר לתאים לאכלס את המבנה הצינורי החלול בתוך המטריצה (G) תרחיף של תאי RCC מעורבבים עם קולגן בצינור 1.5 מ"ל (H) הוספת תמיסת אגר 2% לתאים ליצירת ג'ל RCC. (I) הג'לים ממוקמים באינקובטור כדי להקל על ג'לציה מטריצה (J,K,L) הסרת ג'ל הקולגן הפולימרי עם צינוריות הכליה מהתא המודפס בתלת מימד בעזרת מרית, והנחתן בצלחת של 24 בארות לפני עיבוד נוסף (M,N,O) הסרת ג'ל קולגן-אגר פולימרי עם תאי RCC בעזרת מרית, והנחתם בצלחת של 24 בארות לפני עיבוד נוסף לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: הרכבה של מערכת התרבית המיקרופלואידית. (A,B) פתיחת תאי התרבית של השבב ההומימי2 באמצעות כלי ייעודי (C) לאחר הסרת אמצעי התרבית המשמש לשטיפת השבב, יש להוסיף 400 מיקרוליטר של מצע תרבית טרי. (ד,ה) לאחר הסרת ג'ל הכליה וג'ל RCC מ -24 צלחות הבאר המתאימות, מניחים כל ג'ל בתא התרבית של מעגל זילוח יחיד של השבב ההומימי, באמצעות מריות לטיפול בג'לים. (ו,ז) לאחר מיקום הג'לים בשבב, תאי התרבית נאטמים, והשבב מחובר ליחידת הזילוח באמצעות שלוש משאבות מיקרו בכל מעגל מיקרופלואידי, המחוברות על ידי צינורות מיוחדים. (ח) השבבים ממוקמים באינקובטור למשך תקופת התרבית (I) פרמטרי זילוח שנקבעו ביחידת הבקרה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. הזרקת תאי RPTEC/TERT1
- הזרקת תאי RPTEC/TERT1
- נתקו תאי RPTEC/TERT1 מצלוחיות התרבית שלהם על ידי הוספת טריפסין-EDTA 1x ודגירה בטמפרטורה של 37°C עד שהתאים יתנתקו.
- נטרל את 1x טריפסין על ידי הוספת נפח שווה של מדיום תרבית עם תוספים. אספו את מתלה התא והצנטריפוגה במהירות של 2,500 × למשך 5 דקות.
- יש להשליך את הסופרנאטנט ולהשהות מחדש את כדורי התא בתווך תרבית טרי לריכוז סופי של 1 × 106 תאים/מ"ל (RPTEC/TERT1). ודא שמתלה התא מעורבב היטב וללא גושים לפני ההעמסה לתא.
- טען 10 μL של תרחיף התא מוכן לתוך מיקרו פיפטה עם קצה 10μL. יש לוודא שהפיפטה מעוקרת ומתאימה לטיפול בתאים. הזריקו בזהירות את תרחיף התא לקולגן המוצק (שלב 1.2.4) דרך תא התא בתוך התא.
- הסר בעדינות את חוט הלהט באמצעות מלקחיים, המאפשר לתאים לאכלס את המבנה הצינורי החלול בתוך המטריצה
הערה: ודא פיזור אחיד של התאים בתוך הג'ל. הימנע מהחדרת בועות אוויר במהלך ההזרקה, מכיוון שהן עלולות לשבש את פיזור התאים ואת שלמות הג'ל. - מניחים את התאים באינקובטור 37°C, 5% CO2 . לאחר 60 דקות, הוסף 150 μL של מדיה סלולרית בחלק העליון של המטריצה כדי למנוע התייבשות. יש לדגור במשך 24 שעות כדי לאפשר לתאים להתאקלם ולהשתלב במטריצת הג'ל.
- למחרת, הסר את המטריצה מהחדר באמצעות מרית. מניחים את המטריצות התלת-ממדיות עם התאים בצלחת של 24 בארות עם 1,000 מיקרוליטר של מדיום תרבית ודגרו בטמפרטורה של 37°C עם 5% CO2.
הערה: הג'לים שהוכנו עם צינורית הכליה המשוחזרת וכדורי RCC המשובצים יתווספו למערכת המיקרו-נוזלים לתרבית משותפת
3. זילוח של דגימות תאים תלת ממדיות
- זילוח תאים תלת-ממדי במערכת השבבים מרובת האיברים
- חבר את השבב עם התא התלת-ממדי למערכת הזילוח באמצעות צינורות.
- הגדר את המערכת: תדר: 0.25 הרץ, ואקום: -220 mbar, לחץ: 800 mbar, וחבר שבב 2 למערכת (איור 3).
- טפח את תרבית התאים התלת-ממדית הדינמית במשך 5 ימים באינקובטור בטמפרטורה של 37°C עם 5% CO2.
4. 3D דגימות תאים לאחר איסוף זילוח
- איסוף וניתוח זילוח לאחר זילוח
- הסר את הג'לים ממערכת הזילוח ושטוף אותם עם PBS.
- תקן את הג'לים על ידי הנחת הדגימות ב 2% paraformaldehyde במשך 2-3 שעות בטמפרטורת החדר. אחסן דגימות קבועות ב 4 מעלות צלזיוס.
- מכתימים את הג'לים בצבעים (למשל, Hoechst33342, phalloidin, ZO1, tubulin).
- לאחר 5 ימים של זילוח באמצעות מערכת השבבים הרב-איברים, בוצעו בדיקות ושיטות שונות על תרביות התאים התלת-ממדיות ונאספו מדיה כדי להעריך את כדאיות התא, מורפולוגיה, רמות ביטוי גנים והתאמות תפקודיות. תאי RPTEC/TERT1 במטריצת ג'ל הקולגן ותאי Caki-1 במטריצת קולגן-אגרוז שומרים על כדאיות גבוהה; אשר זאת באמצעות מבחני כדאיות כגון כתמים חיים/מתים.
Access restricted. Please log in or start a trial to view this content.
תוצאות
מערכת HUMIMIC מספקת סביבה דינמית המאפשרת אספקת חומרים מזינים וחמצן רציפה תוך סילוק פסולת מטבולית, ובכך שומרת על קיום התאים ותפקודם לאורך זמן. מערכות אלה מועילות במיוחד ליצירת מודלים מורכבים של איבר על שבב המשכפלים את המיקרו-סביבה של רקמות ספציפיות. הוא תוכנן במיוחד עבור יי?...
Access restricted. Please log in or start a trial to view this content.
Discussion
הפרוטוקול המתואר במחקר זה מייצג פיתוח של מודל סרטן כליות מורכב, הממנף את השילוב של שני סוגי תאים נפרדים - תאי אפיתל צינוריים פרוקסימליים כלייתיים (RPTEC/TERT1) וקרצינומה של תאי הכליה (Caki-1) - בתוך מטריצות קולגן וג'ל קולגן-אגרוז ספציפיות במערכת מיקרופלואידית. הכנת ג'ל קולגן היא קר...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין ניגודי עניינים להצהיר.
Acknowledgements
מרינה סומובה נתמכה על ידי מלגת הדוקטורט של אוניברסיטת גרייפסוואלד - Landesgraduiertenförderungsgesetzes (חוק על מימון בוגר המדינה) של מקלנבורג-וורפומרן. המחברים רוצים להודות לד"ר יאנוש שון ודירק סטוב מהמרכז לאורתופדיה, ניתוחי טראומה ורפואת שיקום, הרפואה האוניברסיטאית גרייפסוואלד על תובנותיהם בתרבית תאים תלת-ממדית ובהכנת דגימות.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5-2.0 mL tubes | Eppendorf | 003012/10237-20205 | |
| 24-well plates | Sarstedt | 83.3922.500 | |
| 3D printer | Prusa | ||
| Agarose | Carl Roth | 3810.3 | |
| AutoDesk Tinker CAD software | computer-assisted design software | ||
| Caki-1 cells | ATCC | HTB-46 | |
| Caspase activity | Promega | G8090 | Caspase 3/7 assay |
| Cell viability | Promega | G7570 | Cell Titer Glo assay |
| Collagen Type I – rat tail, 3.0 mg/mL | Corning | 354236 | |
| DMEM/12F Medium | PAN Biotech | PO4-41650 | |
| DPBS solution | PAN Biotech | P04-53500 | |
| Epidermal Growth Factor | Merck | E4127 | |
| Fetal Calf Serum | PAN Biotech | P30-3033 | |
| Genipin (30 mM) | Merck | G4796 | |
| HUMIMIC chips 2 | TissUse | multi-organ chips | |
| HUMIMIC control unit | TissUse | multi-organ chip control unit | |
| Hydrocortisone | Merck | H6909 | |
| Incubator (37 °C, 5% CO2) | nd | ||
| Insulin,Sodium selenite,Transferrin (IST) | Merck | I1884 | |
| LDH release | Promega | J2380 | |
| Metal spatula | nd | ||
| NaOH (1 M) | Carl Roth | P031.2 | |
| Petri dishes | Sarstedt | 82.1135.500 | |
| Polypropylene (PP) filament | Verbatin | 55952 | |
| RNA-easy extraction kit | Qiagen | 74104 | |
| RPTEC/TERT cells | ATCC | CRL - 4031 | |
| TNF-alfa ELISA | R&D Systems | DY210-05 | |
| Triiodothyronine (T3 ) | Merck | 709611 | |
| Trypsin-EDTA | PAN Biotech | P10-021100 |
References
- Ainslie, G. R., et al. Microphysiological lung models to evaluate the safety of new pharmaceutical modalities: A biopharmaceutical perspective. Lab Chip. 19 (19), 3152-3161 (2019).
- Van Ness, K. P., et al. Microphysiological systems to assess nonclinical toxicity. Curr Protoc Toxicol. 73, 14.18.1-14.18.28 (2017).
- Majo, S., et al. Impact of extracellular matrix components to renal cell carcinoma behavior. Front Oncol. 10, 625(2020).
- Caetano-Pinto, P., et al. Epidermal growth factor receptor mediates the basolateral uptake of phosphorothioate-modified antisense oligonucleotides in the kidney. Organs-on-a-Chip. 4, 100022(2022).
- Manduca, N., et al. 3D cancer models: One step closer to in vitro human studies. Front Immunol. 14, 1175503(2023).
- Simon, B. R., et al. The RPTEC/TERT1 cell line models key renal cell responses to the environmental toxicants, benzo[a]pyrene and cadmium. Toxicol Rep. 1, 231-242 (2014).
- Ogura, T., et al. Methods of high integrity RNA extraction from cell/agarose construct. BMC Res Notes. 8, 644(2015).
- Glube, N., et al. Caki-1 cells represent an in vitro model system for studying the human proximal tubule epithelium. Nephron Exp Nephrol. 107 (2), e47-e56 (2007).
- Kühnl, J., et al. Characterization of application scenario-dependent pharmacokinetics and pharmacodynamic properties of permethrin and hyperforin in a dynamic skin and liver multi-organ-chip model. Toxicology. 448, 152637(2021).
- Padmyastuti, A., et al. Microfluidic-based prostate cancer model for investigating the secretion of prostate-specific antigen and microRNAs in vitro. Sci Rep. 13 (1), 11623(2023).
- Zhang, X., et al. Cancer-on-a-Chip: Models for studying metastasis. Cancers (Basel). 14 (3), 648(2022).
- Sobczuk, P., et al. Choosing the right animal model for renal cancer research. Transl Oncol. 13 (3), 100745(2020).
- Ewart, L., et al. Performance assessment and economic analysis of a human Liver-Chip for predictive toxicology. Commun Med. 2 (1), 154(2022).
- Caetano-Pinto, P., et al. Kidney cancer and chronic kidney disease: Too close for comfort. Biomedicines. 9 (12), 1761(2021).
- Del Piccolo, N., et al. Tumor-on-chip modeling of organ-specific cancer and metastasis. Adv Drug Deliv Rev. 175, 113798(2021).
- Soo, J. Y. C., et al. Advances in predictive in vitro models of drug-induced nephrotoxicity. Nat Rev Nephrol. 14 (6), 378-393 (2018).
- Chapron, A., et al. An improved vascularized, dual-channel microphysiological system facilitates modeling of proximal tubular solute secretion. ACS Pharmacol Transl Sci. 3 (3), 496-508 (2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved