このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
腎臓癌の進行をモデル化するための腎臓健康と腫瘍上皮のマイクロ流体共培養
要約
ここでは、コラーゲンおよびコラーゲン-アガロースマトリックスを微生理学的システムに使用して3D細胞培養を実施するための手順を詳しく説明したプロトコルを紹介します。これらのプロトコルは、腎近位尿細管と腎細胞がんのスフェロイド共培養をサポートし、 in vivo 条件をシミュレートし、腎臓がん細胞の相互作用の高度な研究を可能にします。
要約
微小生理学的システム(MPS)は、より複雑で関連性の高い生理学的要素を in vitro モデルに導入することを可能にし、従来のモデルにはない動的相互作用を伴う複雑な形態学的特徴を3次元環境で再現しました。腎細胞癌(RCC)共培養モデルを導入し、健常腎組織と悪性腎組織とのクロストークを再現しました。
このモデルは、参照された多臓器プラットフォームに基づいており、再構築された腎近位尿細管をRCCスフェロイドと共培養することで構成されています。カスタム設計の3Dプリントチャンバーを使用して、ヒト腎上皮近位尿細管細胞(RPTEC)を培養し、I型コラーゲンマトリックスに含まれる腎尿細管への自己組織化を促進しました。Caki-1 RCC細胞を寒天コラーゲンマトリックスに包埋し、その後、がんスフェロイドを形成しました。コラーゲンゲルと寒天/コラーゲンゲルはどちらも、環状灌流中に完全性を維持し、最低7日間の培養期間中のせん断応力に耐えるように最適化されました。
また、ゲルは適切な栄養供給と細胞分泌を可能にします。さらに、寒天/コラーゲンゲルはRCC細胞の過剰増殖を制限し、比較的均質なスフェロイドサイズを確保します。MPSチップマイクロ流体回路は、標準的な96マイクロプレートウェルのサイズの2つの独立した培養チャンバーで構成されています。腎尿細管とRCCゲルは別々のチャンバーに存在し、同じ培地を共有し、1分間に約2回再循環されます。これらの条件下で、腎尿細管における免疫因子の発現と分泌のアップレギュレーションが観察されました(インターロイキン-8および腫瘍壊死因子-α)。また、腎尿細管は、RCCの影響下で代謝活性を解糖系にシフトします。この新しいアプローチは、共培養ベースのMPSが in vitro でRCCの複雑さを増幅し、非腫瘍細胞に対するがんの影響を研究するために使用できることを示しています。
概要
3D細胞培養システムの進歩は、従来の2D培養と比較してより生理学的に関連性の高いモデルを提供することにより、組織工学と再生医療に革命をもたらしました1,2。この研究では、コラーゲンおよびコラーゲン-アガロースゲルマトリックスを使用しましたが、その能力は細胞外マトリックス(ECM)環境を模倣し、より正確な細胞の挙動と機能を促進し、採用された動的培養条件に適合しています。
ECMに最も多く存在するタンパク質であるコラーゲンは、組織の構造的完全性と生物学的活性を維持する上で重要な役割を果たしています3。I型コラーゲンは、一般的にラットテールから供給され、その生体適合性とさまざまなマトリックス剛性条件に合わせて調整できること、また上皮細胞の基質として証明されていることから好まれました4。3Dコラーゲンマトリックスでは、腎細胞に接着、増殖、分化をサポートする足場が設けられています。この環境により、細胞は、遺伝子発現パターンやin vivo条件を反映する細胞間相互作用など、より自然な形態や振る舞いを示すことができます5。その結果、コラーゲンゲルは、ECMの支持的および調節的役割を再現する能力があるため、がん研究から組織工学に至るまでの用途で広く利用されています。
不死化された腎近位尿細管上皮細胞株RPTEC/TERT1は、健康な腎上皮を表すために使用されました。この細胞株は、ヒトテロメラーゼ逆転写酵素を過剰発現し、代表的なRPTEC表現型を維持しながら、培養中での増殖を可能にします。ラットテールコラーゲンI型ゲルマトリックスを用いて、腎臓微小環境を再現しました。このコラーゲンゲルマトリックスは、RPTEC/TERT16 細胞が本来の特性と生理機能を維持するのをサポートします。対照的に、ハイブリッドコラーゲン-アガロースゲルマトリックスは、腎細胞癌(Caki-1)細胞の培養に利用されます。海藻由来の多糖類であるアガロースは、3D細胞培養システムに新たな次元を加えます。熱可逆性であるため、調製プロセス7中の取り扱いと操作が容易になります。アガロースゲルは、細胞の生存率を維持し、がん細胞を増殖させることにより複雑な構造の形成を促進する中性支持マトリックスを提供します。コラーゲンと組み合わせると、得られたハイブリッドゲルは、コラーゲンからの生化学的手がかりとアガロースからの構造的支持体を活用します。この組み合わせは、腎細胞がん(RCC)Caki-1細胞8 がスフェロイドに増殖するのに適した微小環境を作り出し、腎臓がんモデルとして使用されます。
RPTEC/TERT1細胞とCaki-1細胞にこれらの異なる3Dマトリックスを使用することは、ECM環境を異なる細胞タイプの特定のニーズに合わせて調整することの重要性を強調しています。健康な腎上皮を表すRPTECまたはRCCを表すCaki-1細胞のいずれかを含むゲルを、細胞間で培養培地を再循環させるマイクロ流体システムに組み合わせ、直接接触することなく、健康な腎細胞モデルをRCCの分泌物に効果的にさらしました。本研究で採用したTissUse HUMUMICプラットフォーム9,10(以下、マルチオルガンチッププラットフォーム)は、2つの独立した流体回路を持つ微生物生理学チップと、外部灌流ユニットによって駆動される流れで構成されています。
Access restricted. Please log in or start a trial to view this content.
プロトコル
注:これらのプロトコルは、3Dコラーゲン-アガロースゲルの調製、細胞の注入、サンプルの灌流、およびさらなる分析のための抽出のための包括的な手順を概説しています。インキュベーション時間と条件は、特定の実験要件に基づいて調整します。
1. コラーゲンとアガロースゲルマトリックスの調製
- 3Dプリンティング
注:ゲルマトリックスに適切な形状を作成するために、ゲルを生理学的に適切なオルガノイド形状に成形する独自のチャンバー設計を開発しました( 補足ファイル1を参照)。- コンピュータ支援設計ソフトウェアを使用してチャンバーを設計します。チャンバーは、2つのセルコンパートメント、1つのマトリックスコンパートメント、および接続管の4つの平行なコンパートメントで構成されています(図1 および 図2)。
- 3Dプリントでチャンバーを構築します。加熱ノズルはバイオプラスチックフィラメントを溶かし、層ごとに堆積します。このプロトコルに従うには、ポリプロピレン(PP)、無毒のバイオプラスチックフィラメント、およびXYZ座標系にちなんで名付けられたデカルト型3Dプリンターを使用します。
- 細胞コンパートメントに逆円錐形の特徴を追加して、細胞を管に向けます。
- マトリックスコンパートメントに丸い形を与えることは、コラーゲンゲルの形成に重要です。
- 細胞とマトリックスコンパートメントを管(直径0.04mm、 図3B)で接続し、細胞が細胞コンパートメントからマトリックスコンパートメントに流れ込み、チューブ表面に付着できるようにします。
- RPTEC-TERT1細胞培養のためのコラーゲンマトリックスの調製
注:この手順により、コラーゲンマトリックスが正しく調製され、チャンバーにロードされることが保証され、その後のRPTEC/TERT1細胞の注入と培養、および3D細胞構造の増殖に適した環境が作り出されます。汚染を避けるために、すべてのステップが無菌条件下で行われることを確認してください。- 架橋溶液を調製するには、50 μLのGenipin(30 mM)と50 μLのNaOH(1 M)をボルテックスで混合し、十分に混合します。
- 調製したGenipinおよびNaOH溶液にI型コラーゲン1,000 μLを加え、混合物を氷上に保持して早期ゲル化を防ぎます。渦を使用して溶液を再度混合し、均質な混合物を実現します。
注:早期のゲル化を防ぐために、混合溶液を氷上に継続的に保管してください。 - 1,000 μLのピペットチップを使用して、調製した溶液全体を回収し、150〜200 μLの溶液を3Dプリントチャンバーのマトリックスコンパートメントに加えます。
- CO2 インキュベーター内のチャンバーを37°Cに60〜90分間保持することにより、マトリックスを重合させます。マトリックスの上部に150 μLの培地を加え、インキュベーターに一晩放置します。
- コラーゲン-アガロースマトリックスの調製とCaki-1細胞の包埋
注:RPTEC/TERT1細胞とCaki-1細胞の両方を、DMEM F-12高グルコース培地にITS(10 μg/mLのインスリン、5.5 μg/mLのトランスフェリン、5 ng/mLの亜セレン酸ナトリウム)、10 ng/mLの上皮成長因子(EGF)、36 ng/mLのヒドロコルチゾン、100 U/mLのペニシリン、 100 μg/mL のストレプトマイシン (5% v/v)、および 10% (v/v) ウシ胎児血清 (FCS)。- アガロース粉末を滅菌水またはDPBSに溶解して、最終濃度2%を達成します。アガロース溶液を85°Cに設定された加熱ブロックに置き、完全に溶解します。
注意: アガロース溶液は温度に敏感なため、取り扱いには注意してください。
- アガロース粉末を滅菌水またはDPBSに溶解して、最終濃度2%を達成します。アガロース溶液を85°Cに設定された加熱ブロックに置き、完全に溶解します。
- Caki-1細胞の埋め込み
- 1x トリプシン-EDTAを添加し、細胞が剥離するまで37°Cでインキュベートすることにより、Caki-1細胞を培養フラスコから分離します。等量の培地を添加して、1xトリプシンを中和します。
- 細胞懸濁液を回収し、細胞をカウントし、2,500 × g で5分間遠心分離します。上清を廃棄し、細胞ペレットを新鮮な培地に再懸濁し、最終濃度1×103 細胞/mL(Caki-1)にします。
注:チャンバーにロードする前に、細胞懸濁液が完全に混合され、凝集物がないことを確認してください。 - 25 μLの細胞懸濁液を1.5 mLの微量遠心チューブに加えます。
注:シリンジまたはピペットが滅菌されており、細胞の取り扱いに適していることを確認してください。 - I型コラーゲン75μLを細胞懸濁液とボルテックスでチューブに加えます。
注:早期のゲル化を防ぐために、混合物を氷上に継続的に保管してください。 - 溶かしたアガロースゲル2%100μLを加え、ゲルが均一になるまでボルテックスで慎重に混合します。
注:ゲル内の細胞が均一に分布していることを確認します。注入中に気泡を持ち込むと、細胞の分布やゲルの完全性が乱れる可能性があるため、気泡の持ち込みは避けてください。 - 1時間後、マトリックスの上部に150 μLの細胞培地を加え、スパチュラを使用してチャンバーから取り出します。細胞を含む3Dマトリックスを1,000 μLの培地を入れた24ウェルプレートに入れ、37°C、5%CO2でインキュベートします。
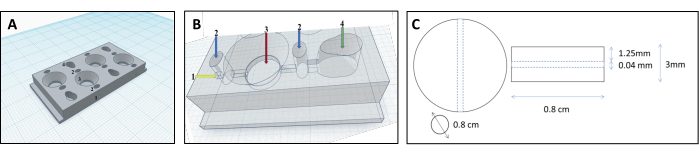
図1:腎尿細管再建のための3Dプリントチャンバー設計 (A,B) 腎尿細管を再構築するための架橋コラーゲンマトリックスを収容するように設計された3Dプリントチャンバーの表現。各チャンバーは4つの個別のコンパートメントで構成されており、等量のゲルを生成するために使用されます。フィラメントの挿入点が1つ、漏れを防ぐために寒天のみで満たされる2つのプレチャンバー、3つのコラーゲンチャンバー、4つのセルチャンバー。(C)架橋されたコラーゲンゲルと埋め込まれた腎尿細管の寸法。 この図の拡大版を表示するには、ここをクリックしてください。

図2:コラーゲンおよび寒天コラーゲンゲルの調製。(A) フィラメントが挿入された3Dプリントチャンバー。 (B) 架橋されたコラーゲン溶液をチャンバーのウェルに分注します (C) コラーゲン溶液で満たされたチャンバーをインキュベーターに入れてマトリックス重合を促進します (D) コラーゲンマトリックスに注入する前にRPTEC-TERT1細胞を収集します (E) チャンバーの細胞コンパートメントに細胞懸濁液を追加します (F) 鉗子の助けを借りてフィラメントを除去し、細胞がマトリックス内の中空管状構造に充填できるようにします (G) 1.5mLチューブ内でコラーゲンと混合されたRCC細胞の懸濁液 (H) 細胞に2%寒天溶液を加えてRCCゲルを生成します。 (I) ゲルをインキュベーターに配置してマトリックスゲル化を促進します (J、K、L) ヘラの助けを借りて3Dプリントチャンバーから腎尿細管を含む重合コラーゲンゲルを除去し、さらに処理する前に24ウェルプレートに配置します (M、N、O) ヘラの助けを借りてRCC細胞で重合コラーゲン-寒天ゲルを除去します。 そして、さらなる処理の前にそれらを24ウェルプレートに入れてください この図の拡大版を表示するには、ここをクリックしてください。

図3:マイクロ流体培養システムの組み立て (A,B) 専用ツールでHumimic chip2の培養コンパートメントを開く (C) チップの洗浄に使用した培地を取り出した後、新鮮な培地を400μL加える。 (D,E) 腎臓ゲルとRCCゲルをそれぞれの24ウェルプレートから取り出した後、スパチュラを使用してHumimicチップの単一の灌流回路の培養コンパートメントに各ゲルを配置し、ゲルを処理します。 (F,G) チップ内にゲルを配置した後、培養チャンバーを密閉し、チップを各マイクロ流体回路内の3つのマイクロポンプを介して灌流ユニットにリンクし、専用チューブで接続します。 (H) チップは、培養期間の期間中、インキュベーターに置かれ ます(I) コントロールユニットに設定された灌流パラメータ。 この図の拡大版を表示するには、ここをクリックしてください。
2. RPTEC/TERT1細胞の注入
- RPTEC/TERT1細胞注入
- 1x トリプシン-EDTAを添加し、細胞が剥離するまで37°Cでインキュベートすることにより、RPTEC/TERT1細胞を培養フラスコから分離します。
- サプリメントと等量の培地を添加することにより、1xトリプシンを中和します。細胞懸濁液を回収し、2,500 × g で5分間遠心分離します。
- 上清を廃棄し、細胞ペレットを新鮮な培地に再懸濁し、最終濃度1 × 106 細胞/mL(RPTEC/TERT1)にします。チャンバーにロードする前に、細胞懸濁液が完全に混合され、凝集物がないことを確認してください。
- 調製した細胞懸濁液10μLをチップ10μLのマイクロピペットに入れます。ピペットが滅菌されており、細胞の取り扱いに適していることを確認してください。固化したコラーゲンに細胞懸濁液を慎重に注入します(ステップ1.2.4)、チャンバー内の細胞コンパートメントを通して。
- 鉗子を使用してフィラメントを静かに除去し、細胞がマトリックス内の中空の管状構造に形成できるようにします
注:ゲル内の細胞が均一に分布していることを確認します。注入中に気泡を導入すると、細胞の分布やゲルの完全性が乱れる可能性があるため、避けてください。 - チャンバーを37°C、5%CO2 インキュベーターに入れます。60分後、乾燥を避けるために、マトリックスの上部に150 μLの細胞培地を加えます。24時間インキュベートして、細胞がゲルマトリックスに順応し、統合できるようにします。
- 翌日、へらを使用してチャンバーからマトリックスを取り出します。細胞を含む3Dマトリックスを1,000 μLの培地を入れた24ウェルプレートに置き、5% CO2で37°Cでインキュベートします。
注: 再構築された尿細管と埋め込まれた RCC スフェロイドのいずれかで調製されたゲルは、共培養のためにマイクロ流体システムに追加されます
3. 3D細胞サンプルの灌流
- 多臓器チップシステムにおける3D細胞灌流
- 3Dセルを装着したチップをチューブで灌流システムに接続します。
- 周波数:0.25 Hz、真空:-220 mbar、圧力:800 mbarのシステムを設定し、チップ2をシステムに接続します(図3)。
- 動的3D細胞培養液をインキュベーターで5日間、37°C、5%CO2で培養します。
灌流採取後の4. 3D細胞サンプル
- 灌流後の採取と分析
- 灌流システムからゲルを取り出し、PBSですすいでください。
- サンプルを2%パラホルムアルデヒドに室温で2〜3時間置いて、ゲルを固定します。固定サンプルは4°Cで保管してください。
- ゲルを染料(Hoechst33342、ファロイジン、ZO1、チューブリンなど)で染色します。
- 多臓器チップシステムを使用して5日間の灌流を行った後、3D細胞培養物と収集培地に対してさまざまなアッセイと方法を実施し、細胞の生存率、形態、遺伝子発現レベル、および機能調整を評価しました。コラーゲンゲルマトリックス中のRPTEC/TERT1細胞とコラーゲン-アガロースマトリックス中のCaki-1細胞は高い生存率を維持しています。これは、生死染色などの生存率アッセイを用いて確認します。
Access restricted. Please log in or start a trial to view this content.
結果
HUMIMICシステムは、代謝老廃物を取り除きながら継続的な栄養と酸素の供給を可能にするダイナミックな環境を提供し、細胞の生存能力と機能を長期間維持します。これらのシステムは、特定の組織の微小環境を再現する複雑な臓器チップモデルを作成するのに特に有益です。これは、Organ-on-a-chipアプリケーション向けに特別に設計されており、組織や臓器の生理学?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
この研究で説明されているプロトコルは、マイクロ流体システムの特定のコラーゲンおよびコラーゲン-アガロースゲルマトリックス内の2つの異なる細胞タイプ-腎近位尿細管上皮細胞(RPTEC / TERT1)および腎細胞癌(Caki-1)細胞の統合を活用して、複雑な腎臓癌モデルの開発を表しています。コラーゲンゲルの調製は、このモデルの成功に不可欠です。コラーゲンとアガロ?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
マリナ・ソモワは、グライフスヴァルト大学博士奨学金 - メクレンブルク・フォアポンメルン州の国家大学院資金に関する法律)の支援を受けました。著者らは、3D細胞培養とサンプル調製に関する洞察について、グライフスヴァルト大学医学部整形外科・外傷外科・リハビリテーション医学センターのJanosh Schoon博士とDirk Stobe博士に感謝します。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 1.5-2.0 mL tubes | Eppendorf | 003012/10237-20205 | |
| 24-well plates | Sarstedt | 83.3922.500 | |
| 3D printer | Prusa | ||
| Agarose | Carl Roth | 3810.3 | |
| AutoDesk Tinker CAD software | computer-assisted design software | ||
| Caki-1 cells | ATCC | HTB-46 | |
| Caspase activity | Promega | G8090 | Caspase 3/7 assay |
| Cell viability | Promega | G7570 | Cell Titer Glo assay |
| Collagen Type I – rat tail, 3.0 mg/mL | Corning | 354236 | |
| DMEM/12F Medium | PAN Biotech | PO4-41650 | |
| DPBS solution | PAN Biotech | P04-53500 | |
| Epidermal Growth Factor | Merck | E4127 | |
| Fetal Calf Serum | PAN Biotech | P30-3033 | |
| Genipin (30 mM) | Merck | G4796 | |
| HUMIMIC chips 2 | TissUse | multi-organ chips | |
| HUMIMIC control unit | TissUse | multi-organ chip control unit | |
| Hydrocortisone | Merck | H6909 | |
| Incubator (37 °C, 5% CO2) | nd | ||
| Insulin,Sodium selenite,Transferrin (IST) | Merck | I1884 | |
| LDH release | Promega | J2380 | |
| Metal spatula | nd | ||
| NaOH (1 M) | Carl Roth | P031.2 | |
| Petri dishes | Sarstedt | 82.1135.500 | |
| Polypropylene (PP) filament | Verbatin | 55952 | |
| RNA-easy extraction kit | Qiagen | 74104 | |
| RPTEC/TERT cells | ATCC | CRL - 4031 | |
| TNF-alfa ELISA | R&D Systems | DY210-05 | |
| Triiodothyronine (T3 ) | Merck | 709611 | |
| Trypsin-EDTA | PAN Biotech | P10-021100 |
参考文献
- Ainslie, G. R., et al. Microphysiological lung models to evaluate the safety of new pharmaceutical modalities: A biopharmaceutical perspective. Lab Chip. 19 (19), 3152-3161 (2019).
- Van Ness, K. P., et al. Microphysiological systems to assess nonclinical toxicity. Curr Protoc Toxicol. 73, 14.18.1-14.18.28 (2017).
- Majo, S., et al. Impact of extracellular matrix components to renal cell carcinoma behavior. Front Oncol. 10, 625(2020).
- Caetano-Pinto, P., et al. Epidermal growth factor receptor mediates the basolateral uptake of phosphorothioate-modified antisense oligonucleotides in the kidney. Organs-on-a-Chip. 4, 100022(2022).
- Manduca, N., et al. 3D cancer models: One step closer to in vitro human studies. Front Immunol. 14, 1175503(2023).
- Simon, B. R., et al. The RPTEC/TERT1 cell line models key renal cell responses to the environmental toxicants, benzo[a]pyrene and cadmium. Toxicol Rep. 1, 231-242 (2014).
- Ogura, T., et al. Methods of high integrity RNA extraction from cell/agarose construct. BMC Res Notes. 8, 644(2015).
- Glube, N., et al. Caki-1 cells represent an in vitro model system for studying the human proximal tubule epithelium. Nephron Exp Nephrol. 107 (2), e47-e56 (2007).
- Kühnl, J., et al. Characterization of application scenario-dependent pharmacokinetics and pharmacodynamic properties of permethrin and hyperforin in a dynamic skin and liver multi-organ-chip model. Toxicology. 448, 152637(2021).
- Padmyastuti, A., et al. Microfluidic-based prostate cancer model for investigating the secretion of prostate-specific antigen and microRNAs in vitro. Sci Rep. 13 (1), 11623(2023).
- Zhang, X., et al. Cancer-on-a-Chip: Models for studying metastasis. Cancers (Basel). 14 (3), 648(2022).
- Sobczuk, P., et al. Choosing the right animal model for renal cancer research. Transl Oncol. 13 (3), 100745(2020).
- Ewart, L., et al. Performance assessment and economic analysis of a human Liver-Chip for predictive toxicology. Commun Med. 2 (1), 154(2022).
- Caetano-Pinto, P., et al. Kidney cancer and chronic kidney disease: Too close for comfort. Biomedicines. 9 (12), 1761(2021).
- Del Piccolo, N., et al. Tumor-on-chip modeling of organ-specific cancer and metastasis. Adv Drug Deliv Rev. 175, 113798(2021).
- Soo, J. Y. C., et al. Advances in predictive in vitro models of drug-induced nephrotoxicity. Nat Rev Nephrol. 14 (6), 378-393 (2018).
- Chapron, A., et al. An improved vascularized, dual-channel microphysiological system facilitates modeling of proximal tubular solute secretion. ACS Pharmacol Transl Sci. 3 (3), 496-508 (2020).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved