JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
신장암 진행을 모델링하기 위한 건강한 신장과 종양 상피의 미세유체 공동 배양
요약
여기에서는 미세생리학적 시스템에서 콜라겐 및 콜라겐-아가로스 매트릭스를 사용하여 3D 세포 배양을 구현하기 위한 지침을 자세히 설명하는 프로토콜을 제시합니다. 이러한 프로토콜은 신장 근위세뇨관 및 신세포 암 스페로이드 공동 배양을 지원하여 생체 내 조건을 시뮬레이션하고 신장암 세포 상호 작용에 대한 고급 조사를 가능하게 합니다.
초록
미세생리학 시스템(MPS)을 통해 더 복잡하고 관련성 있는 생리학적 요소를 체외 모델에 도입할 수 있게 되었으며, 기존 모델에는 없는 동적 상호 작용으로 3차원 환경에서 복잡한 형태학적 특징을 재현할 수 있었습니다. 우리는 건강한 신장 조직과 악성 신장 조직 사이의 혼선을 재현하기 위해 신세포암(RCC) 공동 배양 모델을 구현했습니다.
이 모델은 참조된 다기관 플랫폼을 기반으로 하며 RCC 스페로이드와 함께 재건된 신장 근위세뇨관을 공동 배양하는 것으로 구성됩니다. 맞춤형으로 설계된 3D 프린팅 챔버를 사용하여 인간 신장 상피 근위세뇨관 세포(RPTEC)를 배양하고 콜라겐 I 유형 매트릭스에 포함된 신장 세뇨관으로의 자가 조립을 용이하게 했습니다. Caki-1 RCC 세포는 한천 콜라겐 기질에 내장되어 암 스페로이드를 형성했습니다. 콜라겐과 한천/콜라겐 겔은 모두 순환 관류 동안 무결성을 유지하고 최소 7일의 배양 기간 동안 전단 응력을 견디도록 최적화되었습니다.
젤은 또한 적절한 영양 공급과 세포 분비를 가능하게 합니다. 또한, 한천/콜라겐 겔은 RCC 세포의 과다 증식을 제한하여 상대적으로 균일한 스페로이드 크기를 보장합니다. MPS 칩 미세유체 회로는 표준 96-마이크로플레이트 웰 크기의 두 개의 독립적인 배양 챔버로 구성됩니다. 신세뇨관과 RCC 겔은 별도의 챔버를 채우고 동일한 배양 배지를 공유하며, 이는 분당 약 2회 재순환됩니다. 이러한 조건에서 신세뇨관(인터루킨-8 및 종양괴사인자-알파)의 면역인자 발현 및 분비의 상향 조절을 관찰했습니다. 신세뇨관은 또한 RCC의 영향으로 해당작용으로 대사 활동을 이동합니다. 이 새로운 접근법은 공동 배양 기반 MPS가 체외 RCC의 복잡성을 증폭시키고 암이 비종양 세포에 미치는 영향을 연구하는 데 사용될 수 있음을 보여줍니다.
서문
3D 세포 배양 시스템의 발전은 기존의 2D 배양에 비해 생리학적으로 더 관련성이 높은 모델을 제공함으로써 조직 공학 및 재생 의학에 혁명을 일으켰습니다 1,2. 이 연구에서는 콜라겐 및 콜라겐-아가로스 겔 매트릭스를 사용했는데, 이는 세포외 기질(ECM) 환경을 모방하여 보다 정확한 세포 거동과 기능을 촉진하는 동시에 사용된 동적 배양 조건과 호환되는 능력을 감안하여 사용되었습니다.
ECM에서 가장 풍부한 단백질인 콜라겐은 조직의 구조적 무결성과 생물학적 활성을 유지하는 데 중요한 역할을 합니다3. 일반적으로 쥐 꼬리에서 추출하는 I형 콜라겐은 생체 적합성과 다양한 매트릭스 강성 조건을 충족하도록 맞춤화할 수 있는 능력뿐만 아니라 상피 세포에 입증된 기질을 제공하는 능력으로 인해 선호되었습니다4. 3D 콜라겐 매트릭스에서 신장 세포에는 접착, 증식 및 분화를 지원하는 골격이 제공됩니다. 이러한 환경은 세포가 생체 내 조건을 반영하는 유전자 발현 패턴 및 세포 상호 작용을 포함하여 보다 자연스러운 형태와 행동을 나타낼 수 있도록 합니다5. 결과적으로, 콜라겐 겔은 ECM의 지지 및 조절 역할을 복제할 수 있는 능력으로 인해 암 연구에서 조직 공학에 이르기까지 다양한 응용 분야에서 광범위하게 활용되어 왔습니다.
불멸의 신장 근위 세뇨관 상피 세포주 RPTEC/TERT1은 건강한 신장 상피를 나타내는 데 사용되었습니다. 이 세포주는 인간 텔로머라제 역전사효소를 과발현하여 배양에서 증식하는 동시에 대표적인 RPTEC 표현형을 유지할 수 있습니다. 쥐꼬리 콜라겐 유형 I 젤 매트릭스는 신장 미세환경을 재현하기 위해 사용되었습니다. 이 콜라겐 겔 매트릭스는 RPTEC/TERT16 세포가 본래의 특성과 생리적 기능을 유지하도록 지원합니다. 대조적으로, 하이브리드 콜라겐-아가로스 겔 매트릭스는 신세포 암종(Caki-1) 세포를 배양하는 데 사용됩니다. 해조류에서 유래한 다당류인 아가로스(Agarose)는 3D 세포 배양 시스템에 또 다른 차원을 더합니다. 열적으로 가역적이어서 준비 과정에서 쉽게 취급하고 조작할 수 있습니다7. 아가로스 겔은 세포 생존력을 유지하고 암세포를 증식시켜 복잡한 구조의 형성을 촉진하는 중성 지지 매트릭스를 제공합니다. 콜라겐과 결합하면 생성된 하이브리드 젤은 콜라겐의 생화학적 신호와 아가로스의 구조적 지지력을 활용합니다. 이 조합은 신세포암(RCC) Caki-1 세포8 이 스페로이드로 성장하기에 적합한 미세환경을 조성하고 신장암 모델로 사용됩니다.
RPTEC/TERT1 및 Caki-1 세포에 대해 이러한 다양한 3D 매트릭스를 사용하는 것은 ECM 환경을 다양한 세포 유형의 특정 요구 사항에 맞게 조정하는 것의 중요성을 강조합니다. 건강한 신장 상피를 나타내는 RPTEC 또는 RCC를 나타내는 Caki-1 세포를 포함하는 겔은 세포 사이에서 배양 배지를 재순환하는 미세유체 시스템에서 결합되어 건강한 신장 세포 모델을 직접 접촉 없이 RCC의 분비물에 효과적으로 노출시켰습니다. 본 연구에서 채택된 TissUse HUMUMIC 플랫폼 9,10(이하 다기관 칩 플랫폼)은 외부 관류 장치에 의해 구동되는 흐름을 가진 두 개의 독립적인 유체 회로를 가진 미생물 생리학 칩으로 구성됩니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
참고: 이 프로토콜은 3D 콜라겐-아가로스 겔 준비, 세포 주입, 샘플 관류 및 추가 분석을 위해 추출하기 위한 포괄적인 단계를 간략하게 설명합니다. 특정 실험 요구 사항에 따라 배양 시간과 조건을 조정합니다.
1. 콜라겐 및 아가로스 젤 매트릭스의 준비
- 3D 프린팅
참고: 겔 매트릭스에 적합한 모양을 만들기 위해 겔을 생리학적으로 관련된 오가노이드 형태로 형성하는 고유한 챔버 디자인을 개발했습니다( 보충 파일 1 참조).- 컴퓨터 지원 설계 소프트웨어를 사용하여 챔버를 설계합니다. 챔버는 4개의 병렬 구획으로 구성됩니다: 2개의 셀 구획, 1개의 매트릭스 구획 및 연결 운하(그림 1 및 그림 2).
- 3D 프린팅으로 챔버를 구축하십시오. 가열 노즐은 바이오 플라스틱 필라멘트를 녹이고 층별로 증착됩니다. 이 프로토콜을 따르려면 무독성 바이오 플라스틱 필라멘트인 폴리프로필렌(PP)과 XYZ 좌표계의 이름을 딴 데카르트형 3D 프린터를 사용합니다.
- 세포 구획에 역 원뿔 모양의 기능을 추가하여 세포를 이관으로 유도합니다.
- 매트릭스 구획에 둥근 모양을 부여하면 콜라겐 젤을 형성하는 데 중요합니다.
- 세포와 매트릭스 격실을 운하(직경 0.04mm, 그림 3B)로 연결하여 세포가 세포 격실에서 매트릭스 격실로 흘러 튜브 표면에 부착되도록 합니다.
- RPTEC-TERT1 세포 배양을 위한 콜라겐 매트릭스 준비
참고: 이 절차는 콜라겐 매트릭스가 올바르게 준비되고 챔버에 로드되어 RPTEC/TERT1 세포의 후속 주입 및 배양 및 3D 세포 구조의 성장에 적합한 환경을 조성하도록 합니다. 오염을 방지하기 위해 모든 단계가 멸균 상태에서 수행되는지 확인하십시오.- 철저한 혼합을 보장하기 위해 와류를 사용하여 50μL의 Genipin(30mM)과 50μL의 NaOH(1M)를 혼합하여 가교 용액을 준비합니다.
- 조기된 Genipin 및 NaOH 용액에 1,000μL의 콜라겐 I형을 첨가하고 혼합물을 얼음에 보관하여 조기 겔화를 방지합니다. 균질한 혼합물을 얻기 위해 와류를 사용하여 용액을 다시 혼합합니다.
알림: 조기 겔화를 방지하기 위해 혼합 용액을 얼음에 계속 보관하십시오. - 1,000 μL 피펫 팁을 사용하여 준비된 전체 용액을 수집하고 150-200 μL의 용액을 3D 프린팅 챔버의 매트릭스 격실에 추가합니다.
- CO2 인큐베이터의 챔버를 37 oC에서 60-90 분 동안 유지하여 매트릭스가 중합되도록합니다. 매트릭스 상단에 150μL의 배양 배지를 추가하고 인큐베이터에서 밤새 그대로 둡니다.
- 콜라겐-아가로스 매트릭스의 준비 및 Caki-1 세포의 포매
참고: RPTEC/TERT1 및 Caki-1 세포는 모두 ITS(인슐린 10μg/mL, 트랜스페린 5.5μg/mL, 셀렌산나트륨 5ng/mL)가 보충된 DMEM F-12 고포도당 배지, 표피 성장 인자(EGF) 10ng/mL, 하이드로코르티손 36ng/mL, 페니실린 100U/mL, 스트렙토마이신 100μg/mL(5% v/v) 및 10%(v/v) 태아 송아지 혈청(FCS).- 아가로스 분말을 멸균수 또는 DPBS에 용해시켜 최종 농도 2%를 달성합니다. 완전한 용해를 보장하기 위해 85 oC로 설정된 가열 블록에 아가로스 용액을 놓습니다.
알림: 아가로스 용액은 온도에 민감하기 때문에 조심스럽게 다루십시오.
- 아가로스 분말을 멸균수 또는 DPBS에 용해시켜 최종 농도 2%를 달성합니다. 완전한 용해를 보장하기 위해 85 oC로 설정된 가열 블록에 아가로스 용액을 놓습니다.
- Caki-1 세포 임베딩
- 1x 트립신-EDTA를 첨가하고 세포가 분리될 때까지 37°C에서 배양하여 배양 플라스크에서 Caki-1 세포를 분리합니다. 1x 트립신을 동일한 부피의 배양 배지를 첨가하여 중화합니다.
- 세포 현탁액을 수집하고 세포 계수를 거쳐 2,500 × g 에서 5분 동안 원심분리합니다. 상등액을 버리고 세포 펠릿을 신선한 배양 배지에 1 ×10 3 cells/mL(Caki-1)의 최종 농도로 재현탁합니다.
알림: 챔버에 로드하기 전에 세포 현탁액이 완전히 혼합되고 덩어리가 없는지 확인하십시오. - 25μL의 세포 현탁액을 1.5mL 마이크로 원심분리 튜브에 추가합니다.
알림: 주사기 또는 피펫이 멸균되어 있고 세포 취급에 적합한지 확인하십시오. - 75μL의 콜라겐 유형 I을 세포 현탁액 및 와류가 있는 튜브에 추가합니다.
알림: 조기 겔화를 방지하기 위해 혼합물을 얼음에 계속 보관하십시오. - 100μL의 용융된 아가로스 젤 2%를 추가하고 겔이 균질해질 때까지 와류에서 조심스럽게 혼합합니다.
참고: 겔 내의 세포가 균일하게 분포되도록 하십시오. 주입 중 기포가 유입되면 세포 분포와 겔 무결성을 방해할 수 있으므로 피하십시오! - 1시간 후 매트릭스 상단에 150μL의 세포 배지를 추가하고 주걱을 사용하여 챔버에서 제거합니다. 1,000μL의 배양 배지가 있는 24웰 플레이트에 세포가 있는 3D 매트릭스를 놓고 37°C, 5% CO2에서 배양합니다.
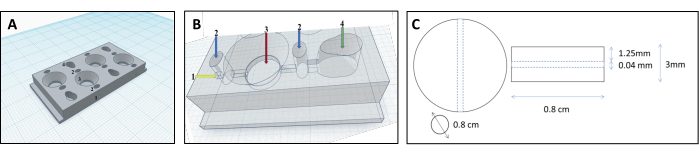
그림 1: 신장 세뇨관 재건을 위한 3D 프린팅 챔버 설계. (A,B) 신장 세뇨관 재건을 위해 가교 연결된 콜라겐 매트릭스를 수용하도록 설계된 3D 프린팅 챔버의 표현. 각 챔버는 동일한 양의 젤을 생산하는 데 사용되는 4개의 개별 구획으로 구성됩니다. 필라멘트를 위한 1-삽입 지점, 누출을 방지하기 위해 한천으로만 채워지는 2-사전 챔버, 3-콜라겐 챔버, 4-셀 챔버. (C) 가교 콜라겐 겔 및 내장된 신세뇨관의 치수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 콜라겐 및 한천-콜라겐 겔의 준비. (A) 필라멘트가 삽입된 3D 프린팅 챔버. (B) 가교결합된 콜라겐 용액을 챔버의 웰에 분배 (C) 콜라겐 용액으로 채워진 챔버를 인큐베이터에 배치하여 매트릭스 중합을 촉진합니다 (D) 콜라겐 매트릭스에 주입하기 전에 RPTEC-TERT1 세포를 수집합니다 (E) 챔버의 세포 구획에 세포 현탁액을 추가합니다 (F) 겸자의 도움으로 필라멘트를 제거하여 세포가 매트릭스 내부의 속이 빈 관 구조를 채울 수 있도록 ( G) 1.5mL 튜브 (H )에 콜라겐과 혼합된 RCC 세포의 현탁액 2% 한천 용액을 세포에 첨가하여 RCC 겔을 생성합니다. (I) 매트릭스 겔화를 촉진하기 위해 겔을 인큐베이터에 배치하고 (J,K,L) 주걱의 도움으로 3D 프린팅된 챔버에서 신세뇨관이 있는 중합된 콜라겐 겔을 제거하고 추가 처리 전에 24웰 플레이트에 배치( M,N,O) 주걱의 도움으로 RCC 세포와 함께 중합된 콜라겐-한천 겔을 제거하고, 추가 처리 전에 24웰 플레이트에 넣습니다 .이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 미세유체 배양 시스템의 조립. (A,B) 전용 도구를 사용하여 Humimic chip2의 배양 구획 열기 (C) 칩을 세척하는 데 사용된 배양 배지를 제거한 후 400μL의 신선한 배양 배지를 추가합니다. (디,이) 각각의 24개 웰 플레이트에서 신장 및 RCC 겔을 제거한 후, 주걱을 사용하여 겔을 처리하는 주걱을 사용하여 Humimic 칩의 단일 관류 회로의 배양 구획에 각 겔을 배치합니다. (여,지) 칩에 겔을 배치한 후 배양 챔버가 밀봉되고 칩은 특수 튜브로 연결된 각 미세유체 회로에 있는 3개의 마이크로 펌프를 통해 관류 장치에 연결됩니다. (H) 칩은 배양 기간 동안 인큐베이터에 배치됩니다 (I) 제어 장치에 설정된 관류 매개 변수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. RPTEC/TERT1 세포 주입
- RPTEC/TERT1 세포 주입
- 1x 트립신-EDTA를 첨가하고 세포가 분리될 때까지 37°C에서 배양하여 배양 플라스크에서 RPTEC/TERT1 세포를 분리합니다.
- 보충제와 함께 동일한 부피의 배양 배지를 첨가하여 1x 트립신을 중화합니다. 세포 현탁액과 원심분리기를 2,500 ×g에서 5 분 동안 수집합니다 .
- 상등액을 버리고 세포 펠릿을 신선한 배양 배지에 1 × 106 cells/mL(RPTEC/TERT1)의 최종 농도로 재현탁합니다. 챔버에 로드하기 전에 세포 현탁액이 완전히 혼합되고 덩어리가 없는지 확인하십시오.
- 준비된 세포 현탁액 10μL를 10μL 팁이 있는 마이크로 피펫에 로드합니다. 피펫이 멸균되어 세포 취급에 적합한지 확인하십시오. 챔버 내의 세포 구획을 통해 응고된 콜라겐(단계 1.2.4)에 세포 현탁액을 조심스럽게 주입합니다.
- 겸자를 사용하여 필라멘트를 부드럽게 제거하여 세포가 매트릭스 내의 속이 빈 관 구조를 채울 수 있도록 합니다.
참고: 겔 내의 세포가 균일하게 분포되도록 하십시오. 주입 중 기포가 유입되면 세포 분포와 겔 무결성을 방해할 수 있으므로 피하십시오. - 챔버를 37°C, 5% CO2 인큐베이터에 놓습니다. 60분 후 건조를 방지하기 위해 매트릭스 상단에 150μL의 세포 배지를 추가합니다. 세포가 겔 매트릭스에 적응하고 통합될 수 있도록 24시간 동안 배양합니다.
- 다음 날에는 주걱을 사용하여 챔버에서 매트릭스를 제거합니다. 1,000μL의 배양 배지가 있는 24웰 플레이트에 세포가 있는 3D 매트릭스를 놓고 5%CO2로 37°C에서 배양합니다.
참고: 재건된 신세뇨관과 내장된 RCC 스페로이드로 준비된 겔은 공동 배양을 위해 미세유체 시스템에 추가됩니다.
3. 3D 세포 시료의 관류
- Multi-organ chip system에서의 3D 세포 관류
- 3D 셀이 있는 칩을 튜브가 있는 관류 시스템에 연결합니다.
- 시스템 설정: 주파수: 0.25Hz, 진공: -220mbar, 압력: 800mbar, 칩 2를 시스템에 연결합니다(그림 3).
- 37°C의 인큐베이터에서 5% CO2로 5일 동안 동적 3D 세포 배양을 배양합니다.
4. 3D 세포 시료 사후 관류 채취
- 사후 관류 수집 및 분석
- 관류 시스템에서 젤을 제거하고 PBS로 헹굽니다.
- 샘플을 실온에서 2-3시간 동안 2% 파라포름알데히드에 샘플을 넣어 겔을 고정합니다. 고정 시료는 4ºC에서 보관하십시오.
- 염료(예: Hoechst33342, phalloidin, ZO1, tubulin)로 겔을 염색합니다.
- Multi-organ chip system을 이용한 5일간의 관류 후, 3D 세포 배양에 대해 다양한 분석 및 방법을 수행하고 배지를 수집하여 세포 생존율, 형태, 유전자 발현 수준 및 기능 조정을 평가했습니다. 콜라겐 겔 기질의 RPTEC/TERT1 세포와 콜라겐-아가로스 기질의 Caki-1 세포는 높은 생존력을 유지합니다. 살아있는/죽은 염색과 같은 생존도 분석을 사용하여 이를 확인합니다.
Access restricted. Please log in or start a trial to view this content.
결과
HUMIMIC 시스템은 대사 폐기물을 제거하면서 지속적인 영양분 및 산소 공급이 가능한 역동적인 환경을 제공하여 장기간 세포의 생존력과 기능을 유지합니다. 이러한 시스템은 특정 조직의 미세환경을 복제하는 복잡한 장기 칩 모델을 만드는 데 특히 유용합니다. 장기 칩 응용 분야를 위해 특별히 설계되었으며 조직 및 기관의 생리학적 조건을 시뮬레이션하는 데 중요한 요...
Access restricted. Please log in or start a trial to view this content.
토론
이 연구에서 설명한 프로토콜은 미세유체 시스템에서 특정 콜라겐 및 콜라겐-아가로스 겔 매트릭스 내에서 신장 근위 세뇨관 상피 세포(RPTEC/TERT1) 및 신장 세포 암종(Caki-1) 세포의 두 가지 고유한 세포 유형의 통합을 활용하는 복잡한 신장암 모델의 개발을 나타냅니다. 콜라겐 젤의 준비는 이 모델의 성공에 매우 중요합니다. 콜라겐과 아가로스의 정확한 농도는 관류 과정...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
마리나 소모바(Maryna Somova)는 메클렌부르크포어포메른(Mecklenburg-Vorpommern)의 그라이프스발트 대학교(University of Greifswald Doctoral Scholarship) - Landesgraduiertenförderungsgesetzes(국가 대학원 자금 지원법)의 지원을 받았습니다. 저자는 3D 세포 배양 및 시료 준비에 대한 통찰력을 제공해 준 Greifswald 대학 의과 대학 정형외과, 외상 수술 및 재활 의학 센터의 Janosh Schoon 박사와 Dirk Stobe에게 감사를 표합니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 1.5-2.0 mL tubes | Eppendorf | 003012/10237-20205 | |
| 24-well plates | Sarstedt | 83.3922.500 | |
| 3D printer | Prusa | ||
| Agarose | Carl Roth | 3810.3 | |
| AutoDesk Tinker CAD software | computer-assisted design software | ||
| Caki-1 cells | ATCC | HTB-46 | |
| Caspase activity | Promega | G8090 | Caspase 3/7 assay |
| Cell viability | Promega | G7570 | Cell Titer Glo assay |
| Collagen Type I – rat tail, 3.0 mg/mL | Corning | 354236 | |
| DMEM/12F Medium | PAN Biotech | PO4-41650 | |
| DPBS solution | PAN Biotech | P04-53500 | |
| Epidermal Growth Factor | Merck | E4127 | |
| Fetal Calf Serum | PAN Biotech | P30-3033 | |
| Genipin (30 mM) | Merck | G4796 | |
| HUMIMIC chips 2 | TissUse | multi-organ chips | |
| HUMIMIC control unit | TissUse | multi-organ chip control unit | |
| Hydrocortisone | Merck | H6909 | |
| Incubator (37 °C, 5% CO2) | nd | ||
| Insulin,Sodium selenite,Transferrin (IST) | Merck | I1884 | |
| LDH release | Promega | J2380 | |
| Metal spatula | nd | ||
| NaOH (1 M) | Carl Roth | P031.2 | |
| Petri dishes | Sarstedt | 82.1135.500 | |
| Polypropylene (PP) filament | Verbatin | 55952 | |
| RNA-easy extraction kit | Qiagen | 74104 | |
| RPTEC/TERT cells | ATCC | CRL - 4031 | |
| TNF-alfa ELISA | R&D Systems | DY210-05 | |
| Triiodothyronine (T3 ) | Merck | 709611 | |
| Trypsin-EDTA | PAN Biotech | P10-021100 |
참고문헌
- Ainslie, G. R., et al. Microphysiological lung models to evaluate the safety of new pharmaceutical modalities: A biopharmaceutical perspective. Lab Chip. 19 (19), 3152-3161 (2019).
- Van Ness, K. P., et al. Microphysiological systems to assess nonclinical toxicity. Curr Protoc Toxicol. 73, 14.18.1-14.18.28 (2017).
- Majo, S., et al. Impact of extracellular matrix components to renal cell carcinoma behavior. Front Oncol. 10, 625(2020).
- Caetano-Pinto, P., et al. Epidermal growth factor receptor mediates the basolateral uptake of phosphorothioate-modified antisense oligonucleotides in the kidney. Organs-on-a-Chip. 4, 100022(2022).
- Manduca, N., et al. 3D cancer models: One step closer to in vitro human studies. Front Immunol. 14, 1175503(2023).
- Simon, B. R., et al. The RPTEC/TERT1 cell line models key renal cell responses to the environmental toxicants, benzo[a]pyrene and cadmium. Toxicol Rep. 1, 231-242 (2014).
- Ogura, T., et al. Methods of high integrity RNA extraction from cell/agarose construct. BMC Res Notes. 8, 644(2015).
- Glube, N., et al. Caki-1 cells represent an in vitro model system for studying the human proximal tubule epithelium. Nephron Exp Nephrol. 107 (2), e47-e56 (2007).
- Kühnl, J., et al. Characterization of application scenario-dependent pharmacokinetics and pharmacodynamic properties of permethrin and hyperforin in a dynamic skin and liver multi-organ-chip model. Toxicology. 448, 152637(2021).
- Padmyastuti, A., et al. Microfluidic-based prostate cancer model for investigating the secretion of prostate-specific antigen and microRNAs in vitro. Sci Rep. 13 (1), 11623(2023).
- Zhang, X., et al. Cancer-on-a-Chip: Models for studying metastasis. Cancers (Basel). 14 (3), 648(2022).
- Sobczuk, P., et al. Choosing the right animal model for renal cancer research. Transl Oncol. 13 (3), 100745(2020).
- Ewart, L., et al. Performance assessment and economic analysis of a human Liver-Chip for predictive toxicology. Commun Med. 2 (1), 154(2022).
- Caetano-Pinto, P., et al. Kidney cancer and chronic kidney disease: Too close for comfort. Biomedicines. 9 (12), 1761(2021).
- Del Piccolo, N., et al. Tumor-on-chip modeling of organ-specific cancer and metastasis. Adv Drug Deliv Rev. 175, 113798(2021).
- Soo, J. Y. C., et al. Advances in predictive in vitro models of drug-induced nephrotoxicity. Nat Rev Nephrol. 14 (6), 378-393 (2018).
- Chapron, A., et al. An improved vascularized, dual-channel microphysiological system facilitates modeling of proximal tubular solute secretion. ACS Pharmacol Transl Sci. 3 (3), 496-508 (2020).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유