Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Böbrek Kanseri İlerlemesini Modellemek için Renal Sağlıklı ve Tümör Epitelinin Mikroakışkan Ko-kültürü
Bu Makalede
Özet
Burada, mikrofizyolojik bir sistemde kollajen ve kollajen-agaroz matrisleri kullanarak 3D hücre kültürlerinin uygulanması için talimatları detaylandıran protokoller sunuyoruz. Bu protokoller, renal proksimal tübül ve renal hücreli karsinom sferoidlerinin ko-kültürünü destekleyerek in vivo koşulları simüle eder ve böbrek kanseri hücre etkileşimlerinin ileri düzeyde araştırılmasını sağlar.
Özet
Mikrofizyolojik sistemler (MPS), daha karmaşık ve ilgili fizyolojik unsurların in vitro modellere dahil edilmesini sağlayarak, geleneksel modellerde bulunmayan dinamik etkileşimlerle üç boyutlu ortamlarda karmaşık morfolojik özellikleri yeniden yaratmıştır. Sağlıklı ve malign böbrek dokusu arasındaki etkileşimi yeniden oluşturmak için bir renal hücreli karsinom (RCC) ko-kültür modeli uyguladık.
Bu model, referans alınan çoklu organ platformuna dayanmaktadır ve yeniden yapılandırılmış bir renal proksimal tübülün RCC sferoidleri ile birlikte kültürlenmesinden oluşur. İnsan renal epitelyal proksimal tübül hücrelerini (RPTEC) kültürlemek ve bunların bir kollajen tip I matrisinde bulunan bir renal tübül içine kendi kendine montajını kolaylaştırmak için özel olarak tasarlanmış 3D baskılı odalar kullanıldı. Caki-1 RCC hücreleri bir agar kollajen matrisine gömüldü ve daha sonra kanser sferoidleri oluşturuldu. Hem kollajen hem de agar / kollajen jelleri, döngüsel perfüzyon sırasında bütünlüklerini korumak ve minimum 7 günlük bir kültür periyodu boyunca kayma stresine dayanmak için optimize edilmiştir.
Jeller ayrıca yeterli besin tedarikini ve hücre salgılarını sağlar. Ayrıca, agar / kollajen jelleri, RCC hücrelerinin aşırı proliferasyonunu sınırlayarak nispeten homojen sferoid boyutu sağlar. MPS çip mikroakışkan devreleri, standart bir 96 mikroplaka kuyusu boyutunda iki bağımsız kültür odası içerir. Renal tübül ve RCC jelleri ayrı odaları doldurur ve dakikada yaklaşık iki kez yeniden dolaştırılan aynı kültür ortamını paylaşır. Bu koşullar altında, renal tübüllerde (interlökin-8 ve tümör nekroz faktörü-alfa) immün faktör ekspresyonunun ve sekresyonunun yukarı regülasyonunu gözlemledik. Renal tübüller ayrıca RCC'nin etkisi altında metabolik aktivitelerini glikolize doğru kaydırır. Bu yeni yaklaşım, ko-kültür bazlı bir MPS'nin, RCC'nin in vitro karmaşıklığını artırabileceğini ve kanserin tümör olmayan hücreler üzerindeki etkisini incelemek için kullanılabileceğini göstermektedir.
Giriş
3D hücre kültürü sistemlerindeki gelişmeler, geleneksel 2D kültürlere kıyasla fizyolojik olarak daha ilgili modeller sunarak doku mühendisliği ve rejeneratif tıpta devrim yaratmıştır 1,2. Bu çalışmada, hücre dışı matriks (ECM) ortamını taklit etme yetenekleri göz önüne alındığında, kullanılan dinamik kültür koşullarıyla uyumlu olurken daha doğru hücresel davranış ve işlevi teşvik eden kollajen ve kollajen-agaroz jel matrisleri kullandık.
ECM'de en bol bulunan protein olan kolajen, dokuların yapısal bütünlüğünün ve biyolojik aktivitesinin korunmasında çok önemli bir rol oynar3. Yaygın olarak sıçan kuyruğundan elde edilen tip I kollajen, biyouyumluluğu ve farklı matris sertliği koşullarını karşılayacak şekilde uyarlanabilme yeteneğinin yanı sıra epitel hücreleri için kanıtlanmış bir substrat sağlaması nedeniyle tercih edildi4. 3D kollajen matrisinde, böbrek hücrelerine yapışmalarını, çoğalmalarını ve farklılaşmalarını destekleyen bir iskele sağlanır. Bu ortam, hücrelerin, in vivo koşulları yansıtan gen ekspresyon kalıpları ve hücresel etkileşimler dahil olmak üzere daha doğal morfolojiler ve davranışlar sergilemesini sağlar5. Sonuç olarak, kollajen jeller, ECM'nin destekleyici ve düzenleyici rollerini çoğaltma kapasiteleri nedeniyle kanser araştırmalarından doku mühendisliğine kadar çeşitli uygulamalarda yaygın olarak kullanılmaktadır.
Sağlıklı böbrek epitelini temsil etmek için ölümsüzleştirilmiş renal proksimal tübüler epitel hücre hattı RPTEC/TERT1 kullanıldı. Bu hücre hattı, insan telomeraz ters transkriptazını aşırı eksprese ederek, temsili bir RPTEC fenotipini korurken kültürde çoğalmasını sağlar. Sıçan kuyruğu kollajen tip I jel matrisi, renal mikroçevreyi yeniden oluşturmak için kullanıldı. Bu kollajen jel matrisi, RPTEC / TERT16 hücrelerinin doğal özelliklerini ve fizyolojik işlevlerini korumalarını destekler. Buna karşılık, renal hücreli karsinom (Caki-1) hücrelerinin kültürlenmesi için hibrit bir kollajen-agaroz jel matrisi kullanılır. Deniz yosunundan elde edilen bir polisakkarit olan agaroz, 3D hücre kültürü sistemlerine başka bir boyut katmaktadır. Termal olarak geri dönüşümlüdür, hazırlama işlemi sırasında kolay kullanım ve manipülasyon sağlar7. Agaroz jelleri, hücre canlılığını koruyan ve kanser hücrelerini çoğaltarak karmaşık yapıların oluşumunu destekleyen nötr bir destekleyici matris sağlar. Kollajen ile birleştirildiğinde, elde edilen hibrit jel, kollajenden gelen biyokimyasal ipuçlarından ve agarozdan gelen yapısal destekten yararlanır. Bu kombinasyon, renal hücreli karsinom (RCC) Caki-1 hücreleri8 için sferoidlere büyüme için uygun bir mikro çevre oluşturur ve böbrek kanseri modeli olarak kullanılır.
RPTEC/TERT1 ve Caki-1 hücreleri için bu farklı 3D matrislerin kullanılması, ECM ortamının farklı hücre tiplerinin özel ihtiyaçlarına göre uyarlanmasının önemini vurgulamaktadır. Sağlıklı renal epiteli temsil eden RPTEC'i veya RCC'yi temsil eden Caki-1 hücrelerini içeren jeller, hücreler arasında kültür ortamını yeniden dolaştıran ve sağlıklı renal hücre modelini doğrudan temas olmaksızın RCC'nin salgılarına etkili bir şekilde maruz bırakan bir mikroakışkan sistemde birleştirildi. Bu çalışmada kullanılan TissUse HUMUMIC platformu 9,10 (bundan böyle çok organlı çip platformu olarak anılacaktır), akışı harici bir perfüzyon ünitesi tarafından yönlendirilen iki bağımsız akışkan devresine sahip bir mikrofizyoloji çipinden oluşur.
Access restricted. Please log in or start a trial to view this content.
Protokol
NOT: Bu protokoller, 3D kollajen-agaroz jellerinin hazırlanması, hücrelerin enjekte edilmesi, numunelerin perfüze edilmesi ve daha fazla analiz için çıkarılması için kapsamlı adımları özetlemektedir. Kuluçka sürelerini ve koşullarını belirli deneysel gereksinimlere göre ayarlayın.
1. Kollajen ve agaroz jel matrisinin hazırlanması
- 3D baskı
NOT: Jel matrisi için uygun şekli oluşturmak için, jeli fizyolojik olarak ilgili bir organoid forma dönüştüren benzersiz bir oda tasarımı geliştirdik (bkz. Ek Dosya 1).- Odaları bilgisayar destekli tasarım yazılımı kullanarak tasarlayın. Bölme dört paralel bölmeden oluşur: iki hücre bölmesi, bir matris bölmesi ve bir bağlantı kanalı (Şekil 1 ve Şekil 2).
- Odaları 3D baskı ile inşa edin; Bir ısıtma nozulu, biyoplastik bir filamenti eritir ve katman katman biriktirir. Bu protokolü takip etmek için, toksik olmayan bir biyoplastik filament olan Polipropilen (PP) ve XYZ koordinat sisteminin adını taşıyan Kartezyen tipi bir 3D yazıcı kullanın.
- Hücreleri kanala yönlendirmek için hücre bölmelerine ters koni şekli özelliği ekleyin.
- Kollajen jeli oluşturmak için çok önemli olan matris bölmesine yuvarlak bir şekil verin.
- Hücre ve matris bölmelerini bir kanalla (çap 0.04 mm, Şekil 3B) bağlayın, hücrelerin hücre bölmesinden matris bölmesine akmasına ve tüp yüzeyine yapışmasına izin verin.
- RPTEC-TERT1 hücrelerinin yetiştirilmesi için kollajen matrisinin hazırlanması
NOT: Bu prosedür, kollajen matrisinin doğru bir şekilde hazırlanmasını ve hazneye yüklenmesini sağlayarak, RPTEC / TERT1 hücrelerinin müteakip enjeksiyonu ve yetiştirilmesi ve 3D hücre yapısının büyümesi için uygun bir ortam yaratır. Kontaminasyonu önlemek için tüm adımların steril koşullar altında gerçekleştirildiğinden emin olun.- Tam karıştırmayı sağlamak için 50 μL Genipin (30 mM) ile 50 μL NaOH (1 M) bir girdap kullanarak karıştırarak çapraz bağlama çözeltisini hazırlayın.
- Erken jelleşmeyi önlemek için karışımı buz üzerinde tutarken hazırlanan Genipin ve NaOH çözeltisine 1.000 μL kollajen tip I ekleyin. Homojen bir karışım elde etmek için çözeltiyi bir girdap kullanarak tekrar karıştırın.
NOT: Erken jelleşmeyi önlemek için karışık çözeltiyi sürekli olarak buz üzerinde tutun. - 1.000 μL'lik bir pipet ucu kullanarak, hazırlanan çözeltinin tamamını toplayın ve 150-200 μL çözeltiyi 3D baskılı haznenin matris bölmesine ekleyin.
- Hazneyi CO2 inkübatöründe 37 oC'de 60-90 dakika tutarak matrisin polimerize olmasına izin verin. Matrisin üstüne 150 μL kültür ortamı ekleyin ve bir gece inkübatörde bırakın.
- Kollajen-agaroz matriksinin hazırlanması ve Caki-1 hücrelerinin gömülmesi
NOT: Hem RPTEC / TERT1 hem de Caki-1 hücreleri, ITS (10 μg / mL insülin, 5.5 μg / mL transferrin ve 5 ng / mL sodyum selenit), 10 ng / mL epidermal büyüme faktörü (EGF), 36 ng / mL hidrokortizon, 100 U / mL penisilin, 100 μg/mL streptomisin (%5 h/v) ve %10 (h/h) Fetal Buzağı Serumu (FCS).- % 2'lik bir nihai konsantrasyon elde etmek için agaroz tozunu steril suda veya DPBS'de çözün. Tam çözünmeyi sağlamak için agaroz çözeltisini 85 oC'ye ayarlanmış bir ısıtma bloğuna yerleştirin.
NOT: Sıcaklık hassasiyeti nedeniyle agaroz çözeltisini dikkatli bir şekilde kullanın.
- % 2'lik bir nihai konsantrasyon elde etmek için agaroz tozunu steril suda veya DPBS'de çözün. Tam çözünmeyi sağlamak için agaroz çözeltisini 85 oC'ye ayarlanmış bir ısıtma bloğuna yerleştirin.
- Caki-1 hücreleri gömme
- 1x tripsin-EDTA ekleyerek ve hücreler ayrılana kadar 37 ° C'de inkübe ederek Caki-1 hücrelerini kültür şişelerinden ayırın. Eşit hacimde kültür ortamı ekleyerek 1x tripsini nötralize edin.
- Hücre süspansiyonunu toplayın, hücreleri sayın ve 5 dakika boyunca 2.500 × g'da santrifüjleyin. Süpernatanı atın ve hücre peletlerini taze kültür ortamında 1 × 103 hücre / mL (Caki-1) nihai konsantrasyona kadar yeniden süspanse edin.
NOT: Hazneye yüklemeden önce hücre süspansiyonunun iyice karıştığından ve topaklardan arınmış olduğundan emin olun. - 1.5 mL'lik bir mikrosantrifüj tüpüne 25 μL hücre süspansiyonu ekleyin.
NOT: Şırınganın veya pipetin sterilize edildiğinden ve hücrelerin kullanımı için uygun olduğundan emin olun. - Hücre süspansiyonu ve vorteks ile tüpe 75 μL kollajen tip I ekleyin.
NOT: Erken jelleşmeyi önlemek için karışımı sürekli olarak buz üzerinde tutun. - 100 μL eritilmiş agaroz jeli %2 ekleyin ve jel homojen hale gelene kadar vorteks üzerinde dikkatlice karıştırın.
NOT: Hücrelerin jel içinde eşit dağıldığından emin olun. Hücre dağılımını ve jel bütünlüğünü bozabileceğinden, enjeksiyon sırasında hava kabarcıkları oluşturmaktan kaçının! - 1 saat sonra, matrisin üstüne 150 μL hücre ortamı ekleyin ve bir spatula kullanarak hazneden çıkarın. Hücreli 3D matrisleri 1.000 μL kültür ortamı içeren 24 oyuklu bir plakaya yerleştirin ve 37 ° C,% 5 CO2'de inkübe edin.
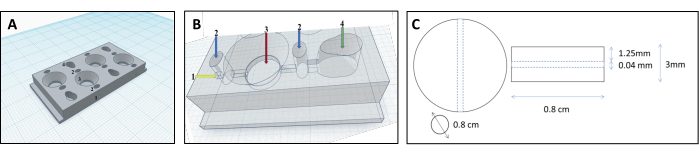
Şekil 1: Renal tübüllerin rekonstrüksiyonu için 3D baskılı oda tasarımı. (A,B) Renal tübülleri yeniden yapılandırmak için çapraz bağlı bir kollajen matrisi barındırmak üzere tasarlanmış 3D baskılı odanın temsili. Her oda, eşit miktarda jel üretmek için kullanılan dört ayrı bölmeden oluşur. Filament için 1-yerleştirme noktası, 2-sızıntıları önlemek için sadece agar ile doldurulacak 2-ön odacık, 3-kollajen odası, 4-hücreli oda. (C) Çapraz bağlı kollajen jeli ve gömülü renal tübülün boyutları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Kollajen ve agar-kollajen jellerinin hazırlanması. (A) Filamentlerin yerleştirildiği 3D baskılı oda. (B) Çapraz bağlı kollajen çözeltisi odanın kuyucuklarına dağıtılır; (C) Kollajen çözeltisi ile doldurulmuş hazne, matris polimerizasyonunu kolaylaştırmak için inkübatöre yerleştirilir; (D) Kollajen matrisine enjeksiyondan önce RPTEC-TERT1 hücrelerinin toplanması (E) Hücre süspansiyonunun eklenmesi: odanın hücre bölmesi (F) Filamentin forseps yardımıyla çıkarılması, hücrelerin matris içindeki içi boş boru şeklindeki yapıyı doldurmasını sağlamak (G) 1.5 mL'lik bir tüpte kollajen ile karıştırılmış RCC hücrelerinin süspansiyonu (H) RCC jeli oluşturmak için hücrelere% 2 agar çözeltisi eklenmesi. (I) Jeller, matris jelleşmesini kolaylaştırmak için inkübatöre yerleştirilir (J,K,L) Renal tübüller ile polimerize kollajen jelin bir spatula yardımıyla 3D baskılı hazneden çıkarılması ve daha sonraki işlemlerden önce 24 oyuklu bir plakaya yerleştirilmesi (M,N,O) Polimerize kollajen-agar jelinin bir spatula yardımıyla RCC hücreleri ile çıkarılması, ve daha fazla işlemeden önce bunları 24 oyuklu bir plakaya yerleştirmek Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Mikroakışkan kültür sisteminin montajı. (A,B) Humimic chip2'nin kültür bölmelerinin özel bir alet kullanılarak açılması (C) Çipi yıkamak için kullanılan kültür ortamını çıkardıktan sonra, 400 μL taze kültür ortamı ekleyin. (D,E) Böbrek ve RCC jellerini ilgili 24 oyuklu plakadan çıkardıktan sonra, jelleri işlemek için spatula kullanarak her bir jeli Hümik çipin tek bir perfüzyon devresinin kültür bölmesine yerleştirin. (F,G) Jelleri çip içine yerleştirdikten sonra, kültür odaları kapatılır ve çip, özel borularla bağlanan her bir mikroakışkan devredeki üç mikro pompa aracılığıyla perfüzyon ünitesine bağlanır. (H) Çipler, kültür periyodu süresince inkübatöre yerleştirilir (I) Kontrol ünitesinde ayarlanan perfüzyon parametreleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. RPTEC / TERT1 hücrelerinin enjeksiyonu
- RPTEC / TERT1 hücreleri enjeksiyonu
- 1x tripsin-EDTA ekleyerek ve hücreler ayrılana kadar 37 ° C'de inkübe ederek RPTEC / TERT1 hücrelerini kültür şişelerinden ayırın.
- Takviyelerle eşit hacimde kültür ortamı ekleyerek 1x tripsini nötralize edin. Hücre süspansiyonunu toplayın ve 5 dakika boyunca 2.500 × g'da santrifüjleyin.
- Süpernatanı atın ve hücre peletlerini taze kültür ortamında 1 × 106 hücre / mL'lik (RPTEC / TERT1) nihai konsantrasyona yeniden süspanse edin. Hazneye yüklemeden önce hücre süspansiyonunun iyice karıştığından ve topaklardan arınmış olduğundan emin olun.
- Hazırlanan hücre süspansiyonunun 10 μL'sini 10μL uçlu bir mikro pipete yükleyin. Pipetin sterilize edildiğinden ve hücrelerin kullanımı için uygun olduğundan emin olun. Hücre süspansiyonunu, oda içindeki hücre bölmesinden katılaşmış kollajen içine (adım 1.2.4) dikkatlice enjekte edin.
- Forseps kullanarak filamenti nazikçe çıkarın, hücrelerin matris içindeki içi boş boru şeklindeki yapıyı doldurmasına izin verin
NOT: Hücrelerin jel içinde eşit dağıldığından emin olun. Hücre dağılımını ve jel bütünlüğünü bozabileceğinden, enjeksiyon sırasında hava kabarcıkları oluşturmaktan kaçının. - Odaları 37 °C,% 5 CO2 inkübatöre yerleştirin. 60 dakika sonra, kurumayı önlemek için matrisin üstüne 150 μL hücre ortamı ekleyin. Hücrelerin alışmasına ve jel matrisine entegre olmasına izin vermek için 24 saat inkübe edin.
- Ertesi gün, bir spatula kullanarak matrisi hazneden çıkarın. Hücreli 3D matrisleri 1.000 μL kültür ortamı içeren 24 oyuklu bir plakaya yerleştirin ve 37 ° C'de% 5 CO2 ile inkübe edin.
NOT: Yeniden yapılandırılmış renal tübül ve gömülü RCC sferoidleri ile hazırlanan jeller, ko-kültür için mikroakışkan sistemine eklenecektir
3. 3D hücre örneklerinin perfüzyonu
- Çok organlı çip sisteminde 3D hücre perfüzyonu
- Çipi 3D hücre ile boru ile perfüzyon sistemine bağlayın.
- Sistemi ayarlayın: Frekans: 0.25 Hz, Vakum: -220 mbar, Basınç: 800 mbar ve çip 2'yi sisteme bağlayın (Şekil 3).
- Dinamik 3D hücre kültürünü% 5 CO 2 ile 37 ° C'de bir inkübatörde 5 gün boyunca yetiştirin.
Perfüzyon toplama sonrası 4. 3D hücresi örnekleri
- Perfüzyon sonrası toplama ve analiz
- Jelleri perfüzyon sisteminden çıkarın ve PBS ile durulayın.
- Numuneleri oda sıcaklığında 2-3 saat boyunca% 2 paraformaldehit içine yerleştirerek jelleri sabitleyin. Sabit numuneleri 4 ºC'de saklayın.
- Jelleri boyalarla boyayın (örneğin, Hoechst33342, phalloidin, ZO1, tübülin).
- Çok organlı çip sistemi kullanılarak 5 günlük perfüzyondan sonra, hücre canlılığını, morfolojisini, gen ekspresyon seviyelerini ve fonksiyonel ayarlamaları değerlendirmek için 3D hücre kültürleri ve toplanan ortamlar üzerinde çeşitli tahliller ve yöntemler gerçekleştirildi. Kollajen jel matrisindeki RPTEC/TERT1 hücreleri ve kollajen-agaroz matrisindeki Caki-1 hücreleri yüksek canlılığı korur; Bunu, canlı/ölü boyama gibi canlılık deneyleri kullanarak onaylayın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
HUMIMIC sistemi, metabolik atıkları giderirken sürekli besin ve oksijen tedarikini sağlayan dinamik bir ortam sağlar, böylece uzun süreler boyunca hücre canlılığını ve işlevini korur. Bu sistemler, belirli dokuların mikro çevresini kopyalayan karmaşık, çip üzerinde organ modelleri oluşturmak için özellikle faydalıdır. Çip üzerinde organ uygulamaları için özel olarak tasarlanmıştır ve doku ve organların fizyolojik koşullarını simüle etmede kritik fakt...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu çalışmada açıklanan protokol, iki farklı hücre tipinin (renal proksimal tübüler epitel hücreleri (RPTEC / TERT1) ve renal hücreli karsinom (Caki-1) hücreleri - spesifik kollajen ve kollajen-agaroz jel matrisleri içinde entegrasyonundan yararlanan karmaşık bir böbrek kanseri modelinin geliştirilmesini temsil etmektedir. Kollajen jellerinin hazırlanması bu modelin başarısı için kritik öneme sahiptir. Perfüzyon işlemi boyunca matrisin yapısal bütünlüğünü ...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Maryna Somova, Mecklenburg-Vorpommern'deki Greifswald Üniversitesi Doktora Bursu - Landesgraduiertenförderungsgesetzes (Devlet Lisansüstü Finansmanı Yasası) tarafından desteklendi. Yazarlar, Greifswald Üniversitesi Tıp Fakültesi Ortopedi, Travma Cerrahisi ve Rehabilitasyon Tıbbı Merkezi'nden Dr. Janosh Schoon ve Dirk Stobe'a 3D hücre kültürü ve numune hazırlama konusundaki görüşleri için teşekkür eder.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5-2.0 mL tubes | Eppendorf | 003012/10237-20205 | |
| 24-well plates | Sarstedt | 83.3922.500 | |
| 3D printer | Prusa | ||
| Agarose | Carl Roth | 3810.3 | |
| AutoDesk Tinker CAD software | computer-assisted design software | ||
| Caki-1 cells | ATCC | HTB-46 | |
| Caspase activity | Promega | G8090 | Caspase 3/7 assay |
| Cell viability | Promega | G7570 | Cell Titer Glo assay |
| Collagen Type I – rat tail, 3.0 mg/mL | Corning | 354236 | |
| DMEM/12F Medium | PAN Biotech | PO4-41650 | |
| DPBS solution | PAN Biotech | P04-53500 | |
| Epidermal Growth Factor | Merck | E4127 | |
| Fetal Calf Serum | PAN Biotech | P30-3033 | |
| Genipin (30 mM) | Merck | G4796 | |
| HUMIMIC chips 2 | TissUse | multi-organ chips | |
| HUMIMIC control unit | TissUse | multi-organ chip control unit | |
| Hydrocortisone | Merck | H6909 | |
| Incubator (37 °C, 5% CO2) | nd | ||
| Insulin,Sodium selenite,Transferrin (IST) | Merck | I1884 | |
| LDH release | Promega | J2380 | |
| Metal spatula | nd | ||
| NaOH (1 M) | Carl Roth | P031.2 | |
| Petri dishes | Sarstedt | 82.1135.500 | |
| Polypropylene (PP) filament | Verbatin | 55952 | |
| RNA-easy extraction kit | Qiagen | 74104 | |
| RPTEC/TERT cells | ATCC | CRL - 4031 | |
| TNF-alfa ELISA | R&D Systems | DY210-05 | |
| Triiodothyronine (T3 ) | Merck | 709611 | |
| Trypsin-EDTA | PAN Biotech | P10-021100 |
Referanslar
- Ainslie, G. R., et al. Microphysiological lung models to evaluate the safety of new pharmaceutical modalities: A biopharmaceutical perspective. Lab Chip. 19 (19), 3152-3161 (2019).
- Van Ness, K. P., et al. Microphysiological systems to assess nonclinical toxicity. Curr Protoc Toxicol. 73, 14.18.1-14.18.28 (2017).
- Majo, S., et al. Impact of extracellular matrix components to renal cell carcinoma behavior. Front Oncol. 10, 625(2020).
- Caetano-Pinto, P., et al. Epidermal growth factor receptor mediates the basolateral uptake of phosphorothioate-modified antisense oligonucleotides in the kidney. Organs-on-a-Chip. 4, 100022(2022).
- Manduca, N., et al. 3D cancer models: One step closer to in vitro human studies. Front Immunol. 14, 1175503(2023).
- Simon, B. R., et al. The RPTEC/TERT1 cell line models key renal cell responses to the environmental toxicants, benzo[a]pyrene and cadmium. Toxicol Rep. 1, 231-242 (2014).
- Ogura, T., et al. Methods of high integrity RNA extraction from cell/agarose construct. BMC Res Notes. 8, 644(2015).
- Glube, N., et al. Caki-1 cells represent an in vitro model system for studying the human proximal tubule epithelium. Nephron Exp Nephrol. 107 (2), e47-e56 (2007).
- Kühnl, J., et al. Characterization of application scenario-dependent pharmacokinetics and pharmacodynamic properties of permethrin and hyperforin in a dynamic skin and liver multi-organ-chip model. Toxicology. 448, 152637(2021).
- Padmyastuti, A., et al. Microfluidic-based prostate cancer model for investigating the secretion of prostate-specific antigen and microRNAs in vitro. Sci Rep. 13 (1), 11623(2023).
- Zhang, X., et al. Cancer-on-a-Chip: Models for studying metastasis. Cancers (Basel). 14 (3), 648(2022).
- Sobczuk, P., et al. Choosing the right animal model for renal cancer research. Transl Oncol. 13 (3), 100745(2020).
- Ewart, L., et al. Performance assessment and economic analysis of a human Liver-Chip for predictive toxicology. Commun Med. 2 (1), 154(2022).
- Caetano-Pinto, P., et al. Kidney cancer and chronic kidney disease: Too close for comfort. Biomedicines. 9 (12), 1761(2021).
- Del Piccolo, N., et al. Tumor-on-chip modeling of organ-specific cancer and metastasis. Adv Drug Deliv Rev. 175, 113798(2021).
- Soo, J. Y. C., et al. Advances in predictive in vitro models of drug-induced nephrotoxicity. Nat Rev Nephrol. 14 (6), 378-393 (2018).
- Chapron, A., et al. An improved vascularized, dual-channel microphysiological system facilitates modeling of proximal tubular solute secretion. ACS Pharmacol Transl Sci. 3 (3), 496-508 (2020).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır