É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Co-cultura microfluídica de epitélio renal saudável e tumoral para modelar a progressão do câncer renal
Neste Artigo
Resumo
Aqui, apresentamos protocolos que detalham instruções para a implementação de culturas de células 3D usando matrizes de colágeno e colágeno-agarose em um sistema microfisiológico. Esses protocolos suportam a co-cultura de esferoides de túbulo proximal renal e carcinoma de células renais, simulando condições in vivo e permitindo a investigação avançada das interações das células cancerígenas renais.
Resumo
Os sistemas microfisiológicos (MPS) têm possibilitado a introdução de elementos fisiológicos mais complexos e relevantes em modelos in vitro , recriando características morfológicas intrincadas em ambientes tridimensionais com interações dinâmicas ausentes nos modelos convencionais. Implementamos um modelo de co-cultura de carcinoma de células renais (CCR) para recriar a conversa cruzada entre tecido renal saudável e maligno.
Este modelo é baseado na plataforma de múltiplos órgãos referenciada e consiste na co-cultura de um túbulo proximal renal reconstruído com esferoides do CCR. Câmaras impressas em 3D projetadas sob medida foram usadas para cultivar células do túbulo proximal epitelial renal humano (RPTEC) e facilitar sua automontagem em um túbulo renal contido em uma matriz de colágeno tipo I. As células Caki-1 RCC foram incorporadas em uma matriz de colágeno em ágar, formando posteriormente esferoides cancerígenos. Tanto o colágeno quanto o ágar/gel de colágeno foram otimizados para manter sua integridade durante a perfusão cíclica e resistir ao estresse de cisalhamento durante um período mínimo de cultivo de 7 dias.
Os géis também permitem o fornecimento adequado de nutrientes e secreções celulares. Além disso, os géis de ágar/colágeno limitam a proliferação excessiva de células RCC, garantindo um tamanho esferóide relativamente homogêneo. Os circuitos microfluídicos do chip MPS compreendem duas câmaras de cultura independentes com o tamanho de um poço padrão de 96 microplacas. O túbulo renal e os géis do CCR preenchem câmaras separadas e compartilham o mesmo meio de cultura, que é recirculado aproximadamente duas vezes por minuto. Nessas condições, observamos regulação positiva da expressão e secreção do fator imune nos túbulos renais (interleucina-8 e fator de necrose tumoral-alfa). Os túbulos renais também mudam sua atividade metabólica para a glicólise sob a influência do CCR. Esta nova abordagem demonstra que um MPS baseado em co-cultura pode amplificar a complexidade do CCR in vitro e ser empregado para estudar o impacto do câncer em células não tumorais.
Introdução
Os avanços nos sistemas de cultura de células 3D revolucionaram a engenharia de tecidos e a medicina regenerativa, oferecendo modelos fisiologicamente mais relevantes em comparação com as culturas 2D tradicionais 1,2. Neste estudo, utilizamos matrizes de gel de colágeno e colágeno-agarose, dada a sua capacidade de mimetizar o ambiente da matriz extracelular (MEC), promovendo comportamento e função celular mais precisos, ao mesmo tempo em que são compatíveis com as condições dinâmicas de cultura empregadas.
O colágeno, a proteína mais abundante na MEC, desempenha um papel crucial na manutenção da integridade estrutural e da atividade biológica dos tecidos3. O colágeno tipo I, comumente proveniente da cauda de rato, foi favorecido por sua biocompatibilidade e capacidade de ser adaptado para atender a diferentes condições de rigidez da matriz, além de fornecer um substrato comprovado para células epiteliais4. Na matriz de colágeno 3D, as células renais recebem um andaime que suporta sua adesão, proliferação e diferenciação. Esse ambiente permite que as células exibam morfologias e comportamentos mais naturais, incluindo padrões de expressão gênica e interações celulares que refletem condições in vivo 5. Consequentemente, os géis de colágeno têm sido amplamente utilizados em aplicações que vão desde a pesquisa do câncer até a engenharia de tecidos devido à sua capacidade de replicar os papéis de suporte e regulamentação da MEC.
A linha celular epitelial tubular proximal renal imortalizada RPTEC/TERT1 foi usada para representar o epitélio renal saudável. Esta linhagem celular superexpressa a transcriptase reversa da telomerase humana, permitindo que ela prolifere em cultura, mantendo um fenótipo RPTEC representativo. A matriz de gel de colágeno tipo I de cauda de rato foi empregada para recriar o microambiente renal. Esta matriz de gel de colágeno suporta as células RPTEC / TERT16 na manutenção de suas características nativas e funções fisiológicas. Em contraste, uma matriz híbrida de gel de colágeno-agarose é utilizada para cultivar células de carcinoma de células renais (Caki-1). A agarose, um polissacarídeo derivado de algas marinhas, adiciona outra dimensão aos sistemas de cultura de células 3D. É termicamente reversível, permitindo fácil manuseio e manipulação durante o processo de preparo7. Os géis de agarose fornecem uma matriz de suporte neutra que mantém a viabilidade celular e promove a formação de estruturas complexas pela proliferação de células cancerígenas. Quando combinado com colágeno, o gel híbrido resultante aproveita as pistas bioquímicas do colágeno e o suporte estrutural da agarose. Essa combinação cria um microambiente adequado para as células Caki-1 do carcinoma de células renais (CCR)8 para crescimento em esferoides e é usada como modelo de câncer renal.
O uso dessas diferentes matrizes 3D para células RPTEC/TERT1 e Caki-1 ressalta a importância de adaptar o ambiente ECM às necessidades específicas de diferentes tipos de células. Os géis que compõem o RPTEC, representando o epitélio renal saudável, ou as células Caki-1, representando o CCR, foram combinados em um sistema microfluídico que recircula os meios de cultura entre as células, expondo efetivamente o modelo de células renais saudáveis às secreções do CCR, sem contato direto. A plataforma TissUse HUMUMIC 9,10 (doravante denominada plataforma de chip de múltiplos órgãos) empregada neste estudo consiste em um chip de microfisiologia com dois circuitos fluídicos independentes, com fluxo acionado por uma unidade de perfusão externa.
Protocolo
NOTA: Esses protocolos descrevem as etapas abrangentes para preparar géis de colágeno-agarose 3D, injetar células, perfundir as amostras e extraí-las para análise posterior. Ajuste os tempos e condições de incubação com base em requisitos experimentais específicos.
1. Preparação da matriz de gel de colágeno e agarose
- Impressão 3D
NOTA: Para criar a forma apropriada para a matriz de gel, desenvolvemos um design de câmara exclusivo que molda o gel em uma forma organoide fisiologicamente relevante (consulte o Arquivo Suplementar 1).- Projete as câmaras usando software de design assistido por computador. A câmara compreende quatro compartimentos paralelos: dois compartimentos de células, um compartimento de matriz e um canal de conexão (Figura 1 e Figura 2).
- Construir as câmaras por impressão 3D; Um bico de aquecimento derrete um filamento de bioplástico e deposita camada por camada. Para seguir este protocolo, use polipropileno (PP), um filamento de bioplástico não tóxico e uma impressora 3D do tipo cartesiano, com o nome do sistema de coordenadas XYZ.
- Adicione um recurso de forma de cone reverso aos compartimentos das células para direcionar as células para o canal.
- Dê uma forma redonda ao compartimento da matriz, o que é crucial para a formação do gel de colágeno.
- Conecte os compartimentos da célula e da matriz com um canal (diâmetro 0,04 mm, Figura 3B), permitindo que as células fluam do compartimento da célula para o compartimento da matriz e se fixem à superfície do tubo.
- Preparação de matriz de colágeno para o cultivo de células RPTEC-TERT1
NOTA: Este procedimento garante que a matriz de colágeno seja preparada corretamente e carregada na câmara, criando um ambiente adequado para a subsequente injeção e cultivo de células RPTEC/TERT1 e o crescimento da estrutura celular 3D. Certifique-se de que todas as etapas sejam executadas em condições estéreis para evitar contaminação.- Prepare a solução de reticulação misturando 50 μL de Genipin (30 mM) com 50 μL de NaOH (1 M) usando um vórtice para garantir uma mistura completa.
- Adicione 1.000 μL de colágeno tipo I à solução preparada de Genipin e NaOH, mantendo a mistura no gelo para evitar a gelificação prematura. Misturar novamente a solução com um vórtice para obter uma mistura homogénea.
NOTA: Mantenha a solução misturada no gelo continuamente para evitar gelificação prematura. - Usando uma ponta de pipeta de 1.000 μL, colete toda a solução preparada e adicione 150-200 μL da solução no compartimento da matriz da câmara impressa em 3D.
- Deixe a matriz polimerizar mantendo a câmara na incubadora de CO2 a 37 oC por 60-90 min. Adicione 150 μL de meio de cultura no topo da matriz e deixe-o durante a noite na incubadora.
- Preparação de matriz colágeno-agarose e incorporação de células Caki-1
NOTA: As células RPTEC/TERT1 e Caki-1 foram cultivadas usando o mesmo meio de cultura, consistindo em meio DMEM F-12 com alto teor de glicose suplementado com ITS (10 μg/mL de insulina, 5,5 μg/mL de transferrina e 5 ng/mL de selenito de sódio), 10 ng/mL de fator de crescimento epidérmico (EGF), 36 ng/mL de hidrocortisona, 100 U/mL de penicilina, 100 μg/mL de estreptomicina (5% v/v) e 10% (v/v) de soro fetal de bezerro (FCS).- Dissolva o pó de agarose em água estéril ou DPBS para atingir uma concentração final de 2%. Colocar a solução de agarose num bloco de aquecimento regulado para 85 oC para assegurar a dissolução completa.
NOTA: Manuseie a solução de agarose com cuidado devido à sua sensibilidade à temperatura.
- Dissolva o pó de agarose em água estéril ou DPBS para atingir uma concentração final de 2%. Colocar a solução de agarose num bloco de aquecimento regulado para 85 oC para assegurar a dissolução completa.
- Incorporação de células Caki-1
- Separe as células Caki-1 de seus frascos de cultura adicionando 1x tripsina-EDTA e incubando a 37 ° C até que as células se desprendam. Neutralize a tripsina 1x adicionando um volume igual de meio de cultura.
- Colete a suspensão celular, conte as células e centrifugue a 2.500 × g por 5 min. Rejeitar o sobrenadante e ressuspender os sedimentos celulares em meio de cultura fresco até uma concentração final de 1 × 103 células/ml (Caki-1).
NOTA: Certifique-se de que a suspensão da célula esteja bem misturada e livre de grumos antes de carregar na câmara. - Adicione 25 μL de suspensão celular em um tubo de microcentrífuga de 1,5 mL.
NOTA: Certifique-se de que a seringa ou pipeta esteja esterilizada e apropriada para o manuseio das células. - Adicione 75 μL de colágeno tipo I no tubo com a suspensão celular e o vórtice.
NOTA: Mantenha a mistura no gelo continuamente para evitar a gelificação prematura. - Adicione 100 μL de gel de agarose derretido a 2% e misture cuidadosamente em vórtice até que o gel fique homogêneo.
NOTA: Garanta uma distribuição uniforme das células dentro do gel. Evite introduzir bolhas de ar durante a injeção, pois elas podem atrapalhar a distribuição celular e a integridade do gel! - Após 1 h, adicione 150 μL de meio celular no topo da matriz e remova-o da câmara usando uma espátula. Coloque as matrizes 3D com células em uma placa de 24 poços com 1.000 μL de meio de cultura e incube a 37 °C, 5% de CO2.
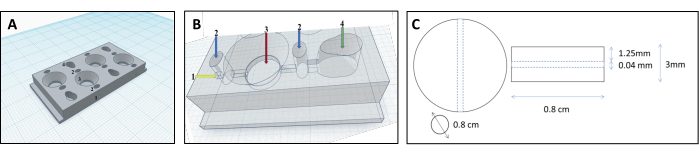
Figura 1: Projeto de câmara impressa em 3D para a reconstrução de túbulos renais. (A,B) Representação da câmara impressa em 3D projetada para acomodar uma matriz de colágeno reticulada para reconstruir túbulos renais. Cada câmara consiste em quatro compartimentos individuais, que são usados para produzir uma quantidade igual de géis. 1 ponto de inserção para o filamento, 2 pré-câmaras a serem preenchidas com ágar apenas para evitar vazamentos, 3 câmaras de colágeno, câmara de 4 células. (C) Dimensões do gel de colágeno reticulado e do túbulo renal incorporado. Clique aqui para ver uma versão maior desta figura.

Figura 2: Preparação de géis de colágeno e ágar-colágeno. (A) Câmara impressa em 3D com filamentos inseridos. (B) A solução de colágeno reticulado é dispensada nos poços da câmara (C) A câmara preenchida com solução de colágeno é colocada na incubadora para facilitar a polimerização da matriz (D) Coleta de células RPTEC-TERT1 antes da injeção na matriz de colágeno (E) Adição de suspensão celular no compartimento celular da câmara (F) Remoção do filamento com o auxílio de pinça, permitindo que as células povoem a estrutura tubular oca dentro da matriz (G) Suspensão das células do CCR misturadas com colágeno em tubo de 1,5mL (H) Adição de solução de ágar 2% às células para gerar o gel do CCR. (I) Os géis são colocados na incubadora para facilitar a gelificação da matriz (J,K,L) Remover o gel de colágeno polimerizado com os túbulos renais da câmara impressa em 3D com o auxílio de uma espátula e colocá-los em uma placa de 24 poços antes do processamento posterior (M,N,O) Remover o gel de colágeno-ágar polimerizado com as células do CCR com o auxílio de uma espátula, e colocá-los em uma placa de 24 poços antes de continuar o processamento Clique aqui para ver uma versão maior desta figura.

Figura 3: Montagem do sistema de cultura microfluídica. (A,B) Abertura dos compartimentos de cultura do chip Humimic2 usando uma ferramenta dedicada (C) Depois de remover o meio de cultura usado para lavar o chip, adicione 400 μL de meio de cultura fresco. (D, E) Após a remoção dos géis renal e CCR das respectivas placas de 24 poços, coloque cada gel no compartimento de cultura de um único circuito de perfusão do chip Humimic usando espátulas para manusear os géis. (F, G) Após o posicionamento dos géis no chip, as câmaras de cultura são seladas e o chip é ligado à unidade de perfusão por meio de três microbombas em cada circuito microfluídico, conectadas por tubos especializados. (H) Os chips são colocados na incubadora durante o período de cultura (I) Parâmetros de perfusão definidos na unidade de controle. Clique aqui para ver uma versão maior desta figura.
2. Injeção de células RPTEC / TERT1
- Injeção de células RPTEC/TERT1
- Separe as células RPTEC/TERT1 de seus frascos de cultura adicionando 1x tripsina-EDTA e incubando a 37 °C até que as células se desprendam.
- Neutralize a tripsina 1x adicionando um volume igual de meio de cultura com suplementos. Recolha a suspensão celular e centrifugue a 2.500 × g durante 5 min.
- Rejeitar o sobrenadante e ressuspender os sedimentos celulares em meio de cultura fresco até uma concentração final de 1 × 106 células/ml (RPTEC/TERT1). Certifique-se de que a suspensão celular esteja bem misturada e livre de grumos antes de carregar na câmara.
- Carregue 10 μL da suspensão celular preparada em uma micropipeta com uma ponta de 10 μL. Certifique-se de que a pipeta esteja esterilizada e apropriada para o manuseio de células. Injete cuidadosamente a suspensão celular no colágeno solidificado (etapa 1.2.4) através do compartimento celular dentro da câmara.
- Remova suavemente o filamento usando uma pinça, permitindo que as células preencham a estrutura tubular oca dentro da matriz
NOTA: Garanta uma distribuição uniforme das células dentro do gel. Evite introduzir bolhas de ar durante a injeção, pois elas podem interromper a distribuição celular e a integridade do gel. - Colocar as câmaras numa incubadora a 37 °C, CO 5%2 . Após 60 min, adicione 150 μL de mídia celular na parte superior da matriz para evitar o ressecamento. Incubar durante 24 h para permitir que as células se aclimatem e se integrem na matriz de gel.
- No dia seguinte, remova a matriz da câmara usando uma espátula. Coloque as matrizes 3D com células em uma placa de 24 poços com 1.000 μL de meio de cultura e incube a 37 ° C com 5% de CO2.
NOTA: Os géis preparados com o túbulo renal reconstruído e os esferoides CCR incorporados serão adicionados ao sistema de microfluidos para co-cultura
3. Perfusão de amostras de células 3D
- Perfusão celular 3D no sistema de chip de múltiplos órgãos
- Conecte o chip com a célula 3D ao sistema de perfusão com tubulação.
- Defina o sistema: Frequência: 0.25 Hz, Vácuo: -220 mbar, Pressão: 800 mbar e conecte o chip 2 ao sistema (Figura 3).
- Cultive a cultura de células 3D dinâmica por 5 dias em uma incubadora a 37 °C com 5% de CO2.
4. 3D amostras de células após a coleta de perfusão
- Coleta e análise pós-perfusão
- Remova os géis do sistema de perfusão e enxágue-os com PBS.
- Fixe os géis colocando as amostras em paraformaldeído a 2% por 2-3 h em temperatura ambiente. Armazenar amostras fixas a 4 ºC.
- Manchar os géis com corantes (por exemplo, Hoechst33342, faloidina, ZO1, tubulina).
- Após 5 dias de perfusão usando o sistema de chip de múltiplos órgãos, vários ensaios e métodos foram realizados nas culturas de células 3D e meios coletados para avaliar a viabilidade celular, morfologia, níveis de expressão gênica e ajustes funcionais. As células RPTEC/TERT1 na matriz de gel de colágeno e as células Caki-1 na matriz de colágeno-agarose mantêm alta viabilidade; Confirme isso usando ensaios de viabilidade, como coloração viva / morta.
Resultados
O sistema HUMIMIC fornece um ambiente dinâmico que permite o fornecimento contínuo de nutrientes e oxigênio enquanto remove os resíduos metabólicos, mantendo assim a viabilidade e a função celular por longos períodos. Esses sistemas são particularmente benéficos para a criação de modelos complexos de órgãos em um chip que replicam o microambiente de tecidos específicos. Ele é projetado especificamente para aplicações de órgão em um chip e permite o controle preciso do...
Discussão
O protocolo descrito neste estudo representa o desenvolvimento de um modelo complexo de câncer renal, alavancando a integração de dois tipos distintos de células - células epiteliais tubulares proximais renais (RPTEC / TERT1) e células de carcinoma de células renais (Caki-1) - dentro de matrizes específicas de colágeno e gel de colágeno-agarose em um sistema microfluídico. A preparação de géis de colágeno é fundamental para o sucesso deste modelo. A concentração precisa...
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Maryna Somova foi apoiada pela Bolsa de Doutorado da Universidade de Greifswald - Landesgraduiertenförderungsgesetzes (Lei de Financiamento Estatal de Pós-Graduação) de Mecklemburgo-Pomerânia Ocidental. Os autores gostariam de agradecer ao Dr. Janosh Schoon e Dirk Stobe, do Centro de Ortopedia, Cirurgia de Trauma e Medicina de Reabilitação, University Medicine Greifswald, por seus insights sobre cultura de células 3D e preparação de amostras.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5-2.0 mL tubes | Eppendorf | 003012/10237-20205 | |
| 24-well plates | Sarstedt | 83.3922.500 | |
| 3D printer | Prusa | ||
| Agarose | Carl Roth | 3810.3 | |
| AutoDesk Tinker CAD software | computer-assisted design software | ||
| Caki-1 cells | ATCC | HTB-46 | |
| Caspase activity | Promega | G8090 | Caspase 3/7 assay |
| Cell viability | Promega | G7570 | Cell Titer Glo assay |
| Collagen Type I – rat tail, 3.0 mg/mL | Corning | 354236 | |
| DMEM/12F Medium | PAN Biotech | PO4-41650 | |
| DPBS solution | PAN Biotech | P04-53500 | |
| Epidermal Growth Factor | Merck | E4127 | |
| Fetal Calf Serum | PAN Biotech | P30-3033 | |
| Genipin (30 mM) | Merck | G4796 | |
| HUMIMIC chips 2 | TissUse | multi-organ chips | |
| HUMIMIC control unit | TissUse | multi-organ chip control unit | |
| Hydrocortisone | Merck | H6909 | |
| Incubator (37 °C, 5% CO2) | nd | ||
| Insulin,Sodium selenite,Transferrin (IST) | Merck | I1884 | |
| LDH release | Promega | J2380 | |
| Metal spatula | nd | ||
| NaOH (1 M) | Carl Roth | P031.2 | |
| Petri dishes | Sarstedt | 82.1135.500 | |
| Polypropylene (PP) filament | Verbatin | 55952 | |
| RNA-easy extraction kit | Qiagen | 74104 | |
| RPTEC/TERT cells | ATCC | CRL - 4031 | |
| TNF-alfa ELISA | R&D Systems | DY210-05 | |
| Triiodothyronine (T3 ) | Merck | 709611 | |
| Trypsin-EDTA | PAN Biotech | P10-021100 |
Referências
- Ainslie, G. R., et al. Microphysiological lung models to evaluate the safety of new pharmaceutical modalities: A biopharmaceutical perspective. Lab Chip. 19 (19), 3152-3161 (2019).
- Van Ness, K. P., et al. Microphysiological systems to assess nonclinical toxicity. Curr Protoc Toxicol. 73, 14.18.1-14.18.28 (2017).
- Majo, S., et al. Impact of extracellular matrix components to renal cell carcinoma behavior. Front Oncol. 10, 625 (2020).
- Caetano-Pinto, P., et al. Epidermal growth factor receptor mediates the basolateral uptake of phosphorothioate-modified antisense oligonucleotides in the kidney. Organs-on-a-Chip. 4, 100022 (2022).
- Manduca, N., et al. 3D cancer models: One step closer to in vitro human studies. Front Immunol. 14, 1175503 (2023).
- Simon, B. R., et al. The RPTEC/TERT1 cell line models key renal cell responses to the environmental toxicants, benzo[a]pyrene and cadmium. Toxicol Rep. 1, 231-242 (2014).
- Ogura, T., et al. Methods of high integrity RNA extraction from cell/agarose construct. BMC Res Notes. 8, 644 (2015).
- Glube, N., et al. Caki-1 cells represent an in vitro model system for studying the human proximal tubule epithelium. Nephron Exp Nephrol. 107 (2), e47-e56 (2007).
- Kühnl, J., et al. Characterization of application scenario-dependent pharmacokinetics and pharmacodynamic properties of permethrin and hyperforin in a dynamic skin and liver multi-organ-chip model. Toxicology. 448, 152637 (2021).
- Padmyastuti, A., et al. Microfluidic-based prostate cancer model for investigating the secretion of prostate-specific antigen and microRNAs in vitro. Sci Rep. 13 (1), 11623 (2023).
- Zhang, X., et al. Cancer-on-a-Chip: Models for studying metastasis. Cancers (Basel). 14 (3), 648 (2022).
- Sobczuk, P., et al. Choosing the right animal model for renal cancer research. Transl Oncol. 13 (3), 100745 (2020).
- Ewart, L., et al. Performance assessment and economic analysis of a human Liver-Chip for predictive toxicology. Commun Med. 2 (1), 154 (2022).
- Caetano-Pinto, P., et al. Kidney cancer and chronic kidney disease: Too close for comfort. Biomedicines. 9 (12), 1761 (2021).
- Del Piccolo, N., et al. Tumor-on-chip modeling of organ-specific cancer and metastasis. Adv Drug Deliv Rev. 175, 113798 (2021).
- Soo, J. Y. C., et al. Advances in predictive in vitro models of drug-induced nephrotoxicity. Nat Rev Nephrol. 14 (6), 378-393 (2018).
- Chapron, A., et al. An improved vascularized, dual-channel microphysiological system facilitates modeling of proximal tubular solute secretion. ACS Pharmacol Transl Sci. 3 (3), 496-508 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados