È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Co-coltura microfluidica dell'epitelio renale sano e tumorale per modellare la progressione del cancro del rene
In questo articolo
Riepilogo
Qui, presentiamo protocolli che descrivono in dettaglio le istruzioni per l'implementazione di colture cellulari 3D utilizzando matrici di collagene e collagene-agarosio in un sistema microfisiologico. Questi protocolli supportano la co-coltura del tubulo prossimale renale e degli sferoidi del carcinoma a cellule renali, simulando condizioni in vivo e consentendo un'indagine avanzata sulle interazioni tra le cellule tumorali del rene.
Abstract
I sistemi microfisiologici (MPS) hanno permesso l'introduzione di elementi fisiologici più complessi e rilevanti in modelli in vitro , ricreando intricate caratteristiche morfologiche in ambienti tridimensionali con interazioni dinamiche prive di modelli convenzionali. Abbiamo implementato un modello di co-coltura di carcinoma a cellule renali (RCC) per ricreare il cross-talk tra tessuto renale sano e maligno.
Questo modello si basa sulla piattaforma multiorgano di riferimento e consiste nella co-coltura di un tubulo prossimale renale ricostruito con sferoidi RCC. Camere stampate in 3D progettate su misura sono state utilizzate per coltivare cellule del tubulo prossimale epiteliale renale umano (RPTEC) e facilitare il loro autoassemblaggio in un tubulo renale contenuto in una matrice di collagene di tipo I. Le cellule Caki-1 RCC sono state incorporate in una matrice di collagene agar, formando successivamente sferoidi tumorali. Sia il collagene che i gel di agar/collagene sono stati ottimizzati per mantenere la loro integrità durante la perfusione ciclica e resistere allo stress da taglio durante un periodo di coltura minimo di 7 giorni.
I gel consentono anche un adeguato apporto di nutrienti e secrezioni cellulari. Inoltre, i gel di agar/collagene limitano la proliferazione eccessiva delle cellule RCC, garantendo dimensioni relativamente omogenee degli sferoidi. I circuiti microfluidici MPS sono costituiti da due camere di coltura indipendenti con le dimensioni di un pozzetto standard da 96 micropiastre. Il tubulo renale e i gel RCC popolano camere separate e condividono lo stesso terreno di coltura, che viene rimesso in circolo circa due volte al minuto. In queste condizioni, abbiamo osservato una sovraregolazione dell'espressione e della secrezione di fattori immunitari nei tubuli renali (interleuchina-8 e fattore di necrosi tumorale-alfa). I tubuli renali spostano anche la loro attività metabolica verso la glicolisi sotto l'influenza del RCC. Questo nuovo approccio dimostra che una MPS basata su co-coltura può amplificare la complessità dell'RCC in vitro ed essere impiegata per studiare l'impatto del cancro sulle cellule non tumorali.
Introduzione
I progressi nei sistemi di coltura cellulare 3D hanno rivoluzionato l'ingegneria tissutale e la medicina rigenerativa offrendo modelli più rilevanti dal punto di vista fisiologico rispetto alle tradizionali colture 2D 1,2. In questo studio, abbiamo utilizzato matrici in gel di collagene e collagene-agarosio, data la loro capacità di imitare l'ambiente della matrice extracellulare (ECM), promuovendo un comportamento e una funzione cellulare più accurati, pur essendo compatibili con le condizioni di coltura dinamiche impiegate.
Il collagene, la proteina più abbondante nella MEC, svolge un ruolo cruciale nel mantenimento dell'integrità strutturale e dell'attività biologica dei tessuti3. Il collagene di tipo I, comunemente proveniente dalla coda di ratto, è stato favorito per la sua biocompatibilità e capacità di essere adattato per soddisfare diverse condizioni di rigidità della matrice, oltre a fornire un substrato collaudato per le cellule epiteliali4. Nella matrice di collagene 3D, le cellule renali sono dotate di un'impalcatura che ne supporta l'adesione, la proliferazione e la differenziazione. Questo ambiente consente alle cellule di esibire morfologie e comportamenti più naturali, compresi i modelli di espressione genica e le interazioni cellulari che riflettono le condizioni in vivo 5. Di conseguenza, i gel di collagene sono stati ampiamente utilizzati in applicazioni che vanno dalla ricerca sul cancro all'ingegneria tissutale grazie alla loro capacità di replicare i ruoli di supporto e regolazione della ECM.
La linea cellulare epiteliale tubulare prossimale renale immortalizzata RPTEC/TERT1 è stata utilizzata per rappresentare l'epitelio renale sano. Questa linea cellulare sovraesprime la trascrittasi inversa della telomerasi umana, consentendole di proliferare in coltura, pur mantenendo un fenotipo RPTEC rappresentativo. La matrice in gel di collagene di coda di ratto di tipo I è stata impiegata per ricreare il microambiente renale. Questa matrice di gel di collagene supporta le cellule RPTEC/TERT16 nel mantenere le loro caratteristiche native e le funzioni fisiologiche. Al contrario, una matrice ibrida di gel di collagene-agarosio viene utilizzata per la coltura di cellule di carcinoma a cellule renali (Caki-1). L'agarosio, un polisaccaride derivato dalle alghe, aggiunge un'altra dimensione ai sistemi di coltura cellulare 3D. È termicamente reversibile, consentendo una facile manipolazione e manipolazione durante il processo di preparazione7. I gel di agarosio forniscono una matrice di supporto neutra che mantiene la vitalità cellulare e promuove la formazione di strutture complesse attraverso la proliferazione delle cellule tumorali. Se combinato con il collagene, il gel ibrido risultante sfrutta i segnali biochimici del collagene e il supporto strutturale dell'agarosio. Questa combinazione crea un microambiente adatto per le cellule Caki-18 del carcinoma a cellule renali (RCC) per la crescita in sferoidi e viene utilizzata come modello di cancro del rene.
L'uso di queste diverse matrici 3D per le cellule RPTEC/TERT1 e Caki-1 sottolinea l'importanza di adattare l'ambiente ECM alle esigenze specifiche dei diversi tipi di cellule. I gel che comprendono RPTEC, che rappresenta l'epitelio renale sano, o cellule Caki-1, che rappresentano l'RCC, sono stati combinati in un sistema microfluidico che fa ricircolare i terreni di coltura tra le cellule, esponendo efficacemente il modello di cellula renale sana alle secrezioni dell'RCC, senza contatto diretto. La piattaforma TissUse HUMUMIC 9,10 (d'ora in poi denominata piattaforma di chip multiorgano) impiegata in questo studio è costituita da un chip di microfisiologia con due circuiti fluidici indipendenti, con flusso guidato da un'unità di perfusione esterna.
Access restricted. Please log in or start a trial to view this content.
Protocollo
NOTA: Questi protocolli delineano i passaggi completi per la preparazione di gel 3D di collagene-agarosio, l'iniezione di cellule, la perfusione dei campioni e l'estrazione per ulteriori analisi. Regolare i tempi e le condizioni di incubazione in base a specifici requisiti sperimentali.
1. Preparazione della matrice in gel di collagene e agarosio
- Stampa 3D
NOTA: Per creare la forma appropriata per la matrice di gel, abbiamo sviluppato un design unico della camera che modella il gel in una forma organoide fisiologicamente rilevante (vedi File supplementare 1).- Progetta le camere utilizzando un software di progettazione assistita da computer. La camera comprende quattro compartimenti paralleli: due compartimenti cellulari, un compartimento della matrice e un canale di collegamento (Figura 1 e Figura 2).
- Costruisci le camere con la stampa 3D; Un ugello riscaldante fonde un filamento di bioplastica e lo deposita strato dopo strato. Per seguire questo protocollo, utilizzare il polipropilene (PP), un filamento bioplastico non tossico, e una stampante 3D di tipo cartesiano, che prende il nome dal sistema di coordinate XYZ.
- Aggiungi una funzione di forma a cono inverso ai compartimenti cellulari per dirigere le cellule nel canale.
- Dai una forma rotonda al compartimento della matrice, che è fondamentale per formare il gel di collagene.
- Collegare i compartimenti della cellula e della matrice con un canale (diametro 0,04 mm, Figura 3B), consentendo alle cellule di fluire dal compartimento cellulare al compartimento della matrice e di attaccarsi alla superficie del tubo.
- Preparazione di matrice di collagene per la coltivazione di cellule RPTEC-TERT1
NOTA: Questa procedura garantisce che la matrice di collagene sia preparata correttamente e caricata nella camera, creando un ambiente adatto per la successiva iniezione e coltivazione di cellule RPTEC/TERT1 e la crescita della struttura cellulare 3D. Assicurarsi che tutti i passaggi vengano eseguiti in condizioni sterili per evitare contaminazioni.- Preparare la soluzione reticolante mescolando 50 μL di genipina (30 mM) con 50 μL di NaOH (1 M) utilizzando un vortice per garantire una miscelazione accurata.
- Aggiungere 1.000 μl di collagene di tipo I alla soluzione preparata di genipina e NaOH mantenendo la miscela sul ghiaccio per evitare la gelificazione prematura. Mescolare nuovamente la soluzione utilizzando un vortice per ottenere una miscela omogenea.
NOTA: Tenere continuamente la soluzione miscelata sul ghiaccio per evitare la gelificazione prematura. - Utilizzando un puntale per pipetta da 1.000 μl, raccogliere l'intera soluzione preparata e aggiungere 150-200 μl di soluzione nello scomparto della matrice della camera stampata in 3D.
- Lasciare polimerizzare la matrice mantenendo la camera nell'incubatore di CO2 a 37 oC per 60-90 min. Aggiungere 150 μl di terreno di coltura sulla parte superiore della matrice e lasciarlo per una notte nell'incubatore.
- Preparazione della matrice di collagene-agarosio e inclusione di cellule di Caki-1
NOTA: Entrambe le cellule RPTEC/TERT1 e Caki-1 sono state coltivate utilizzando lo stesso terreno di coltura, costituito da terreni DMEM F-12 ad alto glucosio integrati con ITS (10 μg/mL di insulina, 5,5 μg/mL di transferrina e 5 ng/mL di selenito di sodio), 10 ng/mL di fattore di crescita epidermico (EGF), 36 ng/mL di idrocortisone, 100 U/mL di penicillina, 100 μg/mL di streptomicina (5% v/v) e 10% (v/v) di siero fetale di vitello (FCS).- Sciogliere la polvere di agarosio in acqua sterile o DPBS per ottenere una concentrazione finale del 2%. Porre la soluzione di agarosio su un blocco riscaldante impostato a 85 oC per garantire la completa dissoluzione.
NOTA: Maneggiare con cura la soluzione di agarosio a causa della sua sensibilità alla temperatura.
- Sciogliere la polvere di agarosio in acqua sterile o DPBS per ottenere una concentrazione finale del 2%. Porre la soluzione di agarosio su un blocco riscaldante impostato a 85 oC per garantire la completa dissoluzione.
- Inclusione di cellule Caki-1
- Staccare le cellule Caki-1 dai loro palloni di coltura aggiungendo 1x tripsina-EDTA e incubarle a 37 °C fino a quando le cellule non si staccano. Neutralizzare la tripsina 1x aggiungendo un volume uguale di terreno di coltura.
- Raccogliere la sospensione cellulare, contare le cellule e centrifugare a 2.500 × g per 5 minuti. Scartare il surnatante e risospendere i pellet cellulari in terreno di coltura fresco fino a una concentrazione finale di 1 × 103 cellule/mL (Caki-1).
NOTA: Assicurarsi che la sospensione cellulare sia accuratamente miscelata e priva di grumi prima di caricarla nella camera. - Aggiungere 25 μl di sospensione cellulare in una provetta per microcentrifuga da 1,5 mL.
NOTA: Assicurarsi che la siringa o la pipetta sia sterilizzata e appropriata per la manipolazione delle cellule. - Aggiungere 75 μl di collagene di tipo I nella provetta con la sospensione cellulare e il vortice.
NOTA: Tenere la miscela continuamente sul ghiaccio per evitare una gelificazione prematura. - Aggiungere 100 μL di gel di agarosio fuso al 2% e mescolare accuratamente a vortice fino a quando il gel diventa omogeneo.
NOTA: Garantire una distribuzione uniforme delle cellule all'interno del gel. Evitare l'introduzione di bolle d'aria durante l'iniezione, poiché possono interrompere la distribuzione cellulare e l'integrità del gel! - Dopo 1 ora, aggiungere 150 μL di terreno cellulare nella parte superiore della matrice e rimuoverlo dalla camera utilizzando una spatola. Posizionare le matrici 3D con le cellule in una piastra a 24 pozzetti con 1.000 μL di terreno di coltura e incubare a 37 °C, 5% di CO2.
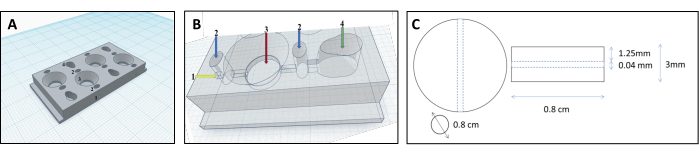
Figura 1: Progettazione di una camera stampata in 3D per la ricostruzione dei tubuli renali. (A,B) Rappresentazione della camera stampata in 3D progettata per ospitare una matrice di collagene reticolato per ricostruire i tubuli renali. Ogni camera è composta da quattro scomparti individuali, che vengono utilizzati per produrre una quantità uguale di gel. 1-punto di inserimento per il filamento, 2-pre-camere da riempire solo con agar per evitare perdite, camera a 3 collageni, camera a 4 celle. (C) Dimensioni del gel di collagene reticolato e del tubulo renale incorporato. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Preparazione di gel di collagene e agar-collagene. (A) Camera stampata in 3D con filamenti inseriti. (B) La soluzione di collagene reticolato viene erogata nei pozzetti della camera (C) La camera riempita con soluzione di collagene viene posta nell'incubatore per facilitare la polimerizzazione della matrice (D) Raccolta delle cellule RPTEC-TERT1 prima dell'iniezione nella matrice di collagene (E) Aggiunta di sospensione cellulare al compartimento cellulare della camera (F) Rimozione del filamento con l'aiuto di una pinza, consentendo alle cellule di popolare la struttura tubolare cava all'interno della matrice (G) Sospensione di cellule RCC mescolate con collagene in una provetta da 1,5 ml (H) Aggiunta di una soluzione di agar al 2% delle cellule per generare il gel RCC. (I) I gel vengono inseriti nell'incubatore per facilitare la gelificazione della matrice (J,K,L) Rimozione del gel di collagene polimerizzato con i tubuli renali dalla camera stampata in 3D con l'aiuto di una spatola e posizionamento in una piastra a 24 pozzetti prima di un'ulteriore lavorazione (M,N,O) Rimozione del gel di collagene-agar polimerizzato con le cellule RCC con l'aiuto di una spatola, e il loro posizionamento in una piastra a 24 pozzetti prima di un'ulteriore elaborazione Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Assemblaggio del sistema di coltura microfluidica. (A,B) Apertura dei compartimenti di coltura del chip Humimic2 utilizzando uno strumento dedicato (C) Dopo aver rimosso il terreno di coltura utilizzato per lavare il chip, aggiungere 400 μL di terreno di coltura fresco. (D,E) Dopo aver rimosso i gel renali e RCC dalle rispettive piastre a 24 pozzetti, posizionare ciascun gel nel compartimento di coltura di un singolo circuito di perfusione del chip Humimic utilizzando le spatole per maneggiare i gel. (F,G) Dopo aver posizionato i gel nel chip, le camere di coltura vengono sigillate e il chip viene collegato all'unità di perfusione attraverso tre micropompe in ciascun circuito microfluidico, collegate da tubi specializzati. (H) I chip vengono inseriti nell'incubatore per la durata del periodo di coltura (I) Parametri di perfusione impostati nell'unità di controllo. Clicca qui per visualizzare una versione più grande di questa figura.
2. Iniezione di cellule RPTEC/TERT1
- Iniezione di cellule RPTEC/TERT1
- Staccare le cellule RPTEC/TERT1 dai loro flaconi di coltura aggiungendo 1x tripsina-EDTA e incubando a 37 °C fino a quando le cellule non si staccano.
- Neutralizzare la tripsina 1x aggiungendo un volume uguale di terreno di coltura con integratori. Raccogliere la sospensione cellulare e centrifugare a 2.500 × g per 5 minuti.
- Scartare il surnatante e risospendere i pellet cellulari in un terreno di coltura fresco fino a una concentrazione finale di 1 × 106 cellule/mL (RPTEC/TERT1). Assicurarsi che la sospensione cellulare sia accuratamente miscelata e priva di grumi prima di caricarla nella camera.
- Caricare 10 μl della sospensione cellulare preparata in una micropipetta con puntale da 10 μl. Assicurarsi che la pipetta sia sterilizzata e appropriata per la manipolazione delle cellule. Iniettare con cautela la sospensione cellulare nel collagene solidificato (passaggio 1.2.4) attraverso il compartimento cellulare all'interno della camera.
- Rimuovere delicatamente il filamento usando una pinza, consentendo alle cellule di popolare la struttura tubolare cava all'interno della matrice
NOTA: Garantire una distribuzione uniforme delle cellule all'interno del gel. Evitare l'introduzione di bolle d'aria durante l'iniezione, poiché possono interrompere la distribuzione cellulare e l'integrità del gel. - Collocare le camere in un incubatore a 37 °C, 5% CO2 . Dopo 60 minuti, aggiungere 150 μL di terreno cellulare sulla parte superiore della matrice per evitare che si secchi. Incubare per 24 ore per consentire alle cellule di acclimatarsi e integrarsi nella matrice gel.
- Il giorno successivo, rimuovere la matrice dalla camera utilizzando una spatola. Posizionare le matrici 3D con le cellule in una piastra a 24 pozzetti con 1.000 μl di terreno di coltura e incubare a 37 °C con CO2 al 5%.
NOTA: I gel preparati con il tubulo renale ricostruito e gli sferoidi RCC incorporati saranno aggiunti al sistema di microfluidi per la co-coltura
3. Perfusione di campioni cellulari 3D
- Perfusione cellulare 3D nel sistema di chip multiorgano
- Collegare il chip con la cella 3D al sistema di perfusione con tubi.
- Impostare il sistema: Frequenza: 0,25 Hz, Vuoto: -220 mbar, Pressione: 800 mbar e collegare il chip 2 al sistema (Figura 3).
- Coltivare la coltura cellulare 3D dinamica per 5 giorni in un incubatore a 37 °C con il 5% di CO2.
4. 3D campioni cellulari dopo la raccolta della perfusione
- Raccolta e analisi post perfusione
- Rimuovere i gel dal sistema di perfusione e risciacquarli con PBS.
- Fissare i gel ponendo i campioni in paraformaldeide al 2% per 2-3 ore a temperatura ambiente. Conservare i campioni fissati a 4 ºC.
- Colorare i gel con coloranti (ad es. Hoechst33342, falloidina, ZO1, tubulina).
- Dopo 5 giorni di perfusione utilizzando il sistema di chip multiorgano, sono stati eseguiti vari saggi e metodi sulle colture cellulari 3D e sono stati raccolti terreni per valutare la vitalità cellulare, la morfologia, i livelli di espressione genica e gli aggiustamenti funzionali. Le cellule RPTEC/TERT1 nella matrice di gel di collagene e le cellule Caki-1 nella matrice di collagene-agarosio mantengono un'elevata vitalità; Confermarlo utilizzando saggi di vitalità come la colorazione viva/morta.
Access restricted. Please log in or start a trial to view this content.
Risultati
Il sistema HUMIMIC fornisce un ambiente dinamico che consente l'apporto continuo di nutrienti e ossigeno, rimuovendo al contempo le scorie metaboliche, mantenendo così la vitalità e la funzione cellulare per periodi prolungati. Questi sistemi sono particolarmente utili per la creazione di modelli complessi di organo su chip che replicano il microambiente di tessuti specifici. È progettato specificamente per applicazioni organ-on-a-chip e consente il controllo preciso del flusso del fl...
Access restricted. Please log in or start a trial to view this content.
Discussione
Il protocollo descritto in questo studio rappresenta lo sviluppo di un modello complesso di cancro del rene, sfruttando l'integrazione di due tipi di cellule distinte - cellule epiteliali tubulari prossimali renali (RPTEC/TERT1) e cellule di carcinoma a cellule renali (Caki-1) - all'interno di specifiche matrici di gel di collagene e collagene-agarosio in un sistema microfluidico. La preparazione dei gel di collagene è fondamentale per il successo di questo modello. La precisa concentra...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Maryna Somova è stata sostenuta dalla borsa di studio di dottorato dell'Università di Greifswald - Landesgraduiertenförderungsgesetzes (Legge sul finanziamento statale dei laureati) del Meclemburgo-Pomerania Anteriore. Gli autori desiderano ringraziare il Dr. Janosh Schoon e Dirk Stobe del Center for Orthopedics, Trauma Surgery and Rehabilitation Medicine, University Medicine Greifswald per le loro intuizioni sulla coltura cellulare 3D e sulla preparazione dei campioni.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5-2.0 mL tubes | Eppendorf | 003012/10237-20205 | |
| 24-well plates | Sarstedt | 83.3922.500 | |
| 3D printer | Prusa | ||
| Agarose | Carl Roth | 3810.3 | |
| AutoDesk Tinker CAD software | computer-assisted design software | ||
| Caki-1 cells | ATCC | HTB-46 | |
| Caspase activity | Promega | G8090 | Caspase 3/7 assay |
| Cell viability | Promega | G7570 | Cell Titer Glo assay |
| Collagen Type I – rat tail, 3.0 mg/mL | Corning | 354236 | |
| DMEM/12F Medium | PAN Biotech | PO4-41650 | |
| DPBS solution | PAN Biotech | P04-53500 | |
| Epidermal Growth Factor | Merck | E4127 | |
| Fetal Calf Serum | PAN Biotech | P30-3033 | |
| Genipin (30 mM) | Merck | G4796 | |
| HUMIMIC chips 2 | TissUse | multi-organ chips | |
| HUMIMIC control unit | TissUse | multi-organ chip control unit | |
| Hydrocortisone | Merck | H6909 | |
| Incubator (37 °C, 5% CO2) | nd | ||
| Insulin,Sodium selenite,Transferrin (IST) | Merck | I1884 | |
| LDH release | Promega | J2380 | |
| Metal spatula | nd | ||
| NaOH (1 M) | Carl Roth | P031.2 | |
| Petri dishes | Sarstedt | 82.1135.500 | |
| Polypropylene (PP) filament | Verbatin | 55952 | |
| RNA-easy extraction kit | Qiagen | 74104 | |
| RPTEC/TERT cells | ATCC | CRL - 4031 | |
| TNF-alfa ELISA | R&D Systems | DY210-05 | |
| Triiodothyronine (T3 ) | Merck | 709611 | |
| Trypsin-EDTA | PAN Biotech | P10-021100 |
Riferimenti
- Ainslie, G. R., et al. Microphysiological lung models to evaluate the safety of new pharmaceutical modalities: A biopharmaceutical perspective. Lab Chip. 19 (19), 3152-3161 (2019).
- Van Ness, K. P., et al. Microphysiological systems to assess nonclinical toxicity. Curr Protoc Toxicol. 73, 14.18.1-14.18.28 (2017).
- Majo, S., et al. Impact of extracellular matrix components to renal cell carcinoma behavior. Front Oncol. 10, 625(2020).
- Caetano-Pinto, P., et al. Epidermal growth factor receptor mediates the basolateral uptake of phosphorothioate-modified antisense oligonucleotides in the kidney. Organs-on-a-Chip. 4, 100022(2022).
- Manduca, N., et al. 3D cancer models: One step closer to in vitro human studies. Front Immunol. 14, 1175503(2023).
- Simon, B. R., et al. The RPTEC/TERT1 cell line models key renal cell responses to the environmental toxicants, benzo[a]pyrene and cadmium. Toxicol Rep. 1, 231-242 (2014).
- Ogura, T., et al. Methods of high integrity RNA extraction from cell/agarose construct. BMC Res Notes. 8, 644(2015).
- Glube, N., et al. Caki-1 cells represent an in vitro model system for studying the human proximal tubule epithelium. Nephron Exp Nephrol. 107 (2), e47-e56 (2007).
- Kühnl, J., et al. Characterization of application scenario-dependent pharmacokinetics and pharmacodynamic properties of permethrin and hyperforin in a dynamic skin and liver multi-organ-chip model. Toxicology. 448, 152637(2021).
- Padmyastuti, A., et al. Microfluidic-based prostate cancer model for investigating the secretion of prostate-specific antigen and microRNAs in vitro. Sci Rep. 13 (1), 11623(2023).
- Zhang, X., et al. Cancer-on-a-Chip: Models for studying metastasis. Cancers (Basel). 14 (3), 648(2022).
- Sobczuk, P., et al. Choosing the right animal model for renal cancer research. Transl Oncol. 13 (3), 100745(2020).
- Ewart, L., et al. Performance assessment and economic analysis of a human Liver-Chip for predictive toxicology. Commun Med. 2 (1), 154(2022).
- Caetano-Pinto, P., et al. Kidney cancer and chronic kidney disease: Too close for comfort. Biomedicines. 9 (12), 1761(2021).
- Del Piccolo, N., et al. Tumor-on-chip modeling of organ-specific cancer and metastasis. Adv Drug Deliv Rev. 175, 113798(2021).
- Soo, J. Y. C., et al. Advances in predictive in vitro models of drug-induced nephrotoxicity. Nat Rev Nephrol. 14 (6), 378-393 (2018).
- Chapron, A., et al. An improved vascularized, dual-channel microphysiological system facilitates modeling of proximal tubular solute secretion. ACS Pharmacol Transl Sci. 3 (3), 496-508 (2020).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon