Method Article
تحديد هجرة الخلايا ثلاثية الأبعاد داخل وإلى المواد الحيوية هيدروجيل الحبيبية
In This Article
Summary
يتم هنا تقديم بروتوكول للتقييم الكمي لهجرة الخلايا ثلاثية الأبعاد داخل وداخل واجهة الهلاميات المائية الحبيبية.
Abstract
تتمتع سقالات الهيدروجيل الحبيبية بإمكانيات كبيرة في الطب التجديدي ، حيث تعمل إما كناقلات لتوصيل الخلايا أو كواجهات لتكامل الأنسجة. تقدم هذه المقالة طريقتين جديدتين لقياس هجرة الخلايا داخل وداخل الهلاميات المائية الحبيبية ، مما يسلط الضوء على التطبيقات المميزة لهذه السقالات. أولا ، يتم تقديم مقايسة واجهة أحادية الطبقة للخلية تحاكي نمو الأنسجة إلى هلاميات مائية حبيبية لأغراض التكامل. ثانيا ، تم وصف الاختبار الكروي ، المصمم لتتبع حركة الخلية داخل مصفوفة الهيدروجيل ، وهو مناسب خصيصا للتطبيقات التي تنطوي على توصيل الخلايا. تتيح كلتا الطريقتين قياسات دقيقة ومضبوطة لهجرة الخلايا ، مما يوفر مجموعة أدوات شاملة للباحثين الذين يستخدمون سقالات هيدروجيل حبيبية. ينبع الدافع وراء هذه الأساليب من الحاجة إلى التحكم المخصص في هجرة الخلايا داخل السقالة لتتماشى مع تطبيقات محددة. من خلال تحسين وتوحيد تقنيات القياس الكمي هذه ، يمكن للباحثين تحسين خصائص الهيدروجيل الحبيبي بشكل متكرر ، مما يضمن فعاليتها في سياقات الطب التجديدي المتنوعة. توفر هذه المجموعة القوية من الأدوات الكمية فرصا جديدة لتعزيز سقالات الهيدروجيل الحبيبية ، وتعزيز استخدامها في كل من تطبيقات توصيل الخلايا وتكامل الأنسجة.
Introduction
تتطور المواد الحيوية للتطبيقات العلاجية بشكل متزايد نحو نماذج أكثر تعقيدا وذات صلة لبيئات الخلايا لدراسة تكامل الأنسجة. توفر سقالات المواد الحيوية بنية ثلاثية الأبعاد (3D) لنمو الخلايا وتهدف إلى تقليد الأنسجة المرغوبة1،2. تشتمل نماذج زراعة الخلايا ثلاثية الأبعاد على مصفوفات طبيعية وسقالات اصطناعية تزود الخلايا بمزيد من التعقيد عبر الإشارات الفردية أو الكيميائية3،4. يتم ربط سقالات الهيدروجيل التقليدية بكميات كبيرة ، مما ينتج عنه شبكة نانوية مسامية تسمح بانتشار الجزيئات الصغيرة5،6 ، ولكنها تتطلب تدهورا للهجرة على نطاق الخلية إلى منطقة الأنسجة التي تحتاج إلىإصلاح 7. الهلاميات المائية الحبيبية هي مجموعة فرعية من المواد الحيوية التي لديها إمكانات عالية للترجمة السريرية بسبب توافقها الحيوي ، وقدرتها على التوافق مع الأشكال غير المنتظمة ، وفي كثير من الحالات ، قابليتها للحقن8،9. توفر طبيعتها اللبنة الأساسية ميزة المسامية على نطاق الخلية لتعزيز تسلل الأنسجة وتكوين الأوعية بالإضافة إلى الوحدات النمطية ، مما يسمح بإضافة إشارات غير متجانسة لسلوك الخلية10،11،12. يعد فهم استجابة الخلية وحركتها داخل سقالة ثلاثية الأبعاد أمرا حيويا للأهمية الفسيولوجية في جميع التطبيقات باستخدام المواد الحيوية لتكامل الأنسجة.
ومع ذلك ، فقد ثبت أن دراسة نمو الأنسجة في ثلاثة أبعاد يصعب تحقيقها بدقة كمية. يتطلب التعقيد الموسع لبيئة ثلاثية الأبعاد نماذج في المختبر لهجرة الخلايا لا يمكنها فقط توفير نظرة ثاقبة لسلوك الخلية ولكن أيضا تحسين حالة المواد. استخدمت التقارير المنشورة سابقا عن هجرة خلايا السقالة الحبيبية ثلاثية الأبعاد البذر الموضعي لاستكشاف سلوك الخلية ، والإبلاغ عن التسلل إلى البنية المسامية ومورفولوجيا الخلية13 وغيرها من الكرات الكروية التي تنبت14،15 ، وقياس طول النمو وعدد البراعم. قد تتأثر أطوال هجرة البذر الموضعية بشكل غير متساو بقوى الجاذبية ، وبسبب قيود الفحص المجهري ، لا يمكن أن تكون النتائج طولية. اقتصرت طريقة الإنبات الكروي على القياس الكمي ثنائي الأبعاد عبر الإسقاط الأقصى ، وهو غير قادر على التقاط آلية الغزو الخاضع للرقابة. يتم قياس كلتا الطريقتين في مستوى xy ، والذي يفتقر إلى الفروق الدقيقة اللازمة لتلخيص الحركة الخلوية ثلاثية الأبعاد وتسلل السقالة بشكل كامل.
يصف هذا البروتوكول طريقتين لقياس هجرة الخلايا ، مثل التسلل في المختبر إلى سقالات الهيدروجيل الحبيبية ثلاثية الأبعاد المسامية ، وتحديدا باستخدام سقالات الجسيمات الملدنة الصغيرة التي يسهل اختراقها (MAP)16،17،18،19. الغرض من الطرق التالية هو دراسة سلوك الخلية في المواد الهلامية الحبيبية من خلال التحكم في اتجاه هجرتها لتحليل ثلاثي الأبعاد. أول نهج لمقايسة الهجرة الصاعدة القائمة على طبقة واحدة (MAMA) ، هو نموذج مبسط لتكامل الخلايا الداخلية يوضح التفاعلات الموحدة بين الخلايا والمواد ويعمل كمنصة لتمثيل البيئة الأولية التي تتفاعل فيها الخلايا مع الهلاميات المائية الحبيبية وكذلك لعزل السلوك الفردي قبل تسلل السقالة. والثاني ، المسمى طريقة مقايسة الهجرة الكروية الخارجية ذات الطبقات المتوازية (PLOSMA) ، هو مقايسة هجرة كروية ثلاثية الأبعاد للخلايا ، تستكشف حركة الخلية عندما تكون محاطة بالكامل ببيئة سقالة معقدة ونمذجة حركة الخلية بعد الولادة ، وكذلك الحركة بعد دخول الخلايا بالكامل في هلام حبيبي.
كلتا الطريقتين قابلة للقياس الكمي عن طريق تحليل الصور ثلاثية الأبعاد ويمكن تطبيقهما على دراسة وتحسين تفاعلات المواد والخلايا باستخدام النقاط الزمنية الطولية للطب التجديدي وتطبيقات هندسة الأنسجة ، حيث يكون تعزيز أو تقييد حركة الخلايا ضمن معايير التصميم. بالإضافة إلى ذلك ، تستفيد هذه الطرق من الطرد المركزي للوحة لإعداد مقايسة موحدة متعددة الآبار.
Protocol
تفاصيل الكواشف والمعدات المستخدمة في الدراسة مدرجة في جدول المواد.
1. تحضير هيدروجيل حبيبي
ملاحظة: جسيمات MAP المستخدمة في هذا البروتوكول هي 3.2٪ بالوزن وزن / حجم هلام مع 45.88 مجم / مل PEG-MAL (10 كيلو دالتون) ، و 0.82 مجم / مل RGD ، و 8.06 مجم / مل ميثمال19 ، و 5.62 مجم / مل MMP-2 قابل للتحلل. الصلابة الميكانيكية للهلام هي 15-20 كيلو باسكال لتتناسب مع صلابة الجلد17.
- قم بتوليد جزيئات هيدروجيل حبيبية واستعد لزراعة الخلايا كالمعتاد.
ملاحظة: يصف هذا البروتوكول التحضير المعقم لهلام الجسيمات الملدنة الصغيرة التي يسهل اختراقها ، والتي تم تفصيل إنتاجها بواسطة Roosa et al.18. - قم بإعداد جزيئات الهيدروجيل الحبيبية للاستخدام في المختبر عن طريق التعقيم بثلاث غسلات من كحول الأيزوبروبيل بنسبة 70٪ متبوعة بثلاث غسلات من 1x PBS المعقم.
- قم بإعداد ليثيوم فينيل -2،4،6-ثلاثي ميثيل بنزويل فوسفينات معقم 0.2 ملي مولار (LAP) في محلول الوسائط عن طريق إذابة مسحوق LAP في ماء فائق النقاء وتمرير المحلول عبر مرشح معقم 0.22 ميكرومتر. أضف هذا المحلول 1: 1 v / v مع كمية الجل اللازمة لإجراء التجربة.
- احتضان محلول LAP والهلام والوسائط 0.2 ملي مولار عند 37 درجة مئوية على دوار أنبوبي عند 20 دورة في الدقيقة لمدة 30 دقيقة على الأقل قبل المتابعة للسماح بنشر LAP في جميع أنحاء الجسيمات الدقيقة.
- بمجرد انقضاء 30 دقيقة ، قم بالطرد المركزي لتعليق الجسيمات عند 18,000 × جم لمدة 5 دقائق عند 25 درجة مئوية. شفط المادة الطافية.
ملاحظة: يمكن أن يختلف الجفاف الكلي لجزيئات MAP بسبب الاختلافات في الكيمياء والماء وحجم الجسيمات. من أجل الاتساق، من الأفضل استخدام جهاز الطرد المركزي لتعليق الجسيمات كما هو موضح، وخلط الجسيمات في الأنبوب باستخدام ماصة إزاحة موجبة ثم تكرار خطوة الطرد المركزي.
2. طريقة فحص الهجرة التصاعدية القائمة على طبقة واحدة (MAMA): زراعة الخلايا والتصوير
ملاحظة: تم تصوير الخلايا باستخدام قناة FITC (488 نانومتر). كانت الصبغة المستخدمة في الخلايا لها إثارة عند 492 نانومتر وانبعاث عند 517 نانومتر. يوفر التكبير بمعدل 10 أضعاف تفاصيل أكبر على التكبير 4 أضعاف ، ولكن يمكن استخدام أي منهما.
- قم بإذابة الخلايا الليفية الجلدية البشرية (HDFs) وفقا لبروتوكول الشركة المصنعة. المرور حسب الحاجة حتى يتم تحقيق المقطع المطلوب ؛ بشكل عام ، تحافظ الخلايا الأولية على التركيب الجيني والظاهري من خلال P5.
- اللوحة 120,000 خلية / سم2 ل n = 6 على الأقل في لوحة 96 بئرا أو حجم اللوحة المطلوب باستخدام حجم الوسائط الموصى به لكل بئر للتعليق ، والشفط برفق قبل كل إضافة. دع الخلايا ترتبط طوال الليل ، كما هو موضح في الشكل 1 أ ، مما سيؤدي إلى التقاء ما يقرب من 80٪ في اليوم التالي.
ملاحظة: بشكل عام ، تعتبر آبار العمود المركزي والصفوف هي الأفضل لنشر الهلام على النحو الأمثل. يستخدم المؤلفون ما يصل إلى 24 بئرا لصفيحة من 96 بئرا (الصفوف B-G والأعمدة 5-8). - قم بإعداد ظروف الجل كما هو مذكور أعلاه ، وأثناء الحضانة في LAP ، قم بإزالة الوسائط باستخدام شفاط أو ماصة من لوحة البئر للخلايا. احرص على عدم إزعاج الجزء السفلي من اللوحة.
- أضف صبغة تتبع الخلايا إلى الآبار وفقا لتعليمات الشركة المصنعة ، الممثلة في الشكل 1 ب. تأكد من تحضير الجل بالكامل كما هو موضح في الخطوة 1 قبل شفط صبغة تتبع الخلايا من الآبار.
- أضف 20 ميكرولتر من كل حالة هلامية إلى الآبار بماصة إزاحة موجبة دون لمس قاع اللوحة.
ملاحظة: تحدث أفضل ظروف الفحص عندما يتم سحب الجل مباشرة إلى مركز البئر. - باستخدام ملحق جهاز طرد مركزي دوار للوحة عند 25 درجة مئوية ، قم بالدوران عند 100 × جم لمدة 15 ثانية مع تسارع وتباطؤ 8 لتسطيح الجل. اقلب اللوحة 180 درجة وقم بالدوران مرة أخرى عند 100 × جم لمدة 15 ثانية لضمان توزيع متساو للهلام عبر قاع البئر ، كما هو موضح في الشكل 1C.
- قم بربط الجل بشكل معقم من الأعلى (الشكل 1 د) عن طريق تطبيق الضوء المركز (365 نانومتر ، 34.4 ميجاوات / سم2) على العينة لمدة 30 ثانية لتلدين السقالة ، مع إضافة 200 ميكرولتر من الوسائط إلى كل بئر من الخلايا بعد تكوين جميع السقالات. دع الخلايا تحتضن عند 37 درجة مئوية لمدة 30 دقيقة للسماح لها بالالتصاق بالسقالة الحبيبية قبل التصوير.
- لالتقاط سلوك الهجرة الملخص في الشكل 1E ، صور الخلايا باستخدام مجهر متحد البؤر. ابحث عن أدنى نقطة تركيز بؤري لمنطقة من اللوحة حيث تكون الخلايا ملتصقة بنسبة 80٪ على الأقل وقم بتعيينها على أنها الحافة السفلية للمكدس z.
- أوجد أعلى نقطة لإشارة فلورسنت الخلية وقم بتعيينها على أنها الحافة العلوية للمكدس z. استخدم حجم خطوة 5 ميكرومتر أو أصغر للحصول على أفضل دقة.
- قم بتصوير ثلاثة آبار على الأقل لتمثيل الخلية أحادية الطبقة وارتفاعات الخلايا غير المهاجرة. يتم عرض النقطة الزمنية t = 0 من كل من العرض العلوي والمنظر الجانبي في الشكل 2 أ. احتضن طوال الليل بعد اكتمال التصوير.
ملاحظة: تم تصوير هذه الخلايا بهدف 4x ، وتم الحفاظ على التعرض متسقا لجميع الآبار. - عند t = 24 ساعة ، ستبدأ الخلايا في الصعود عبر السقالة الحبيبية ، كما هو موضح في الشكل 2 ب من وجهات النظر العلوية والجانبية. كرر خطوات التصوير كما تم إجراؤها ل t = 0 h باستخدام نفس المعلمات. استخدم الارتفاع السابق للمرحلة كمرجع أو ابحث عن أي خلايا لم يتم ترحيلها بعد وقم بتعيينها كحافة سفلية للمكدس z.
- كرر الخطوات لجميع الآبار ، مع ضمان حفظ كل بئر كصورة منفصلة لسهولة التحليل.
ملاحظة: يمكن تصوير النقاط الزمنية لفترات زمنية أطول اعتمادا على القيود التجريبية وطريقة تألق تتبع الخلايا. - قد تكون السقالات ثابتة وملطخة لمقاييس إضافية. في النقطة الزمنية النهائية المطلوبة ، قم بشفط الوسائط من الآبار باستخدام ماصة وتخلص منها. اغسل كل بئر برفق ب 200 ميكرولتر من PBS المعقم مرتين لمدة 5 دقائق لكل منهما. أضف 200 ميكرولتر من 4٪ بارافورمالدهيد (PFA) لمدة 20 دقيقة ، ثم استنشق وتخلص منه. يمكن تلطيخ الآبار على الفور أو تخزينها عند 4 درجات مئوية في 1x PBS لمدة تصل إلى أسبوع.
3. طريقة فحص الهجرة التصاعدية القائمة على طبقة واحدة (MAMA): تحليل الصور ثلاثية الأبعاد
- بالنسبة للتحويلات المجمعة، افتح برنامج IMARIS Image Conversion. قم بسحب وإسقاط صور الفحص المجهري في برنامج التحويل واختر مجلدا داخل برنامج Arena لاستيراده. اضغط على بدء الكل. ستظهر الصور المحولة في Arena كملفات .ims.
ملاحظة: إذا لم يتم تضمين حجم فوكسل في البيانات الوصفية للصورة، فراجع مواصفات التصوير متحد البؤر الفردية للعثور على القيمة. بدلا من ذلك ، يمكن تقريب حجم الفوكسل كحجم الخطوة المستخدم أثناء التصوير. - افتح البرنامج بالنقر المزدوج فوق أيقونة IMARIS Arena لسطح المكتب وتحديد صورة من الساحة.
- يتم تحميل الصورة تلقائيا في علامة تبويب تحليل "3D View" التي تظهر في لوحة أيقونة شريط الأدوات في الأعلى. انقر فوق علامة التبويب Image Proc في شريط الأدوات الرئيسي.
- في الجزء العلوي الأيسر من اللوحة الجانبية ، انقر فوق القائمة المنسدلة للقناة 1 وحدد طرح الخلفية. اضغط على موافق في الجزء السفلي من اللوحة للعودة إلى "3D View". الصور التمثيلية ل t = 0 h و t = 24 h موجودة في الشكل 2 أ ، ب ، على التوالي.
- في شريط الأدوات الصغير أعلى قائمة اللوحة الجانبية مباشرة ، انقر فوق الرمز ذو الأشكال الزرقاء المستديرة ، إضافة أسطح جديدة ، لإنشاء علامة تبويب كائنات قابلة للتحرير باسم "Surfaces 1".
- سيتم فتح واجهة لإعدادات خوارزمية معلمات الإنشاء في أسفل لوحة القائمة. قم بإنشاء المعلمات يدويا لاستخدامها في جميع النسخ المتماثلة بالنقر فوق زر السهم الأزرق في أسفل الواجهة. تأكد من تحديد قناة المصدر الصحيحة وحدد مربع "التنعيم".
- اضبط تفاصيل السطح على 0.7 ميكرومتر وحدد طرح الخلفية (التباين المحلي). اكتب متوسط طول الخلية في مربع "قطر أكبر كرة تتناسب مع الكائن". اضغط على نفس السهم الأزرق في الأسفل عند الانتهاء.
ملاحظة: يمكن تقدير هذه القيمة باستخدام علامة التبويب "شريحة" في شريط الأدوات وقياس عرض متوسط الخلايا.
- اضبط تفاصيل السطح على 0.7 ميكرومتر وحدد طرح الخلفية (التباين المحلي). اكتب متوسط طول الخلية في مربع "قطر أكبر كرة تتناسب مع الكائن". اضغط على نفس السهم الأزرق في الأسفل عند الانتهاء.
- للعتبة ، حدد الرسم البياني للشدة حيث يتم تقسيم الخلايا الأكثر سطوعا فقط. باستخدام مقسم العرض، تحرك لأعلى ولأسفل عبر مكدس الصور للتأكد من دقتها قدر الإمكان.
- حدد تمكين ل "تقسيم الكائنات التي تلامس (نمو المنطقة)" وقم بتعيين قطر نقاط البذور على نفس القطر المستخدم سابقا. تأكد من تحديد عتبة "الكثافة المستندة" وانقر فوق زر السهم الأزرق لليسمن.
- يمكن تعديل الخطوتين التاليتين ، نقاط تصفية البذور وأسطح المرشح ، عن طريق عدة قياسات لضمان دقة الأسطح المتولدة. ومع ذلك ، لا يتطلب تحليل خط الأساس تصفية إضافية. عندما لا تكون هناك حاجة إلى تغيير ، انقر فوق زر السهم الأزرق .
ملاحظة: تسمح الخطوة الأخيرة بمزيد من التصنيف للسطح اعتمادا على الإخراج المطلوب. بعد إجراء أي تعديلات، انقر فوق زر السهم الأخضر لإنهاء إنشاء الأسطح. - لحفظ معلمات الإنشاء لتحليل الدفعات ، انقر فوق أيقونة العصا إنشاء. انقر فوق معلمات المتجر ل Batch وقم بتسميته ، ثم انقر فوق موافق. تظهر الصور التمثيلية المعالجة ل t = 0 و t = 24 h في الأشكال 2C ، D ، على التوالي.
ملاحظة: يمكن تصنيف جميع الكائنات الموجودة داخل "Surface" المحدد إلى مجموعات بناء على الخصائص المختلفة التي يوفرها برنامج تحويل الصور، مثل مساحة السطح والحجم والكثافة والمسافة من الأسطح الأخرى التي تم إنشاؤها. - يتم العثور على خصائص Surface عن طريق تحديد علامة التبويب إحصائيات . لجمع كل ارتفاعات الخلايا ، انقر فوق علامة التبويب "مفصل" وحدد "قيم محددة " و "الموضع Z " من القوائم المنسدلة المتتالية. انقر فوق أيقونة حفظ واحدة لحفظ جميع المواضع z وأي تصنيفات تم إجراؤها في ملف .xls. كرر ذلك لجميع الصور.
- ابحث عن متوسط موضع z للخلايا غير المهاجرة من الصورة التمثيلية واطرح جميع مواضع z أسفل هذا الرقم من كل حالة اختبار جيدا.
ملاحظة: يتم الإبلاغ عن قيم الترحيل كوسيلة للوسطيات لكل حالة من ظروف النسخ المتماثل التقني فوق ارتفاع الخلية غير المهاجرة. يمكن الإبلاغ عنها على أنها متوسط ارتفاع ، كما هو موضح في الشكل 3 أ ، أو كتغيير في ارتفاع الهجرة للنقطة الزمنية المطلوبة مقارنة ب t = 0 ، كما هو موضح في الشكل 3 ب.
4. طريقة فحص الهجرة الكروية الخارجية ذات الطبقات المتوازية (PLOSMA): زراعة الخلايا وزراعة القطرات المعلقة للكبوتات الكروية ثلاثية الأبعاد
ملاحظة: يصف هذا البروتوكول زراعة الخلايا وزراعة القطرات المعلقة المقتبسة من البروتوكول الذي ألفه Nandi et al.14.
- قم بإذابة HDFs وفقا لبروتوكول الشركة المصنعة. المرور حسب الحاجة حتى يتم تحقيق المقطع المطلوب.
- في غطاء زراعة الخلايا المعقمة ، قم بإعداد طبق بتري عن طريق إضافة 10 مل من PBS إلى الأسفل وتقليب الغطاء بحيث يستقر الجزء الخارجي فوق غطاء مزرعة الخلية.
- أضف الحجم المناسب من الخلايا (المحدد من عدد الخلايا) إلى أنبوب الطرد المركزي الدقيق. أضف صبغة تتبع الخلايا المخففة في الوسائط. اجعل الحجم الإجمالي يصل إلى 1 مل باستخدام وسائط دافئة.
ملاحظة: يجب أن تكون الكرات الكروية حوالي 8000 خلية لكل كروي ولكنها قد تتغير بناء على نوع الخلية. - احتضان محلول الخلية لمدة 45 دقيقة عند 37 درجة مئوية. قم بتدوير الخلايا لأسفل وفقا للسرعة الموصى بها من الشركة المصنعة واستنشاق المادة الطافية.
- أعد تعليق الخلايا في 1: 100 ميثيل سلولوز في الوسائط.
- ماصة 20 ميكرولتر قطرات من محلول الخلية / الوسائط على غطاء طبق بتري.
- اقلب الغطاء بثقة وسرعة وحذر وضعه فوق النصف السفلي من طبق بتري الذي يحتوي على PBS.
- احتضان القطرات لمدة 24 ساعة على الأقل.
ملاحظة: يمكن مراقبة تكوين كروي عن طريق الفحص المجهري الساطع.
5. طريقة فحص الهجرة الكروية الخارجية ذات الطبقات المتوازية (PLOSMA): زرع الخلايا الكروية على هيدروجيل حبيبي
ملاحظة: يتم تلخيص العملية التالية في الشكل 4 أ.
- لإعداد طريقة PLOSMA الموضحة في الشكل 4 أ ، أضف 15 ميكرولتر من الجل باستخدام ماصة إزاحة موجبة إلى الآبار في صفيحة شفافة مكونة من 96 بئرا.
- باستخدام ملحق جهاز طرد مركزي دوار للواح ، قم بالدوران بسرعة 1000 × جم لمدة 10 ثوان لتسطيح الجل. اقلب اللوحة 180 درجة وقم بالدوران مرة أخرى عند 1000 × جم لمدة 10 ثوان لضمان توزيع الجل بشكل متساو عبر قاع البئر.
- بمجرد تحقيق التسطيح المتساوي ، قم بربط الجل بشكل معقم من الأعلى عن طريق تطبيق الضوء المركز (365 نانومتر ، 33.4 ميجاوات / سم2) على العينة لمدة 30 ثانية لتلدين السقالة.
- حرك طبق بتري من القطرات المعلقة بشكل معقم إلى غطاء مزرعة الأنسجة المعقمة واقلب الغطاء.
- باستخدام ماصة سعة 20 ميكرولتر، امتص قطرة ببطء حتى يدخل الكروي إلى طرف الماصة. اخرج القطرة على السقالة في وسط البئر.
- كرر الخطوات السابقة لجميع الآبار. تأكد من أن كل بئر يحتوي على كروي عن طريق التأكيد إما بالفحص المجهري للحقل الساطع أو الفلورسنت.
- احتضان لوحة البئر عند 37 درجة مئوية لمدة ساعتين للسماح للكرات بالالتصاق بالسقالة.
- ماصة 15 ميكرولتر إضافية من الجل فوق كل كروي. لضمان وجود توزيع متساو للهلام ، قم بالطرد المركزي للوحة عند 300 × جم لمدة 15 ثانية في كل اتجاه.
- قم بتلدين الطبقة العليا من الجل لمدة 30 ثانية باستخدام ضوء الأشعة فوق البنفسجية (365 نانومتر) عند 33.4 ميجاوات / سم2. وسائط الماصة فوق كل سقالة لرفع الحجم الإجمالي للبئر إلى 200 ميكرولتر.
ملاحظة: ستكون السقالات جافة جدا في هذه المرحلة ، لذا أضف الوسائط المتدلية أسفل جانب البئر لتجنب فصل الكروي.
6. طريقة مقايسة الهجرة الكروية المتوازية ذات الطبقات الخارجية (PLOSMA): التصوير متحد البؤر للكرويات
ملاحظة: تعتمد سهولة التصوير على نظام التصوير. حدد موقع الكروي داخل البئر في وقت تعريض منخفض. تم تصوير الخلايا باستخدام قناة FITC (488 نانومتر). كانت الصبغة المستخدمة في الخلايا لها إثارة عند 492 نانومتر وانبعاث عند 517 نانومتر. يوفر التكبير بمعدل 10 أضعاف تفاصيل أكبر على التكبير 4 أضعاف.
- أوجد أدنى مستوى مرحلة (ارتفاع z) لا تزال الخلايا في التركيز البؤري. قم بتعيين هذا كحد أدنى ل z-stack.
- ابحث عن أعلى مستوى للمرحلة (z-height) الذي لا تزال الخلايا في التركيز البؤري. قم بتعيين هذا كحد أعلى ل z-stack.
ملاحظة: تتضمن أفضل نتائج التصوير حجم خطوة أقل من أو يساوي 5 ميكرومتر للحفاظ على دقة مقياس الخلية. قد تكون هناك مقايضات بين سرعة التصوير والدقة اعتمادا على نظام المجهر متحد البؤر. - صور جميع الكرويات كما هو موضح في t = 0 و 24 ساعة. يمكن أيضا تصوير نقطة زمنية مدتها 48 ساعة اعتمادا على القيود التجريبية. تظهر صور الإسقاط القصوى التمثيلية ل t = 0 و t = 24 في الشكل 4 ب.
7. طريقة فحص الهجرة الكروية المتوازية ذات الطبقات الخارجية (PLOSMA): تحليل الصور ثلاثية الأبعاد
- قم باستيراد الصور إلى برنامج التحليل كما هو موضح في الخطوات من 3.1 إلى 3.4. في الزاوية اليمنى العليا من اللوحة اليسرى ، انقر فوق القائمة المنسدلة للقناة 1 وحدد طرح الخلفية. اضغط على موافق في الجزء السفلي من اللوحة.
- بمجرد العودة إلى عرض 3D ، اضغط على ضبط تلقائي لجميع القنوات في نافذة ضبط العرض المنبثقة وقم بالتصحيح حسب الحاجة.
- في شريط الأدوات الأصغر أعلى القائمة الجانبية مباشرة ، انقر فوق أيقونة إضافة إطار مرجعي جديد موضح في الشكل 5A بثلاثة أسهم متعامدة لإضافة علامة تبويب جديدة تسمى "الإطار المرجعي 1".
- انقل الأصل إلى مركز الكرة الكروية في جميع المستويات الثلاثة ، كما هو موضح في الشكل 5 ب.
- في نفس شريط الأدوات مثل الأسهم المتعامدة الثلاثة ، انقر فوق الرمز الذي يحتوي على الكرات البرتقالية وأضف بقع جديدة لإنشاء علامة تبويب تسمى "Spots 1". اضغط على زر السهم الأزرق.
- ضمن اكتشاف البقعة ، اضبط قطر XY المقدر على القطر المقدر للخلايا. اضغط على زر السهم الأزرق.
ملاحظة: بالنسبة لنطاقات HDF، هذا الرقم هو 15.0 ميكرومتر. - للعتبة، اضبط الرسم البياني للشدة لتطويق الأجزاء الأكثر سطوعا فقط. باستخدام مقسم العرض، تحرك لأعلى ولأسفل عبر مكدس الصور للتأكد من دقتها قدر الإمكان. اضغط على السهم الأزرق التالي.
- اضغط على زر التنفيذ الأخضر لإنهاء التحليل.
- قم بإلغاء تحديد Render on slicer أو انقر فوق رمز المربع الأصفر على الجانب الأيمن من لوحة الإعداد.
- انقر فوق علامة التبويب الإحصائيات . في القائمة المنسدلة الأولى، حدد قيم محددة. في القائمة المنسدلة الثانية، حدد المسافة من الإطار المرجعي للأصل. سيتم عرض جميع قيم الأسطح المحددة ، كما هو موضح في الشكل 5C. انقر فوق أيقونة الحفظ الفردي ، والتي تقوم بتنزيل ملف .xls.
- احفظ التغييرات التي تم إجراؤها على الصورة والتحليلات بالضغط على حفظ في شريط الأدوات الرئيسي. يمثل الشكل 6 أ عرضا ثلاثي الأبعاد لكروي تم تصويره في 24 ساعة ، بينما يمثل الشكل 6 ب وظيفة IMARIS Spots التي تحدد الخلايا المنتشرة ، مشفرة بالألوان وفقا للمسافة من الإطار المرجعي الأصلي.
- تطبيع البيانات المصدرة إلى صور t = 0 وحساب متوسط المسافة الخلوية المقطوعة وارتفاع z لكل كروي للحصول على قيمة واحدة لكل عينة. الشكل 7 أ ، يصور ب رسوما بيانية تمثيلية لكل إخراج ، على التوالي.
النتائج
يهدف هذا البروتوكول إلى تفصيل الخطوات اللازمة لمقايسات ترحيل سقالات حبيبية جديدة. يمكن استخدام طريقة MAMA لتقييم التسلل الخلوي في واجهة الأنسجة. الهلاميات المائية الحبيبية هي نظام أكثر تعقيدا من الهلاميات المائية السائبة ، وبالتالي فهي بطبيعتها أكثر تعقيدا لمعالجة الهجرة9،20. من المهم فهم العملية التدريجية الموضحة في الشكل 1. تعتمد كل خطوة على الخطوة التالية وتم تحسينها في هذا البروتوكول. سيؤدي بذر HDFs بكثافة 120.000 خلية / سم2 إلى التقاء بنسبة 80٪ على الأقل بين عشية وضحاها (الشكل 1 أ) ، ومن الأفضل تمييز هذه الخلايا غير الفلورية بصبغة تتبع الخلايا في يوم التجربة لزيادة إمكانات التصوير (الشكل 1 ب). يتطابق هذا البروتوكول مع قوة الطرد المركزي المنخفضة المستخدمة في مرور HDF للحفاظ على صلاحية الخلية. نظرا للزاوية التي يتم إنتاجها لخطوة طرد مركزي واحدة ، من الضروري قلب اللوحة 180 درجة لضمان تحولات الهلام لتغطية السطح السفلي للآبار بالكامل (الشكل 1 ج). سيؤدي السماح للخلايا بالتعافي في الحاضنة لمدة 30 دقيقة بعد التلدين (الشكل 1 د) إلى الحفاظ على بقاء الخلية ويؤدي إلى الهجرة المثلى (الشكل 1 ه). يمكن تصوير مساحة كبيرة من صفيحة 96 بئرا بهدف 4x ومطابقتها من النقطة الزمنية 0-24 ساعة (الشكل 2 أ ، ب) لتقييم سلوك الخلية على نطاق واسع. توفر معالجة صور z-stack الناتجة في برنامج التحليل تحليلات متقدمة لمجموعات بيانات كبيرة متعددة في واجهة سهلة الاستخدام. يلخص هذا البروتوكول خطوات إنشاء مجموعات بيانات لارتفاع الخلية ، أو الموضع Z ، في كل نقطة زمنية يتم تصورها باستخدام الصور التمثيلية في الشكل 2 ب ، ج. يظهر تحليل البيانات المعالجة في الشكل 3 أ ، وهو مرئي باستخدام متوسط الارتفاعات المتوسطة وانحرافها المعياري لكل نقطة زمنية ، ويظهر ارتفاع تغيير الطي من الخلايا غير المهاجرة عند t = 0 h في الشكل 3 ب. عادة ما يتم توزيع البيانات الأساسية لهذه الطريقة بشكل غير طبيعي ، لذا فإن المتوسطات هي مقاييس أكثر قوة للمقارنة وبالتالي تستخدم لتلخيص البيانات.
وبالمثل ، يمكن استخدام طريقة PLOSMA لتقييم حركة الخلايا التي يتم تسليمها داخل سقالة هيدروجيل حبيبية ثلاثية الأبعاد. يوضح الشكل 4 أ خطوات طريقة PLOSMA ، ومن المهم بشكل خاص زرع الكروي في وسط البئر. يوصى بتوسيط الكروي في مجال الرؤية ولكنه يعتمد على قدرات المجهر. يعرض الشكل 4 ب صورا تمثيلية للانتشار الكروي ل t = 0 h و t = 24 ساعة تم التقاطها بتكبير 10x في قناة FITC (488 نانومتر). في البرنامج ، يمكن إنشاء إطار مرجعي للأصل وتعديله على كل مكدس z (الشكل 5 أ ، ب). يمكن للبرنامج تتبع المسافة الشعاعية من هذا الإطار المرجعي الأصلي وتصديره كمجموعة البيانات المطلوبة (الشكل 5C). يوضح الشكل 6 أ صورة تمثيلية للعرض ثلاثي الأبعاد ل t = 24 ساعة كروية ، بينما يوضح الشكل 6 ب وظيفة البقع الخاصة بالبرنامج. يظهر مثال على البيانات المعالجة في الشكل 7. يمثل الشكل 7 أ متوسط المسافة المقطوعة من المركز الذي تم تطبيعه إلى مسافات اليوم 0. يعزل الشكل 7 ب المسافات المقطوعة في المستوى z فقط لأن هذا هو الاتجاه الذي تهدف طريقة PLOSMA إلى دراسته.
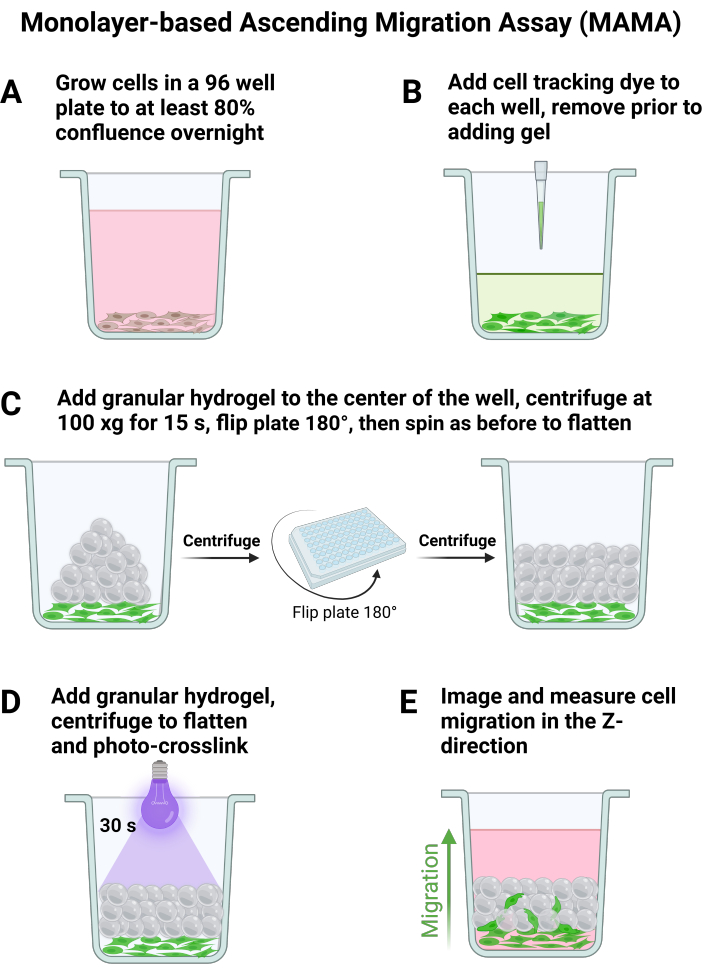
الشكل 1: مقايسة الهجرة التصاعدية القائمة على طبقة واحدة ، وزراعة الخلايا والتصوير. تخطيطي للخطوات الرئيسية في معالجة الخلايا والهلام ل MAMA. (أ) تزرع الخلايا إلى التقاء بين عشية وضحاها ، و (ب) تضاف صبغة تتبع الخلايا قبل إضافة الجل الحبيبي. يتم تجميع السقالة عبر الطرد المركزي للوحة (C) ويتم تثبيتها باستخدام التشابك الضوئي (D). يسمح التصوير في نقاط زمنية متعددة (E) بتصور هجرة الخلايا لأعلى. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
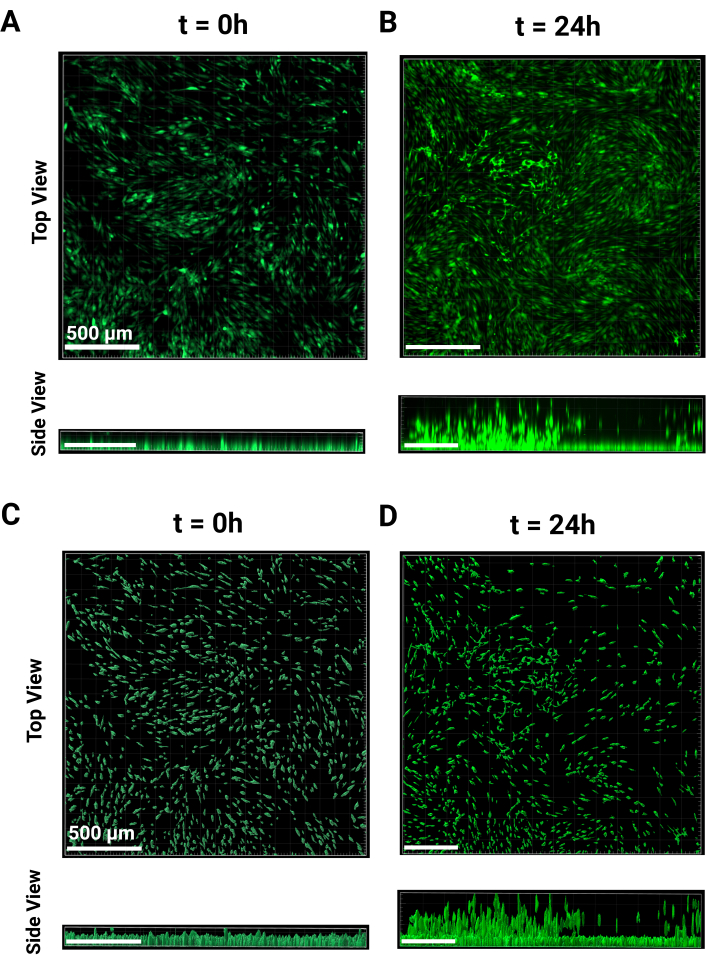
الشكل 2: معالجة صور MAMA. صور تمثيلية لمعالجة الصور. مقارنة المنظر العلوي والجانبي للصور البؤرية الأولية عند (A) t = 0 و (B) t = 24 ساعة في قناة FITC عند تكبير 4x. (ب) مقارنة المنظر العلوي والجانبي لموضع الخلية المعالجة ارتفاعات Z عند (C) و t = 0 و (D) t = 24 ساعة. تتضمن المعالجة لمدة 24 ساعة طرح متوسط ارتفاعات z غير المهاجرة. أشرطة المقياس = 500 ميكرومتر. الاختصارات: MAMA = مقايسة الهجرة التصاعدية القائمة على طبقة واحدة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
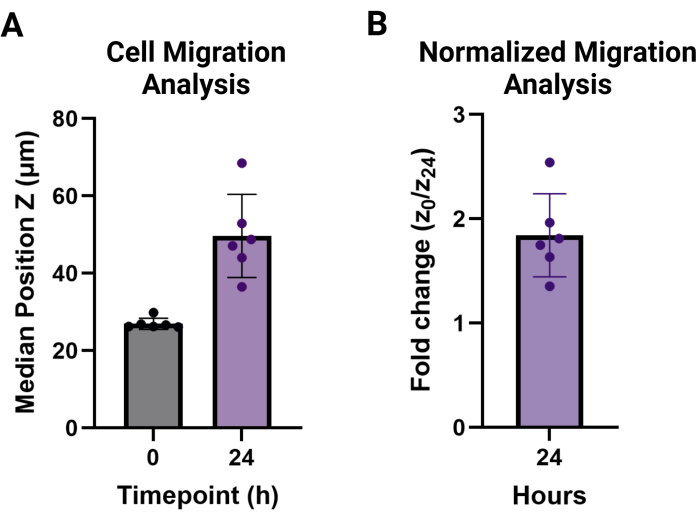
الشكل 3: تحليل مخرجات هجرة خلايا MAMA. (أ) متوسط الموضع Z والانحراف المعياري لارتفاعات الخلايا في كل تكرار (ن = 6) عند النقاط الزمنية t = 0 (27.0 ميكرومتر ± 1.4 ميكرومتر) و t = 24 ساعة (46.6 ميكرومتر ± 10.8 ميكرومتر). (ب) هجرة الخلايا في 24 ساعة تطبيعها إلى 0 ساعة وتم الإبلاغ عنها على أنها تغير في الطية (1.8 ± 0.4). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
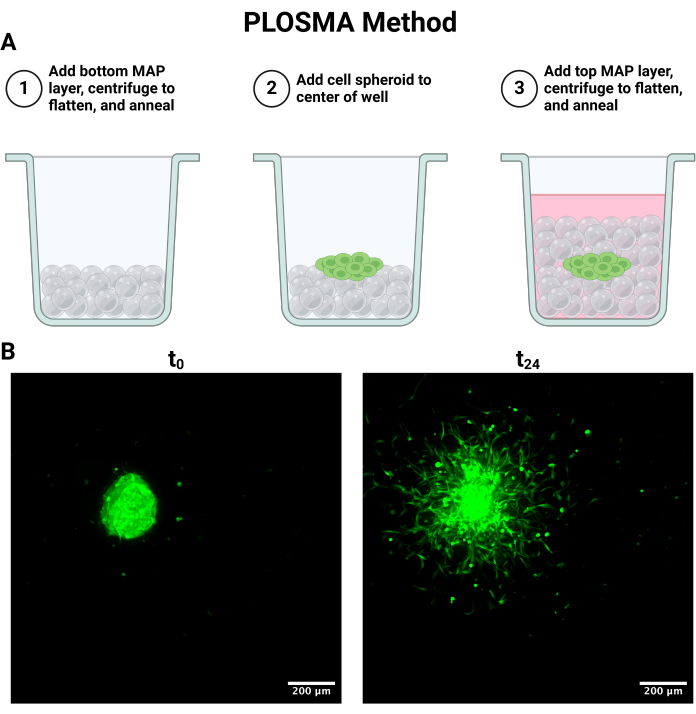
الشكل 4: مقايسة خلية الهجرة الكروية الخارجية للطبقة المتوازية (PLOSMA) وتصويرها. (أ) تخطيطي يصف خطوات طبقات السقالة. (ب) الإسقاطات القصوى للكثافة الكروية المأخوذة في 0 و 24 ساعة. تم التقاط الصور عبر الفحص المجهري الفلوري متحد البؤر في قناة FITC (488 نانومتر) بتكبير 10x. أشرطة المقياس = 200 ميكرومتر. الاختصارات: PLOSMA = مقايسة الهجرة الكروية للطبقة المتوازية إلى الخارج. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
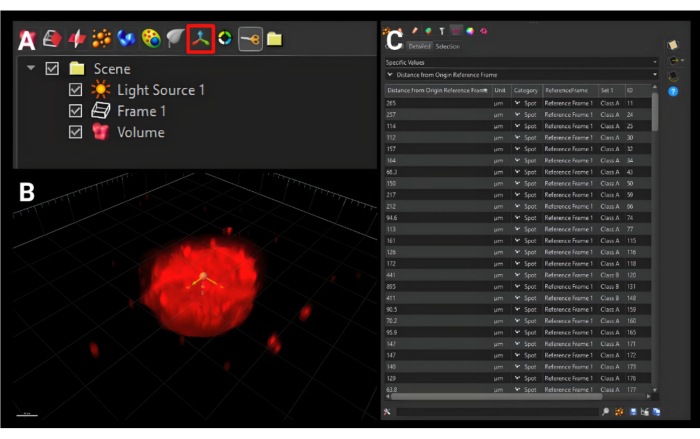
الشكل 5: إنشاء إطار مرجعي جديد للأصل. (أ) زر الإطار المرجعي الأصلي الجديد المحدد بمربع أحمر. (ب) تم تعيين الأصل الجديد ليكون في وسط الكرة في جميع الأبعاد الثلاثة. (ج) مقاييس الإخراج المعروضة هي مسافات أسطح الخلايا من الإطار المرجعي الأصلي ، والذي يصف مدى انتقال الخلايا من المركز. شريط المقياس = 120 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
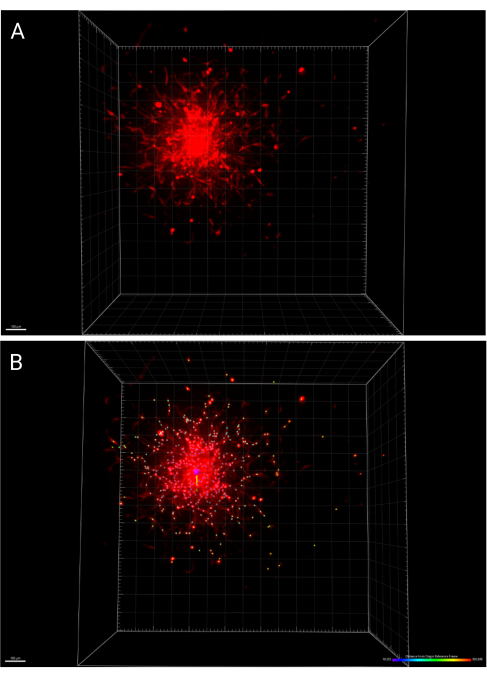
الشكل 6: عروض ثلاثية الأبعاد للكروي المضمن في 24 ساعة. (أ) الكرة الكروية المعالجة في الفضاء ثلاثي الأبعاد. (ب) تم تحديد مركز نفس الكرة باستخدام وظيفة الإطار المرجعي الأصلي في IMARIS ، ويتم ترميز انتشار الخلية بالألوان حسب المسافة من الأصل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
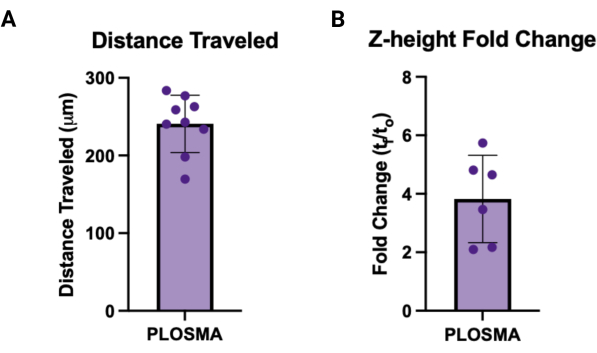
الشكل 7: مثال على مخرجات PLOSMA. (أ) مثال على نتائج PLOSMA التي توضح المسافة المقطوعة بالميكرومتر. كان متوسط المسافة المقطوعة 240.8 ميكرومتر ± 36.87 ميكرومتر. (ب) تغيير طية ارتفاع Z (tf / t0) من الإنبات الكروي. كان متوسط تغيير الطية 3.82 ± 1.495. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يصف هذا البروتوكول نموذجين في المختبر لتوصيف هجرة الخلايا في 3D لالتئام الجروح وتكامل الأنسجة. يعتمد النموذج الأول ، وهو مقايسة الهجرة أحادية الطبقة ، على خلايا متصلة ومتلاقة بشكل صحيح. تم تطوير هذا البروتوكول بنوع خلية الخلايا الليفية وتم تحسينه بكثافة بذر تبلغ 1،20،000 خلية / سم2. تسمح هذه الكثافة للخلايا بالنمو بين عشية وضحاها إلى التقاء 80٪ على الأقل بالتساوي عبر قاع صفيحة البئر. تضمن هذه الخطوة الهجرة في الاتجاه z في غضون 24 ساعة على الأقل ؛ إذا كان التقاء منخفضا جدا عند إضافة طبقة الهلام ، فقد تستمر الخلايا في الانتشار عبر بلاستيك زراعة الأنسجة وكذلك في الجل ، مما يؤدي إلى نمط هجرة غير منتظم وبطيء ، والذي لوحظ أثناء التحسين. لا يزال من الممكن ملاحظة ارتفاعات هجرة غير متساوية في المناطق ذات الخلايا الأقل كثافة ، حتى عند التقاء 80٪. حسنا ، ستقلل التكرارات من ضوضاء سلوكيات الخلية هذه. يمكن أن تتسبب الخلايا شديدة الالتقاء في رفع الخلايا خلال فترة الطرد المركزي وربما موت الخلايا. تتم معالجة هذا التباين عن طريق البذر في عدد ثابت من الخلايا والتقاط منطقة صورة متسقة للسماح بمقارنات البيانات المناسبة. على حد علم المؤلف ، لم يتم نشر الطرد المركزي للألواح لتسطيح الهلام ، ولكن الطرد المركزي يستخدم بشكل شائع لمرور الخلايا والتعامل مع المادة الحيوية21،22. سيؤدي ضبط السرعة لتتناسب مع سرعات المرور إلى الحفاظ على صلاحية الخلية لمزيد من المعالجة المثلى للخلايا.
يتمثل التحدي الأساسي في هذه الطريقة في زيادة دقة التصوير وعمقه مع تقليل وقت التصوير لضمان أفضل تحليل. صبغة تتبع الخلايا الخضراء ساطعة بما يكفي لتصوير بئر 96 بحجم خطوة 5 ميكرومتر أو أقل ويصل إلى 1000 مللي ثانية من وقت التعرض. يقلل تقليل وقت التعرض من مقدار الوقت الذي لا تكون فيه الخلايا في ظروف الحضانة ، ولكنه يقلل أيضا من الدقة. يجب تحسين هذه المعلمات على أساس مجهر فردي ، ولكن يتم تقليل التباين من خلال ضمان التقاط جميع الصور بنفس الإعدادات في دراسة واحدة.
ملاحظة مهمة لتحليل MAMAs هي أنه يتطلب القضاء على الخلايا عند ارتفاع أحادي الطبقة أو أقل لضمان مراعاة الخلايا المهاجرة فقط للاختبارات الإحصائية. وفقا لذلك ، يتم الإبلاغ عن متوسطات الآبار المكررة بسبب طبيعة التوزيع غير الغوسي لمواضع الخلية بعد التصفية. يمكن تصور المقارنة بين المجموعات باستخدام الرسم البياني ، ويمكن تحليل المتوسطات إحصائيا باستخدام اختبار غير معلمي.
على الرغم من هذه التحديات ، فإن طريقة الهجرة التصاعدية القائمة على طبقة واحدة هي ، في أبسط صورها ، اختبار قابل للتكرار لتسلل الخلايا ثلاثية الأبعاد للسقالات المسامية. لدراسة التأثيرات الميكانيكية لهجرة الخلايا ، تأكد من أن المعلمات تناسب نوع الخلية قيد الدراسة. قد يشمل ذلك إضافة مكونات كيميائية أو فردانية ، داخل الجل أو في الوسائط. تشمل الوسائط الكاملة للأرومات الليفية الجلدية البشرية الكيموكينات المهاجرة ، لكن أنواع الخلايا الأخرى التي تستخدم إشارات أكثر تحديدا تتطلب تكييف الفحص وفقا لذلك. هذا الاختبار يفسح المجال لاختبار أنواع متعددة من المتغيرات. ومع ذلك، فإن نطاق هذه المسائل غير مشمول في هذا البروتوكول. يوفر MAMA بيئة ذات صلة من الناحية الفسيولوجية مماثلة لحركة الخلية من الأنسجة السائبة إلى هيدروجيل مسامي محقون في الجسم الحي.
بالنسبة لطريقة PLOSMA ، يعد وضع الكرات الكروية في وسط السقالة أمرا بالغ الأهمية للتصوير الناجح وهجرة الخلايا ذات المغزى في ثلاثة أبعاد. يعتمد البذر الدقيق للفيرويد في وسط الجل على المستخدم. تحقيقا لهذه الغاية ، يساعد تثبيت الماصة في البرميل بيد المستخدم غير المهيمنة في التمركز ، ويمكن تأكيد فعالية موضع البذر باستخدام الفحص المجهري الساطع أو الفلورسنت. يمكن معالجة الكروي خارج المركز بمحاولة ثانية باستخدام كروي جديد ، إما على نفس السقالة أو على سقالة جديدة. لهذا السبب ، يوصي المؤلفون بإنشاء كرويات أكثر من اللازم وإعداد جل MAP أكثر من اللازم.
تضمن خطوة الطرد المركزي للطبقة الثانية أن الكروي (1) مغطى بالتساوي بالهلام و (2) قادر على الانتشار بالتساوي لأعلى ولأسفل في الجل ، وهو أمر بالغ الأهمية لدراسة الخلايا التي يتم تسليمها. يمكن أن يتسبب الطرد المركزي أيضا في تحرك الكروي من المركز نحو حواف البئر ، وبينما يحد هذا البروتوكول من هذه الظاهرة عن طريق تحسين خطوات الطرد المركزي وحجم الجل المستخدم لكل طبقة (15 ميكرولتر) للتوزيع المتساوي ، فإنه لا يلغي حركته تماما. قد يلزم تعديل سرعة الطرد المركزي والتوقيت الدقيقين اللازمين لتقليل الحركة الكروية وفقا لطراز جهاز الطرد المركزي. ومع ذلك، يمكن استخدام المواصفات الموضحة في هذا البروتوكول كمعيار للتحسين الفردي. هناك طريقة أخرى تتمثل في السماح للكرات لمدة 2 ساعة من وقت الحضانة بالالتصاق بالسقالة قبل إضافة الطبقة الثانية من الجل. يتم التخفيف من الحركة الكروية بشكل جيد بشكل خاص عند تنفيذ كلتا الاستراتيجيتين. أخيرا ، بسبب عملية الطرد المركزي متعددة الخطوات ، قد لا تكون هذه الطريقة مناسبة لخطوط الخلايا الأقل صلابة.
بصرف النظر عن الخدمات اللوجستية لطلاء الكرات بطريقة PLOSMA ، هناك قيود أثناء الحصول على الصور. يمكن تصوير الكروي باستخدام تكبير 4x أو 10x ، ولكن للحصول على أفضل النتائج ، استخدم تكبيرا 10x على الأقل وقم بتقليل حجم خطوة مكدسات z إلى 2-5 ميكرومتر. يجب أن يكون التكبير متسقا طوال الدراسة. يزداد وقت التصوير بدقة أعلى ، لذا قلل من عدد العينات في كل لوحة بئر (4-8 آبار لكل لوحة) لتقليل الوقت خارج الحاضنة. يمكن أن يؤدي إعداد التصوير المباشر أيضا إلى تحسين التتبع وتوفير رؤى أكبر.
نظرا لأن الهلاميات المائية الحبيبية لها طوبولوجيا فريدة ومعلمات تصميم تشمل الحجم المتأصل ، والمسامية ، والقوة الميكانيكية ، وفي بعض الحالات ، النشاط الحيوي ، فمن الضروري دراسة سلوك الخلية فيما يتعلق بهذه الجوانب بأكبر قدر ممكن من الدقة. تم تصميم طريقة PLOSMA لنمذجة حركة الخلية بعد الولادة أو بعد دخول الخلايا بالكامل إلى هلام حبيبي. نظرا لأن الخلايا تضطر إلى الهجرة عبر المسام المتأصلة في هندسة الهيدروجيل الحبيبية ، فإن طريقة PLOSMA تعزل المسامية بشكل فعال كتأثير على سلوك الخلية. التطبيقات المحتملة لهذا الاختبار هي توصيل الخلايا في الموقع وتكامل الأنسجة داخل سقالة حبيبية ، لا سيما في مساحة التئام الجروح23.
تم تطوير كلا البروتوكولين مع الخلايا الليفية الجلدية البشرية الأولية بسبب دور هجرة الخلايا الليفية في إصلاح الأنسجة وإعادة تشكيلها4،24 ، ومع ذلك ، يمكن قياس السلوك المهاجر لأي خلايا ملتصقة استجابة لتغيير السقالة المسامية - بما في ذلك إضافات عوامل النمو والتركيب السطحي / السائب للهلام. قد تتطلب هذه التغييرات تكييف هذه المقايسات للحصول على نتائج ملموسة. تشمل المعلمات التي تتطلب مزيدا من التحسين كثافة تلقيح الخلايا ومدة التجربة و / أو خط أنابيب التحليل. IMARIS هي أداة تحليل تصوير قوية تستخدم لتحليل هجرة الخلايا ولديها قدرات تتجاوز ما هو موضح هنا ، والتي تشمل تصنيف جميع الكائنات داخل "سطح" محدد إلى مجموعات بناء على خصائص مختلفة مثل مساحة السطح والحجم والكثافة والمسافة من الأسطح الأخرى التي تم إنشاؤها. هناك العديد من الموارد عبر الإنترنت لتحديد طرق التحليل الإضافية.
لا تعالج الطريقتان الموضحتان هنا الحالة الأولية لإدخال الأنسجة إلى مادة حبيبية بطريقة فسيولوجية فحسب ، بل تعالجان أيضا استجابة الخلية اللاحقة عند دمجها بالكامل داخل المادة. كما هو الحال مع جميع فحوصات الهجرة ، فإن الخلايا الموجودة قادرة على التكاثر بالتوازي مع الحركة ، ولكن تصميم المقايسات الموصوفة لا يعطل الانتشار وبالتالي يضمن عدم وجود تأثير لا داعي له على التحليل. كلتا الطريقتين متوافقتان مع تلطيخ نقطة النهاية بالإضافة إلى التصوير الطولي ، والذي يستخدم تثبيت PFA للكشف عن مقاييس مثل الهيكل الخلوي وترسب الكولاجين والانتشار والمزيد. ينتقل استخدام الطرق الموضحة نحو تمثيل مكاني وزماني أكثر دقة لهجرة الخلايا ثلاثية الأبعاد تستخدم تسلل الخلايا كمعامل قابل للقياس على عكس الطرق السابقة1،6،14،15،25،26،27.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم دعم تمويل هذا العمل جزئيا من خلال المعاهد الوطنية الأمريكية للصحة ذات الأولوية العالية ، وجائزة المشروع قصير الأجل (1R56DK126020-01) وهدية خيرية من Kurtin Trust. تم تمويل JT من قبل زمالة أبحاث الدراسات العليا لمؤسسة العلوم الوطنية. مخططات الشكل التي تم إنشاؤها باستخدام BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 Phalloidin | ThermoFisher | A22287 | |
| Bovine Serum Albumin | VWR International | 332 | |
| CellTracker Green CMFDS Dye, 1 mg | ThermoFisher | C2925 | 20 x 50 ug units, 492/517 nm |
| Centrifuge | ThermoFisher | 75016085 | ST Plus Series |
| Clear 96 well plate | MilliPore Sigma | CLS3997-50EA | |
| Dimethyl Sulfoxide | Fisher Scientific | MT-25950CQC | 250 mL |
| Fibroblast Basal Medium | ATCC | PCS-201-030 | 480 mL, phenol-red-free |
| Fibroblast Growth Kit - Low Serum | ATCC | PCS-201-041 | 7.5 mM L-glut,5 ng/mL rh FGF basic, 5 ug/mL rh Insulin, 1 ug/mL Hydrocortisone, 50 ug/mL Ascorbic acid, 2% FBS |
| FIJI (ImageJ) | NIH | Public access download | |
| Human Dermal Fibroblasts | ATCC | PCS-201-012 | Adult human dermal fibroblasts |
| ImageXpress Micro Confocal | Molecular Devices | Spinning Disc confocal microscope with 4x, 10x magnifications | |
| IMARIS | Oxford Instruments | 3/4D Imaged Visualizaiton and Analysis Software, Proprietary | |
| Incubator | ThermoFisher | Finnpipette F2 Variable volume Pipettes | HeraCell Vios 160i CO2 Incubator, 165L |
| M-20 Microplate Swinging Bucket Rotor | ThermoFisher | 75003624 | |
| Methylcellulose | Fisher Scientific | 9004-67-5 | Lab grade, powder form |
| Microcentrifuge tube | Fisherbrand | 05-408-129 | 1.5 mL microcentrifuge tubes |
| Paraformaldehyde (4%) | Alfa Aesar | AAJ19943K2 | For fixing |
| Petri dish | Corning | 08-757-100A | Bacteriological Petri Dishes with Lid 35 x 10 mm |
| Pipettes | ThermoFisher | 4642080 | Finnpipette F2 Variable volume Pipettes |
| Sterile PBS | Gibco | 10010-023 | |
| Triton-X | Fisher Scientific | 327371000 |
References
- Jerka, D., et al. Unraveling endothelial cell migration: Insights into fundamental forces, inflammation, biomaterial applications, and tissue regeneration strategies. ACS Appl Bio Mater. 7 (4), 2054-2069 (2024).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay Drug Dev Technol. 12 (4), 207-218 (2014).
- Yamada, K. M., Sixt, M. Mechanisms of 3D cell migration. Nat Rev Mol Cell Biol. 20 (12), 738-752 (2019).
- Grinnell, F. Fibroblast biology in three-dimensional collagen matrices. Trends Cell Biol. 13 (5), 264-269 (2003).
- Kloxin, A. M., Kloxin, C. J., Bowman, C. N., Anseth, K. S. Mechanical properties of cellularly responsive hydrogels and their experimental determination. Adv Mater. 22 (31), 3484-3494 (2010).
- Solbu, A. A., et al. Assessing cell migration in hydrogels: An overview of relevant materials and methods. Mater Today Bio. 18, 100537 (2023).
- Madl, C. M., Katz, L. M., Heilshorn, S. C. Tuning bulk hydrogel degradation by simultaneous control of proteolytic cleavage kinetics and hydrogel network architecture. ACS Macro Lett. 7 (11), 1302-1307 (2018).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nat Rev Mater. 5 (1), 20-43 (2020).
- Qazi, T. H., Burdick, J. A. Granular hydrogels for endogenous tissue repair. Biomater Biosyst. 1, 100008 (2021).
- Tanner, G. I., Schiltz, L., Narra, N., Figueiredo, M. L., Qazi, T. H. Granular hydrogels improve myogenic invasion and repair after volumetric muscle loss. Adv Healthc Mater. 25, e2303576 (2024).
- Sussman, E. M., Halpin, M. C., Muster, J., Moon, R. T., Ratner, B. D. Porous implants modulate healing and induce shifts in local macrophage polarization in the foreign body reaction. Ann Biomed Eng. 42 (7), 1508-1516 (2014).
- Roosa, C. A., et al. Conjugation of IL-33 to microporous annealed particle scaffolds enhances type 2-like immune responses in vitro and in vivo. Adv Healthc Mater. 13 (25), 2400249 (2024).
- Jaberi, A., et al. Engineering microgel packing to tailor the physical and biological properties of gelatin methacryloyl granular hydrogel scaffolds. Adv Healthc Mater. 13 (25), 2402489 (2024).
- Nandi, S., Brown, A. C. Characterizing cell migration within three-dimensional in vitro wound environments. J Vis Exp. 126, e56099 (2017).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Adv Mater. 34 (12), 2109194 (2022).
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nat Mater. 14 (7), 737-744 (2015).
- Pruett, L. J., Jenkins, C. H., Singh, N. S., Catallo, K. J., Griffin, D. R. Heparin microislands in microporous annealed particle scaffolds for accelerated diabetic wound healing. Adv Funct Mater. 31 (35), 2104337 (2021).
- Roosa, C., et al. Microfluidic synthesis of microgel building blocks for microporous annealed particle scaffold. J Vis Exp. (184), e64119 (2022).
- Pfaff, B. N., et al. Selective and improved photoannealing of microporous annealed particle (MAP) scaffolds. ACS Biomater Sci Eng. 7 (2), 422-427 (2021).
- Riley, L., Schirmer, L., Segura, T. Granular hydrogels: Emergent properties of jammed hydrogel microparticles and their applications in tissue repair and regeneration. Curr Opin Biotechnol. 60, 1-8 (2019).
- Jo, C. H., Roh, Y. H., Kim, J. E., Shin, S., Yoon, K. S. Optimizing platelet-rich plasma gel formation by varying time and gravitational forces during centrifugation. J Oral Implantol. 39 (5), 525-532 (2013).
- Mironov, V., et al. Fabrication of tubular tissue constructs by centrifugal casting of cells suspended in an in situ. crosslinkable hyaluronan-gelatin hydrogel. Biomaterials. 26 (36), 7628-7635 (2005).
- Vu, L. T., Jain, G., Veres, B. D., Rajagopalan, P. Cell migration on planar and three-dimensional matrices: A hydrogel-based perspective. Tissue Eng Part B Rev. 21 (1), 67-74 (2015).
- Cialdai, F., Risaliti, C., Monici, M. Role of fibroblasts in wound healing and tissue remodeling on Earth and in space. Front Bioeng Biotechnol. 10, 958381 (2022).
- Qazi, T. H., Muir, V. G., Burdick, J. A. Methods to characterize granular hydrogel rheological properties, porosity, and cell invasion. ACS Biomater Sci Eng. 8 (4), 1427-1442 (2022).
- Shaik, R., et al. Cardiac matrix-derived granular hydrogel enhances cell function in 3D culture. ACS Appl Mater Interfaces. 16 (43), 58346-58356 (2024).
- Puiggalí-Jou, A., Asadikorayem, M., Maniura-Weber, K., Zenobi-Wong, M. Growth factor-loaded sulfated microislands in granular hydrogels promote hMSCs migration and chondrogenic differentiation. Acta Biomater. 166, 69-84 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved