Method Article
量化颗粒水凝胶生物材料内部和颗粒状水凝胶生物材料中的三维细胞迁移
摘要
这里提出了一种定量评估颗粒水凝胶界面内和进入颗粒水凝胶界面的 3D 细胞迁移的方案。
摘要
颗粒水凝胶支架在再生医学中具有巨大潜力,可作为细胞递送的载体或组织整合的界面。本文介绍了两种定量颗粒水凝胶内和颗粒水凝胶内细胞迁移的新方法,重点介绍了这些支架的不同应用。首先,提出了一种细胞单层界面测定法,该测定模拟组织生长成颗粒水凝胶以进行整合。其次,描述了一种基于球体的分析,旨在跟踪水凝胶基质内的细胞运动,特别适用于涉及细胞递送的应用。这两种方法都能精确、受控地测量细胞迁移,为利用颗粒水凝胶支架的研究人员提供了一个全面的工具包。这些方法的动机源于需要对支架内的细胞迁移进行定制控制,以符合特定应用。通过优化和标准化这些量化技术,研究人员可以迭代改进颗粒水凝胶特性,确保它们在不同的再生医学环境中的有效性。这套强大的定量工具为增强颗粒水凝胶支架提供了新的机会,促进了它们在细胞递送和组织整合应用中的应用。
引言
用于治疗应用的生物材料正日益发展到更复杂和相关的细胞环境模型,以研究组织整合。生物材料支架为细胞生长提供三维 (3D) 结构,旨在模拟所需的组织 1,2。三维细胞培养模型包括天然基质和合成支架,它们通过趋触性或趋化性线索为细胞提供进一步的复杂性 3,4。传统的水凝胶支架是散装交联的,产生纳米多孔网,允许小分子扩散 5,6,但需要降解才能将细胞规模迁移到需要修复的组织区域7。颗粒水凝胶是生物材料的一个子集,由于其生物相容性、符合不规则形状的能力以及在许多情况下的可注射性,具有很高的临床转化潜力 8,9。它们的构建块性质提供了细胞规模孔隙率的优势,以增强组织浸润和血管生成以及模块化,这允许为细胞行为添加异质线索 10,11,12。了解细胞反应和 3D 支架内的运动对于使用生物材料进行组织整合的所有应用中的生理相关性至关重要。
然而,事实证明,在三维空间中研究组织向内生长很难以定量的准确性完成。3D 环境的复杂性不断增加,这需要细胞迁移的体外模型,该模型不仅可以深入了解细胞行为,还可以优化材料条件。以前发表的 3D 颗粒支架细胞迁移报告使用局部接种来探索细胞行为,报告了渗透到多孔结构和细胞形态13 和其他球状体发芽14,15,测量生长长度和芽的数量。局部接种迁移长度可能受重力不均匀影响,并且由于显微镜的限制,结果不能是纵向的。球体发芽方法仅限于通过最大投影进行 2D 量化,无法捕捉受控侵袭的机制。两种方法都是在 xy 平面上测量的,缺乏完全概括 3D 细胞运动和支架浸润所需的细微差别。
该方案描述了两种量化细胞迁移的方法,例如 体外 浸润到多孔 3D 颗粒水凝胶支架中,特别是使用微孔退火颗粒 (MAP) 支架16、17、18、19。以下方法的目的是通过控制颗粒凝胶迁移的方向性来研究颗粒凝胶中的细胞行为以进行三维分析。第一种基于单层的升序迁移测定 (MAMA) 方法是一种简化的内源性细胞整合模型,它说明了均匀的细胞-材料相互作用,并作为一个平台来表示细胞与颗粒水凝胶接触的初始环境,以及在浸润支架之前隔离个体行为。第二种称为平行分层向外球状体迁移测定 (PLOSMA) 方法,是一种 3D 细胞球状体迁移测定,可探索细胞完全被复杂支架环境包围时的移动,并模拟递送后的细胞运动,以及细胞完全进入颗粒状凝胶后的运动。
这两种方法都可以通过 3D 图像分析进行量化,并且可以应用于使用纵向时间点研究和优化材料-细胞相互作用,用于再生医学和组织工程应用,其中促进或限制细胞运动在设计标准范围内。此外,这些方法利用板离心进行均匀的多孔分析制备。
研究方案
材料 表中列出了研究中使用的试剂和设备的详细信息。
1. 颗粒水凝胶制备
注意:整个方案中使用的 MAP 颗粒是 3.2 wt% w/v 凝胶,含 45.88 mg/mL PEG-MAL (10 kDa)、0.82 mg/mL RGD、8.06 mg/mL MethMal19 和 5.62 mg/mL MMP-2 可降解交联剂。凝胶的机械刚度为 15-20 kPa,以匹配真皮硬度17。
- 生成颗粒状水凝胶颗粒并正常准备细胞培养。
注意:该方案描述了微孔退火颗粒凝胶的无菌制备,其生产由 Roosa 等人详细介绍18。 - 通过用 70% 异丙醇洗涤 3 次,然后用无菌 1x PBS 洗涤 3 次来制备用于 体外 使用的颗粒水凝胶颗粒。
- 通过将 LAP 粉末溶解在超纯水中并将溶液通过 0.22 μm 无菌过滤器,在培养基溶液中制备无菌 0.2 mM 苯基-2,4,6-三甲基苯甲酰膦酸锂 (LAP)。以 1:1 v/v 的比例加入此溶液,加入进行实验所需的凝胶量。
- 将 0.2 mM LAP、凝胶和培养基溶液在 37 °C 下在试管旋转器上以 20 rpm 孵育至少 30 分钟,然后继续进行,以允许 LAP 在整个微粒中扩散。
- 30 分钟后,在 25 °C 下以 18,000 x g 离心颗粒悬浮液 5 分钟。 吸出上清液。
注:MAP 颗粒的整体干燥度可能因化学性质、亲水性和粒径的差异而有所不同。为了保持一致性,最佳做法是按照所述离心颗粒悬浮液,使用外置活塞式移液器混合管中的颗粒,然后重复离心步骤。
2. 基于单层的升序迁移测定 (MAMA) 方法:细胞培养和成像
注:使用 FITC 通道 (488 nm) 对细胞进行成像。用于细胞的染料在 492 nm 处激发,在 517 nm 处发射。与 4 倍放大相比,10 倍放大可提供更多的细节,但可以使用任何一种。
- 根据制造商的方案解冻人真皮成纤维细胞 (HDF)。根据需要通过,直到达到所需的通过;通常,原代细胞通过 P5 维持遗传和表型组成。
- 在 96 孔板或所需板尺寸中以 120,000 个细胞/cm2 接种至少 n = 6 个细胞,使用推荐的每孔悬浮培养基体积,每次添加前轻轻吸出。让细胞附着过夜,如图 1A 所示,这将导致第二天大约 80% 的汇合。
注:通常,中心列和行孔最适合实现最佳凝胶铺展。作者对 96 孔板(B-G 行和第 5-8 列)使用多达 24 个孔。 - 如上所述准备凝胶条件,在 LAP 中孵育时,用抽吸器或移液管从细胞孔板中取出培养基。小心不要打扰板的底部。
- 根据制造商的说明向孔中添加细胞示踪染料, 如图 1B 所示。在从孔中吸出细胞示踪染料之前,确保凝胶已按照步骤 1 中的说明完全制备。
- 用外置活塞式移液器向孔中加入 20 μL 每种凝胶条件,不要接触板的底部。
注:当凝胶直接移液到孔中心时,会出现最佳分析条件。 - 使用 25 °C 的板旋转转子离心机附件,以 100 x g 旋转 15 秒,加速和减速为 8 以使凝胶变平。将板翻转 180°,然后再次以 100 x g 的速度旋转 15 秒,以确保凝胶在孔底均匀分布,如图 1C 所示。
- 通过将聚焦光(365 nm,34.4 mW/cm2)应用于样品 30 秒以对支架进行无菌光交联(图 1D)以退火支架,在所有支架形成后向每个细胞孔中加入 200 μL 培养基。让细胞在 37 °C 下孵育 30 分钟,以便在成像前将它们附着在颗粒支架上。
- 为了捕获 图 1E 中总结的迁移行为,使用共聚焦显微镜对细胞进行成像。找到细胞至少汇合 80% 的板区域的最低焦点,并将其设置为 z 堆栈的下边缘。
- 找到细胞荧光信号的最高点,并将其设置为 z 堆栈的上边缘。使用 5 μm 或更小的步长以获得最佳分离度。
- 至少对三个孔进行成像,以表示细胞单层和非迁移细胞高度。t = 0 时间点从 图 2A 的顶视图和侧视图显示。成像完成后孵育过夜。
注意:这些细胞使用 4 倍物镜成像,并且所有孔的曝光保持一致。 - 在 t = 24 小时时,细胞将开始通过颗粒支架上升,如图 2B 从顶部和侧面视图所示。使用相同的参数重复 t = 0 h 时执行的成像步骤。使用舞台的先前高度作为参考,或查找任何尚未迁移的单元格,并将其设置为 z 堆栈的下边缘。
- 对所有孔重复步骤,确保每个孔都保存为单独的图像,以便于分析。
注:根据实验限制和细胞示踪荧光的方法,可以对更长的时间点进行成像。 - 支架可以固定并染色以获得额外的指标。在所需的终点时间点,用移液管从孔中吸出培养基并丢弃。用 200 μL 无菌 PBS 轻轻洗涤每个孔两次,每次 5 分钟。加入 200 μL 4% 多聚甲醛 (PFA) 20 分钟,然后吸出并丢弃。孔可以立即染色或在 4 °C 下在 1x PBS 中储存长达一周。
3. 基于单层的升序迁移测定 (MAMA) 方法:3D 图像分析
- 对于批量转换,请打开 IMARIS Image Conversion 软件。将显微镜图像拖放到转换软件中,然后在 Arena 软件中选择要导入的文件夹。按 Start All 键。转换后的图像将作为 .ims 文件显示在 Arena 中。
注意:如果图像元数据中未包含体素大小,请参阅各个共聚焦成像规范以查找该值。或者,体素大小可以近似为成像过程中使用的步长。 - 双击桌面 IMARIS Arena 图标 并从 Arena 中选择图像,打开软件。
- 图像会自动加载到顶部工具栏图标面板上的 '3D View' 分析选项卡中。单击主工具栏中的 Image Proc 选项卡。
- 在侧面板的左上角,单击通道 1 的 下拉菜单 ,然后选择 背景减法.按面板底部的 Ok 返回 '3D View'。t = 0 h 和 t = 24 h 的代表性图像分别如图 2A、B 所示。
- 在侧面板菜单正上方的小工具栏中,单击带有圆角蓝色形状的图标 Add new Surfaces,以创建名为 'Surfaces 1' 的可编辑对象选项卡。
- 用于创建参数算法设置的界面将在菜单面板底部打开。通过单击界面底部的 蓝色箭头按钮 ,手动生成用于所有重复的参数。确保选择了正确的源通道,并选中 'Smooth' 框。
- 将表面细节设置为 0.7 μm,然后选择 Background Subtraction (Local Contrast) (背景减法(局部对比度))。在 '适合对象的最大球体的直径' 框中键入平均单元长度。完成后,按底部的相同 蓝色箭头 。
注意:可以使用工具栏中的"切片"选项卡并测量平均单元格的宽度来估计此值。
- 将表面细节设置为 0.7 μm,然后选择 Background Subtraction (Local Contrast) (背景减法(局部对比度))。在 '适合对象的最大球体的直径' 框中键入平均单元长度。完成后,按底部的相同 蓝色箭头 。
- 对于阈值,确定强度直方图,其中仅分割最亮的单元格。使用切片器,在图像堆栈中上下移动,以确保它尽可能准确。
- 为 'Split touching objects (Region Growing)' 选择 启用 (Enable ),并将种子点直径设置为与以前使用的直径相同的直径。确保选中"基于强度"阈值,然后单击 蓝色的向右箭头按钮。
- 接下来的两个步骤(Filter Seed Points 和 Filter Surfaces)可以通过多次测量进行调整,以确保生成的表面准确;但是,基线分析不需要额外的筛选。当不需要更改时,单击 蓝色箭头 按钮。
注意:最后一步允许根据所需的输出对表面进行进一步分类。进行任何编辑后,单击 绿色箭头按钮 以完成曲面的创建。 - 要保存 Creation Parameters 以进行批量分析,请单击棒图标 Creation。点击 Store Parameters for Batch 并命名,然后单击 Ok.t = 0 和 t = 24 h 的代表性处理图像分别显示在 图 2C、D 中。
注意:所选"表面"中的所有对象都可以根据图像转换软件给出的各种属性(例如表面积、体积、强度和与其他创建的表面的距离)进行分类。 - 通过选择 Statistics 选项卡来找到表面属性。要收集所有单元格高度,请单击 Detailed 选项卡,然后从连续的下拉菜单中选择 Specific Values 和 Position Z 。单击单个 Save 图标以将所有 z 位置和任何分类保存到 .xls 文件中。对所有图像重复上述步骤。
- 从代表性图像中找到非迁移细胞的中位 z 位置,并从每个测试条件井中减去该数字下方的所有 z 位置。
注:迁移值报告为高于非迁移细胞高度的每个技术复制条件的中位数平均值。它们可以报告为中位高度,如图 3A 所示,或者报告为所需时间点与 t = 0 相比迁移高度的倍数变化,如图 3B 所示。
4. 平行分层向外球状体迁移测定 (PLOSMA) 方法:3D 球状体的细胞培养和悬垂液滴培养
注意:该方案描述了细胞培养和悬滴培养,改编自 Nandi 等人编写的方案 14。
- 根据制造商的方案解冻 HDF。根据需要通过,直到达到所需的通过次数。
- 在无菌细胞培养罩中,通过在底部加入 10 mL PBS 并翻转盖子以使外部位于细胞培养罩顶部来制备培养皿。
- 将适当体积的细胞(根据细胞计数确定)添加到微量离心管中。添加在培养基中稀释的细胞示踪染料。使用加热的培养基将总体积调至 1 mL。
注:球状体应为每个球状体大约 8000 个细胞,但可能会根据细胞类型而变化。 - 将细胞溶液在 37 °C 下孵育 45 分钟。 根据制造商推荐的速度将细胞离心并吸出上清液。
- 将细胞重悬于培养基中的 1:100 甲基纤维素中。
- 将 20 μL 细胞/培养基溶液液滴移到培养皿的盖子上。
- 自信、快速、小心地倒置盖子,并将其放在含有 PBS 的培养皿下半部分的顶部。
- 将液滴孵育至少 24 小时。
注意:球状体的形成可以通过明场显微镜进行监测。
5. 平行分层向外球状体迁移测定 (PLOSMA) 方法:将细胞球状体接种到颗粒状水凝胶上
注意: 图 4A 总结了以下过程。
- 要设置 图 4A 中概述的 PLOSMA 方法,使用外置活塞式移液器在无菌条件下向透明 96 孔板中的孔中加入 15 μL 凝胶。
- 使用板旋转转子离心机附件,以 1000 x g 旋转 10 秒以使凝胶变平。将板翻转 180°,然后再次以 1000 x g 的速度旋转 10 秒,以确保凝胶在孔底均匀分布。
- 一旦达到均匀的平整度,通过对样品施加聚焦光(365 nm,33.4 mW/cm2)30 秒以对支架进行退火,从顶部无菌地光交联凝胶。
- 在无菌条件下将悬挂液滴的培养皿移入无菌组织培养罩中,并倒置盖子。
- 使用 20 μL 移液器,缓慢吸取液滴,直到球状体进入移液器吸头。将液滴喷射到孔中心的支架上。
- 对所有孔重复前面的步骤。通过使用明场或荧光显微镜确认,确保每个孔都有一个球体。
- 将孔板在 37 °C 下孵育 2 小时,以使球体附着在支架上。
- 在每个球体顶部额外吸取 15 μL 凝胶。为确保凝胶分布均匀,将板以 300 x g 在每个方向离心 15 秒。
- 使用 33.4 mW/cm2 的 UV (365 nm) 光将凝胶顶层退火 30 秒。在每个支架顶部移液介质,使孔的总体积达到 200 μL。
注意:此时支架会非常干燥,因此请沿孔侧面滴加培养基,以避免分离球体。
6. 平行分层向外球状体迁移测定 (PLOSMA) 方法:状球的共聚焦成像
注意:成像的难易程度取决于成像系统。在低曝光时间找到孔内的球体。使用 FITC 通道 (488 nm) 对细胞进行成像。用于细胞的染料在 492 nm 处激发,在 517 nm 处发射。10 倍放大倍率提供比 4 倍放大倍率更多的细节。
- 找到单元格仍处于焦点状态的最低阶段级别(z 高度)。将此设置为 z 堆栈的下限。
- 找到单元格仍处于焦点的最高阶段级别(z 高度)。将此设置为 z 堆栈的上限。
注:最佳成像结果包括小于或等于 5 μm 的步长,以保持细胞规模的分辨率。根据共聚焦显微镜系统,成像速度和分辨率之间可能存在权衡。 - 按照 t = 0 和 24 小时所述对所有球体进行成像。48 小时的时间点也可以根据实验限制进行成像。 图 4B 中显示了 t = 0 和 t = 24 的代表性最大投影图像。
7. 平行分层向外球状体迁移测定 (PLOSMA) 方法:3D 图像分析
- 按照步骤 3.1 到 3.4 中的说明将图像导入分析软件。在左侧面板的右上角,单击通道 1 的 下拉菜单 ,然后选择 背景减法.按面板底部的 Ok(确定 )。
- 返回 3D 视图后,按 自动调整所有通道 在显示调整弹出窗口中并根据需要进行更正。
- 在侧边菜单上方的较小工具栏中,单击图 5A 中所示的 Add new Reference Frame 图标(带有三个正交箭头),以添加一个名为"Reference Frame 1"的新选项卡。
- 将 原点 移动到所有三个平面中椭球体的中心,如图 5B 所示。
- 在与三个正交箭头相同的工具栏中,单击带有橙色球体的图标并添加新的点以创建一个名为"点 1"的选项卡。按 蓝色箭头按钮。
- 在 Spot Detection (点检测) 下,将 Estimated XY Diameter (估计的 XY 直径 ) 设置为细胞的估计直径。按 蓝色箭头按钮。
注:对于 HDF,此数字为 15.0 μm。 - 对于阈值,请调整强度直方图以仅包围最亮的部分。使用 切片器,在图像堆栈中上下移动,以确保它尽可能准确。点击蓝色的 next 箭头。
- 按绿色的 Execute 按钮完成分析。
- 取消选中 Render on slicer 或单击设置面板右侧的黄色方形图标。
- 单击 Statistics 选项卡。在第一个下拉菜单中,选择 Specific Values (特定值)。在第二个下拉菜单中,选择 Distance from Origin Reference Frame(距原点参考帧的距离)。将显示所选表面的所有值,如图 5C 所示。单击单个 保存 图标,将下载 .xls 文件。
- 通过按主工具栏中的 Save 图标保存对图像和分析所做的更改。 图 6A 表示在 24 小时成像的球体的 3D 渲染,而 图 6B 表示标记扩散单元的 IMARIS Spots 功能,根据与原点参考系的距离进行颜色编码。
- 将导出的数据归一化为 t = 0 图像,并计算每个椭球体的蜂窝距离和 z 高度的平均值,以获得每个样本的单个值。 图 7A、B 分别描述了每个输出的代表性图表。
结果
该协议旨在详细说明两种新型颗粒支架迁移测定的必要步骤。MAMA 方法可用于评估组织界面的细胞浸润。颗粒水凝胶是一个比块状水凝胶更复杂的系统,因此,迁移过程本质上更复杂 9,20。理解图 1 中概述的逐步过程非常重要。每个步骤都建立在下一个步骤的基础上,并在该协议中进行了优化。以 120,000 个细胞/cm2 的密度接种 HDF 将在夜间产生至少 80% 的汇合(图 1A),并且这些非荧光细胞最好在实验当天用细胞示踪染料标记,以最大限度地提高成像潜力(图 1B)。该方案与 HDF 传代中使用的较低离心力相匹配,以维持细胞活力。由于单个离心步骤产生的角度,有必要将板翻转 180° 以确保凝胶移动以完全覆盖孔的底面(图 1C)。退火后让细胞在培养箱中恢复 30 分钟(图 1D)将保持细胞活力并导致最佳迁移(图 1E)。可以用 4 倍物镜对 96 孔板的大面积进行成像,并从时间点 0-24 小时进行匹配(图 2A、B)以广泛评估细胞行为。在分析软件中处理生成的 z 堆栈图像,可在易于使用的界面中为多个大型数据集提供高级分析。该协议总结了在用图 2B,C 中的代表性图像可视化的每个时间点创建细胞高度或位置 Z 数据集的步骤。处理数据的分析如图 3A 所示,使用中位高度的平均值和每个时间点的标准差进行可视化,图 3B 显示了 t = 0 h 时非迁移细胞的倍数变化高度。此方法的基础数据通常是非正态分布的,因此中位数是更可靠的比较度量,因此用于汇总数据。
同样,PLOSMA 方法可用于评估 3D 颗粒水凝胶支架内递送细胞的运动性。 图 4A 概述了 PLOSMA 方法的步骤,在孔中心接种球体尤为重要。建议将球体置于视场中,但这取决于显微镜的功能。 图 4B 显示了在 FITC 通道 (488 nm) 中以 10 倍放大倍率拍摄的 t = 0 h 和 t = 24 h 的球状体扩散的代表性图像。在软件中,可以创建原点参考系并针对每个 z 堆栈进行调整(图 5A、B)。该软件可以跟踪与该原点参考系的径向距离,并将其导出为所需的数据集(图 5C)。 图 6A 显示了 t = 24 h 球体的 3D 渲染的代表性图像,而 图 6B 显示了软件的 Spots 功能。 图 7 显示了已处理数据的示例。 图 7A 表示从中心到第 0 天距离的平均行进距离。 图 7B 隔离了仅在 z 平面上行进的距离,因为这是 PLOSMA 方法旨在研究的方向。
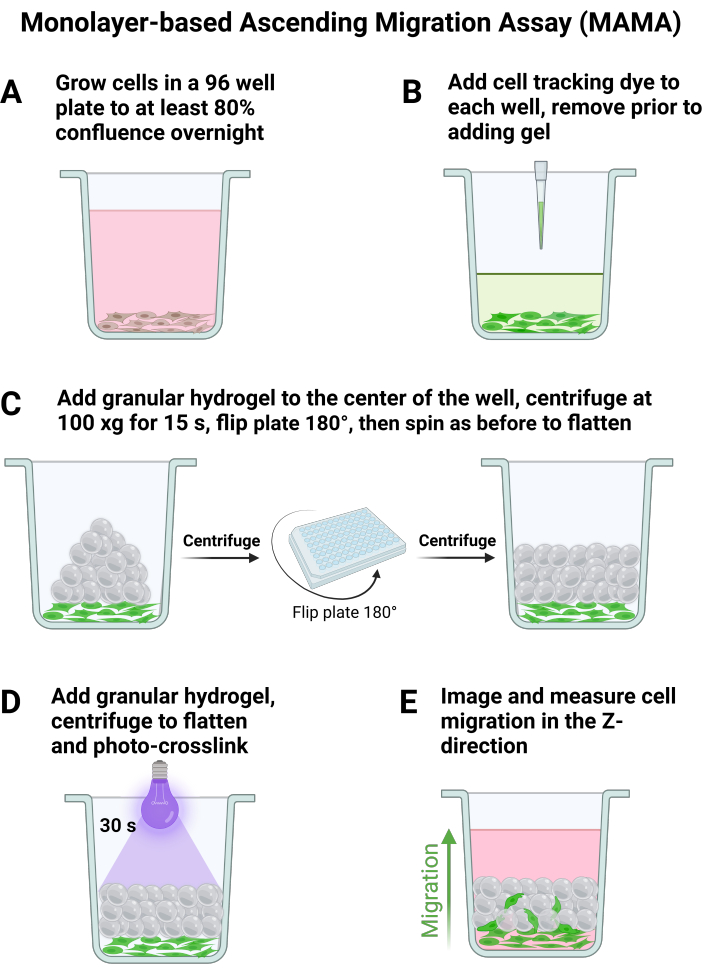
图 1:基于单层的 Ascending Migration Assay 细胞培养和成像。 MAMA 细胞和凝胶处理的主要步骤示意图。(A) 细胞生长至汇合过夜,(B) 在加入颗粒状凝胶之前加入细胞示踪染料。支架 通过 (C) 板离心组装,并用 (D) 光交联稳定。在多个时间点成像允许 (E) 细胞向上迁移的可视化。 请单击此处查看此图的较大版本。
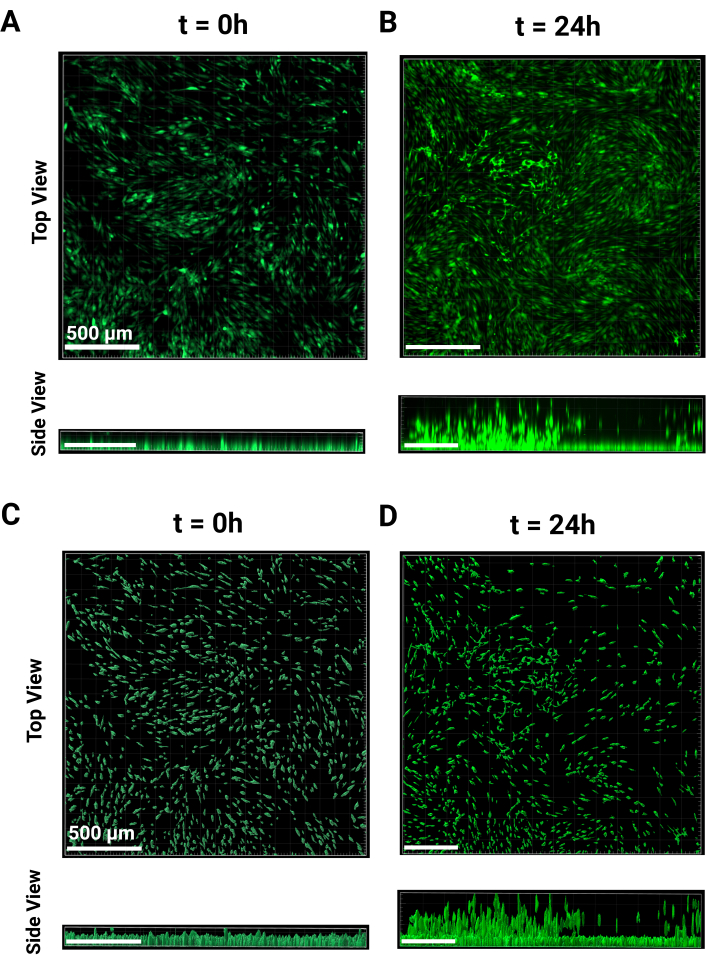
图 2:MAMA 图像处理。 图像处理的代表性图像。在 4 倍放大倍率下,FITC 通道中 (A) t = 0 和 (B) t = 24 h 的原始共聚焦图像的顶视图和侧视图比较。(B) (B) 处理细胞位置 Z 高度在 (C) t = 0 和 (D) t = 24 h 时的顶视图和侧视图比较。24 小时的处理包括减去中位数非迁移 z 高度。比例尺 = 500 μm。缩写:MAMA = 基于单层的 Ascending Migration Assay。 请单击此处查看此图的较大版本。
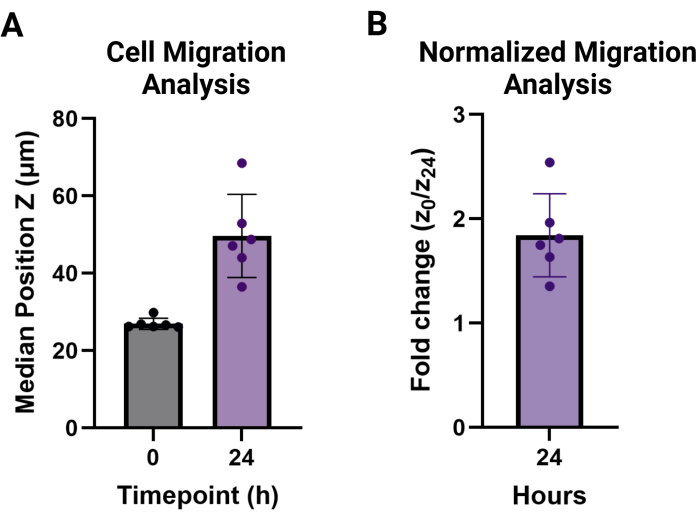
图 3:MAMA 细胞迁移输出分析。 (A) 在时间点 t = 0 (27.0 μm ± 1.4 μm) 和 t = 24 h (46.6 μm ± 10.8 μm) 时每个重复的细胞高度的中位位置 Z 和标准差。(B) 24 小时时细胞迁移归一化为 0 小时,报告为倍数变化 (1.8 ± 0.4)。 请单击此处查看此图的较大版本。
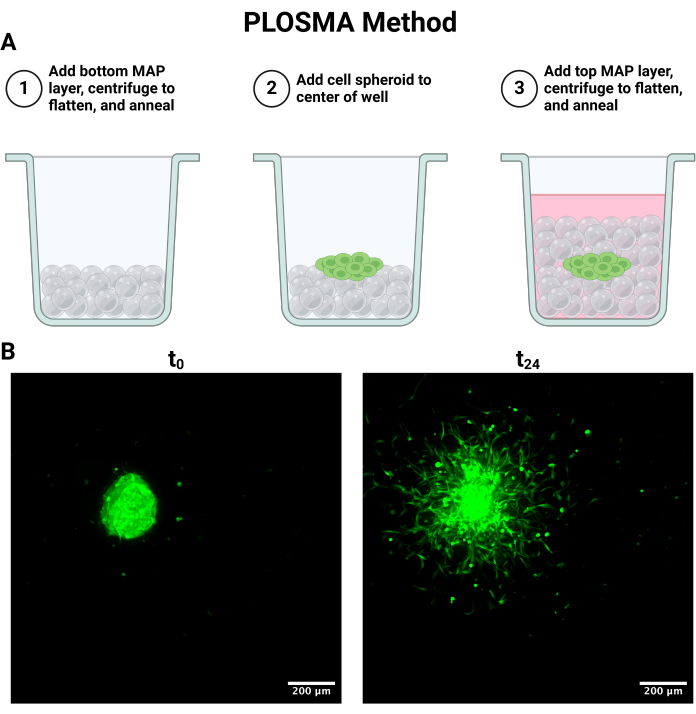
图 4:平行层向外球状体迁移测定 (PLOSMA) 细胞培养和成像。 (A) 描述支架分层步骤的示意图。(B) 在 0 和 24 小时拍摄的椭球体最大强度投影。 通过 FITC 通道 (488 nm) 中的共聚焦荧光显微镜以 10 倍放大倍率拍摄图像。比例尺 = 200 μm。缩写:PLOSMA = 平行层向外球状体迁移测定。 请单击此处查看此图的较大版本。
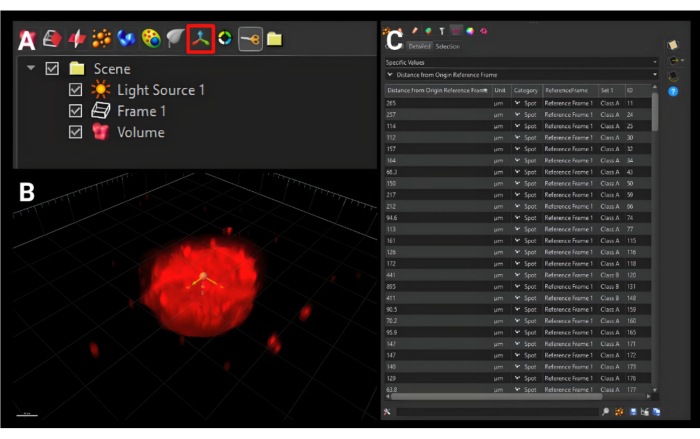
图 5:创建新的原点参考系。 (A) 用红色框勾勒出的新原点参考系按钮。(B) 新原点在所有三个维度上都设置为椭球体的中心。(C) 显示的输出度量是像元表面与原始参考系的距离,它描述了像元从中心迁移的距离。比例尺 = 120 μm。 请点击此处查看此图的较大版本。
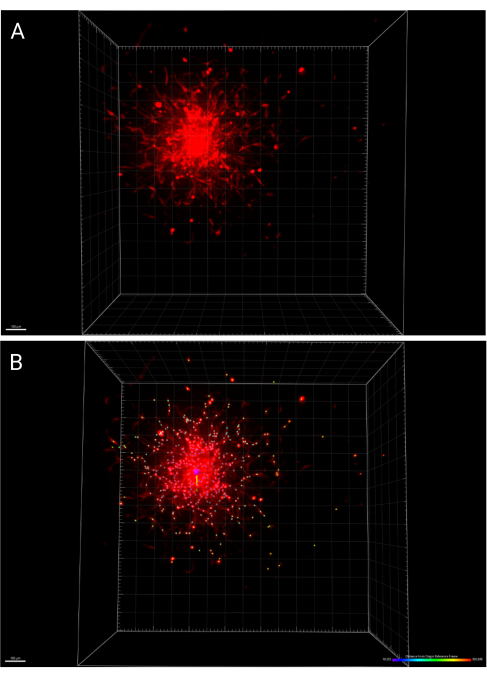
图 6:24 小时时嵌入的椭球体的 3D 渲染。 (A) 在 3D 空间中处理的椭球体。(B) 使用 IMARIS 中的原点参考系函数确定同一椭球体的中心,并且细胞扩散按距原点的距离进行颜色编码。 请单击此处查看此图的较大版本。
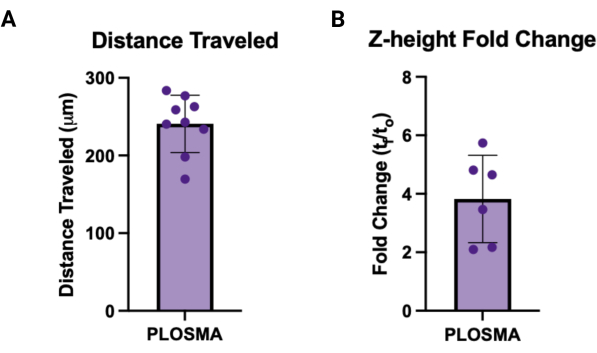
图 7:PLOSMA 的示例输出。 (A) PLOSMA 结果示例,显示以 μm 为单位的行进距离。平均行进距离为 240.8 μm ± 36.87 μm。(B) 球状体发芽的 Z 高度折叠变化 (tf/t0)。平均折叠变化为 3.82 ± 1.495。 请单击此处查看此图的较大版本。
讨论
该协议描述了两种体外模型,用于表征 3D 细胞迁移以进行伤口愈合和组织整合。第一个模型是基于单层的迁移测定,依赖于正确附着和融合的细胞。该方案是使用成纤维细胞类型开发的,并在 1,20,000 个细胞/cm2 的接种密度下进行了优化。该密度允许细胞在过夜内生长至至少 80% 的汇合度均匀地分布在孔板底部。此步骤确保在至少 24 小时内沿 z 方向迁移;如果在添加凝胶层时汇合度太低,细胞可能会继续扩散到组织培养塑料上以及凝胶中,从而导致不均匀、缓慢的迁移模式,这在优化过程中观察到。即使在 80% 汇合时,在细胞密度较低的区域仍可能观察到不均匀的迁移高度。良好的重复将减少这些细胞行为的噪音。过度汇合的细胞会导致离心期间细胞隆起,并可能导致细胞死亡。这种可变性可以通过在一致数量的细胞上接种并捕获一致的图像区域来进行适当的数据比较来解决。据作者所知,尚未发表用于凝胶压平的板离心法,但离心通常用于细胞传代和处理生物物质21,22。调整速度以匹配传代速度将保持细胞活力,从而进一步优化细胞处理。
该方法的主要挑战是最大限度地提高成像分辨率和深度,同时最大限度地减少成像时间以确保最佳分析。Green Cell 示踪染料的亮度足以对步长为 5 μm 或更小的 96 孔进行成像,曝光时间低至 1000 ms。缩短曝光时间可以减少细胞不在孵育条件下的时间,但也会降低分辨率。这些参数必须在单个显微镜的基础上进行优化,但通过确保在一次研究中以相同的设置捕获所有图像来减少可变性。
MAMA 分析的一个重要注意事项是,它需要去除单层高度或以下的细胞,以确保仅考虑迁移的细胞进行统计测试。因此,由于过滤后细胞位置的非高斯分布性质,报告了重复孔的中位数。组间比较可以用直方图可视化,中位数可以用非参数检验进行统计分析。
尽管存在这些挑战,但基于单层的向上迁移方法在最简单的情况下是多孔支架 3D 细胞浸润的可重复测定法。要研究细胞迁移的机制效应,请确保参数适合所研究的细胞类型。这可能包括在凝胶内或培养基中添加趋化或趋触性成分。人真皮成纤维细胞完全培养基包括迁移趋化因子,但其他使用更特异性线索的细胞类型需要相应地调整测定。该分析确实适合测试多种类型的变量;但是,本协议未涵盖这些范围。MAMA 提供了一个生理相关的环境,类似于细胞在 体内从大块组织移动到注射的多孔水凝胶中。
对于 PLOSMA 方法,将球体放置在支架中心对于成功成像和有意义的三维细胞迁移至关重要。球状体在凝胶中心的确切接种取决于用户。为此,用用户的非惯用手将移液器固定在桶上有助于居中,并且可以使用明场或荧光显微镜确认接种位置的有效性。偏离中心的椭球体可以通过在同一支架或新支架上使用新椭球体进行第二次尝试来补救。因此,作者建议制备不必要的球状体,并制备不必要的 MAP 凝胶。
第二层离心步骤确保球状体 (1) 被凝胶均匀覆盖,并且 (2) 能够均匀地向上和向下扩散到凝胶中,这对于研究递送的细胞至关重要。离心还会导致球体从中心向孔边缘移动,虽然该方案通过优化离心步骤和用于每层 (15 μL) 的凝胶体积以实现均匀分布来限制这种现象,但它并不能完全消除其移动。减少球体运动所需的确切离心速度和时间可能需要根据离心机的型号进行调整;但是,本协议中描述的规范可以用作单个优化的基准。另一种方法是在添加第二层凝胶之前,让球体 2 小时的孵育时间附着在支架上。当两种策略都实施时,椭球体运动得到特别好的缓解。最后,由于多步离心过程,该方法可能不适用于耐寒性较差的细胞系。
除了在 PLOSMA 方法中电镀球体的后勤工作外,在图像采集过程中还存在限制。可以使用 4 倍或 10 倍放大倍率对球体进行成像,但为了获得最佳结果,请至少使用 10 倍放大倍率并将 z 堆栈的步长减小到 2-5 μm。在整个研究过程中,放大倍数应保持一致。成像时间随着分辨率的提高而增加,因此请限制每个孔板中的样品数量(每个板 4-8 个孔),以最大限度地减少培养箱外的时间。实时成像设置还可以改进跟踪并提供更深入的见解。
由于颗粒水凝胶具有独特的拓扑结构和设计参数,包括固有体积、孔隙率、机械强度,在某些情况下还包括生物活性,因此有必要尽可能保真地研究与这些方面相关的细胞行为。PLOSMA 方法旨在模拟递送后或细胞完全进入颗粒凝胶后的细胞运动。由于细胞被迫通过颗粒水凝胶几何形状中固有的孔迁移,因此 PLOSMA 方法有效地隔离了孔隙率对细胞行为的影响。该测定的潜在应用是细胞 原位 递送和颗粒支架内的组织整合,特别是在伤口愈合空间23。
由于成纤维细胞迁移在组织修复和重塑中的作用,这两种方案都是用原代人真皮成纤维细胞开发的 4,24,然而,任何贴壁细胞的迁移行为都可以响应多孔支架的改变来测量 - 包括添加生长因子和凝胶的表面/体积组成。这些变化可能需要定制这些检测以获得可观的结果。需要进一步优化的参数包括细胞接种密度、实验持续时间和/或分析流程。IMARIS 是一种强大的成像分析工具,用于细胞迁移分析,其功能超出了此处概述的功能,包括根据各种属性(如表面积、体积、强度和与其他创建表面的距离)将所选"表面"内的所有对象分类为一组。有许多在线资源可用于确定进一步的分析方法。
此处概述的两种方法不仅以生理学方式解决了组织引入颗粒材料的初始状态,还解决了完全嵌入材料中的后续细胞反应。与所有迁移测定一样,存在的细胞能够与移动平行增殖,但是所述测定的设计不会破坏增殖,从而确保不会对分析产生不必要的影响。除了纵向成像外,这两种方法都与终点染色兼容,纵向成像使用 PFA 固定来检测细胞骨架、胶原沉积、增殖等指标。与以前的方法 1,6,14,15,25,26,27 相比,概述方法的使用朝着更准确的 3D 细胞迁移的时空表示发展,利用细胞浸润作为可测量参数。
披露声明
作者没有需要披露的利益冲突。
致谢
这项工作的资金部分由美国国立卫生研究院高优先级短期项目奖 (1R56DK126020-01) 和 Kurtin Trust 的慈善礼物支持。J.T. 由美国国家科学基金会研究生研究奖学金资助。使用 BioRender.com 创建的图示意图。
材料
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 Phalloidin | ThermoFisher | A22287 | |
| Bovine Serum Albumin | VWR International | 332 | |
| CellTracker Green CMFDS Dye, 1 mg | ThermoFisher | C2925 | 20 x 50 ug units, 492/517 nm |
| Centrifuge | ThermoFisher | 75016085 | ST Plus Series |
| Clear 96 well plate | MilliPore Sigma | CLS3997-50EA | |
| Dimethyl Sulfoxide | Fisher Scientific | MT-25950CQC | 250 mL |
| Fibroblast Basal Medium | ATCC | PCS-201-030 | 480 mL, phenol-red-free |
| Fibroblast Growth Kit - Low Serum | ATCC | PCS-201-041 | 7.5 mM L-glut,5 ng/mL rh FGF basic, 5 ug/mL rh Insulin, 1 ug/mL Hydrocortisone, 50 ug/mL Ascorbic acid, 2% FBS |
| FIJI (ImageJ) | NIH | Public access download | |
| Human Dermal Fibroblasts | ATCC | PCS-201-012 | Adult human dermal fibroblasts |
| ImageXpress Micro Confocal | Molecular Devices | Spinning Disc confocal microscope with 4x, 10x magnifications | |
| IMARIS | Oxford Instruments | 3/4D Imaged Visualizaiton and Analysis Software, Proprietary | |
| Incubator | ThermoFisher | Finnpipette F2 Variable volume Pipettes | HeraCell Vios 160i CO2 Incubator, 165L |
| M-20 Microplate Swinging Bucket Rotor | ThermoFisher | 75003624 | |
| Methylcellulose | Fisher Scientific | 9004-67-5 | Lab grade, powder form |
| Microcentrifuge tube | Fisherbrand | 05-408-129 | 1.5 mL microcentrifuge tubes |
| Paraformaldehyde (4%) | Alfa Aesar | AAJ19943K2 | For fixing |
| Petri dish | Corning | 08-757-100A | Bacteriological Petri Dishes with Lid 35 x 10 mm |
| Pipettes | ThermoFisher | 4642080 | Finnpipette F2 Variable volume Pipettes |
| Sterile PBS | Gibco | 10010-023 | |
| Triton-X | Fisher Scientific | 327371000 |
参考文献
- Jerka, D., et al. Unraveling endothelial cell migration: Insights into fundamental forces, inflammation, biomaterial applications, and tissue regeneration strategies. ACS Appl Bio Mater. 7 (4), 2054-2069 (2024).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay Drug Dev Technol. 12 (4), 207-218 (2014).
- Yamada, K. M., Sixt, M. Mechanisms of 3D cell migration. Nat Rev Mol Cell Biol. 20 (12), 738-752 (2019).
- Grinnell, F. Fibroblast biology in three-dimensional collagen matrices. Trends Cell Biol. 13 (5), 264-269 (2003).
- Kloxin, A. M., Kloxin, C. J., Bowman, C. N., Anseth, K. S. Mechanical properties of cellularly responsive hydrogels and their experimental determination. Adv Mater. 22 (31), 3484-3494 (2010).
- Solbu, A. A., et al. Assessing cell migration in hydrogels: An overview of relevant materials and methods. Mater Today Bio. 18, 100537 (2023).
- Madl, C. M., Katz, L. M., Heilshorn, S. C. Tuning bulk hydrogel degradation by simultaneous control of proteolytic cleavage kinetics and hydrogel network architecture. ACS Macro Lett. 7 (11), 1302-1307 (2018).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nat Rev Mater. 5 (1), 20-43 (2020).
- Qazi, T. H., Burdick, J. A. Granular hydrogels for endogenous tissue repair. Biomater Biosyst. 1, 100008 (2021).
- Tanner, G. I., Schiltz, L., Narra, N., Figueiredo, M. L., Qazi, T. H. Granular hydrogels improve myogenic invasion and repair after volumetric muscle loss. Adv Healthc Mater. 25, e2303576 (2024).
- Sussman, E. M., Halpin, M. C., Muster, J., Moon, R. T., Ratner, B. D. Porous implants modulate healing and induce shifts in local macrophage polarization in the foreign body reaction. Ann Biomed Eng. 42 (7), 1508-1516 (2014).
- Roosa, C. A., et al. Conjugation of IL-33 to microporous annealed particle scaffolds enhances type 2-like immune responses in vitro and in vivo. Adv Healthc Mater. 13 (25), 2400249 (2024).
- Jaberi, A., et al. Engineering microgel packing to tailor the physical and biological properties of gelatin methacryloyl granular hydrogel scaffolds. Adv Healthc Mater. 13 (25), 2402489 (2024).
- Nandi, S., Brown, A. C. Characterizing cell migration within three-dimensional in vitro wound environments. J Vis Exp. 126, e56099 (2017).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Adv Mater. 34 (12), 2109194 (2022).
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nat Mater. 14 (7), 737-744 (2015).
- Pruett, L. J., Jenkins, C. H., Singh, N. S., Catallo, K. J., Griffin, D. R. Heparin microislands in microporous annealed particle scaffolds for accelerated diabetic wound healing. Adv Funct Mater. 31 (35), 2104337 (2021).
- Roosa, C., et al. Microfluidic synthesis of microgel building blocks for microporous annealed particle scaffold. J Vis Exp. (184), e64119 (2022).
- Pfaff, B. N., et al. Selective and improved photoannealing of microporous annealed particle (MAP) scaffolds. ACS Biomater Sci Eng. 7 (2), 422-427 (2021).
- Riley, L., Schirmer, L., Segura, T. Granular hydrogels: Emergent properties of jammed hydrogel microparticles and their applications in tissue repair and regeneration. Curr Opin Biotechnol. 60, 1-8 (2019).
- Jo, C. H., Roh, Y. H., Kim, J. E., Shin, S., Yoon, K. S. Optimizing platelet-rich plasma gel formation by varying time and gravitational forces during centrifugation. J Oral Implantol. 39 (5), 525-532 (2013).
- Mironov, V., et al. Fabrication of tubular tissue constructs by centrifugal casting of cells suspended in an in situ. crosslinkable hyaluronan-gelatin hydrogel. Biomaterials. 26 (36), 7628-7635 (2005).
- Vu, L. T., Jain, G., Veres, B. D., Rajagopalan, P. Cell migration on planar and three-dimensional matrices: A hydrogel-based perspective. Tissue Eng Part B Rev. 21 (1), 67-74 (2015).
- Cialdai, F., Risaliti, C., Monici, M. Role of fibroblasts in wound healing and tissue remodeling on Earth and in space. Front Bioeng Biotechnol. 10, 958381 (2022).
- Qazi, T. H., Muir, V. G., Burdick, J. A. Methods to characterize granular hydrogel rheological properties, porosity, and cell invasion. ACS Biomater Sci Eng. 8 (4), 1427-1442 (2022).
- Shaik, R., et al. Cardiac matrix-derived granular hydrogel enhances cell function in 3D culture. ACS Appl Mater Interfaces. 16 (43), 58346-58356 (2024).
- Puiggalí-Jou, A., Asadikorayem, M., Maniura-Weber, K., Zenobi-Wong, M. Growth factor-loaded sulfated microislands in granular hydrogels promote hMSCs migration and chondrogenic differentiation. Acta Biomater. 166, 69-84 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。