Method Article
Количественная оценка трехмерной миграции клеток внутри и в гранулированные гидрогелевые биоматериалы
В этой статье
Резюме
Здесь представлен протокол количественной оценки миграции 3D-клеток внутри и в границу раздела гранулированных гидрогелей.
Аннотация
Гранулированные гидрогелевые каркасы обладают значительным потенциалом в регенеративной медицине, функционируя либо как переносчики для доставки клеток, либо как интерфейсы для интеграции тканей. В данной статье представлены два новых подхода к количественной оценке миграции клеток внутри и в гранулированные гидрогели, подчеркивая различные области применения этих каркасов. Во-первых, представлен анализ границы раздела клеточных монослоев, который имитирует рост тканей в гранулированные гидрогели с целью интеграции. Во-вторых, описан анализ на основе сфероидов, предназначенный для отслеживания движения клеток внутри гидрогелевого матрикса, специально подходящий для приложений, связанных с доставкой клеток. Оба метода позволяют точно и контролируемо измерять миграцию клеток, предоставляя полный набор инструментов для исследователей, использующих гранулированные гидрогелевые каркасы. Мотивация для этих методов проистекает из необходимости индивидуального контроля над миграцией клеток внутри каркаса для согласования с конкретными приложениями. Оптимизируя и стандартизируя эти методы количественной оценки, исследователи могут итеративно улучшать свойства гранулированного гидрогеля, обеспечивая их эффективность в различных контекстах регенеративной медицины. Этот надежный набор количественных инструментов открывает новые возможности для улучшения гранулированных гидрогелевых каркасов, улучшая их использование как в доставке клеток, так и в приложениях для интеграции тканей.
Введение
Биоматериалы для терапевтических применений все больше развиваются в сторону более сложных и актуальных моделей клеточной среды для изучения интеграции тканей. Каркасы из биоматериала обеспечивают трехмерную (3D) структуру для роста клеток и стремятся имитировать желаемую ткань 1,2. Трехмерные модели клеточных культур включают природные матрицы и синтетические скаффолды, которые придают клеткам дополнительную сложность с помощью гаптотаксических или хемотаксических сигналов 3,4. Традиционные гидрогелевые каркасы сшиты в объеме, что дает нанопористую сетку, которая обеспечивает диффузию малых молекул 5,6, но требует деградации для миграции в масштабе клетки в область ткани, нуждающуюсяв восстановлении. Гранулированные гидрогели представляют собой подмножество биоматериалов, которые имеют высокий потенциал для клинической трансляции благодаря своей биосовместимости, способности соответствовать неправильным формам и, во многих случаях, их инъекционной пригодности. Их блочная природа обеспечивает преимущество пористости в масштабе клетки для улучшения инфильтрации тканей и ангиогенеза, а также модульности, что позволяет добавлять гетерогенные сигналы для поведения клеток 10,11,12. Понимание реакции и движения клеток в 3D-каркасе жизненно важно для физиологической значимости во всех приложениях с использованием биоматериалов для интеграции тканей.
Однако изучение врастания тканей в трех измерениях оказалось трудным для достижения количественной точности. Возросшая сложность 3D-среды требует моделей миграции клеток in vitro, которые могут не только дать представление о поведении клеток, но и оптимизировать материальное состояние. В ранее опубликованных отчетах о миграции клеток 3D-гранулярного каркаса использовался местный посев для изучения поведения клеток, сообщая об инфильтрации в пористую структуру и морфологию клетки13 и других сфероидных ростках14,15, измеряя длину роста и количество ростков. На длину миграции местного посева силы тяжести могут неравномерно влиять, а из-за ограничений микроскопии результаты не могут быть продольными. Метод проращивания сфероидов был ограничен 2D-количественной оценкой с помощью максимальной проекции, которая не может охватить механизм контролируемой инвазии. Оба метода измеряются в плоскости xy, в которой отсутствуют нюансы, необходимые для полного повторения трехмерного клеточного движения и инфильтрации скаффолда.
В данном протоколе описаны два подхода к количественной оценке миграции клеток, такие как инфильтрация in vitro в пористые 3D-гранулированные гидрогелевые каркасы, в частности, с использованием микропористых отожженных частиц (MAP) 16,17,18,19. Целью следующих методов является изучение поведения клеток в гранулярных гелях путем управления направленностью их миграции для трехмерного анализа. Первый, основанный на однослойном анализе восходящей миграции (MAMA), представляет собой упрощенную модель эндогенной клеточной интеграции, которая иллюстрирует равномерные взаимодействия клеток и материала и служит платформой для представления начальной среды, в которой клетки взаимодействуют с гранулированными гидрогелями, а также для выделения индивидуального поведения до инфильтрации каркаса. Второй, называемый методом параллельного слоистого анализа миграции сфероидов наружу (PLOSMA), представляет собой трехмерный анализ миграции сфероидов клеток, который исследует движение клеток при полном окружении сложной средой каркаса и моделирует движение клеток после доставки, а также движение после того, как клетки полностью вошли в гранулированный гель.
Оба метода поддаются количественной оценке с помощью 3D-анализа изображений и могут быть применены для изучения и оптимизации взаимодействий материалов и клеток с использованием продольных временных точек для приложений регенеративной медицины и тканевой инженерии, где стимулирование или ограничение движения клеток находится в пределах критериев проектирования. Кроме того, эти методы используют преимущества центрифугирования в планшетах для равномерной подготовки многолуночного анализа.
протокол
Подробная информация о реагентах и оборудовании, использованном в исследовании, приведена в Таблице материалов.
1. Приготовление гранулированного гидрогеля
ПРИМЕЧАНИЕ: Частицы MAP, используемые в данном протоколе, представляют собой 3,2 мас.% по весу геля с 45,88 мг/мл PEG-Mal (10 кДа), 0,82 мг/мл RGD, 8,06 мг/мл MethMal19 и 5,62 мг/мл MMP-2 разлагаемого сшивающего агента. Механическая жесткость геля составляет 15-20 кПа для соответствия дермальной жесткости17.
- Сгенерируйте гранулированные частицы гидрогеля и подготовьте к культивированию клеток в обычном режиме.
ПРИМЕЧАНИЕ: Данный протокол описывает стерильное получение геля с микропористыми отожженными частицами, производство которого подробно описано в работе Roosa et al.18. - Подготовьте гранулированные гидрогелевые частицы для использования in vitro путем стерилизации тремя промывками 70% изопропилового спирта с последующим тремя промывками стерильного 1x PBS.
- Приготовьте стерильный 0,2 мМ фенил-2,4,6-триметилбензоилфосфинат (LAP) в растворе среды, растворив порошок LAP в ультрачистой воде и пропустив раствор через стерильный фильтр 0,22 мкм. Добавьте этот раствор в соотношении 1:1 v/v с количеством геля, необходимым для проведения эксперимента.
- Инкубируйте 0,2 мМ LAP, гель и раствор среды при 37 °C на вращателе пробирки со скоростью 20 об/мин в течение не менее 30 минут, прежде чем продолжить, чтобы обеспечить диффузию LAP по микрочастицам.
- По истечении 30 мин центрифугировать суспензию частиц при 18 000 x g в течение 5 мин при 25 °C. Аспирируйте надосадочную жидкость.
ПРИМЕЧАНИЕ: Общая сухость частиц MAP может варьироваться из-за различий в химическом составе, гидрофильности и размере частиц. Для обеспечения консистенции лучше всего центрифугировать суспензию частиц, как описано, перемешать частицы в пробирке с помощью пипетки прямого действия, а затем повторить этап центрифугирования.
2. Метод анализа восходящей миграции на основе монослоя (MAMA): клеточная культура и визуализация
Примечание: Изображения клеток проводились с использованием канала FITC (488 нм). Краситель, используемый для клеток, имел возбуждение на длине волны 492 нм и излучение на длине волны 517 нм. 10-кратное увеличение обеспечивает повышенную детализацию по сравнению с 4-кратным увеличением, но можно использовать любой из них.
- Разморозьте человеческие дермальные фибробласты (ХДФ) в соответствии с протоколом производителя. Проход по мере необходимости до тех пор, пока не будет достигнут желаемый проход; Как правило, первичные клетки поддерживают генетический и фенотипический состав через P5.
- Планшет 120 000 клеток/см2 по меньшей мере n = 6 в 96-луночном планшете или желаемом размере планшета с использованием рекомендуемого объема среды на лунку для суспензии, осторожно отсасывая перед каждым добавлением. Дайте клеткам прикрепиться на ночь, как показано на рисунке 1А, что приведет к примерно 80% слиянию на следующий день.
ПРИМЕЧАНИЕ: Как правило, центральные колонные и рядные лунки лучше всего подходят для оптимального распределения геля. Для 96-луночной пластины авторы используют до 24 лунок (строки B-G и столбцы 5-8). - Приготовьте гелевые условия, как указано выше, и во время инкубации в LAP удалите среду с помощью аспиратора или пипетки из луночной пластины клеток. Будьте осторожны, чтобы не потревожить дно тарелки.
- Добавьте в лунки краситель для слежения за клетками в соответствии с инструкциями производителя, представленными на рисунке 1В. Убедитесь, что гель полностью подготовлен, как описано в шаге 1, прежде чем аспирировать краситель для отслеживания клеток из лунок.
- Добавьте по 20 мкл каждого геля в лунки с пипеткой положительного вытеснения, не касаясь дна пластины.
ПРИМЕЧАНИЕ: Наилучшие условия анализа возникают, когда гель пипетируется непосредственно в центр лунки. - С помощью центрифуги с вращающимся пластинчатым ротором при температуре 25 °C вращайте при 100 x g в течение 15 с с ускорением и замедлением 8 для расплющивания геля. Переверните пластину на 180° и снова вращайте при 100 x g в течение 15 с, чтобы обеспечить равномерное распределение геля по дну лунки, как показано на рисунке 1C.
- Асептически сшивайте гель сверху (рис. 1D) путем подачи сфокусированного света (365 нм, 34,4 мВт/см2) на образец в течение 30 с для отжига каркаса, добавляя по 200 мкл среды в каждую лунку клеток после формирования всех скаффолдов. Дайте клеткам инкубироваться при 37 °C в течение 30 минут, чтобы они могли прикрепиться к зернистому каркасу перед визуализацией.
- Чтобы зафиксировать миграционное поведение, обобщенное на рисунке 1E, визуализируйте клетки с помощью конфокального микроскопа. Найдите самую низкую точку фокусировки для области пластины, где ячейки сливаются не менее чем на 80%, и установите ее в качестве нижнего края z-стека.
- Найдите самую высокую точку флуоресцентного сигнала ячейки и установите ее в качестве верхнего края z-стека. Используйте шаг 5 μм или меньше для достижения наилучшего разрешения.
- Изобразите по крайней мере три лунки для отображения монослоя клетки и высоты немигрирующих клеток. Временная точка t = 0 показана как сверху, так и сбоку на рисунке 2A. Инкубируйте в течение ночи после завершения визуализации.
ПРИМЕЧАНИЕ: Эти ячейки были визуализированы с 4-кратным объективом, и экспозиция поддерживалась постоянной для всех скважин. - При t = 24 h клетки начнут подниматься вверх по зернистому каркасу, как видно на рисунке 2B сверху и сбоку. Повторите шаги визуализации, выполненные для t = 0 ч, используя те же параметры. Используйте предыдущую высоту рабочей области в качестве эталона или найдите ячейки, которые еще не были перенесены, и установите ее в качестве нижнего края z-стека.
- Повторите шаги для всех скважин, убедившись, что каждая скважина сохранена в виде отдельного изображения для упрощения анализа.
ПРИМЕЧАНИЕ: Временные точки могут быть визуализированы для более длительных временных точек в зависимости от экспериментальных ограничений и метода отслеживания флуоресценции клеток. - Скаффолды могут быть закреплены и окрашены для получения дополнительных показателей. В желаемый конечный момент времени отасуньте среду из лунок с помощью пипетки и выбросьте. Аккуратно промойте каждую лунку 200 мкл стерильного PBS дважды в течение 5 минут каждый. Добавьте 200 μL 4% параформальдегида (PFA) в течение 20 минут, затем аспирируйте и выбросьте. Лунки можно окрашивать сразу или хранить при температуре 4 °C в 1x PBS до недели.
3. Метод анализа восходящей миграции на основе монослоя (MAMA): анализ 3D-изображений
- Для пакетного преобразования откройте программное обеспечение IMARIS Image Conversion. Перетащите изображения микроскопии в программу преобразования и выберите папку внутри программы Arena для импорта. Нажмите «Начать все». Преобразованные изображения появятся на Арене в виде файлов .ims.
ПРИМЕЧАНИЕ: Если размер воксела не включен в метаданные изображения, обратитесь к спецификациям индивидуальной конфокальной визуализации, чтобы найти значение. Кроме того, размер воксела может быть аппроксимирован как размер шага, используемого во время визуализации. - Откройте программу, дважды щелкнув значок IMARIS Arena на рабочем столе и выбрав изображение из Арены.
- Изображение автоматически загружается на вкладку анализа «3D View», которую можно увидеть на панели значков панели инструментов вверху. Перейдите на вкладку «Обработка изображений » на главной панели инструментов.
- В левом верхнем углу боковой панели нажмите на выпадающее меню для канала 1 и выберите «Вычитание фона». Нажмите Ok в нижней части панели, чтобы вернуться к '3D View'. Репрезентативные изображения для t = 0 ч и t = 24 ч представлены на рисунках 2A, B соответственно.
- На небольшой панели инструментов прямо над меню боковой панели нажмите на иконку с закругленными синими формами « Добавить новые поверхности», чтобы создать редактируемую вкладку объектов под названием «Поверхности 1».
- Интерфейс для создания параметров, настройки алгоритма откроется ближе к нижней части панели меню. Вручную сгенерируйте параметры, которые будут использоваться для всех реплик, нажав кнопку с синей стрелкой в нижней части интерфейса. Убедитесь, что выбран правильный исходный канал, и установите флажок «Плавный».
- Установите детализацию поверхности на 0,7 мкм и выберите Вычитание фона (Локальный контраст). Введите среднюю длину ячейки в поле «Диаметр самой большой сферы, которая помещается в объект». Когда закончите, нажмите на ту же синюю стрелку внизу.
ПРИМЕЧАНИЕ: Это значение можно оценить с помощью вкладки «Срез» на панели инструментов и измерения ширины средних ячеек.
- Установите детализацию поверхности на 0,7 мкм и выберите Вычитание фона (Локальный контраст). Введите среднюю длину ячейки в поле «Диаметр самой большой сферы, которая помещается в объект». Когда закончите, нажмите на ту же синюю стрелку внизу.
- Для порогового значения определите гистограмму интенсивности, на которой сегментированы только самые яркие ячейки. С помощью среза перемещайтесь вверх и вниз по стеку изображений, чтобы обеспечить максимальную точность.
- Выберите «Включить » для параметра «Разделить соприкасающиеся объекты (рост области)» и установите диаметр исходных точек на тот же диаметр, что и ранее. Убедитесь, что выбрано пороговое значение «На основе интенсивности», и нажмите синюю кнопку со стрелкой вправо.
- Следующие два шага, Исходные точки фильтра и Поверхности фильтра, могут быть отрегулированы с помощью нескольких измерений, чтобы обеспечить точность сгенерированных поверхностей; Однако базовый анализ не требует дополнительной фильтрации. Когда изменения не нужны, нажмите на кнопку с синей стрелкой .
ПРИМЕЧАНИЕ: На последнем этапе можно дополнительно классифицировать поверхность в зависимости от желаемого результата. После внесения изменений нажмите кнопку с зеленой стрелкой , чтобы завершить создание поверхностей. - Чтобы сохранить параметры создания для пакетного анализа, нажмите на иконку палочки «Создание». Нажмите «Параметры магазина» для параметра «Пакет» и присвойте ему имя, затем нажмите «ОК». Репрезентативные обработанные изображения для t = 0 и t = 24 ч показаны на рисунках 2C,D соответственно.
ПРИМЕЧАНИЕ: Все объекты в пределах выбранной "поверхности" могут быть классифицированы по наборам на основе различных свойств, задаваемых программным обеспечением для преобразования изображений, таких как площадь поверхности, объем, интенсивность и расстояние от других создаваемых поверхностей. - Свойства поверхности можно найти, выбрав вкладку Статистика . Чтобы собрать все высоты ячеек, перейдите на вкладку «Подробности » и выберите «Конкретные значения » и «Положение Z » из последовательных выпадающих меню. Нажмите на один значок «Сохранить », чтобы сохранить все z-позиции и любые классификации в файл .xls. Повторите для всех изображений.
- Найдите медианное z-положение немигрирующих ячеек по репрезентативному изображению и вычтите все z-позиции ниже этого числа из каждой тестовой лунки.
ПРИМЕЧАНИЕ: Значения миграции представлены как среднее значение медиан для каждого технического условия репликации выше высоты немигрирующих клеток. Они могут быть представлены в виде медианной высоты, как показано на рисунке 3А, или в виде кратного изменения высоты миграции для желаемого момента времени по сравнению с t = 0, как показано на рисунке 3В.
4. Метод параллельного слоистого анализа миграции сфероидов наружу (PLOSMA): культура клеток и культура висячих капель для 3D-сфероидов
ПРИМЕЧАНИЕ: Этот протокол описывает клеточную культуру и культуру висячих капель, адаптированную на основе протокола, авторами которого являются Nandi et al.14.
- Разморозьте HDF в соответствии с протоколом производителя. Проходите по мере необходимости, пока не будет достигнут желаемый проход.
- В асептическом колпаке для клеточных культур приготовьте чашку Петри, добавив 10 мл PBS на дно и перевернув крышку так, чтобы внешняя сторона располагалась на верхней части колпака для клеточных культур.
- Добавьте соответствующий объем ячеек (определяемый по количеству клеток) в микроцентрифужную пробирку. Добавьте разведенный в среде краситель для слежения за клетками. Общим объемом довести до 1 мл с помощью подогретого фильтрующего материала.
Примечание: Сфероиды должны составлять примерно 8000 клеток на сфероид, но могут меняться в зависимости от типа клеток. - Инкубировать клеточный раствор в течение 45 минут при 37 °C. Вращайте ячейки вниз в соответствии с рекомендованной производителем скоростью и аспирируйте надосадочную жидкость.
- Ресуспендируйте клетки в соотношении 1:100 метилцеллюлозы в средах.
- Пипеткой капли 20 мкл клеточного/средового раствора нанесите на крышку чашки Петри.
- Уверенно, быстро и осторожно переверните крышку и поместите ее поверх нижней половины чашки Петри, содержащей PBS.
- Инкубируйте капли не менее 24 часов.
ПРИМЕЧАНИЕ: Образование сфероидов можно контролировать с помощью светлопольной микроскопии.
5. Метод параллельного анализа миграции сфероидов наружу (PLOSMA): посев сфероидов клеток на гранулированный гидрогель
ПРИМЕЧАНИЕ: Следующий процесс кратко изложен на рисунке 4A.
- Чтобы настроить метод PLOSMA, описанный на рисунке 4A, асептически добавьте 15 мкл геля с помощью пипетки прямого вытеснения в лунки в прозрачной 96-луночной пластине.
- Используя насадку для центрифуги с вращающимся ротором, вращайте со скоростью 1000 x g в течение 10 с, чтобы разгладить гель. Переверните пластину на 180° и снова вращайте при 1000 x g в течение 10 секунд, чтобы обеспечить равномерное распределение геля по дну лунки.
- После того, как будет достигнута равномерная плоскостность, асептически сшивайте гель сверху фотосшивкой, применяя сфокусированный свет (365 нм, 33,4 мВт/см2) к образцу в течение 30 с для отжига каркаса.
- Асептически переместите чашку Петри с висящими каплями в асептический колпак для культуры тканей и заверните крышку.
- С помощью пипетки объемом 20 мкл медленно впитывайте каплю, пока сфероид не войдет в наконечник пипетки. Выбросьте каплю на строительные леса в центре колодца.
- Повторите предыдущие шаги для всех лунок. Убедитесь, что в каждой лунке есть сфероид, подтвердив это с помощью светлопольной или флуоресцентной микроскопии.
- Инкубируйте луночный планшет при температуре 37 °C в течение 2 часов, чтобы сфероиды могли прикрепиться к каркасу.
- Нанесите пипеткой еще 15 мкл геля поверх каждого сфероида. Чтобы обеспечить равномерное распределение геля, центрифугируйте планшет при давлении 300 x g в течение 15 с в каждом направлении.
- Отжиг верхнего слоя геля в течение 30 с с использованием ультрафиолетового (365 нм) света со скоростью 33,4 мВт/см2. Нанесите пипетку на верхнюю часть каждого каркаса, чтобы довести общий объем лунки до 200 μл.
ПРИМЕЧАНИЕ: На этом этапе скаффолды будут очень сухими, поэтому добавляйте среду по каплям вниз по стенке лунки, чтобы избежать отсоединения сфероида.
6. Метод параллельного анализа миграции сфероидов наружу (PLOSMA): конфокальная визуализация сфероидов
ПРИМЕЧАНИЕ: Простота визуализации зависит от системы визуализации. Расположите сфероид в скважине с низким временем воздействия. Изображения клеток проводили с помощью канала FITC (488 нм). Краситель, используемый для клеток, имел возбуждение на длине волны 492 нм и излучение на длине волны 517 нм. 10-кратное увеличение обеспечивает повышенную детализацию по сравнению с 4-кратным увеличением.
- Найдите самый низкий уровень стадии (высоту z), на котором ячейки все еще находятся в фокусе. Установите его в качестве нижнего предела z-стека.
- Найдите самый высокий уровень стадии (z-высота), на котором клетки все еще находятся в фокусе. Установите это значение в качестве верхнего предела z-стека.
ПРИМЕЧАНИЕ: Наилучшие результаты визуализации включают размер шага менее или равный 5 мкм для поддержания разрешения в масштабе клетки. В зависимости от системы конфокального микроскопа могут существовать компромиссы между скоростью визуализации и разрешением. - Изобразите все сфероиды, как описано при t = 0 и 24 ч. В зависимости от экспериментальных ограничений также может быть получена 48-часовая временная точка. Репрезентативные изображения максимальной проекции t = 0 и t = 24 показаны на рисунке 4B.
7. Метод параллельного анализа многослойной миграции сфероидов наружу (PLOSMA): анализ 3D-изображений
- Импортируйте изображения в программное обеспечение для анализа, как описано в шагах с 3.1 по 3.4. В правом верхнем углу левой панели нажмите на выпадающее меню для Channel 1 и выберите «Вычитание фона». Нажмите Ok в нижней части панели.
- Вернувшись в 3D-вид, нажмите «Автонастройка всех каналов » во всплывающем окне «Настройка дисплея» и откорректируйте по мере необходимости.
- На меньшей панели инструментов прямо над боковым меню нажмите на значок «Добавить новую систему отсчета », показанную на рисунке 5A с тремя ортогональными стрелками, чтобы добавить новую вкладку под названием «Система отсчета 1».
- Переместите начало координат к центру сфероида во всех трех плоскостях, как показано на рисунке 5B.
- На той же панели инструментов, что и три ортогональные стрелки, нажмите на иконку с оранжевыми сферами и добавьте новые пятна, чтобы создать вкладку под названием «Пятна 1». Нажмите кнопку с синей стрелкой.
- В разделе Обнаружение пятен установите Расчетный диаметр XY на расчетный диаметр ячеек. Нажмите кнопку с синей стрелкой.
ПРИМЕЧАНИЕ: Для ХДФ это число составляет 15,0 мкм. - Для пороговых значений настройте гистограмму интенсивности так, чтобы она охватывала только самые яркие части. С помощью среза перемещайтесь вверх и вниз по стеку изображений, чтобы обеспечить максимальную точность. Нажмите на синюю стрелку далее.
- Нажмите зеленую кнопку «Выполнить », чтобы завершить анализ.
- Снимите флажок «Рендеринг на срезе» или нажмите на желтый квадратный значок в правой части панели настройки.
- Перейдите на вкладку «Статистика ». В первом раскрывающемся меню выберите «Определенные значения». Во втором выпадающем меню выберите «Расстояние от исходной системы отсчета». Все значения для выбранных поверхностей будут отображены, как показано на рисунке 5C. Нажмите на значок одиночного сохранения , чтобы загрузить файл .xls.
- Сохраните изменения, внесенные в изображение и анализ, нажав значок «Сохранить » на главной панели инструментов. На рисунке 6A представлена 3D-визуализация сфероида, полученного через 24 часа, в то время как на рисунке 6B представлена функция IMARIS Spots, маркирующая ячейки распределения, с цветовой кодировкой в соответствии с расстоянием от исходной системы отсчета.
- Нормализуйте экспортируемые данные до изображений t = 0 и вычислите среднее значение пройденного расстояния ячейки и z-высоты для каждого сфероида, чтобы получить одно значение для каждого образца. На рисунках 7A, B изображены репрезентативные графики для каждого выхода, соответственно.
Результаты
Этот протокол направлен на детализацию необходимых шагов для двух новых анализов гранулярной миграции скаффолда. Метод MAMA может быть использован для оценки клеточной инфильтрации на границе раздела тканей. Гранулированные гидрогели представляют собой более сложную систему, чем объемные гидрогели, и, следовательно, по своей природе более сложны в обработке для миграции 9,20. Важно понимать пошаговый процесс, описанный на рисунке 1. Каждый шаг основывается на следующем и был оптимизирован в этом протоколе. Посев HDF с плотностью 120 000 клеток/см2 приведет к слиянию не менее 80% за ночь (Рисунок 1A), и эти нефлуоресцентные клетки лучше всего помечать клеточным красителем в день эксперимента, чтобы максимизировать потенциал визуализации (Рисунок 1B). Этот протокол соответствует более низкой центробежной силе, используемой при прохождении HDF для поддержания жизнеспособности клеток. Из-за угла, который создается для одной ступени центрифугирования, необходимо перевернуть пластину на 180°, чтобы обеспечить сдвиги геля для полного покрытия нижней поверхности лунок (Рисунок 1C). Если позволить клеткам восстановиться в инкубаторе в течение 30 минут после отжига (Рисунок 1D), это сохранит жизнеспособность клеток и приведет к оптимальной миграции (Рисунок 1E). Большая площадь 96-луночного планшета может быть визуализирована с помощью 4-кратного объектива и сопоставлена в временной точке 0-24 ч (рис. 2A, B) для широкой оценки поведения клеток. Обработка полученных изображений z-стека в аналитическом программном обеспечении обеспечивает расширенный анализ нескольких больших наборов данных в простом в использовании интерфейсе. Этот протокол обобщает шаги по созданию наборов данных для высоты ячейки или положения Z в каждой временной точке, визуализированной с помощью репрезентативных изображений на рисунке 2B, C. Анализ обработанных данных представлен на рисунке 3A, визуализирован с использованием среднего значения медианных высот и их стандартного отклонения для каждой временной точки, а высота изменения кратности от немигрирующих ячеек при t = 0 h показана на рисунке 3B. Исходные данные этого метода, как правило, ненормально распределены, поэтому медианы являются более надежными показателями для сравнения и поэтому используются для обобщения данных.
Аналогичным образом, метод PLOSMA может быть использован для оценки подвижности доставленных клеток в 3D-гранулированном гидрогелевом каркасе. На рисунке 4А показаны этапы применения метода PLOSMA, и особенно важно засеять сфероид в центре скважины. Центрирование сфероида в поле зрения рекомендуется, но зависит от возможностей микроскопа. На рисунке 4B представлены репрезентативные изображения расширения сфероида для t = 0 ч и t = 24 ч, полученные при 10-кратном увеличении в канале FITC (488 нм). В программном обеспечении можно создать исходную систему отсчета и настроить ее для каждого z-стека (рис. 5A, B). Программное обеспечение может отслеживать радиальное расстояние от этой исходной системы отсчета и экспортировать его в качестве желаемого набора данных (рисунок 5C). На рисунке 6A показано репрезентативное изображение 3D-визуализации сфероида t = 24 h, а на рисунке 6B показана функция Spots. Пример обработанных данных показан на рисунке 7. На рисунке 7A представлено среднее расстояние, пройденное от центра, нормализованное до расстояний в день 0. На рисунке 7B выделены расстояния, пройденные только в z-плоскости, поскольку именно в этом направлении и направлен метод PLOSMA.
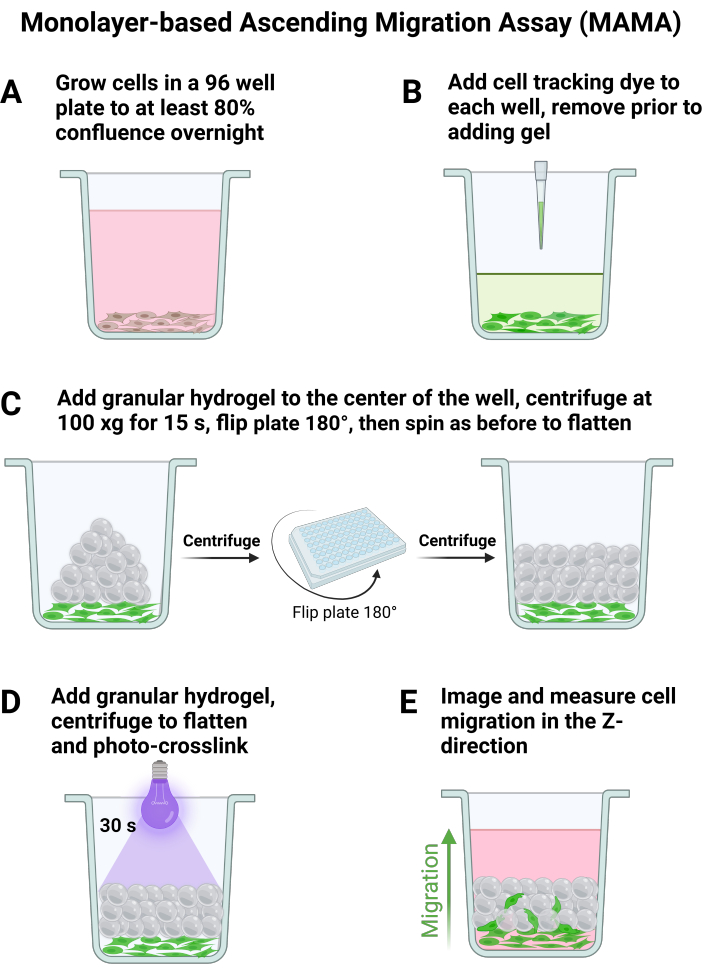
Рисунок 1: Монослойный анализ восходящей миграции и визуализация клеток. Схема основных этапов обработки клеток и гелей для MAMA. (A) Клетки выращивают до слияния в течение ночи, и (B) Краситель для отслеживания клеток добавляют непосредственно перед добавлением гранулированного геля. Каркас собирается с помощью центрифугирования с пластинами (C) и стабилизируется с помощью (D) фотосшивки. Визуализация в нескольких временных точках позволяет (E) визуализировать восходящую миграцию клеток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
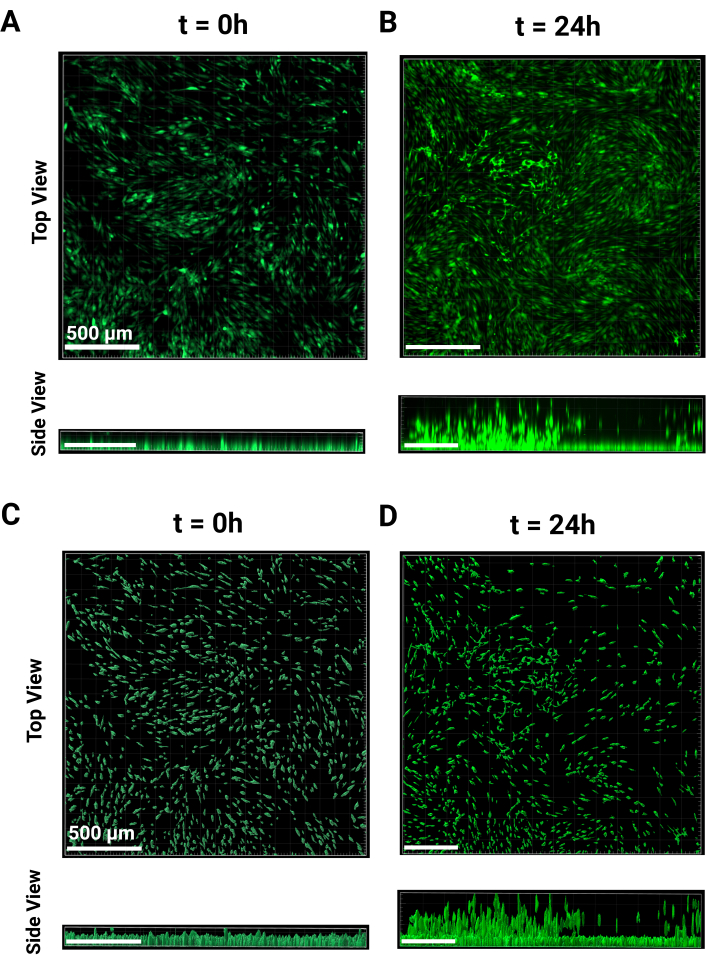
Рисунок 2: Обработка изображений МАМА. Репрезентативные изображения обработки изображений. Сравнение необработанных конфокальных изображений вида сверху и сбоку при (A) t = 0 и (B) t = 24 ч в канале FITC при 4-кратном увеличении. (B) Сравнение положения Z обработанной ячейки с видом сверху и сбоку при (C) t = 0 и (D) t = 24 ч. Обработка за 24 часа включает вычитание медианных немигрирующих z-высот. Масштабные линейки = 500 μм. Сокращения: MAMA = Monolayer-based Ascending Migration Assay. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
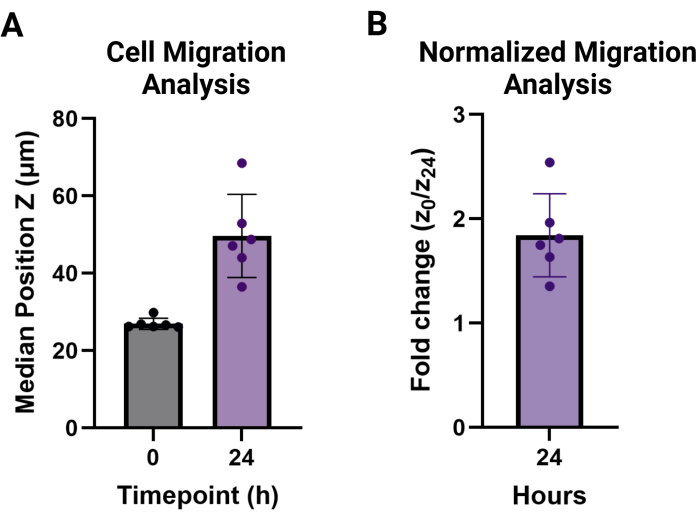
Рисунок 3: Анализ миграции клеток MAMA. (A) Медианное положение Z и стандартное отклонение высот клеток в каждой репликации (n = 6) во временных точках t = 0 (27,0 мкм ± 1,4 мкм) и t = 24 ч (46,6 мкм ± 10,8 мкм). (B) Миграция клеток через 24 ч нормализована до 0 ч и представлена как кратное изменение (1,8 ± 0,4). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
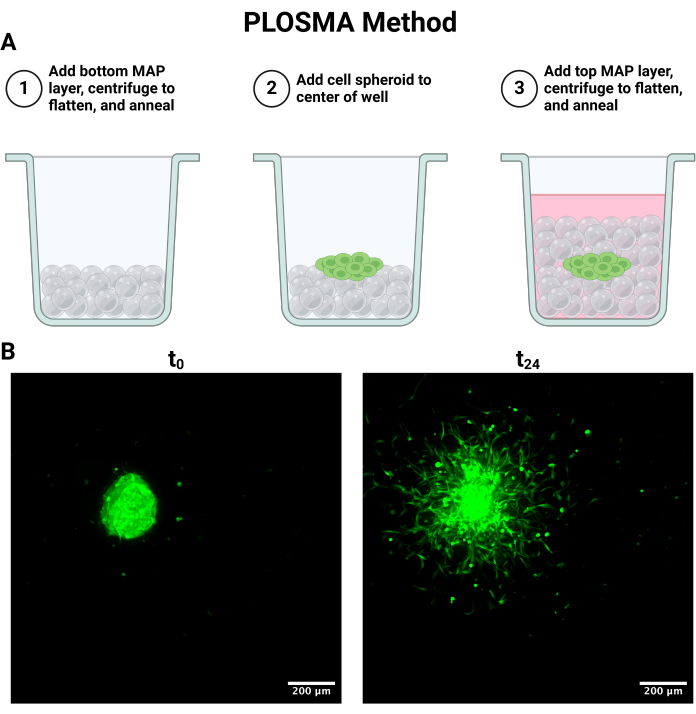
Рисунок 4: Анализ миграции сфероидов из параллельного слоя наружу (PLOSMA) и визуализация. (A) Схема, описывающая этапы наслоения скаффолда. (B) Проекции максимальной интенсивности сфероида, полученные в 0 и 24 ч. Изображения были получены с помощью конфокальной флуоресцентной микроскопии в канале FITC (488 нм) при 10-кратном увеличении. Масштабные линейки = 200 мкм. Сокращения: PLOSMA = Parallel Layer Outward Spheroid Migration Assay. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
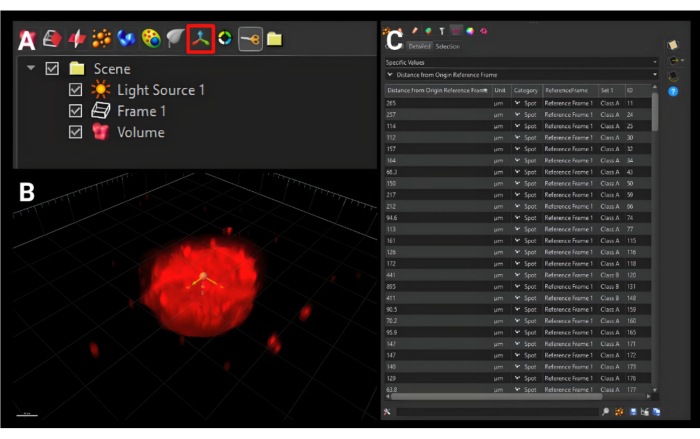
Рисунок 5: Создание новой исходной системы отсчета. (A) Кнопка новой исходной рамки отсчета обведена красным прямоугольником. (B) Новая начало координат должно находиться в центре сфероида во всех трех измерениях. (C) Отображаемые выходные метрики представляют собой расстояния между поверхностями ячеек от исходной системы отсчета, которая описывает, насколько далеко ячейки мигрировали от центра. Масштабная линейка = 120 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
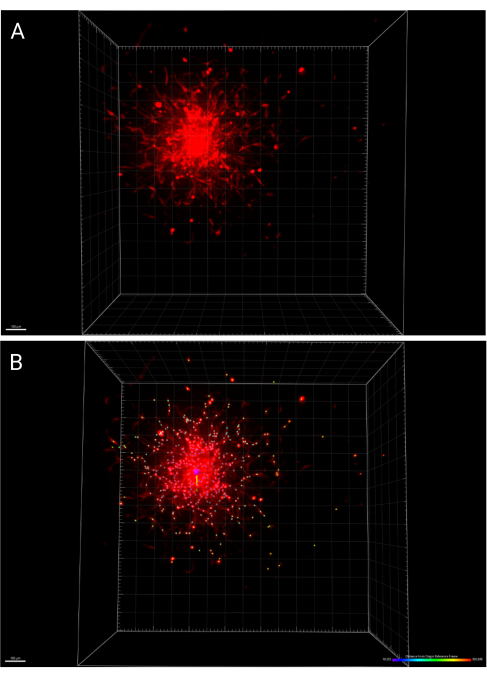
Рисунок 6: 3D-визуализация встроенного сфероида в течение 24 ч. (A) Обработанный сфероид в 3D-пространстве. (B) Центр того же сфероида был определен с помощью функции исходной системы отсчета в IMARIS, а распространение ячеек имеет цветовую кодировку по расстоянию от начала координат. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
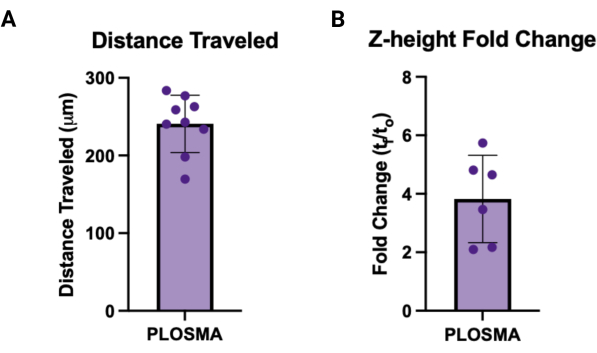
Рисунок 7: Примеры выходных данных для PLOSMA. (A) Примеры результатов PLOSMA, показывающие пройденное расстояние в μм. Среднее пройденное расстояние составило 240,8 мкм ± 36,87 мкм. (B) Z-изменение высоты сгиба (tf/t0) прорастания сфероида. Среднее изменение складки составило 3,82 ± 1,495. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Этот протокол описывает две модели in vitro для характеристики миграции клеток в 3D для заживления ран и интеграции тканей. Первая модель, основанная на анализе миграции на основе монослоев, опирается на правильно прикрепленные и сливающиеся клетки. Этот протокол был разработан с использованием типа клеток фибробластов и оптимизирован при плотности посева 1 20 000 клеток/см2. Такая плотность позволяет клеткам расти за ночь до равномерного слияния не менее 80% по всему дну луночной пластины. Этот шаг обеспечивает миграцию в направлении z в течение как минимум 24 часов; Если конфлюенция слишком мала при добавлении слоя геля, клетки могут продолжать распространяться по пластику тканевой культуры, а также внутрь геля, что приводит к неравномерной, замедленной миграции, которая наблюдалась во время оптимизации. Неравномерные высоты миграции все еще могут наблюдаться в областях с менее плотными ячейками, даже при 80% слиянии. Хорошо реплициты уменьшат шум от поведения этих клеток. Чрезмерно слитые клетки могут вызвать подъем клеток в период центрифугирования и, возможно, их гибель. Эта изменчивость устраняется путем заселения на постоянном числе ячеек и захвата согласованной области изображения, чтобы обеспечить возможность соответствующего сравнения данных. Насколько известно автору, планшетное центрифугирование для сплющивания геля не было опубликовано, но центрифугирование обычно используется для пропускания клеток и обработки биоматериала21,22. Регулировка скорости в соответствии со скоростями прохождения позволит сохранить жизнеспособность клеток для дальнейшей оптимальной обработки клеток.
Основная задача этого метода заключается в максимальном разрешении и глубине изображения при минимизации времени визуализации для обеспечения наилучшего анализа. Краситель для слежения за зелеными клетками достаточно яркий, чтобы получить изображение 96-лунки с шагом 5 мкм или менее и временем экспозиции до 1000 мс. Уменьшение времени экспозиции уменьшает количество времени, в течение которого клетки не находятся в условиях инкубации, но также снижает разрешение. Эти параметры должны быть оптимизированы для каждого конкретного микроскопа, но вариативность уменьшается за счет обеспечения того, чтобы все изображения были получены с одинаковыми настройками в рамках одного исследования.
Важным моментом для анализа AMAs является то, что он требует удаления ячеек на высоте монослоя или ниже, чтобы гарантировать, что только мигрирующие клетки рассматриваются для статистических тестов. Соответственно, медианы реплицитных лунок сообщаются из-за негауссова распределения положений ячеек после фильтрации. Сравнение между группами может быть визуализировано с помощью гистограммы, а медианы могут быть статистически проанализированы с помощью непараметрического теста.
Несмотря на эти проблемы, метод восходящей миграции на основе монослоя является, в самом простом случае, воспроизводимым анализом 3D-инфильтрации клеток пористых скаффолдов. Чтобы изучить механистические эффекты миграции клеток, убедитесь, что параметры соответствуют изучаемому типу клеток. Это может включать добавление хемотаксических или гаптотактических компонентов внутрь геля или в среду. Полноценные среды дермальных фибробластов человека включают мигрирующие хемокины, но другие типы клеток, использующие более специфические сигналы, требуют соответствующей адаптации анализа. Этот анализ подходит для тестирования нескольких типов переменных; Однако сфера их применения не охватывается настоящим Протоколом. MAMA обеспечивает физиологически значимую среду, аналогичную перемещению клеток из объемной ткани во введенный пористый гидрогель in vivo.
Для метода PLOSMA размещение сфероидов в центре каркаса имеет решающее значение для успешной визуализации и значимой миграции клеток в трех измерениях. Точное затравливание сфероида в центр геля зависит от пользователя. С этой целью стабилизация пипетки на цилиндре с помощью недоминирующей руки пользователя способствует центрированию, а эффективность положения посева может быть подтверждена с помощью светлой или флуоресцентной микроскопии. Смещенный от центра сфероид может быть исправлен второй попыткой с помощью нового сфероида, либо на том же каркасе, либо на новом скаффоде. По этой причине авторы рекомендуют создавать больше сфероидов, чем необходимо, и готовить больше геля MAP, чем необходимо.
Этап центрифугирования второго слоя гарантирует, что сфероид (1) равномерно покрыт гелем и (2) способен равномерно распространяться вверх и вниз внутрь геля, что имеет решающее значение для изучения доставленных клеток. Центрифугирование также может привести к смещению сфероида от центра к краям лунки, и хотя этот протокол ограничивает это явление, оптимизируя этапы центрифугирования и объем геля, используемого для каждого слоя (15 μл) для равномерного распределения, он не устраняет его движение полностью. Точную скорость центрифугирования и время, необходимые для уменьшения смещения сфероида, может потребоваться отрегулировать в соответствии с моделью центрифуги; Тем не менее, спецификация, описанная в этом протоколе, может быть использована в качестве эталона для индивидуальной оптимизации. Другой подход заключается в том, чтобы дать сфероидам 2 часа инкубационного времени прикрепиться к каркасу перед добавлением второго слоя геля. Смещение сфероида особенно хорошо смягчается при реализации обеих стратегий. Наконец, из-за многоступенчатого процесса центрифугирования этот метод может не подходить для менее выносливых клеточных линий.
Помимо логистики нанесения покрытий на сфероиды методом PLOSMA, существуют ограничения при получении изображений. Сфероид может быть изображен с использованием 4-кратного или 10-кратного увеличения, но для достижения наилучших результатов используйте как минимум 10-кратное увеличение и уменьшите размер шага z-стеков до 2-5 мкм. Увеличение должно быть постоянным на протяжении всего исследования. Время визуализации увеличивается с более высоким разрешением, поэтому ограничьте количество образцов в каждой луночной пластине (4-8 лунок на пластину), чтобы свести к минимуму время вне инкубатора. Настройка визуализации в реальном времени также может улучшить отслеживание и предоставить более полную аналитику.
Поскольку гранулированные гидрогели обладают уникальной топологией и конструктивными параметрами, которые включают в себя собственный объем, пористость, механическую прочность и, в некоторых случаях, биологическую активность, необходимо изучать поведение клеток в связи с этими аспектами с максимально возможной точностью. Метод PLOSMA предназначен для моделирования движения клеток после доставки или после того, как клетки полностью вошли в гранулированный гель. Поскольку клетки вынуждены мигрировать через поры, присущие гранулярной геометрии гидрогеля, метод PLOSMA эффективно изолирует пористость как фактор, влияющий на поведение клеток. Потенциальными областями применения этого анализа являются доставка клеток in situ и интеграция тканей в гранулярном каркасе, особенно в области заживления ран23.
Оба протокола были разработаны с использованием первичных дермальных фибробластов человека из-за роли миграции фибробластов в восстановлении и ремоделировании тканей 4,24, однако миграционное поведение любых адгезивных клеток может быть измерено в ответ на изменение пористого каркаса, включая добавление факторов роста и поверхностный/объемный состав геля. Эти изменения могут потребовать адаптации этих анализов для достижения заметных результатов. К параметрам, требующим дальнейшей оптимизации, относятся плотность посева клеток, продолжительность эксперимента и/или конвейер анализа. IMARIS — это мощный инструмент анализа изображений, который используется для анализа миграции клеток и обладает возможностями, выходящими за рамки описанных здесь, которые включают в себя классификацию всех объектов в пределах выбранной «поверхности» на наборы на основе различных свойств, таких как площадь поверхности, объем, интенсивность и расстояние от других созданных поверхностей. В интернете существует множество ресурсов для определения дальнейших методов анализа.
Два метода, описанные здесь, рассматривают не только начальное состояние введения ткани в гранулированный материал физиологическим способом, но и последующую реакцию клеток при полном внедрении в материал. Как и во всех анализах миграции, присутствующие клетки способны к пролиферации параллельно движению, однако дизайн описанных анализов не нарушает пролиферацию и, таким образом, не оказывает чрезмерного влияния на анализ. Оба метода совместимы с окрашиванием конечных точек в дополнение к продольной визуализации, которая использует фиксацию PFA для обнаружения таких показателей, как цитоскелет, отложение коллагена, пролиферация и многое другое. Использование описанных методов позволяет получить более точное пространственно-временное представление 3D-миграции клеток, в котором инфильтрация клеток используется в качестве измеряемого параметра, в отличие от предыдущих методов 1,6,14,15,25,26,27.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Финансирование этой работы было частично поддержано за счет премии Национального института здравоохранения США High Priority, Short-Term Project Award (1R56DK126020-01) и благотворительного подарка от Kurtin Trust. J.T. был профинансирован стипендией Национального научного фонда для аспирантов. Схемы фигур, созданные с помощью BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 Phalloidin | ThermoFisher | A22287 | |
| Bovine Serum Albumin | VWR International | 332 | |
| CellTracker Green CMFDS Dye, 1 mg | ThermoFisher | C2925 | 20 x 50 ug units, 492/517 nm |
| Centrifuge | ThermoFisher | 75016085 | ST Plus Series |
| Clear 96 well plate | MilliPore Sigma | CLS3997-50EA | |
| Dimethyl Sulfoxide | Fisher Scientific | MT-25950CQC | 250 mL |
| Fibroblast Basal Medium | ATCC | PCS-201-030 | 480 mL, phenol-red-free |
| Fibroblast Growth Kit - Low Serum | ATCC | PCS-201-041 | 7.5 mM L-glut,5 ng/mL rh FGF basic, 5 ug/mL rh Insulin, 1 ug/mL Hydrocortisone, 50 ug/mL Ascorbic acid, 2% FBS |
| FIJI (ImageJ) | NIH | Public access download | |
| Human Dermal Fibroblasts | ATCC | PCS-201-012 | Adult human dermal fibroblasts |
| ImageXpress Micro Confocal | Molecular Devices | Spinning Disc confocal microscope with 4x, 10x magnifications | |
| IMARIS | Oxford Instruments | 3/4D Imaged Visualizaiton and Analysis Software, Proprietary | |
| Incubator | ThermoFisher | Finnpipette F2 Variable volume Pipettes | HeraCell Vios 160i CO2 Incubator, 165L |
| M-20 Microplate Swinging Bucket Rotor | ThermoFisher | 75003624 | |
| Methylcellulose | Fisher Scientific | 9004-67-5 | Lab grade, powder form |
| Microcentrifuge tube | Fisherbrand | 05-408-129 | 1.5 mL microcentrifuge tubes |
| Paraformaldehyde (4%) | Alfa Aesar | AAJ19943K2 | For fixing |
| Petri dish | Corning | 08-757-100A | Bacteriological Petri Dishes with Lid 35 x 10 mm |
| Pipettes | ThermoFisher | 4642080 | Finnpipette F2 Variable volume Pipettes |
| Sterile PBS | Gibco | 10010-023 | |
| Triton-X | Fisher Scientific | 327371000 |
Ссылки
- Jerka, D., et al. Unraveling endothelial cell migration: Insights into fundamental forces, inflammation, biomaterial applications, and tissue regeneration strategies. ACS Appl Bio Mater. 7 (4), 2054-2069 (2024).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay Drug Dev Technol. 12 (4), 207-218 (2014).
- Yamada, K. M., Sixt, M. Mechanisms of 3D cell migration. Nat Rev Mol Cell Biol. 20 (12), 738-752 (2019).
- Grinnell, F. Fibroblast biology in three-dimensional collagen matrices. Trends Cell Biol. 13 (5), 264-269 (2003).
- Kloxin, A. M., Kloxin, C. J., Bowman, C. N., Anseth, K. S. Mechanical properties of cellularly responsive hydrogels and their experimental determination. Adv Mater. 22 (31), 3484-3494 (2010).
- Solbu, A. A., et al. Assessing cell migration in hydrogels: An overview of relevant materials and methods. Mater Today Bio. 18, 100537 (2023).
- Madl, C. M., Katz, L. M., Heilshorn, S. C. Tuning bulk hydrogel degradation by simultaneous control of proteolytic cleavage kinetics and hydrogel network architecture. ACS Macro Lett. 7 (11), 1302-1307 (2018).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nat Rev Mater. 5 (1), 20-43 (2020).
- Qazi, T. H., Burdick, J. A. Granular hydrogels for endogenous tissue repair. Biomater Biosyst. 1, 100008 (2021).
- Tanner, G. I., Schiltz, L., Narra, N., Figueiredo, M. L., Qazi, T. H. Granular hydrogels improve myogenic invasion and repair after volumetric muscle loss. Adv Healthc Mater. 25, e2303576 (2024).
- Sussman, E. M., Halpin, M. C., Muster, J., Moon, R. T., Ratner, B. D. Porous implants modulate healing and induce shifts in local macrophage polarization in the foreign body reaction. Ann Biomed Eng. 42 (7), 1508-1516 (2014).
- Roosa, C. A., et al. Conjugation of IL-33 to microporous annealed particle scaffolds enhances type 2-like immune responses in vitro and in vivo. Adv Healthc Mater. 13 (25), 2400249 (2024).
- Jaberi, A., et al. Engineering microgel packing to tailor the physical and biological properties of gelatin methacryloyl granular hydrogel scaffolds. Adv Healthc Mater. 13 (25), 2402489 (2024).
- Nandi, S., Brown, A. C. Characterizing cell migration within three-dimensional in vitro wound environments. J Vis Exp. 126, e56099 (2017).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Adv Mater. 34 (12), 2109194 (2022).
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nat Mater. 14 (7), 737-744 (2015).
- Pruett, L. J., Jenkins, C. H., Singh, N. S., Catallo, K. J., Griffin, D. R. Heparin microislands in microporous annealed particle scaffolds for accelerated diabetic wound healing. Adv Funct Mater. 31 (35), 2104337 (2021).
- Roosa, C., et al. Microfluidic synthesis of microgel building blocks for microporous annealed particle scaffold. J Vis Exp. (184), e64119 (2022).
- Pfaff, B. N., et al. Selective and improved photoannealing of microporous annealed particle (MAP) scaffolds. ACS Biomater Sci Eng. 7 (2), 422-427 (2021).
- Riley, L., Schirmer, L., Segura, T. Granular hydrogels: Emergent properties of jammed hydrogel microparticles and their applications in tissue repair and regeneration. Curr Opin Biotechnol. 60, 1-8 (2019).
- Jo, C. H., Roh, Y. H., Kim, J. E., Shin, S., Yoon, K. S. Optimizing platelet-rich plasma gel formation by varying time and gravitational forces during centrifugation. J Oral Implantol. 39 (5), 525-532 (2013).
- Mironov, V., et al. Fabrication of tubular tissue constructs by centrifugal casting of cells suspended in an in situ. crosslinkable hyaluronan-gelatin hydrogel. Biomaterials. 26 (36), 7628-7635 (2005).
- Vu, L. T., Jain, G., Veres, B. D., Rajagopalan, P. Cell migration on planar and three-dimensional matrices: A hydrogel-based perspective. Tissue Eng Part B Rev. 21 (1), 67-74 (2015).
- Cialdai, F., Risaliti, C., Monici, M. Role of fibroblasts in wound healing and tissue remodeling on Earth and in space. Front Bioeng Biotechnol. 10, 958381 (2022).
- Qazi, T. H., Muir, V. G., Burdick, J. A. Methods to characterize granular hydrogel rheological properties, porosity, and cell invasion. ACS Biomater Sci Eng. 8 (4), 1427-1442 (2022).
- Shaik, R., et al. Cardiac matrix-derived granular hydrogel enhances cell function in 3D culture. ACS Appl Mater Interfaces. 16 (43), 58346-58356 (2024).
- Puiggalí-Jou, A., Asadikorayem, M., Maniura-Weber, K., Zenobi-Wong, M. Growth factor-loaded sulfated microislands in granular hydrogels promote hMSCs migration and chondrogenic differentiation. Acta Biomater. 166, 69-84 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены