Method Article
כימות נדידת תאים תלת מימדית בתוך ובתוך ביו-חומרים הידרוג'ל גרגירים
In This Article
Summary
פרוטוקול להערכה כמותית של נדידת תאים תלת מימדיים בתוך ולתוך הממשק של הידרוג'לים גרגירים מוצג כאן.
Abstract
פיגומי הידרוג'ל גרגירים מחזיקים בפוטנציאל משמעותי ברפואה רגנרטיבית, ומתפקדים כנשאים להעברת תאים או כממשקים לשילוב רקמות. מאמר זה מציג שתי גישות חדשות לכימות נדידת תאים בתוך ולתוך הידרוג'לים גרגירים, תוך הדגשת היישומים המובהקים של פיגומים אלה. ראשית, מוצגת בדיקת ממשק חד-שכבתי של תא המדמה צמיחת רקמות להידרוג'לים גרגירים למטרות אינטגרציה. שנית, מתוארת בדיקה מבוססת ספרואיד, שנועדה לעקוב אחר תנועת התאים בתוך מטריצת ההידרוג'ל, המתאימה במיוחד ליישומים הכוללים העברת תאים. שתי השיטות מאפשרות מדידות מדויקות ומבוקרות של נדידת תאים, ומספקות ערכת כלים מקיפה לחוקרים המשתמשים בפיגומי הידרוג'ל גרגירים. המוטיבציה לשיטות אלו נובעת מהצורך בשליטה מותאמת על נדידת התאים בתוך הפיגום כדי ליישר קו עם יישומים ספציפיים. על ידי אופטימיזציה וסטנדרטיזציה של טכניקות כימות אלה, חוקרים יכולים לחדד באופן איטרטיבי את תכונות ההידרוג'ל הגרגירי, ולהבטיח את יעילותן בהקשרים מגוונים של רפואה רגנרטיבית. סט חזק זה של כלים כמותיים מציע הזדמנויות חדשות לשיפור פיגומי הידרוג'ל גרגירים, ולקדם את השימוש בהם הן ביישומי העברת תאים והן ביישומי שילוב רקמות.
Introduction
ביו-חומרים ליישומים טיפוליים מתפתחים יותר ויותר לעבר מודלים מורכבים ורלוונטיים יותר של סביבות תאים לחקר אינטגרציה של רקמות. פיגומים ביו-חומריים מספקים מבנה תלת מימדי (תלת מימד) לצמיחת תאים ומטרתם לחקות רקמה רצויה 1,2. מודלים של תרביות תאים תלת מימדיות כוללים מטריצות טבעיות ופיגומים סינתטיים המספקים לתאים מורכבות נוספת באמצעות רמזים הפטוטקטיים או כימוטקטיים 3,4. פיגומי הידרוג'ל מסורתיים מקושרים בתפזורת, ומניבים רשת ננו-נקבובית המאפשרת דיפוזיה של מולקולות קטנות 5,6, אך דורשת פירוק לצורך נדידה בקנה מידה של תאים לאזור רקמה הזקוק לתיקון7. הידרוג'לים גרגירים הם תת-קבוצה של ביו-חומרים בעלי פוטנציאל גבוה לתרגום קליני בשל התאימות הביולוגית שלהם, יכולתם להתאים לצורות לא סדירות, ובמקרים רבים, יכולת ההזרקה שלהם 8,9. אופי אבני הבניין שלהם מספק את היתרון של נקבוביות בקנה מידה של תאים לשיפור חדירת רקמות ואנגיוגנזה כמו גם מודולריות, המאפשרת הוספת רמזים הטרוגניים להתנהגות התא 10,11,12. הבנת תגובת התא ותנועתו בתוך פיגום תלת מימד חיונית לרלוונטיות פיזיולוגית בכל היישומים המשתמשים בביו-חומרים לשילוב רקמות.
עם זאת, חקר צמיחת רקמות בתלת מימד הוכח כקשה להשגה בדיוק כמותי. המורכבות המורחבת של סביבה תלת מימדית דורשת מודלים במבחנה של נדידת תאים שיכולים לא רק לספק תובנה לגבי התנהגות התא אלא גם אופטימיזציה של מצב החומר. דיווחים שפורסמו בעבר על נדידת תאי פיגום גרגירי תלת מימדיים השתמשו בזריעה מקומית כדי לחקור את התנהגות התאים, ודיווחו על חדירה למבנה הנקבובי ולמורפולוגיה של התא13 ואחרים הנבטים כדוריים 14,15, ומדדו את אורך הצמיחה ומספר הנבטים. אורכי נדידת זריעה מקומיים עשויים להיות מושפעים באופן לא אחיד מכוחות הכבידה, ובשל מגבלות המיקרוסקופיה, התוצאות אינן יכולות להיות אורכיות. שיטת הנבטת הספרואידים הוגבלה לכימות דו-ממדי באמצעות הקרנה מקסימלית, שאינה מסוגלת ללכוד את מנגנון הפלישה המבוקרת. שתי השיטות נמדדות במישור xy, שחסר את הניואנסים הדרושים כדי לסכם באופן מלא את התנועה התאית התלת-ממדית וחדירת הפיגומים.
פרוטוקול זה מתאר שתי גישות לכימות נדידת תאים, כגון חדירה חוץ גופית לפיגומי ההידרוג'ל הגרגיריים התלת-ממדיים הנקבוביים, במיוחד באמצעות פיגומי חלקיקים מיקרו-נקבוביים (MAP) 16,17,18,19. מטרת השיטות הבאות היא לחקור את התנהגות התאים בג'לים גרגירים על ידי שליטה בכיווניות נדידתם לניתוח תלת מימדי. הגישה הראשונה, בדיקת הגירה עולה מבוססת חד-שכבתית (MAMA), היא מודל פשוט של אינטגרציה תאית אנדוגנית הממחיש אינטראקציות אחידות בין תא לחומר ומשמש כפלטפורמה לייצוג הסביבה הראשונית שבה תאים מתממשקים עם הידרוג'לים גרגירים וכן לבידוד התנהגות אינדיבידואלית לפני חדירת הפיגום. השנייה, הנקראת בדיקת הגירה ספרואידית מקבילה שכבתית החוצה (PLOSMA), היא בדיקת נדידת ספרואידים תלת מימדית, החוקרת את תנועת התאים כאשר הם מוקפים לחלוטין בסביבת פיגום מורכבת ומדגמת את תנועת התאים לאחר המסירה, כמו גם תנועה לאחר שהתאים נכנסו לג'ל גרגירי במלואו.
שתי השיטות ניתנות לכימות על ידי ניתוח תמונה תלת מימדית וניתן ליישם אותן ללימוד ואופטימיזציה של אינטראקציות חומר-תא באמצעות נקודות זמן אורכיות ליישומי רפואה רגנרטיבית והנדסת רקמות, כאשר קידום או הגבלה של תנועת התאים הוא בקריטריונים של התכנון. בנוסף, שיטות אלו מנצלות את צנטריפוגת הצלחות להכנה אחידה של בדיקות מרובות בארות.
Protocol
פרטי הריאגנטים והציוד המשמש במחקר מפורטים בטבלת החומרים.
1. הכנת הידרוג'ל גרגירי
הערה: חלקיקי MAP המשמשים בפרוטוקול זה הם 3.2% משקל/מ"ל ג'ל עם 45.88 מ"ג/מ"ל peg-mal (10 kDa), 0.82 מ"ג/מ"ל RGD, 8.06 מ"ג/מ"ל MethMal19 ו-5.62 מ"ג/מ"ל MMP-2 מתכלה. הנוקשות המכנית של הג'ל היא 15-20 kPa כדי להתאים לנוקשות העור17.
- צור חלקיקי הידרוג'ל גרגירים והתכונן לתרבית תאים כרגיל.
הערה: פרוטוקול זה מתאר את ההכנה הסטרילית של ג'ל חלקיקים מחוסל מיקרופורוס, שייצורו מפורט על ידי Roosa et al.18. - הכן את חלקיקי ההידרוג'ל הגרגירים לשימוש במבחנה על ידי עיקור בשלוש שטיפות של 70% אלכוהול איזופרופיל ואחריו שלוש שטיפות של 1x PBS סטרילי.
- הכן ליתיום פניל-2,4,6-טרימתיל-בנזויל פוספינאט (LAP) סטרילי של 0.2 מ"מ בתמיסת מדיה על ידי המסת אבקת LAP במים טהורים במיוחד והעברת התמיסה דרך מסנן סטרילי של 0.22 מיקרומטר. הוסף תמיסה זו 1:1 v/v עם כמות הג'ל הדרושה לביצוע הניסוי.
- דגרו את תמיסת ה-LAP, הג'ל והמדיה של 0.2 מ"מ ב-37 מעלות צלזיוס על מסובב צינור ב-20 סל"ד למשך 30 דקות לפחות לפני שתמשיכו כדי לאפשר דיפוזיה של LAP בכל המיקרו-חלקיקים.
- לאחר שחלפו 30 דקות, צנטריפוגה את תרחיף החלקיקים ב-18,000 x גרם למשך 5 דקות ב-25 מעלות צלזיוס. שאפו את הסופרנטנט.
הערה: היובש הכולל של חלקיקי MAP יכול להשתנות עקב הבדלים בכימיה, הידרופיליות וגודל החלקיקים. לצורך עקביות, מומלץ לצנטריפוגה את מתלה החלקיקים כמתואר, לערבב את החלקיקים בצינור באמצעות פיפטה תזוזה חיובית ואז לחזור על שלב הצנטריפוגה.
2. שיטת בדיקת הגירה עולה מבוססת חד-שכבתית (MAMA): תרבית תאים והדמיה
הערה: התאים צולמו באמצעות ערוץ FITC (488 ננומטר). לצבע ששימש לתאים היה עירור ב-492 ננומטר ופליטה ב-517 ננומטר. הגדלה של 10x מספקת פירוט מוגבר על פני הגדלה פי 4, אך ניתן להשתמש בכל אחד מהם.
- הפשירו פיברובלסטים עוריים אנושיים (HDF) על פי פרוטוקול היצרן. מעבר לפי הצורך עד להשגת המעבר הרצוי; בדרך כלל, תאים ראשוניים שומרים על הרכב גנטי ופנוטיפי באמצעות P5.
- צלחת 120,000 תאים/ס"מ2 עבור לפחות n = 6 בצלחת של 96 בארות או בגודל צלחת רצוי תוך שימוש בנפח המדיה המומלץ לבאר לתלייה, שאיפה עדינה לפני כל הוספה. תנו לתאים להיצמד למשך הלילה, כפי שמוצג באיור 1A, מה שיביא לכ-80% מפגש למחרת.
הערה: בדרך כלל, בארות עמודה מרכזית ושורה הן הטובות ביותר לפיזור ג'ל אופטימלי. המחברים משתמשים בעד 24 בארות לצלחת של 96 בארות (שורות B-G ועמודות 5-8). - הכן תנאי ג'ל כאמור לעיל, ותוך כדי דגירה ב- LAP, הסר את המדיה בעזרת שואב או פיפטה מצלחת הבאר של התאים. היזהר לא להפריע לתחתית הצלחת.
- הוסף צבע מעקב תאים לבארות בהתאם להוראות היצרן, המיוצגות באיור 1B. ודא שהג'ל מוכן לחלוטין כמתואר בשלב 1 לפני שאיבת צבע מעקב אחר תאים מבארות.
- הוסף 20 מיקרוליטר מכל מצב ג'ל לבארות עם פיפטה תזוזה חיובית מבלי לגעת בתחתית הצלחת.
הערה: תנאי הבדיקה הטובים ביותר מתרחשים כאשר הג'ל מוזרם ישירות למרכז הבאר. - בעזרת חיבור צנטריפוגה רוטור מסתובב ב-25 מעלות צלזיוס, סובב ב-100 x גרם למשך 15 שניות עם תאוצה והאטה של 8 כדי לשטח את הג'ל. הפוך את הצלחת ב-180 מעלות וסובב שוב ב-100 x גרם למשך 15 שניות כדי להבטיח פיזור ג'ל אחיד על פני קרקעית הבאר, כפי שניתן לראות באיור 1C.
- קישור צולב אספטי של הג'ל מלמעלה (איור 1D) על ידי החלת אור ממוקד (365 ננומטר, 34.4 mW/cm2) על הדגימה למשך 30 שניות כדי לחשל את הפיגום, ולהוסיף 200 מיקרוליטר של מדיה לכל באר תאים לאחר היווצרות כל הפיגומים. הניחו לתאים לדגור בטמפרטורה של 37 מעלות צלזיוס למשך 30 דקות כדי לאפשר להם להיצמד לפיגום הגרגירי לפני ההדמיה.
- כדי ללכוד התנהגות הגירה המסוכמת באיור 1E, דמו תאים באמצעות מיקרוסקופ קונפוקלי. מצא את נקודת המיקוד הנמוכה ביותר עבור אזור בלוח שבו התאים מתכנסים לפחות 80% והגדר אותה כקצה התחתון של מחסנית ה-z.
- מצא את הנקודה הגבוהה ביותר של אות הפלואורסצנט של התא והגדר אותה כקצה העליון של ערימת ה-z. השתמש בגודל צעד של 5 מיקרומטר או קטן יותר לקבלת הרזולוציה הטובה ביותר.
- דמיין לפחות שלוש בארות כדי לייצג את התא החד-שכבתי ואת גובה התא הלא נודד. נקודת הזמן t = 0 מוצגת הן מהתצוגה העליונה והן מהצד באיור 2A. דגירה למשך הלילה לאחר השלמת ההדמיה.
הערה: תאים אלה צולמו עם מטרה של פי 4, והחשיפה נשמרה עקבית עבור כל הבארות. - ב- t = 24 שעות, תאים יתחילו לעלות דרך הפיגום הגרגירי, כפי שניתן לראות באיור 2B ממבט למעלה ומהצד. חזור על שלבי ההדמיה כפי שבוצעו עבור t = 0 שעות באמצעות אותם פרמטרים. השתמש בגובה הקודם של השלב כהפניה או מצא תאים שעדיין לא עברו והגדר אותו כקצה התחתון של מחסנית ה-z.
- חזור על השלבים עבור כל הבארות, וודא שכל באר נשמרת כתמונה נפרדת כדי להקל על הניתוח.
הערה: ניתן לצלם נקודות זמן לנקודות זמן ארוכות יותר בהתאם לאילוצי הניסוי ולשיטת הקרינה למעקב אחר תאים. - פיגומים עשויים להיות קבועים ומוכתמים למדדים נוספים. בנקודת הזמן הסופית הרצויה, שאפו את המדיה מבארות בעזרת פיפטה והשליכו. שוטפים בעדינות כל באר עם 200 מיקרוליטר PBS סטרילי פעמיים למשך 5 דקות כל אחת. הוסף 200 מיקרוליטר של 4% פרפורמלדהיד (PFA) למשך 20 דקות, ולאחר מכן שאב והשליך. ניתן לצבוע בארות באופן מיידי או לאחסן בטמפרטורה של 4 מעלות צלזיוס ב-1x PBS עד שבוע.
3. שיטת בדיקת הגירה עולה מבוססת חד-שכבתית (MAMA): ניתוח תמונה תלת מימדית
- להמרות אצווה, פתח את תוכנת המרת התמונות של IMARIS. גרור ושחרר את תמונות המיקרוסקופיה לתוכנת ההמרה ובחר תיקיה בתוך התוכנה Arena לייבוא. לחץ על התחל הכל. התמונות שהומרו יופיעו בזירה כקבצי .ims.
הערה: אם גודל הווקסל אינו כלול במטא נתונים של התמונה, עיין במפרטי הדמיה קונפוקלית בודדים כדי למצוא את הערך. לחלופין, ניתן להעריך את גודל הווקסל כגודל הצעד המשמש במהלך ההדמיה. - פתח את התוכנה על ידי לחיצה כפולה על סמל שולחן העבודה של IMARIS Arena ובחירת תמונה מהזירה.
- התמונה נטענת אוטומטית ללשונית הניתוח 'תצוגה תלת-ממדית' המוצגת בחלונית סמל סרגל הכלים בחלק העליון. לחץ על הכרטיסייה Image Proc בסרגל הכלים הראשי.
- בפינה השמאלית העליונה של החלונית הצדדית, לחץ על התפריט הנפתח של ערוץ 1 ובחר חיסור ברקע. לחץ על Ok בתחתית החלונית כדי לחזור ל-'3D View'. תמונות מייצגות עבור t = 0 h ו- t = 24 שעות נמצאות באיור 2A,B, בהתאמה.
- בסרגל הכלים הקטן ממש מעל תפריט החלונית הצדדית, לחץ על הסמל עם הצורות הכחולות המעוגלות, הוסף משטחים חדשים, כדי ליצור כרטיסיית אובייקטים הניתנים לעריכה בשם 'משטחים 1'.
- ממשק להגדרות אלגוריתם של פרמטרים ליצירה ייפתח בתחתית לוח התפריטים. צור באופן ידני את הפרמטרים לשימוש עבור כל השכפולים על ידי לחיצה על לחצן החץ הכחול בתחתית הממשק. ודא שערוץ המקור הנכון נבחר וסמן את התיבה 'חלק'.
- הגדר את פרטי פני השטח ל- 0.7 מיקרומטר ובחר חיסור רקע (ניגודיות מקומית). הקלד את אורך התא הממוצע בתיבה 'קוטר הכדור הגדול ביותר המתאים לאובייקט'. לחץ על אותו חץ כחול בתחתית בסיום.
הערה: ניתן להעריך ערך זה באמצעות הכרטיסייה 'פרוסה' בסרגל הכלים ומדידת רוחב התאים הממוצעים.
- הגדר את פרטי פני השטח ל- 0.7 מיקרומטר ובחר חיסור רקע (ניגודיות מקומית). הקלד את אורך התא הממוצע בתיבה 'קוטר הכדור הגדול ביותר המתאים לאובייקט'. לחץ על אותו חץ כחול בתחתית בסיום.
- לצורך קביעת סף, קבע את היסטוגרמת העוצמה שבה רק התאים הבהירים ביותר מפולחים. בעזרת כלי הפריסה, עברו למעלה ולמטה בערימת התמונות כדי לוודא שהיא מדויקת ככל האפשר.
- בחר Enable עבור 'Split touching objects (Region Growing)' והגדר את קוטר נקודות הזרעים לאותו קוטר שנעשה בו שימוש קודם לכן. ודא שהסף 'מבוסס עוצמה' נבחר ולחץ על לחצן החץ הכחול ימינה.
- ניתן לכוונן את שני השלבים הבאים, נקודות זרע סינון ומשטחי סינון, על ידי מספר מדידות כדי להבטיח שהמשטחים שנוצרו מדויקים; עם זאת, ניתוח בסיסי אינו דורש סינון נוסף. כאשר אין צורך בשינוי, לחץ על כפתור החץ הכחול .
הערה: השלב האחרון מאפשר סיווג נוסף של המשטח בהתאם לתפוקה הרצויה. לאחר ביצוע שינויי עריכה, לחץ על לחצן החץ הירוק כדי לסיים את יצירת המשטחים. - כדי לשמור את פרמטרי היצירה לניתוח אצווה, לחץ על סמל השרביט יצירה. לחץ על אחסן פרמטרים עבור אצווה ותן לו שם, ולאחר מכן לחץ על אישור. תמונות מעובדות מייצגות עבור t = 0 ו- t = 24 שעות מוצגות באיורים 2C,D, בהתאמה.
הערה: ניתן לסווג את כל האובייקטים בתוך 'משטח' שנבחר לקבוצות על סמך מאפיינים שונים שניתנו על ידי תוכנת המרת התמונה, כגון שטח פנים, נפח, עוצמה ומרחק ממשטחים אחרים שנוצרו. - מאפייני פני השטח נמצאים על-ידי בחירה בכרטיסיה סטטיסטיקה. כדי לאסוף את כל גבהי התאים, לחץ על הכרטיסייה מפורט ובחר ערכים ספציפיים ומיקום Z מהתפריטים הנפתחים העוקבים. לחץ על סמל השמירה היחיד כדי לשמור את כל מיקומי ה-z וכל הסיווגים שבוצעו לקובץ .xls. חזור על הפעולה עבור כל התמונות.
- מצא את מיקום ה-z החציוני של תאים שאינם נודדים מהתמונה המייצגת והחסר את כל מיקומי ה-z מתחת למספר זה מכל תנאי בדיקה היטב.
הערה: ערכי העברה מדווחים כאמצעי החציונים עבור כל מצב שכפול טכני מעל גובה התא שאינו נודד. ניתן לדווח עליהם כגובה חציוני, הנראה באיור 3A, או כשינוי קיפול בגובה הנדידה עבור נקודת הזמן הרצויה בהשוואה ל-t = 0, כפי שניתן לראות באיור 3B.
4. שיטת הגירה של ספרואידים שכבתיים מקבילים החוצה (PLOSMA): תרבית תאים ותרבית טיפות תלויות עבור ספרואידים תלת מימדיים
הערה: פרוטוקול זה מתאר תרבית תאים ותרבית טיפה תלויה המותאמת מהפרוטוקול שנכתב על ידי Nandi et al.14.
- הפשירו HDF לפי פרוטוקול היצרן. מעבר לפי הצורך עד להשגת המעבר הרצוי.
- במכסה המנוע של תרבית תאים אספטית, הכינו צלחת פטרי על ידי הוספת 10 מ"ל PBS לתחתית והפיכת המכסה כך שהחלק החיצוני מונח על מכסה המנוע של תרבית התאים.
- הוסף את נפח התאים המתאים (נקבע מספירת התאים) לצינור מיקרוצנטריפוגה. הוסף צבע מעקב תאים מדולל במדיה. הביאו את הנפח הכולל ל-1 מ"ל עם מדיה מחוממת.
הערה: ספרואידים צריכים להיות בערך 8000 תאים לספרואיד אך עשויים להשתנות בהתאם לסוג התא. - דגרו את תמיסת התא למשך 45 דקות בטמפרטורה של 37 מעלות צלזיוס. סובב את התאים כלפי מטה בהתאם למהירות המומלצת של היצרן ושאף את הסופרנטנט.
- השעו מחדש תאים ב-1:100 מתיל צלולוז במדיה.
- פיפטה 20 מיקרוליטר טיפות של תמיסת התא/מדיה על מכסה צלחת הפטרי.
- בביטחון, במהירות ובזהירות הופכים את המכסה ומניחים אותו על גבי החצי התחתון של צלחת הפטרי המכילה PBS.
- דגרו על הטיפות למשך 24 שעות לפחות.
הערה: ניתן לנטר את היווצרות הספרואידים על ידי מיקרוסקופ שדה בהיר.
5. שיטת בדיקת נדידת ספרואידים שכבתית מקבילה החוצה (PLOSMA): זריעת ספרואידים של תאים על הידרוג'ל גרגירי
הערה: התהליך הבא מסוכם באיור 4A.
- כדי להגדיר את שיטת PLOSMA המתוארת באיור 4A, הוסף באופן אספטי 15 מיקרוליטר ג'ל באמצעות פיפטת תזוזה חיובית לבארות בצלחת שקופה של 96 בארות.
- בעזרת חיבור צנטריפוגה של רוטור מסתובב בצלחת, סובב ב-1000 x גרם למשך 10 שניות כדי לשטח את הג'ל. הפוך את הצלחת ב-180 מעלות וסובב שוב ב-1000 x גרם למשך 10 שניות כדי להבטיח פיזור ג'ל אחיד על פני קרקעית הבאר.
- לאחר שהושגה שטוחות אחידה, הצליב את הג'ל מלמעלה על ידי החלת אור ממוקד (365 ננומטר, 33.4 mW/cm2) על הדגימה למשך 30 שניות כדי לחשל את הפיגום.
- העבירו באופן אספטי את צלחת הפטרי של טיפות תלויות לתוך מכסה המנוע של תרבית הרקמה האספטית והפכו את המכסה.
- בעזרת פיפטה של 20 מיקרוליטר, ספוג לאט טיפה עד שהכדור נכנס לקצה הפיפטה. הוציאו טיפות על הפיגום במרכז הבאר.
- חזור על השלבים הקודמים עבור כל הבארות. ודא שלכל באר יש ספרואיד על ידי אישור באמצעות מיקרוסקופ שדה בהיר או פלורסנט.
- דגרו את צלחת הבאר בטמפרטורה של 37 מעלות צלזיוס למשך שעתיים כדי לאפשר לספרואידים להיצמד לפיגום.
- פיפטה 15 מיקרוליטר נוספים של ג'ל על גבי כל ספרואיד. כדי להבטיח חלוקת ג'ל אחידה, צנטריפוגה את הצלחת ב-300 x גרם למשך 15 שניות לכל כיוון.
- חישול שכבת הג'ל העליונה למשך 30 שניות באמצעות אור UV (365 ננומטר) ב-33.4 mW/cm2. אמצעי פיפטה על גבי כל פיגום כדי להביא את הנפח הכולל של הבאר ל-200 מיקרוליטר.
הערה: פיגומים יהיו יבשים מאוד בשלב זה, לכן הוסף מדיה טיפה במורד צד הבאר כדי למנוע ניתוק הכדור.
6. שיטת בדיקת הגירה שכבתית מקבילה החוצה (PLOSMA): הדמיה קונפוקלית של ספרואידים
הערה: קלות ההדמיה תלויה במערכת ההדמיה. אתר את הספרואיד בתוך הבאר בזמן חשיפה נמוך. התאים צולמו באמצעות ערוץ FITC (488 ננומטר). לצבע ששימש לתאים היה עירור ב-492 ננומטר ופליטה ב-517 ננומטר. הגדלה של פי 10 מספקת פירוט מוגבר על פני הגדלה פי 4.
- מצא את רמת השלב הנמוכה ביותר (גובה z) שבה התאים עדיין ממוקדים. הגדר זאת כגבול התחתון של מחסנית z.
- מצא את רמת השלב הגבוהה ביותר (גובה z) שבה התאים עדיין ממוקדים. הגדר זאת כגבול העליון של מחסנית ה-z.
הערה: תוצאות ההדמיה הטובות ביותר כוללות גודל צעד של פחות או שווה ל-5 מיקרומטר כדי לשמור על רזולוציה בקנה מידה תאי. ייתכנו פשרות בין מהירות ההדמיה לרזולוציה בהתאם למערכת המיקרוסקופ הקונפוקלי. - דמיין את כל הספרואידים כמתואר ב-t = 0 ו-24 שעות. ניתן גם לדמות נקודת זמן של 48 שעות בהתאם לאילוצי הניסוי. תמונות הקרנה מקסימליות מייצגות של t = 0 ו- t = 24 נראות באיור 4B.
7. שיטת בדיקת הגירה ספרואידית מקבילה שכבתית החוצה (PLOSMA): ניתוח תמונה תלת מימדית
- ייבא תמונות לתוכנת הניתוח כמתואר בשלבים 3.1 עד 3.4. בפינה השמאלית העליונה של החלונית השמאלית, לחץ על התפריט הנפתח של ערוץ 1 ובחר חיסור רקע. לחץ על אישור בתחתית החלונית.
- לאחר שתחזור לתצוגת תלת מימד, לחץ על כוונון אוטומטי של כל הערוצים בחלון המוקפץ התאמת תצוגה ותקן לפי הצורך.
- בסרגל הכלים הקטן יותר ממש מעל תפריט הצד, לחץ על סמל הוסף מסגרת התייחסות חדשה המוצג באיור 5A עם שלושה חצים אורתוגונליים כדי להוסיף כרטיסייה חדשה בשם 'מסגרת התייחסות 1'.
- הזיזו את המקור למרכז הכדור בכל שלושת המישורים, כפי שמוצג באיור 5B.
- באותו סרגל כלים כמו שלושת החצים האורתוגונליים, לחץ על הסמל עם כדורים כתומים והוסף נקודות חדשות כדי ליצור כרטיסייה בשם 'נקודות 1'. לחץ על לחצן החץ הכחול.
- תחת זיהוי נקודתי, הגדר את קוטר ה-XY המשוער לקוטר המשוער של התאים. לחץ על לחצן החץ הכחול.
הערה: עבור HDF, מספר זה הוא 15.0 מיקרומטר. - לצורך קביעת סף, התאימו את היסטוגרמת העוצמה כך שתקיף רק את החלקים הבהירים ביותר. בעזרת כלי הפריסה, עברו למעלה ולמטה בערימת התמונות כדי לוודא שהיא מדויקת ככל האפשר. לחץ על החץ הבא הכחול.
- לחץ על כפתור הביצוע הירוק כדי לסיים את הניתוח.
- בטל את הסימון של Render on slicer או לחץ על סמל הריבוע הצהוב בצד ימין של לוח ההגדרה.
- לחץ על הכרטיסייה סטטיסטיקה . בתפריט הנפתח הראשון, בחר ערכים ספציפיים. בתפריט הנפתח השני, בחר Distance from Origin Reference Frame. כל הערכים עבור המשטחים שנבחרו יוצגו, כפי שניתן לראות באיור 5C. לחץ על סמל השמירה הבודדת, שמוריד קובץ .xls.
- שמור את השינויים שבוצעו בתמונה ובניתוחים על ידי לחיצה על סמל שמור בסרגל הכלים הראשי. איור 6A מייצג עיבוד תלת מימדי של כדור שצולם ב-24 שעות, בעוד שאיור 6B מייצג את פונקציית IMARIS Spots המסמנת תאים מפוזרים, מקודדים בצבע בהתאם למרחק ממסגרת הייחוס המקורית.
- נרמל את הנתונים המיוצאים לתמונות t = 0 וחשב את ממוצע המרחק הסלולרי שנסע וגובה z עבור כל ספרואיד כדי לקבל ערך יחיד עבור כל דגימה. איור 7A,B מתארים גרפים מייצגים עבור כל פלט, בהתאמה.
תוצאות
פרוטוקול זה נועד לפרט את השלבים הדרושים לשני מבחני נדידת פיגומים גרגירים חדשים. ניתן להשתמש בשיטת MAMA כדי להעריך חדירה תאית בממשק רקמות. הידרוג'לים גרגירים הם מערכת מורכבת יותר מהידרוג'לים בתפזורת, ולכן הם מטבעם מורכבים יותר לעיבוד לנדידה 9,20. חשוב להבין את התהליך ההדרגתי המתואר באיור 1. כל שלב מתבסס על הבא אחריו ועבר אופטימיזציה בפרוטוקול זה. זריעת HDF בצפיפות של 120,000 תאים/סמ"ר תביא למפגש של לפחות 80% בן לילה (איור 1A), ותאים לא-פלואורסצנטיים אלה מתויגים בצורה הטובה ביותר עם צבע מעקב תאים ביום הניסוי כדי למקסם את פוטנציאל ההדמיה (איור 1B). פרוטוקול זה תואם את הכוח הצנטריפוגלי הנמוך יותר המשמש במעבר HDF כדי לשמור על כדאיות התא. בשל הזווית המיוצרת עבור צעד צנטריפוגה יחיד, יש צורך להפוך את הצלחת ב-180 מעלות כדי להבטיח תזוזות ג'ל כדי לכסות במלואן את המשטח התחתון של הבארות (איור 1C). מתן אפשרות לתאים להתאושש באינקובטור במשך 30 דקות לאחר החישול (איור 1D) ישמור על כדאיות התא ויביא לנדידה אופטימלית (איור 1E). ניתן לדמות שטח גדול של צלחת של 96 בארות עם מטרה פי 4 ולהתאים מנקודת זמן 0-24 שעות (איור 2A,B) כדי להעריך באופן נרחב את התנהגות התא. עיבוד תמונות z-stack המתקבלות בתוכנת הניתוח מספק ניתוחים מתקדמים עבור מספר מערכי נתונים גדולים בממשק קל לשימוש. פרוטוקול זה מסכם את השלבים ליצירת מערכי נתונים עבור גובה התא, או מיקום Z, בכל נקודת זמן המוצגת עם התמונות המייצגות באיור 2B,C. ניתוח הנתונים המעובדים נראה באיור 3A, באופן חזותי באמצעות ממוצע הגבהים החציוניים וסטיית התקן שלהם של כל נקודת זמן, וגובה שינוי הקיפול מתאים שאינם נודדים ב-t = 0 שעות מוצג באיור 3B. הנתונים הבסיסיים של שיטה זו מופצים בדרך כלל באופן לא רגיל, ולכן חציונים הם מדדים חזקים יותר להשוואה ולכן משמשים לסיכום הנתונים.
כמו כן, ניתן להשתמש בשיטת PLOSMA כדי להעריך את התנועתיות של תאים המועברים בתוך פיגום הידרוג'ל גרגירי תלת מימדי. איור 4A מתאר את השלבים לשיטת PLOSMA, וחשוב במיוחד לזרוע את הכדור במרכז הבאר. מומלץ לרכז את הספרואיד בשדה הראייה אך תלוי ביכולות המיקרוסקופ. איור 4B מציג תמונות מייצגות של התפשטות ספרואידים עבור t = 0 שעות ו- t = 24 שעות שצולמו בהגדלה של פי 10 בערוץ FITC (488 ננומטר). בתוכנה ניתן ליצור מסגרת ייחוס מקור ולהתאים אותה לכל מחסנית z (איור 5A,B). התוכנה יכולה לעקוב אחר המרחק הרדיאלי ממסגרת הייחוס המקורית ולייצא אותה כמערך הנתונים הרצוי (איור 5C). איור 6A מציג תמונה מייצגת של העיבוד התלת-ממדי של הספרואיד t = 24 שעות, בעוד שאיור 6B מציג את פונקציית ה-Spots של התוכנה. דוגמה לנתונים המעובדים מוצגת באיור 7. איור 7A מייצג את המרחק הממוצע שנסע מהמרכז המנורמל למרחקי היום 0. איור 7B מבודד מרחקים שנסעו רק במישור z מכיוון שזה הכיוון ששיטת PLOSMA שואפת לחקור.
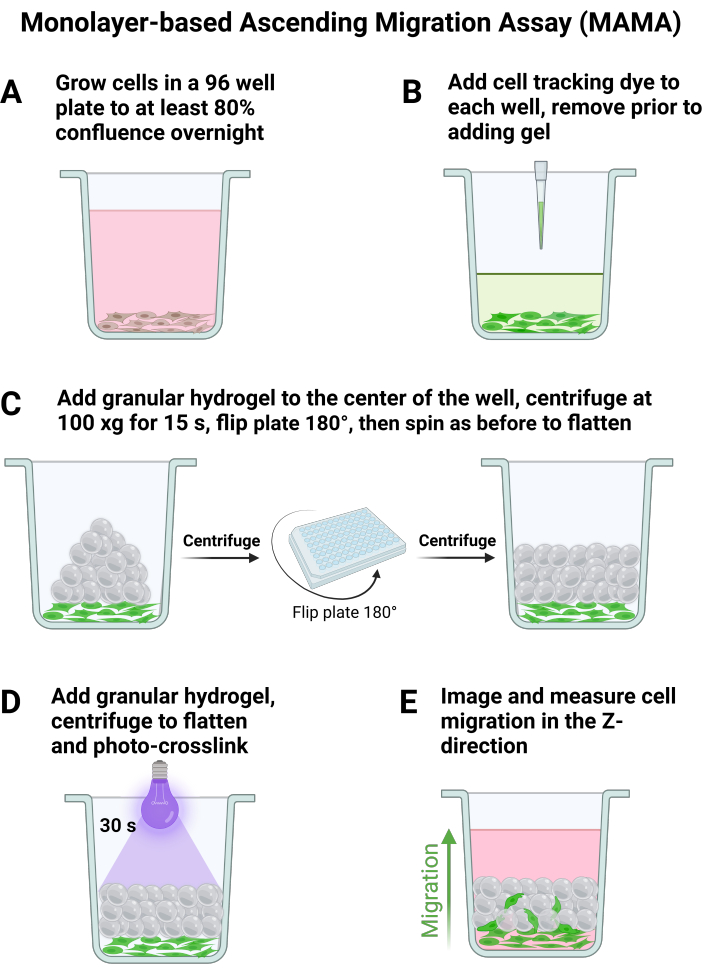
איור 1: בדיקת הגירה עולה מבוססת חד-שכבתית תרבית תאים והדמיה. סכמטי של שלבים עיקריים בעיבוד תאים וג'ל עבור MAMA. (A) תאים גדלים למפגש בן לילה, ו-(B) צבע מעקב אחר תאים מתווסף ממש לפני הוספת ג'ל גרגירי. הפיגום מורכב באמצעות צנטריפוגת צלחת (C) ומיוצב עם (D) הצלבת צילום. הדמיה בנקודות זמן מרובות מאפשרת הדמיה (E) של נדידת תאים כלפי מעלה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
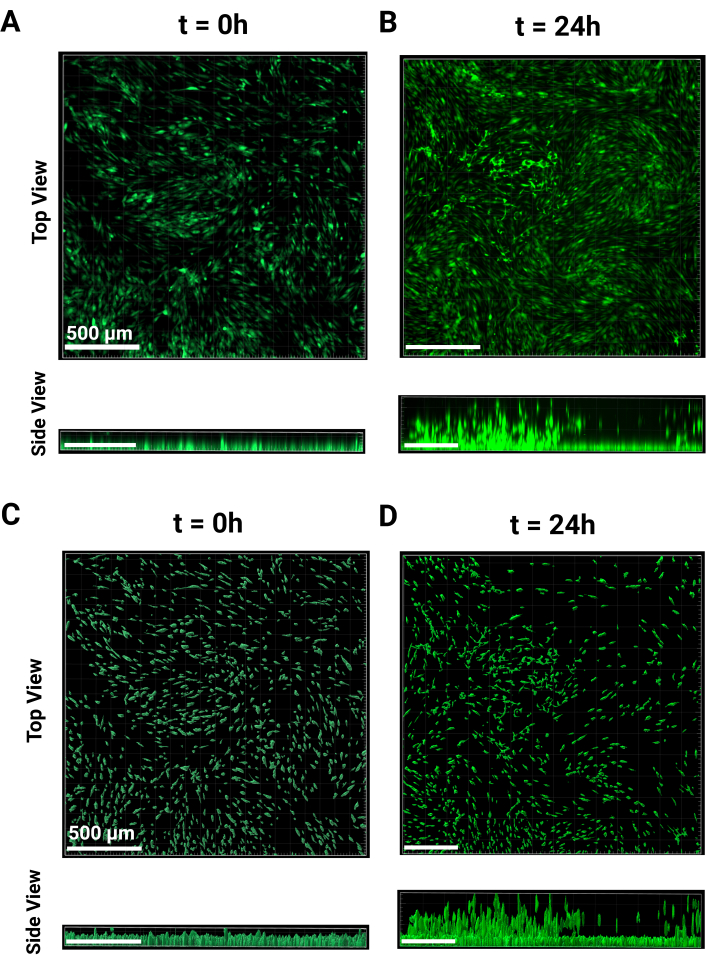
איור 2: עיבוד תמונה MAMA. תמונות מייצגות של עיבוד תמונה. השוואה בין תמונות קונפוקליות גולמיות ב-(A) t = 0 ו-(B) t = 24 שעות בערוץ FITC בהגדלה פי 4. (B) השוואת תצוגה עליונה וצדדית של מיקום התא המעובד בגבהי Z ב-(C) t = 0 ו-(D) t = 24 שעות. העיבוד במשך 24 שעות כולל חיסור של גבהי z חציוניים שאינם נודדים. פסי קנה מידה = 500 מיקרומטר. קיצורים: MAMA = בדיקת הגירה עולה מבוססת חד-שכבתית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
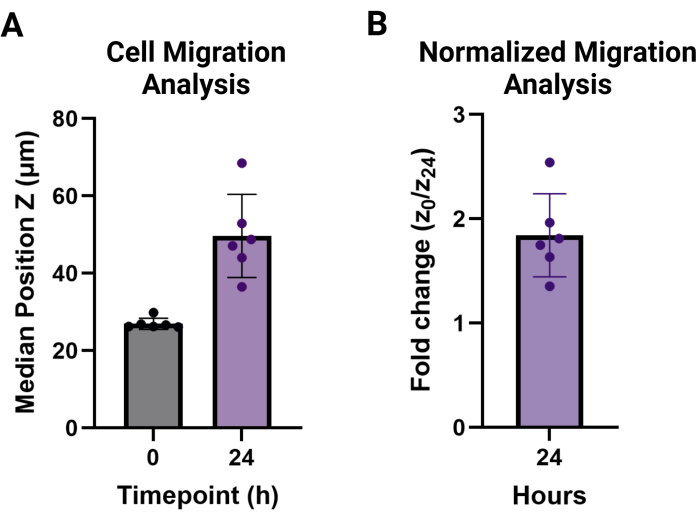
איור 3: ניתוח פלט נדידת תאי MAMA. (A) מיקום חציוני Z וסטיית תקן של גבהי התאים בכל שכפול (n = 6) בנקודות זמן t = 0 (27.0 מיקרומטר ± 1.4 מיקרומטר) ו- t = 24 שעות (46.6 מיקרומטר ± 10.8 מיקרומטר). (B) נדידת תאים לאחר 24 שעות מנורמלת ל-0 שעות ומדווחת כשינוי קיפול (1.8 ± 0.4). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
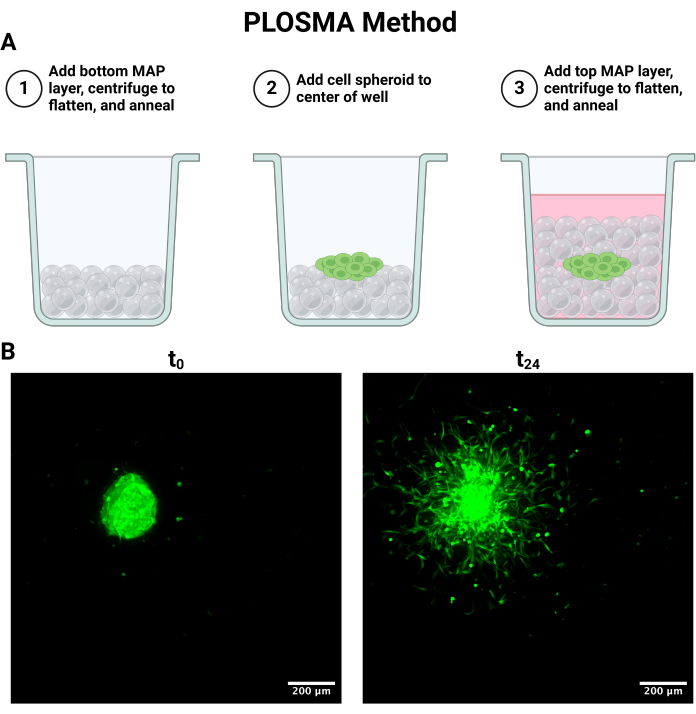
איור 4: תרבית תאים והדמיה של בדיקת הגירה ספרואידית של שכבה מקבילה החוצה (PLOSMA). (A) סכמטי המתאר שלבים של שכבות פיגומים. (B) הקרנות עוצמה מקסימלית של ספרואיד שנלקחו ב-0 וב-24 שעות. התמונות צולמו באמצעות מיקרוסקופיה פלואורסצנטית קונפוקלית בערוץ FITC (488 ננומטר) בהגדלה של פי 10. פסי קנה מידה = 200 מיקרומטר. קיצורים: PLOSMA = בדיקת נדידת ספרואידים בשכבה מקבילה כלפי חוץ. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
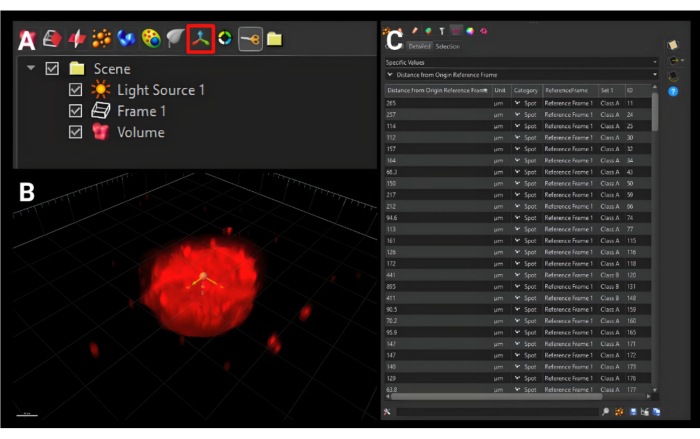
איור 5: יצירת מסגרת ייחוס מקור חדשה. (A) לחצן מסגרת ההתייחסות למקור החדש המתוארת בתיבה אדומה. (B) המקור החדש מוגדר להיות במרכז הספרואיד בכל שלושת הממדים. (C) מדדי הפלט שמוצגים הם המרחקים של משטחי התא ממסגרת הייחוס המקורית, המתארת כמה רחוק התאים נדדו מהמרכז. סרגל קנה מידה = 120 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
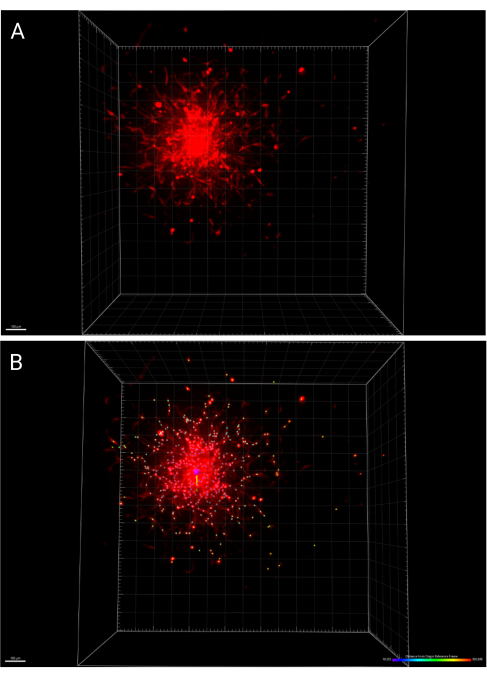
איור 6: עיבודים תלת-ממדיים של הספרואיד המשובץ ב-24 שעות. (A) ספרואיד מעובד במרחב תלת-ממדי. (B) המרכז של אותו ספרואיד נקבע באמצעות פונקציית מסגרת הייחוס המקורית ב-IMARIS, והתפשטות התא מקודדת בצבע לפי המרחק מהמקור. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
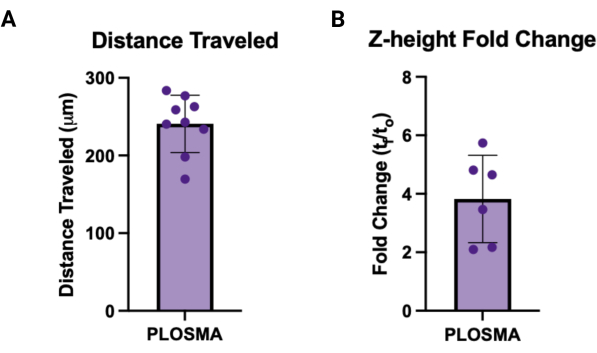
איור 7: יציאות לדוגמה עבור PLOSMA. (A) דוגמה לתוצאות PLOSMA המציגות מרחק נסיעה במיקרומטר. המרחק הממוצע שנסע היה 240.8 מיקרומטר ±-36.87 מיקרומטר. (B) שינוי קיפול בגובה Z (tf/t0) של הנבטה הספרואידית. השינוי הממוצע בקיפול היה 3.82 ±-1.495. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
פרוטוקול זה מתאר שני מודלים במבחנה לאפיון נדידת תאים בתלת מימד לריפוי פצעים ושילוב רקמות. המודל הראשון, מבחן ההגירה החד-שכבתי, מסתמך על תאים מחוברים וקונפלואנטים כהלכה. פרוטוקול זה פותח עם סוג תא פיברובלסטים ומותאם בצפיפות זריעה של 1,20,000 תאים/סמ"ר. צפיפות זו מאפשרת לתאים לצמוח בן לילה עד לפחות 80% מפגש באופן שווה על פני תחתית צלחת הבאר. שלב זה מבטיח הגירה בכיוון z תוך 24 שעות לפחות; אם המפגש נמוך מדי עם הוספת שכבת הג'ל, התאים עשויים להמשיך להתפשט על פני פלסטיק תרבית הרקמה כמו גם לתוך הג'ל, וכתוצאה מכך דפוס נדידה לא אחיד ומואט, שנצפה במהלך האופטימיזציה. עדיין ניתן להבחין בגבהי נדידה לא אחידים באזורים של תאים פחות צפופים, אפילו במפגש של 80%. שכפולים טובים יפחיתו את הרעש של התנהגויות תאים אלה. תאים מתכנסים יתר על המידה עלולים לגרום להרמת תאים במהלך תקופת הצנטריפוגה ואולי למוות של תאים. שונות זו מטופלת על ידי זריעה במספר עקבי של תאים ועל ידי לכידת אזור תמונה עקבי כדי לאפשר השוואות נתונים מתאימות. למיטב ידיעת המחבר, צנטריפוגת צלחות לא פורסמה להשטחת ג'ל, אך צנטריפוגה משמשת בדרך כלל למעבר תאים וטיפול בביו-חומר21,22. התאמת המהירות כך שתתאים למהירויות המעבר תשמור על כדאיות התא לעיבוד תאים אופטימלי נוסף.
האתגר העיקרי בשיטה זו הוא מקסום רזולוציית ההדמיה והעומק תוך מזעור זמן ההדמיה כדי להבטיח את הניתוח הטוב ביותר. צבע מעקב תאים ירוקים בהיר מספיק כדי לצלם באר של 96 עם גודל צעד של 5 מיקרומטר או פחות וזמן חשיפה של עד 1000 אלפיות השנייה. הפחתת זמן החשיפה מפחיתה את משך הזמן שבו התאים אינם נמצאים בתנאי דגירה, אך גם מפחיתה את הרזולוציה. יש לבצע אופטימיזציה של פרמטרים אלה על בסיס מיקרוסקופ בודד, אך השונות מופחתת על ידי הבטחה שכל התמונות נלכדות באותן הגדרות במחקר אחד.
הערה חשובה לניתוח MAMAs היא שהוא דורש חיסול התאים בגובה החד-שכבתי או מתחתיו כדי להבטיח שרק תאים נודדים נלקחים בחשבון לבדיקות סטטיסטיות. בהתאם לכך, החציונים של בארות משוכפלות מדווחים בשל אופי ההתפלגות הלא-גאוס של מיקומי התאים לאחר הסינון. ניתן לדמיין השוואה בין קבוצות באמצעות היסטוגרמה, וניתן לנתח סטטיסטית את החציונים באמצעות מבחן לא פרמטרי.
למרות האתגרים הללו, שיטת ההגירה כלפי מעלה המבוססת על חד-שכבות היא, בפשטותה, בדיקה הניתנת לשחזור לחדירת תאים תלת מימדיים לפיגומים נקבוביים. כדי לחקור את ההשפעות המכאניסטיות של נדידת תאים, ודא שהפרמטרים מתאימים לסוג התא הנחקר. זה עשוי לכלול תוספת של רכיבים כימוטקטיים או הפטוטקטיים, בתוך הג'ל או במדיה. מדיה שלמה של פיברובלסטים עוריים אנושיים כוללת כימוקינים נודדים, אך סוגי תאים אחרים המשתמשים ברמזים ספציפיים יותר דורשים התאמה של הבדיקה בהתאם. בדיקה זו אכן מתאימה לבדיקת סוגים רבים של משתנים; עם זאת, היקף אלה אינו מכוסה בפרוטוקול זה. ה-MAMA מספק סביבה רלוונטית מבחינה פיזיולוגית המקבילה לתנועת תאים מרקמה בתפזורת להידרוג'ל נקבובי מוזרק in vivo.
בשיטת PLOSMA, מיקום הספרואידים במרכז הפיגום הוא קריטי להדמיה מוצלחת ולנדידת תאים משמעותית בתלת מימד. הזריעה המדויקת של הכדור במרכז הג'ל תלויה במשתמש. לשם כך, ייצוב הפיפטה בקנה עם היד הלא דומיננטית של המשתמש מסייע במרכז, וניתן לאשר את יעילות מיקום הזריעה באמצעות מיקרוסקופ שדה בהיר או פלואורסצנטי. ניתן לתקן ספרואיד מחוץ למרכז על ידי ניסיון שני עם ספרואיד חדש, על אותו פיגום או על פיגום חדש. מסיבה זו, המחברים ממליצים ליצור יותר ספרואידים מהנדרש ולהכין יותר ג'ל MAP מהנדרש.
שלב הצנטריפוגה של השכבה השנייה מבטיח שהספרואיד (1) מכוסה באופן שווה על ידי הג'ל ו-(2) מסוגל להתפשט באופן שווה כלפי מעלה ומטה לתוך הג'ל, דבר חיוני לחקר התאים המועברים. צנטריפוגה יכולה גם לגרום לכדור לנוע מהמרכז לכיוון שולי הבאר, ובעוד שפרוטוקול זה מגביל תופעה זו על ידי אופטימיזציה של שלבי הצנטריפוגה ונפח הג'ל המשמש לכל שכבה (15 מיקרוליטר) לפיזור אחיד, הוא אינו מבטל לחלוטין את תנועתו. ייתכן שיהיה צורך להתאים את מהירות הצנטריפוגה המדויקת ואת התזמון הנדרשים להפחתת תנועת הכדורים בהתאם למודל הצנטריפוגה; עם זאת, המפרט המתואר בפרוטוקול זה עשוי לשמש כאמת מידה לאופטימיזציה אינדיבידואלית. גישה נוספת היא לאפשר לספרואידים שעתיים של זמן הדגירה להיצמד לפיגום לפני הוספת שכבת הג'ל השנייה. תנועת הכדורים מתמתנת היטב כאשר שתי האסטרטגיות מיושמות. לבסוף, בגלל תהליך הצנטריפוגה הרב-שלבי, ייתכן ששיטה זו לא תתאים לקווי תאים פחות עמידים.
מלבד הלוגיסטיקה של ציפוי הספרואידים בשיטת PLOSMA, ישנן מגבלות במהלך רכישת התמונה. ניתן לדמות את הספרואיד באמצעות הגדלה של פי 4 או פי 10, אך לקבלת התוצאות הטובות ביותר, השתמש בהגדלה של פי 10 לפחות והקטן את גודל הצעד של ערימות ה-z ל-2-5 מיקרומטר. ההגדלה צריכה להיות עקבית לאורך כל המחקר. זמן ההדמיה גדל עם רזולוציה גבוהה יותר, לכן הגבל את מספר הדגימות בכל צלחת באר (4-8 בארות לצלחת) כדי למזער את הזמן מחוץ לחממה. מערך הדמיה חיה יכול גם לשפר את המעקב ולספק תובנות גדולות יותר.
מכיוון שלהידרוג'לים גרגירים יש טופולוגיה ופרמטרים עיצוביים ייחודיים הכוללים נפח אינהרנטי, נקבוביות, חוזק מכני, ובמקרים מסוימים, ביו-אקטיביות, יש צורך לחקור את התנהגות התאים ביחס להיבטים אלה בנאמנות רבה ככל האפשר. שיטת PLOSMA נועדה לדגמן את תנועת התאים לאחר הלידה או לאחר שהתאים נכנסו לג'ל גרגירי במלואו. מכיוון שהתאים נאלצים לנדוד דרך הנקבוביות הטבועות בגיאומטריית הידרוג'ל גרגירית, שיטת PLOSMA מבודדת ביעילות את הנקבוביות כהשפעה על התנהגות התא. יישומים פוטנציאליים לבדיקה זו הם העברת תאים באתרם ושילוב רקמות בתוך פיגום גרגירי, במיוחד בחלל ריפוי הפצעים23.
שני הפרוטוקולים פותחו עם פיברובלסטים עוריים אנושיים ראשוניים בשל תפקיד נדידת הפיברובלסטים בתיקון רקמות ועיצוב מחדש 4,24, עם זאת, ניתן למדוד את התנהגות הנדידה של כל תא דבק בתגובה לשינוי הפיגום הנקבובי - כולל תוספות של גורמי גדילה והרכב פני השטח/תפזורת של הג'ל. שינויים אלה עשויים לדרוש התאמה של מבחנים אלה לתוצאות ניכרות. פרמטרים הדורשים אופטימיזציה נוספת כוללים צפיפות זריעת תאים, משך הניסוי ו/או צינור ניתוח. IMARIS הוא כלי רב עוצמה לניתוח הדמיה המשמש לניתוח נדידת תאים ויש לו יכולות מעבר למה שמתואר כאן, הכוללות סיווג כל האובייקטים בתוך 'משטח' נבחר לקבוצות המבוססות על מאפיינים שונים כגון שטח פנים, נפח, עוצמה ומרחק ממשטחים אחרים שנוצרו. ישנם משאבים מקוונים רבים לקביעת שיטות ניתוח נוספות.
שתי השיטות המתוארות כאן לא רק מתייחסות למצב הראשוני של החדרת רקמה לחומר גרגירי בצורה פיזיולוגית, אלא גם לתגובת התא שלאחר מכן כאשר היא מוטמעת במלואה בתוך החומר. כמו בכל מבחני הנדידה, התאים הקיימים מסוגלים להתרבות במקביל לתנועה, אולם תכנון הבדיקות המתוארות אינו משבש את ההתפשטות ובכך מבטיח שאין השפעה מיותרת על הניתוח. שתי השיטות תואמות לצביעה בנקודות קצה בנוסף להדמיה אורכית, המשתמשת בקיבוע PFA כדי לזהות מדדים כגון שלד ציטו, שקיעת קולגן, התפשטות ועוד. השימוש בשיטות המתוארות מתקדם לעבר ייצוג מרחבי-זמני מדויק יותר של נדידת תאים תלת מימדית המשתמשת בחדירת תאים כפרמטר מדיד בניגוד לשיטות קודמות 1,6,14,15,25,26,27.
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
המימון לעבודה זו נתמך בחלקו באמצעות פרס הפרויקט לטווח קצר של המכונים הלאומיים לבריאות בארה"ב (1R56DK126020-01) ותרומה פילנתרופית מקרן קורטין. J.T. מומן על ידי מלגת המחקר לתארים מתקדמים של הקרן הלאומית למדע. סכמות איורים שנוצרו באמצעות BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 Phalloidin | ThermoFisher | A22287 | |
| Bovine Serum Albumin | VWR International | 332 | |
| CellTracker Green CMFDS Dye, 1 mg | ThermoFisher | C2925 | 20 x 50 ug units, 492/517 nm |
| Centrifuge | ThermoFisher | 75016085 | ST Plus Series |
| Clear 96 well plate | MilliPore Sigma | CLS3997-50EA | |
| Dimethyl Sulfoxide | Fisher Scientific | MT-25950CQC | 250 mL |
| Fibroblast Basal Medium | ATCC | PCS-201-030 | 480 mL, phenol-red-free |
| Fibroblast Growth Kit - Low Serum | ATCC | PCS-201-041 | 7.5 mM L-glut,5 ng/mL rh FGF basic, 5 ug/mL rh Insulin, 1 ug/mL Hydrocortisone, 50 ug/mL Ascorbic acid, 2% FBS |
| FIJI (ImageJ) | NIH | Public access download | |
| Human Dermal Fibroblasts | ATCC | PCS-201-012 | Adult human dermal fibroblasts |
| ImageXpress Micro Confocal | Molecular Devices | Spinning Disc confocal microscope with 4x, 10x magnifications | |
| IMARIS | Oxford Instruments | 3/4D Imaged Visualizaiton and Analysis Software, Proprietary | |
| Incubator | ThermoFisher | Finnpipette F2 Variable volume Pipettes | HeraCell Vios 160i CO2 Incubator, 165L |
| M-20 Microplate Swinging Bucket Rotor | ThermoFisher | 75003624 | |
| Methylcellulose | Fisher Scientific | 9004-67-5 | Lab grade, powder form |
| Microcentrifuge tube | Fisherbrand | 05-408-129 | 1.5 mL microcentrifuge tubes |
| Paraformaldehyde (4%) | Alfa Aesar | AAJ19943K2 | For fixing |
| Petri dish | Corning | 08-757-100A | Bacteriological Petri Dishes with Lid 35 x 10 mm |
| Pipettes | ThermoFisher | 4642080 | Finnpipette F2 Variable volume Pipettes |
| Sterile PBS | Gibco | 10010-023 | |
| Triton-X | Fisher Scientific | 327371000 |
References
- Jerka, D., et al. Unraveling endothelial cell migration: Insights into fundamental forces, inflammation, biomaterial applications, and tissue regeneration strategies. ACS Appl Bio Mater. 7 (4), 2054-2069 (2024).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay Drug Dev Technol. 12 (4), 207-218 (2014).
- Yamada, K. M., Sixt, M. Mechanisms of 3D cell migration. Nat Rev Mol Cell Biol. 20 (12), 738-752 (2019).
- Grinnell, F. Fibroblast biology in three-dimensional collagen matrices. Trends Cell Biol. 13 (5), 264-269 (2003).
- Kloxin, A. M., Kloxin, C. J., Bowman, C. N., Anseth, K. S. Mechanical properties of cellularly responsive hydrogels and their experimental determination. Adv Mater. 22 (31), 3484-3494 (2010).
- Solbu, A. A., et al. Assessing cell migration in hydrogels: An overview of relevant materials and methods. Mater Today Bio. 18, 100537 (2023).
- Madl, C. M., Katz, L. M., Heilshorn, S. C. Tuning bulk hydrogel degradation by simultaneous control of proteolytic cleavage kinetics and hydrogel network architecture. ACS Macro Lett. 7 (11), 1302-1307 (2018).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nat Rev Mater. 5 (1), 20-43 (2020).
- Qazi, T. H., Burdick, J. A. Granular hydrogels for endogenous tissue repair. Biomater Biosyst. 1, 100008 (2021).
- Tanner, G. I., Schiltz, L., Narra, N., Figueiredo, M. L., Qazi, T. H. Granular hydrogels improve myogenic invasion and repair after volumetric muscle loss. Adv Healthc Mater. 25, e2303576 (2024).
- Sussman, E. M., Halpin, M. C., Muster, J., Moon, R. T., Ratner, B. D. Porous implants modulate healing and induce shifts in local macrophage polarization in the foreign body reaction. Ann Biomed Eng. 42 (7), 1508-1516 (2014).
- Roosa, C. A., et al. Conjugation of IL-33 to microporous annealed particle scaffolds enhances type 2-like immune responses in vitro and in vivo. Adv Healthc Mater. 13 (25), 2400249 (2024).
- Jaberi, A., et al. Engineering microgel packing to tailor the physical and biological properties of gelatin methacryloyl granular hydrogel scaffolds. Adv Healthc Mater. 13 (25), 2402489 (2024).
- Nandi, S., Brown, A. C. Characterizing cell migration within three-dimensional in vitro wound environments. J Vis Exp. 126, e56099 (2017).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Adv Mater. 34 (12), 2109194 (2022).
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nat Mater. 14 (7), 737-744 (2015).
- Pruett, L. J., Jenkins, C. H., Singh, N. S., Catallo, K. J., Griffin, D. R. Heparin microislands in microporous annealed particle scaffolds for accelerated diabetic wound healing. Adv Funct Mater. 31 (35), 2104337 (2021).
- Roosa, C., et al. Microfluidic synthesis of microgel building blocks for microporous annealed particle scaffold. J Vis Exp. (184), e64119 (2022).
- Pfaff, B. N., et al. Selective and improved photoannealing of microporous annealed particle (MAP) scaffolds. ACS Biomater Sci Eng. 7 (2), 422-427 (2021).
- Riley, L., Schirmer, L., Segura, T. Granular hydrogels: Emergent properties of jammed hydrogel microparticles and their applications in tissue repair and regeneration. Curr Opin Biotechnol. 60, 1-8 (2019).
- Jo, C. H., Roh, Y. H., Kim, J. E., Shin, S., Yoon, K. S. Optimizing platelet-rich plasma gel formation by varying time and gravitational forces during centrifugation. J Oral Implantol. 39 (5), 525-532 (2013).
- Mironov, V., et al. Fabrication of tubular tissue constructs by centrifugal casting of cells suspended in an in situ. crosslinkable hyaluronan-gelatin hydrogel. Biomaterials. 26 (36), 7628-7635 (2005).
- Vu, L. T., Jain, G., Veres, B. D., Rajagopalan, P. Cell migration on planar and three-dimensional matrices: A hydrogel-based perspective. Tissue Eng Part B Rev. 21 (1), 67-74 (2015).
- Cialdai, F., Risaliti, C., Monici, M. Role of fibroblasts in wound healing and tissue remodeling on Earth and in space. Front Bioeng Biotechnol. 10, 958381 (2022).
- Qazi, T. H., Muir, V. G., Burdick, J. A. Methods to characterize granular hydrogel rheological properties, porosity, and cell invasion. ACS Biomater Sci Eng. 8 (4), 1427-1442 (2022).
- Shaik, R., et al. Cardiac matrix-derived granular hydrogel enhances cell function in 3D culture. ACS Appl Mater Interfaces. 16 (43), 58346-58356 (2024).
- Puiggalí-Jou, A., Asadikorayem, M., Maniura-Weber, K., Zenobi-Wong, M. Growth factor-loaded sulfated microislands in granular hydrogels promote hMSCs migration and chondrogenic differentiation. Acta Biomater. 166, 69-84 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved