Method Article
Granül Hidrojel Biyomalzemeler İçinde ve İçine Üç Boyutlu Hücre Migrasyonunun Ölçülmesi
Bu Makalede
Özet
Granül hidrojellerin arayüzü içinde ve içine 3D hücre göçünün kantitatif değerlendirmesi için bir protokol burada sunulmaktadır.
Özet
Granül hidrojel iskeleler, rejeneratif tıpta önemli bir potansiyele sahiptir ve ya hücre iletimi için taşıyıcılar ya da doku entegrasyonu için arayüzler olarak işlev görür. Bu makale, granül hidrojeller içinde ve içine hücre göçünü ölçmek için iki yeni yaklaşım sunmakta ve bu iskelelerin farklı uygulamalarını vurgulamaktadır. İlk olarak, entegrasyon amacıyla granül hidrojellere doku büyümesini simüle eden bir hücre tek katmanlı arayüz testi sunulmaktadır. İkinci olarak, hidrojel matrisi içindeki hücre hareketini izlemek için tasarlanmış, özellikle hücre dağıtımını içeren uygulamalar için uygun olan sferoid bazlı bir test açıklanmaktadır. Her iki yöntem de hücre göçünün hassas ve kontrollü ölçümlerini mümkün kılarak, granül hidrojel iskeleleri kullanan araştırmacılar için kapsamlı bir araç seti sağlar. Bu yöntemlerin motivasyonu, belirli uygulamalarla uyum sağlamak için iskele içindeki hücre göçü üzerinde özel kontrol ihtiyacından kaynaklanmaktadır. Araştırmacılar, bu niceleme tekniklerini optimize ederek ve standartlaştırarak, granüler hidrojel özelliklerini yinelemeli olarak rafine edebilir ve çeşitli rejeneratif tıp bağlamlarında etkinliklerini sağlayabilirler. Bu sağlam kantitatif araç seti, granül hidrojel iskelelerini geliştirmek için yeni fırsatlar sunarak hem hücre iletimi hem de doku entegrasyon uygulamalarında kullanımlarını ilerletiyor.
Giriş
Terapötik uygulamalar için biyomalzemeler, doku entegrasyonunu incelemek için daha karmaşık ve ilgili hücre ortamı modellerine doğru giderek daha fazla gelişmektedir. Biyomateryal iskeleler, hücre büyümesi için üç boyutlu (3D) bir yapı sağlar ve istenen bir dokuyu taklit etmeyi amaçlar 1,2. Üç boyutlu hücre kültürü modelleri, haptotaktik veya kemotaktik ipuçları yoluyla hücrelere daha fazla karmaşıklık sağlayan doğal matrisleri ve sentetik iskeleleri içerir 3,4. Geleneksel hidrojel iskeleler toplu olarak çapraz bağlanır ve küçük moleküllerin 5,6 difüzyonuna izin veren, ancak onarım ihtiyacı olan bir doku alanına hücre ölçeğinde göç için bozunma gerektiren nano gözenekli bir ağ verir7. Granül hidrojeller, biyouyumlulukları, düzensiz şekillere uyma yetenekleri ve çoğu durumda enjekte edilebilirlikleri nedeniyle klinik translasyon potansiyeli yüksek olan bir biyomateryal alt kümesidir 8,9. Yapı taşı yapıları, doku infiltrasyonu ve anjiyogenezi geliştirmek için hücre ölçeğinde gözenekliliğin yanı sıra modülerliği artırır, bu da hücre davranışı için heterojen ipuçlarının eklenmesine izin verir10,11,12. Bir 3D iskele içindeki hücre tepkisini ve hareketini anlamak, doku entegrasyonu için biyomalzemelerin kullanıldığı tüm uygulamalarda fizyolojik uygunluk için hayati önem taşır.
Bununla birlikte, doku büyümesini üç boyutta incelemenin, kantitatif doğrulukla gerçekleştirilmesinin zor olduğu kanıtlanmıştır. Bir 3D ortamın genişletilmiş karmaşıklığı, yalnızca hücre davranışı hakkında bilgi sağlamakla kalmayıp aynı zamanda malzeme durumu optimizasyonu da sağlayabilen in vitro hücre göçü modelleri gerektirir. Daha önce yayınlanmış 3D granüler iskele hücre göçü raporları, hücre davranışını keşfetmek, gözenekli yapıya ve hücre morfolojisinesızmayı 13 ve diğerleri küresel filizlenmeyi 14,15 raporlamak, büyüme uzunluğunu ve filiz sayısını ölçmek için topikal tohumlamayı kullanmıştır. Topikal tohumlama göç uzunlukları, yerçekimi kuvvetlerinden eşit olmayan bir şekilde etkilenebilir ve mikroskopi sınırlamaları nedeniyle sonuçlar uzunlamasına olamaz. Küresel filizlenme yöntemi, kontrollü istila mekanizmasını yakalayamayan maksimal projeksiyon yoluyla 2D miktar tayini ile sınırlandırılmıştır. Her iki yöntem de, 3D hücresel hareketi ve iskele sızmasını tam olarak özetlemek için gerekli nüanstan yoksun olan bir xy düzleminde ölçülür.
Bu protokol, özellikle Mikro Gözenekli Tavlanmış Parçacık (MAP) iskeleleri 16,17,18,19 kullanılarak, gözenekli 3D granül hidrojel iskelelerine in vitro sızma gibi hücre göçünü ölçmek için iki yaklaşımı tanımlar. Aşağıdaki yöntemlerin amacı, üç boyutlu analiz için migrasyonlarının yönlülüğünü kontrol ederek granül jellerdeki hücre davranışını incelemektir. İlk, tek katmanlı tabanlı artan göç testi (MAMA) yaklaşımı, tek tip hücre-materyal etkileşimlerini gösteren ve hücrelerin granüler hidrojellerle arayüz oluşturduğu ilk ortamı temsil etmek ve iskelenin sızmasından önce bireysel davranışı izole etmek için bir platform görevi gören basitleştirilmiş bir endojen hücre entegrasyonu modelidir. Paralel katmanlı dışa doğru küresel migrasyon tahlili (PLOSMA) yöntemi olarak adlandırılan ikincisi, karmaşık bir iskele ortamı ile tamamen çevrelendiğinde hücre hareketini araştıran ve doğumdan sonra hücre hareketini modelleyen bir 3D hücre sferoid migrasyon testidir.
Her iki yöntem de 3D görüntü analizi ile ölçülebilir ve hücre hareketini teşvik etmenin veya kısıtlamanın tasarım kriterleri dahilinde olduğu rejeneratif tıp ve doku mühendisliği uygulamaları için uzunlamasına zaman noktalarını kullanarak malzeme-hücre etkileşimlerini incelemek ve optimize etmek için uygulanabilir. Ek olarak, bu yöntemler, tek tip çok kuyulu tahlil hazırlığı için plaka santrifüjlemesinden yararlanır.
Protokol
Çalışmada kullanılan reaktiflerin ve ekipmanların detayları Malzeme Tablosunda listelenmiştir.
1. Granül hidrojel hazırlama
NOT: Bu protokol boyunca kullanılan MAP partikülleri, 45.88 mg / mL PEG-MAL (10 kDa), 0.82 mg / mL RGD, 8.06 mg / mL MethMal19 ve 5.62 mg / mL MMP-2 bozunur çapraz bağlayıcı ile ağırlıkça% 3.2 w / v jeldir. Jelin mekanik sertliği, dermal sertliğe17 uyacak şekilde 15-20 kPa'dır.
- Granül hidrojel parçacıkları oluşturun ve normal şekilde hücre kültürü için hazırlanın.
NOT: Bu protokol, üretimi Roosa ve ark.18 tarafından detaylandırılan Mikro Gözenekli Tavlanmış Parçacık jelinin steril hazırlanmasını açıklar. - Granül hidrojel parçacıklarını in vitro kullanım için hazırlayın üç yıkama% 70 izopropil alkol ile sterilize ederek, ardından üç yıkama steril 1x PBS ile.
- LAP tozunu ultra saf suda çözerek ve çözeltiyi 0.22 μm steril bir filtreden geçirerek ortam çözeltisinde steril bir 0.2 mM lityum fenil-2,4,6-trimetilbenzoilfosfinat (LAP) hazırlayın. Bu çözeltiyi, deneyi yapmak için gerekli jel miktarı ile 1: 1 v / v ekleyin.
- 0.2 mM LAP, jel ve ortam çözeltisini 37 ° C'de 20 rpm'de bir tüp döndürücü üzerinde en az 30 dakika inkübe edin LAP'ın mikropartiküller boyunca difüzyonuna izin vermek için devam etmeden önce.
- 30 dakika geçtikten sonra, partikül süspansiyonunu 18.000 x g'da 25 °C'de 5 dakika santrifüjleyin. Süpernatanı aspire edin.
NOT: MAP parçacıklarının genel kuruluğu, kimya, hidrofiliklik ve parçacık boyutundaki farklılıklar nedeniyle değişebilir. Tutarlılık için, partikül süspansiyonunu tarif edildiği gibi santrifüjlemek, tüpteki partikülleri pozitif yer değiştirmeli bir pipet kullanarak karıştırmak ve ardından santrifüjleme adımını tekrarlamak en iyi uygulamadır.
2. Tek Tabakalı Artan Migrasyon Testi (MAMA) yöntemi: Hücre kültürü ve görüntüleme
NOT: Hücreler FITC kanalı (488 nm) kullanılarak görüntülendi. Hücreler için kullanılan boya, 492 nm'de bir uyarılmaya ve 517 nm'de bir emisyona sahipti. 10x büyütme, 4x büyütmeye göre daha fazla ayrıntı sağlar, ancak her ikisi de kullanılabilir.
- İnsan dermal fibroblastlarını (HDF'ler) üreticinin protokolüne göre çözün. İstenilen geçiş elde edilene kadar gerektiği gibi geçiş; genel olarak, birincil hücreler P5 aracılığıyla genetik ve fenotipik yapıyı korur.
- 96 oyuklu bir plakada en az n = 6 için 120.000 hücre / cm2 veya istenen plaka boyutu için, süspansiyon için oyuk başına önerilen ortam hacmini kullanarak, her eklemeden önce hafifçe aspire edin. Şekil 1A'da gösterildiği gibi hücrelerin gece boyunca bağlanmasına izin verin, bu da ertesi gün yaklaşık% 80 birleşme ile sonuçlanacaktır.
NOT: Genel olarak, merkez sütun ve sıra kuyucukları, optimum jel yayılması için en iyisidir. Yazarlar, 96 oyuklu bir plaka için 24'e kadar kuyu kullanır (B-G satırları ve sütun 5-8). - Jel koşullarını yukarıda belirtildiği gibi hazırlayın ve LAP'ta inkübe ederken, ortamı bir aspiratör veya pipet ile hücrelerin kuyu plakasından çıkarın. Plakanın altını rahatsız etmemeye dikkat edin.
- Şekil 1B'de gösterilen üretici talimatlarına göre kuyucuklara hücre izleme boyası ekleyin. Kuyucuklardan hücre izleme boyasını aspire etmeden önce jelin 1. adımda açıklandığı gibi tamamen hazırlandığından emin olun.
- Plakanın dibine dokunmadan pozitif yer değiştirmeli bir pipet ile kuyucuklara her bir jel koşulundan 20 μL ekleyin.
NOT: En iyi tahlil koşulları, jel doğrudan kuyu merkezine pipetlendiğinde ortaya çıkar. - 25 ° C'de bir plaka eğirme rotoru santrifüj ataşmanı kullanarak, jeli düzleştirmek için 8 hızlanma ve yavaşlama ile 15 saniye boyunca 100 x g'de döndürün. Plakayı 180° çevirin ve Şekil 1C'de görüldüğü gibi kuyu tabanı boyunca eşit jel dağılımı sağlamak için 15 saniye boyunca 100 x g'da tekrar döndürün.
- İskeleyi tavlamak için numuneye 30 saniye boyunca odaklanmış ışık (365 nm, 34.4 mW/cm2) uygulayarak jeli üstten aseptik olarak foto-çapraz bağlayın (Şekil 1D), tüm iskeleler oluşturulduktan sonra her bir hücre kuyucuğuna 200 μL ortam ekleyin. Görüntülemeden önce granül iskeleye yapışmalarını sağlamak için hücrelerin 37 ° C'de 30 dakika inkübe etmesine izin verin.
- Şekil 1E'de özetlenen göç davranışını yakalamak için, hücreleri konfokal bir mikroskop kullanarak görüntüleyin. Hücrelerin en az %80'inin birleştiği plakanın bir alanı için en düşük odak noktasını bulun ve bunu z yığınının alt kenarı olarak ayarlayın.
- Hücre floresan sinyalinin en yüksek noktasını bulun ve bunu z-yığınının üst kenarı olarak ayarlayın. En iyi çözünürlük için 5 μm veya daha küçük bir adım boyutu kullanın.
- Hücre tek tabakasını ve göç etmeyen hücre yüksekliklerini temsil etmek için en az üç kuyu görüntüleyin. T = 0 zaman noktası, Şekil 2A'da hem üstten hem de yandan görünümden gösterilmiştir. Görüntüleme tamamlandıktan sonra gece boyunca inkübe edin.
NOT: Bu hücreler 4x objektifle görüntülendi ve maruziyet tüm kuyucuklar için tutarlı tutuldu. - T = 24 h'de, hücreler, Şekil 2B'de üstten ve yandan görünümlerden görüldüğü gibi, granüler iskeleden yükselmeye başlayacaktır. Aynı parametreleri kullanarak t = 0 saat için gerçekleştirilen görüntüleme adımlarını tekrarlayın. Sahne alanının önceki yüksekliğini referans olarak kullanın veya henüz geçirilmemiş hücreleri bulun ve bunu z yığınının alt kenarı olarak ayarlayın.
- Analiz kolaylığı için her kuyucuğun ayrı bir görüntü olarak kaydedildiğinden emin olarak tüm kuyucuklar için adımları tekrarlayın.
NOT: Zaman noktaları, deneysel kısıtlamalara ve floresan hücre izleme yöntemine bağlı olarak daha uzun zaman noktaları için görüntülenebilir. - Ek ölçümler için iskeleler sabitlenebilir ve boyanabilir. İstenen bitiş noktasında, ortamı bir pipetle kuyulardan aspire edin ve atın. Her bir kuyuyu 200 μL steril PBS ile her biri 5 dakika boyunca iki kez nazikçe yıkayın. 20 dakika boyunca 200 μL %4 Paraformaldehit (PFA) ekleyin, ardından aspire edin ve atın. Kuyular hemen boyanabilir veya 4 °C'de 1x PBS'de bir haftaya kadar saklanabilir.
3. Tek Katmanlı Tabanlı Artan Migrasyon Testi (MAMA) yöntemi: 3D görüntü analizi
- Toplu dönüştürmeler için IMARIS Görüntü Dönüştürme yazılımını açın. Mikroskopi görüntülerini dönüştürme yazılımına sürükleyip bırakın ve içe aktarmak için Arena yazılımının içinde bir klasör seçin. Tümünü Başlat'a basın. Dönüştürülen görüntüler Arena'da .ims dosyaları olarak görünecektir.
NOT: Voksel boyutu görüntü meta verilerine dahil değilse, değeri bulmak için ayrı ayrı konfokal görüntüleme özelliklerine bakın. Alternatif olarak, voksel boyutu, görüntüleme sırasında kullanılan adım boyutu olarak yaklaşık olarak tahmin edilebilir. - Masaüstü IMARIS Arena simgesine çift tıklayarak ve Arena'dan bir görüntü seçerek yazılımı açın.
- Görüntü, üst kısımdaki araç çubuğu simge panelinde görülen '3D Görünüm' analiz sekmesine otomatik olarak yüklenir. Ana araç çubuğundaki Image Proc sekmesine tıklayın.
- Yan panelin sol üst köşesinde, Kanal 1 için açılır menüye tıklayın ve Arka Plan Çıkarma'yı seçin. '3D Görünüm'e dönmek için panelin altındaki Tamam'a basın. t = 0 h ve t = 24 h için temsili görüntüler sırasıyla Şekil 2A,B'dedir.
- Yan panel menüsünün hemen üzerindeki küçük araç çubuğunda, 'Yüzeyler 1' adlı düzenlenebilir nesneler sekmesi oluşturmak için yuvarlatılmış mavi şekiller içeren simgeye tıklayın, Yeni Yüzeyler Ekle.
- Menü panelinin alt kısmına doğru parametre oluşturma algoritma ayarları için bir arayüz açılacaktır. Arayüzün altındaki mavi ok düğmesine tıklayarak tüm çoğaltmalar için kullanılacak parametreleri manuel olarak oluşturun. Doğru kaynak kanalının seçildiğinden emin olun ve 'Pürüzsüz' kutusunu işaretleyin.
- Yüzey ayrıntısını 0,7 μm olarak ayarlayın ve Arka Plan Çıkarma (Yerel Kontrast) öğesini seçin. Ortalama hücre uzunluğunu 'Nesneye sığan en büyük Kürenin Çapı' kutusuna yazın. İşiniz bittiğinde alttaki aynı mavi oka basın.
NOT: Bu değer, araç çubuğundaki 'Dilim' sekmesi kullanılarak ve ortalama hücrelerin genişliği ölçülerek tahmin edilebilir.
- Yüzey ayrıntısını 0,7 μm olarak ayarlayın ve Arka Plan Çıkarma (Yerel Kontrast) öğesini seçin. Ortalama hücre uzunluğunu 'Nesneye sığan en büyük Kürenin Çapı' kutusuna yazın. İşiniz bittiğinde alttaki aynı mavi oka basın.
- Eşikleme için, yalnızca en parlak hücrelerin bölümlere ayrıldığı yoğunluk histogramını belirleyin. Dilimleyiciyi kullanarak, mümkün olduğunca doğru olduğundan emin olmak için görüntü yığınında yukarı ve aşağı hareket edin.
- 'Dokunan nesneleri böl (Bölge Yetiştirme)' için Etkinleştir'i seçin ve Tohum Noktaları Çapını daha önce kullanılanla aynı çapa ayarlayın. 'Yoğunluğa Dayalı' eşiklemenin seçili olduğundan emin olun ve mavi sağ ok düğmesine tıklayın.
- Sonraki iki adım, Filtre Tohum Noktaları ve Filtre Yüzeyleri, oluşturulan yüzeylerin doğru olduğundan emin olmak için çeşitli ölçümlerle ayarlanabilir; Ancak, temel analiz ek filtreleme gerektirmez. Herhangi bir değişiklik gerekmediğinde, mavi ok düğmesine tıklayın.
NOT: Son adım, istenen çıktıya bağlı olarak yüzeyin daha fazla sınıflandırılmasına izin verir. Herhangi bir düzenleme yapıldıktan sonra, yüzeyleri oluşturmayı tamamlamak için yeşil ok düğmesini tıklayın. - Oluşturma Parametrelerini toplu analiz için kaydetmek için, değnek simgesi Oluşturma'ya tıklayın. Batch için Mağaza Parametreleri'ne tıklayın ve adlandırın, ardından Tamam'a tıklayın. t = 0 ve t = 24 h için temsili işlenmiş görüntüler sırasıyla Şekil 2C,D'de gösterilmiştir.
NOT: Seçilen bir 'Yüzey' içindeki tüm nesneler, görüntü dönüştürme yazılımı tarafından verilen yüzey alanı, hacim, yoğunluk ve oluşturulan diğer yüzeylerden uzaklık gibi çeşitli özelliklere dayalı olarak kümeler halinde sınıflandırılabilir. - Yüzey özellikleri, İstatistikler sekmesi seçilerek bulunur. Tüm hücre yüksekliklerini toplamak için Ayrıntılı sekmesine tıklayın ve ardışık açılır menülerden Belirli Değerler ve Z Konumu'nu seçin. Tüm z pozisyonlarını ve yapılan tüm sınıflandırmaları bir .xls dosyasına kaydetmek için tek Kaydet simgesine tıklayın. Tüm görüntüler için tekrarlayın.
- Temsili görüntüden göç etmeyen hücrelerin medyan z konumunu bulun ve bu sayının altındaki tüm z konumlarını her test koşulundan iyi bir şekilde çıkarın.
NOT: Migrasyon değerleri, migrasyon yapılmayan hücre yüksekliğinin üzerindeki her teknik çoğaltma koşulu için medyan ortalaması olarak rapor edilir. Şekil 3A'da görülen medyan yükseklik olarak veya Şekil 3B'de görülen t = 0'a kıyasla istenen zaman noktası için göç yüksekliğindeki kat değişikliği olarak rapor edilebilirler.
4. Paralel Katmanlı Dışa Doğru Küresel Migrasyon Testi (PLOSMA) yöntemi: 3D sferoidler için hücre kültürü ve asılı damlacık kültürü
NOT: Bu protokol, Nandi ve ark.14 tarafından yazılan protokolden uyarlanan hücre kültürünü ve asılı damla kültürünü tanımlar.
- HDF'leri üreticinin protokolüne göre çözün. İstenilen geçiş elde edilene kadar gerektiği gibi geçiş.
- Bir aseptik hücre kültürü davlumbazında, tabana 10 mL PBS ekleyerek ve dış kısım hücre kültürü başlığının üzerine oturacak şekilde kapağı ters çevirerek bir Petri kabı hazırlayın.
- Uygun hücre hacmini (hücre sayısından belirlenir) bir mikrosantrifüj tüpüne ekleyin. Ortamda seyreltilmiş hücre izleme boyası ekleyin. Isıtılmış ortam ile toplam hacmi 1 mL'ye getirin.
NOT: Sferoidler, sferoid başına yaklaşık 8000 hücre olmalıdır, ancak hücre tipine göre değişebilir. - Hücre çözeltisini 37 ° C'de 45 dakika inkübe edin. Hücreleri üreticinin tavsiye ettiği hıza göre döndürün ve süpernatanı aspire edin.
- Ortamdaki hücreleri 1:100 metilselüloz içinde yeniden süspanse edin.
- 20 μL'lik hücre/ortam solüsyonu damlacıklarını Petri kabının kapağına pipetleyin.
- Kapağı güvenle, hızlı ve dikkatli bir şekilde ters çevirin ve PBS içeren Petri kabının alt yarısının üzerine yerleştirin.
- Damlacıkları en az 24 saat inkübe edin.
NOT: Sferoid oluşumu parlak alan mikroskobu ile izlenebilir.
5. Paralel Katmanlı Dışa Doğru Küresel Migrasyon Testi (PLOSMA) yöntemi: Hücre sferoidlerinin granül hidrojel üzerine tohumlanması
NOT: Aşağıdaki işlem Şekil 4A'da özetlenmiştir.
- Şekil 4A'da özetlenen PLOSMA yöntemini ayarlamak için, şeffaf 96 oyuklu bir plakadaki kuyucuklara pozitif yer değiştirmeli bir pipet kullanarak aseptik olarak 15 μL jel ekleyin.
- Plaka eğirme rotorlu bir santrifüj ataşmanı kullanarak, jeli düzleştirmek için 10 saniye boyunca 1000 x g'da döndürün. Plakayı 180° çevirin ve kuyu dibinde eşit jel dağılımı sağlamak için 10 saniye boyunca 1000 x g'de tekrar döndürün.
- Eşit düzlük elde edildikten sonra, iskeleyi tavlamak için numuneye 30 saniye boyunca odaklanmış ışık (365 nm, 33,4 mW/cm2) uygulayarak jeli üstten aseptik olarak foto-çapraz bağlayın.
- Asılı damlacıklardan oluşan Petri kabını aseptik olarak aseptik doku kültürü başlığına taşıyın ve kapağı ters çevirin.
- 20 μL'lik bir pipet kullanarak, küre pipet ucuna girene kadar bir damlacığı yavaşça alın. Kuyunun ortasındaki iskeleye damlacık atın.
- Tüm kuyucuklar için önceki adımları tekrarlayın. Parlak alan veya floresan mikroskobu ile onaylayarak her kuyucuğun bir sferoide sahip olduğundan emin olun.
- Kürelerin iskeleye yapışmasını sağlamak için kuyu plakasını 37 °C'de 2 saat inkübe edin.
- Her sferoidin üzerine 15 μL daha jel pipetleyin. Eşit jel dağılımı olduğundan emin olmak için, plakayı her yönde 15 saniye boyunca 300 x g'da santrifüjleyin.
- 33,4 mW/cm2'de UV (365 nm) ışık kullanarak jelin üst tabakasını 30 saniye boyunca tavlayın. Kuyunun toplam hacmini 200 μL'ye getirmek için her iskelenin üzerine ortam pipetleyin.
NOT: İskeleler bu noktada çok kuru olacaktır, bu nedenle sferoidin ayrılmasını önlemek için kuyunun kenarından aşağıya doğru medya ekleyin.
6. Paralel Katmanlı Dışa Doğru Küresel Migrasyon Testi (PLOSMA) yöntemi: Sferoidlerin konfokal görüntülemesi
NOT: Görüntüleme kolaylığı, görüntüleme sistemine bağlıdır. Sferoidi kuyu içinde düşük maruz kalma süresinde bulun. Hücreler FITC kanalı (488 nm) kullanılarak görüntülendi. Hücreler için kullanılan boya, 492 nm'de bir uyarılmaya ve 517 nm'de bir emisyona sahipti. 10x büyütme, 4x büyütmeye göre daha fazla ayrıntı sağlar.
- Hücrelerin hala odakta olduğu en düşük aşama seviyesini (z yüksekliği) bulun. Bunu z yığınının alt sınırı olarak ayarlayın.
- Hücrelerin hala odakta olduğu en yüksek aşama seviyesini (z-yüksekliği) bulun. Bunu z yığınının üst sınırı olarak ayarlayın.
NOT: En iyi görüntüleme sonuçları, hücre ölçeğinde çözünürlüğü korumak için 5 μm'ye eşit veya daha küçük bir adım boyutu içerir. Konfokal mikroskop sistemine bağlı olarak görüntüleme hızı ve çözünürlük arasında ödünleşimler olabilir. - Tüm sferoidleri t = 0 ve 24 h'de açıklandığı gibi görüntüleyin. Deneysel kısıtlamalara bağlı olarak 48 saatlik bir zaman noktası da görüntülenebilir. t = 0 ve t = 24'ün temsili maksimal projeksiyon görüntüleri Şekil 4B'de görülmektedir.
7. Paralel Katmanlı Dışa Doğru Küresel Migrasyon Testi (PLOSMA) yöntemi: 3D görüntü analizi
- Görüntüleri, 3.1 ile 3.4 arasındaki adımlarda belirtildiği gibi analiz yazılımına aktarın. Sol panelin sağ üst köşesinde, Kanal 1 için açılır menüye tıklayın ve Arka Plan Çıkarma'yı seçin. Panelin alt kısmındaki Tamam'a basın.
- 3D görünüme geri döndükten sonra, Ekran Ayarı açılır penceresinde Tüm Kanalları Otomatik Ayarla'ya basın ve gerektiği gibi düzeltin.
- Yan menünün hemen üzerindeki daha küçük araç çubuğunda, 'Referans Çerçevesi 1' adlı yeni bir sekme eklemek için Şekil 5A'da üç ortogonal okla gösterilen Yeni Referans Çerçevesi Ekle simgesine tıklayın.
- Şekil 5B'de görselleştirildiği gibi, orijini her üç düzlemde de sferoidin merkezine taşıyın.
- Üç ortogonal okla aynı araç çubuğunda, turuncu küreli simgeye tıklayın ve 'Noktalar 1' adlı bir sekme oluşturmak için yeni Noktalar ekleyin. Mavi ok düğmesine basın.
- Nokta Algılama altında, Tahmini XY Çapı'nı hücrelerin tahmini çapına ayarlayın. Mavi ok düğmesine basın.
NOT: HDF'ler için bu sayı 15.0 μm'dir. - Eşikleme için, yoğunluk histogramını yalnızca en parlak kısımları çevreleyecek şekilde ayarlayın. Dilimleyiciyi kullanarak, mümkün olduğunca doğru olduğundan emin olmak için görüntü yığınında yukarı ve aşağı hareket edin. Sonraki mavi oka basın.
- Analizi bitirmek için yeşil Yürüt düğmesine basın.
- Dilimleyicide Oluştur seçeneğinin işaretini kaldırın veya kurulum panelinin sağ tarafındaki sarı kare simgesine tıklayın.
- İstatistikler sekmesine tıklayın. İlk açılır menüde Belirli Değerler'i seçin. İkinci açılır menüde, Başlangıç Referans Çerçevesinden Uzaklık'ı seçin. Seçilen yüzeyler için tüm değerler, Şekil 5C'de görüldüğü gibi görüntülenecektir. Bir .xls dosyası indiren tek kaydetme simgesini tıklayın.
- Ana araç çubuğundaki Kaydet simgesine basarak görüntüde ve analizlerde yapılan değişiklikleri kaydedin. Şekil 6A , 24 saatte görüntülenen bir sferoidin 3B görüntüsünü temsil ederken, Şekil 6B , orijin referans çerçevesine olan mesafeye göre renk kodlu yayılmış hücreleri işaretleyen IMARIS Noktaları işlevini temsil eder.
- Dışa aktarılan verileri t = 0 görüntülerine normalleştirin ve her örnek için tek bir değer elde etmek için kat edilen hücresel mesafenin ortalamasını ve her sferoid için z-yüksekliğini hesaplayın. Şekil 7A,B, sırasıyla her çıktı için temsili grafikleri göstermektedir.
Sonuçlar
Bu protokol, iki yeni granüler iskele migrasyon testi için gerekli adımları detaylandırmayı amaçlamaktadır. MAMA yöntemi, bir doku arayüzünde hücresel infiltrasyonu değerlendirmek için kullanılabilir. Granül hidrojeller, toplu hidrojellerden daha karmaşık bir sistemdir ve bu nedenle, migrasyon için işlenmesi doğal olarak daha karmaşıktır 9,20. Şekil 1'de özetlenen adım adım süreci anlamak önemlidir. Her adım bir sonrakinin üzerine inşa edilir ve bu protokolde optimize edilmiştir. HDF'lerin 120.000 hücre/cm2 yoğunlukta tohumlanması, gece boyunca en az %80 birleşme ile sonuçlanacaktır (Şekil 1A) ve bu floresan olmayan hücreler, görüntüleme potansiyelini en üst düzeye çıkarmak için deney günü en iyi hücre izleme boyası ile etiketlenir (Şekil 1B). Bu protokol, hücre canlılığını korumak için HDF geçişinde kullanılan daha düşük merkezkaç kuvvetiyle eşleşir. Tek bir santrifüjleme aşaması için üretilen açı nedeniyle, kuyucukların alt yüzeyini tamamen kaplayacak şekilde jel kaymasını sağlamak için plakayı 180° çevirmek gerekir (Şekil 1C). Tavlamadan sonra hücrelerin inkübatörde 30 dakika boyunca iyileşmesine izin vermek (Şekil 1D), hücre canlılığını koruyacak ve optimal migrasyon ile sonuçlanacaktır (Şekil 1E). 96 oyuklu bir plakanın geniş bir alanı 4x objektifle görüntülenebilir ve hücre davranışını geniş çapta değerlendirmek için 0-24 saat zaman noktasından (Şekil 2A, B) eşleştirilebilir. Elde edilen z-stack görüntülerinin analiz yazılımında işlenmesi, kullanımı kolay bir arayüzde birden çok büyük veri kümesi için gelişmiş analizler sağlar. Bu protokol, Şekil 2B,C'deki temsili görüntülerle görselleştirilen her zaman noktasında hücre yüksekliği veya Z konumu için veri kümeleri oluşturma adımlarını özetler. İşlenen verilerin analizi Şekil 3A'da görülmüş, medyan yüksekliklerin ortalaması ve her bir zaman noktasının standart sapması kullanılarak görselleştirilmiştir ve t = 0 h'de göç etmeyen hücrelerden kat değişim yüksekliği Şekil 3B'de gösterilmiştir. Bu yöntemin temel verileri tipik olarak normal dağılım göstermez, bu nedenle medyanlar karşılaştırma için daha sağlam ölçümlerdir ve bu nedenle verileri özetlemek için kullanılır.
Benzer şekilde, PLOSMA yöntemi, bir 3D granül hidrojel iskelesi içinde verilen hücrelerin motilitesini değerlendirmek için kullanılabilir. Şekil 4A, PLOSMA yönteminin adımlarını özetlemektedir ve sferoidin kuyunun ortasına tohumlanması özellikle önemlidir. Kürenin görüş alanında merkezlenmesi önerilir ancak mikroskobun yeteneklerine bağlıdır. Şekil 4B, FITC kanalında (0 nm) 10x büyütmede çekilen t = 24 saat ve t = 488 saat için küresel yayılmanın temsili görüntülerini göstermektedir. Yazılımda, bir orijin referans çerçevesi oluşturulabilir ve her bir z-yığınına göre ayarlanabilir (Şekil 5A,B). Yazılım, bu başlangıç referans çerçevesinden radyal mesafeyi izleyebilir ve bunu istenen veri kümesi olarak dışa aktarabilir (Şekil 5C). Şekil 6A, t = 24 h sferoidin 3B görüntüsünün temsili bir görüntüsünü gösterirken, Şekil 6B, yazılımın Noktalar işlevini gösterir. İşlenen verilerin bir örneği Şekil 7'de gösterilmiştir. Şekil 7A, Gün 0 mesafelerine normalize edilmiş merkezden kat edilen ortalama mesafeyi temsil eder. Şekil 7B, PLOSMA yönteminin incelemeyi amaçladığı yön olduğu için sadece z-düzleminde kat edilen mesafeleri izole eder.
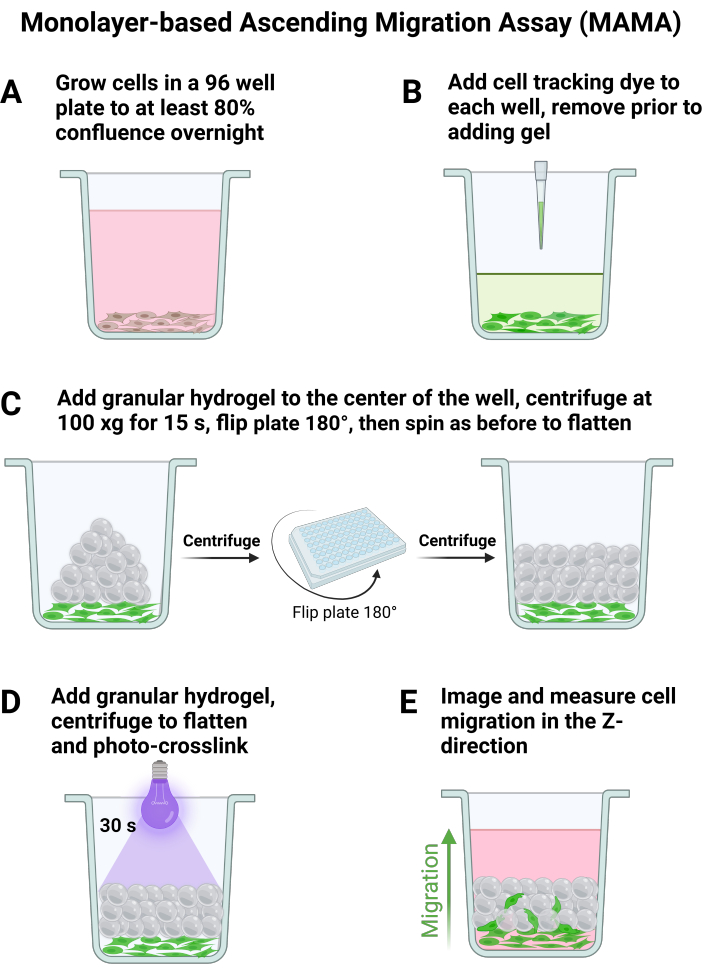
Şekil 1: Tek Tabakalı Artan Migrasyon Testi hücre kültürü ve görüntüleme. MAMA için hücre ve jel işlemedeki ana adımların şeması. (A) Hücreler gece boyunca birleşecek şekilde büyütülür ve (B) granül jel ilavesinden hemen önce hücre izleme boyası eklenir. İskele, (C) plaka santrifüjleme ile monte edilir ve (D) foto-çapraz bağlama ile stabilize edilir. Birden fazla zaman noktasında görüntüleme, yukarı doğru hücre göçünün (E) görselleştirilmesini sağlar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
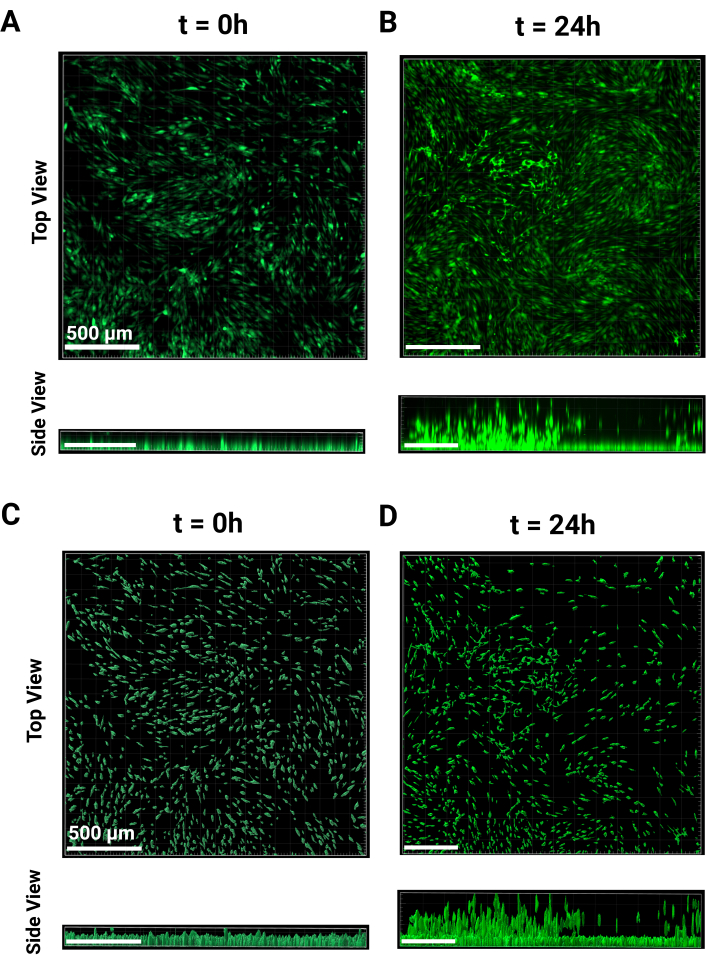
Şekil 2: MAMA görüntü işleme. Görüntü işlemenin temsili görüntüleri. 4x büyütmede FITC kanalında (A) t = 0 ve (B) t = 24 saatte ham konfokal görüntülerin üstten ve yandan görünüm karşılaştırması. (B) (C) t = 0 ve (D) t = 24 h'de işlenmiş hücre konumu Z yüksekliklerinin üstten ve yandan görünüm karşılaştırması. 24 saat için işleme, medyan göç etmeyen z-yüksekliklerinin çıkarılmasını içerir. Ölçek çubukları = 500 μm. Kısaltmalar: MAMA = Tek Katmanlı Tabanlı Artan Migrasyon Testi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
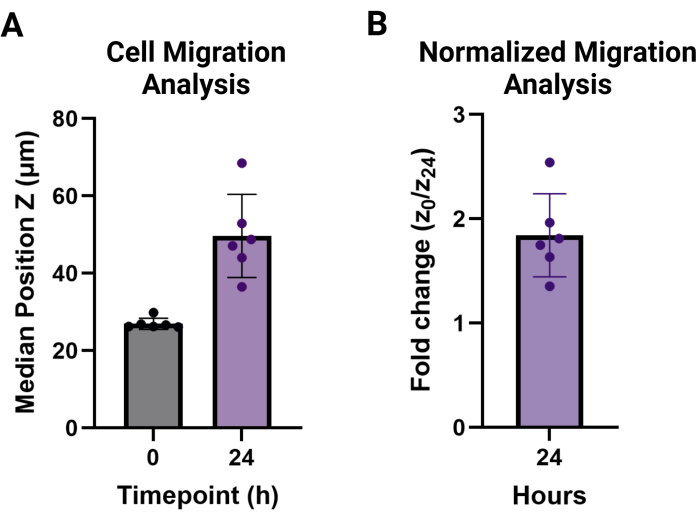
Şekil 3: MAMA hücre migrasyonu çıktı analizi. (A) t = 0 (27.0 μm ve 1.4 μm) ve t = 24 saat (46.6 μm ±± 10.8 μm) zaman noktalarında her bir kopyada (n = 6) medyan pozisyon Z ve hücre yüksekliklerinin standart sapması. (B) Hücrelerin 24 saatte göçü 0 saate normalize edildi ve kat değişikliği olarak rapor edildi (1.8 ± 0.4). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
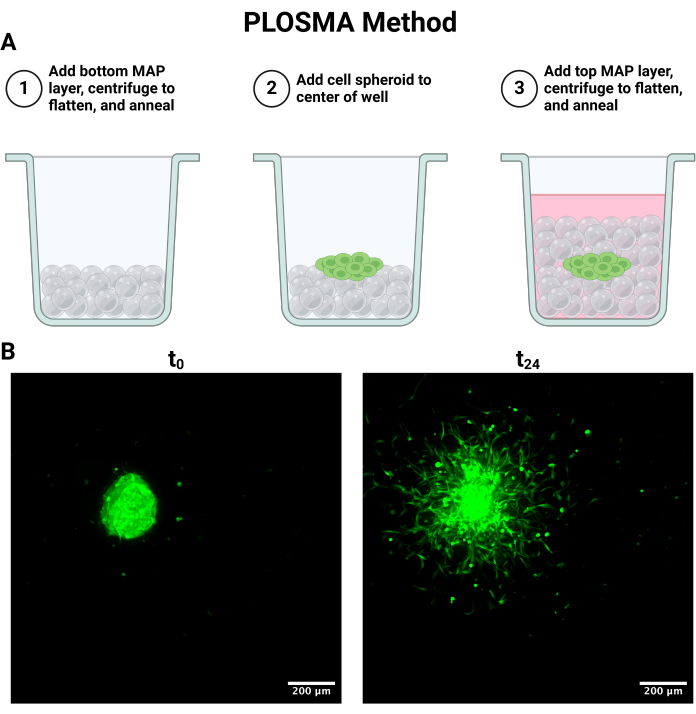
Şekil 4: Paralel Katman Dışa Doğru Küresel Migrasyon Testi (PLOSMA) hücre kültürü ve görüntüleme. (A) İskele katmanlama adımlarını açıklayan şematik. (B) 0 ve 24 saatte alınan sferoidin maksimum yoğunluk projeksiyonları. Görüntüler konfokal floresan mikroskobu ile FITC kanalında (488 nm) 10x büyütmede çekildi. Ölçek çubukları = 200 μm. Kısaltmalar: PLOSMA = Paralel Katman Dışa Doğru Küresel Migrasyon Testi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
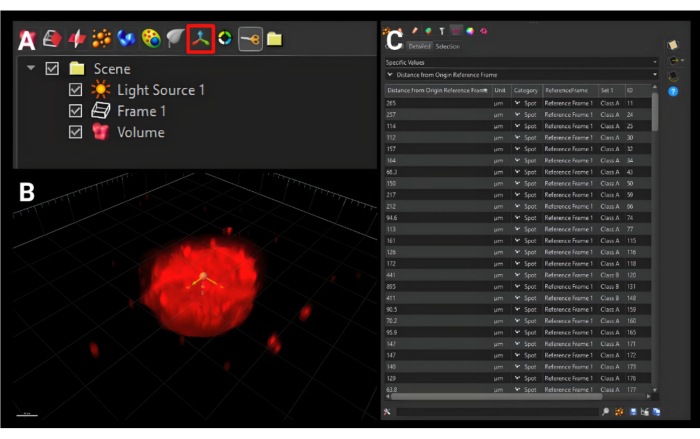
Şekil 5: Yeni bir orijin referans çerçevesi oluşturma. (A) Kırmızı bir kutu ile çevrelenen yeni başlangıç referans çerçevesi düğmesi. (B) Yeni orijin, her üç boyutta da sferoidin merkezinde olacak şekilde ayarlanmıştır. (C) Gösterilen çıktı metrikleri, hücrelerin merkezden ne kadar uzağa göç ettiğini açıklayan kaynak referans çerçevesinden hücre yüzeylerinin uzaklıklarıdır. Ölçek çubuğu = 120 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
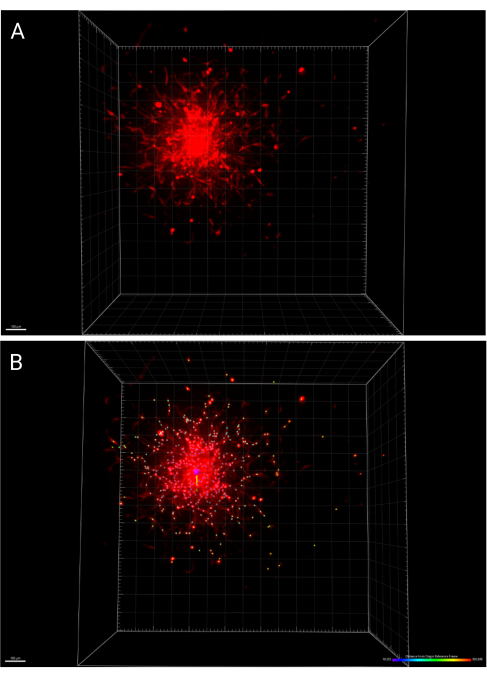
Şekil 6: Gömülü sferoidin 24 saatteki 3D görüntüleri. (A) 3D uzayda işlenmiş sferoid. (B) Aynı sferoidin merkezi, IMARIS'teki orijin referans çerçevesi fonksiyonu kullanılarak belirlendi ve hücre yayılımı, orijinden uzaklığa göre renk kodludur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
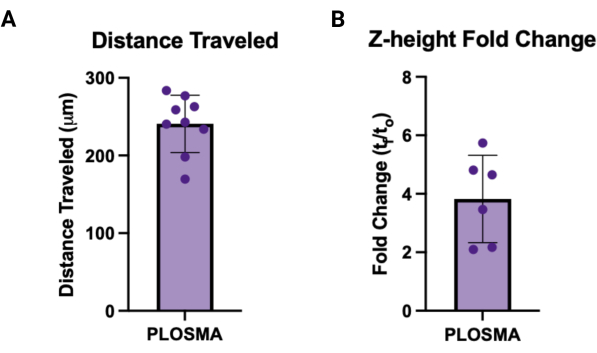
Şekil 7: PLOSMA için örnek çıktılar. (A) μm cinsinden kat edilen mesafeyi gösteren örnek PLOSMA sonuçları. Kat edilen ortalama mesafe 240.8 μm ± 36.87 μm idi. (B) Küresel filizlenmenin Z-yükseklik kıvrım değişimi (tf / t0). Ortalama kat değişimi 3.82 ± 1.495 idi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, yara iyileşmesi ve doku entegrasyonu için 3D hücre göçünü karakterize etmek için iki in vitro modeli tanımlar. İlk model, tek katmanlı tabanlı migrasyon testi, uygun şekilde bağlanmış ve birleştirilmiş hücrelere dayanır. Bu protokol bir fibroblast hücre tipi ile geliştirilmiş ve 1.20.000 hücre/cm2 tohumlama yoğunluğunda optimize edilmiştir. Bu yoğunluk, hücrelerin gece boyunca kuyu plakasının dibinde eşit şekilde en az% 80 birleşmeye kadar büyümesine izin verir. Bu adım, en az 24 saat içinde z yönünde göç sağlar; Jel tabakasının eklenmesi üzerine birleşme çok düşükse, hücreler doku kültürü plastiğine ve jele yayılmaya devam edebilir, bu da optimizasyon sırasında gözlemlenen homojen olmayan, yavaşlamış bir göç paterni ile sonuçlanır. Eşit olmayan göç yükseklikleri, daha az yoğun hücrelerin bulunduğu alanlarda,% 80 birleşmede bile gözlenebilir. İyi kopyalar, bu hücre davranışlarının gürültüsünü azaltacaktır. Aşırı birleşik hücreler, santrifüjleme süresi boyunca hücrelerin kaldırılmasına ve potansiyel olarak hücre ölümüne neden olabilir. Bu değişkenlik, tutarlı sayıda hücrede tohumlama ve uygun veri karşılaştırmalarına izin vermek için tutarlı bir görüntü alanı yakalayarak ele alınır. Yazarın bilgisine göre, jel düzleştirme için plaka santrifüjlemesi yayınlanmamıştır, ancak santrifüjleme, hücre geçişi ve biyomaddenin işlenmesi için yaygın olarak kullanılmaktadır21,22. Hızı geçiş hızlarına uyacak şekilde ayarlamak, daha fazla optimum hücre işleme için hücre canlılığını koruyacaktır.
Bu yöntemdeki birincil zorluk, en iyi analizi sağlamak için görüntüleme süresini en aza indirirken görüntüleme çözünürlüğünü ve derinliğini en üst düzeye çıkarmaktır. Yeşil hücre izleme boyası, 5 μm veya daha az adım boyutuna ve 1000 ms'ye kadar maruz kalma süresine sahip 96 oyuklu bir görüntüyü görüntülemek için yeterince parlaktır. Maruz kalma süresinin düşürülmesi, hücrelerin inkübasyon koşullarında olmadığı süreyi azaltır, aynı zamanda çözünürlüğü de azaltır. Bu parametreler bireysel mikroskop temelinde optimize edilmelidir, ancak tüm görüntülerin tek bir çalışmada aynı ayarlarla yakalanmasını sağlayarak değişkenlik azaltılır.
MAMA'ların analizi için önemli bir not, istatistiksel testler için yalnızca göç eden hücrelerin dikkate alındığından emin olmak için hücrelerin tek tabaka yüksekliğinde veya altında ortadan kaldırılmasını gerektirmesidir. Buna göre, replikasyon kuyularının medyanları, filtrelemeden sonra hücre pozisyonlarının Gauss olmayan dağılım doğası nedeniyle rapor edilir. Gruplar arasındaki karşılaştırma bir histogram ile görselleştirilebilir ve medyanlar parametrik olmayan bir test ile istatistiksel olarak analiz edilebilir.
Bu zorluklara rağmen, tek katmanlı tabanlı yukarı doğru göç yöntemi, en basit haliyle, gözenekli iskelelerin 3D hücre sızması için tekrarlanabilir bir testtir. Hücre göçünün mekanik etkilerini incelemek için, parametrelerin incelenen hücre tipine uygun olduğundan emin olun. Bu, jel içinde veya ortamda kemotaktik veya haptotaktik bileşenlerin eklenmesini içerebilir. İnsan dermal fibroblast tam ortamı göçmen kemokinleri içerir, ancak daha spesifik ipuçları kullanan diğer hücre tipleri, testin buna göre uyarlanmasını gerektirir. Bu tahlil, birden fazla değişken türünü test etmeye elverişlidir; Ancak bunların kapsamı bu protokolde yer almamaktadır. MAMA, toplu dokudan in vivo olarak enjekte edilen gözenekli bir hidrojele hücre hareketine benzer fizyolojik olarak ilgili bir ortam sağlar.
PLOSMA yönteminde, sferoidlerin iskelenin merkezine yerleştirilmesi, üç boyutta başarılı görüntüleme ve anlamlı hücre göçü için kritik öneme sahiptir. Jelin merkezindeki sferoidin tam tohumlanması kullanıcıya bağlıdır. Bu amaçla, pipeti kullanıcının baskın olmayan eliyle namluda sabitlemek, merkezlemeye yardımcı olur ve tohumlama pozisyonunun etkinliği, parlak alan veya floresan mikroskobu kullanılarak doğrulanabilir. Merkez dışı bir sferoid, aynı iskele üzerinde veya yeni bir iskele üzerinde yeni bir sferoid ile ikinci bir denemeyle giderilebilir. Bu nedenle yazarlar gereğinden fazla sferoid oluşturulmasını ve gereğinden fazla MAP jeli hazırlanmasını önermektedir.
İkinci katman santrifüjleme adımı, sferoidin (1) jel tarafından eşit şekilde kaplanmasını ve (2) jelin içine eşit şekilde yukarı ve aşağı doğru yayılmasını sağlar, bu da verilen hücrelerin incelenmesi için çok önemlidir. Santrifüjleme ayrıca sferoidin merkezden kuyunun kenarlarına doğru hareket etmesine neden olabilir ve bu protokol, santrifüjleme adımlarını ve her katman için kullanılan jelin hacmini (15 μL) eşit dağılım için optimize ederek bu fenomeni sınırlarken, hareketini tamamen ortadan kaldırmaz. Küresel hareketi azaltmak için gereken tam santrifüjleme hızı ve zamanlamasının, santrifüj modeline göre ayarlanması gerekebilir; Bununla birlikte, bu protokolde açıklanan spesifikasyon, bireysel optimizasyon için bir kıyaslama olarak kullanılabilir. Başka bir yaklaşım, ikinci jel tabakasını eklemeden önce sferoidlerin 2 saatlik inkübasyon süresinin iskeleye yapışmasına izin vermektir. Spheroid hareketi, her iki strateji de uygulandığında özellikle iyi bir şekilde hafifletilir. Son olarak, çok aşamalı santrifüjleme işlemi nedeniyle, bu yöntem daha az dayanıklı hücre hatları için uygun olmayabilir.
PLOSMA yönteminde sferoidlerin kaplanması lojistiğinin yanı sıra, görüntü elde etme sırasında sınırlamalar vardır. Küre, 4x veya 10x büyütme kullanılarak görüntülenebilir, ancak en iyi sonuçlar için en az 10x büyütme kullanın ve z-yığınlarının adım boyutunu 2-5 μm'ye düşürün. Büyütme çalışma boyunca tutarlı olmalıdır. Görüntüleme süresi daha yüksek çözünürlükle artar, bu nedenle inkübatörün dışındaki süreyi en aza indirmek için her bir kuyucuk plakasındaki numune sayısını (plaka başına 4-8 kuyu) sınırlayın. Canlı görüntüleme kurulumu, izlemeyi de iyileştirebilir ve daha fazla bilgi sağlayabilir.
Granül hidrojeller, doğal hacim, gözeneklilik, mekanik mukavemet ve bazı durumlarda biyoaktiviteyi içeren benzersiz topolojiye ve tasarım parametrelerine sahip olduğundan, bu yönlerle ilgili olarak hücre davranışını mümkün olduğunca aslına uygun olarak incelemek gerekir. PLOSMA yöntemi, doğumdan sonra veya hücreler granüler bir jele tamamen girdikten sonra hücre hareketini modellemek için tasarlanmıştır. Hücreler, granüler hidrojel geometrisinin doğasında bulunan gözeneklerden geçmeye zorlandığından, PLOSMA yöntemi, hücre davranışı üzerinde bir etki olarak gözenekliliği etkili bir şekilde izole eder. Bu test için potansiyel uygulamalar, yerinde hücre iletimi ve özellikle yara iyileşme alanında granüler bir iskele içinde doku entegrasyonudur23.
Her iki protokol de doku onarımı ve yeniden şekillenmesinde fibroblast migrasyonunun rolü nedeniyle primer insan dermal fibroblastları ile geliştirilmiştir 4,24, bununla birlikte, herhangi bir yapışık hücrenin göç davranışı, gözenekli iskelenin değişmesine yanıt olarak ölçülebilir - büyüme faktörlerinin eklenmesi ve jelin yüzey / toplu bileşimi dahil. Bu değişiklikler, kayda değer sonuçlar için bu tahlillerin uyarlanmasını gerektirebilir. Daha fazla optimizasyon gerektiren parametreler arasında hücre tohumlama yoğunluğu, deney süresi ve/veya analiz boru hattı bulunur. IMARIS, hücre göçü analizi için kullanılan güçlü bir görüntüleme analiz aracıdır ve seçilen bir 'Yüzey' içindeki tüm nesneleri, yüzey alanı, hacim, yoğunluk ve oluşturulan diğer yüzeylerden uzaklık gibi çeşitli özelliklere dayalı olarak kümeler halinde sınıflandırmayı içeren, burada belirtilenin ötesinde yeteneklere sahiptir. Daha fazla analiz yöntemini belirlemek için birçok çevrimiçi kaynak vardır.
Burada özetlenen iki yöntem, yalnızca granüler bir materyale fizyolojik bir şekilde doku girişinin ilk durumunu değil, aynı zamanda materyalin içine tamamen gömüldüğünde sonraki hücre tepkisini de ele alır. Tüm migrasyon tahlillerinde olduğu gibi, mevcut hücreler harekete paralel olarak çoğalabilir, ancak açıklanan tahlillerin tasarımı proliferasyonu bozmaz ve bu nedenle analiz üzerinde gereksiz bir etki olmamasını sağlar. Her iki yöntem de hücre iskeleti, kollajen birikimi, proliferasyon ve daha fazlası gibi ölçümleri tespit etmek için PFA fiksasyonunu kullanan uzunlamasına görüntülemeye ek olarak uç nokta boyama ile uyumludur. Ana hatlarıyla belirtilen yöntemlerin kullanımı, önceki yöntemlerin aksine hücre sızmasını ölçülebilir bir parametre olarak kullanan 3B hücre göçünün daha doğru bir uzaysal-zamansal temsiline doğru ilerler 1,6,14,15,25,26,27.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışmanın finansmanı, ABD Ulusal Sağlık Enstitüleri Yüksek Öncelikli, Kısa Vadeli Proje Ödülü (1R56DK126020-01) ve Kurtin Vakfı'ndan hayırsever bir hediye aracılığıyla kısmen desteklendi. JT, Ulusal Bilim Vakfı Lisansüstü Araştırma Bursu tarafından finanse edildi. BioRender.com ile oluşturulan şekil şemaları.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 Phalloidin | ThermoFisher | A22287 | |
| Bovine Serum Albumin | VWR International | 332 | |
| CellTracker Green CMFDS Dye, 1 mg | ThermoFisher | C2925 | 20 x 50 ug units, 492/517 nm |
| Centrifuge | ThermoFisher | 75016085 | ST Plus Series |
| Clear 96 well plate | MilliPore Sigma | CLS3997-50EA | |
| Dimethyl Sulfoxide | Fisher Scientific | MT-25950CQC | 250 mL |
| Fibroblast Basal Medium | ATCC | PCS-201-030 | 480 mL, phenol-red-free |
| Fibroblast Growth Kit - Low Serum | ATCC | PCS-201-041 | 7.5 mM L-glut,5 ng/mL rh FGF basic, 5 ug/mL rh Insulin, 1 ug/mL Hydrocortisone, 50 ug/mL Ascorbic acid, 2% FBS |
| FIJI (ImageJ) | NIH | Public access download | |
| Human Dermal Fibroblasts | ATCC | PCS-201-012 | Adult human dermal fibroblasts |
| ImageXpress Micro Confocal | Molecular Devices | Spinning Disc confocal microscope with 4x, 10x magnifications | |
| IMARIS | Oxford Instruments | 3/4D Imaged Visualizaiton and Analysis Software, Proprietary | |
| Incubator | ThermoFisher | Finnpipette F2 Variable volume Pipettes | HeraCell Vios 160i CO2 Incubator, 165L |
| M-20 Microplate Swinging Bucket Rotor | ThermoFisher | 75003624 | |
| Methylcellulose | Fisher Scientific | 9004-67-5 | Lab grade, powder form |
| Microcentrifuge tube | Fisherbrand | 05-408-129 | 1.5 mL microcentrifuge tubes |
| Paraformaldehyde (4%) | Alfa Aesar | AAJ19943K2 | For fixing |
| Petri dish | Corning | 08-757-100A | Bacteriological Petri Dishes with Lid 35 x 10 mm |
| Pipettes | ThermoFisher | 4642080 | Finnpipette F2 Variable volume Pipettes |
| Sterile PBS | Gibco | 10010-023 | |
| Triton-X | Fisher Scientific | 327371000 |
Referanslar
- Jerka, D., et al. Unraveling endothelial cell migration: Insights into fundamental forces, inflammation, biomaterial applications, and tissue regeneration strategies. ACS Appl Bio Mater. 7 (4), 2054-2069 (2024).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay Drug Dev Technol. 12 (4), 207-218 (2014).
- Yamada, K. M., Sixt, M. Mechanisms of 3D cell migration. Nat Rev Mol Cell Biol. 20 (12), 738-752 (2019).
- Grinnell, F. Fibroblast biology in three-dimensional collagen matrices. Trends Cell Biol. 13 (5), 264-269 (2003).
- Kloxin, A. M., Kloxin, C. J., Bowman, C. N., Anseth, K. S. Mechanical properties of cellularly responsive hydrogels and their experimental determination. Adv Mater. 22 (31), 3484-3494 (2010).
- Solbu, A. A., et al. Assessing cell migration in hydrogels: An overview of relevant materials and methods. Mater Today Bio. 18, 100537 (2023).
- Madl, C. M., Katz, L. M., Heilshorn, S. C. Tuning bulk hydrogel degradation by simultaneous control of proteolytic cleavage kinetics and hydrogel network architecture. ACS Macro Lett. 7 (11), 1302-1307 (2018).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nat Rev Mater. 5 (1), 20-43 (2020).
- Qazi, T. H., Burdick, J. A. Granular hydrogels for endogenous tissue repair. Biomater Biosyst. 1, 100008 (2021).
- Tanner, G. I., Schiltz, L., Narra, N., Figueiredo, M. L., Qazi, T. H. Granular hydrogels improve myogenic invasion and repair after volumetric muscle loss. Adv Healthc Mater. 25, e2303576 (2024).
- Sussman, E. M., Halpin, M. C., Muster, J., Moon, R. T., Ratner, B. D. Porous implants modulate healing and induce shifts in local macrophage polarization in the foreign body reaction. Ann Biomed Eng. 42 (7), 1508-1516 (2014).
- Roosa, C. A., et al. Conjugation of IL-33 to microporous annealed particle scaffolds enhances type 2-like immune responses in vitro and in vivo. Adv Healthc Mater. 13 (25), 2400249 (2024).
- Jaberi, A., et al. Engineering microgel packing to tailor the physical and biological properties of gelatin methacryloyl granular hydrogel scaffolds. Adv Healthc Mater. 13 (25), 2402489 (2024).
- Nandi, S., Brown, A. C. Characterizing cell migration within three-dimensional in vitro wound environments. J Vis Exp. 126, e56099 (2017).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Adv Mater. 34 (12), 2109194 (2022).
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nat Mater. 14 (7), 737-744 (2015).
- Pruett, L. J., Jenkins, C. H., Singh, N. S., Catallo, K. J., Griffin, D. R. Heparin microislands in microporous annealed particle scaffolds for accelerated diabetic wound healing. Adv Funct Mater. 31 (35), 2104337 (2021).
- Roosa, C., et al. Microfluidic synthesis of microgel building blocks for microporous annealed particle scaffold. J Vis Exp. (184), e64119 (2022).
- Pfaff, B. N., et al. Selective and improved photoannealing of microporous annealed particle (MAP) scaffolds. ACS Biomater Sci Eng. 7 (2), 422-427 (2021).
- Riley, L., Schirmer, L., Segura, T. Granular hydrogels: Emergent properties of jammed hydrogel microparticles and their applications in tissue repair and regeneration. Curr Opin Biotechnol. 60, 1-8 (2019).
- Jo, C. H., Roh, Y. H., Kim, J. E., Shin, S., Yoon, K. S. Optimizing platelet-rich plasma gel formation by varying time and gravitational forces during centrifugation. J Oral Implantol. 39 (5), 525-532 (2013).
- Mironov, V., et al. Fabrication of tubular tissue constructs by centrifugal casting of cells suspended in an in situ. crosslinkable hyaluronan-gelatin hydrogel. Biomaterials. 26 (36), 7628-7635 (2005).
- Vu, L. T., Jain, G., Veres, B. D., Rajagopalan, P. Cell migration on planar and three-dimensional matrices: A hydrogel-based perspective. Tissue Eng Part B Rev. 21 (1), 67-74 (2015).
- Cialdai, F., Risaliti, C., Monici, M. Role of fibroblasts in wound healing and tissue remodeling on Earth and in space. Front Bioeng Biotechnol. 10, 958381 (2022).
- Qazi, T. H., Muir, V. G., Burdick, J. A. Methods to characterize granular hydrogel rheological properties, porosity, and cell invasion. ACS Biomater Sci Eng. 8 (4), 1427-1442 (2022).
- Shaik, R., et al. Cardiac matrix-derived granular hydrogel enhances cell function in 3D culture. ACS Appl Mater Interfaces. 16 (43), 58346-58356 (2024).
- Puiggalí-Jou, A., Asadikorayem, M., Maniura-Weber, K., Zenobi-Wong, M. Growth factor-loaded sulfated microislands in granular hydrogels promote hMSCs migration and chondrogenic differentiation. Acta Biomater. 166, 69-84 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır